Artigo
|
|
| Constituintes químicos das cascas do caule de Vochysia thyrsoidea Pohl. (Vochysiaceae) e avaliação das atividades citotóxica e inibitória frente as catepsinas B e K Chemical constituents of the stem bark of Vochysia thyrsoidea Pohl. (Vochysiaceae) and evaluation of their cytotoxicity and inhibitory activity against cathepsins B and K |
|
Lorena Ramos Freitas de SousaI; Jame's A. da SilvaI; Paulo Cezar VieiraI; Maísa Borges CostaII; Mirley Luciene dos SantosII; Aline Borba SbardelottoIII; Cláudia do O PessoaIII; Manoel Odorico de MoraesIII; Antônio Carlos Severo Menezes*,II
IDepartamento de Química, Universidade Federal de São Carlos, Rod. Washington Luís, Km 235,13565-905 São Carlos - SP, Brasil Recebido em 05/09/2013 *e-mail: amenezes@ueg.br A new flavonoid, catechin-3-O-(3"-O-trans-cinnamoyl)-α-rhamnopyranoside, along with known compounds, catechin-3-O-α-rhamnopyranoside, 3-oxo-urs-12-en-28-oic acid, 2,4,6-trimethoxybenzoic acid, 2-butyl-D-fructofuranoside and 1-butyl-D-fructofuranoside, has been isolated from the stem bark of V. thyrsoidea. These compounds were assayed for inhibition of protease activity (cathepsins B and K) and against cancer cell lines. Catechin-3-O-(3"-O-trans-cinnamoyl)-α-rhamnopyranoside showed moderate inhibitory activity (IC50 = 62.02 µM) against cathepsin B while 2-butyl-D-fructofuranoside was the most potent against a strain of CNS (SF-295) and human leukemia (HL-60) with IC50 = 36.80 µM and IC50 = 25.37 µM, respectively. INTRODUÇAO Vochysia thyrsoidea Pohl., conhecida como gomeira, pau-de-goma, casca-doce, árvore do vinho, vinheiro-do-campo, goma-arábica, goma-arábica-da-lagoa-santa, é uma Vochysiaceae encontrada em abundância no cerrado brasileiro e campos cerrados de altitude, usada na medicina popular como expectorante.1 O estudo prévio relacionado à caracterizaçao química dos constituintes desta espécie revela o isolamento de dois ácidos elágicos (ácidos 3,3',4-tri-O-metilelágico e 3,3',4,4'-tetra-O-metilelágico) e das duas quinonas (1,8-dihidroxi-6-metoxi-3-metilantra-quinona e 2,6-dimetoxi-1,4-benzoquinona).2 Poucos estudos desta planta sao descritos e nao houve anteriormente avaliaçoes de atividades biológicas para esta espécie. Este trabalho relata as atividades citotóxica e inibitória da atividade das catepsinas B e K de extratos (folhas e cascas) e compostos isolados das cascas do caule de V. thyrsoidea, bem como o isolamento e elucidaçao estrutural de duas catequinas (1-2) e de dois derivados butil-D-frutofuranosídeo (3-4) (Figura 1), além do ácido 2,4,6-trimetoxibenzóico e ácido 3-oxo-urs-12en-28-oico.
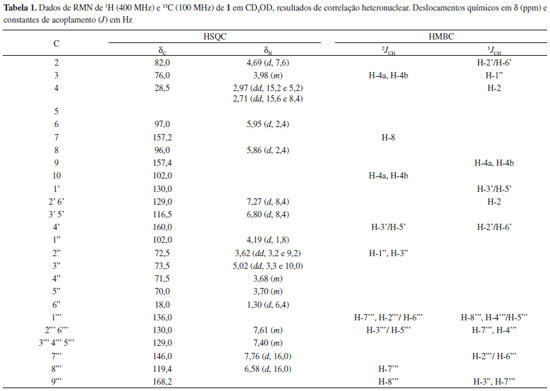
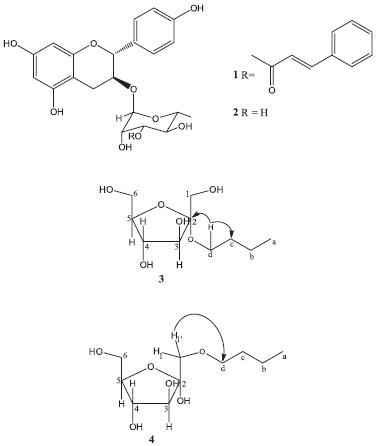 Figura 1. Constituintes químicos isolados das cascas do caule de Vochysia thyrsoidea
PARTE EXPERIMENTAL Instrumentaçao e procedimentos gerais Os espectros de RMN 1H e 13C 1D/2D foram obtidos em espectrômetro Bruker modelos ARX 100 MHz e DRX 400 MHz, utilizando CD3OD e acetona-d6 como solventes e TMS como referência interna. O espectro de massas de alta resoluçao foi realizado em um equipamento da Bruker Daltonics, modelo micrOTOF - Q II - ESI - TOF. As separaçoes cromatográficas em coluna à pressao atmosférica foram realizadas em sílica gel 60 (230 a 700 Mesh) da Merck e Sephadex LH-20 da Amersham Pharmacia Biotech AB. As placas usadas para cromatografia em camada delgada analítica (CCDA) foram de cromatofolhas de alumínio de sílica gel 60 F254 da Merck. As revelaçoes das cromatoplacas foram feitas através de luz UV (254 e 365 nm) e por borrifamento com soluçao de vanilina sulfúrica. Os solventes (etanol, metanol, hexano, acetato de etila, diclorometano e n-butanol) utilizados na preparaçao dos extratos e fracionamentos cromatográficos foram todos de grau analítico. Material vegetal O material botânico de V. thyrsoidea foi coletado na Serra dos Pirineus, Pirenópolis - GO, em março de 2010 e identificado pela Drª. Mirley Luciene dos Santos. A exsicata (nº7051) encontra-se depositada no Herbário da Universidade Estadual de Goiás, Campus Henrique Santillo, Anápolis - GO. Isolamento dos constituintes químicos As cascas do caule (Cc; 1.465 g) e folhas (F; 1.140 g) de V. thyrsoidea, após secagem em estufa a 40 ºC e moagem, foram extraídas com etanol. Após eliminaçao dos solventes sob pressao reduzida, os extratos brutos foram obtidos [Cc (23,0 g) e F (150,0 g)]. O extrato oriundo das cascas do caule foi particionado com MeOH-H2O (1:3) e solventes de diferentes polaridades [hexano (1,5 g), CH2Cl2 (1,3g), AcOEt (7,3 g), n-BuOH (1,0 g) e hidroalcoólico (10,8 g)] enquanto que o das folhas foi fracionado com celulose microcristalina D, fornecendo os extratos em hexano (5,6 g), CH2Cl2 (15,8 g), AcOEt (52,3 g) e MeOH (50,7 g). A fraçao diclorometânica das cascas do caule (1,3 g) foi cromatografada em duas etapas utilizando cromatografia de adsorçao em gel de sílica, ambas em eluiçao isocrática com Hex:AcOEt (8,5:1,5). Desta última etapa cromatográfica foram obtidas 11 fraçoes, dentre as quais a segunda fraçao foi identificada por comparaçao dos dados espectroscópicos de RMN 1H e 13C com a literatura como o triterpeno ácido 3-oxo-urs-12en-28-oico (2,0 mg).3 A fraçao 7 (190,0 mg) foi refracionada por cromatografia de coluna de gel de sílica no modo isocrático Hex:AcOEt (7:3), trazendo o isolamento do ácido 2,4,6-trimetoxibenzóico (5,2 mg), cuja estrutura foi proposta com base em dados espectrais de de RMN 1H e 13C e comparaçao com a literatura.4 O fracionamento do extrato de AcOEt das cascas do caule (7,3 g) foi feito através de cromatografia em coluna (CC) de gel de sílica, usando como fase móvel os solventes AcOEt:MeOH com gradiente de eluiçao em ordem crescente de polaridade. Desta coluna obteve-se 85 fraçoes, que foram submetidas à análise por CCDA e entao reunidas em 4 fraçoes. A segunda fraçao (1,0 g) foi submetida à CC de gel de sílica, usando como fase móvel CH2Cl2:MeOH (4:1) no modo isocrático de eluiçao, o qual proporcionou o isolamento da substância 1 (3,0 mg). Após sucessivos fracionamentos desta fraçao 2 por cromatografia de exclusao (Sephadex LH-20) e eluiçao em MeOH 100%, obteve-se a substância 2 (3,0 mg) identificada por RMN 1D/2D.5 Catequin-3-O-(3"-trans-cinamoil)-α-raminopiranosideo (1). HRESIMS m/z: 549,1755 [M - H]- (calc. para C30H30O10, 550,1839) RMN 1H e 13C: Tabela 1.
Catequin-3-O-α-ramnopiranosideo (2). RMN 1H(400 MHz, CD3OD) δH (mult.; J em Hz; H): 7,22 (d; J= 8,5; H-2' e H-6'); 6,78 (d; J=8,5; H-3' e H-5'); 5,93 (d; J=2,4; H-6); 5,84 (d; J=2,4; H-8); 4,65 (d; J=8,0; H-2); 4,25 (d; J= 1,6; H-1"); 3,95 (m; H-3); 3,70 (m; H-3"); 3,68 (m; H-4"); 3,62 (dd; J=3,2 e 9,2; H-2"); 3,20 (m; H-5"); 2,91 (dd; J=16,5 e 6,0; H-4α); 2,64 (dd; J=16,4 e 8,4; H-4β); 1,24 (d; J=6,4; H-6"). HSQC e HMBC (1H: 400 MHz, 13C: 100 MHz, CD3OD) δC: 145,0 (C-5); 130,0 (C-1'); 129,0 (C-2' e C-6'); 116,3 (C-3' e C-5'); 102,0 (C-1" e C-10); 96,2 (C-6); 95,0 (C-8); 81,0 (C-2); 76,2 (C-3); 72,5 (C-2"); 71,8 (C-3"); 71,5 (C-4"); 70,0 (C-5"); 31,0 (C-6"); 28,3 (C-4). A fraçao n-butanólica das cascas do caule foi fracionada por CC de gel de sílica com CH2Cl2:MeOH (9:1) no modo isocrático de eluiçao, fornecendo 48 fraçoes que foram reagrupadas em 5 novas fraçoes após análise por CCDA. A segunda fraçao (300,0 mg) foi cromatografada por CC de gel de sílica no modo isocrático usando Hex:AcOEt (7:3), gerando 16 subfraçoes. Dentre estas, as subfraçoes 8 e 11 foram identificadas como substância 3 (20 mg) e 4 (10 mg), respectivamente. 1-Butil-D-frutofuranosideo (3). RMN 1H(400 MHz, CD3OD) δH (mult.; J em Hz; H): 4,10 (d; J=8,1; H-3); 3,91 (t; H-4); 3,82-3,86 (m; H-5); 3,60-3,80 (m; H-6); 3,70 (d; J=12; H-1) e 3,62 (d; J=12; H-1'); 3,47 (dd; J=6,7 e J=9,1; OCH2); 1,51 (quinteto; 2H, CH2); 1,38 (sexteto; 2H, CH2); 0,92 (t; 3H, CH3). HSQC e HMBC (1H: 400 MHz, 13C: 100 MHz, CD3OD) δC: 103,0 (C-2); 83,3 (C-5); 78,5 (C-3); 77,3 (C-4); 65,0 (OCH2); 62,3 (C-6); 62,0 (C-1); 33,5 (CH2); 20,5 (CH2); 14,4 (CH3). 2-Butil-D-frutofuranosideo (4). RMN 1H (400 MHz, CD3OD) δH (mult.; J em Hz; H): 4,06 (d; J=4,8; H-3); 3,91 (dd; J=7,6 e J=8,0; H-4); 3,76-3,80 (m; H-5); 3,60-3,80 (m; H-6); 3,65 (d; J=12; H-1) e 3,52 (d;J=12; H-1'); 3,51 (dd; J=6,4 e J=9,2; OCH2); 1,53 (quinteto; 2H, CH2); 1,41 (sexteto; 2H, CH2); 0,93 (t; 3H, CH3). HSQC e HMBC (1H: 400 MHz, 13C: 100 MHz, CD3OD) δC: 103,0 (C-2); 82,9 (C-5 e C-3); 78,1 (C-4); 62,0 (C-1, C-6 e OCH2); 33,3 (CH2); 20,1 (CH2); 14,0 (CH3). Ensaio toxicológico Baseado na metodologia de Meyer et al. (1982), com algumas adaptaçoes, foi preparado um ambiente adequado para o desenvolvimento da Artermia salina.6 Os extratos brutos e particionados da casca do caule e das folhas de V. thyrsoidea foram solubilizados em água salina e DMSO 1%, e partindo-se de soluçoes padrao efetuaram-se diluiçoes. Foram separadas 10 larvas por tubo de ensaio contendo 10 mL das soluçoes nas concentraçoes de 125, 250 e 500 µg/mL em triplicata. Cada teste foi acompanhado de um controle negativo, soluçao salina, do veículo usado para diluir os extratos (DMSO 1%) e do controle positivo com K2Cr2O7 (DL50 = 20 a 40 ppm). As larvas A. salina em testes foram mantidas à temperatura ambiente (26 ºC) sob iluminaçao artificial por um período de 24 horas. Após este período, foram realizadas leituras da contagem do número de larvas sobreviventes e mortas. A obtençao da dose que causa letalidade de 50% dos náuplios (DL50) foi feita por cálculos do método PROBIT de análise, por meio do software STATPLUSr 2005 (95% de confiança). Ensaio de atividade citotóxica in vitro As análises da citotoxicidade foram realizadas no Laboratório de Oncologia Experimental da Universidade Federal do Ceará por meio do método de MTT, que consiste em uma análise colorimétrica baseada na conversao do sal 3-(4,5-dimetil-2-tiazol)-2,5-difenil-brometo de tetrazolium (MTT) em azul de formazan, a partir de enzimas mitocondriais presentes em células metabolicamente ativas. As linhagens utilizadas, MDA-MB-435 (melanoma), HCT-8 (cólon humano), SF-295 (sistema nervoso central) e HL-60 (leucemia), foram cedidas pelo Instituto Nacional do Câncer (USA), tendo sido cultivadas em frascos plásticos para cultura, utilizando o meio RPMI 1640 suplementado com 10% de soro fetal bovino e 1% de antibióticos (penicilina/estreptomicina). As células foram incubadas em estufa a 37 ºC com atmosfera de 5% de CO2 e 95% de umidade, seguido da observaçao do crescimento celular com ajuda do microscópio de inversao a cada 24 horas. Quando necessário, as células foram repicadas em meio de cultura novo, em uma concentraçao de 1,0 x 105 céls/100 µL. As substâncias foram diluídas em DMSO puro e estéril na concentraçao de 5 µg/mL (dose única) e adicionadas em placas de 96 poços (100 µL/poço), onde a análise de cada amostra foi feita a partir de dois experimentos realizados em duplicata, tendo como controle positivo o quimioterápico doxorrubicina. Após um período de incubaçao de 72 horas, a absorbância foi lida em um espectrofotômetro de placas (DTX 880 Multimode Detector) a um comprimento de onda de 550 nm.7 Os resultados foram analisados segundo suas médias e respectivos desvios-padrao no programa GraphPad Prism. Ensaio de inibiçao enzimática: catepsinas B e K Os ensaios de inibiçao enzimática frente à catepsina B e K foram realizados no Laboratório de Produtos Naturais da Universidade Federal de Sao Carlos, usando-se as mesmas condiçoes experimentais para ambas as catepsinas. A metodologia aplicada, com algumas modificaçoes, consiste na determinaçao da inibiçao enzimática através da detecçao do aumento da fluorescência que ocorre com à hidrólise do substrato fluorogênico Z-FRMCA, o qual é detectado em espectrofluorímetro com fenda de excitaçao ajustada para λex = 380 nm e emissao λem = 460 nm.8 O modelo do espectrofluorímetro utilizado neste ensaio foi da Molecular Devices Corporation - Spetra MAX M3 GEMINI XS. Os ensaios foram feitos em triplicatas, nos quais as amostras foram diluídas em DMSO, obtendo uma concentraçao final do composto de 125 µM. Um volume de 5 µL foi transferido para cada poço das placas de ELISA (96 poços) e adicionou-se o MIX 1 e a enzima em concentraçao 3 mM em tampao (acetato de sódio 100 mM com 5 mM de EDTA e pH de 5,5) pré-ativada com DTE (5,0 mM) aos analitos. A enzima ficou em contato com os compostos por 5 minutos e posteriormente foram adicionados 10 µM do MIX 2 (substrato fluorogênico Z-FRMCA em tampao), realizando-se a leitura em seguida. Para os compostos que apresentaram inibiçao significativa (superior ou igual a 80%) frente às enzimas testadas foram determinados os valores de IC50. O potencial de inibiçao foi determinado utilizando-se dez diferentes concentraçoes do inibidor e construindo uma curva de concentraçao x resposta pelo método de regressao nao-linear do programa Origin.
RESULTADOS E DISCUSSAO A substância 1 foi identificada pela análise dos espectros de RMN 1H, HSQC e HMBC (Tabela 1) e massas de alta resoluçao (HRESIMS) em comparaçao com a literatura.5,9 O espectro de massas de alta resoluçao foi obtido no modo negativo, e exibiu um pico característico do íon em 549,1755 [M - H]-, sugerindo a fórmula molecular C30H30O10. No espectro de RMN de 1H a substância 1 apresentou sinais na regiao de hidrogênios alifáticos [δ 4,69 (d; J= 7,6 Hz), 3,98 (m), δ 2,97 (dd; J= 15,2 e 5,2 Hz) e 2,71 (dd; J= 15,6 e 8,4 Hz)], característicos dos hidrogênios H-2, H-3 e dos hidrogênios diastereotópicos H-4a e H-4b respectivamente. Na regiao de deslocamentos químicos de hidrogênios aromáticos os sinais em δ5,95 (d) e 5,86 (d) com constante de acoplamento de J= 2,4 Hz referem-se ao acoplamento entre os hidrogênios H-6 e H-8. Os dois dubletos em δ 7,27 (d) e 6,80 (d) com J= 8,4 Hz foram atribuídos aos hidrogênios H-2', H-6', H-3' e H-5' referente a um sistema de acoplamento de spins AA'XX'. A presença do resíduo de açúcar nesta estrutura foi observada pela presença dos sinais entre δ 3,62 e 4,19 de hidrogênios carbinólicos. A caracterizaçao da α-ramnose foi entao realizada com base no sinal do dubleto em δ 1,30 (d, J= 6,4 Hz) referente ao acoplamento dos hidrogênios da metila (H-6") com H-5", bem como pelo dubleto em δ 4,19 (J= 1,8 Hz) referente ao acoplamento diequatorial de H-1" e H-2".5 A unidade trans-cinamoíla presente pôde ser observada pelo conjunto de sinais no espectro de RMN 1H, onde na regiao de aromáticos um conjunto de dois dubletos em δ 7,76 e 6,58 (H- 7"' e H-8"'), ambos com J=16 Hz integrando para um hidrogênio cada, caracterizou o acoplamento em trans. Os multipletos em [δ 7,61 (m; H-2"' e H-6"') e 7,40 (m; H-3"', H-4"' e H-5"')] apresentaram um padrao de acoplamento típico de anel aromático monossubstituído. No experimento de HMBC observou-se que o dubleto em δH 4,19 referente ao hidrogênio anomérico da ramnose (H-1") apresentou correlaçao com o sinal em δC 76,0 (C-3), confirmando que a unidade de ramnose encontra-se ligada à posiçao 3 do flavonoide. Também foi possível por este experimento observar as correlaçoes do sinal em δH 7,76 (H-7"') com os sinais em δC 119,4 (C-8"'), δ 136,0 (C-1"') e δ 168,2 (C-9"'). A ligaçao da unidade cinamoíla ao oxigênio do carbono C-3" (δC 73,5) da ramnose foi confirmada através dos sinais δH 5,02/ δC 168,2 que correspondem à correlaçao do H-3" e o carbono da carbonila (C-9"') (Figura 2).
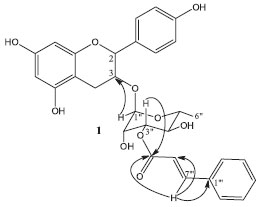 Figura 2. Correlaçoes do experimento de HMBC para substância 1
Uma substância estruturalmente relacionada a este flavonoide (1), o canferol 3-O-α-L-(4"-E-p-cumaroil)-raminosideo foi relatada anteriormente em Qualea grandiflora Mart. (Vochysiaceae).5 Os frutofuranosídeos tiveram suas estruturas determinadas por meio da comparaçao da literatura com os dados experimentais de RMN 1H, HSQC, HMBC, DEPT 135 e reaçao de acetilaçao utilizando DMAP como catalisador.10 O espectro de RMN de 1H da substância 3 apresentou um tripleto bastante intenso em δ 0,92 (t; 3H) referente aos hidrogênios da metila; um sexteto em δ 1,38 integrando para dois hidrogênios e um quinteto em δ 1,51referente aos hidrogênios metilênicos H-b e H-c. O duplo-dubleto em δ 3,47 (dd; J= 6,7 e 9,1 Hz) indicou a presença de uma unidade O-glicosídica que provocou a desblindagem destes hidrogênios metilênicos da cadeia alquílica (H-d). A substância 4 também apresentou na regiao entre 0,9-3,5 ppm o mesmo padrao de multiplicidade de sinais encontrados na substância 3, que juntamente com o número de hidrogênios estimados pela integral confirmaram também a presença de um grupo butila. Nestes espectros observa-se ainda a presença de sinais na regiao entre δ 3,40-4,2 referente à presença de uma unidade de açúcar. No experimento de DEPT 135º foram observados quatro sinais positivos (CH e CH3) e cinco sinais negativos (CH2), os quais foram atribuídos aos respectivos carbonos pela comparaçao com os deslocamentos químicos assinalados anteriormente (HSQC). Os sinais em δC 62,3 e 62,0 pertencem aos carbonos C-6 e C-1 do açúcar confirmando a frutofuranose pela presença de dois grupos metilênicos. O sinal negativo em δC 65,0 refere-se ao C-d (OCH2) e os outros dois sinais em δC 33,5 e 20,5 correspondem aos grupos CH2 da cadeia alquílica. O sinal em δC 14,4 é referente à metila da cadeia alquílica (C-a) e os outros três sinais (δC 83,3, 78,5 e 77,3) sao respectivamente dos carbonos do açúcar C-5, C-3 e C-4. A posiçao do grupo alquila ligado à unidade de açúcar foi determinada por meio do experimento de HMBC, que apresentou a correlaçao entre os sinais δC 65,0/δH 3,70 e 3,62 atribuídos, respectivamente, aos H-1 e H-1' e o C-d da cadeia alquílica. A substância 4 foi diferenciada da substância 3 com base nos sinais de carbono projetados no espectro de HMBC. A correlaçao do H-d (δH 3,51) e o C-c (δC 33,3), bem como a correlaçao deste hidrogênio (H-d) e o C-2 (δC 103,0) confirmaram a ligaçao da cadeia alquílica à unidade de açúcar no C-2.10 Ensaios biológicos A análise dos resultados do teste TAS, segundo Meyer, 6 foi realizada por meio de uma relaçao entre a dose letal média, DL50, e o grau de toxicidade, nos quais consideram-se tóxico valores de DL50<1000 µg/mL. Todos os extratos testados, exceto o hexânico das folhas (DL50<1000 µg/mL), apresentaram toxicidade frente a A. salina [cascas do caule: 283,94 (EtOH), 499,60 (hexano), 288,33 (CH2Cl2) e 476,58 (AcOEt) µg/mL; folhas: 209,08 (EtOH), 921,47 (CH2Cl2), 32,06 (AcOEt) e 151,90 (MeOH) µg/mL]. Os ensaios de toxicidade frente a esta espécie de microcrustáceo apresentam correlaçao com diversas atividades biológicas,11 e baseando-se nas substâncias obtidas no estudo fitoquímico foram realizados ensaios de inibiçao enzimática e de citotoxicidade. Das fraçoes do extrato bruto das cascas do caule e folhas de V. thyrsoidea avaliadas, nenhuma demonstrou potencial citotóxico relevante (percentual de inibiçao do crescimento tumoral maior que 80%) para as linhagens celulares tumorais testadas, MDA-MB-435 (melanoma), HCT-8 (cólon-humano), SF-295 (sistema nervoso central). Dentre os compostos avaliados, o 2-butil-D-frutofuranosídeo apresentou valores significativos de toxicidade com IC50=36,80 µM frente às células tumorais do sistema nervoso central (SF-295) e IC50=25,37 µM em linhagem HL-60 (leucemia humana). Os compostos testados nao apresentaram inibiçao frente à catespina K, entretanto frente à catepsina B obteve-se um resultado de inibiçao enzimática moderado, apresentado pelo composto catequina-3-O-(3"-trans-cinamoil)-α-ramnopiranosídeo (1), com IC50=62,02 (+/-0,79 µM).
CONCLUSAO O trabalho contribuiu com a caracterizaçao fitoquímica da planta V. thyrsoideaatravés do isolamento do catequin-3-O-(3"-trans-cinamoil)-α-ramnopiranosídeo, catequin-3-O-α-ramnopiranosídeo, 1-butil-D-frutofuranosídeo, 2-butil-D-frutofuranosídeo, ácido 2,4,6-trimetoxibenzóico e ácido 3-oxo-urs-12en-28-oico. Dentre as substâncias isoladas, os flavonoides e os frutofuranosídeos sao relatados pela primeira vez no gênero Vochysia, e a substânciacatequin-3-O-(3"-trans-cinamoil)-α-ramnopiranosídeo, a qual apresentou moderada atividade inibitória frente a catepsina B, foi descrita pela primeira vez na literatura. Em relaçao à atividade citotóxica, o 2-butil-D-frutofuranosídeo foi a substância que apresentou o resultado mais significativo de inibiçao das células tumorais do sistema nervoso central e leucemia humana.
MATERIAL SUPLEMENTAR As Figuras 1S à 17S estao disponíveis no site da Química Nova (http://quimicanova.sbq.org.br) em arquivo pdf, com acesso livre.
AGRADECIMENTOS Os autores agradecem ao Dr. N. P. Lopes da Faculdade de Ciências Farmacêuticas de Ribeirao Preto - USP pelo espectro de massas de alta resoluçao e ao CNPq, CAPES e FAPEG pelo suporte financeiro.
REFERENCIAS 1. Silva, M. C. J.; 100 Arvores do Cerrado: Guia de Campo; Brasília, 2005; Lorenzi, H.; Arvores Brasileiras: Manual de Identificaçao e Cultivo de Plantas Arbóreas do Brasil; Sao Paulo, 1998. 2. Corrêa, D. B.; Birchal, E.; Aguilar, J. E. V.; Gottlieb, O. R.; Phytochemistry 1975, 14, 1138. 3. Gnoatto, S. C. B.; Klimpt, A. D.; Nascimento, S; Galéra, P.; Boumediene, K.; Gosmann, G.; Sonnet, P.; Moslemi, S.; Eur. J. Med. Chem. 2008, 43, 1865. 4. Russell, K. M.; Molan, P. C.; Wilkins, A. L.; Holland, P. T.; J. Agric. Food Chem. 1990, 38, 10. 5. Ayres, M. C. C.; Escórcio, S. P.; da Costa, D. A.; Chaves, M. H.; Quim. Nova 2008, 6, 1481; Lokvama, J.; Coley, P. D.; Kursar, T. A.; Phytochemistry 2004, 65, 351. 6. Meyer, B. N.; Ferrigini, N. R.; Putnan, J. E.; Jacobsen, L. B.; Nichols, D. E.; Mclaughlin, J. L.; Planta Med. 1982, 45, 31. 7. Mossman, T.; J. Immunol. Methods 1983, 65, 55. 8. Bromme, D.; Steinert, A.; Friebe, S.; Fittkau, S.; Wiederanders, B.; Kirschke, H.; Biochem. J. 1989, 264, 475. 9. David, J. M.; Souza, J. C.; Guedes, M. L. S.; David, J. P.; Rev. Bras. Farmacogn. 2006, 16, 105; Kraft, C.; Siems, J. K.; Siems, K.; Solis, P. N.; Gupta, M. P.; Bienzle, U.; Eich, E.; Phytochemistry 2001, 58, 769. 10. Dudíková, J.; Mastihubová, M.; Mastihuba, V.; Kolarova, N.; J. Mol. Catal. B: Enzym. 2007, 45, 27. 11. Pisutthanan, S.; Plianbangchang, P.; Pisutthanan, N.; Ruanruay, S.; Muanrit, O.; Naresuan Univ. J. 2004, 12, 13. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access