Revisão
|
|
| Semioquímicos de moscas das frutas do gênero Anastrepha Semiochemicals of fruit flies of the genus Anastrepha |
|
Alana Lima-Mendonça; Adriana de Lima Mendonça; Antônio Euzébio Goulart Sant'Ana; Ruth R. Do Nascimento*
Instituto de Química e Biotecnologia, Universidade Federal de Alagoas, 57072-970 Maceió - AL, Brasil Recebido em 14/02/2013 *e-mail: ruth.nascimento@pq.cnpq.br Volatile compounds involved in the chemical communication of fruit flies have been studied for some years; however, their complete elucidation has not yet been reported. Tephritids, which belong to the Anastrepha genus, exhibit inter- and intraspecific changes regarding the chemical composition of their sex pheromones, as well as an evident relationship with the volatiles produced by their hosts. This paper reports advances in the elucidation of the chemical communication of Anastrepha species that involve sex pheromones, cuticular hydrocarbons, and the interaction between the fruit host volatiles and compounds released by the male flies. INTRODUÇÃO O Brasil é o terceiro maior produtor mundial de frutas, perdendo apenas para a China e a Índia, ocupando o primeiro lugar em número de espécies de clima tropical. Ainda, nos últimos doze anos, as exportações de frutos frescos cresceram uma média de 2,5 toneladas/ano, representando um montante superior a 900 milhões de dólares, ao passo que as frutas processadas representaram cerca de dois bilhões de dólares no agronegócio de frutas. No ano de 2011 foram exportadas 681.268 toneladas de frutos com uma previsão de mais de 750 mil toneladas para 2012.1 Embora o mercado exportador de frutos brasileiros esteja em nítida expansão, alguns problemas surgem em decorrência de insetos-praga, destacando-se dentre eles as moscas-das-frutas, devido aos grandes prejuízos causados ao mercado interno por ocasionarem queda precoce e depreciação de frutos para consumo in natura e para a industrialização.2 Os danos diretos causados pelas moscas-das-frutas são representados pela punctura realizada pela fêmea, no momento da oviposição, e/ou pelo desenvolvimento da larva no interior do fruto. Dependendo da espécie frutífera, a punctura realizada durante a oviposição pode servir de porta de entrada para fungos e bactérias, como foi observado em macieira,3 podendo ocorrer também a queda prematura dos frutos, provocada por distúrbios hormonais, devido às larvas que se desenvolvem no seu interior.4,5 De acordo com a FAO (Organização das Nações Unidas para a Alimentação e Agricultura), mundialmente, os prejuízos causados por tefritídeos totalizam US$ 1,7 bilhão por ano, 10% dos quais ocorrem no Brasil.6 Poucos insetos têm maior impacto no comércio internacional do que as moscas das frutas pertencentes à família Tephritidae. Tais moscas têm assumido crescente importância enquanto pragas de frutas e vegetais, gerando a implantação de sérios programas de controle regionais, nacionais e interfronteiras.7 A forma de controle para moscas-das-frutas mais amplamente usada no Brasil é a química, por meio de aplicações de iscas tóxicas e pulverizações em cobertura, empregando-se inseticidas fosforados, os quais possuem elevada toxicidade e carência, além de não serem seletivos aos inimigos naturais.8,9 Com a mudança no perfil do consumidor, particularmente os apreciadores de frutos in natura, que exigem alimentos com níveis reduzidos ou isentos de resíduos de agrotóxicos e da conscientização da população sobre os riscos ambientais causados por tais produtos, os programas de manejo integrado de pragas têm incentivado o uso de vários métodos e táticas de controle destacando-se dentre eles o monitoramento dos pomares, o ensacamento dos frutos, a resistência varietal, o controle biológico e o uso de atrativos.10 O uso de semioquímicos, principalmente os feromônios, de insetos-praga aumenta a eficiência de estratégias de controle, tais como monitoramento, coleta em massa e confusão sexual, e ainda contribui para a preservação do meio ambiente.11 Dentre os tefrítidios, aqueles pertencentes ao gênero Anastrepha Schiner contêm o maior número de espécies nos trópicos e subtrópicos das Américas com mais de 250 descritas.12-16 Da mesma forma, é o gênero mais importante em nível de pragas nessas regiões.17 No mundo, as espécies estão distribuídas principalmente na América do Sul e em parte das Américas Central e do Norte-México, sul do Texas e centro-sul da Flórida.18 As de maior importância econômica são A. obliqua (Macquart), A. ludens (Loew), A.suspensa (Loew), A. grandis (Macquart), A. serpentina (Wiedemann), A. striata (Schiner).19 e A. fraterculus (Wiedemann) com destaque para esta última, conhecida como mosca das frutas sul-americana, a qual é altamente polífaga14 e apresenta uma ampla distribuição nas Américas, desde o sul dos Estados Unidos até a Argentina.20 Anastrepha fraterculus, originalmente considerada uma praga amplamente distribuída,18,21,22 é atualmente conhecida por constituir um complexo de espécies crípticas (denominado Complexo AF) que exibe níveis consideráveis de isolamento reprodutivo pré- e pós-zigótico. Alguns estudos importantes realizados com diferentes populações desta espécie, inclusive brasileiras, demonstraram a existência de entidades taxonômicas distintas. Tais diferenças foram observadas em nível de filogenia (gene mitocondrial citocromo oxidase I - COI), citogenética (diferenciação cariótipica), preferência do hospedeiro, isoenzimática, morfologia de ovos, desenvolvimento embrionário, morfometria e compatibilidade de acasalamento, além da comunicação química, neste caso somente para populações do Peru e Argentina.23-38 No Brasil, o estudo do complexo fraterculus é de especial interesse, porque estudos anteriores sugeriram a existência de três espécies neste complexo, as quais foram denominadas Anastrepha fraterculus sp.1 aff. fraterculus, Anastrepha fraterculus sp.2 aff. fraterculus e Anastrepha fraterculus sp.3 aff. fraterculus.28,33,35,39 Da mesma forma, o cruzamento de Anastrepha fraterculus sp. 1 aff. fraterculus com Anastrepha fraterculus sp.2 aff. fraterculus, resultou na diminuição da incubação de ovos e no desvio da proporção sexual, indicando a existência de isolamento reprodutivo.29,35 Esse alto nível de isolamento pré-zigótico é baseado nas diferenças no ritmo da atividade sexual e, provavelmente, na composição do feromônio sexual do macho.40,41 Os insetos exercem as relações ecológicas envolvidas na sua comunicação com o ambiente e com os outros organismos de várias maneiras, sendo uma das mais importantes aquela que é mediada por compostos químicos. Esses compostos, denominados sinais químicos ou semioquímicos é, provavelmente, a mais antiga forma de comunicação em organismos vivos, e os insetos constituem um grupo de animais que utilizam e dependem destes compostos em diversas etapas do seu comportamento reprodutivo e de sobrevivência no habitat em que estão inseridas. Os sinais químicos utilizados pelos insetos são divididos em dois grupos: os aleloquímicos e os feromônios. Os aleloquímicos compreendem as substâncias envolvidas na comunicação interespecífica e atuam no processo de busca pelo alimento, tais compostos podem agir como alomônios, cairomônios e sinomônios, dependendo do organismo que emite e recebe os sinais. Quando o semioquímico tem ação intraespecífica é chamado de feromônio e se é liberado pelo macho ou pela fêmea e atrai o sexo oposto é conhecido como feromônio sexual.42-44 Esses sinais são percebidos por células nervosas receptoras localizadas dentro das sensilas olfativas,45 as quais estão presentes principalmente nas antenas, podendo, também, estarem localizadas nas mandíbulas, palpos, tarsos e no ovipositor.46-48 Nas espécies do gênero Anastrepha a liberação dos atraentes sexuais é feita pela distensão lateral da cutícula abdominal na altura do terceiro ao quinto segmentos, formando bolsas que estão associadas às glândulas exócrinas pleurais. Além dessa via, as substâncias atraentes são também oriundas de secreções intestinais, as quais são liberadas no momento em que o tecido anal é evertido, apresentando uma gotícula de secreção na extremidade do abdome e pela extensão e retração das partes bucais, que estão associadas às glândulas salivares.49-51 Feromônio de agregação A comunicação é um processo crucial para ambas as interações intra e interespecífica de todos os organismos.52 Em tefrítideos como Anastrepha spp., os machos produzem feromônios para atrair machos e fêmeas coespecíficas para os leks (assembléias de machos). Por funcionar como atraente para ambos os sexos, este sinal químico é classificado como feromônio de agregação. Entretanto, pelo fato de funcionar como atraente para fêmeas, este sinal também pode ser classificado como feromônio sexual. A resposta comportamental de um inseto estimulado pelo feromonio de agregação é o movimento em direção à fonte feromonal. Além disso, na maioria das vezes, a agregação de ambos os sexos ocorre em associação com os locais de oviposição, alimentação ou ainda com a exibição de comportamento agressivo relacionado à defesa de território.53 Os tefritídeos, por exemplo, utilizam pistas olfativas para buscar e avaliar o habitat, as fontes de alimento e os sítios de oviposição.54-56 Sendo assim, os sinais químicos têm sido estudados a partir de duas diferentes perspectivas: i) a forma como as moscas armazenam e liberam os feromônios sexuais57 e ii) como estes infoquímicos são empregados na atração de fêmeas e influenciam no sucesso do acasalamento.49,58 Os feromônios sexuais desempenham papel fundamental no reconhecimento de parceiro e no comportamento de acasalamento de espécies pertencentes ao gênero Anastrepha. Nas espécies deste gênero, um macho pioneiro escolhe um determinado sítio e inicia o comportamento de chamamento e corte, emitindo sinais químicos que atraem outros machos para o mesmo local, os quais também passam a exibir um comportamento coletivo que envolve movimentos estereotipados e a liberação simultânea de sinais químicos, acústicos e visuais, para atrair fêmeas sexualmente receptivas, as quais, após interagirem com alguns machos do grupo, escolhem um deles para copular.59,60 As áreas de exibição onde os machos se congregam para atrair e cortejar as fêmeas são denominadas de assembleias de machos ou leks e já foram observadas em algumas espécies do gênero Anastrepha.50,61 Vários tefritídeos formam leks nas folhagens das árvores hospedeiras ou não, próximas aos sítios de oviposição das fêmeas, que são atraídas para os leks objetivando exclusivamente a côrte e a seleção do parceiro.60 Anastrepha spp. obedece a um padrão pouco variável na sequencia comportamental, as mudanças ocorrem basicamente em relação ao período do dia e fatores como idade e status de acasalamento. Após atingirem a maturidade sexual, na fase adulta, os machos exibem o comportamento de chamamento, apresentando uma distensão das bolsas abdominais e da bolsa anal e mantém as asas em ângulo reto ao corpo, vibrando-as periodicamente em alta frequência por um período de 1 a 3 segundos. Em adição aos sons produzidos, os quais possivelmente fazem parte do processo de comunicação, a vibração de asas ajuda na dispersão dos atraentes sexuais, uma vez que direciona um jato de ar sobre as referidas bolsas, além de elevar a temperatura do corpo como resultado do trabalho metabólico realizado. Frequentemente, após um período de vibração de asas, o inseto toca a superfície da folha com a extremidade do abdome, provavelmente depositando pequenas quantidades de atraente sexual e, em seguida, gira o corpo em outra direção e repete a vibração de asas e o toque sobre a superfície da folha com a extremidade do abdômen.51 Alguns componentes do feromônio sexual já foram identificados em espécies do gênero Anastrepha (Tabela 1).

Anastrepha suspensa Para A. suspensa, nove compostos incluindo dois álcoois: (Z)-3-nonenol e (Z,Z)-3,6-nonadienol;62 três lactonas isoméricas: anastrefina (trans-hexaidro-trans-4,7α-dimetil-4-vinil-2-(3H)-benzofuranona), epianastrefina (trans-hexaidro-cis-4,7α-dimetil-4-vinil-2-(3H)-benzofuranona) e suspensolídeo (E,E)-4,8-dimetil-3,8-decadien-10-olídeo);63,64 três sesquiterpenos: β-bisaboleno, E,E-α-farneseno e α-trans-bergamoteno e um monoterpeno: (Z)-β-ocimeno,65-67 foram identificados como os compostos voláteis presentes na mistura liberada por machos e que funciona como atraente para as fêmeas. As fontes de emissão destes compostos são principalmente a boca e a bolsa anal do macho, entretanto, a liberação de alguns destes constituintes voláteis através de poros presentes na cutícula não pode ser descartada.40,42 Existem dois aspectos interessantes no comportamento de sinalização sexual de machos de A. suspensa: o primeiro é que, durante a liberação de feromônios, os machos tocam a face da folha com um material proveniente da glândula anal e segundo, eles regurgitam, através da boca, gotas de líquido sobre as superfícies foliares. Existe um pico de inclinação da glândula feromonal anal no começo do fotoperíodo, seguido por um declínio e, então, mais um período extensivo de atividade na segunda metade do fotoperíodo. Durante os períodos de picos de sinalização, a maioria dos machos tem uma série distinta de glândulas laterais projetadas para frente na maior parte do tempo. Episódios de agitação de asas (os quais podem dispersar o feromônio) também são observados e a inclinação de abdômen coincide com o período de ocupação do macho na superfície da folha. Por sua vez, as fêmeas são atraídas até 48 horas após a deposição e, além disso, esse comportamento também foi observado em machos no momento em que estão formando as assembleias ou leks, objetivando criar um sistema em que a volatilização do feromônio é lenta.68 Inicialmente, foi sugerido que as lactonas isoméricas anastrefina e epianastrefina poderiam funcionar como odores de atração, para fêmeas desta espécie, quando misturados à secreção oral.51 Posteriormente, análises químicas de extratos da secreção oral de machos sexualmente maduros revelaram que além das duas lactonas acima mencionadas existem mais três compostos: outra lactona, o suspensolídeo e dois sesquiterpenos: β-bisaboleno e (E,E)-α-farneseno, os quais também estão presentes, em grandes quantidades, na mistura de compostos liberada por machos de A. suspensa durante a sinalização sexual.69 Anastrepha ludens A mistura feromonal produzida ou emitida por machos de A. ludens é quimicamente muito semelhante àquela produzida por machos de A. suspensa.67 Os estudos conduzidos até hoje reportaram que as duas espécies diferiram marcadamente com relação à mistura de terpenos liberada, em particular quanto às proporções relativas dos sesquiterpenos. A mistura de compostos liberada por machos de A. suspensa continha o sesquiterpeno cíclico β-bisaboleno, como o componente mais abundante, uma menor quantidade de (E,E)-α-farneseno e traços de α-trans-bergamoteno. Por outro lado, a mistura de compostos voláteis liberados por machos de A. ludens apresentava o sesquiterpeno acíclico (E,E)-α-farneseno, como o componente presente em maior proporção, uma menor quantidade de α-trans-bergamoteno e uma quantidade mínima de β-bisaboleno. Essas duas espécies também diferiram com relação aos monoterpenos presentes na mistura de compostos voláteis liberada pelos machos. A. suspensa liberou exclusivamente o monoterpeno acíclico (Z)-β-ocimeno, enquanto A. ludens emitiu somente o isômero cíclico deste, o limoneno. Os autores relacionaram as diferenças encontradas nos terpenos de A. suspensa e A. ludens ao isolamento reprodutivo destas duas espécies.67 Sendo assim, as diferenças quantitativas e qualitativas da composição feromonal garantem a especificidade da comunicação química entre as duas espécies. Anastrepha obliqua Em A. obliqua, os primeiros estudos relatando a composição do feromônio sexual de machos foram realizados há dez anos. No primeiro estudo com esta espécie, dois compostos, (Z,E)-α-farneseno e (E,E)-α-farneseno, foram identificados como os compostos voláteis majoritários presentes na mistura liberada por machos. Além destes terpenóides, o álcool (Z)-3-nonenol foi também identificado, sendo que os dois primeiros foram isolados de extratos das glândulas salivares e o último do intestino posterior de machos desta espécie. Além disso, outros compostos, tais como: (Z,Z)-3,6-nonadienol, β-bisaboleno, suspensolídeo, anastrefina e apianastrefina, que foram identificados como componentes da mistura de compostos liberados por machos de A. suspensa e A. ludens, não foram detectados na mistura produzida por machos de A. obliqua.70,71 Em um segundo estudo, conduzido em 2004,72 foi demonstrado que a mistura de compostos liberada por machos desta espécie é caracterizada pela presença predominante do 1-heptanol. Esse álcool não havia sido identificado em nenhuma das espécies do gênero Anastrepha estudadas até então. Entretanto, nenhuma das lactonas identificadas na mistura feromonal de machos de A. suspensa e A. ludens foi detectada na mistura de compostos voláteis liberada por machos de A. obliqua. Por outro lado, compostos oxigenados, tais como: (E,Z)-3,6-nonadien-1-ol, 2-hexanona, hexanoato de etila e os terpenóides: linalol, α-trans-bergamoteno, α-trans-cariofileno e α-copaeno foram caracterizados como constituintes da mistura de compostos liberada por machos de A. obliqua. Recentemente, foram identificados nove compostos liberados por machos desta espécie, pertencentes a populações de laboratório, a saber: (Z)-3-nonenol, nonadienol, um sesquiterpeno de identidade desconhecida, β-farneseno, (E,E)-α-farneseno, (Z,E)-α-farneseno e três isômeros do farneseno. Dentre estes compostos, (Z)-3-nonenol e a mistura constituída por (Z)-3-nonenol+β-farneseno foram atrativos para fêmeas e machos de A. obliqua.73 Apesar disto, a identificação completa e a síntese dos compostos desconhecidos precisam ser realizadas, para avaliação de suas atividades biológicas em ensaios comportamentais. Anastrepha striata Para A. striata foi demonstrado que os principais compostos presentes na mistura liberada por machos desta espécie foram: linalool, hexanoato de etila e octanoato de etila.70 No entanto, a atividade feromonal destes compostos ainda não foi estabelecida. Anastrepha serpentina Recentemente, o feromônio de A. serpentina foi isolado e identificado e os dois componentes majoritários do feromônio emitido por machos foram a 2,5-dimetilpirazina (DMP) e o 3,6-diidro-2,5-dimetilpirazina (DHDMP), além da 2,3,5- trimetilpirazina (TMP) como componente minoritário.74 Bioensaios subsequentes, nos quais foram testadas misturas contendo DMP, TMP e DHDMP, aplicadas em papel filtro e expostas a fêmeas de A. serpentina, revelaram que a mistura constituída por DMP e DHDMP apresenta maior probabilidade de constituir o feromônio sexual para esta espécie.75 Anastrepha fraterculus Os componentes voláteis liberados por machos de A. fraterculus foram primeiramente isolados das glândulas salivares de espécimes provenientes da região sul do Brasil.76 No extrato dessas glândulas foram identificados os sesquiterpenos isoméricos (E,Z)-α-farneseno e (Z,E)-α-farneseno, e a lactona (E,E)-suspensolídeo. A análise química da secreção dessa glândula revelou a presença de (E,Z)-α-farneseno como o composto mais abundante, do (Z,E)-α-farneseno e de quatro pirazinas: 2,5-dimetilpirazina (DMP),2,3,5-trimetilpirazina (TMP),3-etil-2,5-dimetilpirazina (EDMP) e a 3-butil-2,5-dimetilpirazina, em quantidades muito pequenas. Posteriormente, para essa mesma população, foram identificados na mistura de compostos voláteis liberados por machos dois monoterpenos: o (Z)-β-ocimeno e o limoneno. O primeiro em maior quantidade do que o segundo. No extrato de lavagem da câmara onde os machos foram acondicionados para coleta dos compostos voláteis, foram identificadas as lactonas anastrefina e epianastrefina, como componentes menos abundantes que o (E,Z)-α-farneseno.77 Um estudo químico da mistura de constituintes voláteis liberada por machos em chamamento de população de A. fraterculus, coletada no município de Paripueira (Alagoas), região nordeste do Brasil, revelou a presença de 23 compostos, dos quais merecem destaque o (E,Z)-3,6-nonadien-1-ol, o α-trans-bergamonteno, o α-trans-cariofileno, o (E,E)-α-farneseno e o β-bisaboleno. Além desses compostos, as lactonas isoméricas suspensolídeo, anastrefina e epianastrefina, também foram identificadas.78 Considerando a hipótese de que diferenças fisiológicas e morfológicas evidentes ou sutis podem influenciar na composição química do feromônio sexual de populações diferentes desta espécie, visto que os mesmos atuam no contexto intraespecífico, estudos recentes identificaram diferenças qualitativas e quantitativas na composição química do feromônio de machos de A. fraterculus oriundos de populações provenientes da Argentina e do Peru.40 Os autores afirmaram que machos da primeira população produzem pequenas quantidades de (E)-β-ocimeno, n-nonanal e grandes quantidades de (Z)-3-nonen-1-ol, ácido benzóico, suspensolídeo, (Z,E)-α-farneseno, (E,E)-α-farneseno, anastrefina e epianastrefina e nenhuma quantidade detectável de (E)-α-trans-bergamonteno ou β-bisaboleno. Entretanto, machos da população proveniente do Peru produziram pequenas quantidades de limoneno, n-nonanal e (Z)-3-nonen-1-ol e quantidades relativamente grandes de (E)-β-ocimeno e (E)-α-trans-bergamoteno, (E,E)-α-farneseno e β-bisaboleno, suspensolídeo, anastrefina e epianastrefina, e, nenhuma quantidade detectável de (Z,E)-α-farneseno. Além disso, a mistura de compostos liberada por machos de populações híbridas (obtidas pelo cruzamento de machos e fêmeas de populações originárias da Argentina e do Peru) foram semelhantes tanto qualitativa quanto quantitativamente e continham todos os compostos identificados nas cepas parentais. Estudos de compatibilidade de acasalamento verificaram que fêmeas híbridas preferem acasalar com machos híbridos, sugerindo que tal resposta pode ser mediada por mudanças na resposta ao feromônio do macho, indicando possíveis diferenças nas misturas feromonais dos machos em relação aos parentais.41 Análises químicas e eletrofisiológicas de extratos contendo constituintes químicos da mistura feromonal liberada por machos de A. fraterculus, mantidos em laboratório e provenientes de população originária da Argentina, demonstraram que, dentre os compostos identificados, seis eliciaram respostas em antenas de fêmeas, são eles: (Z)-3-nonen-1-ol, (Z,Z)-3,6-nonadien-1-ol, geranilacetona, (E,E)-3,6-α-farneseno, suspensolideo e (S, S)-(-)-epianastrefina. Essas análises também revelaram que as antenas de machos coespecíficos respondem a estes compostos, com exceção dos álcoois (Z)-3-nonen-1-ol e (Z,Z)-3,6-nonadien-1-ol.79 Esses resultados sugerem a existência de uma especificidade sexual na percepção de componentes individuais do feromônio sexual desta espécie e, por conseguinte, levanta a hipótese de uma implicação de tais componentes como sinais carreadores de informações específicas em duas situações distintas: a do chamamento para a formação de leks e a que visa predominantemente a atração de fêmeas para a escolha de parceiro. No entanto, bioensaios específicos precisam ser conduzidos para confirmar ou refutar esta hipótese. Hidrocarbonetos cuticulares Embora os atraentes de longa distância (feromônios sexuais) sejam imprescindíveis para o encontro entre parceiros, existem outras substâncias, como é o caso dos hidrocarbonetos e alguns compostos minoritários tais como ésteres, alcoóis e ácidos graxos livres presentes na epicutícula do inseto, que podem funcionar como atraentes de curta distância, induzindo mudanças fisiológicas, tais como receptividade em fêmeas e outros comportamentos associados à cópula.80-82 A descoberta do papel que os hidrocarbonetos desempenham na comunicação química (servir como feromônio sexual, cairomônios, sinais de reconhecimento inter, intraespecífico e sexual, mimetismo químico e feromônios de efeito preparador) resultou em uma explosão de novas informações nas últimas décadas.83 Hidrocarbonetos cuticulares de insetos (CHCs) são usualmente uma mistura de compostos que podem incluir n-alcanos, n-alcenos, monometilalcanos com ramificação terminal, monometilalcanos com ramificação interna, dimetilalcanos, trimetilalcanos e outros. Eles são sintetizados a partir dos precursores acetil-CoA e malonil-CoA, a partir da descarboxilação nos oenocitos, os quais estão associados com as células epidérmicas ou corpos gordurosos. Após a síntese, os CHCs são transportados através da hemolinfa pela proteína lipoforina.82,84 Um esquema descritivo da síntese destes hidrocarbonetos pode ser visualizado na Figura 1. O perfil de hidrocarbonetos cuticulares, os quais são espécie-específicos tanto em insetos solitários como sociais, servem como impressões digitais, tornando possível discriminar espécies taxonomicamente semelhantes.85
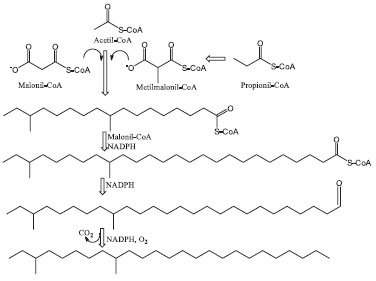 Figura 1. Rota de biosíntese proposta para cadeias de hidrocarbonetos ramificadas
Diferenças qualitativas e/ou quantitativas especificamente relacionadas ao sexo e ao status de acasalamento têm sido demonstradas para uma extensa lista de insetos incluindo os dípteros.80 Estudos realizados com tefritídeos demonstraram que os CHCs constituem um sinal potencial para o reconhecimento de espécies e de parceiros. A investigação de mudanças no perfil de CHCs dependentes da idade e do sexo do inseto pode revelar importantes informações para escolha entre parceiros, isto é, a qualidade do parceiro potencial ou o seu status de acasalamento.86 Estudos recentes demonstraram que os compostos presentes na cutícula de machos e fêmeas de uma população de A. fraterculus, proveniente da província de Tucumán, Argentina, é uma mistura de hidrocarbonetos saturados e insaturados, predominando, n-alcanos, alcanos, metil-ramificados, alcenos e alcadienos, com o número de carbonos variando entre treze a trinta e sete átomos de carbono e que o perfil de hidrocarbonetos presente nas cutículas de machos e fêmeas diferencia-se tanto em qualidade quanto em quantidade.87 No Brasil, apesar de todos os estudos direcionados a caracterização das populações de A. fraterculus, muito pouco se sabe no que se refere a identificação dos hidrocarbonetos cuticulares (CHCs) e esta pode ser uma ferramenta para diagnóstico de populações diferentes desta espécie, desde que a atividade biológica destes compostos seja elucidada. Feromônio de marcação do hospedeiro Do ponto de vista da procura por sítios de oviposição, quando os recursos para o forrageamento de insetos estão fixados em uma determinada localidade (por exemplo, folhas, frutos, larvas), a eficiência das fêmeas na busca por um substrato adequado aumenta caso elas sejam capazes de reconhecê-lo rapidamente e evitar os hospedeiros infestados. O uso de feromônios de marcação do hospedeiro (FMH) constitui uma estratégia de sucesso para minimizar a superlotação e para provocar o afastamento de áreas já ocupadas.88 O comportamento de marcação do hospedeiro inclui a inserção do acúleo pela fêmea na polpa do fruto, mantendo o ovipositor em posição perpendicular à superfície.89 As fêmeas não depositam ovos obrigatoriamente, mas, em alguns casos, removem o acúleo marcando somente a punctura ou, com o acúleo protraído, depositam o FMH.90 Assim, este feromônio é um sinal químico coespecífico associado com um hospedeiro que foi ocupado pelo inseto.91 Esse tipo de sinal é normalmente percebido por quimiorreceptores de contato e é geralmente produzido por fêmeas para funcionar como arrestante para fêmeas coespecíficas, evitando, desta forma, uma multi-infestação do hospedeiro.92 Em moscas das frutas, a ação de marcação do sítio de oviposição já foi observada para 10 espécies do gênero Anastrepha90 e o comportamento de marcação do hospedeiro já foi descrito para três espécies de Anastrepha: A. suspensa,93 A. fraterculus94 e A. ludens.95 Em Anastrepha, de maneira análoga ao que acontece com a espécie Ceratitis capitata e algumas espécies do gênero Rhagoletis,96,97 a presença do FMH não evita que outros indivíduos da mesma espécie deixem de exibir os comportamentos de oviposição e de marcação de fruto. Fêmeas de A. ludens depositam seus ovos em grapefruits marcadas anteriormente, ao menos três vezes, por fêmeas coespecíficas. A baixa concentração do ferômonio parece estimular a marcação contínua do hospedeiro e, em concentrações maiores, a oviposição parece ser desestimulada. Tal comportamento em A. ludens, por exemplo, é regulado pela adaptação sensorial ou habituação ao feromônio de marcação em conjunto com a inibição dose-dependente do comportamento locomotor.92 Nas espécies do gênero Anastrepha, cujos FMHs já foram identificados, descobriu-se que eles são compostos polares (facilmente dissolvidos em água e metanol) e notadamente estáveis diante de variações de pH, condições de luz e temperatura ambiental.89 Para A. ludens, A. obliqua e A. serpentina, além da função territorial, demonstrou-se que extratos metanólicos de fezes de uma espécie de mosca eliciam atividade biológica arrestante idêntica nas três espécies testadas, indicando uma função de reconhecimento interespecífico mútuo.98 Dentre os estudos relacionados à identificação de FMHs em espécies de Anastrepha destaca-se um trabalho conduzido com A. ludens, que reporta a extração, determinação estrutural, síntese e a atividade biológica de FMHs nesta espécie, presentes no extrato metanólico de suas fezes. Neste trabalho, o ácido (L)-2(R)-2-(2,15-dimetil-pentadecanoilamino-pentanodióico) é descrito como o HMP de A. ludens, e a atividade arrestante de oviposição deste composto e de dois análogos sintéticos, DM-HMP (ácido [L]-2-[(R)-2-metil-pentadecanoilamino]-pentanodióico e a anastrefamida (mistura diasteroisomérica dos ácidos [L]-2-[(R)-2-metil-hexadecanoilamino]-pentanodióico e [L]-2-[(S)-2-metil-hexadecanoilamino]-pentanodióico 1:1) foi evidenciada, em espécies de Anastrepha de importância econômica tais como A. fraterculus, A. grandis, A. ludens, A. obliqua, A. serpentina. A. striata e A. suspensa.99 Anastrefamida e DM-HMP também foram avaliados como arrestantes de oviposição de A. obliqua em pomares tropicais de ameixa e manga. Os resultados obtidos indicaram uma redução do nível de infestação em pomares de ameixas da ordem de 53.3% e 58.7%, respectivamente, no 18º e 26º dia após aplicação. A anastrefamida, por sua vez, reduziu em 73.9% o nível de infestação nesses pomares, 20 dias após a aplicação, resultando numa diminuição de 80% do número de larvas por fruto.100 Estudos posteriores com os quatro diasteroisômeros do HMP demonstraram um efeito arrestante para o derivado (R)-L, DM-HMP e para a anastrefamida de maneira análoga ao efeito produzido pelo produto natural HMP.101 As estruturas destes compostos estão descritas na Figura 2.
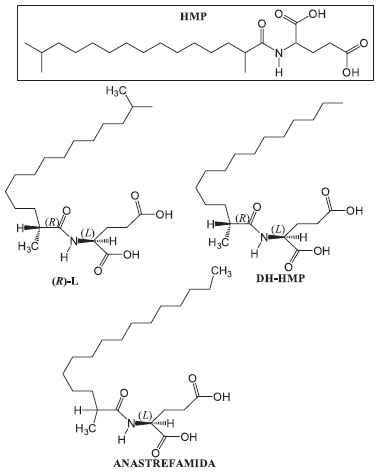 Figura 2. Estrutura dos compostos descritos como feromônio de marcação de hospedeiro com efeito arrestante para Anastrepha spp. A. ludes. HMP: ácido N-(2,14-dimetil-1-oxopentadecil)-glutâmico; (R)-L: (L)-2(R)-2-(2,15-dimetilpentadecanoilamino-pentanodióico); DM-HMP:(ácido [L]-2-[(R)-2-metil-pentadecanoilamino]-pentanodióico e; Anastrefamida: mistura diasteroisomérica 1:1 dos ácidos [L]-2-[(R)-2-metil-hexadecanoilamino]-pentanodióico e [L]-2-[(S)-2-metil-hexadecanoilamino]-pentanodióico)
Estes estudos demonstram a importância potencial do uso de FMHs no manejo de moscas-das-frutas, incluindo Anastrepha spp. Inicialmente foi proposta a utilização destes compostos em uma estratégia push-pull (produto arrestante associado a um produto atraente instalado em armadilhas),100,101 todavia, não indicada para o controle de espécies com alta taxa de crescimento populacional. Foi postulado que o emprego de FMHs no controle de Anastrepha spp. pode ser viável em quatro situações distintas de infestação: 1) em frutos cujo tempo de permanência na árvore é pequeno, como é o caso de ameixas, mangas e goiabas; 2) em frutos de alto valor comercial, como é o caso dos cultivares de maça; 3) nos cultivos de frutos orgânicos e 4) nos cultivos de frutos cuja utilização de inseticidas é severamente restrita.100 Interação dos compostos voláteis de moscas das frutas do gênero Anastrepha com as substâncias voláteis dos hospedeiros Além do enfoque feromonal, os compostos voláteis produzidos por tefritídeos envolvem relações evidentes com os seus hospedeiros. Tem sido bem documentado que as plantas hospedeiras podem influenciar o comportamento sexual de insetos herbívoros de diversas maneiras, dentre elas a produção ou a liberação de compostos voláteis pelos insetos e a busca por sítios apropriados para oviposição.102 Adicionalmente, os feromônios também podem agir de maneira associada aos aleloquímicos (ex. ação sinérgica de feromônios de agregação e compostos da planta hospedeira) ou terem sua emissão influenciada pelos aleloquímicos (ex. produção de feromônios de agregação somente na presença da planta hospedeira).102,103 Para os insetos, dentre os estímulos químicos, o olfato é considerado o principal sentido na localização de parceiros para a cópula (feromônios) e de plantas hospedeiras (cairomônios). Tefritídeos adultos podem detectar compostos voláteis de frutos a vários metros de distância e estes estímulos são utilizados por essas moscas para orientação em direção à planta hospedeira. Após o encontro, o fruto é escolhido com base na cor, forma, tamanho e compostos voláteis por ele liberados.104,105 Tem sido demonstrado que odores emitidos pelos frutos influenciam a cópula, a alimentação e a oviposição.106 Esses odores podem estimular uma maior ou menor atratividade, em decorrência da idade, status de cópula e experiência dos insetos com o hospedeiro.107 A avaliação da resposta de Anastrepha ludens aos compostos voláteis de laranja e manga, verdes e maduras, indicaram que machos e fêmeas acasaladas foram significativamente mais atraídos aos frutos das duas espécies quando estavam verdes, enquanto os não copulados foram mais atraídos por frutos maduros.108 Estudos envolvendo o efeito da idade em relação às respostas eletroantenográficas (EAG) de Anastrepha suspensa a duas substâncias atraentes, indicaram que as fêmeas desta espécie apresentaram maior sensibilidade à amônia, quando estavam sexualmente imaturas, e ao dióxido de carbono, quando estavam maduras. Contudo, em testes comportamentais, foi verificado que tanto as fêmeas imaturas quanto as maduras foram atraídas pela amônia. De acordo com os autores ocorre a liberação dessa substância, principalmente, quando alguns alimentos proteicos estão em estágio de decomposição, atraindo naturalmente as moscas para estes recursos.109 Comparando os extratos de aeração de machos de A. obliqua em chamamento e os de frutos de Avehrroa carambola, demonstrou-se que os mesmos apresentaram como compostos em comum, a 2-hexanona, identificada dentre os compostos voláteis liberados pelos frutos de carambola nos estágios de maturação verde e intermediário, e o cis-ocimeno, identificado apenas nos extratos de frutos no estágio verde. O hexanoato de etila, encontrado no extrato obtido pela lavagem da câmara de aeração dos insetos, foi identificado como composto majoritário nos estágios de maturação do fruto já mencionados. Nos frutos dos três estágios de maturação, principalmente dos estágios intermediário e maduro, foram identificados outros ésteres contendo seis átomos de carbono na cadeia principal, saturados e insaturados, que têm possibilidade de serem convertidos em hexanoato de etila. Além disso, embora o 3-octenoato de etila não tenha sido encontrado nos extratos de frutos de A. carambola, o qual foi identificado tanto nos extratos de aeração de machos quanto nos de lavagem da câmara de aeração, uma série de ésteres saturados e insaturados contendo oito átomos de carbono na cadeia foram encontrados nos frutos de carambola em estágio intermediário de maturação e nos completamente maduros. Esses compostos coincidentes demonstraram a existência de similaridade na composição química dessas duas misturas de substâncias voláteis.110 Estudos posteriores demonstraram que, entre os extratos de secreções de glândulas salivares de machos de A. obliqua e aqueles de seu fruto hospedeiro, a carambola, o estágio de maturação verde, preferido por fêmeas da espécie para oviposição, coincidiu em oito compostos dos quinze identificados para o fruto, são eles: a 2-heptanona, a 3-octanona, a 2-octanona, o hexanoato de etila, o heptanoato de metila, o 2-etil-1-hexanol, o limoneno e o (Z)-β-ocimeno, levantando a hipótese de que estes constituintes químicos podem ser adquiridos por esses machos ainda nos primeiros instares larvais e que poderiam também ser responsáveis pela atração das fêmeas para frutos desse estágio de maturação.111 Em 2006,112 foi demonstrado que fêmeas e machos de A. obliqua são atraídas para extratos de frutos maduros de Spondias mombin L e, análises químicas destes extratos por CG-EAG e CG-EM, , evidenciaram nove compostos, foram eles: butirato de etila, butirato de isopropila, hexan-1-ol, butirato de propila, butirato de isopropila, hexanoato de etila, butirato de isopentila, benzoato de etila e etanoato de etila. A mistura sintética destes compostos, na proporção encontrada na mistura natural, foi atrativa tanto em bioensaios conduzidos em túnel de vento quanto para iscas em gaiolas de campo, as quais capturaram mais insetos de A. obliqua do que a proteína hidrolizada ou a água. A influência desse hospedeiro na composição do feromônio sexual da espécie não afeta a produção dos compostos voláteis pelos machos, mas possivelmente interfere na sua liberação.113 Um estudo comparativo entre os compostos voláteis liberados por machos de A. fraterculus, e por seu hospedeiro preferencial, os frutos de Psidium guava, realizado pelo grupo de Ecologia Química, da Universidade Federal de Alagoas, demonstrou que alguns compostos estão presentes nas misturas liberadas por frutos e por machos desta espécie, porém testes comportamentais com os mesmos ainda estão sendo conduzidos (dados não publicados). Recentemente, o efeito da exposição à polpa da goiaba, limão e manga no sucesso de acasalamento de machos de A. fraterculus foi avaliado. Foi constatado que o desempenho sexual aumenta na presença dos dois primeiros, sugerindo que o α-copaeno, presente em maior quantidade neles, em detrimento da manga, seria o composto responsável por este efeito, apesar da possibilidade do envolvimento de outros compostos, visto que o fruto libera uma mistura complexa de compostos voláteis.114
CONCLUSÕES As informações fornecidas nesta revisão apontam que os tefritídeos, de maneira geral, utilizam sinais químicos para intermediar as interações intra- e interespecíficas. Uma diversa gama de compostos oxigenados faz parte da mistura feromonal liberada por machos de Anastrepha spp. e, embora existam componentes comuns a algumas espécies, a mistura feromonal de cada uma delas é espécie-específica, sugerindo que tais componentes podem servir como diagnóstico de identificação de espécies e/ou populações distintas. É evidente a semelhança química existente entre os constituintes voláteis liberados por machos de Anastrepha e por seus hospedeiros, assim como o é a participação dos compostos voláteis dos hospedeiros na escolha e na atração de adultos de Anastrepha spp. No tocante às espécies que compõem o complexo de espécies crípticas de Anastrepha, estudos químicos e comportamentais são imprescindíveis para a compreensão do mesmo, de modo que se faz necessário à sua continuidade. Assim poderão ser reunidas informações suficientes que permitam a elaboração de protocolos que auxiliem no diagnóstico das espécies pertencentes a este complexo e, consequentemente, em estratégias de manejo desta praga pelos fruticultores.
AGRADECIMENTOS Às Instituições de fomento CAPES e CNPq pelas bolsas concedidas (Ds.C, PNPD e PQ) e à International Atomic Energy Agency (IAEA) da Food and Agriculture Organization of the United Nations (FAO-ONU, Proc. Nº 16051) pelo apoio financeiro.
REFERÊNCIAS 1. Kist, B. B.; Vencato, A. Z.; Carvalho, C.; Reetz, E. R.; Poll, H.; Beling, R. R.; Brasilian Fruit Yearbook, 1th ed., Gazeta Santa Cruz: Santa Cruz do Sul, 2012. 2. Duarte, A. L.; Malavasi, A. Em Moscas das Frutas de importância Econômica no Brasil; Malavasi, A.; Zucchi, R. A., eds.; Holos: Ribeirão Preto, 2000, cap.25. 3. Santos, J. P.; Corrent, A. R.; Berton, O.; Schwarz, L. L.; Denardi, F.; Rev. Bras. Frutic. 2008, 30, 118. 4. Malavasi, A.; Nascimento, A. S.; Carvalho, R. S.; Anais do Terceiro Seminário Internacional de citros-MIP, Campinas, Brasil, 1994. 5. Aguiar-Menezes, E. L.; Ferrara, F. A. A.; Menezes, E. B. Em Citricultura Fluminense: principais pragas e seus inimigos naturais; Cassino, P. C. R.; Rodrigues, W. C., eds.; Seropédica: Universidade Rural, 2004, 67-84. 6. http://faostat.fao.org, acessada em Dezembro 2010. 7. IAEA.; Trapping Guidelines for Area-Wide Fruit Fly Programmes, 1th ed., IAEA: Vienna, 2003. 8. Kovaleski, A.; Ribeiro, L. G. Em Produção integrada de frutas: O caso da maçã no Brasil; Protas, J. F. S.; Sanhueza, R. M. V., eds.; Embrapa uva e vinho: Bento Gonçalves, 2003, 34. 9. Scoz, P. L.; Botton, M.; Garcia, M. S.; Ciência Rural 2004, 34, 1689. 10. Carvalho, R. S.; Nascimento, A.S.; Matragalo, V.J.R. Em Moscas das Frutas de importância econômica no Brasil; Malavasi, A.; Zucchi, R. A., eds.; Holos: Ribeirão Preto, 2000, cap.14. 11. Zarbim P. H. G.; Rodrigues, M. A. C. M.; Lima, E. R.; Quim. Nova 2009, 32, 722. 12. Norrbom, A. L., Zucchi, R. A.; Hernandez-Ortiz, V. Em Fruit Flies (Tephritidae): Phylogeny and Evolution of Behavior; Aluja, M.; Norrbom, A. L., eds.; CRC: Boca Raton, 1999, cap. 12. 13. McPheron, B. A., Han, H. Y., Silva, J. G.; Norrbom, A. L. Em Fruit flies (Tephritidae): Phylogeny and evolution of Behavior; Aluja, M.; Norrbom, A. L., eds.; CRC: Boca Raton, 1999, cap. 13. 14. http://www.sel.barc.usda.gov:591/diptera/TephritI/TephHosts/search.Html, acessada em Setembro 2012. 15. Norrbom, A. L.; Korytkowski, C. A.; Zootaxa 2009, 2182. 16. Norrbom, A. L.; Korytkowski, C. A.; Zootaxa 2011, 2740. 17. Norrbom, A. L.; Korytkowski, C. A.; Zootaxa 2012, 3778. 18. Nascimento, A. A.; Carvalho, R. S. Em Moscas das Frutas de importância Econômica no Brasil; Malavasi, A.; Zucchi, R. A., eds.; Holos: Ribeirão Preto, 2000, cap. 22. 19. Zucchi, R. A. Em Moscas das Frutas de importância econômica no Brasil; Malavasi, A.; Zucchi, R. A., eds.; Holos: Ribeirão Preto, 2000, cap.1. 20. Aluja, M.; Annu. Rev. Entomol. 1994, 39, 155; Salles, L. A. B.; An. Soc. Entomol. Bras. 1995, 24(3), 423; Steck, G. J.; The South American fruit fly Anastrepha fratercullus (Wied.): Advances in Artificial Rearing Taxonomic Status and Biological Studies, 1th ed., IAEA: Vienna, 1999; Zucchi, R.A. Em Moscas das Frutas de importância econômica no Brasil; Malavasi, A.; Zucchi, R.A., eds.; Holos: Ribeirão Preto, 2000, cap. 4. 21. Hernandez-Ortiz, V.; El gênero Anastrepha Schiner (Diptera: Tephritidae). Taxonomía, distribución y sus plantas huéspedes. 1th ed., Xalapa: Veracruz, 1999. 22. Malavasi, A.; Zucchi, R. A.; Sugayama, R. L.; Em Moscas das Frutas de importância econômica no Brasil (conhecimento básico e aplicado); Malavasi, A.; Zucchi, R.A., eds.; Holos: Ribeirão Preto, 2000, cap. 10. 23. Stone, A.; The Fruit Flies of the genus Anastrepha. Miscellaneous: Washington, 1942. 24. Bush, G. L.; Psyche 1962, 68, 87. 25. Morgante, J. S.; Malavasi, A.; Bush, G. L.; Ann. Entomol. Soc. Am. 1980, 73, 622. 26. Malavasi, A.; Morgante, J. S.; Genetica 1983, 60, 207. 27. Selivon, D.; Morgante, J. S.; Perondini, A. L. P.; Braz. J. Genet. 1997, 20, 253. 28. Selivon, D.; Perondini, A. L. P.; Ann. Entomol. Soc. Am. 1998, 91, 474. 29. Selivon, D.; Perondini, A. L. P.; Morgante, J. S.; Genet. Mol. Biol. 1999, 22, 507. 30. Selivon, D.; Vretos, C.; Perondini, A. L. P.; Neotrop. Entomol. 2003, 32, 527. 31. Smith-Caldas, M. R. B.; Mcpheron, B. A.; Silva, J. G.; Zucchi, R. A.; Neotrop. Entomol. 2001, 30, 565. 32. Hernández-Ortiz, V.; Gómez-Anaya, J. A.; Sánchez, A.; Mcpheron, B. A.; Aluja, M.; Bull. Entomol. Res. 2004, 94, 487. 33. Selivon, D.; Vretos, C.; Fontes, L.; Perondini, A. L. P.; Proceedings, 6th International Symposium on Fruit Flies of Economic Importance; Stellenbosch, South Africa, 2002. 34. Petit-Marty, N.; Vera, M. T.; Calcagno, G.; Cladera, J. L.; Segura, D. F.; Allinghi, A.; Rodriguero, M.; Goméz-Cendra, P.; Viscarret, M. M.; Vilard, J. C.; Ann. Entomol. Soc. Am. 2004, 97, 1320. 35. Selivon, D.; Perondini, A. L. P.; Morgante, J. S.; Ann. Entomol. Soc. Am. 2005, 98, 367. 36. Vera, M. T.; Cáceres, C.; Wornoayporn, V.; Islam, A.; Robinson, A. S.; De La Vega, M. H.; Hendrichs, J.; Cayol, J. P.; Ann. Entomol. Soc. Am. 2006, 99, 387. 37. Marcon, H. S.; Domingues, D. S.; Coscrato, V. E.; Selivon, D.; Perondini, A. L. P.; Marino, C. L.; Neotrop. Entomol. 2011, 40, 568. 38. Hernandez-Ortiz, V.; Bartolucci, A. F.; Morales-Valles, P.; Frias, D.; Selivon, D.; Ann. Entomol. Soc. Am. 2012, 105, 305. 39. Selivon, D.; Perondini, A. L. P. Em Moscas de la fruta ver Latinoamérica (Diptera: Tephritidae): Diversidad, Biología y Manejo; Hernández-Ortiz, V., ed.; SyG: Distrito Federal, Mexico, 2007, 119-132. 40. Cárceres, C.; Segura, D. F.; Vera, M. T.; Wornoayporn, V.; Cladera, J. L.; Teal, P.; Sapountzis, P.; Bowtzis, K.; Zacharopoulou, A.; Robinson, A. S.; Biol. J. Linn. Soc. 2009, 97, 152. 41. Segura, D. F.; Vera, M. T.; Rull, J.; Wornoayporn, V.; Islam, A.; Robinson, A. S.; Biol. J. Linn. Soc. 2011, 102, 346. 42. Nordlund, D. A.; Lewis, W. J.; J. Chem. Ecol. 1976, 2(2), 211. 43. Dicke, M.; Sabelis, M. W.; Funct. Ecol. 1988, 2, 131. 44. Lima, E. R.; Della-Lucia, T. M.C. Em Feromônios de Insetos; Vilela, E. F.; Della Lucia, T. M. C., eds.; Holos: Ribeirão Preto, 2001, cap. 1. 45. Corrêa, A. G.; Sant'Ana, J. Em Produtos naturais no controle de insetos; Ferreira, J. A. C.; Corrêia, A. G.; Vieira, P., eds.; UFSCar: São Carlos, 2001, cap. 1. 46. Atkins, M. D.; Boeckh, J. Em Insect communication; Lewis, T., ed.; Macmillan: New York, 1984, 123-149. 47. Sivinski, J.; Aluja, M.; Dodson, G. N.; Freidberg, A.; Headrick, D. H. Em Fruit flies (Tephritidae): Phylogeny and Evolution of Behavior; Aluja, M.; Norrbom, A. L., eds.; CRC: Boca Raton, 2000, cap. 28. 48. Kaneshiro, K. Y.; Landolt, P. J.; Faucheux, M. J.; Int. J. Insect Morphol. Embryol. 1991, 20, 291. 49. Landolt, P. J.; Averill, A. L. Em Pheromones of Non-lepidopteran Insects Associated with Agricultural Plants; Hardie, J.; Minks, A.K., eds.; CABI: New York, 1999, 3-25. 50. Malavasi, A.; Barros, M. D.; Anais do I Encontro sobre Moscas-das-frutas, Campinas, Brasil, 1988. 51. Nation, J. L. Em Fruit Flies their Biology, Natural Enemies and Control, Robson, A. S.; Hooper, G., eds.; Elsevier: Amsterdan, 1989, 189-205. 52. Kroiss, J.; Tese de doutorado, Universität Regensburg, Regensburg, Alemanha, 2008. 53. Vilela, E. F.; Kovaleski, A. Em Moscas das frutas de importância econômica no Brasil (conhecimento básico e aplicado); Malavasi, A.; Zucchi, R. A., eds.; Holos: Ribeirão Preto, 2000, cap. 11. 54. Prokopy, R. J.; Roitberg, B. D. Am. Sci. 1984, 72, 49. 55. Light, D. M.; Jang, E. B.; Dickens, J. C.; J. Chem. Ecol. 1988, 14, 159. 56. Katsoyanos, B. I.; Kouloussis, N. A.; Papadopoulos, N. T.; Entomol. Exp. Appl. 1997, 82, 181. 57. Fletcher, B. S. Nature 1968, 219. 58. Nation, J. L. Ann. Entomol. Soc. Am. 1972, 65, 1364; Perdomo, A. J.; Tese de Doutorado, University of Florida, USA, 1974; Katsoyannos, B. I.; Environ. Entomol. 1976, 5, 474; Landolt, P. J., Heath, R. R.; King, J. R.; Ann. Entomol. Soc. Am. 1985, 78, 751. 59. Sivinski, J.; Burk, T. Em Fruit Flies their Biology, Natural Enemies and Control; Robson, A. S.; Hooper, G., eds.; Elsevier: Amsterdan, 1989, 91-103. 60. Sugayama, R. L.; Malavasi, A. Em Moscas das frutas de importância econômica no Brasil; Malavasi, A.; Zucchi, A. R., eds.; Holos: Ribeirão Preto, 2000, cap. 12. 61. Robacker, D. C.; Hart, W. G.; Ann. Entomol. Soc. Am. 1985, 78, 488. 62. Ponce, W. P.; Nation, J. L.; Emmel, T. C.; Smittle, B. J.; Teal, P. E. A.; J. Chem. Ecol. 1993, 19, 3045. 63. Battiste, M. A.; Strekowski, L.; Vanderbilt, D. O.; Vinisck, M.; King, R. W.; Nation, J. L.; Tetrahedron Lett. 1983, 24, 2611. 64. Chuman, J.; Sivinski, J.; Heath, R. R.; Calkins, C. O.; Tumlinson, J. H.; Battiste, M. A.; Wydra, R. L.; Strekowski, L.; Nation, J. L. Tetrahedron Lett. 1988, 29, 6561. 65. Tumlinson, J.H.; J. Chem. Ecol. 1988, 14, 2109. 66. Nation, J.L.; Proceedings of the International Symposium on the Biology and Control of Fruit Flies, Okinawa, Japan, 1991. 67. Rocca, Jr.; Nation, J.L.; Strekowski, L.; Battiste, M.A.; J. Chem. Ecol. 1992, 18, 223. 68. Sivinski, J.M.; Epsky, N.; Heath, R.R.; J. Insect Behav. 1994, 7, 43. 69. Lu, F.; Teal, P.E.E.; Arch. Insect Biochem. Physiol. 2001, 48, 144. 70. Heath, R.R.; Landolt, P. J.; Robacker, D.C.; Dueben, B.D.; Epsky, N. Em Fruit flies (Tephritidae): Phylogeny and Evolution of Behavior; Aluja, M.; Norrbom, A.L., eds.; CRC: Boca Raton, 2000, cap. 29. 71. Ibañez-López, A.; Cruz-López, L.; Folia Entomologica Mexicana 2001, 40, 221. 72. Gonçalves, G.B.; Qualificação de doutorado, Universidade Federal de Alagoas, Brasil, 2004. 73. López-Guillén, G.; Cruz-López, L.; Malo, E.A.; Rojas, J.C.; Fla. Entomol. 2011, 94, 874. 74. Robacker, D.C.; Aluja, M.; Bartelt, R.J.; Patt, J.; J. Chem. Ecol. 2009, 35, 601. 75. Robacker, D.C.; Aluja, M.; Cossé, A.A.; Sacchetti, P.; Ann. Entomol. Soc. Am. 2009, 102, 500. 76. Lima, I.S.; Howse, P.E.; Stevens, D.R. Em Fruit Fly Pests: A World Assessment of their Biology and Management; MacPheron, B.A.; Steck, G.J., eds.; St Lucie: London, 1996, 91-99. 77. Lima, I.S.; Howse, P.E.; Do Nascimento, R.R.; J. Braz. Chem. Soc. 2001, 12, 196. 78. Santos, J.C.G.S.; Dissertação de Mestrado, Universidade Federal de Alagoas, Brasil, 2003. 79. Vanicková, L.; Tese de Doutorado, Institute of Chemical Technology, República Theca, 2012. 80. Lockey, K. H.; Insect Biochem. 1981, 11, 549. 81. Lockey, K. H.; Comp. Biochem. Physiol. 1988, 89, 595. 82. Howard, R. W.; Blonquist, G. J.; Annu. Rev. Entomol. 2005, 50, 371. 83. Blonquist, G. J.; Bagnéres, A. G.; Insect Hydrocarbons: Biology, Biochemistry and Chemical ecology, 1th ed., Cambridge University: Cambridge, 2010. 84. Blonquist, G. J.; Howard, R. W.; Em Insect Pheromone Biochemistry and Molecular Biology; Blonquist, G. J.; Vogt, R. G., eds.; Academic Press: London, 2003. 85. Vrkoslav, V.; Muck, A.; Cvacka, J.; Svatos, A.; J. Am. Soc. Mass Spectrom. 2010, 21, 220. 86. Carlson, D. A.; Yocom, S. R.; Arch. Insect Biochem. Physiol. 1986, 3, 397; Lavine, B. K.; Carlson, D. A. Calkins, C. O.; Microchem. J. 1992, 45, 50; Goh, S. H.; Ooi, K. E.; Chang, C. H.; Yong, H. S.; Khoo, S. G.; Ong, S. H.; Biochem. Syst. Ecol. 1993, 21, 215; Sutton, B. D.; Carlson, D. A.; Arch. Insect Biochem. Physiol. 1993, 23, 53; Sutton, B. D.; Steck, G. J.; Fla. Entomol. 1994, 77, 231. 87. Vaníčková, L.; Svatoš, A.; Kroiss, J.; Kaltenpoth, M.; Do Nascimento, R. R.; Hoskovec. M.; Břízová, R.; Kalinová, B.; J. Che, m. Ecol. 2012, 38, 1133. 88. Prokopy, R. J. Em Semiochemicals: Their Role in Pest Control; Nordlund, D. A.; Jones, R. L.; Lewis, W. J., eds.; Wiley & Sons: New York, 1981, 283-295. 89. Díaz-Fleischer, F.; Papaj, D. R.; Prokopy, R. J.; Norrbom, A. L.; Aluja, M. Em Fruit Flies (Tephritidae): Phylogeny and Evolution of Behavior, CRC: Boca Raton, 2000, cap. 30. 90. Silva, M. A.; Bezerra-Silva, G. C. D.; Mastragelo, T.; Braz. Arch. Biol. Technol. 2012, 55, 835. 91. Nufio, C. R.; Papaj, D. R.; Entomol. Exp. Appl. 2001, 99, 273. 92. Papaj, D. R.; Aluja; M.; Physiol. Entomol. 1993, 18, 279. 93. Prokopy, R. J.; Spatcher, P. J.; Ann. Entomol. Soc. Am. 1977, 70, 960. 94. Prokopy, R. J., Malavasi, A.; Morgante, J. S.; J. Chem. Ecol. 1982, 8, 763. 95. Boeckh, J. Em Insect Communication; Lewis, T., ed.; Macmillan: New York, 1984, 83-104. 96. Prokopy, R. J.; Environ. Entomol. 1972, 1, 326. 97. Papaj, D. R.; Roitberg, B. D.; Opp, S. B.; J. Anim. Ecol. 1989, 58, 955. 98. Aluja, M.; Diaz-Fleischer, F.; J. Chem. Ecol. 2006, 32, 351. 99. Aluja-Schuneman, M. R.; Díaz-Fletcher, F.; Edmunds, A. J. F.; Hagmann, L.; US pat 6, 555, 120 2003. 100. Aluja, M.; Díaz-Fletcher, F.; Boller, E. F.; Hurter, J.; Edmunds, A. J. F.; Hagmann, L.; Patrian, B.; Reyes, J.; J. Econ. Entomol. 2009, 102, 2268. 101. Edmund, A. J. F.; Aluja, M.; Díaz-Fletcher, F.; Patrian, B.; Hagmann, L.; Chimis 2010, 64, 37. 102. Landolt, P. J.; Philips, T. W.; Annu. Rev. Entomol. 1997, 42, 371. 103. Reddy, G. V. P.; Guerrero, A.; Trends Plant Sci. 2004, 9, 253. 104. Robacker, D. C.; Garcia, J. A.; Hart, W. G.; Environ. Entomol. 1990, 19, 403. 105. Aluja, M.; Prokopy, R. J.; Physiol. Entomol. 1992, 17, 1. 106. Landolt, P. J.; Reed, H. C.; Heath, R. R.; Environ Entomol. 1992, 21, 1154. 107. Cornelius, M. L.; Duan, J. J.; Messing, R. H.; J. Econ. Entomol. 2000, 93, 93. 108. García-Ramiréz, M.; Cibrián, T. J.; Arzufí, B. R.; López, C. J.; Soto, H. M.; Agrociencia 2004, 38, 423. 109. Kendra, P. E.; Montgomery, W. S.; Mateo, D. M.; Puche, H.; Epsky, N. D.; Heath, R. R.; Environ. Entomol. 2005, 34, 584. 110. Gonçalves, G.B.; Dissertação de Mestrado, Universidade Federal de Alagoas, Brasil, 2001. 111. Gonçalves, G. B.; Tese de Doutorado, Universidade Federal de Alagoas, Brasil, 2005. 112. Cruz-Lopes, L; Malo, E. A.; Toledo, A. V.; Del Mazo, A.; Rojas, J. C.; J. Chem. Ecol. 2006, 32, 351. 113. Lopez-Guillén, G.; Cruz-López, L.; Malo, E. A.; Gonzáles-hernadéz, H.; Cazares, C. L.; López-Collado, J. T.; Rojas, J.; Environ. Entomol. 2008, 37, 876. 114. Vera, M. T.; Ruiz, M. J.; Oviedo, A.; Abrahan, S.; Mendonza, M.; Segura, D. F.; Kouloussis, N. A.; Willink, E.; J. Appl. Entomol. 2010, 137, 2. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





