Revisão
|
|
| Dissulfeto de molibdênio, um material multifuncional e surpreendente: doze anos depois Molybdenum disulfide, a multifunctional and remarkable material: twelve years on |
|
Fernando Wypych*
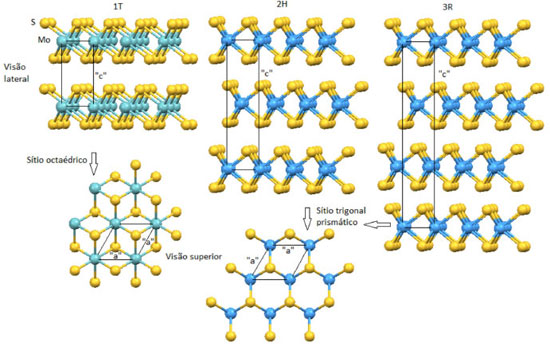
Departamento de Química, Universidade Federal do Paraná, CP 19081, 81531-980 Curitiba - PR, Brasil Recebido em 05/12/2013 *e-mail: wypych@ufpr.br In 2002, a review article was published in which molybdenum disulfide properties were discussed. The last sentence of the article read as follows: "Based on that described above, we can conclude that in spite of the vast applications of molybdenum disulfide in several industrial branches, many of the potential applications need to be investigated in the future". Since 2002, novel properties of molybdenum disulfide have been described which promise to revolutionize science. The objective of the present review paper was to provide an overview of the processes of 2H-MoS2 exfoliation and properties of the single layers, reported mainly in the last decade. INTRODUÇÃO O dissulfeto de molibdênio com composição MoS2 ocorre em três variedades polimórficas, as fases 1T, 2H e 3R, sendo a fase 2H a que ocorre na natureza na forma do mineral molibdenita, principalmente associado a rochas submetidas a processos hidrotermais a altas temperaturas.1 A molibdenita é a principal fonte de molibdênio na natureza. Todas as variedades polimórficas do dissulfeto de molibdênio têm estruturas lamelares (Figura 1) que se caracterizam pelas propriedades anisotrópicas; a fase 2H foi descrita no primeiro artigo publicado por Linus Pauling, quando era estudante de doutorado no Instituto de Tecnologia da Califórnia (Caltech).2
Nas fases 2H e 3R, o molibdênio no estado de oxidação +4 está coordenado por forças fortes a seis ânions sulfeto em uma coordenação trigonal prismática regular,2 enquanto que na fase 1T a coordenação do molibdênio é octaédrica distorcida.3 A fase 1T é produzida pela oxidação do composto KMoS2 ou LiMoS2 e é metaestável: ela se converte à fase 2H desordenada após aquecimento a uma temperatura da ordem de 100 ºC. A figura 2 mostra três vistas idealizadas de uma monolamela de 2H-MoS2. Em todos os casos, as lamelas estão ligadas entre si por forças de Van der Waals e empilhadas ao longo do eixo basal, o eixo "c".
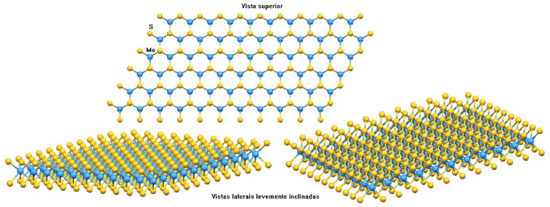 Figura 2. Vista superior e duas vistas laterais levemente inclinadas de uma monolamela idealizada do 2H-MoS24,5
As aplicações do 2H-MoS2 são as mais variadas possíveis e vão desde catalisadores de hidrotratamento (HDT), quando são responsáveis pela remoção de S, O, N e metais de combustíveis,6 até catodos para baterias de lítio, passando por lubrificantes sólidos.7 Mais recentemente, o MoS2 pode ser obtido na forma de nanotubos e nanoesferas8 e uma grande variedade de diferentes nanoestruturas.9 (Figura 3).
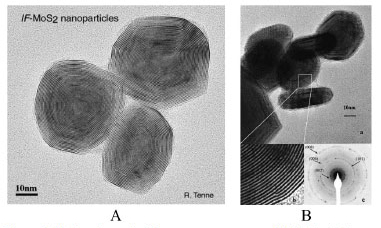 Figura 3. MoS2 na forma de diferentes nanoestruturas (IF-MoS2). A - Reproduzido da ref. 8, com autorização da Elsevier. B - Reproduzido da ref. 9, com autorização da American Chemical Society
De modo geral, os materiais lamelares na forma de nanoesferas possuem uma estrutura semelhante aos fulerenos,10 consequentemente seus nomes têm sido relacionados a essa classe de materiais, adotando a nomenclatura de "IF - Inorganic fullerene-like" ou compostos inorgânicos com estruturas semelhantes aos fulerenos. Os compostos do tipo IF-MoS2 foram desenvolvidos no grupo de pesquisas do Prof. Reshef Tenne do Department of Materials and Interfaces - Weizmann Institute of Science, Israel, hoje vendidos em grande escala por uma empresa, a ApNano Nanomaterials Inc. Quando a fase 2H-MoS2 obtida in situ pela sulfetação de misturas de óxidos na presença de um suporte é utilizada como catalisadores de HDT, observa-se que as bordas dos cristais de MoS2 são as mais ativas cataliticamente enquanto que as faces basais dos cristais são praticamente inertes. Devido à alta razão de aspecto dos cristais lamelares (largura e comprimento maiores que a altura), parece bastante óbvio que a termodinâmica favorece a formação de planos basais em vez de bordas. Esse é um grande desafio que persiste na área de catálise de hidrotratamento, obter cristais lamelares de MoS2 dopados com níquel ou cobalto porém com grande superfície de bordas. A localização desses dopantes e natureza da fase obtida durante o processo de sulfetação, além da interação com o suporte, foram motivos de discussão na literatura especializada por décadas, porém hoje se sabe que a fase ativa é composta de nanocristais de 2H-MoS2, com as bordas dos cristais decoradas com Ni+2 e/ou Co+2 sulfetados, formando fases não estequiométricas do tipo Ni-Mo-S e Co-Mo-S (Figura 4).
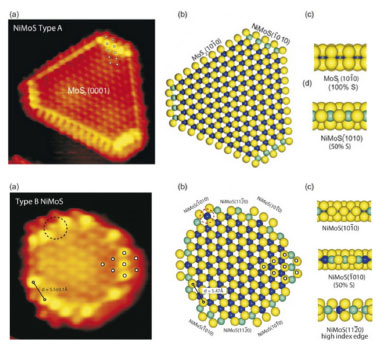 Figura 4. Estrutura do tipo A (superior) e do tipo B (inferior) do composto Ni-Mo-S obtido pela dopagem dos nanocristais de 2H-MoS2 com níquel.6 Reproduzido da ref. 4, com autorização da Elsevier
O processo de dopagem dos cristalitos de 2H-MoS2 afeta a estrutura eletrônica e geométrica das bordas do material dopado, as quais contêm menos enxofre que as bordas dos cristais de 2H-MoS2 precursor, o que certamente afeta e promove a atividade catalítica no material final. Dois tipos de sítios são descritos na literatura, o sítio tipo A e o sítio tipo B (Figura 4), sendo que o que os distingue é a localização do dopante nas bordas dos cristais lamelares. Outro fato a ser considerado nos catalisadores de HDT é o seu o poder hidrogenante de olefinas. O abaixamento do seu teor reduz a octanagem do combustível e consequentemente a sua qualidade. O ideal é considerar catalisadores que possuam atividade de HDT com uma baixa atividade de hidrogenação de olefinas, fato que ocorre com as fases de Ni-Mo-S suportadas em gama-alumina, justificando a sua larga aplicação industrial. Em se tratando de remoção de enxofre, um novo desafio apareceu atualmente com a redução do teor de enxofre em combustíveis no Brasil. Para atender a resolução número 415 do CONAMA - Conselho Nacional de meio ambiente, à exemplo do diesel, a gasolina brasileira terá seus teores de enxofre reduzidos dos atuais 800 mg/kg de enxofre para 50 mg/kg, a partir de janeiro de 2014. Catalisadores de hidrotratamento profundo precisam ser desenvolvidos para o tratamento do petróleo e suas frações mais pesadas. É importante também considerar a influência do suporte de tal forma que esse deveria interagir com as superfícies basais dos cristais, expondo preferencialmente os sítios catalíticos presentes nas bordas. Um trabalho recentemente publicado leva em consideração esses fatos e propõe estratégias para que os materiais bidimensionais sejam obtidos com maior densidade de bordas.11 Lubrificantes sólidos baseados especialmente em 2H-MoS2 são importantes quando óleos e graxas são impossíveis de serem utilizados devido principalmente às condições drásticas de uso ou quando contaminações são indesejáveis, como no caso de altas e baixas temperaturas, devido à perda de propriedades dos materiais tradicionais líquidos e pastosos, na indústria aeroespacial devido as necessidades de suportar altos vácuos e pressões e em uso geral, quando vapores precisam ser evitados devido a contaminações variadas. Durante a lubrificação, devido às propriedades anisotrópicas e forças fracas que ligam as lamelas no cristal lamelar, eles são facilmente delaminados formando um filme lubrificante que ocupa ranhuras e irregularidades das superfícies, normalmente metálicas, minimizando o atrito e o desgaste prematuro. O 2H-MoS2, por ser inerte química e termicamente, pode ser utilizado na forma de pó ou ainda disperso em óleos e graxas lubrificantes, melhorando as suas propriedades. Nesse último caso é preciso dispersar um material hidrofílico em um composto hidrofóbico, o que torna as dispersões instáveis e não homogêneas, fato que justifica uma potencial aplicação desse material a partir de suspensões de material esfoliado, como descrito abaixo.
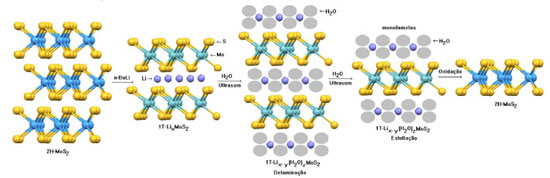
REAÇÕES DE INTERCALAÇÃO/ESFOLIAÇÃO A estabilidade química e térmica de monolamelas de materiais lamelares em geral se deve às suas estruturas, nas quais mesmo que as ligações que mantêm o cristal coeso, isto é, várias lamelas empilhadas (forças de van der Waals) sejam rompidas, as ligações nas lamelas não são afetadas. Esse comportamento é distinto nos materiais tridimensionais nos quais ligações químicas são rompidas quando fragmentados, fazendo com que os átomos na superfície do cristal (ou até três átomos de profundidade) sejam sujeitos à forças distintas daquelas que atuam no retículo estendido. Nesse caso, os cristais precisam minimizar a sua energia superficial se ligando a outras espécies disponíveis ou ser submetidas a processos de rearranjo por relaxação ou reconstrução, nos quais os átomos ocupam novas posições, distintas daquelas definidas cristalograficamente no seu retículo estendido e relaxado. Obviamente que esse processo de rearranjo é necessário nas bordas do cristal, já que aí se concentram as ligações insaturadas do cristal e os sítios catalíticos, como descrito nos catalisadores de HDT (Figura 4).6 Os estudos das propriedades do grafeno, obtidos por um processo antigo de esfoliação da grafita,12 puseram em evidência, mais recentemente, outros materiais bidimensionais, entre eles o 2H-MoS2 esfoliado. A exemplo do processo de esfoliação da grafita, conhecida a mais de 150 anos, a esfoliação do 2H-MoS2 foi descrita pela primeira vez em 1986, por um grupo de pesquisas do Canadá,13,14 embora a reação com n-butillítio já tenha sido descrito em 1975.15 O processo consiste de uma reação do 2H-MoS2 com um redutor forte (n-butillítio), o qual sob atmosfera inerte e um solvente orgânico livre de água reduz cátions Mo+4 à Mo+3, com a consequente intercalação de íons Li+ entre as lamelas. O 2H-MoS2 é submetido a uma alteração interpolítipa 2H/1T, com alteração de suas propriedades de semicondutor à condutor iônico/eletrônico. Esse material após eliminação do excesso de reagente e lavado com n-hexano seco e seco sob atmosfera, ao ser adicionado à água, promove uma reação de redução das moléculas de água com eliminação de hidrogênio e oxidação parcial dos átomos de Mo+3. O efeito das moléculas de hidrogênio geradas entre as lamelas, aliado ao processo de sonicação, levam ao processo de esfoliação. Sucessivas lavagens até pH próximo da neutralidade conduzem à formação de uma suspensão de monolamelas de MoS2. Sabe-se hoje que nesse processo químico não são formadas monolamelas de 2H-MoS2, mas sim monolamelas de 1T-Lix(H2O)yMoS2, com x ~ 0,1, as quais podem ter seus íons Li+ trocados por vários cátions, sejam orgânicos ou inorgânicos. Uma posterior oxidação leva à formação de monolamelas de 2H-MoS2, com características semicondutoras (Figura 5).
A suspensão de monolamelas pode ser útil em vários tipos de aplicações, desde sensores para diferentes gases,16,17 nanocompósitos poliméricos,18 eletrocatalisadores e fotoeletrocatalisadores na redução de água para produção de hidrogênio,19,20 etc.
PROPRIEDADES E APLICAÇÕES DE MONOLAMELAS DE MoS2 Macrocristais de 2H-MoS2 esfoliados exibem o fenômeno da fotoluminescência, o que indica uma transição de um semicondutor de band gap indireto no retículo estendido para um de band gap direto no material esfoliado.21,22 Esse fato indica que a esfoliação química que deveria gerar um composto condutor recupera a sua propriedade semicondutora após exposição ao ar, aquecimento ou oxidação. O confinamento quântico é um fenômeno que ocorre em materiais mono, bi e tridimensionais, ou seja, em materiais que possuem uma, duas ou três dimensões em escala nanométrica. A dimensão em que esse efeito se estabelece é dependente da natureza de cada material. Os efeitos de confinamento ocorrem tipicamente em dimensões próximas ao comprimento de onda de Fermi que decresce com a densidade de portadores de carga e que é da ordem do raio de um éxciton.23 Deve ainda ser definida qual é a dimensão nanométrica máxima de cada material para que o efeito do confinamento quântico seja observado. O 2H-MoS2 no seu retículo estendido é um semicondutor do tipo indireto com um band-gap de 1,2 eV e após o processo de esfoliação, a monolamela passa a ser um semicondutor do tipo direto com um band-gap de 1,8 eV, fato que se deve principalmente ao confinamento quântico. Dessa forma monolamelas de 2H-MoS2 possuem características superiores ao do grafeno, embora as características desse último que é um semimetal com um band-gap igual a zero possam ser ajustadas por reações químicas, gerando derivados semicondutores. À exemplo dos "quantum dots", devido às propriedades luminescentes e eletroluminescentes, monolamelas de 2H-MoS2 podem eventualmente ser utilizadas como biosensores para o reconhecimento molecular. As vantagens das monolamelas estão relacionadas à sua estabilidade química e térmica. Medidas de espectroscopia Raman mostram claramente que existe uma correlação direta entre o número de lamelas no MoS2 e a posição de bandas ativas no Raman (E12g e A1g). A banda E12g localizada próxima de 383 cm-1 no retículo estendido do 2H-MoS2 corresponde à vibração Mo-S no plano da lamela e a banda A1g localizada próximo a 407 cm-1, corresponde à vibração fora do plano. O desdobramento em cm-1 entre essas duas bandas é dependente de quantas lamelas estão empilhadas e é uma forma simples de diagnóstico do MoS2 esfoliado (Figura 6).
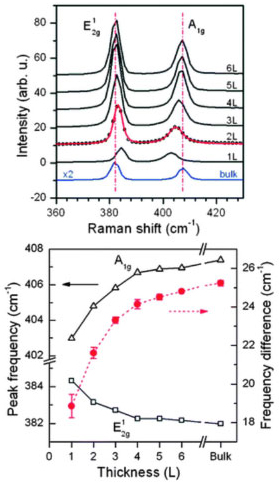 Figura 6. Espectros Raman de 2H-MoS2 na forma de retículo expandido e esfoliado (esquerda). Dependência da diferença do número de onda entre essas duas bandas, em função do número de lamelas empilhadas (direita).21 Reproduzido da ref. 21, com autorização da American Chemical Society
Dispersões de pequenos cristais de 2H-MoS2 são amplamente utilizadas na forma de lubrificantes líquidos ou graxas porém a baixa interação entre as fases obriga o uso de compatibilizantes. Para superar essas dificuldades, sugere-se a utilização de suspensões de monolamelas já comentadas, onde íons lítio hidratados podem ser substituídos por aminas protonadas de cadeia longa em pH levemente ácido (Figura 7 - Ex.: cátion dodecilamônio - DDA), o que torna o material dispersável em qualquer tipo de lubrificante ou graxa. Essa estratégia pode ser adotada para a preparação de lubrificantes aditivados inovadores.
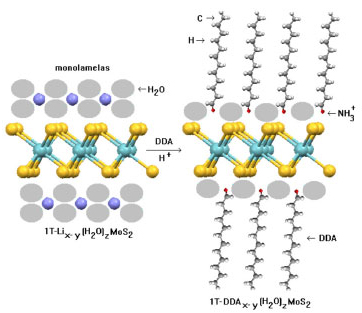 Figura 7. Hidrofobização de monolamelas com o cátion dodecilamônio (DDA)4,5
MoS2 esfoliado pode também ser utilizado como carga na preparação de compósitos poliméricos funcionais, tanto em polímeros termorrígidos quando os termoplásticos, de origem natural e/ou sintética, hidrofílicos ou hidrofóbicos (Figura 8). O fato relevante a considerar são as propriedades mecânicas de monolamelas de 2H-MoS2, as quais possuem um módulo de Young (módulo elástico) de 270 ± 100 GPa, que é superior a muitos metais e próximo ao do aço (AISI 302 com 180 MPa e ASTM-A36 com 200 MPa).24
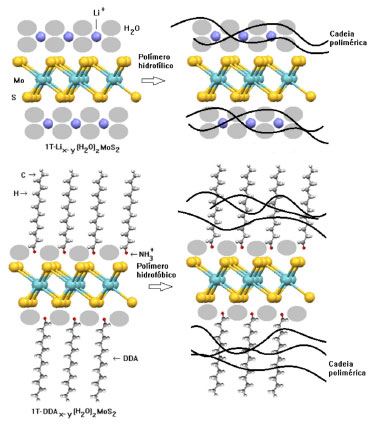 Figura 8. Monolamelas como cargas de polímeros hidrofílicos ou hidrofóbicos4,5
No caso de polímeros hidrofílicos, basta esfoliar o composto LiMoS2 em água, corrigir o pH da suspensão para levemente alcalino ou neutro e adicionar o Lix(H2O)yMoS2 à suspensão do polímero.18,25,26 No caso de polímeros hidrofóbicos, basta substituir o íons lítio hidratados na superfície das lamelas por cátions orgânicos (sugere-se sais de amônio como aqueles utilizados em argilominerais trocadores catiônicos do grupo 2:1) e adicionar essa mistura em uma suspensão do polímero. Após a homogeneização das suspensões, os filmes dos nanocompósitos poliméricos podem ser obtidos e secos em uma estufa a vácuo (casting úmido). Em ambos os casos, é possível promover a secagem dos compostos de intercalação e adicioná-los em polímeros fundidos, obtendo-se nanocompósitos pelo processo de extrusão e injeção. Outra possibilidade para atribuir novas propriedades químicas foi descrita recentemente e consiste na funcionalização de monolamelas de MoS2 (mistura das fases 1T e 2H) com tióis. Esse método liga covalentemente tióis de cadeia longa à defeitos de sulfeto nas bordas das monolamelas atribuindo função hidrofóbica às lamelas e formando suspensões estáveis em vários solventes orgânicos.27 As propriedades semicondutoras do 2H-MoS2 despertaram a atenção da comunidade científica, principalmente após os trabalhos de Radisavljevic e colaboradores,28 que demonstraram pela primeira vez a fabricação de um transistor baseado em uma nonolamela de 2H-MoS2 que possui uma espessura menor que 0,6 nm (no cristal, espessura da lamela + espaço interlamelar = 0,615 nm) (Figura 9).
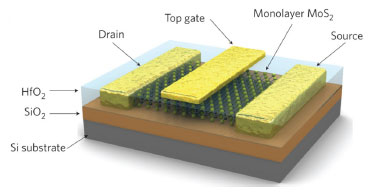 Figura 9. Esquema de um transistor fabricado com uma monolamela de 2H-MoS2.25 Reproduzido da ref. 28, com autorização da Macmillan Publishers Ltd.
Outra vantagem apresentada pelas monolamelas de MoS2 é a sua alta transparência, resistência mecânica e flexibilidade, o que faz com que possam ser fortemente distorcidas sem perder as suas propriedades elétricas; isto as torna candidatas vantajosas para a fabricação de dispositivos flexíveis inteligentes em substituição ao silício,29 entre outros materiais.30 Devido a esse trabalho, que demonstrou a possibilidade de se fabricar um transistor baseado em monolamelas de MoS2 que gasta cerca de 100.000 vezes menos energia quando em stand-by que um dispositivo de silício, o número de publicações envolvendo o MoS2 tem crescido. Utilizando-se o sítio do ISI - Institute for Scientific Information e o Web of Science, entre 1963 e 2003 foram descritos 4578 trabalhos (média de 114/ano), 2996 entre 2004 e 2013 (média de 300/ano), enquanto que esse número foi de 781 somente no ano de 2013 (palavra chave em "tópico": MoS2). No Derwent Innovation Index, as patentes não seguem a mesma tendência. Entre 1963 e 2003 foram relatadas 2213 patentes (em média 55/ano), 358 entre 2004 e 2013 (36/ano) e 33 no ano de 2013 (palavra chave em "tópico": MoS2). Uma explicação para esse fato se deve à provável não publicação de todas as patentes envolvendo 2H-MoS2, na base de dados do ISI. Mais recentemente, demonstrou-se que a combinação de monolamelas semincondutoras de 2H-MoS2 com o grafeno condutor produz uma memória do tipo "flash", dessas que são utilizadas em pen-drives e discos rígidos externos.31 O MoS2 é também um candidato a aplicações em dispositivos spintrônicos.32,33 Embora MoS2 na forma estendida seja um material diamagnético, ele se torna ferromagnético à temperatura ambiente na forma de nanofitas quando suas bordas adotam padrão em zig-zag, em razão dos defeitos induzidos, ou ainda quando elementos não-metálicos, tais como H, B, C, N e F são nele adsorvidos.32,33 A indução de ordenamento magnético em monolamelas de MoS2 é descrita pela formação de vacâncias e pelo processo de hidrogenação após irradiação por prótons que promove um aumento na concentração de portadores polarizados em spin próximo a energia de Fermi. Estes resultados experimentais confirmam a previsão teórica de supressão do mecanismo de Dyakonov-Perel de relaxação de spin, resultando em longos tempos de vida para o spin dos elétrons que submetem-se a um desdobramento de spin gigante devido à ação do acoplamento spin-órbita no MoS2, como ocorre com outros dicalcogenatos de metais de transição.34
MÉTODOS DE ESFOLIAÇÃO DO 2H-MoS2 Atualmente existem várias formas de esfoliar o 2H-MoS2, além do método químico descrito anteriormente,13,14,35 a maioria dos demais métodos é do tipo físico. O método mais elementar possível consiste em colar uma fita adesiva em um monocristal de 2H-MoS2 e após sucessivos processos de cola/descola, materiais delaminados ou esfoliados podem ser obtidos.36 Basicamente esse método foi o mesmo utilizado para a preparação de uma lamela de grafeno, através do "peeling" de um monocristal de grafita, utilizando a fita adesiva.12,37 Os estudos do grafeno levaram Novoselov e Geim a ganharem o prêmio Nobel de física de 2010. O método do atrito consiste em esfregar um cristal de 2H-MoS2 em uma superfície qualquer e coletar os fragmentos deixados pelo cristal, como aqueles deixados por um grafite em uma folha de papel.38 Outro método simples desenvolvido consiste em submeter diferentes materiais lamelares em solventes específicos ao ultrassom em um banho de alta potência, seguido ou não de centrifugação para a separação das partículas por tamanho.39,40 Nesse procedimento, o fator mais importante é tensão superficial do solvente já que existe uma correlação clara entre essa e a tensão superficial das monolamelas do material que se pretende esfoliar.35 A combinação de solvente e material deve ser investigada de forma que ocorra a esfoliação e que suspensões estáveis sejam obtidas, com teores relativamente altos de monolamelas. O método de deposição química de vapor (CVD) consiste basicamente em vaporizar precursores de 2H-MoS2 em um substrato, na presença de um agente sulfetante (Ex.: MoO3 ou MoCl5 + H2S ou MoO3 + S, etc).41-43 Os materiais obtidos podem ser produzidos na forma de monolamelas, lamelas duplas, triplas, etc, até a obtenção de monocristais orientados. O método de decomposição do tetratiomolibdato leva à formação de MoS3 amorfo e em seguida, após aquecimento em uma temperatura da ordem de 200 à 300 ºC sob atmosfera controlada, leva à formação do 2H-MoS2.44,45 O processo de afinamento por laser ou ablação térmica (laser-thinning)46 ou plasma de argônio consiste em delaminar o 2H-MoS2, depositar essas partículas multilamelares em um substrato (Ex.: silício/sílica) e submeter as amostras a pulsos de laser de alta energia ou plasma de argônio de forma a "afinar o cristal", até que somente uma lamela esteja disponível.47 Esse processo pode facilmente ser acompanhado pelo próprio laser quando do uso de um espectrômetro Raman, no qual o desdobramento das bandas E12g e A1g diagnosticam quantas lamelas estão empilhadas (Figura 6).19 Outros métodos estão sendo frequentemente relatados na literatura, porém certamente a aplicação industrial se dará por um dos métodos descritos acima. Estamos na era da nanociência/nanotecnologia e a exemplo dos materiais tridimensionais (nanopartículas) e bidimensionais (nanotubos e nanofitas), os materiais lamelares monodimensionais encontram o seu nicho.
CONCLUSÃO As páginas acima relatam estudos realizados na última década, principalmente quando o foco principal das pesquisas é o 2H-MoS2. Apesar dessa restrição imposta, não podemos nos esquecer que uma grande gama de materiais lamelares condutores, semicondutores e isolantes espera na fila para que possa ser aplicada nas mais diversas áreas da ciência e tecnologia. Entre esses podemos citar os calcogenetos de metais de transição, argilominerais do grupo 1:1 e 2:1 trocadores catiônicos ou não, hidróxidos metálicos, hidróxidos duplos e hidroxissais lamelares trocadores aniônicos, 48 fosfatos e fosfonatos metálicos, etc. Embora outros materiais lamelares tenham tido muito destaque nos últimos anos, como é o caso da grafita que pode dar origem tanto aos fulerenos, nonotubos de carbono e mais recentemente, ao grafeno e suas variantes grafino, grafano e grafono, etc., o 2H-MoS2 continua sendo um dos materiais mais versáteis que se conhece, dando origem a materiais equivalentes aos obtidos da grafita como os nanotubos, esferas e distintas unidades geométricas, além das monolamelas. As expectativas em relação a esse material são grandes, já que especialistas prevêem, num futuro próximo, a fabricação de materiais a base de 2H-MoS2 e outros materiais lamelares que irão revolucionar não só a ciência, mas a tecnologia, alcançando em pouco anos a sociedade de modo geral. As promessas são muitas, espera-se que em mais 10 anos haja a possibilidade de se revisar mais uma vez essas propriedades e que novas surpresas surjam, para o bem da humanidade.
AGRADECIMENTOS O autor agradece às editoras que autorizaram a reprodução das Figuras 3, 4, 6 e 9. Agradece também aos órgãos de fomento CNPq, CAPES, FINEP e Fundação Araucária (PR) pelo apoio financeiro, alunos de graduação e pós-graduação pelo desenvolvimento dos projetos propostos e parceiros científicos em várias instituições brasileiras e estrangeiras.
REFERÊNCIAS 1. Wypych, F.; Quim. Nova 2002, 25, 83. 2. Dickinson, R. G.; Pauling, L.; J. Am. Chem. Soc. 1923, 45, 1466. 3. Wypych, F.; Schöllhorn, R.; J. Chem. Soc. Chem. Commun. 1992, 1386. 4. Lauritsen J. V.; Kibsgaard, J.; Olesen, G. H.; Moses, P. G.; Hinnemann, B., Helveg, S.; Norskov, J. S.; Clausen, B. S.; Topsoe, H.; Laegsgaard, E.; J. Catal. 2007, 249, 220. 5. Crystallography Open Database - http://www.crystallography.net/search.html. Acessado em novembro de 2013. 6. Mercury crystal structure visualization - free download - http://www.ccdc.cam.ac.uk/Solutions/FreeSoftware/Pages/FreeMercury.aspx. Acessado em novembro de 2013. 7. Savan, A.; Pflüger, E.; Voumard, P.; Schröer, A.; Simmonds, M.; Lubr. Sci. 2000, 12, 185. 8. Tenne R.; Coll. Surf. A: Phys. Eng. Asp. 2002, 208, 83. 9. Zak, A.; Feldman. Y.; Lyakhovitskaya, V.; Leitus, G.; Popovitz-Biro, R.; Wachtel, E.; Cohen, H.; Reich, S.; Tenner, T.; J. Am. Chem. Soc. 2002, 124, 4747. 10. Kroto, H. W.; Heath, J. R.; Obriens, S. C.; Curl, R. F.; Smalley, R. E.; Nature 1985, 318, 162. 11. Kibsgaard, J.; Chen, Z.; Reinecke, B. N.; Jaramillo, T. F.; Nat. Mater. 2012, 11, 963. 12. Novoselov, K. S.; Geim, A. K.; Morozov, S. V.; Jiang, D.; Katsnelson, M. I.; Grigorieva, I. V.; Dubonos, S. V.; Firsov, A. A.; Nature 2005, 438, 197. 13. Joensen, P.; Frindt, R. F .; Morrison, S. R.; Mater. Res. Bull. 1986, 21, 457. 14. Gee, M. A.; Frindt, R. F.; Morrison, S. R.; Joenson, P.; Mater. Res. Bull. 1986, 21, 543. 15. Dines, M. B.; Mater. Res. Bull. 1975, 10, 287. 16. Late, D. J.; Huang, Y. K.; Liu, B.; Acharya, J.; Shirodkar, S. N.; Luo, J. J.; Yan, A. M.; Charles, D.; Waghmare, U. V.; Dravid, V. P.; Rao, C. N. R.; ACS Nano 2013, 6, 4879. 17. Perkins, F. K.; Friedman, A. L.; Cobas, E.; Campbell, P. M.; Jernigan, G. G.; Jonker, B. T.; Nano Lett. 2013, 13, 668. 18. Mancinelli, K. C. B.; Lisboa, F. S.; Soares, J. F.; Zawadzki, S. F.; Wypych, F.; Mat. Chem. Phys. 2013, 137, 764. 19. Zhao, Y.; Zhang, Y.; Yang, Z.; Yan Y.; Sun, K.; Sci. Technol. Adv. Mater. 2013, 14, 43501. 20. Li, Y.; Li, Y. L.; Araujo, C. M.; Luob, W.; Ahuja, R.; Catal. Sci. Technol. 2013, 3, 2214 21. Lee, C.; Yan, H.; Brus, L. E.; Heinz, T. F.; Hone, J.; Ryu, R.; ACS Nano 2010, 4, 2695. 22. Eda, G.; Yamaguchi, H.; Voiry, D.; Fujita, T.; Chen, M. W.; Chhowalla, M.; Nano Lett. 2011, 12, 5111. 23. Koch, S. W.; Kira, M.; Khitrova, G.; Gibbs, H. M.; Nat. Mater. 2006, 5, 523. 24. Bertolazzi, S, ; Brivio, J.; Kis, A.; ACS Nano 2011, 5, 9703. 25. Wypych, F.; Arizaga, G. G. C.; Satyanarayana, K. G. Em Polymer nanocomposites research advances, Thomas, S.; Saikov, G. E., eds.; Nova Science: New York, 2008. 26. Wypych, F.; Adad, L. B.; Grothe, M. C.; Quim. Nova 1998, 21, 687. 27. Chou, S. S.; De, M.; Kim, J.; Byun, S.; Dykstra, C.; Yu, J.; Huang, J.; Dravid, V. P.; J. Am. Chem. Soc. 2013, 135, 4584. 28. Radisavljevic, B.; Radenovic, A.; Brivio, J.; Giacometti, V.; Kris, A.; Nat. Nanotechnol. 2011, 6, 147. 29. Chang, H.; Yang, S.; Lee, J.; Tao, L.; Hwang, W.; Jena, D.; Lu, N.; Akinwande, D.; ACS Nano 2013, 7, 5446. 30. Huang, X.; Zeng, Z.; Zhang, H.; Chem. Soc. Rev. 2013, 42, 1934. 31. Bertolazzi, S.; Krasnozhon, D.; Kis, A.; ACS Nano 2013, 7, 3246. 32. Han, S. W.; Hwang, Y. H.; Kim, S. H.; Yun, W. S.; Lee, J. D.; Park, M. G.; Ryu, S.; Park, J. S.; Yoo, D. H.; Yoon, S. P.; Hong, S. C.; Kim, K. S.; Park, Y. S.; Phys. Rev. Lett. 2013, 110, 247201 33. Klinovaja, J.; Loss, D.; Phys. Rev. B 2013, 88, 075404. 34. Zhu, Z. Y.; Cheng, Y. C.; Schwingenschlogl, U.; Phys. Rev. B 2011, 84, 153402. 35. Nicolosi, V.; Chhowalla, M.; Kanatzidis, M. G.; Strano, M. S.; Coleman, J. N.; Science 2013, 340, 1226419-1. 36. Novoselov, K. S.; Geim, A. K.; Morozov, S. V.; Jiang, D.; Zhang, Y.; Dubonos, S. V.; Grigorieva, I. V.; Fisov, A. A.; Science 2004, 306, 666. 37. Novoselov, K. S.; Jiang, D.; Schedin, F.; Booth, T. J.; Khotkevich, V. V.; Morozov, S. V.; Geim, A. K.; Proc. Natl. Acad. Sci. U.S.A. 2005, 102, 10451. 38. Geim, A. K.; Novoselov, K. S.; Nat. Mater. 2007, 6, 183. 39. O'Neil, A.; Khan, U.; Coleman, J. N.; Chem. Mater. 2012, 24, 2414. 40. Coleman, J. N.; Lotya, M.; O, Neill, A.; Bergin, S. D.;King, P. J.; Khan, U.; Young, K.; Gaucher, A.; De, S.; Smith, R. J.; Shvets, I. V.; Arora, S. K.; Stanton, G.; Kim, H. Y.; Lee, K.; Kim, G. T.; Duesberg, G. S.; Hallam, T.; Boland, J. J.; Wang, J. J.; Donegan, J. F.; Grunlan, J. C.; Moriarty, G.; Shmeliov, A.; Nicholls, R. J.; Perkins, J. M.; Grieveson, E. M.; Theuwissen, K.; McComb, D. W.; Nellist, P. N.; Nicolosi, V.; Science 2011, 331, 568. 41. Foglia, S.; Tomlinson, A. A. G.; Mulley, S.; Sironi, A.; J. Mat. Chem. 1995, 5, 1191. 42. Lee, Y. H.; Zhang, X. Q.; Chang, M. T.; Lin, C. T.; Chang, K. D.; Yu, Y. C.; Wang, J. T.; Chang, C. S.; Li, L. J.; Lin, T. W.; Adv. Mater. 2012, 2, 2320. 43. Zhang, W.; Huang, J. K.; Chen, C. H.; Chang, Y. J.; Cheng, Y. J.; Li, L. J.; Adv. Mater. 2013, 25, 3456. 44. Wang, S.; An, C.; Yuan, J.; Mater. 2010, 3, 401. 45. Liu, K. K.; Zhang, W.; Lee, Y. H.; Lin, Y. C.; Chang, M. T.; Su, C. Y.; Chang, C. S.; Li, H.; Shi, Y.; Zhang, H.; Lai, C. S.; Li, L. J.; Nano Lett. 2012, 12, 1538. 46. Castellanos-Gomez, A.; Barkelid, M.; Goossens, A. M.; Calado, V. E.; Van der Zant, H. S. J.; Steele, G. A.; Nano Lett. 2012, 12, 3187. 47. Liu, Y.; Nan, H.; Pan, W.; Wang, W.; Bai, J.; Zhao, W.; Sun, L.; Wang, X.; Ni, Z.; ACS Nano 2013, 28, 4202. 48. Arizaga, G. G. C.; Satyanarayana, K. G.; Wypych, F.; Solid State Ionics 2007, 178, 1143. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access