Revisão
|
|
| Membranas de condução mista iônica e eletrônica (MIEC): composições, preparação e desempenho Mixed ionic-electronic conducting membranes (MIEC): composition, preparation, and performance |
|
Giulliani Sachinelli GarciaI; Priscila Lemes RachadelI; Ricardo Antonio Francisco MachadoI; Dachamir Hotza*,I; Joao Carlos Diniz da CostaII
IDepartamento de Engenharia Química, Universidade Federal de Santa Catarina,88040-900 Florianópolis - SC, Brasil Recebido em 03/04/2013 *e-mail: dhotza@gmail.com This paper presents a review of different chemical compositions that are used in the production of mixed ionic-electronic conducting membranes with the perovskite structure. In these dense membranes, oxygen from the air is permeated through ionic and electronic processes, and high oxygen permeation fluxes are observed at high temperatures (800-900 ºC). Various membranes were compared for their performance and properties after being synthesized by different methods. INTRODUÇÃO A separação de oxigênio do ar para uso industrial é um grande negócio, produzindo aproximadamente 100 milhões de toneladas de O2 a cada ano. Esse mercado deverá expandir a curto prazo, pois virtualmente todas as tecnologias de energia limpa em grande escala precisam de gás oxigênio.1 Isso se reflete em várias políticas nacionais e internacionais para manter o suprimento de energia e reduzir os gases de efeito estufa. Preocupações mundiais sobre mudanças climáticas de origem antropológica levaram a um esforço concentrado no desenvolvimento de tecnologias para permitir a captura e sequestro de gases de efeito estufa. Em particular, uma série de opções de tecnologia de "carvão limpo" (clean coal) estão sendo investigadas, incluindo oxicombustão e gaseificação do carvão, muitas das quais exigem uma alimentação de oxigênio puro.2 Atualmente, a separação de O2 em grande escala é feita por um processo criogênico. Além de sua complexidade, esse processo necessita de grande quantidade de energia, pois opera a temperaturas muito baixas (-185 ºC) e pressões elevadas. Acoplar uma unidade criogênica de separação de ar a uma planta termoelétrica ainda reduz as eficiências de geração de energia atuais em cerca de 30 a 40%.3 Uma tecnologia com potencial aplicação para separar o O2 do ar no suprimento de energia limpa é a de membranas cerâmicas densas. Essas membranas, conhecidas como MIEC (mixed ionic-electronic conducting, de condução mista iônica e eletrônica), têm atraído uma grande atenção nas últimas três décadas.4 Por exemplo, no caso de geração de energia a partir do carvão, as membranas cerâmicas densas podem reduzir os custos de energia de O2 em 35%,5,6 quando se comparam a processos convencionais de produção de oxigênio. Apesar dos avanços, as membranas MIEC, assim como outras membranas inorgânicas,7 ainda não tiveram uma utilização comercial ampla, devido à baixa estabilidade mecânica e química, a falta de um design confiável e de métodos de selagem a alta temperatura.8 Membranas de separação de O2 podem ser aplicadas em vários processos industriais que requerem uma alimentação de O2. Cada aplicação impõe um conjunto único de requisitos na membrana óxida escolhida. Este artigo pretende, a partir das pesquisas mais recentes com membranas à base de perovskitas com alta permeação de oxigênio, descrever os métodos de fabricação e comparar o desempenho das membranas sintetizadas.
CONCEITO DE MIEC O tipo mais comum de material que exibe propriedades de condução tanto iônica quanto eletrônica são as perovskitas.9 A altas temperaturas e na presença de um gradiente de pressão parcial de oxigênio através da membrana, íons de oxigênio com seletividade de 100% podem permear sem a aplicação de qualquer campo elétrico externo.10 As perovskitas são de especial interesse devido ao fato de apresentarem condutividade eletrônica e iônica, com excelente estabilidade química, em uma ampla faixa de temperaturas. As perovskitas são materiais estratégicos devido a suas propriedades catalíticas, eletrônicas e magnéticas, as quais são influenciadas pelas condições de síntese e calcinação. Perovskitas tem sido sintetizadas para uso em vários processos químicos como oxidação de propano e CO,11 oxidação parcial de metano,12 oxidação total de etanol,13 redução de NO com CO,14 produção de gás de síntese,15 entre outros. Para a síntese das perovskitas, diversos métodos têm sido empregados, como Pechini (ou precursores poliméricos),16 reação no estado sólido,12 sol-gel,17 spray-pirólise,18 gel proteico,15 auto-combustão,19 entre outros. A estrutura cristalina de uma perovskita ideal pertence ao grupo espacial cúbico, possuindo uma estequiometria ABO3, que consiste em unidades de octaedros (BO6) compartilhando os vértices, como mostrado nas Figuras 1a e 1b.20 O cátion B corresponde a um metal de transição, como Fe, Co, Ni ou Cu e o cátion A corresponde a um íon de terras raras, alcalino ou alcalino-terroso, como por exemplo, La, Na, Ca, Sr ou Ba.
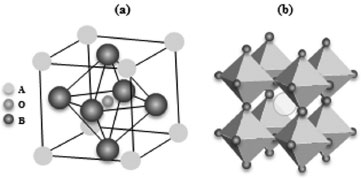 Figura 1. Estrutura geral de uma perovskita (a) e a mesma estrutura visualizada a partir dos octaedros BO6 (b) (adaptada)20
Em perovskitas com fórmula AxA'1-xByB'1-yO3-δ, sendo A: La, Ba; A': Sr, Ca; B: Cr, Co, Mn, Ga e B': Ni, Fe, Cu; uma substituição heterovalente de La por um metal alcalino-terroso é necessária para criar vacâncias de íons na rede, melhorando o transporte de íons oxigênio, enquanto que os íons de metais de transição em B e B' geram condutividade elétrica.10 As propriedades de transporte através da membrana são principalmente controladas pela difusão em volume dos íons oxigênio através da membrana. Portanto, além do material em si, do gradiente de pressão de oxigênio e da temperatura, a espessura da membrana é um dos principais parâmetros envolvidos no aumento das taxas de permeação. No entanto, para uma camada muito fina de algumas MIEC, as reações de troca na superfície da membrana podem influenciar significativamente a taxa de permeação de oxigênio e, nesse caso, camadas de catalisador devem ser depositadas.10 A difusão dos íons óxidos é proporcionada pelas imperfeições ou defeitos presentes dentro da estrutura perovskita, pois a estrutura ideal (ABO3) não tem capacidade de conduzir esses íons. A presença dos defeitos é devida à não-estequiometria para que a condução ou difusão ocorra. Vários estudos têm sido direcionados a materiais de estruturas perovskíticas devido à sua alta tolerância à não-estequiometria, o que os permite obter uma alta condução iônica de oxigênio. Em outras palavras, devido aos defeitos pré-existentes na fase cristalina, a concentração destes não depende da temperatura e da pressão. Porém, o fluxo de oxigênio irá aumentar conforme o aumento da temperatura devido à difusão volumétrica ou à troca cinética na superfície. Quando o sítio A da perovskita é dopado com um íon metálico de menor estado de valência (tal como uma substituição parcial de La+3 por Sr+2 em LaCoO3-δ), vacâncias de oxigênio, bem como uma mudança no estado de valência dos íons B na rede, ocorrerão a fim de manter a neutralidade eletrônica. Deve-se notar que o termo δ é dito como a quantidade de vacâncias ou defeitos; por isso, quanto maior o número de vacâncias, maior é o fluxo de permeação de oxigênio.21 A elevadas temperaturas, o oxigênio é incorporado na estrutura cristalina da perovskita, resultando na aniquilação de uma vacância de oxigênio e a formação de dois elétrons-buracos, como expresso Eq. (1).
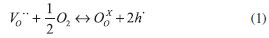
sendo que VO.. representa a vacância de oxigênio, OOX o oxigênio na rede e h. o elétron-buraco. As membranas MIEC, quando expostas a elevadas temperaturas (700-900 ºC), exibem alta condutividade eletrônica. A condutividade eletrônica tipicamente excede a condutividade iônica em algumas ordens de grandeza na maioria das membranas MIECs. Por exemplo, La1-xSrxCo1-yFeyO3-δ a 800 ºC em ar apresenta uma condutividade eletrônica de 102-103 S cm-1, enquanto a condutividade iônica permanece de 10-2 a 1 S cm-1. Em resumo, a condutividade nas membranas de condução mista é definida como a soma da condutividade iônica mais a condutividade eletrônica.3 As membranas MIEC precisam ser densas e impermeáveis a gases, permitindo apenas o transporte iônico do oxigênio. O O2 é transportado pela membrana MIEC de uma região com uma maior pressão parcial de O2 para uma região com uma menor pressão parcial. O transporte de oxigênio através de uma membrana MIEC tipicamente ocorre por meio de cinco etapas, como descrito a seguir e mostrado na Figura 2.22-25
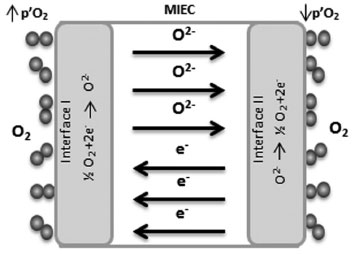 Figura 2. Transporte de oxigênio através de uma membrana MIEC
Isso posto, o fluxo de oxigênio através das membranas MIEC pode ser limitado pela cinética de troca na superfície das membranas e pela difusão em volume.26-28 É importante ressaltar que a difusão volumétrica será a etapa de controle quando a membrana for relativamente espessa. Assim, para uma dada membrana, reduzindo a sua espessura, a resistência à condução de íons oxigênio será menor até certo limite, conhecido como espessura característica da membrana (Lc), que é altamente dependente das condições de operação e significa o ponto onde a resistência a difusão em volume é igual à resistência exercida pela cinética de troca na superfície da membrana (Figura 3). Abaixo desse valor o fator limitante passa a ser as reações de troca na superfície da membrana MIEC. O Lc da maioria das perovskitas (MIEC) tipicamente está na faixa de 20 a 3000 µm dependendo da composição e das condições de operação, como temperatura e pressão parcial de oxigênio.29
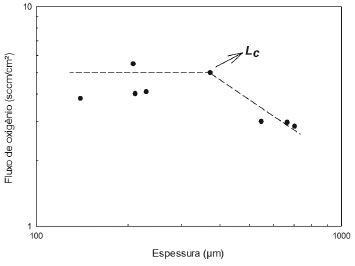 Figura 3. Variação do fator limitante difusão em volume para reação de troca na superfície em função da redução na espessura da membrana (adaptada)4
Composição das membranas As perovskitas apresentam um alto nível de permeação de O2 e resistência a altas temperaturas, mas o material sofre de uma baixa estabilidade química e estrutural em atmosfera redutora, bem como quando exposto a altos níveis de CO2.30,31 Além disso, algumas composições de estrutura perovskita apresentam baixa resistência mecânica. Dentre vários materiais perovskíticos dopados, duas composições são típicas: Ba1-xSrxCo0,8Fe0,2O3-δ (BSCF) e La1-xSrxCo1-yFeyO3-δ (LSCF), devido ao alto fluxo de oxigênio e boa estabilidade química. A Tabela 1 apresenta desenvolvimentos recentes de membranas MIEC de estrutura perovskita, planares e tubulares, para separação de oxigênio dos sistemas LSCF e BSCF e suas respectivas propriedades.
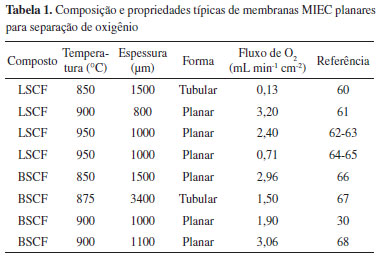
MÉTODOS DE PREPARAÇÃO DE MEMBRANAS A técnica selecionada para preparar membranas cerâmicas finas deve preencher os seguintes requisitos: (i) ser ao mesmo tempo simples e ter bom custo-benefício, (ii) fornecer a estrutura desejada com uma composição adequada; (iii) evitar completamente rachaduras que causariam vazamento e (iv) garantir a resistência da camada sob tratamentos a altas temperaturas. Muitos estudos podem ser encontrados na literatura sobre as técnicas de preparação de membranas inorgânicas densas, sejam porosas ou finas, e de várias aplicações.32 No entanto, as tentativas de produzir membranas finas e densas de perovskita para a separação de oxigênio em suportes porosos são escassas. Para a preparação das membranas, diversos métodos têm sido desenvolvidos e empregados.4 Dentre eles se destacam o método convencional no estado sólido (SS, do inglês solid state); coprecipitação (CP); método sol-gel com rota de complexação EDTA-citrato (EC), também conhecido com método Pechini; síntese hidrotérmica; atomização (spray drying) e liofilização (freeze drying). A seguir, esses métodos são apresentados resumidamente. Método convencional no estado sólido O método de misturas de pó é o processo mais comum de síntese para produzir pós convencionais, também chamado de reação no estado sólido (SS, solid state). Emprega a reação completa de óxidos mistos, carbonatos, hidróxidos ou sais. Faz-se uma calcinação em temperaturas de pelo menos dois terços do ponto de fusão por períodos de até 10 h. O tamanho das partículas é controlado pela mistura mecânica de matérias-primas e processos de moagem. A homogeneidade e pureza do pó são consideradas pobres, para não mencionar a sua ampla distribuição de tamanho de partículas. Além disso, esse processo tem um alto consumo energético por causa da alta temperatura. Estruturas à base de perovskitas foram extensivamente preparadas usando essas reações.33-36 Coprecipitação A coprecipitação (CP) é uma das mais antigas técnicas de mistura composta de uma solução aquosa contendo os cátions desejados e outra solução que age como agente de precipitação. Filtração, secagem e decomposição térmica são usadas para se obter os produtos desejados. As propriedades dos produtos são ajustadas de acordo com pH, temperatura e concentração. Normalmente, a morfologia e o controle da composição são adequados, embora diferentes taxas de precipitação resultem em heterogeneidades. Um agente de dopagem pode ser adicionado para se alcançar composições homogêneas. O composto resultante requer uma menor temperatura de sinterização do que aquelas empregadas no método de pó convencional ou reações no estado sólido, devido à elevada dispersão no precipitado. O tamanho de partícula é geralmente na faixa de poucos nanômetros, que é obtido pela cuidadosa precipitação utilizando apropriados agentes surfactantes e tamponantes. Estruturas à base de perovskitas têm sido obtidas a partir desse método.37-40 Sol-gel Técnicas de sol-gel envolvem a produção de um gel amorfo seguido de desidratação a baixas temperaturas. Essas técnicas proporcionam elevado grau de pureza e excelente controle da composição. Dentre as rotas de preparação de estruturas através do sol-gel, destaca-se a rota de complexação EDTA-citrato (EC), também conhecida como método Pechini. Essa técnica tem sido amplamente utilizada devido às suas vantagens como compostos quimicamente homogêneos e de alta densidade relativa. Essa rota envolve complexação de íons metálicos em EDTA/ácido cítrico, seguida pela evaporação da água e decomposição térmica do solvente e do complexo com a formação subsequente da fase perovskita. Um agente quelante (EDTA, ácido etilenodiamino tetra-acético) é usado para prevenir a segregação parcial de componentes metálicos, o que poderia ocorrer no caso de diferentes estabilidades com os cátions metálicos em solução. Geralmente, o pH pode ser ajustado para controlar o grau de complexação. Várias estruturas à base de perovskitas têm sido sintetizadas utilizando essa rota.41-44 Síntese hidrotérmica A síntese hidrotérmica é aplicada para produzir óxidos mistos avançados com características específicas na sua composição, tais como pigmentos para a eletrônica. Esse processo usa geralmente temperaturas entre o ponto de ebulição da água e a temperatura crítica dos materiais (normalmente acima dos 300 ºC), enquanto que a pressão pode estar até 15 MPa. Consequentemente, a etapa de calcinação necessária por outros passos discutidos anteriormente não é necessária neste caso. A síntese hidrotérmica pode ser usada para auxiliar a técnica sol-gel a controlar o tamanho das partículas. Os materiais utilizados geralmente são de baixo custo, e fáceis de controlar em termos de tamanho, forma e estequiometria. A eliminação de impurezas associadas resulta em pós muito finos e altamente reativos. Esse método ainda se encontra em seus estágios iniciais de desenvolvimento.45-48 Atomização e liofilização A atomização ou secagem por spray (spray drying) consiste em uma rápida vaporização do solvente em pequenas gotas contendo soluções necessárias de cátions. A atomização permite a obtenção de pós finos e homogêneos. Uma variante da atomização é a pirólise em spray ou spray pirólise (SP, spray pyrolisys) que é uma técnica muito empregada para deposição de filmes em um substrato; no caso de produção de pós, há uma decomposição química por meio do calor (pirólise) a partir da atomização de precursores em solução, diferentemente da atomização simples, no qual ocorre apenas um processo físico (secagem). Por outro lado, a liofilização ou crio-secagem (freeze drying) envolve a sublimação lenta do solvente. Os passos importantes na liofilização são a pulverização de gotículas de solução em nitrogênio líquido e a sublimação do solvente em ausência de fase líquida. Estruturas de perovskitas têm sido preparadas usando ambos os métodos.49-51 Comparação entre os métodos Pesquisas recentes indicam que em condições operacionais semelhantes, diferentes formas de preparo de uma membrana cerâmica com determinada composição resultam em valores diferentes de fluxo de oxigênio.4 Isso é causado principalmente pelo efeito da microestrutura única obtida em cada método, que reflete sobre suas propriedades físicas e de transporte. Diferentes métodos de preparação levam a pós com propriedades distintas, como área superficial e porosidade. A coprecipitação, por exemplo, proporciona maior densidade para membranas de composição La0,8Sr0,2Co0,6Fe0,4O3-δ, seguida pelo método de preparação no estado sólido e spray pirólise. Para cerâmica microcristalina com condutividade eletrônica predominante, aumentando-se o tamanho de grão, encontram-se efeitos positivos para a condutividade iônica devido à diminuição da concentração de contornos de grão. Isso sugere que uma maior resistividade está associada ao volume de contornos de grão, geralmente superior à resistividade do volume de grãos propriamente ditos.4 Kharton e Marques52 mostraram que a microestrutura tem um impacto significativo nas propriedades de transporte elétrico e permeação de oxigênio dos materiais eletrólitos sólidos. Perovskitas do tipo LaCoO3-δ e SrCo0,6Fe0,25Cu0,15O3-δ com tamanho de grão na escala de micrômetros tendem a apresentar melhores fluxos de oxigênio para maiores tamanhos de grãos, no caso em que o transporte iônico é limitado pela difusão volumétrica. Perovskitas do tipo La0,8Sr0,2Co0,6Fe0,4O3-δ foram sintetizadas por meio de quatro métodos: estado sólido (SS), coprecipitação (CP), EDTA-citrato (EC) e spray pirólise (SP), para estudar o efeito de suas microestruturas em relação às suas propriedades de permeação elétrica e oxigênio. O tamanho de grão final aumentou na ordem seguinte: SP < CP < SS (1, 3 e 5 µm), embora nenhum contorno de grão claro tenha sido observado por microscopia eletrônica de varredura (MEV) para os materiais resultantes do processo de EC. A condutividade elétrica melhorou na ordem CP < SS < EC < SP; já a condutividade de oxigênio seguiu a ordem CP < EC < SS < SP. Além disso, a tendência de energia de ativação foi CP < EC < SS < SP. O método de spray pirólise exibe o maior fluxo de oxigênio apenas para regiões de altas temperaturas. A composição de membrana foi o fator mais importante e o desvio da composição desejada foi a principal razão para a discrepância entre a magnitude do fluxo de oxigênio. Diferenças nas microestruturas ainda causaram diferenças nas propriedades de transporte, como mostrado pela tendência em relação à redução da energia de ativação com o aumento do tamanho de grão.4 Em estudo realizado por Zeng et al.53 com membranas de La0,6Sr0,4Co0,2Fe0,8O3-δ se reforça o fato de que o contorno de grão tem uma condutividade elétrica muito menor do que a fase volumétrica. O aumento da temperatura de sinterização leva ao aumento do tamanho de grão, acompanhado por um aumento siginificativo de condutividade elétrica, que corresponde à soma das condutividades eletrônica e iônica, bem como por uma redução da energia de ativação, resultando em maior fluxo de oxigênio. A Figura 4 mostra valores de condutividade eletrônica numa faixa de 300 a 900 ºC dessas membranas sinterizadas em diferentes temperaturas onde vê-se claramente que a condutividade eletrônica praticamente dobrou a 900 ºC entre as temperaturas de sinterização de 1100 para 1200 ºC.
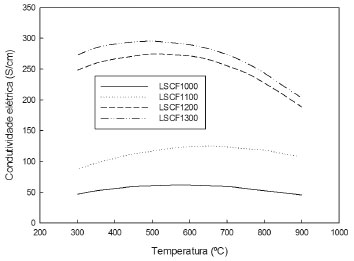 Figura 4. Condutividade elétrica das membranas sinterizadas em diferentes temperaturas. Adaptada da ref. 53
Além disso, diferentes métodos podem produzir morfologias de grãos distintas, como encontrado para a composição Ba0,5Sr0,5Co0,8Fe0,2O3-δ, preparada pelo método do estado sólido modificado com citrato (MC) e por método de complexação citrato-EDTA (EC).54 Análises dos materiais resultantes mostram estruturas cristalinas diferentes, mesmo apresentando quase a mesma distribuição de tamanho de partículas. O fluxo de oxigênio para esses compostos aumentou na ordem EC < MC < SS. O uso de diferentes condições de sinterização de Ba0,5Sr0,5Co0,8Fe0,2O3-δ resultou em um aumento do fluxo de oxigênio com o tamanho de grão, como observado por Wang et al.55 Zhu et al.56 investigaram o desempenho do fluxo de permeação de oxigênio em membranas cerâmicas densas de BaCe0,15Fe0,85O3-δ (BCF1585) sintetizadas pelo método de reação em estado sólido (SS) e pelo método de complexação ácido cítrico-EDTA (EC). As membranas sintetizadas pelo método SS apresentaram maiores fluxos do que as fabricadas por EC ao longo de toda a faixa de temperatura considerada. O fluxo de permeação de oxigênio da membrana sintetizada por SS foi de 0,92 mL cm-2 min-1 enquanto que o da membrana sintetizada por EC foi de 0,71 mL cm-2 min-1, ambos a 940 ºC. O tamanho de grão da membrana sintetizada por SS foi maior do que o da membrana sintetizada por EC, o que sugere a melhoria de desempenho do fluxo de permeação de oxigênio. Tan et al.54 também relataram que o fluxo de permeação de oxigênio de membranas densas de Ba0,5Sr0,5Co0,8Fe0,2O3-δ sintetizadas por SS foi maior quando comparado ao método EC. Nota-se que diferentes métodos de síntese de pós de óxidos mistos levam a variados tamanhos de partículas, atividades de sinterização e composições químicas, e, consequentemente, a distintas microestruturas. Isso resulta em diferentes desempenhos de fluxo de permeação de oxigênio.54-56
DESEMPENHO DAS MEMBRANAS Várias estratégias têm sido adotadas para melhorar o fluxo de membranas com estrutura perovskita, incluindo a fabricação de geometrias não planas, o revestimento de camadas porosas e catalíticas sobre a superfície da membrana, e a adaptação da composição da membrana. Várias pesquisas têm se dedicado a substituir parcialmente elementos no sítio A e/ou B de modo a: (i) melhorar a estabilidade térmica e química da estrutura de perovskita cúbica, (ii) adaptar a concentração de vacâncias de oxigênio, e (iii) aumentar a condutividade iônica. Trabalhos recentes têm se focado na introdução de pequenas quantidades de cátions (5 mol%) no sítio B, com o objetivo de melhorar a permeabilidade ao oxigênio do material. Exemplos incluem a substituição parcial por cério em BaFeO3-δ e por zircônio em Ba0,5Sr0,5Co0,8Fe0,2O3-δ, que resultaram na estabilização da estrutura cúbica e desempenhos mais elevados em quantidades baixas de substituição (5 e 3 mol%, respectivamente). Além disso, resultados positivos semelhantes foram relatados para a substituição parcial tanto no sítio A quanto B, incluindo bismuto por cobalto (5% mol) em BaBi0,05Sc0,1Co0,85O3-δ, e ítrio (5% mol) em SrCoO3-δ. Um outro efeito positivo da dopagem dos sítios A e/ou B foi a melhora nos fluxos de oxigênio a temperaturas elevadas (800-900 ºC).2 A dependência do fluxo de permeação de oxigênio em função da espessura da membrana em forma de disco (0,55; 1,10 e 1,65 mm) foi observada por Sunarso et al.57 Como pode ser visto na Figura 5, o fluxo de permeação de oxigênio foi insignificante quando a temperatura foi inferior a 600 ºC. No entanto, em temperaturas acima de 650 ºC, um valor considerável de fluxo de permeação de oxigênio foi obtido. O aumento acentuado do fluxo de permeação de oxigênio foi obtido para temperaturas acima de 800 ºC, devido à melhoria da difusão do oxigênio iônico e/ou da taxa de reação de superfície. Foi observado um aumento de seis vezes (de 0,2 para 1,2 mL cm-2 min-1) em membranas de disco com espessura igual a 0,55 mm para um incremento de temperatura de 800 para 950 ºC. Sunarso et al.57 também revelaram que o fluxo de permeação de oxigênio aumenta com a diminuição da espessura da membrana, especialmente para temperaturas superiores a 800 ºC. Curiosamente, foi observado que o aumento do fluxo de permeação de oxigênio não foi inversamente proporcional à redução da espessura da membrana. Isso pode ser explicado pela redução pela metade da espessura do disco da membrana (de 1,10 a 0,55 mm). Como resultado, o aumento do fluxo de permeação de oxigênio foi de apenas 20%, ao invés de 100%. A partir dos resultados obtidos, Sunarso et al.57 sugeriram que tanto a difusão em massa quanto a cinética na superfície de troca foram os passos limitantes para o transporte de oxigênio através das membranas. Uma observação semelhante foi relatada por Watanabe et al.58
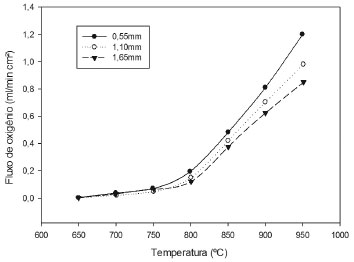 Figura 5. Permeação de fluxo de oxigênio em diferentes espessuras de membranas (adaptada) 57
Por outro lado, o fluxo do gás de arraste também desempenha um papel importante. Zydorczak et al.59 estudaram o desempenho do fluxo de permeação de oxigênio em uma membrana ultrafina de La0,6Sr0,4Co0,2Fe0,8O3-δ, investigando os efeitos de temperaturas de funcionamento e taxa de fluxo de gás de varredura (hélio) sobre os fluxos de permeação de oxigênio. Eles observaram que o fluxo de permeação de oxigênio aumenta com a temperatura de operação. Uma tendência similar ocorre com o aumento das taxas de fluxo de gás de varredura. A diferença de pressão parcial de oxigênio através da membrana de fibra oca aumenta com a taxa de fluxo do gás. O gradiente de pressão parcial de oxigênio age como força motriz para o transporte de oxigênio através da membrana e, portanto, há um acentuado aumento no fluxo de permeação de oxigênio. A redução da espessura da membrana contribui para melhorar o fluxo de permeação de oxigênio. É importante notar que a reação na superfície de troca e a difusão em massa são dois fatores que contribuem para a resistência ao transporte no que diz respeito à temperatura de funcionamento. A reação na superfície de troca é o passo limitante a baixas temperaturas; inversamente, a difusão volumétrica torna-se o passo limitante com o aumento da temperatura.
CONCLUSÃO O desenvolvimento de membranas cerâmicas de condução mista iônica e eletrônica (MIEC) para separação do oxigênio do ar vem avançando muito nos últimos anos, e diversas composições com estrutura perovskita vem sendo sintetizadas devido a alta estabilidade desta estrutura a altas temperaturas. A manutenção da neutralidade elétrica ao conduzir íons de oxigênio e elétrons em direções opostas é uma grande funcionalidade das membranas MIEC. Os vários métodos de preparação existentes para essas membranas apontam diversos parâmetros a serem controlados para obtenção de uma membrana final com estrutura propícia a uma boa condutividade iônica e eletrônica a altas temperaturas. O artigo demonstra claramente que a forma e tamanho de partícula final do pó produzido, bem como o controle da microestrutura, tamanho de grão, volume de contornos de grãos influenciam significativamente no fluxo de oxigênio de membrana final produzida, que precisa além de tudo ser densa, permitindo apenas o transporte de íons oxigênio. O fluxo de oxigênio das membranas MIEC também é limitado por vários fatores, em especial pela difusão em volume dos íons oxigênio no caso de membranas relativamente espessas e pela cinética de troca na superfície, no caso de membranas mais finas. A busca por melhores desempenhos levou a diversos estudos relativos à mudança na geometria das membranas, na composição das mesmas, e, mais recentemente, na deposição de camadas ultra-finas de membranas MIEC sobre suportes porosos e/ou deposição de camadas catalíticas. A seleção adequada do método de preparação dos materiais, do material em si, da forma e processo de sinterização e das condições de operação como temperatura e pressão parcial de O2 são ainda um grande desafio que se encontra em intenso estudo na comunidade científica.
AGRADECIMENTOS Os autores agradecem a Petrobras, Capes e CNPq pelo apoio financeiro.
REFERÊNCIAS 1. Emsley, J.; Nature's building blocks : an A-Z guide to the elements; Oxford University Press: Oxford, New York, 2001. 2. Haworth, P.; Smart, S.; Glasscock, J.; Diniz da Costa, J. C.; Sep. Purif. Technol. 2011, 81, 88. 3. Leo, A.; Liu, S. M., Diniz da Costa, J. C.; Int. J. Greenhouse Gas Control 2009, 3, 357. 4. Sunarso, J.; Baumann, S.; Serra, J. M.; Meulenberg, W. A.; Liu, S.; Lin, Y. S.; Diniz da Costa, J. C.; J. Membr. Sci. 2008, 320, 13. 5. Doukelis, A.; Kakaras, E.; Glannakopoulos, D.; Koumanakos, A.; Fuel 2007, 86, 2151. 6. Johannessen, E.; Jordal, K.; Energy Conversion and Management 2005, 46, 1059. 7. Rangel, M. C.; Quim. Nova 1997, 20, 486. 8. Yang, W. S.; Wang, H. H.; Zhu, X. F.; Lin, L. W.; Top. Catal. 2005, 35, 155. 9. Muccillo, E. N. S.; Cerâmica 2008, 54, 129. 10. Abrutis, A.; Teiserskis, A.; Garcia, G.; V, K.; Saltyte, Z.; Salciunas, Z.; V, F.; Figueras, A.; Rushworth, S.; J. Membr. Sci. 2004, 240, 113. 11. Silva, P. R. N.; Quim. Nova 2004, 27, 35. 12. Noronha, F. B.; Mattos, L. V.; Souza, H. P.; Morelli, M. R.; Passos, F. B.; Greca, M. C.; Mat. Res. 2004, 7, 309. 13. Soares, A. B.; Silva, P. R. N.; Freitas, J. C. C.; Almeida, C. M.; Quim. Nova 2007, 30, 1061. 14. Tanabe, E. Y.; Assaf, E. M.; Quim. Nova 2009, 32, 1129. 15. Santos, J. C.; Souza, M. J. B.; Ruiz, J. A. C.; Melo, D. M. A.; Mesquita, M. E.; Pedrosa, A. M. G.; J. Braz. Chem. Soc. 2012, 23, 1858. 16. Gasparotto, G.; Simões, A. Z.; Zaghete, M. A.; Perazolli, L.; Varela, J. A.; Longo E.; Cerâmica 2003, 49, 110. 17. Bouyssiéres, L.; Schifferli, R.; Urbina, L.; Araya, P.; Palacios, J. M.; J. Chil. Chem. Soc. 2005, 50, 407. 18. Rabelo, S. S.; Venâncio, S. A.; Paes Jr, H. R.; Silva, G. C.; Miranda, P. E. V.; Matéria 2007, 12, 44. 19. Silva, A. L. A.; Conceição, L.; Rocco, A. M.; Souza, M. M. V. M.; Cerâmica 2012, 58, 521. 20. Burggraaf, A. J.; Cot, L.; Fundamentals of inorganic membrane science and technology; Elsevier: Amsterdam, New York, 1996. 21. Yang, W. S.; Wang, H. H.; Cong, Y.; J. Membr. Sci. 2002, 210, 259. 22. Manning, P. S.; Sirman, J. D.; Kilner, J. A.; Solid State Ionics 1996, 93, 125. 23. Ishihara, T.; Kilner, J. A.; Honda, M.; Sakai, N.; Yokokawa, H.; Takita, Y.; Solid State Ionics 1998, 113, 593. 24. Ruiz-Trejo, E.; Sirman, J. D.; Baikov, Y. M.; Kilner, J. A.; Solid State Ionics 1998, 113, 565. 25. Lane, J. A.; Kilner, J. A.; Solid State Ionics 2000, 136, 927. 26. Jacobson, A. J.; Kim, S.; Yang, Y. L.; Abeles, B.; Solid State Ionics 1998, 106, 189. 27. Lin, Y. S.; Wang, W.; Han, J.; AIChE J. 1994, 40, 1117. 28. Li, K.; Tan, X. Y.; Liu, Y. T.; AIChE J. 2005, 51, 1991. 29. Aasland, S.; Tangen, I. L.; Wiik, K.; Odegard, R.; Solid State Ionics 2000, 135, 713. 30. Arnold, M.; Wang, H. H.; Feldhoff, A.; J. Membr. Sci. 2007, 293, 44. 31. Yan, A. Y.; Maragou, V.; Arico, A.; Cheng, M.; Tsiakaras, P.; Appl. Catal., B 2007, 76, 320. 32. Cot, L.; Ayral, A.; Durand, J.; Guizard, C.; Hovnanian, N.; Julbe, A.; Larbot, A.; Solid State Sci. 2000, 2, 313. 33. Capoen, E.; Steil, M. C.; Nowogrocki, G.; Malys, M.; Pirovano, C.; Lofberg, A.; Bordes-Richard, E.; Bolvin, J. C.; Mairesse, G.; Vannier, R. N.; Solid State Ionics 2006, 177, 483. 34. Nigara, Y.; Mizusaki, J.; Ishigame, M.; Solid State Ionics 1995, 79, 208. 35. Qiu, L.; Lee, T. H.; Liu, L. M.; Yang, Y. L.; Jacobson, A. J.; Solid State Ionics 1995, 76, 321. 36. Ishihara, T.; Yamada, T.; Arikawa, H.; Nishiguchi, H.; Takita, Y.; Solid State Ionics 2000, 135, 631. 37. Tang, J.; Zhu, M.; Zhong, T.; Hou, Y.; Wang, H.; Yan, H.; Materials Chemistry and Physics 2007, 101, 475. 38. Zhang, F.; Karaki, T.; Adachi, M.; Powder Technol. 2005, 159, 13. 39. Yasukawa, M.; Ioroi, A.; Ikeuchi, K.; Kono, T.; Mater. Lett. 2004, 58, 3536. 40. Mori, M.; Sammes, N. M.; Tompsett, G. A.; J. Power Sources 2000, 86, 395. 41. Han, J. H.; Zeng, Y. X.; Lin, Y. S.; J. Membr. Sci. 1997, 132, 235. 42. Lin, Y. S.; Kim, J.; J. Membr. Sci. 2000, 167, 123. 43. Yang, W. S.; Shao, Z. P.; Cong, Y.; Dong, H.; Tong, J. H.; Xiong, G. X.; J. Membr. Sci. 2000, 172, 177. 44. Li, K.; Liu, S. M.; Tan, X. Y.; Hughes, R.; Ceram. Int. 2002, 28, 327. 45. Wu, L. Y.; Ma, J. M.; Huang, H. B.; Tian, R. F.; Zheng, W. J.; Hsia, Y. F.; Mater. Charact. 2010, 61, 548. 46. Wu, L. Y.; Mei, X. Y.; Zheng, W. J.; Mater. Lett. 2006, 60, 2326. 47. Chen, C.; Cheng, J. R.; Yu, S. W.; Che, L. J.; Meng, Z. Y.; J. Cryst. Growth 2006, 291, 135. 48. Wang, D.; Yu, R. B.; Feng, S. H.; Zheng, W. J.; Takei, T.; Kumada, N.; Kinomura, N.; Solid State Ionics 2002, 151, 329. 49. Lopez, R.; Gonzalez, F.; Villafuerte-Castrejon, M. E.; J. Eur. Ceram. Soc. 2010, 30, 1549. 50. Kirchnerova, J.; Klvana, D.; Solid State Ionics 1999, 123, 307. 51. Costa, A. L.; Galassi, C.; Roncari, E.; J. Eur. Ceram. Soc. 2002, 22, 2093. 52. Kharton, V. V.; Marques, F. M. B.; Curr. Opin. Solid State Mater. Sci. 2002, 6, 261. 53. Zeng, P. Y.; Ran, R.; Chen, Z. H.; Gu, H. X.; Shao, Z. P.; Diniz da Costa, J. C.; Liu, S. M.; J. Membr. Sci. 2007, 302, 171. 54. Xu, N. P.; Tan, L. A.; Gu, X. H.; Yang, L.; Jin, W. Q.; Zhang, L. X.; J. Membr. Sci. 2003, 212, 157. 55. Wang, H. H.; Tablet, C.; Feldhoff, A.; Caro, H.; J. Membr. Sci. 2005, 262, 20. 56. Yang, W. S.; Zhu, X. F.; Cong, Y.; J. Membr. Sci. 2006, 283, 158. 57. Sunarso, J.; Liu, S.; Lin, Y. S.; Diniz da Costa, J. C.; J. Membr. Sci. 2009, 344, 281. 58. Watanabe, K.; Takauchi, D.; Yuasa, M.; Kida, T.; Shimanoe, K.; Teraoka, Y.; Yamazoe, N.; J. Electrochem. Soc. 2009, 156, E81. 59. Li, K.; Zydorczak, B.; Wu, Z. T.; Chem. Eng. Sci. 2009, 64, 4383. 60. Xu, N., Li, S.J., Wanqin, Shi, J., Lin, Y.S.; AIChEJ. 1999, 45, 2519. 61. Kusaba, H.; Shibata, Y.; Sasaki, K.; Teraoka, Y.; Solid State Ionics 2006, 177, 2249. 62. Teraoka, Y.; Zhang, H. M.; Yamazoe, N.; Chem. Lett. 1985, 1367. 63. Teraoka, Y.; Zhang, H. M.; Furukawa, S.; Yamazoe, N.; Chem. Lett. 1985, 1743. 64. Zeng, P. Y.; Chen, Z. H.; Zhou, W.; Gu, H. X.; Shao, Z. P.; Liu, S. M.; J. Membr. Sci. 2007, 291, 148. 65. Zeng, P. Y.; Ran, R.; Chen, Z. H.; Gu, H. X.; Shao, Z. P.; Diniz da Costa, J. C.; Liu, S. M.; J. Membr. Sci. 2007, 302, 171. 66. Tan, L.; Gu, X. H.; Yang, L.; Zhang, L. X.; Wang, C. Q.; Xu, N. P.; Sep. Purif. Technol. 2003, 32, 307. 67. Wang, H., Wang, R., Liang, D.T., Yang, W.; J. Membr. Sci. 2004, 243, 405. 68. Chen, Z. H.; Ran, R.; Zhou, W.; Shao, Z. P.; Liu, S. M.; Electrochim. Acta 2007, 52, 7343. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





