Artigo
|
|
| Desenvolvimento de um método para a determinação de tioconazol associado a nanocápsulas poliméricas por cromatografia líquida Development of a method for determination of tioconazole associated with polymeric nanocapsules by liquid chromatography |
|
Andréia P. G. Härter; Mariana H. Motta; Júlia G. de Barros; Roseane F. Ribeiro; Andréa I. H. Adams; Scheila R. Schaffazick; Cristiane de B. da Silva*
Departamento de Farmácia Industrial, Centro de Ciências da Saúde, Universidade Federal de Santa Maria, Av. Roraima, 1000, 97105-900 Santa Maria - RS, Brasil Recebido em 03/10/2013 *e-mail: csbona@smail.ufsm.br The aim of this work was to develop and validate an analytical method for the quantification of tioconazole in polymeric nanocapsule suspensions by high performance liquid chromatography with UV detection. The analysis was performed with a mobile phase composed of methanol:water (80:20) and 0.18% ammonium hydroxide; RP-18 column and UV detection at 219 nm. The method proved to be linear in the concentration range of 5-50 µg mL-1 (r = 0.9999), specific, precise (repeatability RSD = 1.42%, intermediate precision RSD = 1.17%), accurate (98 - 102%) and robust (RSD < 2.0%). In conclusion, a simple and rapid method was validated proving suitable for quantification of tioconazole in polymeric nanocapsules. INTRODUÇÃO Os derivados imidazólicos são agentes antifúngicos caracterizados pela presença de um anel azólico com dois átomos de nitrogênio, o qual se liga a outros anéis aromáticos que conferem a esses fármacos diferentes propriedades físico-químicas e biológicas.1 O tioconazol (Figura 1) é um imidazol, caracterizado como um pó cristalino branco ou quase branco, muito pouco solúvel em água, muito solúvel em clorofórmio e facilmente solúvel em etanol.2 Sua fórmula molecular é C16H13Cl3N2OS; apresenta massa molecular de 387,71 g mol-1,3 pKa de 6,54 e LogP de 4,29.5
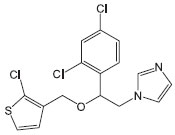 Figura 1. Estrutura química do tioconazol
Esse fármaco possui amplo espectro de ação, sendo utilizado para o tratamento tópico de dermatofitoses de pele e unhas, pitiríase versicolor e candidíase mucocutânea.6 Relatos de efeitos indesejáveis decorrente do uso de tioconazol são encontrados na literatura, destacando-se como um dos derivados imidazólicos com maior potencial alergênico.7 Esses inconvenientes na terapêutica com tioconazol podem estar diretamente relacionados com a baixa absorção do fármaco, uma vez que se faz necessária a utilização de concentrações elevadas para o efeito desejado.8 Visando minimizar os problemas enfrentados com o uso deste antifúngico, nanocápsulas poliméricas contendo tioconazol foram desenvolvidas pelo nosso grupo de pesquisa. As nanocápsulas poliméricas são nanopartículas, compostas por um núcleo geralmente oleoso, envolto por um fino filme de polímero, sendo que o fármaco pode estar adsorvido na parede, disperso no meio e/ou dissolvido no núcleo.9,10 Esses sistemas apresentam tamanho de partículas inferior a 1 µm e atuam como carreadores de fármacos, promovendo uma liberação controlada das substâncias em locais específicos. Além disso, promovem uma melhora na resposta terapêutica, permitem a redução da quantidade administrada de fármaco e minimizam efeitos colaterais indesejáveis.11,12 A caracterização dos sistemas nanoestruturados é realizada por diferentes métodos, sendo fundamental a determinação do teor de fármaco incorporado a eles. Na literatura científica encontram-se alguns métodos por cromatografia líquida de alta eficiência (CLAE) para a quantificação do tioconazol em formas farmacêuticas; entretanto, nenhum é específico para as nanoestruturas propostas neste trabalho. Além disso, são métodos bastante trabalhosos, que utilizam solventes de custo elevado e, ainda, a grande maioria faz uso de soluções tampão.4,13-15 A Farmacopeia Americana3 descreve como fase móvel a utilização de acetonitrila:metanol:água (44:40:28) alcalinizada com hidróxido de amônio, tendo como desvantagem o uso de acetonitrila, solvente de alto custo. Outro fator desvantajoso é o comprimento da coluna (25 cm), que acarreta em longo tempo de eluição, retardando o tempo de retenção do pico do tioconazol (entre 12 e 17 minutos). Por outro lado, a Farmacopeia Britânica2 descreve métodos para a quantificação do tioconazol em forma farmacêutica creme. O método utiliza como fase móvel uma mistura de tetrabutilamônio diidrogênio ortofosfato 0,005 g mol-1 (pH ajustado para 7,4 com hidróxido de amônio 2 g mol-1) e metanol (1:4), fator esse desvantajoso em se tratando do uso de tampão, por ser prejudicial para o tempo de vida útil da coluna e por requerer cuidados em relação ao equipamento. Frente ao exposto, o objetivo deste trabalho foi o desenvolvimento e a validação de um método analítico simples e eficiente, capaz de quantificar o tioconazol após a sua associação à nanocápsulas poliméricas.
PARTE EXPERIMENTAL Material e reagentes A matéria-prima de tioconazol (99,22%, m/m) foi obtida da Pharma Nostra (São Paulo, Brasil); metanol grau cromatográfico foi adquirido da Tedia (Rio de Janeiro, Brasil); o hidróxido de amônia da Vetec (Rio de Janeiro, Brasil) e a água ultrapura foi purificada através do aparelho MegaPurity Mega RO (Rio de Janeiro, Brasil). Para a preparação das nanopartículas foram utilizados monoestearato de sorbitano (Span® 80) e o polímero poli(ε-caprolactona) (PCL, Mn = 70.000 - 90.000) obtidos da Sigma-Aldrich (São Paulo, Brasil); o óleo (triglicerídeos de cadeia média) adquirido da Delaware (Porto Alegre, Brasil); polissorbato 80 (Tween® 80) e acetona da Vetec (Rio de Janeiro, Brasil). Preparação da suspensão de nanocápsulas poliméricas As suspensões de nanocápsulas foram preparadas pelo método de deposição interfacial do polímero pré-formado descrito em trabalho prévio.16 Foram obtidas nanocápsulas poliméricas de tioconazol (NC-TIO), a uma concentração de 1,0 mg mL-1. Para a avaliação da especificidade do método, nanocápsulas sem o fármaco foram, também, preparadas (NC-B). Condições cromatográficas Um sistema de cromatografia a líquido Shimadzu (Kyoto, Japão) foi utilizado, equipado com bomba LC-10AD VP, detector UV SPD-10A VP, central de controle SCL-10A VP e injetor manual Rheodyne (volume de injeção 20 µL). Os dados foram analisados pelo programa Class-VP (Shimadzu, Kyoto, Japão). Um segundo cromatógrafo foi utilizado para determinação da pureza do pico cromatográfico (Shimadzu LC-20A, Kyoto, Japão), equipado com bomba LC-20AT, detector SPD-M20A PDA e sistema controlador CBM-20A. Como fase estacionária empregou-se uma coluna Gemini® Phenomenex C-18 (150 x 4,6 mm) com tamanho de partícula de 5 µm, associada a uma pré-coluna Phenomenex® C-18 (4,0 x 3,0 mm, 5 µm). A fase móvel foi composta de metanol:água:NH4OH (80:20:0,18, v/v). O sistema foi operado à temperatura ambiente, utilizando vazão de 1,0 mL min-1. A detecção foi realizada em 219 nm e o tempo de retenção foi de, aproximadamente, 7,2 minutos. Preparação das soluções amostra Para a determinação do tioconazol, 400 µL da suspensão de nanocápsulas poliméricas foram adicionados em balão volumétrico de 20 mL juntamente com metanol. Essa solução foi submetida à sonicação por 40 minutos, a fim de extrair o fármaco presente nas nanoestruturas. Após, o volume do balão foi aferido para obtenção da concentração teórica de 20,0 µg mL-1. As amostras foram filtradas em filtro quantitativo e em membrana de celulose regenerada (0,45 µm; Sartorius®) sendo, então, analisadas por CLAE-UV. Preparação das soluções da substância química de referência Uma solução estoque de tioconazol em metanol foi preparada, na concentração de 1,0 mg mL-1. Uma alíquota de 400 µL da solução estoque foi transferida para balão volumétrico de 20 mL, utilizando metanol como solvente, a fim de obter uma solução de concentração de 20 µg mL-1. Todas as soluções foram filtradas em membrana de celulose regenerada (0,45 µm; Sartorius®) antes de serem analisadas pelo sistema cromatográfico (n = 3). Validação do método analítico Os parâmetros avaliados na validação do método compreenderam: especificidade, linearidade, limites de quantificação e detecção, precisão (repetibilidade e precisão intermediária), exatidão e robustez.17,18 Especificidade A especificidade do método foi determinada pela análise da pureza do pico do tioconazol e pela utilização de uma suspensão de nanocápsulas sem o fármaco, contendo os excipientes utilizados na sua preparação (amostra placebo). Essa suspensão foi submetida ao mesmo processo usado para a preparação das amostras que continham o fármaco. O cromatograma obtido foi analisado para verificar a possibilidade de interferência dos componentes da formulação. Para verificar a presença de possíveis produtos de degradação, as NC-TIO (1,0 mL) foram acondicionadas em cubetas transparentes (Brand®, 12.5 mm x 45 mm x 12.5 mm) e expostas à luz ultravioleta artificial UVC (Phillips TUV - UVC long life, 30 W) em câmara espelhada (1 m x 25 cm x 25 cm). As amostras foram coletadas no tempo zero e após 15 horas de exposição, submetidas ao processo de extração, e o teor de tioconazol foi determinado por CLAE-UV. O ensaio foi realizado em triplicata. Linearidade e limites de detecção e quantificação Para a construção da curva analítica, alíquotas da solução estoque (1,0 mg mL-1) foram transferidas para balões volumétricos de 20 mL e o conteúdo diluído em metanol, a fim de se obter concentrações de 5, 10, 20, 30, 40 e 50 µg mL-1. Três curvas analíticas independentes foram construídas e a linearidade foi obtida pelo estudo da regressão linear, pelo método dos mínimos quadrados e analisadas por Análise de Variância (ANOVA). Os limites de detecção (LD) e quantificação (LQ) foram calculados a partir da curva analítica média, considerando o desvio padrão do intercepto e a inclinação.18 Precisão A precisão foi determinada em níveis de repetibilidade e precisão intermediária. A repetibilidade foi realizada a partir da análise de seis amostras independentes, na mesma concentração (20,0 µg mL-1), no mesmo dia e nas mesmas condições experimentais. Para a avaliação da precisão intermediária as amostras (20,0 µg mL-1) foram analisadas em três dias diferentes (n = 3/dia). Os resultados foram expressos como desvio padrão relativo (DPR, %). Exatidão O ensaio de exatidão foi realizado em triplicata, a partir do teste de recuperação. Uma solução de tioconazol na concentração de 10 µg mL-1 foi preparada após a extração do fármaco das nanocápsulas com metanol. A essa solução foram acrescidas quantidades da solução estoque, a fim de obter soluções de concentração de 16, 20 e 24 µg mL-1 (correspondendo a 80, 100 e 120% da concentração usual de análise - 20 µg mL-1). O percentual de recuperação foi calculado pela diferença entre as áreas obtidas das soluções acrescidas ou não da solução estoque.19 Robustez A robustez do método foi avaliada a partir da análise das amostras (20 µg mL-1, n = 3/condição), variando-se o comprimento de onda (216 e 222 nm), a vazão (0,8 e 1,2 mL min-1) e a coluna (Nanoseparation® C-18, 150 x 4,6 mm, tamanho de partícula de 5 µm).
RESULTADOS E DISCUSSÃO O desenvolvimento de um método analítico capaz de quantificar fármacos incorporados em sistemas nanoestruturados exige cuidados no sentido de garantir a total separação do fármaco do complexo sistema ao qual está confinado. Neste sentido, a CLAE tem se mostrado uma boa alternativa e cada vez mais estudos acerca do uso desse método para análise de fármacos nanoestruturados vêm sendo realizados. Como exemplos, métodos analíticos por CLAE-UV foram desenvolvidos e validados para a quantificação de clobetasol20, clotrimazol21, adapaleno22 e ácido lipoico23 em suspensões de nanocápsulas. Neste trabalho, alguns testes para a escolha da fase móvel ideal foram realizados, sendo o principal objetivo utilizar um sistema eluente menos complexo que os já relatados na literatura.13,15 Inicialmente, foram testadas soluções de metanol:água em diferentes proporções (80:20; 85:15; 90:10), sendo o metanol o solvente escolhido por apresentar um menor custo quando comparado à acetonitrila. Todas as fases móveis testadas proporcionaram valores adequados de assimetria e pratos teóricos (em torno de 1,2 e 3.000, respectivamente); entretanto, as proporções 85:15 e 90:10, apesar de promoverem uma redução no tempo de retenção, levaram à diminuição da resolução. A proporção 80:20 foi a escolhida por propiciar uma melhor resolução, além de utilizar menor quantidade de solvente orgânico. No entanto, no decorrer das análises, variações significativas nos parâmetros cromatográficos (área, fator de cauda e resolução dos picos) foram observadas. Essas variações foram atribuídas a mudanças nos valores de pH durante o ensaio. Cabe salientar que em meio levemente ácido e neutro, mesmo com pequenas variações nos valores de pH, a ionização do fármaco muda drasticamente, pelo fato de que o tioconazol é uma base fraca. Desta forma, optou-se pela adição de uma base à fase móvel, a fim de manter o tioconazol na forma não ionizada, sem ser necessário o uso de solução tampão para o controle do pH. A escolha de hidróxido de amônio e da concentração utilizada foi baseada no método descrito pela Farmacopeia Americana.3 A fase móvel composta por metanol:água:NH4OH (80:20:0,18, v/v), mostrou-se adequada, proporcionando picos com boa resolução (próximo a 3), simétricos (fator de cauda em torno de 1,2) e com pratos teóricos em torno de 5.000. Após a definição das condições cromatográficas, o método foi validado quanto à especificidade, linearidade, limites de detecção e quantificação, precisão, exatidão e robustez. No que diz respeito à especificidade, o método mostrou-se específico para a análise do tioconazol, não sendo observada a interferência dos excipientes e/ou solvente no pico cromatográfico do fármaco. A Figura 2 mostra a sobreposição dos cromatogramas obtidos para a amostra (NC-TIO), solução de trabalho e para a solução placebo (NC-B), demonstrando que nenhum pico referente aos excipientes foi detectado no tempo de retenção do tioconazol e nem mesmo próximo a ele. A análise da pureza do pico demonstrou a especificidade do método, uma vez que o índice de pureza encontrado foi de 1,000, confirmando a ausência de outras substâncias coeluindo no mesmo tempo de retenção do fármaco.
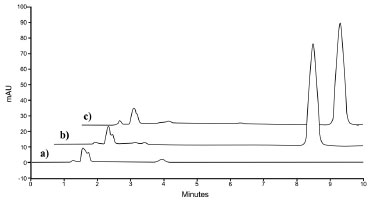 Figura 2. Cromatogramas obtidos por CLAE-UV para: (a) formulação placebo (NC-B); (b) solução de tioconazol (20,0 µg mL-1) e (c) suspensão de nanocápsulas poliméricas contendo tioconazol (NC-TIO) (20,0 µg mL-1)
Após 15 h de exposição do fármaco à luz UVC, verificou-se que o teor residual de tioconazol associado às nanopartículas foi de 44,36 % em relação ao valor obtido no tempo zero. Observou-se a formação de picos adicionais, que podem ser referentes a produtos de degradação do tioconazol ou dos excipientes. Cabe salientar que o método cromatográfico desenvolvido permitiu a total separação do pico cromatográfico do fármaco e de seus possíveis produtos de degradação, o que foi evidenciado pelo índice de pureza do pico (> 0,9999) e pela boa resolução dos picos adjacentes (R>2) (Figura 3). Dessa forma, o método pode ser utilizado em estudos de estabilidade do tioconazol.
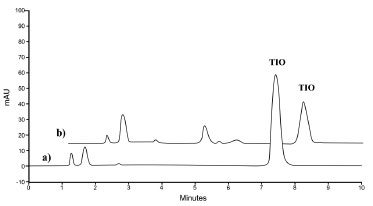 Figura 3. Cromatogramas obtidos por CLAE-UV para o tioconazol associado à nanocápsulas poliméricas no tempo zero (a) e após 15 horas de exposição à luz UVC (b)
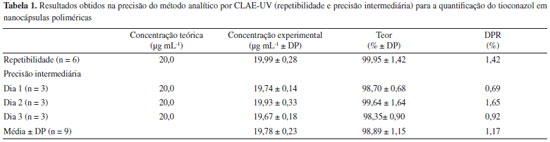
Na análise da linearidade, a curva analítica descrita pela equação y = 52105x - 386,7 apresentou coeficiente de correlação próximo a unidade (r = 0,9999), o que demonstra que o modelo proposto foi adequado. A análise estatística evidenciou regressão linear significativa (Fcalculado = 64.256,05 > Ftabelado = 4,75) e ausência de desvio de linearidade (Fcalculado = 1,74 < Ftabelado = 3,26), em nível de confiança de 95%. Tais resultados demonstraram que o método proposto é linear na faixa de concentração de 5 a 50 µg mL-1. Os valores de LQ e LD foram de 0,61 µg mL-1 e 0,18 µg mL-1, respectivamente, demonstrando a sensibilidade do método para baixas concentrações do fármaco. Os resultados obtidos para a precisão (repetibilidade e precisão intermediária) estão expressos na Tabela 1. O desvio padrão relativo (DPR) para a repetibilidade foi de 1,42% e para a precisão intermediária foi de 1,17%, indicando que o método desenvolvido é preciso dentro da faixa de concentração e das condições adotadas. Os valores de recuperação alcançados para o ensaio de exatidão estão entre 98 e 102 %, demonstrando que o método possui exatidão satisfatória24 (Tabela 2).
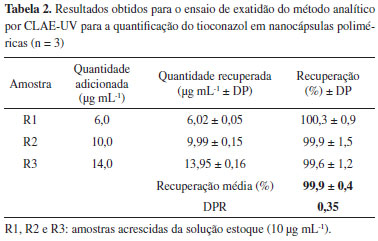 > >
A Tabela 3 demonstra os resultados encontrados na robustez do método analítico. O método não foi afetado pelas pequenas variações no comprimento de onda, vazão e nem mesmo pela mudança da marca da coluna, uma vez que não houve diferença significativa entre os teores de tioconazol encontrados nas nanocápsulas poliméricas e os obtidos nas condições recomendadas (p>0,05), indicando a robustez do método cromatográfico desenvolvido.
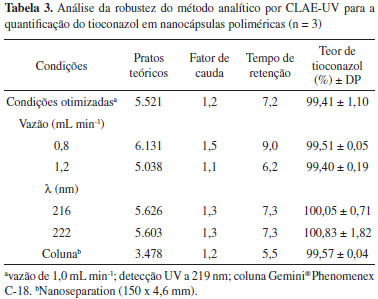
Mediante o conjunto dos resultados, foi possível verificar que o método cromatográfico desenvolvido é adequado para a análise do tioconazol, podendo ser aplicado em estudos de fotoestabilidade e para a quantificação do fármaco incorporado em matrizes complexas como as nanocápsulas poliméricas, devido à sua seletividade satisfatória.
CONCLUSÃO Neste trabalho, um método rápido, simples e eficiente por cromatografia líquida de alta eficiência com detecção UV foi desenvolvido para a quantificação do tioconazol em nanocápsulas poliméricas. O método proposto mostrou-se específico, robusto, preciso, exato e linear na faixa de concentração de 5 a 50 µg mL-1, demonstrando a confiabilidade do mesmo e seu potencial de aplicação para a quantificação do fármaco no nanocarreador proposto. Além disso, quando comparado com os métodos cromatográficos já relatados, o método proposto apresenta como vantagens a facilidade na preparação da fase móvel, a redução de solventes orgânicos e a não utilização de solução tampão, que são relacionados a maiores custos e cuidados preventivos do equipamento.
REFERÊNCIAS 1. Silva, P.; Farmacologia, 8ª ed., Editora Guanabara & Koogan: Rio de Janeiro, 2010. 2. British Pharmacopoeia, Her Majesty Stationary Office: London, 2010. 3. The United States Pharmacopeia, 35th ed., United States Pharmacopeia Convention: Rockville, 2012. 4. Ferguson, P.D.; Goodall, D.M.; Loran, J.S.; J. Chromatogr. A 1996, 745, 25. 5. Vrakas, D.; Giaginis, C.; Tsantili-Kakoulidou, A.; J. Chromatogr. A 2006, 1116, 158. 6. Sobue, S.; Sekiguchi, K.; Biol. Pharm. Bull. 2004, 27, 1428. 7. Dooms-Goossens, A.; Matura, M.; Driegh, J.; Degreef, H.; Contact Dermatitis 1995, 33, 73. 8. Muñoz, A. J. C.; Tur-Tur, C.; Molina, J. M. H.; Santos, P.; Cárdenes, D.; Giusiano, G.; Rev. Iberoam. Micol. 2010, 27, 49. 9. Schaffazick, S. R.; Freitas, L. L.; Pohlmann, A. R.; Guterres, S. S.; Quim. Nova 2003, 26, 726. 10. Rawat, M.; Singh, D.; Saraf, S.; Saraf, S.; Biol. Pharm. Bull. 2006, 29, 1790 11. Mora-Huertas, C. E.; Fessi, H.; Elaissari, A.; Int. J. Pharm. 2010, 385, 113. 12. Kumari, A.; Yadav, S. K.; Yadav, S. C.; Colloids Surf. B 2010, 75, 1. 13. Berridge, J.C.; Last, P.E.; Platt, R.V.; J. Pharm. Biomed. Anal. 1985, 3, 391. 14. Pietra, A.M.; Cavrini, V.; Andrisano, V.; Gatti, R.; J. Pharm. Biomed. Anal. 1992, 10, 873. 15. Gagliardi, L.; Orsi, D.; Chimenti, P.; Porra, R.; Tonelli, D.; Anal. Sci. 2003, 19, 1195. 16. Fessi, H.; Puisieux, F.; Devissaguet, J-Ph.; Ammoury, N.; Benita, S.; Int. J. Pharm. 1989, 55, r1. 17. Brasil, Agência Nacional de Vigilância Sanitária, Resolução nº 899, 29/05/2003, Diário Oficial da União, Brasília, DF, 2003. 18. ICH - Internacional Conference on Harmonization, Validation of Analytical Procedures: Text and Methodology, Q2 (R1), 2005. 19. AOAC.; Official Methods of Analysis, 17th ed, Association of Official Analytical Chemists: Gaithersburg, 2000. 20. Fontana, M.C.; Bastos, M.O.; Beck, R.C.R.; J. Chromatogr. Sci. 2010, 48, 637. 21. Santos, S. S.; Ferreira, L. M.; Schaffazick, S. R.; Cruz, L.; Lat. Am. J. Pharm. 2012, 31, 482. 22. Barrios, J. G.; Farias, G.; Roggia, I.; Peixoto, S. C.; Pons, F. R.; Bruschi, M.; Raffin, R. P.; Alves, M. P. Quim. Nova 2011, 34, 1464. 23. Külkamp, I. C.; Paese, K.; Guterres, S. S.; Pohlmann, A. R. Quim. Nova 2009, 32, 2078. 24. Shabir, G. A.; J. Chromatogr. A 2003, 987, 57. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access