Artigo
|
|
| Produção e caracterização de polihidroxialcanoatos obtidos por fermentação da glicerina bruta residual do biodiesel Production and characterization of polyhydroxyalkanoates obtained by fermentation of crude glycerin from biodiesel |
|
Tamiris V. B. FigueiredoI,*; Márcio I. CamposII; Luciane S. SousaI; Jaff R. da SilvaI; Janice I. DruzianI
IDepartamento de Análises Bromatológicas, Faculdade de Farmácia, Universidade Federal da Bahia, Rua Barão de Geremoabo, s/n, Ondina, 40171-970 Salvador - BA, Brasil Recebido em 27/08/2013 *e-mail: tamirisvilasboas@gmail.com The aim of this study was to evaluate the production of polyhydroxyalkanoates (PHAs) by fermentation of Crude Glycerin, a byproduct of the biodiesel industry, by Cupriavidus necator IPT 026, 027 and 028. The influence of fermentation time and temperature in shake flasks were evaluated. The highest PHA production (2.82 g L-1) occurred at 35 ºC for 72 h of fermentation. The melting and initial thermal degradation temperatures of this PHA were 177.9 ºC and 306.33 ºC, respectively, with 55% crystallinity. FTIR spectrum was similar to those reported in literature. The polymer obtained presented three different methyl esters of hydroxyalkanoates in its composition, with molecular weight of 630 kDa. Bacteria can use Crude Glycerin as an inexpensive substrate to produce value-added biodegradable products, such as PHA. INTRODUÇÃO A atual preocupação com os problemas ambientais causados pelo acúmulo de materiais de origem petroquímica contribuiu para o desenvolvimento de alternativas para a redução do consumo de plásticos convencionais, como a substituição destes por plásticos biodegradáveis ou bioplásticos, dentre os quais se destacam os Polihidroxialcanoatos (PHAs). Os PHAs são acumulados intracelularmente por bactérias como reserva de carbono e/ou energia sob a limitação de um nutriente essencial ao seu crescimento, como nitrogênio, fósforo, enxofre ou oxigênio. Estes biopolímeros são considerados uma alternativa aos plásticos convencionais, como o polipropileno1,2 e são completamente degradados por micro-organismos à água e dióxido de carbono sob condições aeróbicas e a metano, sob condições anaeróbicas.3 Muitos são os micro-organismos produtores de PHA, sendo a espécie Cupriavidus necator uma das que apresentam condições mais favoráveis à produção industrial. Esta bactéria pode acumular cerca de 80% de sua massa seca em polímero além de utilizar diferentes tipos de substratos, como glicose, frutose, entre outros.1 PHAs são poliésteres alifáticos formados por unidades monoméricas que podem apresentar diferentes números de átomos de carbono. A Figura 1 apresenta a estrutura geral dos PHAs, cuja unidade monomérica depende da composição da cadeia lateral R e do valor de m.2 O Poli(3-hidroxibutirato) [P(3HB)] é constituído por unidades repetitivas de 4 átomos de carbono e representa o polímero mais estudado e comercializado mundialmente dentre a família dos alcanoatos.4
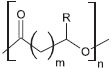 Figura 1. Estrutura geral das unidades monoméricas constituintes dos PHAs
Os PHAs possuem características físico-químicas e de biocompatibilidade que possibilitam diversas aplicações na área médica, como a produção de fios de sutura, moldes para engenharia de tecidos e matrizes para a liberação controlada de fármacos.5 Porém, apesar da grande possibilidade de aplicações, estes bioplásticos ainda possuem participação mínima no mercado em virtude de seu alto custo de obtenção em relação aos plásticos petroquímicos. Isto ocorre devido ao uso de fontes de carbono de elevado valor para a produção de biomassa, como glicose e sacarose, o que limita a produção e comercialização dos biopolímeros.6 No Brasil, a empresa PHB Industrial S.A. produz [P(3HB)] em larga escala a partir da cana-de-açúcar e utiliza uma produção integrada em usina sucroalcooleira. Apesar da utilização de sacarose como fonte de carbono, os custos de produção da empresa são os menores do mundo. Assim, enquanto o polímero é produzido a US$ 10 - 20 / kg na Europa, esses custos são de US$ 2,5 - 5 / kg no Brasil, embora este valor ainda represente cerca de 4 a 5 vezes o custo dos polímeros convencionais.6 Uma alternativa para problemas de viabilidade é a utilização de substratos de menor custo comparados com glicose e sacarose, que pode representar 40% de economia no processo de produção.7 Além disso, o estudo de parâmetros do processo fermentativo que permitam explorar ao máximo o potencial dos micro-organismos produtores pode contribuir para o aumento da produção do polímero e, consequentemente, para a redução de custo.8 No Brasil, a crescente produção de biodiesel representa uma alternativa sustentável de obtenção de biocombustíveis por meio de fontes agrícolas renováveis. Porém, a geração de glicerina como co-produto da reação de síntese de biodiesel em uma taxa de, aproximadamente, 1 kg por 12,6 L de biodiesel, e o alto custo associado aos processos de purificação e refino da glicerina bruta representam problemas relacionados ao reaproveitamento deste resíduo.9 A Glicerina Bruta Residual do Biodiesel (GBRB) é constituída principalmente por etanol ou metanol residual, glicerol e ácidos graxos, apresentando condições favoráveis para sua possível aplicação como substrato fermentescível a ser utilizado por micro-organismos produtores de PHA.10 Assim, a reutilização da GBRB surge como uma possibilidade de redução dos custos de produção de PHA e uma alternativa de reaproveitar e agregar valor a este resíduo industrial, visto que este é um coproduto da cadeia de produção do biodiesel que oferece riscos ambientais devido à grande quantidade na qual é gerado, além da escassez de alternativas para reaproveitamento ou descarte. O objetivo deste estudo foi, então, realizar a produção de PHA por fermentação da GBRB como substrato fermentescível alternativo, verificar a influência de diferentes micro-organismos, do tempo e da temperatura na produção do polímero, além de caracterizar as propriedades do PHA obtido através das melhores condições de fermentação.
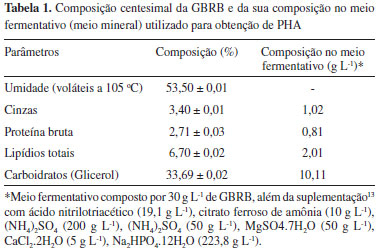
PARTE EXPERIMENTAL Composição centesimal da Glicerina Bruta Residual do Biodiesel (GBRB) A glicerina utilizada como substrato na produção de PHA foi cedida pela Empresa Comanche Biocombustíveis, situada em Simões Filho - BA, e gerada durante a produção de biodiesel a partir de óleo de soja e metanol. A GBRB foi avaliada em termos de lipídios totais,11 umidade, cinzas e proteína bruta.12 O teor de carboidratos foi calculado pela diferença entre 100 e a soma dos percentuais de umidade, proteína, lipídios totais e cinzas. As análises foram realizadas em triplicata. Micro-organismos e manutenção Os micro-organismos utilizados na produção de PHA foram três linhagens de bactérias Cupriavidus necator, cepas IPT 026, IPT 027 e IPT 028. As bactérias foram mantidas sob refrigeração em meio ágar nutriente (NA), composto por 5,0 g L-1 de peptona de carne, 3,0 g L-1 de extrato de carne e 1,5% de ágar, com repique periódico realizado a cada 15 dias. Produção de biomassa e PHA a partir da fermentação de GBRB Fermentação de GBRB por diferentes linhagens de Cupriavidus necator As produções de PHAs a partir da GBRB foram realizadas em triplicata utilizando-se duas pré-culturas e cultura final. Como primeira pré-cultura, foi inoculada 1 alçada (1 x 1012 UFC mL-1) do micro-organismo em 50 mL de meio caldo nutriente (5,0 g L-1 de peptona de carne e 3,0 g L-1 de extrato de carne) e incubado em agitador orbital (TE 424, Tecnal) a 30 ºC e 150 rpm por 24 h. Os polímeros foram produzidos pelos micro-organismos C. necator cepas IPT 026, IPT 027 e IPT 028. Para as demais culturas foi utilizada uma fração de 10% (v/v) em relação ao volume de trabalho utilizado. O meio mineral13 (ácido nitrilotriacético, 19,1 g L-1; citrato ferroso de amônia, 10 g L-1; MgSO4.7H2O, 50 g L-1; CaCl2.2H2O, 5 g L-1; (NH4)2SO4, 200 g L-1; Na2HPO4.12H2O, 223,8 g L-1; e GBRB 30 g L-1) foi utilizado como segunda pré-cultura, incubado em agitador orbital a 30 ºC e 150 rpm por 24 h. Como cultura final utilizou-se o meio mineral com limitação de nitrogênio, incubado em agitador orbital a 30 ºC e 180 rpm por 72 h. A concentração de (NH4)2SO4 (fonte de nitrogênio) na cultura final foi de 50 g L-1. De maneira a avaliar o potencial de aplicação de GBRB como substrato alternativo na produção de PHA, os mesmos experimentos foram realizados conforme descrito acima, utilizando-se 30 g L-1 de glicose como fonte de carbono convencional constituinte do meio fermentativo. Variação do tempo e da temperatura no processo fermentativo Após a seleção do micro-organismo que proporcionou a maior produção de PHA, foi avaliada a influência do tempo e da temperatura de fermentação na produção do polímero conforme o procedimento descrito anteriormente. O processo de fermentação foi realizado em agitador orbital a 150 rpm, com variação da temperatura entre 30, 32,5 e 35 ºC e do tempo de fermentação entre 24, 48 e 72 h, de modo a verificar a condição mais favorável à produção de PHA. Precipitação em centrífuga Ao final das fermentações, a determinação da biomassa total foi realizada por medidas gravimétricas (massa seca). O meio líquido resultante foi centrifugado a 18000 rpm durante 30 min a 5 ºC e a biomassa precipitada pela centrifugação foi seca em estufa a 80 ºC até atingir peso constante. Extração do polímero A extração dos PHAs do interior das células dos micro-organismos foi realizada utilizando-se clorofórmio e de hipoclorito de sódio combinados (2 : 1 v/v) e posterior evaporação do solvente em estufa a 40 ºC por 24 h. A produção de PHAs foi calculada por método gravimétrico para o biopolímero obtido após extração. A produção foi expressa como g L-1. A porcentagem de acumulo foi determinada pela relação entre a quantidade de PHAs produzidos e a quantidade de biomassa. Caracterização do PHA produzido por C. necator IPT 026 a partir de GBRB O polímero produzido a partir da GBRB por C. necator IPT 026 na condição de fermentação que proporcionou maior produção (temperatura de 35 ºC por 72 h de fermentação em agitador orbital) foi caracterizado por meio das técnicas de Infravermelho com Transformada de Fourier (FTIR), Calorimetria Diferencial de Varredura (DSC), Difração de Raios X (DRX), Análise Termogravimétrica (TGA), determinação da massa molar por Cromatografia Líquida de Alta Eficiência - Índice de Refração (CLAE-IR) e da composição química por Cromatografia Gasosa - Espectrometria de Massas (CG-EM). Infravermelho com Transformada de Fourier (FTIR) A caracterização dos grupamentos funcionais do PHA produzido foi determinada por espectroscopia na região do infravermelho, no intervalo de 4.000 a 450 cm-1, pela técnica de ATR. Calorimetria Diferencial de Varredura (DSC) A determinação da Temperatura de Fusão (Tm) foi realizada a partir da análise de DSC. O PHA obtido com GBRB foi aquecido sob atmosfera inerte (nitrogênio) de -30 ºC a 200 ºC a 10 ºC min-1. Difração de Raios X (DRX) A análise de DRX foi realizada para determinar a cristalinidade do PHA produzido a partir de GBRB. Foi utilizado um difratômetro SHIMADZU (XRD-6000, USA), operando a 40 kV e 30 mA com radiação CuKa (λ = 1,5433 Å). Os dados foram adquiridos em escala 2θ com variação de 5 a 80º. Análise Termogravimétrica (TGA) O PHA foi avaliado por análise termogravimétrica, com monitoramento da temperatura de início de degradação (Ti) e temperatura máxima de degradação (Tpico), obtida a partir da primeira derivada (DTG) da curva de TGA, de forma a avaliar a degradação térmica e a perda de massa do polímero. A análise foi realizada utilizando um equipamento Pyris-1 Perkin Elmer. A amostra foi aquecida de 25 ºC a 700 ºC a uma taxa de aquecimento de 10 ºC min-1, sob atmosfera de nitrogênio. Determinação da massa molar por Cromatografia Líquida de Alta Eficiência - Índice de Refração (CLAE-IR) A massa molar (MM) do polímero foi obtida por CLAE-IR utilizando um equipamento Perkin Elmer 200 equipado com injetor automático, detector de Índice de Refração (Perkin Elmer), coluna Shodex KD 807 (30 cm x 78 mm x 5 µm) e forno na temperatura de 30 ºC. A amostra de PHA foi dissolvida em clorofórmio na concentração final de 0,7 mg mL-1 e a solução do polímero resultante foi filtrada (membrana de PTFE, 0,22) antes da análise. A fase móvel utilizada foi clorofórmio no fluxo de 1 mL min-1. Uma curva padrão foi criada usando padrões de poliestireno, no intervalo de 682 a 1.670.000 g mol-1 (Poliestireno de Alta Massa Molar, Normas Kit, Polymer Standards Service, EUA). A MM do polímero produzido foi calculada em relação à curva padrão logMM = -0.504 x Tr + 16,45, com R2 = 0,985. Composição química por Cromatografia Gasosa - Espectrometria de Massas (CG-EM) A composição química do PHA produzido com GBRB foi determinada por CG-EM utilizando um cromatógrafo a gás Clarus 500 PerkinElmer equipado com detector de Espectrometria de Massas, com software TurboMass versão 4.5.0 e Biblioteca NIST 98. Aproximadamente 0,04 g do PHA foi submetido a um processo de preparo da amostra por metanólise.14,15 O volume de 1 µL da fase orgânica obtida contendo o polímero foi submetido à injeção no modo sem divisão de fluxo (splitless), utilizando uma câmara de vaporização com 2 mm de diâmetro interno e separação em coluna capilar DB-1 (30 m x 0,25 mm x 0,25 mm) a 80 ºC por 1 min, aumentando a 20 ºC min-1 até 200 ºC. Hélio foi utilizado como gás de arraste no fluxo de 1,0 mL min-1. As temperaturas do injetor e do detector foram 250 ºC e 240 ºC, respectivamente. O espectrômetro de massas foi programado para varredura na faixa de 50 a 550 m/z e os monômeros constituintes dos bioplásticos foram identificados por comparação do tempo de retenção e dos espectros de massa obtidos.
RESULTADOS E DISCUSSÃO Composição centesimal da Glicerina Bruta Residual do Biodiesel (GBRB) A literatura afirma que o glicerol pode ser utilizado por diversos micro-organismos como fonte de carbono para o crescimento. No entanto, ainda são poucos os trabalhos que empregam o glicerol como substrato para produção biológica de produtos de valor agregado com potenciais usos industriais.10 Os resultados da composição da GBRB expostos na Tabela 1 mostram que este substrato contém minerais, nitrogênio orgânico e lipídios oriundos do processamento do biodiesel. Como a glicerina residual foi utilizada na concentração de 30 g L-1 no meio fermentativo, a quantidade da fração de carbono contida neste meio corresponde a 12,12 g L-1, referente à soma dos teores de carboidratos (33,69% = 10,11 g L-1) e de lipídios totais (6,07% = 2,01 g L-1). Associado a este valor, a fração de nitrogênio contida no meio mineral (aproximadamente 261 g L-1), os demais componentes da GBRB e os micronutrientes usados como suplementos do meio de cultivo13 (Tabela 1) contribuem para as necessidades nutricionais dos micro-organismos, de forma a induzir a reprodução celular e o acúmulo intracelular de polímero.
Isto demonstra o potencial de aplicação da GBRB como substrato fermentescível na produção de PHA, agregando valor a este co-produto da indústria do biodiesel e possibilitando a redução dos custos de produção do polímero. Produção de biomassa e PHA a partir da fermentação de GBRB Fermentação de GBRB por diferentes linhagens de Cupriavidus necator As produções de PHA (g L-1) por meio dos experimentos realizados utilizando as três linhagens de C. necator estão presentes na Tabela 2. A seleção do micro-organismo, assim como do substrato fermentativo, tem grande influência no custo de produção do PHA.16
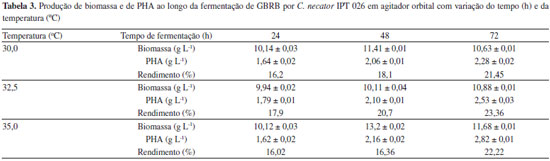
Os maiores valores de biomassa celular e de PHA foram obtidos por fermentação de GBRB utilizando a bactéria C. necator IPT 026. A Tabela 2 também apresenta os resultados referentes à produção de PHA por fermentação das três linhagens de C. necator utilizando glicose como fonte de carbono nas mesmas condições empregadas para a GBRB. Os resultados mostram que, apesar da maior produção ter sido obtida com o uso de glicose, a GBRB possui potencial de aplicação como substrato alternativo na produção do biopolímero. Além disso, ambos os substratos apresentaram maior produção de PHA por fermentação de C. necator IPT 026. Isto pode ser explicado pelas melhores condições de adaptação encontradas por este micro-organismo no meio de cultivo constituído por GBRB, possibilitando maior multiplicação celular e acúmulo de polímero. O emprego de diferentes micro-organismos, incluindo C. necator IPT 026, é relatado na literatura para fermentação de óleo de soja e os melhores resultados de produção também foram obtidos por esta cepa, resultando em 80 g L-1 de PHA em sistema de batelada alimentada.17 Isto pode indicar uma importante contribuição dos 6,70% correspondentes à fração lipídica total da GBRB (Tabela 1) para a biossíntese de PHA, uma vez que ao se utilizar 30 g L-1 deste substrato no meio fermentativo, 2,01 g L-1 são mono-, di- ou tri-glicerídeos ou ácidos graxos livres oriundos do processo de produção de biodiesel, além de glicerol disponível para reprodução e manutenção celular e acúmulo do polímero. Variação do tempo e da temperatura no processo fermentativo As produções de biomassa e de PHA por fermentação da GBRB por C. necator IPT 026 obtidas em agitador orbital com variação de tempo (24 h, 48 h e 72 h) e temperatura (30 ºC, 32,5 ºC e 35 ºC) constam na Tabela 3.
A literatura apresenta a temperatura de 30 ºC como adequada para o cultivo de C. necator na produção de P(3HB).8 Entretanto, a influência da temperatura de fermentação na produção de PHA por C. Necator foi avaliada anteriormente utilizando meio hidrolisado de amido de arroz suplementado com óleo de soja e a maior produção de polímero foi atingida na temperatura de 35 ºC.18 Além disso, o estudo do tempo de fermentação também é um parâmetro indispensável à otimização do processo de produção de PHA, pois condições bem definidas deste parâmetro podem contribuir para um maior acúmulo de polímero nas células dos micro-organismos. A Tabela 3 mostra que o aumento da temperatura favorece a produção de biomassa e PHA em todos os tempos de fermentação testados. Um estudo relata que utilizando glicose como substrato fermentescível, os maiores resultados de produção de PHA foram obtidos na temperatura de 35 ºC.7 Da mesma forma, ao utilizar GBRB como substrato, o aumento do tempo de fermentação de 24 h para 72 h à temperatura de 35 ºC resultou em um aumento de 72% na produção de PHA por C. necator IPT 026 (Tabela 3). Entretanto, apesar do aumento da produção observado após as seleções do micro-organismo e dos parâmetros de tempo e temperatura de fermentação em agitador orbital, este não foi proporcional ao aumento dos valores de produção de biomassa (Tabela 3). Isto demonstra que, provavelmente, a extração de PHA realizada não foi eficaz para a obtenção do polímero por lise celular. Estudos abordam o uso de diferentes métodos de extração de PHA, sendo o método de liofilização combinado com a utilização de clorofórmio o mais utilizado.10,19,20 Caracterização do PHA produzido por C. necator IPT 026 a partir de GBRB As propriedades do PHA obtido por fermentação da GBRB com a cepa C. necator IPT 026 em agitador orbital na condição que proporcionou maior produção (35 ºC, 72 h) foram determinadas a partir das técnicas de caracterização a seguir. Infravermelho com Transformada de Fourier (FTIR) A espectrometria no infravermelho constitui uma valiosa técnica para estudar os polímeros, estimando as interações e mudanças na morfologia dos componentes, pois combina as interações químicas e a estrutura conformacional das moléculas.21 A Figura 2 apresenta o espectro de FTIR do PHA obtido com GBRB por fermentação em agitador orbital a 35 ºC por 72 h.
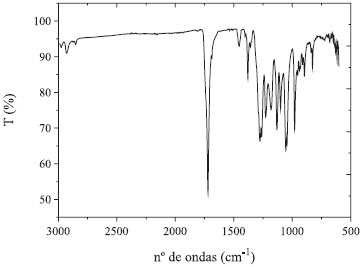 Figura 2. Espectro de FTIR do PHA obtido por 72 h de fermentaçao de GBRB por C. necator IPT 026 em agitador orbital a 35 ºC
As bandas características de PHA, tais como as deformações axiais da carbonila (C=O) em 1.737 cm-1, pico atribuído à vibração da carbonila do grupo éster,21 e de C-C em 978 cm-1 são observadas. A banda de deformação angular simétrica no plano dos grupamentos CH3 em 1.380 cm-1 e a banda típica da conformação helicoidal das cadeias a 1.227 cm-1, estão de acordo com os picos descritos na literatura.22 As bandas 1.134 cm-1 e 1.187 cm-1 são atribuídas, respectivamente, aos estiramentos simétricos e assimétricos do grupo C-O-C.23 Além disso, foi relatado que na faixa entre 1.228 cm-1 e 1.279 cm-1 as bandas são características da ligação C-O-C.22 Calorimetria Diferencial de Varredura (DSC) O PHA obtido a partir da GBRB foi caracterizado em termos de propriedades térmicas com avaliação da temperatura de fusão (Tm) (Figura 3), parâmetro interligado ao potencial de aplicações do polímero.24
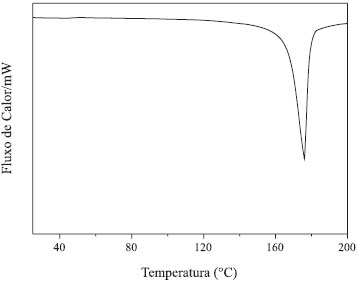 Figura 3. Análise de DSC do PHA obtido por 72 h de fermentaçao de GBRB por C. necator IPT 026 em agitador orbital a 35 ºC
A temperatura de fusão (Tm) apresentada pelo PHA obtido a partir da GBRB foi de 177,9 ºC, valor condizente com outros encontrados na literatura para PHAs produzidos a partir de glicose (entre 174 ºC e 183 ºC).15,25 Este parâmetro é importante devido às limitações de aplicação de polímeros que apresentam temperatura de degradação térmica próxima à temperatura de fusão em processos de moldagem e que exigem manipulação dos PHAs em altas temperaturas. Difração de Raios X (DRX) Verificou-se pelo resultado da DRX (Figura 4) que o PHA obtido por fermentação de GBRB apresentou grau de cristalinidade de 55%. Em comparação com outros valores citados na literatura (65% e 58%),2, 26 o PHA produzido apresentou melhor resultado, uma vez que menores valores de cristalinidade aumentam as possibilidades de aplicações industriais devido às melhores características de processamento dos polímeros.
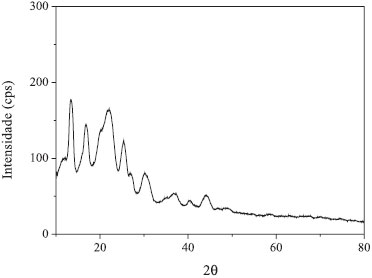 Figura 4. Análise de DRX do PHA obtido por 72 h de fermentaçao de GBRB por C. necator IPT 026 em agitador orbital a 35 ºC
Análise Termogravimétrica (TGA) A análise de TGA permitiu determinar a temperatura de início de degradação térmica, a temperatura máxima de degradação e a porcentagem de perda de massa do PHA produzido a partir da GBRB. A determinação da temperatura máxima de degradação foi feita com base na 1ª derivada (DTG). A Figura 5 apresenta as curvas TGA e DTG do PHA analisado.
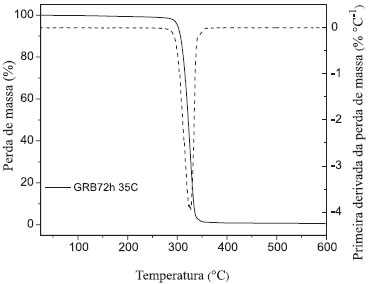 Figura 5. Curvas TGA e DTG do PHA obtido por 72 h de fermentaçao de GBRB por C. necator IPT 026 em agitador orbital a 35 ºC
A Figura 5 mostra que a degradação térmica do polímero ocorre em um único evento de perda de massa envolvendo apenas um passo de degradação. A Tabela 4 apresenta os valores das temperaturas de início de degradação (Ti), temperaturas máximas de degradação (Tpico) e percentual de perda de massa, obtidos a partir das curvas da Figura 5.

A temperatura inicial de degradação determinada para o PHA obtido por fermentação da GBRB foi de 306,33 ºC. O polímero produzido apresentou maior estabilidade térmica quando comparado ao PHA produzido por fermentação de glicerol por Burkholderia cepacia ATCC 17759, que apresentou temperatura incial de degradação de 268,6 ºC,27 e ao PHA obtido por fermentação de sacarose de beterraba, cuja temperatura inicial de degradação foi de 255,14 ºC.28 É interessante ressaltar que a alta temperatura de decomposição encontrada para o PHA obtido com GBRB é um fator atrativo comercialmente, uma vez que esta característica favorece sua aplicação em processos de moldagem por extrusão e sob altas temperaturas, possibilitando a produção de filmes biodegradáveis, por exemplo, o que representa uma alternativa à utilização de plásticos de origem petroquímica. Determinação da massa molar por Cromatografia Líquida de Alta Eficiência - Índice de Refração (CLAE-IR) A Figura 6 mostra o cromatograma obtido por CLAE-IR para o PHA produzido a partir da GBRB. A massa molar determinada para o polímero foi de 630 kDa.
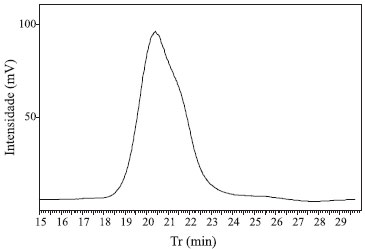 Figura 6. Cromatograma CLAE-IR do PHA obtido por 72 h de fermentaçao de GBRB por C. necator IPT 026 em agitador orbital a 35 ºC
O valor de MM encontrado é compatível com outros citados na literatura29,30 para PHAs produzidos a partir de glicerina por C. necator e todos possuem a mesma ordem de grandeza (620 - 750 kDa) em comparação com polímeros obtidos através do uso de açúcares como fontes de carbono na fermentação.31 As diferentes massas molares dos polímeros podem influenciar as propriedades físicas, mecânicas, térmicas, reológicas e de processamento. Além disso, esta característica pode ser determinada de acordo com as diferentes condições de produção. Assim, devido à grande competição industrial, ressalta-se a importância da capacidade de controlar a massa molar dos polímeros durante a produção e de compreender como as influências deste parâmetro interferem nas propriedades finais do polímero. Composição química por Cromatografia Gasosa - Espectrometria de Massas (CG-EM) A Figura 7 contém o cromatograma obtido por CG-EM do PHA produzido por fermentação da GBRB com C. necator IPT 026 em agitador orbital a 35 ºC por 72 h. Os picos referentes aos tempos de retenção (Tr) são característicos dos metil-ésteres de hidroxialcanoatos formados por clivagem do grupo funcional hidroxila por meio da reação de metanólise realizada previamente.32 A Tabela 5 mostra a composição química do polímero analisado.
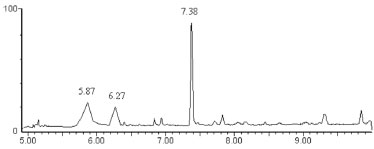 Figura 7. Cromatograma CG-EM dos ésteres metílicos do PHA obtido por 72 h de fermentaçao de GBRB por C. necator IPT 026 em agitador orbital a 35 ºC

A Tabela 5 e a Figura 7 mostram que o PHA produzido a partir de GBRB apresentou 36,57% do constituinte identificado como 8-hidroxinonanoato (Tr = 7,38 min); 34,68% referentes ao constituinte 3-hidroxibutirato (3HB) (Tr = 5,87 min); e 16,35% correspondentes ao 3-hidroxipentanoato (Tr = 6,27 min), além de outros picos não identificados (N.I.). Um estudo realizado por CG-EM mostra que o Polihidroxibutirato (PHB) produzido por fermentação de sacarose de beterraba por Alcaligenes latus apresentou 80,15% de constituição por monômeros hidroxibutirato (HB) referentes aos ésteres propílicos de ácido hidroxibutírico presentes no cromatograma.28 Em contrapartida, o PHA produzido com GBRB apresentou composição diversificada por monômeros de cadeias carbônicas maiores (3-hidroxipentanoato e 8-hidroxinonanoato), além de uma menor porcentagem de 3-hidroxibutirato (Tabela 5). Esta diferença na composição química pode influenciar as propriedades térmicas e mecânicas dos polímeros, uma vez que a constituição monomérica dos PHAs depende do substrato e dos nutrientes que compõem o meio fermentativo, além do micro-organismo produtor. A produção de PHA a partir de ácido oleico pela bactéria Pseudomonas aeruginosa, por exemplo, resultou na produção de PHA constituído, majoritariamente, pelos monômeros 3-hidroxioctanoato e 3-hidroxidecanoato, além de monômeros de cadeia insaturada.33 Assim, a variação na composição e no comprimento das cadeias de carbono dos polímeros pode determinar as diversas aplicações dos PHAs, de acordo com as diferentes propriedades apresentadas. Desta forma, nota-se que as seleções do micro-organismo produtor e das condições de fermentação, como tempo e temperatura, resultaram no aumento da biomassa celular e da produção de PHA por fermentação de GBRB por C. necator IPT 026. Estas condições determinadas em agitador orbital podem, então, ser adaptadas à produção do polímero em escala de reator (capacidade > 4 L), possibilitando obter maiores quantidades de polímero. Entretanto, o aumento do rendimento de produção de PHA pode, ainda, estar relacionado à escolha de um método de extração mais eficaz para a recuperação do polímero das células bacterianas, sendo uma alternativa descrita na literatura o método que emprega liofilização das células seguida do uso de clorofórmio. Assim, o emprego deste método de recuperação de PHAs pode contribuir para a obtenção de resultados mais precisos e condizentes com o potencial de aplicação de GBRB como substrato fermentescível na produção destes biopolímeros.
CONCLUSÃO A utilização de GBRB como substrato alternativo fermentescível possibilitou a produção de PHA por linhagens bacterianas de Cupriavidus necator, com maior produção obtida por C. necator IPT 026 por meio de fermentação realizada em agitador orbital nas condições de tempo e temperatura de 72 h e 35 ºC. O PHA obtido nestas condições apresentou temperatura inicial de degradação e de fusão de 306,33 ºC e 177,9 ºC, respectivamente, e 55% de cristalinidade. Além disso, este polímero apresentou três diferentes metil-ésteres de hidroxialcanoatos em sua composição química e um valor de massa molar de 630 kDa. Estes resultados mostram a possibilidade de aplicação de GBRB na produção de PHA, o que representa uma forma de agregar valor a este co-produto da indústria do biodiesel, além de possibilitar a redução dos custos de produção do polímero.
AGRADECIMENTOS Os autores agradecem à CAPES pelo apoio financeiro por meio do projeto NANOBIOTEC 757/09.
REFERÊNCIAS 1. Ramsay, B. A.; Proceedings of The Symposium on Physiology, Kinetics, Production and Use of Biopolymers, Seggau, Austria, 1994. 2. Lee, S. Y.; Biotechnol. Bioeng. 1996, 49, 1. 3. Reddy, C. S. K.; Ghai, R.; Kalia, R.V.C.; Bioresour. Technol. 2003, 87, 137. 4. Khardenavis, A. A.; Kumar, M. S.; Mudliar, S. N.; Chakrabarti, T.; Bioresour. Technol. 2007, 98, 3579. 5. Da Silva, L. F.; Gomez, J. G. C.; Rocha, R. C. S.; Taciro, M. K.; Pradella, J. G. C.; Quim. Nova 2007, 30, 1732. 6. Fiorese, M. L.; Tese de Doutorado, Universidade Federal de Santa Catarina, Brasil, 2008. 7. Kim, B. S.; Enzyme Microb. Technol. 2000, 27, 774. 8. Khanna, S.; Srivastava, A.K.; Process Biochem. 2005, 40, 2173. 9. Thompson, J. C.; He, B. B.; Appl. Eng. Agric. 2006, 22, 261. 10. Ashby, R. D.; Solaiman, D. K. Y.; Strahan, G. D.; J. Am. Oil. Chem. Soc. 2011, 88, 949. 11. Bligh, E. G.; Dyer, W. J.; Can. J. Biochem. Physiol. 1959, 37, 911. 12. (Association of Official Analytical Chemists) A.O.A.C. Em Official Methods of Analysis of AOAC International; Horwitz, W., ed.; 16th ed., Gaithersburg, 1997. 13. Aragão, G. M. F.; Lindley, N.D.; Uribellarea, J.L.; Pareilleux, A.; Biotechnol. Lett. 1996, 18, 937. 14. Brandl, H.; Gross, R.A.; Lenz, R.W.; Fuller, R.C.; Appl. Environ. Microbiol. 1988, 54, 1977. 15. Braunegg, G.; Sonnleither, B.E.; Lafferty, R.M.; Appl. Microbiol. Biotechnol. 1978, 6, 29. 16. Anderson, A. J.; Dawes, E. A.; Microbiol. Rev. 1990, 54, 450. 17. Delgado, C. C. R.; Dissertação de Mestrado, Universidade de São Paulo, Brasil, 2006. 18. Dalcanton, F.; Ienczak, J. L.; Fiorese, M. L.; Aragão, G. M. F.; Quim. Nova 2010, 33, 552. 19. Koller, M.; Bona, R.; Chiellini, E.; Grillo, E.; Horvat, P.; Kutschera, C.; Hesse, P.; Braunegg, G.; Bioresour. Technol. 2008, 99, 4854. 20. Pandian, S. R.; Deepak, V.; Kalishwaralal, K.; Rameshkumar, N.; Jeyaraj, M.; Gurunathan, S.; Bioresour. Technol. 2010, 101, 705. 21. Spier, V. C.; Dissertação de Mestrado, Universidade do Estado de Santa Catarina, Brasil, 2005. 22. Galego, N.; Rozsa, C.; Sánchez, R.; Fung, J.; Vásquez, A.; Tomás, J.S.; Polym. Test. 2000, 19, 485. 23. Formolo, M. C.; Vogelsanger-Jr, N.; Schneider, A. L.; Furlan, S. A.; Aragão, G. M. F.; Pezzin, S. H.; Pezzin, A. P. T.; Anais do VII Congresso Brasileiro de Polímeros, Belo Horizonte, Brasil, 2003. 24. Dobroth, Z. T.; Hu, S.; Coats, E. R.; McDonald, A.; Bioresour. Technol. 2011, 102, 3352. 25. Gomez, J. G. C.; Bueno Netto, C. L.; Braz. J. Chem. Eng. 1997, 17, 24. 26. Bengtsson, S.; Pisco, A. R.; Johansson, P.; Lemos, P.C.; Reis, M. A. M.; J. Biotechnol. 2010, 147, 172. 27. Zhu, C.; Nomura, C. T.; Perrota, J.; Stipanovic, A. J.; Nakas, J.P.; Biotechnol. Prog. 2010, 26, 424. 28. Wang, B.; Sharma-Shivappa, R. R.; Olson, J. W.; Khan, S.A.; Ind. Crops Prod. 2013, 43, 802. 29. Mothes, G.; Schnorpfeil, C.; Ackermann, J. U.; Eng. Life Sci. 2007, 7, 475. 30. Cavalheiro, J. M. B. T.; de Almeida, M. C. M. D.; Grandfils, C.; da Fonseca, M.M.R.; Process Biochem. 2009, 44, 509. 31. Madden, L. A.; Anderson, A. J.; Shah, D. T.; Asrar, J.; Int. J. Biol. Macromol. 1999, 25, 43. 32. Choi, J.; Lee, S. Y.; Bioprocess Eng. 1997, 17, 335. 33. Dalal, J.; Sarma, P. M.; Mandal, A. K.; Lal, B.; Biomass Bioenerg. 2013, 54, 67. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access