Educação
|
|
| Alterações em medicamentos mal acondicionados: uma estratégia para desenvolver habilidades investigativas, comunicação científica e interdisciplinaridade nas aulas de química Alterations in inappropriately stored drugs: a strategy to develop investigative skills, scientific communication and interdisciplinarity in chemistry classes |
|
Jaqueline R. Maluta#,* Departamento de Química, Instituto de Ciências Exatas, Naturais e Educação, Universidade Federal do Triângulo Mineiro, Av. Dr. Randolfo Borges Júnior, 1400, Campus Univerdecidade - Unidade II, 38064-200 Uberaba - MG, Brasil Recebido em 14/11/2013 *e-mail: ruizjp@iqsc.usp.br The chemist must master a number of abilities. These include a solid knowledge of theory and the capacity to devise theoretical problems. The chemist is also expected to solve problems. In order to improve these abilities, this work aimed to evaluate several tools, such as the use of contextualization, problem-based learning and the interdisciplinary approach. In the methodology developed, undergraduate students had to investigate and propose a hypothesis, suggesting how physical changes took place in inappropriately stored drugs. The interdisciplinary approach is achieved by connecting public interest, chemistry, biology and pharmacology concepts. The tools can improve these abilities required for a well-prepared chemist. INTRODUÇÃO Relatos das dificuldades dos alunos em assimilar alguns assuntos de química são frequentes e encontrar alternativas para ensinar os conteúdos teóricos é uma das primeiras funções do professor. No entanto, além da compreensão da química, diversas outras habilidades devem ser desenvolvidas durante a graduação para que o profissional formado esteja realmente habilitado a exercer suas atribuições, como por exemplo, formulação de problemas, busca de soluções e transferência desses conhecimentos especializados à sociedade.1 Assim, o professor deve sempre procurar metodologias inovadoras de ensino a fim de estar preparado para facilitar o aprendizado dos conteúdos de química, além de desenvolver as habilidades que serão exigidas do aluno em sua vida profissional. Diversas metodologias podem ser exploradas na tentativa de melhorar o ensino. Dentre elas, a contextualização do ensino de química mostrou ser um importante facilitador de aprendizagem em diversos trabalhos em que foram utilizados temas de interesse dos alunos na exemplificação de importantes processos químicos.2-5 Outra ferramenta bastante explorada é a aprendizagem baseadas em problemas,6-8 uma das muitas abordagens de ensino que tornam a aprendizagem uma tarefa significativa. Tal abordagem utiliza problemas do mundo real e estimula os estudantes a serem responsáveis pela própria aprendizagem, cabendo ao professor a função de facilitador e guia desta pesquisa. Além das metodologias citadas acima, a interdisciplinaridade também é usada frequentemente como ferramenta facilitadora do ensino.4 Esta abordagem desperta o interesse do aluno, pois quando um mesmo assunto é tratado em várias áreas do conhecimento, uma maior compreensão é alcançada.
MOTIVAÇÃO Este trabalho buscou associar as três ferramentas anteriores com o objetivo de facilitar o ensino da química no nível de graduação. A química permite compreender os fenômenos que ocorrem ao nosso redor ao nível molecular e atômico. Assim, alterações que ocorreram em comprimidos de um conhecido multivitamínico e multimineral mal acondicionados são uma maneira de obter a contextualização necessária para aproximar assuntos abordados em sala de aula ao dia a dia dos alunos. Esta contextualização ganhou destaque por ser um assunto pouco explorado. A alteração das características visuais do comprimido é real e ocorre em poucos dias. O suplemento em questão é conhecido, possui preço acessível e sua venda não necessita de prescrição médica. Além do mais, um estudo realizado por Santos e Barros-Filho9 com estudantes da Universidade de São Paulo mostrou que 30% dos entrevistados usavam vitaminas com a justificativa de garantir a saúde. Assim, trata-se de um assunto de grande interesse do público alvo. Outra vantagem é o fato do tema possibilitar uma abordagem interdisciplinar nas aulas de química, relacionando assuntos como reações orgânicas radicalares, reações de oxirredução, moléculas anidras e hidratadas, estabilidade de moléculas, ação de moléculas antioxidantes, metabolismo, preparo e conservação de medicamentos, nutrição, saúde e bem estar. Finalmente, optou-se em propor uma situação-problema em que, em lugar dos tradicionais textos utilizados,10 entrega-se aos alunos um comprimido com as alterações e outro recém-retirado da embalagem original, o que fez com que aumentasse seu interesse. Com esse tipo de abordagem, o aluno foi estimulado a pensar como um pesquisador de maneira instintiva, buscando soluções baseadas em conhecimentos prévios e/ou buscando respostas em veículos de informação confiáveis, em lugar do mero conhecimento popular.
O QUE ABORDAR EM SALA DE AULA Sobre radicais livres e os antioxidantes A ação deletéria dos radicais livres é a justificativa mais explorada pela indústria de suplementos alimentares e cosméticos para vender seus produtos. Os radicais livres são tidos como os grandes vilões na geração de doenças e no processo de envelhecimento.11 Já os antioxidantes são conhecidos como a solução para todos os problemas gerados pelos radicais livres.12 Apesar de muito difundidos, os dois termos geram dúvidas e devem ser abordados, em sala de aula, relacionando a função biológica e a estrutura química. Radicais livres são espécies que possuem um ou mais elétrons desemparelhados, altamente instáveis, com meia-vida curta e muito reativas. São exemplos de radicais livres o oxigênio singlete (1O2) e o radical hidroxila (OH·).13 A geração destas moléculas ocorre naturalmente devido à reações do metabolismo celular e o organismo possui defesas naturais contra elas. No entanto, algumas situações aumentam a concentração dos radicais livres, como por exemplo exposição ao ozônio, à radiação ultravioleta e a inalação de fumaça de cigarro. O desequilíbrio entre moléculas oxidantes e antioxidantes resulta em danos celulares e é chamado de estresse oxidativo.13 Os radicais livres lesam as células de modo direto ou danificam os ácidos nucléicos e as proteínas, tornando-os mais suscetíveis à degradação,14 processo que têm sido associado a doenças degenerativas, envelhecimento precoce e carcinogênese.13 Por exemplo, o radical hidroxila (OH·) pode começar uma reação em cadeia, removendo um hidrogênio da membrana lipídica (L). O radical lipídico (L·) formado combina-se com o oxigênio (LOO·) e continua a peroxidação lipídica, atacando os lipídios adjacentes como visto na Figura 1.15,16
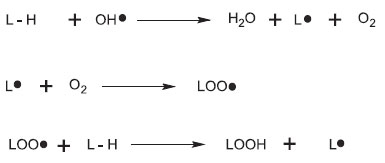 Figura 1. Reação em cadeia iniciado pelo radical hidroxila, adaptado de Tappel16
Os radicais livres formados no organismo podem ser interceptados por moléculas antioxidantes, como por exemplo as vitaminas C, E, A e a glutadiona, que, quando presente em baixas concentrações em relação ao substrato oxidável, atrasa ou inibe significativamente a oxidação deste substrato.17 Sobre vitaminas Do ponto de vista biológico, as vitaminas são substâncias presentes nos alimentos e que são utilizadas direta e indiretamente pelo organismo para manter sua estrutura18,19 e funcionamento. São substâncias de natureza química variada,20 cujas principais funções englobam a interferência em vias metabólicas atuando como coenzimas (Vitamina B1),21 atuação como hormônios (vitaminas A e D)22 e a proteção do organismo ao agirem como antioxidantes (vitamina E).23 O caráter antioxidante pode ser exemplificada pela ação da vitamina E, que é um conjunto de diferentes moléculas, em geral tocoferóis e tocotrienóis.23 A Figura 2 apresenta a ação do α-tocoferol na proteção das membranas lipídicas contra os radicais livres. Os radicais LOO· que podem ser gerados segundo esquema representado na Figura 2, ao reagirem com o α-tocoferol geram o radical tocoferoxila, altamente instável, que reage com os radicais LOO·, interrompendo a reação em cadeia.
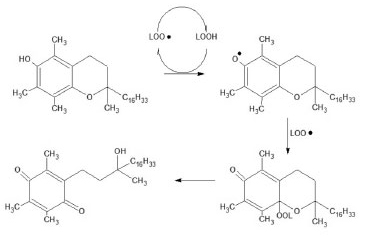 Figura 2. Ação antioxidante do α-tocoferol no organismo, modificado de Siese colaboradores17
Sobre minerais Um balanço mineral apropriado no organismo humano é considerado fundamental para se prevenir, assim como corrigir problemas de saúde.24 Alguns minerais são necessários em quantidades maiores do que 100 mg/dia, como é o caso dos compostos de cálcio, magnésio, fósforo, sódio, potássio, enxofre e cloro. Outros minerais são chamados de oligoelementos, os quais são necessários em quantidades inferiores a 100 mg/dia, incluindo os derivados de ferro, iodo, cobre, manganês, zinco, molibdênio, selênio e cromo.25,26 Atualmente, 30 elementos são conhecidos como essenciais. Estes executam funções vitais como transporte e ativação do oxigênio27, transporte de elétrons28, função estrutural29 e centro catalítico em processos de oxirredução e ácido-base.30 Por exemplo, o fósforo, um não-metal localizado na família 5A, é essencial para vida. Grupos fosfatos fazem parte dos ácidos nucleicos, e portanto estão ligados ao armazenamentos e transmissão de informação genética. Os grupos fosfatos também estão envolvidos no armazenamento celular de energia participando formação e conversão de trifosfato de adenosina (ATP) a difosfato de adenosina (ADP), como ilustrado na Figura 3.31,32
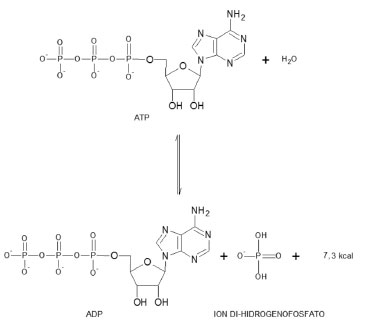 Figura 3. Importância do fosfato no processo energético celular, modificado de Bettelheime colaboradores31
Algumas características químicas dos compostos presentes no suplemento É importante ressaltar para os alunos algumas características químicas dos compostos presentes no suplemento para que os mesmos possam seguir um caminho na avaliação dos possíveis eventos químicos que ocorreram durante a degradação do comprimido. Partindo da composição do comprimido (Material Suplementar) podem ser abordadas características físicas e de reatividade, com base no conteúdo de livros de química inorgânica, como por exemplo o texto de Atkins33 e o de Lee.34 Os metais alcalinos (1A) e alcalinos terrosos (2A), presentes na forma de sais no comprimido, possuem a característica de existirem em apenas um estado de oxidação, M+1 e M+2, respectivamente. Também estão presentes sais de metais de transição, cuja principal característica é a possibilidade de existirem em diversos estados de oxidação, os quais diferem em uma unidade. Por não possuírem número de oxidação variável, não esperamos que os sais da família 1A e 2A sofram reações de redox facilmente. Já os de metais de transição tendem a sofrer reações de redox facilmente, e tais íons metálicos possuem grande tendência a formar complexos com ligantes (grupos capazes de doar um par de elétrons). Essa característica é o que torna alguns íons de metais de transição essenciais ao organismo, uma vez que esses íons coordenam-se com proteínas, ácidos nucleicos, lipídios e outras moléculas, influenciando o seu funcionamento.33 O comprido degradado apresentou alterações visíveis de coloração despertando o seguinte questionamento por parte dos alunos: "Porque as substâncias apresentam cores diferentes?". A partir desta pergunta, abordou-se assuntos relacionados com as cores das substâncias. As cores dos compostos estão relacionadas com transições eletrônicas. Por exemplo, os compostos iônicos, quando formados pela combinação de cátions das famílias 1A e 2A, com ânions de não-metais, geralmente são brancos. Isso ocorre pois os cátions formados possuem configuração de gás nobre, nos quais a energia necessária para ocorrer transições eletrônicas é muito grande. Assim sendo, geralmente formam compostos iônicos brancos. Somente serão coloridos os compostos em que o ânion é responsável pela cor. Em contraste com as substâncias derivadas dos elementos das famílias 1A e 2A, muitos compostos iônicos e covalentes dos metais de transição são coloridos. Essa cor pode resultar do fato de as camadas d ou f estarem incompletas, o que permitem transições eletrônicas de energia compatível com frequências da luz visível. A magnitude da diferença de energia dos orbitais envolvidos nas transições eletrônicas é o fator determinante da cor destes compostos, e é fortemente influenciada pelo ambiente ao redor de íon central. Assim, na presença de solventes, ligantes ou outros íons, as energias dos orbitais d serão alteradas, o que explica porque um mesmo metal apresenta cores diferentes, dependendo dos componentes da substância.33,34 Alguns exemplos desses efeitos nos compostos de cromo III estão listados na Tabela 1.
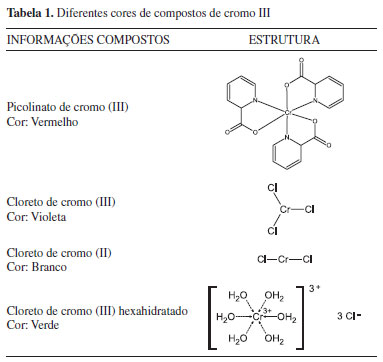
A cor também pode ser devida a defeitos nos sólidos, ou então, a uma transferência de carga. Quando um complexo absorve a radiação correspondente à transferência de um elétron de um ligante para os orbitais d do átomo central ou vice-versa, pode haver emissão de radiação de diferentes comprimentos de onda. Por exemplo, os óxidos de ferro são vermelhos e amarelos devido à transição ϖp do ligante para 3d do metal. Sobre conservação de medicamentos Outro assunto importante a ser abordado é a conservação de medicamentos ou suplementos, uma vez que foi a má conservação do suplemento que provocou a alteração de coloração observada. Antes da comercialização de um medicamento, estudos são feitos com relação ao modo de conservação e tempo de validade. Todas estas informações estão na embalagem do produto e devem ser rigorosamente seguidas pelos consumidores. O período de validade de um medicamento ou suplemento é determinado com base no tempo em que pode ser estocado antes que haja produtos de degradação em quantidade suficiente para representar risco ou diminuição de sua atividade.35 As condições físicas de acondicionamento geralmente são especificadas na embalagem e, segundo Waterman e colaboradores,35 alguns fatores aceleram a degradação química tornando o medicamento ou suplemento impróprios para o consumo até mesmo antes do tempo pré-determinado. Uma das condições a serem avaliadas é a temperatura, a qual pode levar ao aumento da velocidade de algumas reações, alterações de fase (ex: liquefação, vaporização) e alterações de pH. A umidade também tem um efeito significativo no processo de degradação de medicamentos, geralmente levando à formação de compostos hidratados ou provocando a sua solubilização. O processo de degradação é acelerado já que íons hidratados possuem uma maior mobilidade, afetando a frequência das colisões e resultando em um aumento da velocidade das reações. Além disso, na presença de água algumas substâncias podem ser hidrolisadas.35 Processos de oxidação também são importantes na degradação de medicamentos e podem ocorrer com o oxigênio do ar ou moléculas oxidantes presentes. A exposição à luz também pode levar a uma degradação fotoquímica e também deve ser evitada.35 A exposição dos medicamentos ou suplementos em ambientes úmidos e quentes levam ao crescimento de microorganimos. Este tipo de contaminação também é importante pois pode levar à instabilidade da formulação e geração de produtos inadequados para o consumo humano.36 Sobre suplementos vitamínicos e minerais Trata-se de um senso comum a correlação entre o bem-estar e uma alimentação balanceada, com um consumo equilibrado de vitaminas e minerais. Já nas décadas de 60 e 70, o químico americano Linus Pauling, Prêmio Nobel de Química em 1954, e da Paz em 1962, explorou largamente os benefícios da vitamina C (ácido ascórbico) como prolongador da juventude,37 no combate de gripe e resfriados38 e no tratamento de câncer.39,40 Apesar de ser do conhecimento das pessoas há muito tempo, o interesse em alimentação saudável e complementação alimentar tem aumentado atualmente, principalmente entre os jovens. Devido à crescente preocupação com saúde, surgiram os suplementos vitamínicos/minerais, os quais são definidos segundo a Portaria nº 32, de 1998, do Ministério da Saúde41 como alimentos que servem para complementar a dieta diária de uma pessoa saudável. Estes devem ser utilizados em casos onde a ingestão de alimentos é insuficiente ou quando a dieta requer suplementação. Também determina-se que o suplemento deve conter de 25 a 100% da ingestão diária recomendada de cada composto. A necessidade de suplementação da dieta com as vitaminas e minerais citados ainda é controversa, muitos afirmam que o necessário é obtido facilmente com a alimentação e que a suplementação é desnecessária. No entanto, em pesquisa realizada com moradores de São Paulo - SP, com idade entre 20 e 60 anos, constatou-se que 99% dos indivíduos pesquisados não consomem a quantidade de cálcio e vitamina D recomendada. Também, 80% dos indivíduos não consomem as quantidades necessárias de magnésio e vitamina K e 50% não consomem quantidades necessárias de vitamina A.42 Essa carência geralmente é associada aos novos padrões de vida nos grandes centros urbanos, nos quais as pessoas passam o dia todo fora de casa e alimentam-se mal, o que justifica a grande busca por algum tipo complementação na dieta. Segundo Muth e colaboradores, 25 a França lidera a importação de suplementos vitamínicos com um gasto 109 milhões de dólares em 1997, e o Japão lidera a importação de minerais com um gasto 77 milhões de dólares no mesmo ano.
METODOLOGIA Conforme o ciclo de aprendizagem centrada em problemas, apresentado por Hmelo-Silver,6 propõem-se a seguinte metodologia de ensino baseada em etapas. Na primeira etapa do projeto, deve-se apresentar um problema que instigue a curiosidade dos alunos. Para tal finalidade, antes de iniciar a disciplina, comprimidos de um suplemento multivitamínico / multimineral devem ser armazenados em um porta-comprimidos e deixados sob intemperes naturais tais como, alteração de umidade e temperatura. Após aproximadamente uma semana, algumas alterações visuais puderam ser observadas e foram intensificadas com maior tempo de exposição, tal como pode ser visto na Figura 4.
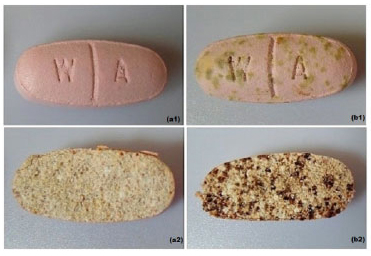 Figura 4. Comprimidos (a) recém-retirado da embalagem original e (b) após duas semanas fora da embalagem original
Na primeira aula, após a apresentação da disciplina, entrega-se à sala comprimidos do suplemento recém-retirados da embalagem original e comprimidos mantidos fora de sua embalagem original. Como atividade extraclasse, os alunos devem ser orientados a se reunirem e preparar uma lista contendo todas as perguntas que porventura tenham surgido ao observar os comprimidos. Como segunda etapa do projeto, propõem-se a apresentação de possíveis questões que surgiram com o problema apresentado, seguida por uma discussão dirigida em sala de aula. O professor pode, durante a discussão, sugerir temas focando nas seguintes áreas:
Em uma terceira etapa, os alunos devem ser instruídos a se reunirem e gerarem uma hipótese para o problema "Qual/quais componentes do suplemento sofreram alteração?" Na quarta etapa, solicita-se aos alunos a elaboração de um texto sobre o assunto, abordando os temas, relativos a diversas áreas, que haviam sido elaborados em sala de aula. Os textos devem ser discutidos em sala de aula, a fim de se identificar lacunas no conhecimento, trocar informações e complementar o texto original. Com isso, todos os alunos podem adquirir uma base teórica forte e aprimorar habilidades de exposição em público. A quinta etapa contempla a elaboração de um texto escrito com todo o material coletado, aplicando novos conhecimentos na resolução final do problema. A atividade de escrever, rever o texto e reescrevê-lo é muito importante, pois mostra ao aluno que escrever é um trabalho árduo e que, raramente, é realizado em uma única etapa. Um bom texto deve ser lido e reescrito várias vezes, até que se atinja um padrão ideal. A sexta etapa proposta é a apresentação de um seminário final, seguida de uma discussão em sala de aula, o que permite a abstração dos conhecimentos adquiridos com a atividade proposta. Também esta etapa é uma atividade importante, pois desenvolve a habilidade de transferência de conhecimento à sociedade.
CONCLUSÃO A utilização da situação-problema descrita neste trabalho, visando explorar reações de oxirredução mostrou-se interessante, pois difere das abordagens tradicionais sobre pilhas e baterias, entrando em um campo inusitado e de grande interesse para os dos jovens. Além disso, pode ser utilizada em diversas disciplinas de graduação, sendo que uma maior ênfase poderia ser dada nas áreas específicas da disciplina. Por exemplo, aulas de química inorgânica podem explorar as características dos elementos e a formação de complexos. Outra possibilidade seria a utilização em aulas experimentais, possibilitando a realização de experimentos para testar as hipóteses geradas.
MATERIAL SUPLEMENTAR Algumas informações sobre os componentes do comprimido estão disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
REFERÊNCIAS 1. Zucco, C.; Pessine, F. B.; Andrade, J. B.; Quim. Nova 1999, 3, 454. 2. Ferreira, E.; Montes, R.; Química Nova na Escola 1999, 53, 550. 3. Braathen, C.; Química Nova na Escola 1997, 5, 1. 4. Dias-Filho, C. R.; Antedomenico, E.; Química Nova na Escola 2010, 32, 1. 5. Bocchi, N.; Ferracin, L. C.; Biaggio, S. R.; Química Nova na Escola 2000, 11, 1. 6. Hmelo-Silver, C. E.; Educational Psychology Review 2004, 3, 235. 7. Shelton, J.; Smith, R.; Research in Science & Technological Education 1998, 1, 19. 8. Pérez, D. G.; Torregrosa, J. M.; European Journal of Science Education 1983, 4, 447. 9. Santos, K. M. O.; Barros-Filho, A. A.; Revista de Saúde Pública 2002, 2, 250. 10. Sá, L. P.; Francisco, C. A.; Queiroz, S. L.; Quim. Nova 2007, 3, 731. 11. Ferreira, A.; Matsubara, L.; Revista da Associação Médica Brasileira 1997, 1, 61. 12. Di Mascio, P.; Murphy, M. E.; Sies, H.; American Society of Clinical Nutrition 1991, 1, 194S. 13. Bianchi, M. L. P.; Antunes, L. M. G.; Rev. Nutr. 1999, 2, 123. 14. Leite, H. P.; Sarni, R. S.; Revista Brasileira de Nutrição Clínica 2003, 2, 60. 15. Halliwell, B.; Gutteridge, J.; Trends Biochem. Sci. 1986, 9, 372. 16. Tappel, A. L.; Ann. N. Y. Acad. Sci. 1972, 1, 12. 17. Sies, H.; Stahl, W.; American Society of Clinical Nutrition 1995, 6, 1315S. 18. Girgis, C. M.; Clifton-Bligh, R. J.; Hamrick, M. W.; Holick, M. F.; Gunton, J. E.; Endocr. Rev. 2013, 1, 33. 19. Magalhães, M. S. F.; Fechine, F. V.; Macedo, R. N. D.; Monteiro, D. L. S.; Oliveira, C. C.; Brito, G. A. D. C.; Moraes, M. E. A. D.; Moraes, M. O. D.; Acta Cir. Bras. 2008, 3, 262. 20. Repollo, C.; Hernández, V.; Carrieri, R.; Viera, M.; Salhá, B; Sansone, S.; Enseñanza de las Ciencias 2005, 1, 133. 21. Guilland, J.-C.; La Revue du Praticien 2013, 8, 1074. 22. Reichrath, J.; Lehmann, B.; Carlberg, C.; Varani, J.; Zouboulis, C.; Horm. Metab. Res. 2007, 2, 71. 23. Brigelius-Flohé, R.; Traber, M. G.; The FASEB Journal 1999, 10, 1145. 24. Carneiro, M. T. W. D.; Silveira, C. L. P.; Miekeley, N.; Fortes, L. M. C.; Quim. Nova 2002, 1, 37. 25. Muth, M. K.; Anderson, D. W.; Domanico, J. L.; Smith, J. B.; Wendling, B.; Economic Characterization of the Dietary Supplement Industry, 1st ed., Center for Food Safety and Administration: Washington, 1999. 26. Soetan, K. O.; Olaiya, C. O.; Oyewole, O. E.; Afr. J. Food Sci. 2010, 5, 200. 27. Santhirapala, V.; Williams, L.; Tighe, H.; Jackson, J.; Shovlin, C.; Thorax 2013, 68, A24. 28. Kato, S.; Hashimoto, K.; Watanabe, K.; Microbes Environ. 2013, 28, 141. 29. Vallet-Regí, M.; González-Calbet, J. M.; Prog. Solid State Chem. 2004, 1, 1. 30. Baran, E. J.; Química Nova na Escola - Cadernos Temáticos 2005, 6, 1. 31. Bettelheim, F. A.; Brown, W. H.; Farrell, S. O.; Campbell, M. K.; Introdução a química geral, orgânica e bioquímica, 9th ed., CENGAGE: São Paulo, 2012. 32. Domingos, J. B.; Longhinotti, E.; Machado, V. G.; Nome, F.; Quím. Nova 2003, 5, 745. 33. Atkins, P.; Overton, T.; Shriver and Atkins' Inorganic Chemistry, 5th ed., W. H. Freeman and Company: New York, 2010. 34. Lee, J. D.; Química inorgânica não tão concisa, 1st ed., Edgard Blucher: São Paulo, 1999. 35. Waterman, K. C.; Adami, R. C.; Int. J. Pharm. 2005, 1, 101. 36. Roy, J.; AAPS PharmSciTech 2002, 2, 1. 37. Pauling, L.; Proc. Natl. Acad. Sci. U. S. A. 1970, 4, 1643. 38. Pauling, L.; Vitamin C, the common cold, and the flu, WH Freeman: San Francisco, 1976. 39. Cameron, E.; Pauling, L.; Leibovitz, B.; Cancer Res. 1979, 3, 663. 40. Cameron, E.; Pauling, L. C.; Cancer and vitamin C: a discussion of the nature, causes, prevention, and treatment of cancer with special reference to the value of vitamin C, 1th ed., Camino books: 1993. 41. http://portal.anvisa.gov.br, acessada em Novembro 2013. 42. Pinheiro, M. M.; Schuch, N. J.; Genaro, P. S.; Ciconelli, R. M.; Ferraz, M. B.; Martini, L. A.; Nutr. J. 2009, 6, 1. 43. Atkins, P. P. W.; De Paula, J.; Atkins' Physical Chemistry, 5th ed., Oxford University Press: New York, 2002.
#Endereço Atual: Departamento de Físico-Química, Instituto de Química de São Carlos, Universidade de São Paulo, Av. do Trabalhador Sã |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





