Artigo
|
|
| Método hidrometalúrgico para reciclagem de metais terras raras, cobalto, níquel, ferro e manganês de eletrodos negativos de baterias exauridas de Ni-MH de telefone celular Hydrometallurgical method for recycling rare earth metals, cobalt, nickel, iron, and manganese from negative electrodes of spent Ni-MH mobile phone batteries |
|
Vinicius Emmanuel de Oliveira dos Santos*, I; Vinicius Guilherme CelanteII; Maria de Fátima Fontes LelisI; Marcos Benedito José Geraldo de FreitasI
IDepartamento de Química, CCE, Universidade Federal do Espírito Santo, Av. Fernando Ferrari, 514, Vitória - ES, Brasil Recebido em 20/02/2013 *e-mail: viniciusemmanuel@hotmail.com A hydrometallurgical method for the recovery of rare earth metals, cobalt, nickel, iron, and manganese from the negative electrodes of spent Ni-MH mobile phone batteries was developed. The rare earth compounds were obtained by chemical precipitation at pH 1.5, with sodium cerium sulfate (NaCe(SO4)2.H2O) and lanthanum sulfate (La2(SO4)3.H2O) as the major recovered components. Iron was recovered as Fe(OH)3 and FeO. Manganese was obtained as Mn3O4.The recovered Ni(OH)2 and Co(OH)2 were subsequently used to synthesize LiCoO2, LiNiO2 and CoO, for use as cathodes in ion-Li batteries. The anodes and recycled materials were characterized by analytical techniques. INTRODUÇÃO As baterias Ni-MH têm sido ativamente pesquisadas desde 1950, como resultado do desenvolvimento de ligas de armazenamento de hidrogênio, mas não tiveram uso comercial até 1980. A preocupação ambiental cresceu no final da década de 1990, devido às restrições sobre a utilização de metais pesados, tais como chumbo, mercúrio, e cádmio. Isto levou ao desenvolvimento das chamadas baterias "verdes". De acordo com Zhang e colaboradores as baterias de Ni-MH foram desenvolvidas em 1989 e comercializadas principalmente no Japão em 1990.1 Estas baterias são ecologicamente corretas e podem substituir as baterias de Ni-Cd em muitas aplicações. As baterias secundárias de níquel-hidreto metálico são comumente usadas como fontes de energia em dispositivos eletrônicos, tais como: celulares, computadores e veículos elétricos híbridos.2,3 Há outras vantagens para as baterias Ni-MH, incluindo uma maior densidade de energia, taxas de carga/descarga mais elevadas, maior capacidade a baixa temperatura e a ausência de efeito memória.4,5 As baterias de íon - lítio foram produzidas pela Sony em 1991. Estas baterias têm substituído as baterias Ni-Cd e Ni-MH em muitas aplicações devido à sua alta densidade de energia, baixa taxa de auto-descarga e excelente ciclo de vida. Essas baterias também são aceitáveis em termos ambientais.6 A necessidade de baterias com alta eficiência energética que podem ser usadas com altas cargas e altas taxas de descarga tem aumentado o uso de baterias de íon - lítio. Como consequência, o consumo de baterias Ni-MH para telefones celulares e notebooks diminuiu. O descarte de baterias exauridas de Ni-MH tornou-se assim um assunto de interesse entre os pesquisadores. O elétrodo positivo de Ni-MH consiste em NiOOH/Ni(OH)2, juntamente com aditivos, tais como: o grafite e o cobalto que melhoram o seu desempenho. Cobalto tem a finalidade de recobrir as partículas de hidróxido de níquel, aumentando a diferença de potencial entre a reação desejada de oxidação do hidróxido de níquel e a reação indesejável de desprendimento de oxigênio no eletrodo positivo.7 O eletrólito é geralmente hidróxido de potássio, e os separadores consistem de poliamida, poliolefina ou uma mistura de ambos.8,9 O elétrodo negativo das baterias de Ni-MH utiliza hidrogênio absorvido em ligas de tipo AB2 ou AB5. As ligas do tipo AB2 mais estudadas podem ser compostas por Ti-Zr-V-Ni-Cr e/ou outros elementos, onde Ti e Zr representam o componente A.10 Paul Ruetschi e colaboradores relatam uma composição definida para as ligas AB2 como: V15Ti15Zr20Ni28Cr5Co5Fe6Mn6.11 Ligas AB2 possuem grande capacidade de armazenamento de hidrogênio e um melhor ciclo de vida do que as ligas convencionais do tipo AB5, contudo suas aplicações práticas são limitadas devido à energia de ativação lenta e elevado custo.12 Ligas AB5 contêm uma mistura de La, Pr, Nd, Ce, Ni e Co, conhecida comercialmente como mischmetal.13 As baterias de Ni-MH contêm quantidades significativas de metais valiosos, como os metais terras raras, Ni e Co. As quantidades de matérias-primas utilizadas na produção destas baterias são potencialmente muito grandes.14 Comercialmente as terras raras são usadas como aditivos em ligas de aço, ímãs permanentes, materiais de armazenamento de hidrogênio, discos de armazenamento ópticos, dispositivos magnéticos, raios catódicos eletroluminescentes e baterias domésticas. A importância de níquel no revestimento industrial é indicada pela grande quantidade de níquel que é consumida em cada ano em todo o mundo. Revestimentos de níquel são aplicados em automóveis, motocicletas, bicicletas e uma grande quantidade de bens de consumo. O cobalto é um metal crítico utilizado em várias aplicações industriais. O cobalto eletroquimicamente recuperado pode ser usado para fazer tanto ligas com propriedades magnéticas ou novos eletrodos para baterias.15 Assim, o seu preço tem aumentado consideravelmente devido à sua utilização como matéria-prima para os eletrodos positivos em baterias de íon - lítio. O alto consumo de cobalto levou à preocupação com o impacto ambiental devido à disposição inadequada de baterias no lixo municipal e tem levado muitos países a estabelecer normas sobre a prestação de tais produtos como as baterias. Como resultado, a reciclagem de baterias se tornou uma importante questão.16,17 Neste trabalho, um processo hidrometalúrgico para a reciclagem de metais de terras raras, níquel, cobalto, ferro e manganês presentes nos eletrodos negativos de baterias de telefones Ni-MH móveis foi desenvolvido. Os metais das terras raras foram recuperados como sais de sulfato. Níquel, cobalto, ferro e manganês foram recuperados como os seus hidróxidos ou óxidos. Posteriormente foi sintetizado a partir dos materiais recuperados, Ni(OH)2 e Co(OH)2, o composto LiCoO2, para confecção de cátodos de baterias de íon - lítio, sendo esta etapa a principal motivação deste trabalho. Os materiais recuperados foram caracterizados por difração de raios X (DRX), microscopia eletrônica de varredura (MEV), espectroscopia de infravermelho com transformada de Fourier (FT-IR) e com plasma indutivamente acoplado com espectroscopia de emissão óptica (ICP-OES).
PARTE EXPERIMENTAL Técnicas de caracterização Os espectros de difração de raios X (DRX) foram obtidos num difractômetro Shimadzu XRD-6000, modelo 20013. Foi usado radiação Ka de cobre com filtro de níquel correspondente a um comprimento de onda de 1.540 nm e velocidade de varredura de 0,5º por minuto. As micrografias foram obtidas por microscopia eletrônica de varredura (MEV) em um modelo Shimadzu SSX-50. Na espectroscopia de emissão óptica com plasma indutivamente acoplado (ICP - OES), foi usado o equipamento Varian 715 - ES. Dissolução do elétrodo negativo e precipitação dos metais de terras raras As baterias exauridas de Ni-MH foram fisicamente desmontadas e separados em ânodos, cátodos, separadores orgânicos e compartimentos de aço. O ânodo foi dissolvido usando uma relação massa - volume de 1,0 g do material ativo por 20 mL em uma solução de H2SO4 1,0 mol.L-1 com 5,0 mL de H2O2 30% v/v. A suspensão foi agitada constantemente a 298 K até a dissolução completa e, em seguida, filtrada. Os metais de terras raras, La e Ce, foram precipitados na solução por adição de NaOH 1,0 mol L-1 (pH 1,5) a uma taxa de 0,10 mL por minuto com agitação constante.18 As alterações no pH e condutividade foram medidas durante a precipitação dos metais de terras raras. O precipitado foi lavado e seco à temperatura ambiente e armazenado em um dessecador. Recuperação de cobalto, níquel, ferro e manganês A mistura resultante foi filtrada após a precipitação dos compostos de terras raras. Em seguida, uma solução de NH4OH 6,0 mol L-1 e HCl 6,0 mol L-1 foi adicionado à solução do filtrado para formar um tampão de pH 9,3. O ferro foi precipitado com hidróxido de sódio e separado por centrifugação a 2500 rpm durante 10 minutos. Na etapa seguinte, o precipitado de hidróxido de ferro foi lavado e seco. Uma solução de Na2S 1.0 mol L-1 foi então adicionada ao filtrado para precipitar CoS, ZnS, NiS e MnS. Os compostos MnS e ZnS foram dissolvidos pela adição de uma solução 1,0 mol L-1 de HCl. O CoS e NiS precipitados foram removidos por centrifugação a 2.500 rpm durante 10 minutos. Na solução contendo os íons de Zn2 + e Mn2 + foi adicionado NaOH até pH 13, precipitando o Mn2+ com a formação do complexo solúvel [Zn(OH)4]2-. Os precipitados NiS e CoS foram dissolvidos com HNO3 15,0 mol L-1. Na solução contendo Ni2+ e Co2+ foi, em seguida, adicionado NaOH até atingir o pH 9,0 precipitando os hidróxidos de níquel e de cobalto.19 Síntese do material para cátodo de baterias de íon - lítio O material do cátodo para as baterias de íon - lítio foi preparado usando um método de reação em estado sólido com o reagente analítico LiCO3 e os materiais recuperados Ni(OH)2 e Co(OH)2 numa razão de massa 2:1:1. Foi adicionada água à mistura de reagentes sólidos até obter uma pasta do material precursor formado.20 Em seguida, o material precursor foi aquecido a 80 ºC durante 60 minutos e depois a 650 ºC durante 120 minutos para produzir óxidos duplos de lítio cobalto e óxidos de lítio níquel. A Figura 1 representa o fluxograma do processo hidrometalúrgico dos materiais recuperados das baterias exauridas de Ni-MH.
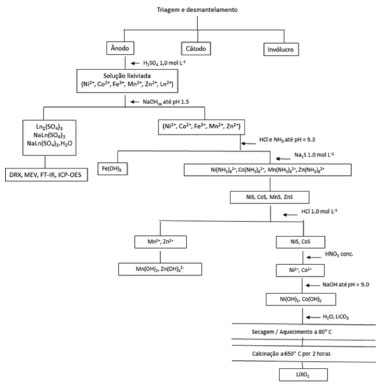 Figura 1. Fluxograma da rota de obtençao dos materiais recuperados da bateria de Ni-MH.(adaptado)19
RESULTADOS E DISCUSSÃO Caracterização do ânodo da bateria de Ni-MH Os eletrodos negativos de baterias de Ni-MH recarregáveis foram caracterizados para determinar o melhor método para a recuperação das matérias-primas. As micrografias do elétrodo negativo são mostradas na Figura 2, nas quais podem ser observadas rachaduras ao longo de toda a superfície dos elétrodos negativos das baterias de Ni-MH.
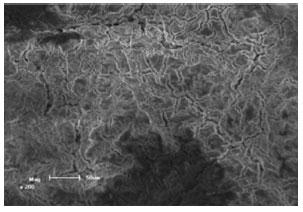 Figura 2. Micrografia do material do ânodo da bateria de Ni - MH. Aumento: 200x
As rachaduras ocorreram durante a remoção do material ativo devido ao processo de intercalação e desintercalação de átomos de hidrogênio (isto é, de carga e descarga, respectivamente, do ânodo). Na Figura 3 observa-se o difratograma de raios X do eletrodo negativo. Os sinais foram comparados com os cartões JCPDS identificando os compostos CeO2,21 CeO,22 Ce,23 LaNi5,24 LaNi,25 FeNi,26 Mn3O427 e CoONiO.28
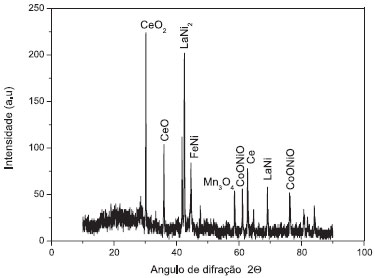 Figura 3. Difratograma de raios X do material do ânodo da bateria de Ni-MH
A concentração relativa do material do ânodo foi determinada por análise de ICP-OES e apresentou as seguintes concentrações: Co = 302 ppm, Ni = 190.0 ppm, Ce = 138.8 ppm, Fe = 84.1 ppm, La = 22.1 ppm, Mn = 18.9 ppm, Zn = 1.1 ppm. Os resultados indicam altas concentrações de Co, Ni e Ce no qual é substituído pelo La em muitas ligas. O Fe detectado é, devido à contaminação com o coletor de corrente, Mn e traços de Zn são provenientes do eletrodo positivo. Os resultados de ICP-OES concordaram muito bem com as medições de difração de raios X. Caracterização dos compostos de terras raras recuperados A composição e a concentração relativa dos elementos químicos que compõem os materiais de terras raras foram Ce = 24.67 ppm, La = 6.256 ppm, Mn = 0.089 ppm, Zn = não detectado, Ni = não detectado, Co = não detectado e Fe = não detectado. A análise de ICP-OES confirmou que os elementos cobalto, níquel e ferro permaneceram na solução após a precipitação de cério e lantânio e que existe uma baixa concentração de manganês no material recuperado. Os compostos de terras raras são recuperados com elevada pureza e podem ser usados em aplicações industriais. A Figura 4 mostra o difratograma de raios X para os materiais recuperados. De acordo com os arquivos JPCDS, os materiais recuperados são compostos por NaCe(SO4)2.H2O,29 NaCe(SO4)2,30 Ce2(SO4)3,31 NaCe(SO4)232 e La2(SO4)3.H2O.33 Estes resultados estão de acordo com a solução de dissolução do ânodo analisado por ICP-OES.
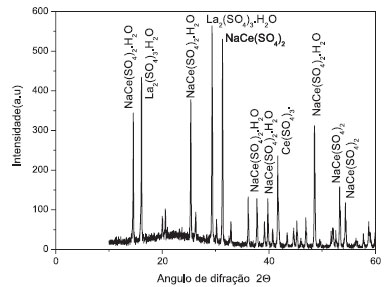 Figura 4. Difratograma de raios X dos compostos recuperados das terras raras
Na Figura 5 pode-se ver a micrografia dos compostos de terras raras, sendo o tamanho de partícula inferior a 1,0 µm apresentando uma estrutura hexagonal clara. O espectro de infravermelho dos compostos de terras raras confirma que os compostos foram obtidos nas suas formas hidratadas com a presença de bandas na região de 3588 cm-1 e 1616 cm-1, relativas, respectivamente, à vibração de alongamento do grupo OH- e deformação da água. Além disso, a banda observada a 3510 cm-1 sugere a existência de água cristalizada, demonstrando a presença de uma forte banda entre 1108 cm-1 e 1053 cm-1 e uma banda fraca a 1003 cm-1, típicas de sulfato. As faixas compreendidas entre 675 cm-1 e 565 cm-1 indicam vibrações das ligações metal - oxigênio (La - O ou Ce - O).
 Figura 5. Micrografia dos compostos recuperados das terras raras. Aumento: 10000x
Caracterização do cobalto e níquel recuperados O difratograma de raios - X dos compostos Co e Ni são mostrados na Figura 6. Este difratograma apresenta picos que, quando comparados com a base de dados JCPDS, indicam um empacotamento hexagonal de β-Ni(OH)234 e Co(OH)2,35 com os parâmetros a = 3,13 Å e c = 4,61 Å. A estrutura cúbica para o CoO 36 apresenta parâmetro de rede a = 4,29 Å.
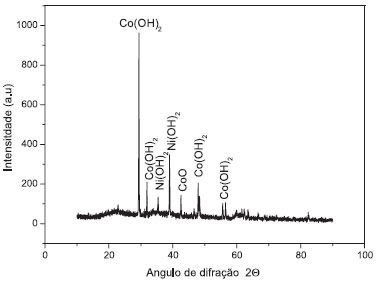 Figura 6. Difratograma de raios X dos materiais recuperados dos metais níquel e cobalto
No espectro de FT-IR, os números de onda de 3644 cm-1 e 3464 cm-1 indicam a vibração dos grupos hidroxilas do Ni(OH)2 e Co(OH)2 e o alongamento vibracional do grupo hidroxila da água adsorvida, respectivamente. Sinais de FT-IR de 1384 cm-1 são característicos de sulfatos e carbonatos. Estes resultados confirmam que o hidróxido de níquel e cobalto retém sólidos de sulfato e carbonato a partir das soluções iniciais. Além disso, a banda de absorção em 546 cm-1 é atribuível ao alongamento vibracional da ligação Co-O. O alongamento vibracional do Ni-O pode ser observado nas regiões de 637 cm-1 e 835 cm-1. Os hidróxidos de cobalto e níquel recuperados foram posteriormente utilizados para sintetizar materiais de cátodos para baterias de íon - lítio. Caracterização dos materiais sintetizados para baterias de íon - lítio Na Figura 7 observa-se o difratograma de raios X dos materiais sintetizados. Os picos dos difratogramas foram comparados com os arquivos JPCDS para confirmar que os materiais recuperados são compostos de LiCoO2,37 LiNiO238 e CoO.
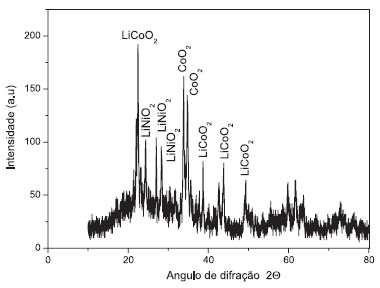 Figura 7. Difratograma de raios X dos compostos sintetizados para cátodos de baterias de íon - lítio
O resultado de microscopia eletrônica de varredura detectou microporos e macroporos. Os microporos são necessários para melhorar a capacidade da bateria devido ao aumento da área de superfície na reação eletroquímica. Os macroporos asseguram a difusão dos íons de lítio no material do cátodo. Caracterização dos compostos de ferro recuperados por precipitação O difratograma de raios X (DRX) dos compostos de ferro recuperados por precipitação segundo os dados dos cartões JPCDS detectou que os picos nos difratogramas foram identificados como Fe(OH)339 e FeO40 com empacotamento cúbico. A estrutura de Fe(OH)241 existe como uma célula hexagonal, com parâmetros de rede a = 3,27 Å e c = 4,62 Å. Além disso, uma estrutura de Fe2O3.H2O42 é identificada em um sistema de empacotamento ortorrômbico com parâmetros de rede a = 4,59 Å, b = 9,94 Å e c = 3,015 Å. Caracterização dos compostos de manganês recuperados por precipitação O hidróxido de manganês precipitado foi submetido a um processo de envelhecimento na solução alcalina e na presença de oxigênio. Assim, por conseguinte, não é surpreendente que Mn3O4 foi obtido como resultado deste envelhecimento. Os materiais recuperados são constituídos por óxidos e óxidos hidróxidos de manganês. De acordo com os arquivos JPCDS o composto Mn3O4 possui um sistema de empacotamento tetragonal com parâmetros de rede: a = 5.76 Å e c = 9.44 Å. A estrutura do composto MnO(OH)243 possui um sistema de empacotamento hexagonal com parâmetros de rede: a = 9.65 Å e c = 4.43 Å. Os picos de difração são aumentados devido ao pequeno tamanho dos cristalitos analisados.
CONCLUSÕES Os eletrodos negativos das baterias de Ni-MH recarregáveis foram caracterizados para determinar o melhor método para a recuperação dos materiais reciclados. De acordo com a análise de difração de raios X, o eletrodo negativo apresentou as estruturas CeO, LaNi5, La2O3, Mn3O4, FeNi, CoO e NiO. Portanto, um eletrodo negativo do tipo AB5. As concentrações destes materiais anódicos foram determinadas por ICP-OES. A análise de ICP-OES revelou altas concentrações de Co, Ni e Ce, que substitui o lantânio em muitas ligas. O ferro é devido à contaminação do coletor de corrente, Mn e Zn são elementos de traços do cátodo devido ao processo de prensagem. Um método hidrometalúrgico foi posteriormente desenvolvido para a recuperação de metais de terras raras, cobalto, níquel, ferro e manganês a partir de baterias de telefones celulares de Ni-MH em escala de laboratório. Os compostos de terras raras foram obtidos por precipitação química em pH 1,5 sendo o composto majoritário NaCe(SO4)2.H2O. A precipitação das terras raras é considerada quantitativa, uma vez que os metais La e Ce possuem baixa solubilidade em meio de íons SO42- e o resultado de ICP-OES da solução sobrenadante não detectou estes metais. A composição e concentração relativa dos elementos químicos que constituíam os materiais de terras raras recuperados foram determinadas por ICP - OES. Esta análise confirmou que o cobalto, níquel, ferro e manganês permanecem em solução após a precipitação do cério e lantânio. Os compostos de terras raras são recuperados com elevado grau de pureza e podem ser utilizados em futuras aplicações industriais. O ferro foi recuperado na forma de Fe(OH)3, FeO, Fe2O3, o Fe(OH)2 e Fe2O3.H2O. Manganês inicialmente passa por um processo de envelhecimento em solução alcalina e na presença de oxigênio produzindo o Mn3O4. Níquel e cobalto foram recuperados como β-Ni(OH)2 e Co(OH)2, com parâmetros de rede a = 3,13 Å e c = 4,61 Å. Os hidróxidos de cobalto e níquel recuperados foram então usados para sintetizar os materiais LiCoO2, LiNiO2 e CoO utilizados em cátodos de baterias de íon - lítio.
AGRADECIMENTOS À CAPES, CNPq e PETROBRAS, pelo apoio financeiro.
REFERÊNCIAS 1. Zhang, P.; Yokoyama, T.; Itabashi,O.; Wakui, Y.; Suzuki, T.M.; Inoque, K.; J. Power Sources 1999, 77, 116. 2. Rodrigues, L. E. O. C.; Mansur, M. B. J.; J. Power Sources 2010, 195, 3735. 3. Soria, M. L.; Chacón, J.; Hernández, J. C.; J. Power Sources 2001, 102, 97. 4. Bernades, A. M.; Espinosa, D. C. R.; Tenório, J. A. S.; J. Power Sources 2004, 130, 291. 5. Espinosa, D. C. R.; Bernardes, A. M.; Tenório, J. A. S.; J. Power Sources 2004, 135, 311. 6. Kanamura, K.; Hoshikawa, W.; Umegaki, T.; J. Electrochem. Soc. 2002, 149, 339. 7. Afonso, J. C.; Valverde, M. I.; Barandas, B. G. M.; Quim. Nova. 2007, 30, 712. 8. Yinga,T. K.; Gaob, X. P.; Huc, W. K.; Wud, F.; Noréusc, D.; Int. J. Hydrogen Energy 2006, 31, 525. 9. Deabate, S.; Fourgeot, F.; Henn, F.; Electrochim. Acta 2006, 51, 5430. 10. Sullivan, J. L.; Gaines, L.; Energy Convers. Manage. 2012, 58, 134. 11. Ruetschi, P.; Meli, F.; Desilvestro, J.; J. Power Sources 1995, 57, 85. 12. Wen, M.; Chen, L.; Tong, M.; Chen, D.; Mater. Sci. Technol. 2001, 17, Suppl.1. 13. Lupi, C.; Pilone, D.; Waste Manage. 2002, 22, 871. 14. Xiaofeng, LI.; Xia, B.; J. Alloys Compd. 2005, 391,190. 15. Freitas, M. B. J. G.; Pegoretti, V. C.; Pietre, M. K.; J. Power Sources 2007, 164, 947. 16. Zhang, P.; Yokoyama, T.; Itabashi, O.; Wakui, Y.; Suzuki, T. M.; J. Power Sources 1999, 77, 116. 17. Pietrelli, L.; Bellomo, B.; Montereali, D. M.; Hydrometallurgy 2002, 66, 135 18. Bertuol, D. A.; Bernardes, A. M.; Tenório, J. A.; J. Power Sources 2009, 193, 914. 19. Baccan, N.; Aleixo, L. M.; Stein, E.; Godinho, O. E. S; Introdução a Semimicroanalise Qualitativa, 4th ed., Unicamp: São Paulo, 1990. 20. Jutang, S.; Wang, C.; Xiaoling, M. A.; Cheng, J.; Yunhong, Z.; Mater. Lett. 2007, 61, 556. 21. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 34 - 0394. 22. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 33 - 0334. 23. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 38 - 0763. 24. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 12 - 0497. 25. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 19 - 0654. 26. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 03 -1044. 27. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 16 - 0154. 28. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 03 - 0984. 29. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 40 - 1485. 30. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 21 - 1109. 31. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 1- 208. 32. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 21-1109. 33. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 41- 509. 34. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 14 - 117. 35. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 2 - 1094. 36. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 1 - 1227. 37. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 44 -145. 38. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 26 - 117. 39. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 22 - 346. 40. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 2 - 1186. 41. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 3 - 903. 42. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 2 - 272. 43. Joint Committee on Power Diffraction Standards (JCPDS), Card No. 17 - 510. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





