Revisão
|
|
| Terpenos em cupins do gênero Nasutitermes (Isoptera, Termitidae, Nasutitermitinae) Terpenes from Nasutitermes genus termites (Isoptera, Termitidae, Nasutitermitinae) |
|
Márcia N. S. de la CruzI; Helvécio M. dos Santos JúniorI; Claudia M. Rezende*, I; Ruy J. V. AlvesII; Eliana M. CancelloIII; Maurício M. da RochaIII
IInstituto de Química, Universidade Federal do Rio de Janeiro, 21941-909 Rio de Janeiro - RJ, Brasil Recebido em 03/04/2013 *e-mail: claudia.rezendeufrj@gmail.com The chemical composition of the front gland of termites has been studied for over 40 years. The genus Nasutitermes, considered the most evolved of the Termitidae family, has a peculiarity that sets it apart from the others: a caste of soldiers that carry a terpenic mixture used in defense. This secretion is formed by mono, sesqui and diterpenes from trinervitane, kempane and rippertane skeletons, only found in termites. This article sought to review the scientific literature and contribute to the knowledge on the chemical composition of the secretion of the Nasutitermes soldiers from the interesting aspects of its behavior. INTRODUÇÃO Térmitas, usualmente conhecidos por cupins, estão entre as espécies de insetos mais abundantes nas regiões tropicais e subtropicais do planeta. Esses insetos são conhecidos pelos prejuízos econômicos que causam em áreas urbanas, devido ao ataque às construções e madeiras em geral. Algumas espécies são também consideradas pragas agrícolas e florestais. Mas, do ponto de vista ecológico, são muito benéficos para a natureza: apresentam papel fundamental na constituição química e física do solo; atuam na reciclagem de materiais a base de celulose; e suas construções, túneis e caminhos dentro do solo e de seus ninhos podem servir de abrigo para outros animais. Existem mais de 2900 espécies de cupins.1 Os térmitas são eusociais com alto nível de organização social, formada por castas, a saber, dos reprodutores (de forma simplificada, são os alados que se transformam em reis e rainhas), operários e soldados, que exercem papéis específicos na colônia (Figura 1). As castas apresentam diferenças morfológicas, fisiológicas de desenvolvimento e funcionais, sendo que na maioria das espécies os soldados e operários são estéreis.
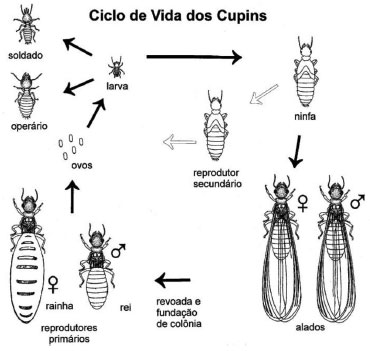 Figura 1. Organizaçao social dos térmitas2
O rei e a rainha são responsáveis pela reprodução. Como todos os insetos hemimetábolos, dos ovos eclodem ninfas que, no caso dos cupins, podem se transformar em operários, soldados ou alados, os futuros reprodutores. Há uma nomenclatura diferente para algumas fases, assim, ninfas muito jovens podem ser chamadas de "larvas". Os alados saem voando das colônias originais, tanto de ninhos epígeos (sobre o solo), arborícolas (em árvores), como de aberturas no solo, no caso de cupins subterrâneos, e vão perder as asas, formar novos casais, fundando novas colônias. Os operários são os responsáveis por praticamente todas as tarefas da colônia como, por exemplo, cuidado à prole, alimentação das outras castas, construção e/ou reparação do cupinzeiro, enquanto os soldados são responsáveis pela defesa da colônia. A defesa pode ser física, química ou uma combinação de ambas. Algumas espécies possuem mandíbulas bem desenvolvidas, usadas no ataque direto aos invasores. Outras espécies utilizam tanto o método físico quanto o químico já que possuem, além das mandíbulas, substâncias químicas que são ejetadas sobre o inimigo. Há ainda grupos cujas mandíbulas foram se reduzindo em diferentes graus ao longo do processo evolutivo, ao mesmo tempo em que glândulas especiais foram se desenvolvendo, ou seja, com a habilidade de produzir substâncias químicas especializadas, que são lançadas sobre os inimigos, como é o caso dos Nasutitermes.1,3,4 Os térmitas do gênero Nasutitermes incluem 243 espécies no mundo e 71 espécies nominais na Região Neotropical.1 A cabeça do soldado Nasutitermes tem formato de pera, coloração marrom e um nasus (tubo frontal) estreito para a saída da secreção, o que permite atacar os inimigos à distância, evitando o contato direto (Figura 2).
 Figura 2. Vista geral do soldado Nasutitermes macrocephalus. Foto de Christiana Klingenberg/State Museum of Natural History Karlsruhe Nature (SMNK), Alemanha
Durante a coleta, o transporte e o armazenamento dos térmitas Nasutitermes (provenientes de Minas Gerais e Rio de Janeiro), foi possível observar algumas curiosidades relativas ao comportamento desses insetos. Foram coletados ninhos arborícolas e epígeos com diferentes aspectos. Nas serras de Minas Gerais, como na Serra de São José, Tiradentes, os ninhos tinham aparência negra com frequência, embora o solo fosse tanto amarronzado quanto esbranquiçado, característico dos silicatos. Na cobertura e nas laterais do termiteiro, parte das paredes era formada pelo exoesqueleto dos térmitas. Quando a parede do ninho era perfurada, a restauração pelos operários era imediata, sob a vigilância dos soldados. Quando removidos do ninho, observou-se uma grande tendência à dispersão, mesmo quando acomodados em recipientes altos e de parede lisa. Ao tentar conter o processo de dispersão, montamos armadilhas com água. Apesar de caírem na água, os cupins continuaram vivos por alguns dias até o momento da extração. Observamos ainda que, aparentemente, a secreção auxiliou sua fuga, já que os soldados, térmitas não mandibulados, escaparam dos invólucros plásticos, o que pode sugerir uma ação solvente para a secreção. Os soldados permaneceram vivos por mais tempo quando juntos aos operários, o que deve estar relacionado ao fato de serem alimentados por estes.5
TERPENOS PRESENTES NOS SOLDADOS Nasutitermes A secreção da glândula frontal do soldado Nasutitermes é composta por monoterpenos, sesquiterpenos e diterpenos, que formam uma mistura grudenta e tóxica para os inimigos.5-7 O perfil cromatográfico dessa secreção, obtido por cromatografia em fase gasosa (CG), pode ser visualizado na Figura 3, e está de acordo com trabalhos anteriores sobre o perfil terpenoídico de vegetais obtido por CG acoplado à espectrometria de massas (CG/EM).8
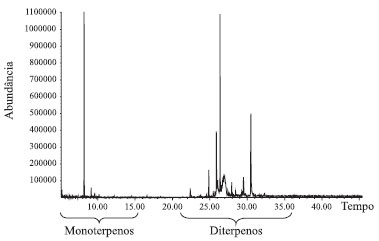 Figura 3. Cromatograma do extrato em diclorometano de soldados de Nasutitermes coxipoensis por cromatografia gasosa acoplada à espectrometria de massas (CG/EM por impacto de elétrons a 70 eV)
MONOTERPENOS E SESQUITERPENOS DE SOLDADOS Nasutitermes A composição dos monoterpenos inclui limoneno, α-pineno, β-pineno, canfeno, mirceno, α-terpineno, α-felandreno, entre outros minoritários, que são substâncias comuns em plantas. Diversos estudos propuseram a associação da composição monoterpênica à variação intra e interespécies dos cupins, estudadas em diversos países. Apesar do esforço neste sentido, não há evidências claras quanto aos marcadores terpênicos em cupins Nasutitermes.9-12 A descrição dos monoterpenos e sua ocorrência podem ser vista na Tabela 1.
A ocorrência dos monoterpenos na secreção dos térmitas foi relacionada ao papel de solvente para os diterpenos, à ação como feromônios de alarme e de recrutamento e como agentes tóxicos aos predadores do ninho.5,6,25 Em 2000, Rosengaus e colaboradores apresentaram resultados dos experimentos in vitro e in vivo para a propriedade fungistática da secreção da glândula frontal dos soldados de N. costalis e N. nigriceps. Dentre os monoterpenos, dois constituintes comumente observados, α-pineno e limoneno, foram ativos na inibição da germinação dos esporos do fungo entomopatogênico Metarhizium anisopliae, uma praga natural que já foi sugerida para o controle biológico de termiteiros.26 A ação tóxica do α-pineno frente a baratas, borboletas e formigas é descrita na literatura científica.27,28 Everaerts e colaboradores, por sua vez, isolaram o α-pineno da secreção de soldados de N. princeps e verificaram que o enantiômero (+)-α-pineno estava presente com pureza óptica de 99,5%. Já que estudos anteriores não correlacionaram o papel repelente dos monoterpenos à sua composição enantiomérica, é possível que a enantioespecificidade observada por Everaerts se deva a ação como feromônio.29 Os sesquiterpenos são pouco relatados em Nasutitermes. Os trabalhos mais representativos foram descritos para N. gracilirostris, N. torresi, N. triodiae30 e N. octopilis,31 e relataram a ocorrência de elemanos e selinanos como sendo os esqueletos de maior ocorrência (Figura 4).
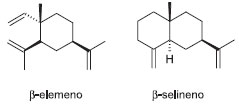 Figura 4. Sesquiterpenos encontrados em Nasutitermes
Em 2013, foram identificados os sesquiterpenos trans-β-cariofileno e acetato de γ-eudesmila em N. macrocephalus, sendo esse último inédito na secreção de soldados de Nasutitermes de ocorrência no Brasil.24
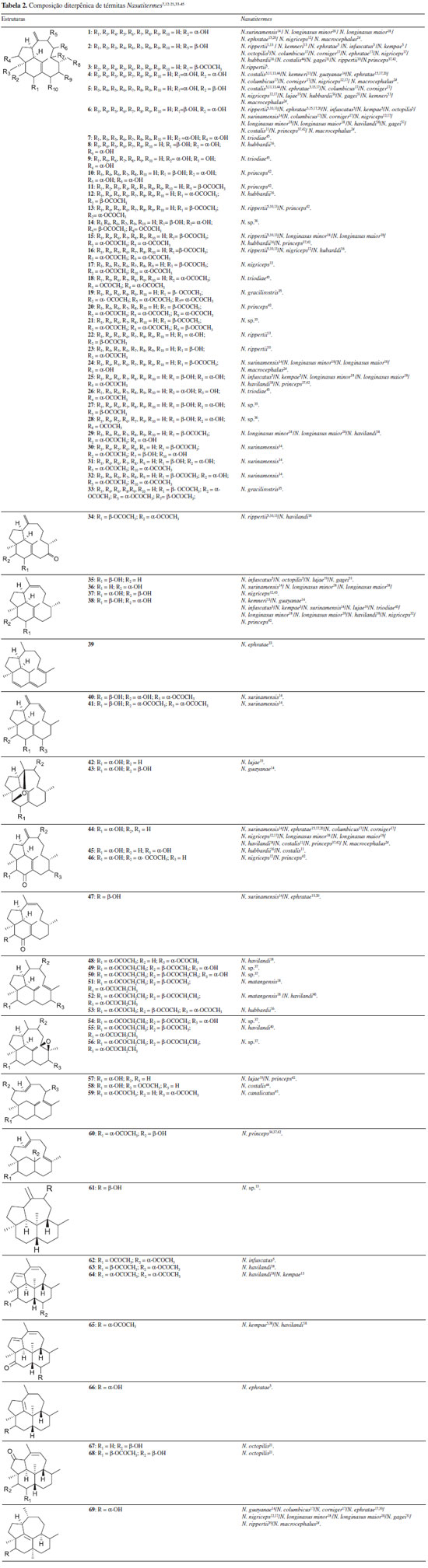
DITERPENOS EM SOLDADOS Nasutitermes Nas 34 espécies de térmitas Nasutitermes estudados quanto à composição química, de um total de 243 espécies identificadas, observa-se que há 3 esqueletos básicos que compõem os diterpenos até hoje identificados, que são: trinervitano, ripertano e kempano (Figura 5). Na grande maioria dos constituintes isolados, observam-se grupamentos hidroxila, acetoxi e carbonila cetônica.
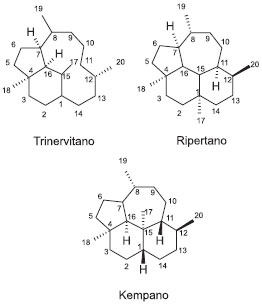 Figura 5. Esqueletos dos diterpenos trinervitano, ripertano e kempano
Até o momento, há 34 artigos em periódicos indexados que abordam a composição química da secreção de térmitas Nasutitermes, cuja representatividade pode ser vista na Figura 6 a partir do levantamento da base Scifinder.32
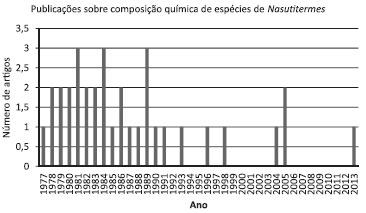 Figura 6. Publicaçoes sobre composiçao química de térmitas Nasutitermes, compiladas a partir de 1970 utilizando a base de dados Scifinder32
Recentemente, a investigação da composição terpênica de N. macrocephalus num estudo inédito no Brasil, os pesquisadores encontraram 2 monoterpenos, 2 sesquiterpenos e 7 diterpenos (compostos 1,4, 5, 6, 24, 44 e 69 da Tabela 2).24 Esse trabalho constituiu a retomada da pesquisa sobre composição química de Nasutitermes, estagnada desde 2005, sendo ainda o segundo trabalho em periódico indexado sobre a composição química de Nasutitermes de ocorrência no território brasileiro.24,33
Há 69 diterpenos isolados de Nasutitermes, os quais se encontram na Tabela 2. A principal classe é dos trivervitanos, sendo o diol 2β,3α-di-hidroxi-trinervita-1(15),8(19)-dieno (6, Tabela 2) o mais comum. Observa-se que as funcionalizações ocorrem majoritariamente em C1 e C15 (como ligação dupla), seguido por C8 e C19 (como ligação dupla), com substituições oxigenadas ocorrendo preferencialmente em C2, C3 e C9. Foram observados compostos mono, di e tri-hidroxilados, que podem vir acompanhados das respectivas cetonas e dos derivados acetilados, todos com o mesmo padrão de substituição. Para os kempanos, as funcionalizações ocorrem em C8 e C9 (como ligação dupla), C6 e C7 (como ligação dupla), com as substituições oxigenadas ocorrendo preferencialmente em C3 e C14. Foi descrito, em soldados de Nasutitermes, apenas uma substância com esqueleto ripertano (69, Tabela 2). O estudo químico dessas substâncias exige capacitação analítica, além do óbvio conhecimento químico. A glândula onde os terpenos são produzidos encontra-se envolta numa carcaça dura, o que dificulta o acesso. Os insetos são pequenos, medindo em torno de 1 cm, o que dificulta a remoção da cabeça, que em geral é feita após criogenia. O rendimento da secreção é baixo: aproximadamente 100 mg são obtidos a partir da extração de 5000 soldados, que devem ser catados manualmente, para evitar a contaminação pelos operários, presentes em grande número. Além disso, os diterpenos aparecem com frequência como diastereoisômeros e alguns coeluem em cromatografia gasosa, o que reforça a necessidade do isolamento dos constituintes e sua análise estrutural por ressonância magnética nuclear (RMN).
CONTEXTUALIZAÇÃO DA PESQUISA EM Nasutitermes O grande nome na pesquisa dos térmitas da família Termitidae, especialmente do gênero Nasutitermes, é do químico americano Glenn D. Prestwich, da Universidade de Utah, EUA. Prestwich iniciou sua carreira em ecologia química, com 54 publicações sobre térmitas entre aproximadamente 600, que englobam química de produtos naturais, síntese orgânica, bioquímica e biomateriais.46 Após os trabalhos iniciais sobre a composição da secreção de térmitas australianos, que foram relatados nos anos 60 por Moore,47 Prestwich descreveu seus dados à luz da cristalografia de raio-X, o que levou à primeira caracterização espectroscópica completa do constituinte majoritário do térmita Trinervitermes gratiosus (Nasutitermitidae), um novo esqueleto diterpênico tricíclico, denominado trinervitano, e a substância em questão identificada como sendo 2β,3α-di-hidroxi-9α-acetoxi-trinervita-1(15),8(19)-dieno (25, Tabela 2), cujo nome derivou-se do gênero do térmita estudado.48 Logo em seguida, Prestwich comunicou a presença de outro novo esqueleto diterpênico, agora em Nasutitermes, o tetraciclokempano 3,14α-diacetoxi-kempa-6,8-dieno (62, Tabela 2) e 14α-acetoxi-kempa-6,8-dien-3-ona (65, Tabela 2), empregando cromatografia em coluna aberta com Florisil® seguido de purificação por cromatografia líquida de alta eficiência (CLAE), um sistema cromatográfico ainda pouco explorado à época, abrindo as portas para diversas publicações na área. Esse mesmo autor estudou térmitas da Malásia, Nova Guiné, América Central e do Sul e descreveu as diversas funcionalizações oxigenadas destes esqueletos, além de seu comportamento e aspectos fisiológicos.3,5,6,9,21,31,39,40,48,49 Em 1980, Prestwich e colaboradores descreveram a estrutura do 3α-hidroxi-15-riperteno (69, Tabela 2), novamente com base nos dados de cristalografia de raio-X, levando à caracterização espectroscópica completa do novo esqueleto diterpênico. Apesar de anteriormente descrito em espécies de Nasutitermes, o esqueleto ripertano apresentava evidências da migração 1,2 de metila, nunca antes observada na biossíntese de insetos, o que durante muito tempo suscitou dúvidas quanto a sua existência.39 Em 1981, Prestwich e colaboradores verificaram a incorporação de precursores de terpenos, como acetato e mevalonato marcados com C14, através de injeção direta, no abdômen de N. octopilis, o que os levou a concluir que a biossíntese dos diterpenos se dá a partir de cembranos.50 Cembranos são diterpenos macrocíclicos amplamente relatados em corais e em folhas de tabaco, que haviam sido previamente relatados em cupins, como hormônios de trilha.51 Como não havia evidência da presença de terpenos entre os operários, os autores comprovaram a hipótese de que a mistura terpênica é sintetizada e armazenada na glândula frontal dos soldados. Além disso, os autores definiram que a composição terpênica dos insetos é independente da dieta.6,13,52 Paralelamente aos trabalhos de Prestwich, o grupo tcheco de Vrkoč iniciou seu estudo sobre a composição química de térmitas. Em 1978, este grupo relatou a composição química da secreção de N. costalis (2, 4, 5, 6, 44, 45, 58 da Tabela 2), coletados em Cuba, bem como a oxidação de um diol trinervitano com dióxido de manganês que serviu no auxílio à busca de cetonas, algumas delas sugeridas como artefatos do processo de isolamento.10,11 Ao longo dos anos, o grupo tcheco buscou contribuir para a compreensão do papel taxonômico dos mono e diterpenos nesses térmitas. Valterová e colaboradores, em 1989, relataram a composição química do extrato etanólico dos soldados de N. ephratae da Amazônia peruana. Apesar do emprego de um solvente polar, o que até então não era frequente nas metodologias extrativas, a composição terpênica manteve o padrão de substituição até então identificado.15 Em 1993, Everaerts e colaboradores deram uma contribuição interessante à metodologia em vigor, comparando a composição química de três diferentes extratos, que foram: somente a secreção dos cupins; extração da cabeça com solvente; e extração com solvente do cupim inteiro, de onde concluíram não haver diferença no perfil químico pela técnica de CG/EM, exceto por alguns poucos ácidos graxos, estudo reforçado ainda pelo isolamento dos constituintes principais e caracterização por RMN.30 Secotritervitanos também foram caracterizados nestes cupins, como os compostos 57 e 58 isolados de N. lujae,19 59 isolado de soldados de N. canaliculatus41 e 60, isolado de soldados N. princeps (Tabela 2).24 Através de técnicas bioguiadas, Zhao e colaboradores relataram a atividade antibiótica de cinco diterpenos (7, 9, 18, 26 e 38, Tabela 2) de N. triodiae contra a bactéria Gram positiva Bacillus subtilis, abrindo frente para outros papéis ecológicos dos terpenos de térmitas. O material testado não foi ativo frente à bactéria Gram negativa Escherichia coli.45 Dessa mesma época data uma publicação no Chemical & Engeneering News, acerca do possível aproveitamento de trinervitanos modificados como antibióticos.53 Em 2005, o mesmo grupo depositou uma patente sobre a atividade microbicida de diversos derivados de trinervitanos, com grupamentos variados entre os quais aminas, sulfetos, sulfonilas e ésteres de ácidos graxos, entre outros, com substituição nos carbonos usualmente oxigenados. Aparentemente, as substâncias de melhor desempenho entraram em fase clínica I, mas não há relatos quanto ao prosseguimento desses ensaios.54 Em 2013, foram relatados os resultados da atividade antimicrobiana dos compostos 5, 44 e 69 (Tabela 2) contra a bactéria Staphylococcus aureus resistente à meticilina, a qual é responsável por infeções hospitalares. Essa foi a primeira descrição de um diterpeno com estrutura ripertano com atividade biológica.24 A primeira síntese total do núcleo ripertano foi publicada em 2011 por Snyder e colaboradores.55 Diterpenos possuem histórico de atividade microbicida, a exemplo do ácido ent-3β-hidroxi-kaur-16-en-19-óico, isolado da anonácea de Mata Atlântica Xylopia laevigata56 e do ácido pupofólico, isolado do cipó brasileiro Aristolochia esperanzae (Aristolochiaceae).57 Em insetos, os diterpenos mais comuns são acíclicos, como o geranilgeraniol, observado na ordem Hymenoptera a qual pertencem formigas e abelhas.58 Diterpenos cíclicos derivados do núcleo cembrano são os mais comumente observados e atuam como feromônio em térmitas, flebotomíneos e em formigas brasileiras do gênero Crematogaster, que os empregam ainda em seu veneno.59 Recentemente, o veneno da espécie C. pygmaea, coletada no Ceará, mostrou-se ativo frente a bactérias gram-positivas e negativas, mas sua composição química não foi investigada.60
CONCLUSÃO Os terpenos produzidos pelos térmitas do gênero Nasutitermes, da subfamília Nasutitermitinae, considerada a mais desenvolvida entre as de Termitidae, possuem função de defesa e comunicação.1,3-7,15,20,24-26,29,33,44 Os diterpenos identificados até hoje na secreção dos soldados de Nasutitermes atuam, simultaneamente com os monoterpenos, para formar uma "cola" sobre os inimigos do ninho.5-7,26,45 Esse mesmo mecanismo de defesa é observado em alguns vegetais superiores, como espécies do gênero Pinus, rica em pinenos e ácido abiético.5,8 Aparentemente, os monoterpenos apolares interagem com as membranas celulares e com os hidrocarbonetos epicuticulares dos invasores, enquanto os diterpenos diminuem sua taxa de evaporação e aumentam a viscosidade da resina, aumentando sua eficiência imobilizadora.8,25 Conforme os compostos oxigenados se dimerizam através de ligações hidrogênio, sua hidrofobicidade aumenta, levando a uma solvatação mais efetiva pelos monoterpenos. A atuação dos metabólitos secundários em térmitas é apenas mais um dos belos exemplos da intrincada complexidade que correlaciona os organismos na natureza.2
REFERÊNCIAS 1. Constantino, R.; Pap. Avulsos Zool. 1999, 40, 387. http://www.termitologia.unb.br/images/stories/pdf/constantino1999.pdf, acessada em Março 2013. 2. DIVECEL, 2011. DIVECEL - Dedetizadora e desentupidora, 2012. http://www.divecel.com.br/, acessada em Março 2013. 3. Prestwich, G.; Sci. Am. 1983, 249, 68. 4. Santos, C. A.; Costa-Leonardo, A. M. Microsc. Res. Tech. 2006, 69, 913. 5. Prestwich, G.; Biochem. Syst. Ecol. 1979, 7, 211. 6. Prestwich, G.; J. Chem. Ecol. 1979, 5, 459. 7. Everaerts, C.; Pasteels, J. M.; Roisin, Y.; Bonnard, O.; Biochem. Syst. Ecol. 1988, 16, 437. 8. Patitucci, M. L.; Veiga Júnior, V. F.; Pinto, A. C.; Zoghbi, M. G. B; Silva, J. R. A.; Quim. Nova 1995, 18, 262. 9. Prestwich, G.; Annu. Rev. Entomol. 1984, 29, 201. 10. Vrkoc, J.; Budesinsky, M.; Sedmera, P.; Collect. Czech. Chem. Commun. 1978, 43, 1125. 11. Vrkoc, J.; Budesinsky, M.; Sedmera, P.; Collect. Czech. Chem. Commun. 1978, 43, 2478. 12. Valterova, I.; Budesinsky, M.; Vrkoc, J.; Collect. Czech. Chem. Commun. 1991, 56, 2969. 13. Baker, R.; Walmsley, S.; Tetrahedron 1982, 38, 1899. 14. Laurent, P.; Daloze, D.; Pasteels, J. M.; Braekman, J. C.; J. Nat. Prod. 2005, 68, 532. 15. Valterova, I.; Krecek, J.; Vrkoc, J.; Biochem. Syst. Ecol. 1989, 17, 327. 16. Valterova, I.; Krecek, J.; Vrkoc, J.; Acta Ent. Bohemoslov. 1984, 81, 416. 17. Gush, T.; Bentley, B.; Glenn, P.; Thorne, B.; Biochem. Syst. Ecol. 1985, 13, 329. 18. Chuah, C. H.; Goh, S. H.; Tho, Y. P.; J. Chem. Ecol. 1989, 15, 549. 19. Braekman, J.; Daloze, D.; Dupont, A.; Pasteels, J.; Lefeuve, P.; Bordereau, C.; Declercq, J.; Van Meerssche, M.; Tetrahedron 1983, 39, 4237. 20. Valterova, I.; Vasickova, S.; Budesinsky, M.; Vrkoc, J.; Collect. Czech. Chem. Commun. 1986, 51, 2884. 21. Prestwich, G. D.; Lauher, J. W.; Collins, M. S.; Tetrahedron Lett. 1979, 40, 3827. 22. Goh, S.H.; Tong, S. L.; Tho, Y. P.; Mikrochim. Acta 1982, 1, 219. 23. Ruther, J.; Hilker, M.; J. Chem. Ecol. 1998, 24, 525. 24. Cruz, M. N. S.; Júnior, H. M. S.; Oliveira, D. F.; Costa-Lotufo, L. V.; Ferreira, A. G.; Alviano, D. S.; Rezende, C. M.; Nat. Prod. Commun. 2013, 8, 69. 25. Zarbin, P. H. G.; Rodrigues, M. A. C. M.; Lima, E. R.; Quim. Nova 2009, 32, 722. 26. Rosengaus, R.; Lefebvre, M.; Traniello, J.; J. Chem. Ecol. 2000, 26, 21. 27. Howse, P. E.; Symposium of the International Union for the Study of Social Insects, Dijon, França, 1975, p. 23. 28. Eisner, T.; Kriston, L.; Aneshansley, D. J.; Behav. Ecol. Sociobiol. 1976, 1, 83. 29. Everaerts, C.; Bonnard, O.; Pasteels, J. M.; Roisin, Y.; Konig, W. A.; Experientia 1990, 46, 227. 30. Everaerts, C.; Roisin, Y.; Le Quéré, J.-L.; Bonnard, O.; Pasteels, J. M.; J. Chem .Ecol. 1993, 19, 2865. 31. Prestwich, G.; Collins, M.; Biochem. Syst. Ecol. 1981, 9, 83. 32. SciFinder. https://scifinder.cas.org/, acessada em Março 2013. 33. Budesinsky, M.; Valterova, I.; Sémon, E.; Cancello, E.; Bordereau, C.; Tetrahedron 2005, 61, 10699. 34. Braekman, J.; Daloze, D.; Dupont, A.; Pasteels, J.; Tursch, B.; Declercq, J.; Germain, G.; Van Meerssche, M.; Tetrahedron Lett. 1980, 21, 2761. 35. Braekman, J. C.; Daloze, D.; Dupont, A.; Pasteels, J. M.; Ottinger, R.; Bull. Soc. Chim. Belg. 1984, 93, 291. 36. Braekman, J. C.; Daloze, D.; Pasteels, J. M.; Roisin, Y.; Bull. Soc. Chim. Belg. 1986, 95, 915. 37. Dupont, A.; Braekman, J.; Daloze, D.; Pasteels, J.; Tursch, B.; Bull. Soc. Chim. Belg. 1981, 90, 485. 38. Prestwich, G. D; Solheim, B.; Clardy, J.; Pilkiewicz, F.; Miura, I.; Tanis, S.; Nakanishi, K.; J. Am. Chem. Soc. 1977, 99, 8082. 39. Prestwich, G. D; Spanton, S. G.; Lauher, J. W.; Vrkoc, J.; J. Am. Chem. Soc. 1980, 102, 6825. 40. Prestwich, G. D.; Spanton, S. G.; Goh, S. H.; Tho, Y. P.; Tetrahedron Lett. 1981, 22, 1563. 41. Rabemanantsoa, A.; Ranarivelo, Y.; Andriantsiferana, M.; J. Nat. Prod. 1996, 59, 883. 42. Roisin, Y.; Pasteels, J. M.; Braekman, J. C.; Biochem. Syst. Ecol. 1987, 15, 253. 43. Valterova, I.; Budesinsky, M.; Vrkoc, J.; Prestwich, G. D.; Collect. Czech. Chem. Commun. 1990, 55, 1580. 44. Valterova, I.; Budesinsky, M.; Turecek, F.; Vrkoc, J.; Collect. Czech. Chem. Commun. 1984, 49, 2024. 45. Zhao, C.; Rickards, R.; Trowel, S.; Tetrahedron 2004, 60, 10753. 46. Prestwich, G.; Curriculum Vitae; http://s3.amazonaws.com/seak_members/production/2659/original/CV%20All%20-%20May%202012%20copy.pdf?1337041745, acessada em Março 2013. 47. Moore, B. P.; J. Insect Physiol. 1968, 14, 33. 48. Prestwich, G. D.; Tanis, S. P.; Springer, J. P.; Clardy, J.; J. Am. Chem. Soc. 1976, 98, 6061. 49. Prestwich, G. D.; Tanis, S. P.; Pilkiewicz, F.; Miura, I.; Nakanishi, K.; J. Am. Chem. Soc. 1976, 98, 6062. 50. Prestwich, G. D.; Jones, R. W.; Collins, M. S.; Insect Biochem. 1981, 11, 331. 51. Ali, M. F.; Morgan, E. D.; Biol. Rev. 1990, 65, 227. 52. Prestwich, G.; Tetrahedron 1982, 38, 1911. 53. Rouhi, A. M.; Washington, C. E.; Chem. Eng. News 2003, 81, 93. http://pubs.acs.org/cen/coverstory/8141/8141pharmaceuticals3.html, acessada em Março 2013. 54. Rickards, R. W.; Zhao, C.; Trowell, S. C.; U. S. Pat.Appl. US 20060094780 A1 20060504, 2006. 55. Snyder , S. A.; Wespe, D. A.; von Holf, J. M.; J. Am. Chem. Soc. 2011, 133, 8850. 56. Silva, D. M.; Costa, E. V.; Nogueira, P. C. L.; Moraes, V. R. S.; Cavalcanti, S. C. H.; Salvador, M. J.; Ribeiro, L. H. G.; Gadelha, F. R.; Barison, A.; Ferreira, A. G.; Quim. Nova 2012, 35, 1570. 57. Pacheco, A. G.; Silva, T. M.; Manfrini, R. M.; Sallum, W. S. T.; Duarte, L. P.; Piló-Veloso, D.; Alcântara, A. F. C.; Knupp, V. F.; Quim. Nova 2010, 33, 1649. 58. Morgan, E. D.; Biosynthesis in Insects, Advanced Edition, Royal Society of Chemistry: Cambrigde, 2010. 59. Leclercq, S.; DeBiseau, J. C.; Daloze, D.; Braekman, J. C.; Quinet, Y.; Pasteels, J. M.; Tetrahedron Lett. 2000, 41, 633. 60. Quinet, Y; Vieira, R. H. S. F.; Sousa, M. R.; Evangelista-Barreto, N. S.; Carvalho, F. C. T.; Guedes, M. I. F.; Alves, C. R.; de Biseau, J. C.; Heredia, A.; J. Venom. Anim. Toxins incl. Trop. Dis. 2012, 18, 441. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access