Educação
|
|
| Eletrodo compósito à base de grafite-Araldite®: aplicações didáticas - Parte II Graphite-araldite® composite electrode: didactic applications - Part II |
|
Carolina Maria Fioramonti Calixto; Sidney Xavier dos Santos#; Éder Tadeu Gomes Cavalheiro*
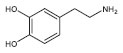
Departamento de Química e Física Molecular, Instituto de Química de São Carlos, Universidade de São Paulo, 13560-970 São Carlos - SP, Brasil Recebido em 09/05/2013 *e-mail: cavalheiro@iqsc.usp.br This work proposes the use of a graphite-Aralditer 70% (graphite, m/m) composite electrode in didactic experiments, specifically in the quantitative determination of the neurotransmitter dopamine (DA) in a sample of pharmaceutical formulation. The goal is to demonstrate the possibility of using voltammetric techniques in quality control of medicines, besides covering some concepts such as the influence of pH on the redox process, the differential pulse voltammetry (DPV) technique, the optimization of experiments and comparison with an official method described in the United States Pharmacopoeia. INTRODUÇÃO Os eletrodos à base de carbono têm sido largamente utilizados em eletroanalítica por apresentarem amplo intervalo de potenciais com baixa corrente residual, principalmente na região de potenciais positivos, na qual o eletrodo de mercúrio apresenta limitações. Estes eletrodos podem ser utilizados no estudo de substâncias orgânicas e inorgânicas, tanto em processos de oxidação como de redução.1,2 Vários tipos de eletrodos à base de carbono são relatados na literatura, dentre os quais podem ser citados o eletrodo de carbono vítreo (GC),3 o eletrodo de grafite pirolítico4 e o eletrodo de fibra de carbono,5 além dos materiais compósitos preparados pela mistura de grafite e óleo mineral, no caso das pastas de carbono6 ou polímeros, no caso de eletrodos sólidos.7-8 Avanços recentes na análise voltamétrica de compostos com importância biológica, usando eletrodos à base de carbono, foram descritos em um artigo de revisão por Cavalheiro et al.9 Em trabalho anterior,10 a preparação de eletrodos compósitos à base de grafite e Araldite®, uma resina polimérica comercial do tipo epóxido, e sua aplicação utilizando técnicas voltamétricas foram propostas como experimento didático em cursos de análise instrumental e apresentada nessa revista. Naquele trabalho, os objetivos foram avaliar os efeitos da composição do material compósito na condutividade e na resposta voltamétrica dos eletrodos, a influência da velocidade de varredura no transporte de massa, além de demonstrar alguns conceitos fundamentais relacionados às técnicas voltamétricas usando experimentos simples. Complementando o trabalho anterior, este artigo descreve a aplicação do eletrodo compósito grafite-Araldite® 70% (grafite, m/m) na determinação de uma amostra de formulação farmacêutica, demonstrando a possibilidade da utilização de técnicas voltamétricas no controle de qualidade de medicamentos, além de destacar alguns conceitos relacionados à análise quantitativa. Esses experimentos contemplam desde a utilização da voltametria de pulso diferencial, o estudo da influência do pH no processo redox, a otimização de experimentos através de planejamento fatorial, até a comparação com um método oficial descrito na farmacopeia americana.11 A dopamina (DA) (1,2-dihidroxibenzeno-5-etanoamina) é um neurotransmissor pertencente à classe das catecolaminas. Precursora metabólica da adrenalina e da noradrenalina, atua em receptores específicos presentes no sistema nervoso central, nos vasos mesentéricos, renais e coronárias, sendo que níveis anormais dessa substância podem indicar doenças como Alzheimer12 e mal de Parkinson.13 Sua fórmula estrutural, bastante conhecida, é apresentada a seguir:
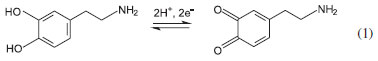
As catecolaminas são amplamente utilizadas no tratamento de asma bronquial, hipertensão, doença de Parkinson, uso excessivo de drogas, esquizofrenia e infarto do miocárdio.14 Muitos métodos têm sido descritos na literatura para a determinação de DA em amostras biológicas e em formulações farmacêuticas utilizando espectrometria,15 HPLC16 e potenciometria.14 A DA pode ser facilmente oxidada eletroquimicamente por eletrodos convencionais e, devido a isso, as técnicas eletroanalíticas têm sido amplamente utilizadas na sua determinação.17-19 Segundo Afkhami et al.,20 a DA é oxidada eletroquimicamente por um processo reversível envolvendo 2 prótons e 2 elétrons, produzindo o derivado o-benzoquinona (dopaminaquinona), o qual pode ser reduzido na varredura reversa, como representado na Equação 1.
Desta forma o objetivo didático deste trabalho é propor experimentos para ilustrar os conteúdos de análise instrumental, com base na preparação e uso de um eletrodo compósito confeccionado pelos próprios estudantes, usando como sonda eletroquímica a dopamina. O uso de um neurotransmissor importante como a DA em uma formulação comercial é útil no sentido de chamar a atenção dos alunos para o conteúdo abordado, tendo em vista sua presença no cotidiano e na mídia. Trata-se também de um motivador para temas inter e multidisciplinares, podendo ser interessante para cursos de graduação, além dos de química, como engenharia química, farmácia, bioquímica e outros.
PARTE EXPERIMENTAL Reagentes e soluções Os reagentes utilizados neste trabalho foram de grau analítico (P.A.) e usados sem purificação prévia. Todas as soluções foram preparadas em água purificada em sistema BarnsteadTM EasyPure® Rodi system (Thermoscientific, modelo D13321), resistividade > 18 MΩ cm. A solução tampão fosfato foi preparada segundo procedimento descrito por Christian e Purdy,21 dissolvendo-se quantidades adequadas de fosfato monobásico de potássio (J. T. Baker), fosfato dibásico de sódio (J. T. Baker) e fosfato tribásico de sódio em água e ajustando-se o volume em balão volumétrico de 200,0 mL. Foram preparadas soluções tampão no intervalo de pH entre 4-12. A solução de DA deve ser preparada diariamente, devido à sua fotossensibilidade.22 Neste caso, 0,0190 g de DA (Sigma-Aldrich) foram dissolvidos em tampão fosfato pH 6,0, completando-se o volume para 50,0 mL, resultando numa solução estoque de 2,0 mmol L-1. Equipamentos Os experimentos voltamétricos descritos foram realizados utilizando-se um potenciostato/galvanostato Autolab PGSTAT-30 (Ecochemie), acoplado a um microcomputador e controlado pelo software GPES 4.9 (Ecochemie). Entretanto, qualquer equipamento equivalente pode ser usado. Para realização das medidas voltamétricas, sugere-se o uso de uma célula de vidro com capacidade total de 25,0 mL, contendo o eletrodo compósito (eletrodo trabalho), um eletrodo auxiliar de platina e um eletrodo de referência, que pode ser um eletrodo de calomelano saturado (SCE) ou Ag/AgCl. Nestes experimentos foram utilizados um fio de platina de 1,0 cm de comprimento como eletrodo auxiliar, um SCE como referência e, para estudos de comparação, um eletrodo de carbono vítreo (Φ = 3,0 mm). Todas as medidas foram realizadas em temperatura ambiente e sem desaeração prévia das soluções. Como método comparativo foi utilizado um sistema de cromatografia líquida de alta eficiência Shimadzu, constituído por um controlador SLC-10A VP, bomba LC-6 AD e detector UV-Vis SPD 10A VP, equipado com uma coluna SUPELCOSIL LC-18 (150 × 4,6 mm,5 µm), acoplado a um microcomputador e controlado pelo software CLASS-VP 6.1 (Shimadzu). A fase móvel foi uma mistura filtrada e desgaseificada de 5,0 mmol L-1 de 1-octanossulfonato de sódio em 1% de ácido acético e acetonitrila (87/13) e a vazão utilizada foi 0,5 mL min-1. O volume de injeção foi de 20,0 µL e a detecção por UV foi acompanhada a 280 nm.11 Equipamento equivalente deve ser disponibilizado aos alunos, caso se queira desenvolver tais estudos comparativos. Confecção do eletrodo Conforme sugerido em trabalho anterior,10 o ideal seria que os alunos preparassem os eletrodos compósitos. Entretanto, poderiam recebê-los prontos da equipe instrutora, como sugerido no trabalho anterior. Os detalhes da confecção dos eletrodos foram descritos detalhadamente por Calixto et al.10 e, basicamente, consistiram em misturar uma parte de resina e uma parte de endurecedor, do adesivo Araldite® de cura de 24 h, conforme instruções do fabricante. Após a mistura, acrescentou-se uma quantidade de grafite à resina, a fim de se obter um compósito contendo 70 % de grafite (m/m). A mistura resultante foi homogeneizada por 15 minutos em almofariz de vidro e prensada numa prensa manual com extrusor de 3 mm de diâmetro. Após a cura da resina, os tarugos foram cortados em peças de 1,0 cm de comprimento e conectados a fios de cobre com auxílio de um adesivo condutor (Conductive Silver Epoxy Kit, Electron Microscopy Sciences, USA ou equivalente). O conjunto compósito/fio de cobre foi inserido em tubo de vidro de 5 mm de diâmetro interno e 70 mm de comprimento e o espaço foi preenchido com resina epóxi (SILAEX, SQ 2004), aguardando-se um tempo de cura de 24 h. O tratamento mecânico foi feito por abrasão em lixa d'água 600, para eliminar o excesso de resina epóxi da superfície e expor o compósito e, em seguida, a superfície do eletrodo foi polida em suspensão de alumina 1,0 µm em uma politriz APL-02 (Arotec). Finalmente, os eletrodos foram imersos em isopropanol em banho de ultrassom por 5 min, antes de cada medida. O mesmo procedimento foi feito em água, para a retirada de possíveis partículas da superfície do eletrodo.
EXPERIMENTOS PROPOSTOS Os resultados descritos a seguir foram obtidos pelos autores deste trabalho, usando o eletrodo compósito grafite-Araldite® 70 % (grafite, m/m) como eletrodo de trabalho na determinação de DA em uma formulação farmacêutica injetável. Uma aplicação didática deveria seguir os mesmos passos, para os diferentes experimentos propostos. Experimento 1 - Voltametria cíclica e otimização do pH Os alunos deverão utilizar o eletrodo compósito grafite-Araldite® 70% (grafite, m/m) para investigar o comportamento eletroquímico da DA, por voltametria cíclica, em tampão fosfato pH 6,0 contendo 1,0 × 10-4 mol L-1 de DA. De acordo com o voltamograma obtido na Figura 1, observa-se somente um par de picos de oxidação-redução da DA, no intervalo de potenciais de -150 a 500 mV (vs. SCE), com características de processo reversível.23
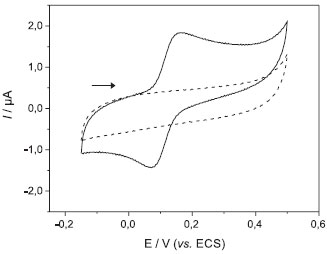 Figura 1. Voltamogramas cíclicos obtidos com eletrodo compósito grafite-Araldite® 70% (grafite, m/m) na presença (linha cheia) e na ausência (linha tracejada) de 1,0 × 10-4 mol L-1 de DA em tampão fosfato pH 6,0, n = 25 mV s-1
Os potenciais de pico de oxidação e redução foram observados, respectivamente, em 160 e 74 mV (vs. SCE) correspondentes ao processo redox reversível descrito pela Equação 1. A fim de se observar o efeito do pH na resposta voltamétrica do eletrodo frente à DA, os alunos deverão realizar estudos em soluções tampão fosfato com diferentes valores de pH. No experimento aqui descrito, o pH do eletrólito suporte foi variado entre 3,0 e 8,0 para selecionar aquele que apresentasse melhor resposta. Os voltamogramas cíclicos obtidos estão apresentados na Figura 2a.
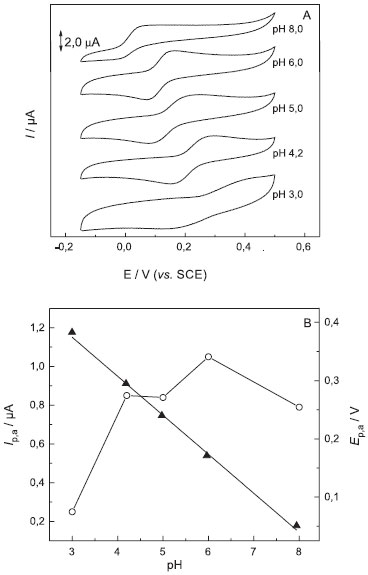 Figura 2. (A) Voltamogramas cíclicos obtidos com eletrodo compósito grafite-Araldite® 70% (grafite, m/m) em solução de 1,0 × 10-4 mol L-1 de DA em tampão fosfato, em diferentes valores de pH, n = 25 mV s-1. (B) Dependências da (○) corrente de pico anódica e do (▲) potencial de pico com o pH
Observa-se um aumento das correntes de pico anódica e catódica com o aumento do pH atingindo um máximo em pH 6,0. Acima deste valor ocorre diminuição na intensidade das correntes de pico. Observa-se também deslocamento dos potenciais de pico para potenciais menos positivos, com o aumento da acidez do meio (diminuição do valor de pH). Na Tabela 1 estão apresentados os valores de corrente e potencial de pico obtidos em solução tampão fosfato com diferentes valores de pH, contendo 1,0 × 10-4 mol L-1 de DA. De acordo com os resultados obtidos, pode ser observado que em pH 6,0 há maior intensidade de corrente, portanto foi o pH escolhido para os estudos seguintes.
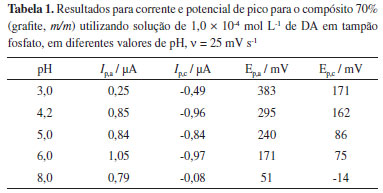
A forma distorcida do pico e as baixas correntes observadas em meio mais ácido, pH = 3,0, podem estar relacionadas com o mecanismo de oxidação e redução da DA (Eq. 1), pois o processo de oxidação parece ser desfavorecido em excesso de H+, uma vez que ocorre com liberação de 2 prótons. Uma relação linear entre o potencial de pico anódico (Ep,a) e os valores de pH pode ser observada nos voltamogramas cíclicos. Os resultados estão apresentados na Figura 2b e a relação linear pode ser representada pela Equação 2 a seguir:
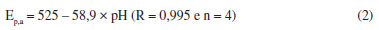
O deslocamento de potenciais de pico anódico de aproximadamente -59 mV por unidade de pH sugere um mecanismo envolvendo o mesmo número de prótons e elétrons no processo redox, o que concorda com a reação química representada pela Equação 1,1 e pode ser explicado pela equação de Nernst (temperatura = 25 ºC); para uma reação hipotética:

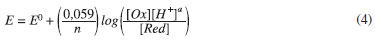
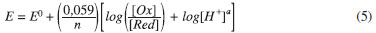
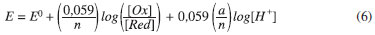
sendo n = número de elétrons transferidos na reação, a = número de prótons envolvidos, [Ox] e [Red] = concentrações das formas oxidadas e reduzidas da DA. Para (Ep,a), [Ox]/[Red] é constante, então:
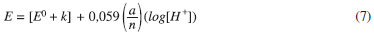
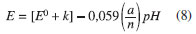
O coeficiente angular da reta Ep,a vs. pH, pode ser obtido:
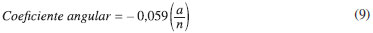
Como o valor para o coeficiente angular obtido na Equação 2 foi de aproximadamente 59 mV, a razão a/n é igual a 1, ou seja, a=n, confirmando que um mesmo número de prótons e elétrons estão envolvidos na reação. Experimento 2 - Voltametria de pulso diferencial, otimização dos parâmetros experimentais e curva analítica Na determinação de DA, os alunos deverão utilizar a voltametria de pulso diferencial (DPV), por se tratar de uma técnica mais sensível que a voltametria cíclica e com maior habilidade em discriminar a corrente capacitiva da corrente faradaica (aquela resultante do processo redox).24 Neste caso, somente a oxidação da DA foi considerada. Inicialmente, os parâmetros experimentais devem ser otimizados para se obter as melhores respostas do método analítico. Uma maneira de se fazer isso seria variar um parâmetro de cada vez mantendo o outro constante, porém um procedimento mais eficiente para tal fim seria a realização de um planejamento fatorial.25 O planejamento fatorial permite avaliar o efeito conjunto de dois ou mais fatores na resposta. Neste experimento, os dois fatores de interesse são a amplitude de pulso (a) e a velocidade de varredura (ν), em dois níveis (a = 10 e 50 mV e ν = 10 e 50 mV s-1, os quais representam parâmetros razoáveis em termos da resolução de picos e tempo de experimento em DPV.1 Esse tipo de planejamento é considerado o mais simples e é denominado planejamento fatorial 2n, sendo n = número de fatores. Portanto, sendo 22, deverão ser realizados quatro ensaios. Na Tabela 2 estão apresentados os resultados obtidos no planejamento experimental realizado em tampão fosfato pH 6,0 contendo 5,0 × 10-5 mol L-1 de DA. Analisando a tabela, pode-se observar que o maior valor de Ip,a (0,54 µA) foi obtido no ensaio 3, empregando-se ν = 10 mV s-1 e a = 50 mV, o qual também apresenta melhor resolução no pico, portanto foram os parâmetros escolhidos para os demais experimentos.

Para o propósito deste trabalho e considerando a simplicidade do planejamento utilizado a simples observação das formas dos voltamogramas e intensidade das correntes é suficiente para a escolha das condições. Entretanto, há tratamento de dados que envolvem sistemas mais complexos, caso se deseja aprofundar no uso destes sistemas.25 Na Figura 3 estão apresentados os voltamogramas obtidos, sendo possível observar o pico de oxidação da DA próximo de 120 mV (vs. SCE). Nos voltamogramas de pulso diferencial é possível observar também um pico de oxidação em aproximadamente -50 mV, referente ao tampão fosfato.26,27
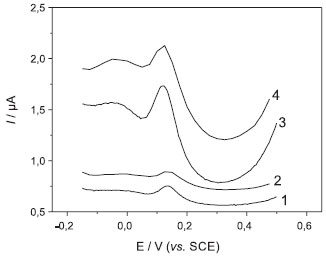 Figura 3. Voltamogramas de pulso diferencial obtidos com eletrodo compósito grafite-Araldite® 70% (grafite, m/m), usando solução 5,0 × 10-5 mol L-1 de DA em tampão fosfato pH 6,0. (1) a = 10 mV e n = 10 mV s-1; (2) a = 10 mV e n = 50 mV s-1; (3) a = 50 mV e n = 10 mV s-1 e (4) a = 50 mV e n = 50 mV s-1
Em seguida, os alunos deverão utilizar os parâmetros experimentais otimizados para a obtenção de uma curva analítica que relacione a corrente de pico com a concentração de DA. Neste trabalho, curvas analíticas foram obtidas com o eletrodo compósito 70% (grafite, m/m), em DPV, com a = 10 mV e ν = 50 mV s-1 e também com o carbono vítreo, para comparação. Antes de cada medida foi feita uma adição de volume adequado de solução estoque do analito e agitação do sistema para a homogeneização do meio. As medidas voltamétricas foram realizadas sem a necessidade de renovação da superfície do eletrodo compósito entre as determinações sucessivas, em um intervalo de concentração de DA entre 4,0 e 95 µmol L-1, como apresentado na Figura 4. Acima de 75 µmol L-1 parece haver desvio da linearidade devido à saturação dos sítios ativos da superfície do eletrodo.
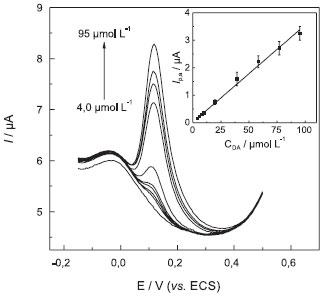 Figura 4. Voltamogramas de pulso diferencial obtidos com eletrodo compósito grafite-Araldite® 70% (grafite, m/m), em tampão fosfato pH 6,0, em concentrações crescentes de DA (4,0, 6,0, 8,0, 10, 20, 40, 60, 80 e 95 μmol L-1). n = 10 mV s-1 e a = 50 mV. Inserção: curva analítica
Uma curva linear foi obtida no intervalo entre 4,0 e 95 µmol L-1 (inserção - Figura 4), obedecendo a Equação 10:
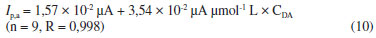
O limite de detecção (LD) calculado foi de 1,3 µmol L-1. Segundo Long e Winefordner,28 o LD é determinado como sendo três vezes o desvio padrão do sinal do branco (Sd), dividido pelo coeficiente angular da reta (b), conforme Equação 11.

O limite de quantificação (LQ)28 obtido foi de 4,2 µmol L-1, determinado como sendo dez vezes o desvio padrão do sinal do branco (Sd), dividido pelo coeficiente angular da reta (b), conforme Equação 12.

Experimento 3 - Quantificação de dopamina em formulação farmacêutica pelo método da adição de padrão Neste experimento os alunos terão a oportunidade de aplicar o método desenvolvido na quantificação de DA em uma amostra comercial. Após definida a relação linear entre a concentração de DA e o sinal de resposta do equipamento, neste caso a corrente de pico, o método de adição de padrão foi empregado na determinação voltamétrica da DA presente na formulação farmacêutica na forma injetável Inotropisa® (Hypofarma) que, de acordo com informações do rótulo, contém 5,0 mg mL-1 (0,026 mol L-1) e trata-se de solução contendo apenas DA. Nesse ponto, vale ressaltar que o método de adição de padrão é comumente empregado para determinações em amostras complexas por minimizar ou até mesmo eliminar os efeitos da matriz, ou seja, as interferências causadas por componentes da amostra sobre o sinal analítico.29 Para este procedimento, considerando informação do rótulo, uma solução estoque da amostra, de concentração aproximada de 2,0 mmol L-1 de DA, foi preparada pipetando-se 3,8 mL de DA injetável e diluindo-se com tampão fosfato pH 6,0 em balão volumétrico de 50,0 mL. Em seguida, uma alíquota de 300 µL dessa solução foi transferida para a célula voltamétrica contendo 20,0 mL de solução tampão fosfato pH 6,0 para se obter a solução amostra contendo aproximadamente 29,55 µmol L-1. À amostra foram feitas adições sucessivas de padrão nas concentrações de 29,1; 38,6; 48,1 e 57,4 µmol L-1 a partir de uma solução padrão estoque de concentração igual a 2,0 mmol L-1 de DA. Para a amostra e padrões adicionados foram obtidos voltamogramas de pulso diferencial, em triplicata, utilizando as condições experimentais otimizadas anteriormente (Figura 5). Um gráfico dos valores de corrente de pico anódico em função da concentração de padrão adicionado foi usado para cálculo da concentração de DA na amostra do medicamento injetável (inserção - Figura 5).
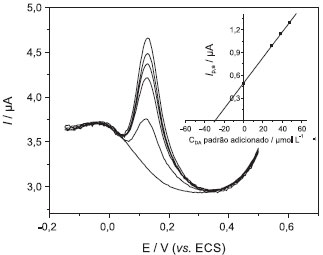 Figura 5. Voltamogramas de pulso diferencial e curva de adição de padrão obtidos com eletrodo compósito grafite-Araldite® 70% (grafite, m/m), em tampão fosfato pH 6,0, para quantificação de DA na formulação farmacêutica Inotropisa®. n = 10 mV s-1 e a = 50 mV
As adições de DA padrão à solução da formulação farmacêutica Inotropisa® mostraram recuperação entre 92,2 e 115,5%. O teste de recuperação foi realizado a partir da curva de adição de padrão, cuja equação de reta foi Ip,a = 2,1987 + 0,65796 × CDA. Substituindo-se os valores de Ip,a medidos na equação da reta, obtiveram-se os valores de concentração "recuperados", os quais foram comparados àqueles realmente adicionados. Os resultados obtidos na determinação de DA no fármaco por DPV foram comparados aos obtidos por cromatografia líquida de alta eficiência (HPLC), que consiste no método padrão descrito na Farmacopéia Americana (USP).11 A solução padrão foi obtida pela diluição de solução padrão estoque de DA (1,6 mg mL-1), obtendo-se 0,16 mg mL-1 de DA em fase móvel. A solução da amostra da formulação farmacêutica foi preparada com concentração de 0,16 mg mL-1 de DA. Foram injetados separadamente no cromatógrafo volumes iguais (20,0 µL) das soluções amostra e padrão, e a partir das áreas do picos obtidos nos cromatogramas a quantidade de DA em mg, em cada mL da solução injetável Inotropisa® foi calculada utilizando-se a Equação 13:
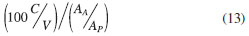
na qual C é a concentração, em mg mL-1, de DA na solução padrão, V é o volume tomado, em mL, da solução injetável Inotropisa®, e AA e AP são as áreas do picos cromatográficos obtidos das soluções amostra e padrão, respectivamente. Os resultados estão apresentados na Tabela 3.

Os resultados obtidos pelo método proposto DPV concordam com os do método comparativo HPLC em 95% de confiança, segundo o teste t-Student, quando se consideram os desvios padrão pareados.
CONSIDERAÇÕES FINAIS Tais experimentos envolvendo dopamina com sonda eletroquímica são propostos para alunos de cursos de análise instrumental usando técnicas voltamétricas (CV e DPV), em eletrodos compósitos. Todos são factíveis em aulas experimentais e envolvem instrumentação comum em laboratórios de química analítica, permitindo chegar a uma série de resultados e promover ricas discussões para cursos de química analítica.
AGRADECIMENTOS À FAPESP (Procs. 05/02497-1, 2011/02705-6 e 2010/11080-7), CNPq e CAPES.
REFERÊNCIAS 1. Kissinger, P. T.; Heineman, W. R.; Laboratory techniques in electroanalytical chemistry, Marcel Dekker: New York, 1984. 751 p. 2. Valentini, F.; Amine, A.; Orlanducci, S.; Terranova, M. L.; Palleschi, G.; Anal. Chem. 2003, 75, 5413. 3. Zittel, H. E.; Miller, F. J.; Anal. Chem. 1965, 37, 200. 4. Miller, F. J.; Zittel, H. E.; Anal. Chem. 1963, 35, 1866. 5. Edmonds, T. E.; Anal. Chim. Acta 1985, 175, 1. 6. Adams, R. N.; Anal. Chem. 1958, 30, 1576. 7. Mendes, R. K.; Claro-Neto, S.; Cavalheiro, E. T. G.; Talanta 2002, 57, 909. 8. Oliveira, A. C.; Santos, S. X., Cavalheiro, E. T. G.; Talanta 2008, 74, 1043. 9. Cavalheiro, E. T. G.; Brett, C. M. A.; Oliveira-Brett, A. M.; Fatibello-Filho, O.; Bioanal. Rev. 2012, 4, 31. 10. Calixto, C. M. F.; Cervini, P.; Cavalheiro, E. T. G.; Quim. Nova 2008, 31, 2194. 11. United States Pharmacopeia (USP) Convention; US Pharmacopeia 16, Rockville, 1984, p. 1989. 12. Cross, A. J.; Crow, T. J.; Ferrier, I. N.; Johnson, J. A.; Markakis, D.; Neurosci. Lett. 1984, 52, 1. 13. Wightman, R. M.; May, L. J.; Michael, A. C.; Anal. Chem. 1988, 60, 769A 14. Rover-Junior, L.; Fernandes, J. C. B.; Oliveira-Neto, G.; Kubota, L. T.; J. Electroanal. Chem. 2000, 481, 34. 15. Nagaraja, P.; Vasantha, R. A.; Sunitha, K. R.; J. Pharm. Biomed. Anal. 2001, 25, 417. 16. Chen, J.; Shi, Y.; Liu, J.; J. Chromatogr. A 2003, 1003, 127. 17. Shankar, S. S.; Swamy, B. E. K.; Chandreshekar, B. N.; J. Mol. Liq. 2012, 168, 80. 18. Li, J.; Zhao, J.; Wei, X.; Sens. Actuators, B 2009, 140, 663. 19. Oztekin, T. M.; Bilici, E.; Mikoliunaite, L.; Yazicigil, Z.; Ramanaviciene, A.; Ramanavicius, A.; Electrochim. Acta 2012, 76, 201. 20. Afkhami, A.; Nematollahi, D.; Khalafi, L.; Rafiee, M.; Int. J. Chem. Kinet. 2005, 37, 17. 21. Christian, G. D.; Purdy, W. C.; J. Electroanal. Chem. 1962, 3, 363. 22. Caruso, C. S.; Vieira, I. C.; Fatibello-Filho, O.; Anal. Lett. 1999, 32, 39. 23. Bard, A. J.; Faulkner, L. R.; Electrochemical methods: fundamentals and applications. 2nd ed., Wiley: New York, 2001, 833 p. 24. Osteryoung, J.; J. Chem. Educ. 1983, 60, 296. 25. Barros-Neto, B.; Scarminio, I. S.; Bruns, R. E.; Planejamento e otimização de experimentos. Editora da UNICAMP: Campinas, 1995. 26. Zhao, H.; Zhang, Y.; Yuan, Z.; Anal. Chim. Acta 2001, 441, 117. 27. Shahrokhian, S.; Saberi, R. S.; Int. J. Electrochem. Sci. 2007, 2, 158. 28. Long, G. L.; Winefordner, J. D.; Anal. Chem. 1983, 55, 712A. 29. Willard, H.; Merrit Jr., L.; Dean, J.; Análise Instrumental, 2ª ed., Calouste Gulbenkian: Lisboa, 1979, p.442.
#Endereço atual: Instituto de Ciências Exatas e Tecnológicas, Universidade Federal de Viçosa, Rio Paranaíba - MG, Brasil |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





