Nota Técnica
|
|
| Extração assistida por ultrassom para determinação colorimétrica de ferro em solo: uma comparação com espectrometria de massa com plasma indutivamente acoplado Ultrasound-assisted extraction for colorimetric determination of iron in soil: a comparison with inductively coupled plasma mass spectrometry |
|
Paula Cristiana de FreitasI; Rui Miguel de CarvalhoII; Jessee Severo Azevedo SilvaII; Thiago PradoI; Elis Regina DuarteI; Vera L. A. FrescuraII; Eduardo S. ChavesI,*
IDepartamento de Engenharia Química, Universidade Tecnológica Federal do Paraná, 84016-210 Ponta Grossa - PR, Brasil Recebido em 30/08/2014 *e-mail: eschaves@utfpr.edu.br A simple procedure for ultrasound-assisted extraction and colorimetric determination of iron in soil samples was developed. The iron concentration in the analyzed samples was determined by the colorimetric method and the results compared with inductively coupled plasma mass spectrometry (ICP-MS). Fifteen soil samples were analyzed and the iron concentration results compared with those obtained by ICP-MS using microwave-assisted sample digestion. The proposed procedure showed good efficiency for iron extraction and the results obtained by colorimetric determination exhibited good agreement with ICP-MS. Moreover, ultrasound-assisted extraction and colorimetric determination is a simple, fast and low-cost procedure for application in routine analysis. INTRODUÇÃO O Ferro (Fe) é um dos elementos mais abundantes no solo, sendo adotado como um dos indicadores de fertilidade.1,2 Isso por que a quantidade de ferro presente no solo está associada a características das águas subterrâneas, atividade microbiana, distribuição de matéria orgânica e também aos padrões de agregação do solo.3,4 No Brasil, onde a economia é voltada, em grande parte, para a agricultura e pecuária, a qualidade do solo, bem como o conhecimento das suas características físico-químicas, é fundamental para a sustentabilidade desses sistemas. Neste sentido, várias metodologias analíticas vêm sendo propostas para a determinação de metais, incluindo Fe, utilizando diferentes técnicas. Entre as técnicas mais amplamente utilizadas para a determinação elementar em solos estão a espectrometria de absorção molecular (UV-Vis), espectrometria de absorção atômica (AAS), espectrometria de emissão óptica com plasma indutivamente acoplado (ICP OES), espectrometria de massa com plasma indutivamente acoplado (ICP-MS) e a espectrometria de fluorescência de Raio-X.5-8 Entretanto, a determinação de Fe, bem como de outros metais em amostras de solo, não é uma tarefa simples. Isso se deve ao alto teor inorgânico da matriz, o que a torna uma amostra de difícil decomposição. Assim, para a decomposição total de amostras de solo, geralmente são necessários métodos laboriosos e que requerem reagentes perigosos.6 Os métodos mais comuns para o preparo de amostras de solo são a digestão em meios ácidos como HF, HNO3, H2SO4 e HClO4 e aquecimento em frasco aberto9,10 e a digestão ácida assistida por micro-ondas.8,11-13 Além disso, muitos dos métodos propostos utilizam grandes volumes dos ácidos concentrados, muitas vezes perigosos e que necessitam de altas temperaturas e pressão. Nesse sentido o desenvolvimento de métodos de preparo de amostras que possibilitem a utilização de menores quantidades de reagentes, temperaturas brandas e que não necessite de equipamentos onerosos ou sofisticados é extremamente importante. A utilização da extração assistida por ultrassom é uma alternativa para o preparo de amostras, sendo um procedimento simples, rápido e que, geralmente, não requer a utilização de reagentes perigosos.14-16 Assim, a extração assistida por ultrassom vem sendo utilizada para a extração de metais em amostras biológicas e ambientais para a posterior determinação por diversas técnicas analíticas.17-19 A extração assistida por ultrassom é baseada na ação de ondas mecânicas de baixa frequência às quais resultam na cavitação, fenômeno responsável pela formação e colapso de bolhas de cavitação que refletem em áreas pontuais de alta pressão e temperatura, facilitando o processo de extração dos elementos.18,20 A determinação de metais por espectrometria de massa com plasma indutivamente acoplado (ICP-MS) é amplamente utilizada, devido a vantagens tais como determinações multielementares e alta sensibilidade.6,7,21-23 Contudo, a técnica apresenta alto custo, o que muitas vezes limita a sua utilização por muitos laboratórios. Assim, métodos que utilizem técnicas bem estabelecidas, porém mais acessíveis, como a espectrometria de absorção molecular na região do Uv-Vísivel, têm sido cada vez mais adotados devido a sua simplicidade, baixo custo operacional e boa reprodutibilidade.19,24-26 Neste sentido, o objetivo deste trabalho é desenvolver um método simples e rápido para a extração de Fe em amostras de solo, utilizando extração assistida por ultrassom e determinação colorimétrica por espectrometria de absorção molecular UV-Vis. Os parâmetros de mérito e os resultados foram comparados com os obtidos por ICP-MS utilizando digestão ácida assistida por micro-ondas.
PARTE EXPERIMENTAL Equipamentos As determinações foram realizadas utilizando um espectrômetro de absorção molecular UV-Vis (FEMTO 800XI) e espectrômetro de massa com plasma indutivamente acoplado (ICP-MS) Elan 6000 (Perkin Elmer-Sciex) e argônio (99,996%, White Martins, São Paulo, Brasil) como gás do plasma. Os parâmetros instrumentais utilizados para as determinações de ferro por colorimetria e por ICP-MS são apresentados na Tabela 1. Balança analítica (BEL Engineering MARK 205A) foi utilizada para as medidas de massa. A umidade das amostras foi medida utilizando balança térmica (Top Ray, Bel Engineering), para as determinações por colorimetria, foi utilizada a extração do analito assistida por ultrassom em banho ultrassônico UNIQUE, USC-1400A 40KHz. Para as determinações por ICP-MS utilizou-se digestão ácida assistida por micro-ondas Milestone MLS 1200 Mega (Sorisole, Itália).
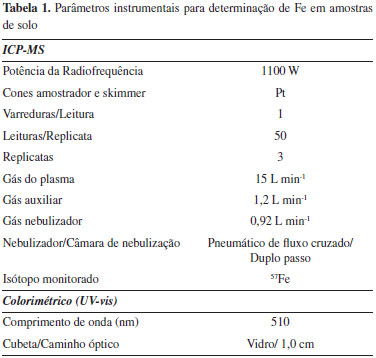
Materiais Reagentes Todos os reagentes utilizados foram de grau analítico. Para as determinações colorimétricas utilizou-se água ultrapura com resistividade de 18 MΩ cm, obtida em sistema de purificação GEHAKA (Master All 2000), ácido clorídrico 37% v/v P.A (ALPHATEC, Macaé, Brasil), ácido acético glacial P.A e acetato de sódio P.A (IMPEX, Novo Hamburgo, Brasil). Cloridrato de hidroxilamina P.A (VETEC) foi utilizado como agente redutor e 1,10-fenantrolina P.A (VETEC) utilizada como complexante. Para calibração foi utilizada solução estoque de ferro (100 mg L-1 ), obtida de Sulfato de Ferro(II) e Amônio Hexahidratado PA (VETEC). Para a avaliação de possíveis interferentes utilizou-se soluções estoque (100 mg L-1 ) de cada cátion avaliado preparadas a partir de: sulfato de cobalto P.A (SYNTH, Diadema, Brasil); sulfato de cobre P.A (DINÂMICA, Diadema, Brasil); sulfato de zinco P.A (BIOTEC, Porto Alegre, Brasil); sulfato de alumínio P.A cristalizado (REAGEN, Colombo); cloreto de bário P.A (REAGEN); sulfato de magnésio heptahidratado P.A (VETEC) e cloreto de cálcio P.A (BIOTEC). Para as determinações por ICP-MS utilizou se água ultrapura com resistividade de 18 MΩ cm, obtida em sistema de purificação Milli-Q (Millipore, Bedford, EUA), ácido nítrico 65% v/v e ácido clorídrico 37% v/v (Merck, Darmstadt, Alemanha) bidestilados abaixo da temperatura de ebulição em destilador de quartzo. Ácido fluorídrico 40% v/v (Merck) foi tridestilado em destilador de Teflon® (Kurner Analysentechnik, Rosenheim, Alemanha). Peróxido de hidrogênio 30% v/v supra-puro (VETEC, Duque de Caxias, Brasil) e ácido bórico (VETEC) solução saturada a 5% m/v foram utilizados para eliminação dos fluoretos das amostras digeridas. Amostras de solo A exatidão das determinações realizadas por colorimetria e ICP-MS foi avaliada através da análise de amostras de referência, Robin Test River Sediment Sample (RS-3) e Quality Control Material LGCQC 3004 (Clay Soil 1). Para comparação dos métodos foram analisadas 15 amostras de solos provenientes de duas diferentes regiões do município de Ponta Grossa no estado do Paraná. As amostras foram devidamente homogeneizadas e peneiradas em malha de nylon 75 µm. Procedimento analítico Colorimetria (UV-Vis) Para a extração do ferro, uma alíquota de 0,05 g de solo foi diretamente pesada em tubos de ensaio, adicionou-se 1 mL de solução extratora, ácido clorídrico 12 mol L-1 (37% v/v P.A) e submeteu-se à ação do ultrassom, em banho ultrassônico, à temperatura de 55 ± 5 ºC e durante 30 minutos. Após a extração, as amostras foram avolumadas para 10 mL. Para a reação de complexação do ferro com a 1,10-fenantrolina, uma alíquota de 100 µL da amostra foi pipetada em um tubo de 15 mL, em seguida adicionou-se 250 µL da solução redutora de hidroxilamina (10% m/v) e manteve-se a solução em repouso por 5 minutos. Posteriormente, foi adicionado 1 mL da solução tampão ácido acético/acetato (pH 4,5), e de 250 µL da solução de 1, 10 - fenantrolina (1% m/v). As amostras foram avolumadas para 10 mL e após 30 minutos de reação a absorbância foi lida em espectrômetro de UV-Vis a 510 nm. A calibração foi realizada com padrões de ferro submetidos ao mesmo procedimento. ICP-MS Para as determinações de ferro por ICP-MS, aproximadamente 0,10 g de solo foi pesado nos frascos de digestão, adicionou-se 4 mL de HNO3, 1 mL de HCl, 1 mL de H2O2 e 0,5 mL de HF e, em seguida, as amostras foram submetidas à digestão em forno de micro-ondas conforme descrito por Silva et al.27 Após a digestão, adicionou-se às soluções 4 mL de ácido bórico 5% m/v e submeteu-se novamente ao programa de digestão em forno de micro-ondas, para eliminação dos fluoretos.27 As amostras digeridas foram avolumadas para 50 mL com água ultrapura, diluídas adequadamente (1:10 v/v ou 1:100 v/v) e, posteriormente, a concentração de ferro foi determinada usando calibração externa e Rh (10 µg L-1 ) como padrão interno. Análise estatística O tratamento estatístico foi efetuado utilizando-se a análise de variância ANOVA unifatorial com intervalo de confiança de 95% e o teste de Tukey com nível de significância α= 0,05 utilizando o software Sisvar. 28
RESULTADOS E DISCUSSÃO Extração assistida por ultrassom Como a composição do solo pode ser muito diferente de uma região para outra, os parâmetros para extração foram otimizados utilizando uma amostra composta de uma mistura uniforme e homogênea, contendo os diferentes tipos de solo analisados. Para a otimização do procedimento de extração do ferro das amostras de solo, foi avaliada a influência de parâmetros como a temperatura e tempo de extração, além da concentração do ácido extrator. O solvente extrator eleito não deveria apresentar características oxidantes, uma vez que somente o ferro (II) forma complexo com a 1,10-fenantrolina, assim o ácido clorídrico (HCl) foi utilizado como extrator.20,26 Para a otimização da temperatura de extração de ferro do solo, foram avaliadas as extrações em temperatura ambiente (25 ± 3 ºC) e sob aquecimento a 55 ± 5 ºC. A concentração de HCl e o tempo de ação do ultrassom foram fixados em 12 mol L-1 e 30 minutos, respectivamente, sendo que os resultados obtidos em mg g-1 de ferro estão apresentados na Figura 1.
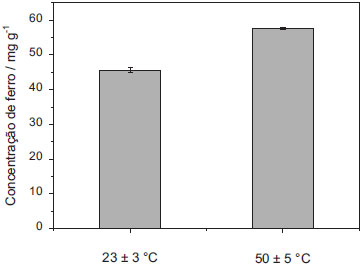 Figura 1. Otimização da temperatura de extração, temperatura ambiente (25 ± 3 ºC) e sob aquecimento (55 ± 5 ºC). Utilizando solvente extrator: HCl 12 mol L-1, Tempo de ultrassom: 30 min
Os resultados obtidos demostraram que o aquecimento de 55 ± 5 ºC proporcionou uma eficiência maior na extração do ferro, uma vez que nestas condições foram obtidas concentrações superiores, se comparada à extração sem aquecimento (25 ± 3 ºC). A ação do ultrassom em temperatura de 50 ºC favorece a formação de núcleos de cavitação, o que por sua vez aumenta a eficiência de extração, conforme relatado na literatura.19 Assim, as demais otimizações foram realizadas com aquecimento a 55 ± 5 ºC para extração em ultrassom. O tempo de permanência no ultrassom para extração de ferro das amostras de solo foi avaliado e os resultados estão apresentados na Figura 2. Observou-se que a extração de ferro das amostras de solo não foi efetiva até 10 min de extração. Entretanto, a partir de 20 min não houve diferença significativa entre os resultados obtidos nos diferentes tempos de extração avaliados. O tempo selecionado para as demais otimizações foi de 30 min, uma vez que os valores de desvio padrão obtidos com 20 min de extração foram relativamente maiores.
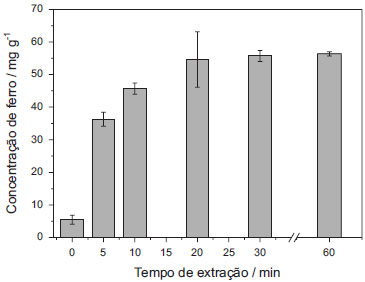 Figura 2. Otimização do tempo de extração. Utilizando solvente extrator: HCl 12 mol L-1 Temperatura: 55 ± 5 ºC
A concentração do HCl utilizado como extrator foi também otimizada avaliando-se o efeito de concentrações de HCl variando de 0 a 12 mol L-1 . Os resultados obtidos são apresentados na Figura 3. A ausência de HCl não proporcionou uma extração significativa de ferro. O aumento na concentração de HCl entre 1,2 e 6 mol L-1 resultou em um aumento significativo na extração de ferro, observado pelo aumento da concentração obtida. Não houve diferença significativa nas extrações realizadas com HCl na concentração entre 9 e 12 mol L-1, sendo que os valores obtidos para ferro foram expressivamente superiores aos obtidos com concentrações menores de HCl. Contudo, optou-se por utilizar HCl 12 mol L-1 já que o desvio padrão obtido para HCl 9 mol L-1 foi relativamente alto. Assim, as condições ótimas para extração de ferro em amostras de solo foram: HCl 12 mol L-1 como extrator, temperatura de 55 ± 5 ºC e tempo de extração 30 minutos, sendo essas condições utilizadas para as determinações colorimétricas
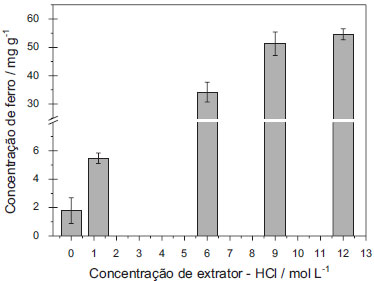 Figura 3. Otimização da concentração do solvente extrator, HCl. Utilizando tempo de extração: 30 min, Temperatura: 55 ± 5 ºC
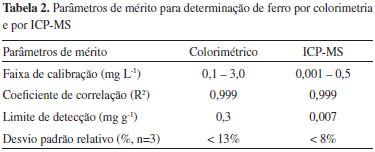
Parâmetros de mérito e verificação da exatidão Os parâmetros de mérito para determinação de Fe em amostras de solo foram obtidos para as determinações colorimétricas usando extração assistida por ultrassom e também por ICP-MS. Os coeficientes de correlação linear obtidos foram maiores que 0,999 para ambas as técnicas avaliadas e a precisão, expressa como desvio padrão relativo (RSD, n=3), foi menor que 13% para as análises colorimétricas e inferiores a 8% para as determinações por ICP-MS. Os limites de detecção (LOD) foram calculados considerando-se 3 vezes o desvio padrão de dez medidas consecutivas do branco das amostras dividido pelo valor da inclinação da respectiva curva de calibração. Os LODs dos métodos obtidos para as duas técnicas são apresentados na Tabela 2. Como esperado, os LODs obtidos para técnica de ICP-MS foram significantemente inferiores aos obtidos por colorimetria, contudo, o LOD de 0,3 mg g-1 obtido para as determinações colorimétricas são adequados para a determinação de Fe em amostras de solo, já que normalmente este elemento encontra-se em concentrações relativamente altas neste tipo de amostra. Os limites de quantificação (LOQ), definidos como 3,3 vezes o LOD, podem ser facilmente obtidos a partir dos dados da Tabela 2.
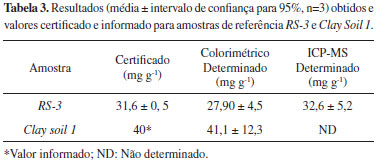
A verificação da exatidão foi realizada através de análise de amostras de referência com concentrações certificadas e informadas para ferro. Os resultados obtidos estão apresentados na Tabela 3, e demonstram boa concordância com o valor certificado (RS-3) e informado (Clay Soil 1) tanto para as determinações por colorimetria quanto por ICP-MS, de acordo com o teste-t, considerando um nível de confiança de 95%.
Interferências A 1,10-fenantrolina é um agente complexante que pode formar complexos com vários metais de transição tais como zinco, manganês e ferro.21-23 Assim, com a finalidade de testar a interferência de cátions conhecidamente presentes nas amostras de solo, tais como Al3+, Ba2+, Ca2+, Co2+, Cu2+, Mg2+ e Zn2+, a influência destes elementos sobre a complexação do Fe 2+ foi avaliada pela adição de uma concentração do cátion interferente (Ci) de 10 mg L-1 em solução aquosa de concentração de ferro (CFe) 1 mg L-1 . A interpretação dos resultados obtidos permitiu afirmar que os íons na razão de concentrações avaliada Aplicação analítica e comparação com ICP-MS O método colorimétrico de análise com extração assistida por ultrassom foi aplicado para a determinação de Fe em diferentes amostras de solo e os resultados comparados com os obtidos por ICP-MS. Na Tabela 4 estão apresentados os resultados, média ± intervalo de confiança de 95%, obtidos utilizando-se extração assistida por ultrassom e determinação através do método colorimétrico e os resultados obtidos por ICP-MS para os diferentes tipos de solo analisados.
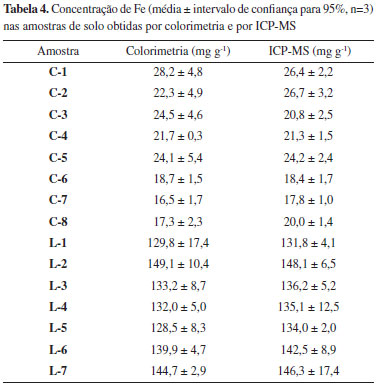
As amostras de solo denominadas C e L foram coletadas em localidades diferentes da região do município de Ponta Grossa, PR, assim apresentam características distintas. Isso explica as diferenças nas concentrações de Fe observadas entre os dois tipos de solo. Entretanto, as pequenas variações observadas entre as amostras de solo de mesma característica podem estar relacionadas às diferentes práticas de manejo utilizadas no local onde as amostras foram coletadas.24 Para comparação dos resultados obtidos por colorimetria e ICP-MS foi realizada análise de variância ANOVA unifatorial com intervalo de confiança de 95% e o teste de Tukey com nível de significância α = 0,05. Os resultados obtidos demostraram que não houve diferença estatística entre os resultados obtidos por colorimetria e por ICP-MS para as amostras de solo analisadas. A correlação entre os resultados obtidos por colorimetria usando extração assistida por ultrassom com os resultados obtidos por ICP-MS utilizando digestão acida assistida por micro-ondas estão apresentados na Figura 4.
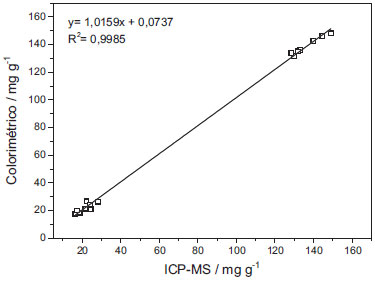 Figura 4. Relação entre os resultados obtidos por colorimetria usando extração assistida por ultrassom e os obtidos por ICP-MS usando digestão ácida assistida por micro-ondas
Os dados obtidos demostram que há uma boa correlação linear entre os resultados (R2 = 0,9985), o valor do coeficiente angular próximo a 1 (1,0159) e um intercepto relativamente baixo e próximo de zero (0,0737), o que indica claramente que os resultados obtidos através do método colorimétrico usando extração assistida por ultrassom apresentam boa concordância com os obtidos por ICP-MS com digestão ácida, demostrando a eficiência da extração assistida por ultrassom para determinação de ferro em amostras de solo.29
CONCLUSÃO O método proposto para determinação de ferro em amostras de solo utilizando extração assistida por ultrassom e determinação colorimétrica por UV-vis mostrou-se simples, rápido e preciso. Os resultados obtidos foram comparáveis aos obtidos por ICP-MS utilizando a digestão ácida assistida por micro-ondas como preparo das amostras, demostrando a eficiência da extração e exatidão do método proposto. Entretanto, a extração assistida por ultrassom, além de não requerer a digestão completa da amostra, utiliza quantidades reduzidas de reagentes, o que minimiza os custos e os resíduos gerados durante a análise.
AGRADECIMENTOS À Universidade Tecnologia Federal do Paraná, Universidade Federal de Santa Catarina e ao Programa de Educação Tutorial - PET, SESU/MEC.
REFERÊNCIAS 1. Harm, B.; Gerrit, E. Schaepman M.; Int. J. Appl. Earth Obs. Geoinf. 2007, 9, 194. DOI: http://dx.doi.org/10.1016/j.jag.2006.09.001 2. González, A. G.; Pokrovsky O. S.; Shirokova L. S.; Santana-Casiano, J. M. Emnova E. E.; Chem. Geol. 2014, 372, 32. DOI: http://dx.doi.org/10.1016/j.chemgeo.2014.02.013 3. Wilson, C. A.; Cloy, J. M.; Graham, M. C.; Hamlet, L. E.; Geoderma 2013, 202, 71. DOI: http://dx.doi.org/10.1016/j.geoderma.2013.03.020 4. Neubauer, E.; Schenkeveld D. C. W.; Plathe, K.; Rentenberger, C.; Kammer, F.; Kraemer, S. M.; Hofmann, T.; Sci. Total Environ. 2013, 462, 108. DOI: http://dx.doi.org/10.1016/j.scitotenv.2013.04.076 5. Ahmed, M. J.; Uddin, M. N.; Chemosphere 2007, 67, 2020. DOI: http://dx.doi.org/10.1016/j.chemosphere.2006.09.019 PMID: 17215023 6. Soodan, R. K.; Pakade, Y. B.; Nagpal, A.; Katnoria, K. J.; Talanta 2014, 125, 405. DOI: http://dx.doi.org/10.1016/j.talanta.2014.02.033 PMID: 24840464 7. Picoloto, R. S.; Wiltsche, H.; Knapp, G.; Mello, P. A.; Barin, J. S,; Flores, E. M. M.; Spectrochim. Acta, Part B 2013, 86, 123. DOI: http://dx.doi.org/10.1016/j.sab.2013.01.010 8. Frentiu, T.; Mihaltan, A. I.; Senila, M.; Darvasi, E.; Ponta, M.; Frentiu, M.; Pintican, B. P.; Microchem. J. 2013, 110, 545. DOI: http://dx.doi.org/10.1016/j.microc.2013.06.009 9. Fernandes, R. B. A.; Luz, W. V.; Fontes, M. P. F.; Fontes, L. E. F.; Rev. Bras. Eng. Agríc. Ambient. 2007, 11, 81. DOI: http://dx.doi.org/10.1590/S1415-43662007000100011 10. Campos, M. L; Guilherme, L. R. G; Melo Marques, J. J. G. S. M.; Curi, N.; Araújo, A. S. A.; Miquelluti, D. J.; Lopes, C.; Spiazzi, F. R.; Rev. Bras. Ciênc. Solo. 2013, 37, 281. DOI: http://dx.doi.org/10.1590/S0100-06832013000100029 11. Biondi, C. M.; Nascimento, C. W. A.; Brito, F. A.; Ribeiro, M. R.; Rev. Bras. Ciênc. Solo 2011, 35, 1057. DOI: http://dx.doi.org/10.1590/S0100-06832011000300039 12. Biondi, C. M.; Nascimento, C. W. A. Fabricio N. A. B.; Rev. Bras. Ciênc. Solo, 2011, 35, 1819. DOI: http://dx.doi.org/10.1590/S0100-06832011000500036 13. Alvarez, M. A.; Carrillo, G.; Talanta 2012, 97, 505. DOI: http://dx.doi.org/10.1016/j.talanta.2012.05.006 PMID: 22841115 14. Bortoluzzi, E. C.; Poleto, C.; Baginski, A. J.; Silva, V. R.; Rev. Bras. Ciênc. Solo 2010, 34, 725. DOI: http://dx.doi.org/10.1590/S0100-06832010000300014 15. Rodrigues, C.; Oliveira, V. A.; Silveira, P. M.; Santos, G. G.; Rev. Bras. Ciênc. Solo 2011, 35, 1589. DOI: http://dx.doi.org/10.1590/S0100-06832011000100010 16. Almeida, T. S.; Sant'Ana, M. O.; Cruz, J. M.; Tormen, L.; Curtius, A. J.; Alves, J. P. H.; Garcia, C. A. B.; Santos, P. A.; Araujo, R. G. O.; J. Braz. Chem. Soc. 2013, 24, 700. 17. Lima, A. F.; Richter, E. M.; Muñoz, R. A. A.; J. Braz. Chem. Soc. 2011, 22, 1519. DOI: http://dx.doi.org/10.1590/S0103-50532011000800016 18. Bendicho, C.; De La Calle, I.; Pena, I.; Costas, M.; Cabaleiro, N.; Lavilla, I.; TrAC, Trends Anal. Chem. 2012, 31, 50. DOI: http://dx.doi.org/10.1016/j.trac.2011.06.018 19. Moraes, P. M.; Loureiro, V. R.; Padilha, P. M.; Neves, R. C. F.; Saleh, M. A. D.; Santos, F. A.; Silva, F. A.; Quim. Nova 2009, 32, 923. DOI: http://dx.doi.org/10.1590/S0100-40422009000100033 20. Krug, F. J. Métodos de preparo de amostras - Fundamentos sobre preparo de amotras orgânicas e inorgânicas para analise elementar; Francisco José Krug, ed.; Piracicaba, 2008, cap. 3-5. 21. Makonnen, Y.; Beauchemin, D.; Spectrochim. Acta, Part B 2014, 99, 87. DOI: http://dx.doi.org/10.1016/j.sab.2014.06.015 22. Lin, M.; Jiang, S.; Food Chem. 2013, 141, 2158. DOI: http://dx.doi.org/10.1016/j.foodchem.2013.04.105 PMID: 23870942 23. Roje, V;.J. Braz. Chem. Soc. 2011, 22, 532. DOI: http://dx.doi.org/10.1590/S0103-50532011000300017 24. Araújo, L. B. D. C.; Silva, S. L.; Galvao, M. A. A.; Ferreira, M. R. A.; Araújo, E. L.; Randau, K. P.; Soares, L. A. L.; Rev. Bras. Farmacogn. 2013, 23, 736. DOI: http://dx.doi.org/10.1590/S0102-695X2013000500004 25. Sun, Y.; Dong, F.; Wang, D.; Li, Y.; J. Braz. Chem. Soc. 2011, 22, 1089. DOI: http://dx.doi.org/10.1590/S0103-50532011000600013 26. Breitkreitz, M. C.; Souza, A. M.; Poppi, R. J.; Quim. Nova 2014, 37, 564. 27. Silva, J. S. A.; Maranhao, T. A.; Oliveira, F. J. S.; Curtius, A. J.; Frescura, V. L. A.; J. Braz. Chem. Soc. 2014, 25, 1062. 28. Ferreira, D. F.; Ciência e Agrotecnologia (UFLA) 2011, 35, 1039. 29. Ivanov, K.; Zaprjanova, P.; Petkova, M.; Stefanova, V.; Kmetov, V.; Georgieva, D.; Angelova, V.; Spectrochim. Acta, Part B 2012, 71-72, 117. DOI: http://dx.doi.org/10.1016/j.sab.2012.05.013 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





