Artigo
|
|
| Aproveitamento de resíduo de biodiesel para preparação de carvões ácidos com elevada atividade catalítica na reação de eterificação do glicerol Utilization of biodiesel waste for acid carbon preparation with high catalyst activity in the glycerol etherification reaction |
|
Michelle MantovaniI; Erik Moda AguiarI; Wagner Alves CarvalhoI; Dalmo MandelliI; Maraisa GonçalvesI,II,*
ICentro de Ciências Naturais e Humanas, Universidade Federal do ABC, Rua Santa Adélia, 166, 09210-170 Santo André - SP, Brasil Recebido em 28/10/2014 *e-mail: maraisa_g@yahoo.com.br Environmentally friendly acid carbon (CG) catalysts, containing a high amount of sulfonated and oxygenated groups, were prepared from glycerin, a biodiesel waste. CGs were produced by glycerin carbonization in the presence of H2SO4 at 1:3 m:m ratio in a closed autoclave at 180ºC for different times: 0.25; 1; 3 and 6 hours (CG-0.25h; CG-1h; CG-3h and CG-6h, respectively). The catalyst properties for all carbons were evaluated in the glycerol etherification reaction with tert-butyl alcohol (TBA). The yield for mono-tert-butyl glycerol (MTBG), di-tert-butyl glycerol (DTBG) and tri-tert-butyl-glycerol (TTBG) was high and very similar for all CGs, of about 43% and 20% for the MTBG and DTBG + TTBG, respectively. Furthermore, the activity of these catalysts were close to those obtained using a commercial resin, Amberlyst-15, of about 50% and 27% for MTBG and DTBG + TTBG, respectively. INTRODUÇÃO A crescente preocupação com a conservação dos recursos naturais é uma das principais questões deste século. Assim, a busca por fontes renováveis para queima e geração de energia e que, se utilizada adequadamente, têm um menor impacto sobre as emissões de CO2 e geração de resíduos, tem motivado inúmeras pesquisas neste setor. A sociedade moderna é dependente de combustíveis fósseis, como petróleo e gás natural, porém, em todo o mundo, a viabilização da utilização de combustíveis renováveis é crescente, destacando-se entre estas novas fontes o biodiesel. No cenário mundial, o Brasil é um dos maiores produtores e consumidores de biodiesel. Na reação entre um éster (triglicerídeo) e um álcool (metanol ou etanol) na presença de um catalisador, obtém-se como principal produto o biodiesel e também um subproduto, a glicerina. Estima-se que para cada 9 kg de biodiesel produzido, aproximadamente 1 kg de glicerina é formado. De acordo com a Agência Nacional de Petróleo (ANP) em 2013 foram produzidos 267000 m3 de resíduo de biodiesel no Brasil.1 Este resíduo é composto basicamente por glicerol (80%), mas também pode conter resíduos de triglicerídeos, catalisadores, álcool e água, inviabilizando seu uso in natura.2 Assim, o estudo e desenvolvimento de tecnologias viáveis para utilização da glicerina, além de diminuir a extensão de problemas ambientais, podem transformá-la em materiais de maior valor econômico.3-5 Uma alternativa promissora para a transformação desse resíduo é a produção de carvão com características ácidas para aplicação como catalisador em inúmeras reações. Os carvões produzidos, além de agregar valor ao resíduo, também podem ser utilizados como catalisadores ácidos na reação de eterificação do glicerol, a qual também pode ser considerada outra forma de agregar valor a este resíduo.6,7 As reações de eterificação do glicerol são favorecidas em presença de sítios ácidos, principalmente os ácidos de Brönsted. A literatura apresenta vários estudos de catalisadores heterogêneos com propriedades ácidas, os quais apresentam boa eficiência na eterificação de glicerol, principalmente as resinas de troca iônica (Amberlyst) devido à constituição de sua superfície ser basicamente por grupos sulfônicos.8 Frusteri e colaboradores estudaram a reação de eterificação do glicerol em presença da resina Amberlyst-15, a 70 ºC, obtendo uma conversão de 82%.9 Viswanadham e Saxena empregaram resinas do tipo Amberlyst-15 e 35, zeólitas do tipo BEA, modernita e USY e uma zeólita nanocristalina sintetizada em laboratório (N-BEA) como catalisadores na eterificação do glicerol com terc-butanol obtendo maior conversão do glicerol (95%) em presença da N-BEA.10 Beatrice e colaboradores, estudando diferentes catalisadores como resina do tipo Hyflon suportada em dois tipos de sílica esférica (MS3030 e ES70Y) ou sílica coloidal (LM50) e resina do tipo Amberlyst-15, obtiveram melhor conversão do glicerol em presença de Amberlyst-15.11 Porém, os catalisadores tipo Amberlyst possuem um grande inconveniente, a baixa estabilidade térmica. Para substituir esses catalisadores, materiais a base de carbono consistem em uma promissora área de investigação para obtenção de catalisadores ácidos de elevada atividade catalítica, baixo custo e estabilidade térmica. A grande vantagem de preparação de carvões a partir de resíduos, além do valor agregado a estes, é a facilidade de inserção de grupos superficiais nestes sólidos durante ou após a carbonização. Carvões sulfonados a partir da carbonização de açúcares para utilização como catalisadores em reações de conversão do glicerol, principalmente na esterificação ou mesmo na eterificação foram investigados por diferentes pesquisadores. Janaun e Ellis estudaram carvão sulfonado obtido a partir da carbonização de glicose como catalisador na eterificação do glicerol com terc-butanol.12 Sanchez e colaboradores relatam a conversão completa do glicerol utilizando um catalisador obtido pela carbonização e sulfonação de glicose.13 Também, alguns autores relatam a utilização de um carvão sulfonado obtido a partir de resíduos lignocelulósicos para utilização como catalisador na eterificação do glicerol. Zhao e colaboradores, utilizando carvão sulfonado a partir de resíduos de amendoim para eterificação do glicerol, obtiveram elevada conversão de glicerol.14 Zhao e colaboradores mostraram a viabilidade da aplicação de carvões sulfonados para a eterificação de isopenteno com metanol.15 Em outros trabalhos publicados pelo grupo verificou-se a viabilidade da aplicação de catalisadores obtidos a partir de resíduos lignocelulósicos e de glicerol na reação de eterificação do glicerol em presença de terc-butanol. Gonçalves e colaboradores prepararam carvões a partir de resíduos lignocelulósicos e avaliaram suas propriedades catalíticas na eterificação de glicerol com terc-butanol, obtendo rendimento para os produtos MTBG (2-terc-butoxi-1,3-propanodiol e 3-terc-butoxi-1,2-propanodiol) de 40 a 60%.7 Galhardo e colaboradores, estudando a preparação de carvão sulfonado por diferentes métodos obtidos a partir de casca de arroz, obtiveram uma conversão de glicerol de 53%, com seletividade de 25% para os produtos DTBG (1,2-di-(terc-butoxi)-3-propanol e 1,3-di-(terc-butoxi)-2-propanol) + TTBG (1,2,3-tri-(terc-butoxi)-propano).16 Também foi estudada a preparação de carvão ácido a partir de resíduo de biodiesel nas proporções de 1:3 e 10:1 (mglicerina:mH2SO4) carbonizado por um período de 24 h. Os carvões obtidos quando utilizaram a proporção 1:3 apresentaram elevado rendimento para os produtos, 52 e 22% para o MTBG e DTBG + TTBG, respectivamente. O carvão preparado em menor proporção 10:1 apresentou baixa conversão do glicerol, porém, um tratamento com ácido sulfúrico a 180 ºC posterior à carbonização mostrou a viabilidade da aplicação deste material como catalisador na reação de eterificação do glicerol.5 Devido aos resultados promissores em trabalho anteriores, o objetivo deste trabalho foi estudar a preparação de um carvão com elevada acidez a partir de resíduo do biodiesel buscando diminuir os custos de preparação com o tempo de carbonização. Estes carvões foram caracterizados e suas propriedades catalíticas foram avaliadas na reação de eterificação do glicerol em presença do terc-butanol (TBA).
PARTE EXPERIMENTAL Preparação dos carvões Os carvões ácidos foram obtidos pela carbonização hidrotérmica do resíduo de biodiesel, glicerina (Oxiteno-Brasil), em presença de H2SO4 na proporção 1:3 (mglicerina:mH2SO4), condições baseadas em outros trabalhos publicados pelo grupo.5 A mistura de glicerina:ácido foi adicionada a um reator tipo autoclave e a carbonização realizada em forno mufla com temperatura controlada à 180 ºC, variando o tempo de carbonização em 0,25; 1; 3 e 6 h. Os carvões obtidos foram lavados em um extrator Soxhlet para remoção do excesso de ácido e seco em estufa a 100 ºC por 24 h. Os carvões de glicerina (CG) foram nomeados de acordo com o tempo de carbonização: CG-0,25h; CG-1h; CG-3h e CG-6h. Caracterização dos materiais As propriedades texturais dos carvões foram avaliadas por adsorção de N2 a -196 ºC, realizada em um equipamento Autosob 1- Quantachrome. As amostras foram previamente tratadas por 4 h a 150 ºC em sistema de vácuo para remoção de gases e água adsorvidos na superfície dos carvões. A análise da acidez superficial foi realizada por titulação ácido-base, utilizando 300 mg do carvão em contato com 25 mL de solução NaOH 0,1 mol L-1 mantida em agitação por 24 h. Uma alíquota de 10 mL desta solução foi, então, titulada com HCl (0,05 mol L-1), em titulador automático Metrohm. Para a avaliação dos grupos superficiais foi realizada a análise de infravermelho em um espectrômetro Varian com transformada de Fourier FT-IR 660. As amostras foram homogeneizadas em KBr na razão de aproximadamente 3:100 (mcarvão:mKBr). A mistura foi seca em estufa por 12 h, posteriormente esta foi prensada e a pastilha resultante submetida a análises por espectroscopia de FTIR do tipo transmissão. Os espectros foram medidos com acumulação de 100 scans de varredura e resolução de 4 cm-1. Para a quantificação de enxofre superficial foi realizada a análise de microscopia eletrônica de varredura com energia dispersiva de raios-X em um equipamento JEOL-JMS 6701F (Field emission scanning electron microscope). Para avaliação da estabilidade dos carvões foi realizada a análise termogravimétrica utilizando o equipamento TGA-Q500 da marca TA instruments. Cerca de 7 a 10 mg da amostra foram inseridos no forno, aquecendo de 30 a 800 ºC, sob taxa de aquecimento de 10 ºC min-1, com um fluxo de N2 de 100 mL min-1. Os espectros de fotoelétron de raios-X (XPS) foram obtidos em um equipamento VG-Microtech MULTILAB 3000, equipado com um analisador de elétrons hemisférico com fonte de raio-X Mg K (h = 1253.6 eV, 1 eV = 1,6302 × 10-19 J). Avaliação das propriedades catalíticas dos materiais A atividade catalítica dos carvões ácidos foi avaliada na eterificação do glicerol (99.5% - Sigma-Aldrich) em fase líquida com terc-butanol (TBA-99.7% - Sigma-Aldrich). A reação foi realizada em reator (PARR 4848) com autoclave de aço inoxidável. As reações foram realizadas na proporção molar glicerol:TBA de 1:4 (15 g:48,3 g), 5% de catalisador (% em relação a massa de glicerol), em atmosfera inerte de N2, a 120 ºC sob agitação de 600 rpm. As amostras foram coletadas em diferentes tempos de reação. A quantificação dos produtos foi realizada por cromatografia a gás (Agilent 7890-A, equipado com uma coluna capilar DB-Wax, 30 m × 0,25 mm × 0,25 µm) acoplada a detector por ionização em chamas. As condições de análise foram: temperatura de injetor e detector de 250 e 270 ºC, respectivamente, temperatura inicial da coluna de 50 ºC por 2 min e posterior aquecimento de 30 ºC min-1 até 230 ºC mantendo isotermicamente por 3 min e utilizando N2 como gás de arraste (1,6 mL min-1). O rendimento dos produtos foi calculado de acordo com a Equação 1 e a conversão do glicerol foi calculada pela Equação 2. 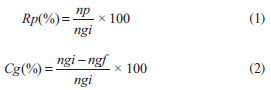 em que: Rp = rendimento do produto, np = número de mols do produto, Cg = conversão do glicerol, ngi = número de mols inicial de glicerol e ngf = número de mols final de glicerol.
RESULTADOS E DISCUSSÃO Caracterização dos carvões O rendimento para os carvões obtidos a partir de glicerina foi de 39-43%. Este rendimento é elevado quando comparado com rendimento para carvões obtidos a partir de material lignocelulósico (20-25%). Porém, resultado similar para carvões de glicerol foi encontrado por Prabhavathi Devi e colaboradores.17 Além do alto rendimento, outra importante característica desses carvões é o baixo teor de cinzas, menor que 1%. A área superficial, obtida a partir da análise de adsorção de N2, foi menor que 10 m2 g-1. A baixa área superficial pode ser devido ao processo de preparação dos carvões, pois estes foram apenas carbonizados em baixa temperatura (180 ºC) e não foram submetidos a um processo de ativação. A acidez superficial é considerada fundamental em reações de eterificação de glicerol, já que o processo envolve uma etapa inicial de protonação do agente eterificante e formação do carbocátion, com posterior eterificação do glicerol. A elevada atividade catalítica do catalisador comercial Amberlyst-15, (4,7 mmolH+ g-1 dados fornecidos pelo fabricante), é atribuída principalmente à acidez relacionada aos grupos sulfônicos. A acidez total dos carvões preparados em diferentes tempos de carbonização foi analisada por titulação de Boehm (ácido-base) e a quantificação de enxofre presente na superfície dos diferentes carvões foi realizada pela análise de microscopia eletrônica de varredura (MEV) acoplada a um detector de energia dispersiva de raios-X (EDX). Os resultados obtidos para acidez total e a quantidade de enxofre para todos os carvões são apresentados na Tabela 1.
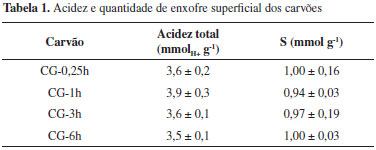
Pelos resultados obtidos verifica-se uma acidez superficial de aproximadamente 3,5 mmolH+ g-1. Além disso, vale destacar que o tempo de carbonização não influenciou na acidez superficial dos carvões. Esta acidez é similar a resultados encontrados por Valle-Vigón e colaboradores para diferentes carvões sulfonados, acidez total de 2,9 a 3,9 mmolH+ g-1.18 Zhang e colaboradores também prepararam carvão a partir de sucrose obtendo acidez total de 2,66 a 3,20 mmolH+ g-1, semelhante à obtida neste trabalho.19 Pelos resultados obtidos para a quantidade de enxofre (Tabela 1) verifica-se uma similaridade para todos os carvões, entre 0,94 a 1,00 mmol g-1. Os resultados para o enxofre são semelhantes ou melhores aos relatados na literatura. Janaun & Ellis prepararam carvão sulfonado mesoporoso, encontrando uma quantidade variável de enxofre de 0,53 a 1,30 mmol g-1.12 Mo e colaboradores prepararam carvão sulfonado a partir de glicose, obtendo acidez total de 3,70 mmol, sendo 0,67 mmol de enxofre.20 Pela análise de microscopia eletrônica de varredura com mapeamento elementar verifica-se a formação de estruturas sem uma forma e tamanho definido (Figura 1(a)), porém, há homogeneidade na dispersão de carbono, oxigênio e enxofre (Figura 1(b), 1(c) e 1(d), respectivamente), únicos elementos detectados na superfície dos carvões.
 Figura 1. Análise de dispersão dos elementos na superfície do CG-6h: (a) micrografia do carvão, (b) dispersão obtida para o carbono, (c) dispersão obtida para o oxigênio e (d) dispersão obtida para o enxofre
A fim de identificar os grupos funcionais na superfície dos carvões foi realizada a análise de espectroscopia de infravermelho e os espectros obtidos são apresentados na Figura 2.
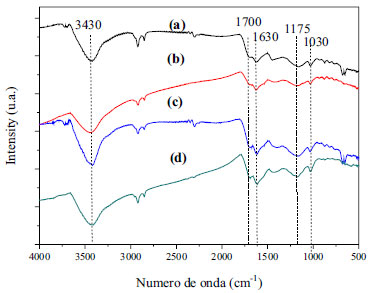 Figura 2. Espectro de infravermelho dos materiais obtidos: (a) CG-0,25h; (b) CG-1h; (c) CG-3h e (d) CG-6h
Todos os carvões apresentam bandas características de diversos grupos funcionais. Bandas em 3440 cm-1 são correspondentes a estiramento de grupos hidroxilas (-OH). Também é possível observar bandas em 1630 cm-1 que podem ser atribuídas a estiramento de ligações C=C13,21,22 formadas no processo de carbonização da glicerina. As bandas em 1700 cm-1 são características dos modos de estiramento de grupos carboxílicos (-COOH).14,23 Além disso, bandas características de estiramento assimétrico (1030 cm-1) e simétrico (1175 cm-1) de SO2 pertencentes a grupos -SO3H13,14,24,25 são observadas para todos os carvões, inferindo que o tempo de carbonização não influenciou na inserção destes grupos. Para avaliar a estabilidade dos grupos ácidos foi realizada a análise termogravimétrica dos carvões. Os resultados obtidos são apresentados na Figura 3.
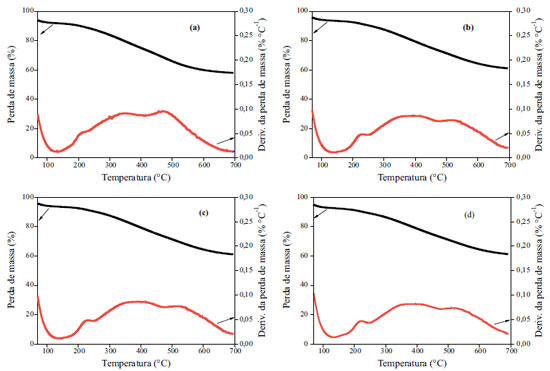 Figura 3. Análise termogravimétrica para todos os carvões: (a) CG-0,25h; (b) CG-1h; (c) CG-3h e (d) CG-6h
Existem relatos controversos com respeito à atribuição de temperatura específica para a decomposição de grupos específicos presentes na superfície de carvões. No entanto, algumas tendências gerais entre todos os carvões já foram estabelecidas por diferentes autores: existe um pico largo resultante da decomposição de grupos de ácidos carboxílicos e grupos sulfônicos em baixas temperaturas e, em temperaturas mais elevadas, os picos de lactona, fenol, éter e grupos das carbonilas.26 A temperatura de decomposição dos grupos superficiais de um carvão é afetada pela textura porosa, a velocidade de aquecimento e da geometria do sistema de análise utilizado. Os resultados obtidos pela derivada da análise termogravimétrica para todos os carvões são similares (Figura 3). Em aproximadamente 200-350 ºC observa-se um pico atribuído aos carboxílicos e sulfônicos e também há picos largos em temperaturas elevadas, 400-700 ºC, originários da decomposição de grupos fenólicos e carbonilas. O pico em aproximadamente 100 ºC é atribuído à perda de água adsorvida na superfície dos carvões.27 A presença dos grupos oxigenados e sulfurados na superfície dos carvões foi confirmada pela análise de espectroscopia de fotoelétron de raios-X (XPS) para o carvão CG-6h (Figura 4).
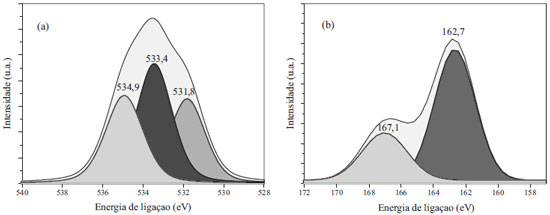
Pelos resultados da análise dos grupos superficiais de oxigênio (O1s) obtida por XPS (Figura 4 (a)), observa-se a presença de grupos C=O com energia de ligação centrada em 531,8 eV, grupos C-OH e C-O-C com energia de ligação com pico máximo em 533,4 e grupos COOH e COO- com pico centrado em 534,9 eV.28 Pelo gráfico obtido para a análise de enxofre S2p (Figura 4(b)) verifica-se a presença de um pico largo com máximo em 167 eV que pode ser atribuído a S2p de grupos SO3H.29 Porém, outros compostos de enxofre não oxidados (-S-) parecem ser formados durante o processo de carbonização da glicerina em presença de H2SO4, evidenciado pelo pico largo entre 160-165 eV.30 Assim, foram obtidos carvões ácidos a partir de resíduo de biodiesel, a glicerina, utilizando apenas 15 min de carbonização em temperatura branda (180 ºC). Todos os carvões preparados apresentam em sua superfície elevada quantidade de grupos oxigenados e sulfurados, o que o torna um potencial catalisador ácido. Avaliação da atividade catalítica dos carvões na reação de eterificação do glicerol Para avaliar as propriedades catalíticas dos diferentes carvões preparados, os mesmos foram utilizados em reações de eterificação do glicerol em presença de terc-butanol (TBA). Além disso, para fins de comparação, a reação também foi realizada utilizando o catalisador comercial, Amberlyst-15. Nas condições de análise utilizada neste trabalho não foram separados os isômeros dos produtos MTBG (2-terc-butoxi-1,3-propanodiol e 3-terc-butoxi-1,2-propanodiol) e do DTBG (1,2-di-(terc-butoxi)-3-propanol e 1,3-di-(terc-butoxi)-2-propanol). Os resultados obtidos para a avaliação das propriedades catalíticas dos carvões preparados com diferentes tempos de carbonização são apresentados na Figura 5.
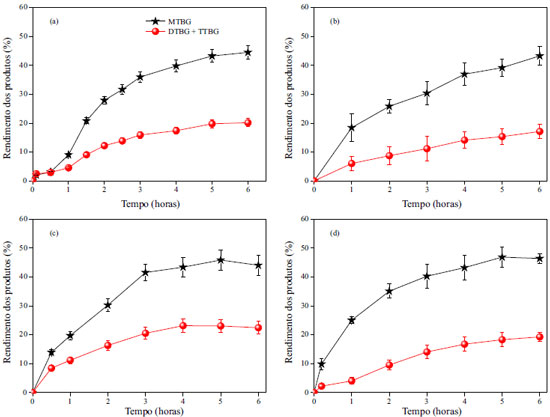 Figura 5. Cinética da reação de eterificação do glicerol com TBA utilizando os diferentes carvões como catalisador: (a) CG-0,25h; (b) CG-1h; (c) CG-3h e (d) CG-6h . Condições: temperatura 120ºC, glicerol:TBA 1:4 e 5% de catalisador
Observa-se a partir dos resultados obtidos que a reação de conversão do glicerol é lenta na primeira hora, seguida de um aumento significativo em sua velocidade. Ocorre um equilíbrio dinâmico na formação dos produtos após 4 h de reação, corroborando resultados obtidos para outros carvões ácidos.16,31,7 Também foi analisada a reprodutibilidade das reações, encontrando um erro inferior a 7%, valor este próximo a erros aceitáveis para reprodutibilidade de análises. Não foi observada diferença significativa entre o rendimento dos produtos da eterificação na presença dos diferentes carvões como catalisadores. Como ressaltado anteriormente, a reação de eterificação é favorecida em presença de ácidos de Brönsted, principalmente os sulfônicos. Assim, os resultados da reação de eterificação corroboram as caracterizações de acidez e grupos superficiais, onde não foi observada diferença significativa entre os carvões obtidos. O produto obtido em maior quantidade foi o MTBG, com rendimento de aproximadamente 43%. Para os produtos mais eterificados, DTBG + TTBG, o rendimento foi de 15, 14, 20 e 17% para o CG-0,25h: CG-1h; CG-3h e CG-6h, respectivamente. Comparando a atividade catalítica dos carvões ácidos obtidos neste trabalho observa-se um rendimento para o MTBG apenas 7% inferior ao obtido em presença do catalisador comercial, Amberlyst-15. Os resultados obtidos, para todos os carvões, são similares ou melhores que os resultados mostrados na literatura com outros catalisadores. González e colaboradores avaliaram as propriedades catalíticas de diversas sílicas mesoporosas modificadas na eterificação do glicerol com isobuteno obtendo conversão do glicerol de 20 a 84%, porém em tempo de reação muito longo, 24 h.32 Frusteri e colaboradores testaram dois heteropoliácidos, Nafion suportado em sílica amorfa e Amberlyst-15 na eterificação do glicerol com TBA, encontrando a conversão de glicerol de 82% para a Amberlyst-15, porém, para os outros materiais a conversão foi inferior a 55%.31 Janaun e Ellis utilizaram um carvão sulfonado a partir de glicose na eterificação de glicerol em presença de TBA e relataram a viabilidade da utilização deste material como catalisador.33 Galhardo e colaboradores avaliando as propriedades catalíticas de um carvão sulfonado obtido a partir de casca de arroz na eterificação do glicerol obtiveram conversão de glicerol de aproximadamente 53%.16 Quando se avalia catalisadores heterogêneos, um importante parâmetro a ser avaliado é a estabilidade dos sítios ativos, pois estes devem manter-se no sólido sem ocorrer lixiviação, apresentando assim atividade catalítica em reações consecutivas. Com o intuito de verificar a estabilidade dos grupos superficiais nos carvões preparados, foi utilizado o CG-6h. Para o teste de lixiviação dos grupos ácidos o procedimento foi realizado segundo Sheldon e colaboradores.34 Para tal, o catalisador foi removido do meio reacional após uma hora de reação, em temperatura de 120 ºC. Os dados obtidos são apresentados na Figura 6 (a).
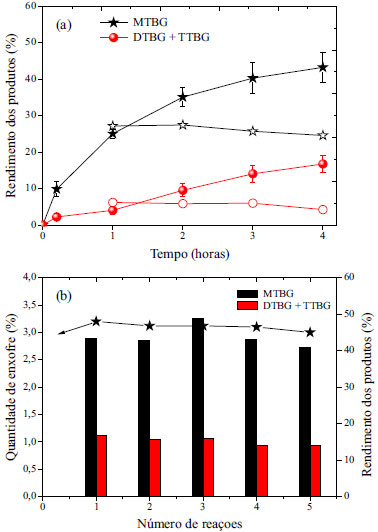 Figura 6. Estabilidade do catalisador CG-6h: (a) teste de lixiviação (simbolo cheio: reação com catalisador e símbolo vazio: após remoção do catalisador) e (b) reaproveitamento do catalisador
O rendimento dos produtos obtido após a retirada do catalisador do meio reacional foi constante, indicando que os grupos superficiais do carvão são estáveis, ou seja, não ocorre lixiviação. A fim de confirmar a constante atividade do carvão foi realizado um teste de reaproveitamento. Para isto o carvão foi lavado com água destilada após cada reação e seco em estufa por 12 h a 100 ºC. Os resultados obtidos (Figura 6 (b)) mostraram que a atividade do catalisador manteve-se constante nas cinco reações avaliadas. Esses resultados estão de acordo com outros encontrados na literatura ou mesmo obtidos em trabalhos anteriores do grupo. Gonçalves e colaboradores avaliaram a estabilidade de um carvão e demonstraram que sua atividade catalítica manteve-se constante em oito reações avaliadas, confirmando a estabilidade destes carvões.5 O mesmo comportamento também foi verificado por Zhao e colaboradores, avaliando a atividade catalítica de um carvão sulfonado a partir da casca de amendoim, em cinco reações de eterificação do glicerol, constatando que a atividade do catalisador, em termos de conversão do glicerol e de seletividade para DTBG e TTBG, permaneceu praticamente inalterada.14 Assim, com os resultados obtidos verificou-se a viabilidade de preparação de carvões ácidos com elevada atividade catalítica e estabilidade dos grupos superficiais, utilizando o resíduo do biodiesel como precursor.
CONCLUSÃO As caracterizações dos materiais obtidos mostraram que os métodos de preparação utilizados foram eficientes para a formação de carvões com propriedades ácidas, sendo que estes apresentam atividade catalítica nas reações de eterificação do glicerol comparável ao catalisador comercial, a Amberlyst-15, mostrando assim que estes são promissores na utilização como catalisadores com propriedades ácidas. Desta forma, a utilização do glicerol como precursor para a preparação de carvão com propriedades ácidas para utilização como catalisador em reações de eterificação do próprio glicerol mostrou-se um processo viável, agregando valor a este resíduo produzido em abundância no Brasil.
AGRADECIMENTOS À FAPESP (Projeto 2011/22264-4, 2013/21160-6 e 2014/18529-0), à CAPES (CAPES/MINCYT/208/12) e ao CNPq (Projeto 441936/2014-8) pelo financiamento do trabalho, à Central Experimental Multiusuário (CEM) da UFABC pela colaboração nas análises e à Oxiteno-Brasil pelo fornecimento da glicerina.
REFERÊNCIAS 1. http://www.anp.gov.br/, acessada em Junho 2014. 2. Mota, C. J. A.; Silva, C. X. A.; Gonçalves, V. L. C.; Quim. Nova. 2009, 32, 639. DOI: http://dx.doi.org/10.1590/S0100-40422009000300008 3. Medeiros, M. A.; Lago, R. M.; Quim. Nova. 2011, 34, 1079. DOI: http://dx.doi.org/10.1590/S0100-40422011000600028 4. Medeiros, M. A.; Cançado, T. M.; Leite, C. M. M.; Lago, R. M.; J. Chem. Technol. Biotechnol. 2012, 87, 1654. DOI: http://dx.doi.org/10.1002/jctb.3805 5. Gonçalves, M.; Mantovani, M.; Carvalho, W. A.; Rodrigues, R.; Mandelli, D.; Albero, J. S.; Chem. Eng. J. 2014, 256, 468. DOI: http://dx.doi.org/10.1016/j.cej.2014.07.013 6. Kiatkittipong, W.; Intaracharoen, P.; Laosiripojana, N.; Chaisuk, C.; Praserthdam, P.; Assabumrungrat, S.; Comput. Chem. Eng. 2011, 35, 2034. DOI: http://dx.doi.org/10.1016/j.compchemeng.2011.01.016 7. Gonçalves, M.; Souza, V. C.; Galhardo, T. S.; Mantovani, M.; Figueiredo, F. C. A.; Mandelli, D.; Carvalho, W. A.; Ind. Eng. Chem. Res. 2013, 52, 2832. DOI: http://dx.doi.org/10.1021/ie303072d 8. Melero, J. A.; van Grieken, R.; Morales, G.; Paniagua, M.; Energy Fuels 2007, 21, 1782. DOI: http://dx.doi.org/10.1021/ef060647q 9. Frusteri, F.; Arena, F.; Bonura, G.; Cannilla, C.; Spadaro, L.; Blasi, O. D.; Appl. Catal., A 2009, 367, 77. DOI: http://dx.doi.org/10.1016/j.apcata.2009.07.037 10. Viswanadham, N.; Saxena, S. K.; Fuel 2013, 103, 980. DOI: http://dx.doi.org/10.1016/j.fuel.2012.06.057 11. Beatrice, C.; Di Blasio, G.; Lazzaro, M.; Cannilla, C.; Bonura, G.; Frusteri, F.; Asdrubali, F.; Baldinelli, G.; Presciutti, A.; Fantozzi, F.; Bidini, G.; Bartocci. P.; Appl. Energy 2013, 102, 63. DOI: http://dx.doi.org/10.1016/j.apenergy.2012.08.006 12. Janaun, J.; Ellis, N.; Appl. Catal., A 2011, 394, 25. DOI: http://dx.doi.org/10.1016/j.apcata.2010.12.016 13. Sánchez, J. A; Hernández, D. L.; Moreno, J. A., Mondragón, F.; Fernández, J. J.; Appl. Catal., A 2011, 405, 55. DOI: http://dx.doi.org/10.1016/j.apcata.2011.07.027 14. Zhao, W.; Yang, B.; Yi, C.; Lei, Z.; Xu, J.; Ind. Eng. Chem. Res. 2010, 49, 12399. DOI: http://dx.doi.org/10.1021/ie101461g 15. Zhao, Y.; Wang, H.; Zhao, Y.; Shen, J.; Catal. Commun. 2010, 11, 824. DOI: http://dx.doi.org/10.1016/j.catcom.2010.03.001 16. Galhardo, T. S.; Simone, N.; Gonçalves, M.; Figueiredo, F. C. A.; Mandelli, D.; Carvalho, W. A.; ACS Sustainable Chem. Eng. 2013, 1, 1381. DOI: http://dx.doi.org/10.1021/sc400117t 17. Prabhavathi Devi, B. L. A.; Gangadhar, K. N.; Siva Kumar, K. L. N.; Shiva Shanker, K.; Prasad, R. B. N.; Sai Prasad, P. S.; J. Mol. Catal. A: Chem. 2011, 345, 96. DOI: http://dx.doi.org/10.1016/j.molcata.2011.05.025 18. Valle-Vigón, P.; Sevilla, M.; Fuertes. A. B.; Appl. Surf. Sci. 2012, 261, 574. DOI: http://dx.doi.org/10.1016/j.apsusc.2012.08.059 19. Zhang, B.; Ren, J.; Liu, X.; Guo, Y.; Guo, Y.; Lu, G.; Wang, Y.; Catal. Commun. 2010, 11, 629. DOI: http://dx.doi.org/10.1016/j.catcom.2010.01.010 20. Mo, X.; López, D. E.; Suwannakarn, K.; Liu, Y.; Lotero, E.; Goodwin Jr, J. G.; Lu, C.; J. Catal. 2008, 254, 332. DOI: http://dx.doi.org/10.1016/j.jcat.2008.01.011 21. Boehm, H. P.; Carbon 2002, 40, 145. DOI: http://dx.doi.org/10.1016/S0008-6223(01)00165-8 22. Zhou, W.; Yoshino, M.; Kita, H.; Okamoto, K.; Ind. Eng. Chem. Res. 2001, 40, 4801. DOI: http://dx.doi.org/10.1021/ie010402v 23. Kastner, J. R.; Miller, J.; Geller, D. P.; Locklin, J.; Keith, L. H.; Johnson, T.; Catal. Today. 2012, 190, 122. DOI: http://dx.doi.org/10.1016/j.cattod.2012.02.006 24. Larkin, P.; Infrared and Raman Spectroscopy, 1st ed., Elsevier: Oxford, 2011. 25. Xing, R.; Liu, Y.; Wang, Y.; Chen, L.; Wu, H.; Jiang, Y.; He, M.; Wu, P.; Microporous Mesoporous Mater. 2007, 105, 41. DOI: http://dx.doi.org/10.1016/j.micromeso.2007.06.043 26. Figueiredo, J. L.; Pereira, M. F. R.; Freitas, M. M. A.; Orfao, J. J. M.; Carbon 1999, 37, 1379. DOI: http://dx.doi.org/10.1016/S0008-6223(98)00333-9 27. Gorgulho, H. F.; Mesquita, J. P.; Gonçalves, F.; Pereira, M. F. R.; Figueiredo, J. L.; Carbon 2008, 46, 1544. DOI: http://dx.doi.org/10.1016/j.carbon.2008.06.045 28. Strzemiecka, B.; Voelkel, A.; Donate-Robles, J.; Martín-Martínez, J. M.; Appl. Surf. Sci. 2014, 316, 315. DOI: http://dx.doi.org/10.1016/j.apsusc.2014.07.174 29. Suganuma, S.; Nakajima, K.; Kitano, M.; Yamaguchi, D.; Kato, H.; Hayashi, S.; Hara, M.; Solid State Sci. 2010, 12, 1029. DOI: http://dx.doi.org/10.1016/j.solidstatesciences.2010.02.038 30. George, G. N.; Gorbaty, M. L.; Kelemen, S. R.; Sansone, M.; Energy Fuels 1991, 5, 93. DOI: http://dx.doi.org/10.1021/ef00025a016 31. Frusteri, F.; Arena, F.; Bonura, G.; Cannilla, C.; Spadaro, L.; Di Blasi, O.; Appl. Catal., A 2009, 367, 77. DOI: http://dx.doi.org/10.1016/j.apcata.2009.07.037 32. González, M. D.; Salagre, P.; Mokaya, R.; Cesteros, Y.; Catal. Today 2014, 227, 171. DOI: http://dx.doi.org/10.1016/j.cattod.2013.10.029 33. Janaun, J.; Ellis, N.; J. Appl. Sci. 2010, 10, 2633. DOI: http://dx.doi.org/10.3923/jas.2010.2633.2637 34. Sheldon, R. A.; Wallau, M.; Arends, I. W. C. E.; Schuchardt, U.; Acc. Chem. Res. 1998, 31, 485. DOI: http://dx.doi.org/10.1021/ar9700163 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access