Nota Técnica
|
|
| Desenvolvimento e validação de método por clae-dad e estudo preliminar da estabilidade da sinefrina em extrato seco de Citrus aurantium L. Development and validation of a hplc-pda method and preliminary stability study of synephrine in Citrus aurantium L. dry extract |
|
Cristina Lenhardt KaeferI; Fernanda Macke HellwigI; Rafael Henrique Dias ReisI; Carine Viana SilvaII; Marcelo Donadel MalesuikI,*
ICurso de Farmácia, Universidade Federal do Pampa, 97508-000 Uruguaiana - RS, Brasil Recebido em 12/09/2014 *e-mail: marcelodonadel@gmail.com A reversed-phase liquid chromatographic method was developed for the assay of synephrine in Citrus aurantium dry extract. The chromatographic separation used a C18 (250 x 4.6 mm, 5 µm) column and a mobile phase consisting of acetonitrile: 0.01% orthophosphoric acid (pH 3.0) at a 15:85 ratio, flow rate of 1 mL min-1 and detection at 220 nm. The detector response was linear in the range 15 - 45 mg mL-1. Specificity and stability, indicating suitability of the method, were confirmed using stress conditions (acid and basic hydrolysis, oxidation and photolysis). Intraday precision yielded RSD values of less than 1.77% and interday precision of 2.5%. The average recovery accuracy of the test was 102.03%. The method was validated according to international guidelines and can be used in routine quality control and stability studies of Citrus aurantium preparations. The preliminary stability study showed that synephrine is susceptible to hydrolysis, oxidation and photolysis. INTRODUÇÃO A sinefrina (Figura 1) é uma amina adrenérgica presente em plantas do gênero Citrus sp, disponível atualmente em produtos dietéticos para o emagrecimento. Em 2004 o órgão americano Food and Drug Administration (FDA) proibiu para uso a efedrina (Figura 1) em suplementos alimentares devido à associação clínica com problemas cardíacos e o sistema nervoso central. Neste contexto, a sinefrina, que é um alcaloide alternativo à efedrina, ganhou popularidade no tratamento da obesidade e encontra-se presente na formulação de diversas preparações disponíveis comercialmente.1,2 O interesse por produtos contendo sinefrina se deve a sua similaridade estrutural com a efedrina e seus supostos efeitos lipofílicos, que têm sido associados ao aumento da lipólise por meio da promoção da termogênese, presumivelmente por meio de adrenoreceptores β3. No entanto, estudos demonstram que essa amina age também em adrenoreceptores β1 e β2, e seu uso indiscriminado pode levar ao desenvolvimento de efeitos adversos graves, que podem ser piorados com a associação com outros estimulantes, elevando o risco de cardiotoxicidade.1,3,4 Essa preocupação já levou o Healt Canada a suspender seu uso em produtos dietéticos.5 Entretanto, segundo alguns dados da literatura, a sinefrina está entre os cinco ingredientes mais vendidos em suplementos alimentares para o emagrecimento.6 Neste contexto, tornam-se imprescindíveis estudos para contribuir com o controle de qualidade de produtos à base dessas substâncias.
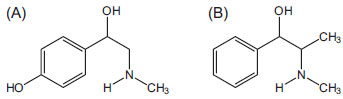 Figura 1. Estrutura química da sinefrina (A) e efedrina (B)
A sinefrina está presente no extrato seco de Citrus aurantium, conhecido no Brasil como laranja-amarga, laranja-azeda e laranja-cavalo, pertencente à família Rutaceae.7 Esse extrato é utilizado como matéria-prima no mercado nacional em diferentes produtos dietéticos, suplementos alimentares e compostos manipulados em farmácias magistrais, mas, até o momento, não possui monografia em códigos oficiais ou farmacopeia. Nesse intuito, o maior problema relacionado a estes produtos está na falta de padronização e no deficiente controle de qualidade, tanto do extrato utilizado, como do produto final, fatos que comprometem diretamente a garantia da sua composição química, teor de princípio ativo, estabilidade, segurança e eficácia, refletindo em prejuízo terapêutico à população, além de potencial toxicológico. Alguns trabalhos já propuseram a determinação da sinefrina e aminas correlatas em amostras de Citrus aurantium e suplementos alimentares.8-13 No entanto, verificou-se não haver estudos publicados na literatura que contemplem o desenvolvimento de métodos indicativos da estabilidade e, tampouco, estudos que relatam a estabilidade da sinefrina em condições forçadas de armazenamento. Portanto, este trabalho teve como objetivo o desenvolvimento e validação de método analítico por CLAE-DAD, bem como a realização de estudo preliminar da estabilidade da sinefrina em extrato seco de Citrus aurantium utilizando condições forçadas de armazenamento.
EXPERIMENTAL Produtos químicos e reagentes Sinefrina usada como substância química de referência, com teor declarado de 98%, foi adquirido da empresa Sigma-Aldrich. Extrato seco de Citrus aurantium contendo 6,2% de sinefrina, conforme especificado pelo certificado de análise, foi adquirido da empresa DEG Importação de produtos Químicos Ltda (São Paulo, Brasil). Os reagentes utilizados foram acetonitrila (grau CLAE, Tedia, Fairfield, EUA), ácido o-fosfórico (Merck, Darmstadt, Alemanha) e trietilamina (Merck, Darmstadt, Alemanha) e a água ultra-pura foi obtida pelo sistema Direct-Q UV 3 Milli-Q® (Merck Millipore, Milford, MA, EUA). Equipamento e condições cromatográficas As análises cromatográficas foram realizadas em cromatógrafo líquido Shimadzu (LC-20AT Prominence), com sistema dotado de bomba quaternária, amostrador automático, detector de arranjo de fotodiodo (DAD), degaseificador e controlador (Shimadzu, Kyoto, Japan). A coluna Thermo Scientific C18 ODS Hypersil (250 × 4,6 mm, 5 µm, Cheshire, Inglaterra) acoplada a uma pré-coluna Phenomenex SecurityGuard C18 (4,0 × 3,0 mm, 5 µm, Torrance, CA, EUA) foram utilizadas para as separações cromatográficas. A fase móvel foi composta por uma mistura binária de ácido o-fosfórico 0,01% (v/v) pH 3,0 ajustado com trietilamina: acetonitrila (85:15, v/v). Os componentes da fase móvel foram filtrados sob vácuo, através de uma membrana de nylon com diâmetro de 47 mm e poro de 0,45 µm (Millipore, Billerica, MA, EUA). A vazão da fase móvel foi de 1,0 mL min-1 e o volume injetado de amostra foi 20 µL. A temperatura de análise foi de 25 ºC, com detecção em 220 nm. Preparo da solução padrão A solução de sinefrina foi preparada em água destilada pela dissolução de 15 mg de sinefrina em balão volumétrico de 100 mL. Após, 2 mL foram transferidos para um balão volumétrico de 10 mL e o volume completado com água, obtendo concentração final de 30 µg mL-1. A solução foi homogeneizada e filtrada em membrana de nylon com diâmetro de 13 mm e poro de 0,45 µm (Millipore, Billerica, MA, EUA). Preparo da solução amostra Cerca de 241,9 mg de extrato seco (equivalente a 15 mg de sinefrina) foram pesados e transferidos para balão volumétrico de 100 mL com o auxílio de 80 mL de água destilada. A amostra foi sonicada em ultrassom por 30 min para extração da sinefrina, à temperatura ambiente. Foi completado o volume com o mesmo solvente e a solução transferida para tubos de ensaio para posterior centrifugação a 3000 rpm por 30 min. Uma alíquota de 2 mL foi transferida para um balão volumétrico de 10 mL e o volume completado com água, atingindo concentração final de 30 µg mL-1 de sinefrina. A solução foi homogeneizada e filtrada em membrana de nylon com diâmetro de 13 mm e poro de 0,45 µm (Millipore, Billerica, MA, EUA). Estudos de degradação O estudo de degradação teve como intuito verificar a estabilidade da sinefrina e a capacidade indicativa de estabilidade do método, ou seja, a determinação o analito na presença de produtos formados. O padrão de sinefrina e o extrato seco de Citrus aurantium foram submetidos a condições forçadas de armazenamento, de modo a conduzir os estudos de degradação.14 Degradação do padrão de sinefrina A solução de sinefrina, para a hidrólise ácida, foi preparada pela dissolução de 15 mg do padrão com ácido clorídrico 1 mol L-1, em balão volumétrico de 100 mL (150 µg mL-1 de sinefrina). Após, foi submetida à sonicação por 10 minutos e, posteriormente, ao refluxo (80 ºC) por 4 h. A hidrólise básica seguiu os mesmos procedimentos, sendo conduzida ao refluxo (80 ºC) com hidróxido de sódio 5 mol L-1 por 6 h. Após o arrefecimento à temperatura ambiente as amostras foram neutralizadas. Uma alíquota de 2 mL de cada solução foi transferida para respectivo balão volumétrico de 10 mL e diluída em água, obtendo-se concentração final de 30 µg mL-1 de sinefrina. Para a realização da degradação oxidativa foram transferidas para balão volumétrico de 10 mL alíquotas de 2 mL de peróxido de hidrogênio 10% e 2 mL de solução de sinefrina em água na concentração de 150 µg mL-1. O balão foi mantido por 48 horas ao abrigo da luz, à temperatura ambiente. Após esse período o volume do balão foi completado com água, obtendo-se a concentração final de 30 µg mL-1 de sinefrina e analisada imediatamente por CLAE. Para avaliação da fotodegradação foi preparada uma solução estoque em água, equivalente a 1.500 µg mL-1 de sinefrina. Uma alíquota de 1 mL dessa solução foi diluída em balão volumétrico de 10 mL com acetonitrila e exposta à luz UVC - 254 nm em cubetas descartáveis por 1 h, com temperatura controlada. Posteriormente, uma alíquota de 2 mL foi transferida para balão volumétrico de 10 mL e o volume completado com água, obtendo-se a concentração final de 30 µg mL-1 de sinefrina. Em todos os casos, após atingir a concentração de trabalho de 30 µg mL-1 de sinefrina, as amostras foram filtradas em membrana de nylon com diâmetro de 13 mm e poro de 0,45 µm. Degradação do extrato de Citrus aurantium A degradação ácida do extrato ocorreu pela diluição de 1,2097 g do mesmo, (equivalente a 75 mg de sinefrina) em um balão volumétrico de 50 mL, ao qual foi adicionado cerca de 40 mL de água destilada. A amostra foi sonicada em ultrasson por 30 min para extração da sinefrina. Foi completado o volume com o mesmo solvente e a solução transferida para tubos de ensaio para posterior centrifugação a 3000 rpm por 30 min. Uma alíquota de 5 mL foi transferida para um balão volumétrico de 50 mL e o volume completado com ácido clorídrico 1 mol L-1, atingindo concentração final de 150 µg mL-1 de sinefrina. Esta solução foi submetida ao refluxo (80 ºC) por 5 h. A hidrólise básica também foi conduzida sob refluxo (80 ºC) com hidróxido de sódio 5 mol L-1 por 6 h. Após, as amostras foram arrefecidas à temperatura ambiente e neutralizadas. Uma alíquota de 2 mL de cada solução foi transferida para respectivo balão volumétrico de 10 mL e diluída em água, obtendo-se concentração final de 30 µg mL-1. Para a realização da degradação oxidativa foram transferidas para balão volumétrico de 10 mL alíquotas de 4 mL de peróxido de hidrogênio 30% e 2 mL de solução de sinefrina em água na concentração de 150 µg mL-1. Esta solução foi armazenada à temperatura ambiente e protegida da luz por 72 h. Após esse período, o volume do balão foi completado com água, obtendo-se a concentração final de 30 µg mL-1 de sinefrina, e analisada imediatamente por CLAE. A condição da degradação oxidativa imposta ao extrato (H2O2 30%, por 72 h) foi empregada devido a estudos preliminares que demostraram que não ocorreu degradação da sinefrina em condições mais brandas, como as usadas com o padrão (H2O2 10%, por 48 h). Para avaliação da fotodegradação foi preparada uma solução estoque do extrato em água, equivalente a 1.500 µg mL-1 de sinefrina. Após passar pelas etapas de sonicação e centrifugação, uma alíquota de 1 mL desta foi diluída em balão volumétrico de 10 mL com acetonitrila e exposta à luz UVC - 254 nm em cubetas descartáveis por 20 h, com temperatura controlada. Posteriormente, uma alíquota de 2 mL foi transferida para balão volumétrico de 10 mL e o volume completado com água, obtendo-se a concentração final de 30 µg mL-1 de sinefrina. Em todos os casos, após atingir a concentração de trabalho de 30 µg mL-1 de sinefrina, as amostras foram filtradas em membrana de nylon com diâmetro de 13 mm e poro de 0,45 µm. Validação do método analítico A validação do método analítico foi conduzida conforme a The United States Pharmacopoeia (USP 36),15 os guias do International Conference on Harmonisation (ICH)16,17 e artigos científicos especializados.18,19 Linearidade A linearidade foi determinada pela construção de três curvas de calibração com cinco pontos cada. A solução estoque (150 µg mL-1) de sinefrina foi preparada em água e alíquotas foram transferidas para balões volumétricos de 10 mL, obtendo a concentração final de 15; 22,5; 30; 37,5 e 45 µg mL-1. As curvas padrão foram obtidas pela construção de gráficos de concentração versus área absoluta. A equação da reta foi determinada por meio do estudo de regressão linear pelo método dos mínimos quadrados e a análise de variância por ANOVA foi realizada para verificação da linearidade do método. Limite de detecção e limite de quantificação O limite de detecção (LD) e o limite de quantificação (LQ) foram calculados a partir das fórmulas descritas no ICH, baseadas no desvio padrão do intercepto e na inclinação da curva de calibração. Para confirmação dos valores teóricos calculados foram preparadas soluções de sinefrina em água e analisadas experimentalmente (n = 6). Especificidade A especificidade, ou seja, a capacidade do método em determinar o fármaco, com pureza adequada, na presença dos produtos formados, e a capacidade indicativa de estabilidade do método foram avaliadas utilizando degradação forçada do fármaco e do extrato, em condições de oxidação, fotodegradação e hidrólise ácida e básica, por meio da determinação da pureza do pico estabelecida pelo detector DAD. Este parâmetro de validação foi avaliado concomitantemente aos estudos de degradação citados anteriormente. Precisão A precisão do método foi determinada pelo ensaio de repetibilidade (precisão intradia) e precisão intermediária (precisão interdia), sendo o resultado expresso como estimativa do desvio padrão relativo (DPR), conforme o resultado obtido em seis medições intradia e dezoito medições interdia da solução do extrato na concentração correspondente a 30 µg mL-1. Os dados para a precisão intermediária foram coletados em dias diferentes e por analistas diferentes. Exatidão A exatidão foi determinada a partir de ensaio de recuperação de padrão, isto é, por meio da adição de quantidades conhecidas de padrão nas soluções amostra (extrato de Citrus aurantium). Alíquotas de 1, 2 e 3 mL de um padrão de sinefrina com concentração de 50 µg mL-1 foram transferidas para balões volumétricos de 10 mL contendo solução amostra na concentração de 30 µg mL-1, visando avaliar a porcentagem de recuperação em cada nível de concentração. Cada solução foi preparada em triplicata. Robustez A robustez do método foi avaliada por meio de pequenas e deliberadas modificações nas condições cromatográficas, tais como vazão (0,8 e 1,2 mL min-1), pH da fase aquosa (2,8 e 3,2), proporção da fase móvel (10:90 e 20:80) e tempo de extração (25 e 35 min).
RESULTADOS E DISCUSSÃO Desenvolvimento e otimização do método As condições cromatográficas que resultaram em adequados parâmetros analíticos foram definidas após teste de diferentes fases móveis, proporção da fase orgânica, pH da fase aquosa e fluxo da fase móvel. Os testes iniciais foram realizados em mistura binária de acetonitrila:água na proporção de 30:70 (v/v), com pH na faixa de 2,5 a 3,5, ajustado com ácido fosfórico. Também foi avaliado o sistema de vazão gradiente e isocrático, na faixa de 0,6 a 1,5 mL min-1. Não obtendo êxito na separação cromatográfica, nova fase móvel foi testada, sendo esta composta por acetonitrila:ácido fosfórico 0,1% na proporção 15:85 (v/v). Com essa fase móvel foram investigados o efeito do pH (2,5 e 3,0) e da vazão, que variou de 0,6 a 1,0 mL min-1. Na tentativa de otimizar as condições cromatográficas, outra mistura de solventes foi investigada, desta vez acetonitrila:ácido fosfórico 0,01% nas proporções 30:70, 25:75, 20:80 e 15:85 (v/v) com pH 2,8 e 3,0 e vazão que variou de 0,6 a 1,0 mL min-1. Finalmente, a fase móvel constituída por acetonitrila:ácido fosfórico 0,01% (v/v) pH 3,0 (ajustado com trietilamina), numa proporção 15:85 (v/v) e vazão de 1,0 mL min-1 foi definida para dar prosseguimento aos experimentos, pois apresentou bons resultados nos parâmetros de adequabilidade do sistema, tais como número de pratos teóricos (N = 9000), simetria de pico (T = 1,19) e reprodutibilidade das injeções (RSD = 0,5, n = 5). A fase móvel empregada é de fácil e rápido preparo, o que permite ser usada rotineiramente nas análises de controle de qualidade. Outra vantagem é o fato de não apresentar sais em sua composição, que poderiam ocasionar danos à coluna e ao sistema cromatográfico. Estudos de degradação Os estudos de degradação forçada foram conduzidos com o intuito de desenvolver uma avaliação preliminar da estabilidade do fármaco frente a diferentes condições de armazenamento, bem como avaliar a seletividade e a capacidade indicativa de estabilidade do método proposto. Degradação do padrão de sinefrina Na Figura 2A, pode-se observar o cromatograma típico da sinefrina padrão na concentração de 30,0 µg mL-1. Quando submetido a condições ácidas de degradação (HCl 1 mol L-1 por 4 h), houve um decaimento de 36% na área do pico da sinefrina e o surgimento de um produto de degradação em aproximadamente 2,6 min de análise (PD1b), como pode ser observado no cromatograma da Figura 2B. Na degradação alcalina (NaOH 5 mol L-1) por um período de 6 h o percentual de degradação foi de aproximadamente de 10%, com o surgimento de quatro produtos de degradação (PD1c, PD2c, PD3c e PD1c), como pode ser observado na Figura 2C. Também, alguns aspectos em relação às características físicas desta amostra devem ser considerados, pois após o período de exposição da degradação alcalina apresentou coloração levemente amarelada e uma espécie de precipitado, provavelmente devido a algum dos produtos de degradação formados.
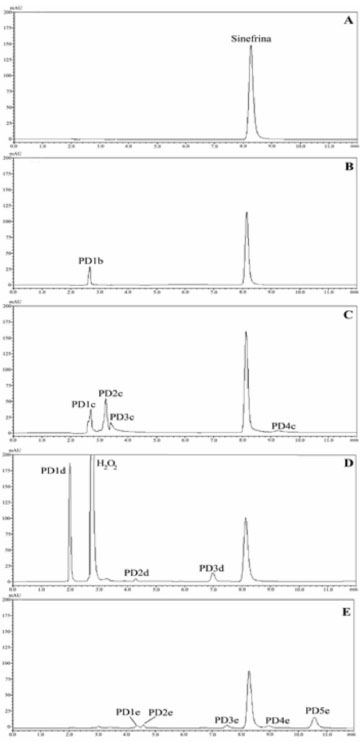 Figura 2. (A) Cromatograma típico da soluçao padrao de sinefrina 30,0 µg mL-1 por CLAE com detecçao em 220 nm; (B) degradaçao ácida (HCl 1 mol L-1, 4 h) e produto de degradaçao (PD1b); (C) degradaçao alcalina (NaOH 5 mol L-1, 6 h) e produtos de degradaçao (PD1c, PD2c, PD3c e PD4c); (D) degradaçao oxidativa (H2O2 10 %, 48 h) e produtos de degradaçao (PD1d, PD2d e PD3d); (E) fodegradaçao (UVC-254 nm, 1 h) e produtos de degradaçao (PD1e, PD2e, PD3e, PD4e e PD5e)
Na degradação oxidativa (H2O2 10%, por 48 h) o decaimento do pico referente à sinefrina foi de aproximadamente 30%, com a ocorrência de um expressivo produto de degradação com pequeno tempo de retenção, praticamente junto ao volume morto, em 2 min (PD1d). Outros dois produtos de menor concentração (PD2d e PD3d), como pode ser observado na Figura 2D, também foram formados nas condições testadas. Os resultados da degradação fotolítica estão demonstrados na Figura 2E, na qual pode ser observado a ocorrência de picos adicionais de menor concentração (PD1e, PD2e, PD3e, PD4e e PD5e), além do sinal relativo à sinefrina com decréscimo na área do pico de, aproximadamente, 30% após 1 h de exposição. Degradação do extrato de Citrus aurantium Na Figura 3A pode-se observar o cromatograma típico da sinefrina no extrato de Citrus aurantium na concentração de 30,0 µg mL-1. Quando o extrato foi submetido às condições de degradação ácida (HCl 1 mol L-1) por 5 h, ocorreu a formação de dois produtos de degradação (PE1b e PE2b), com decréscimo de 28,6% na área do pico da sinefrina (Figura 3B). A degradação alcalina resultou no surgimento de novos produtos de degradação (PE1c, PE2c, PE3c e PE4c), além de um decréscimo na área do pico da sinefrina de aproximadamente 10%, praticamente o mesmo percentual de degradação apresentado na degradação alcalina do padrão de sinefrina (Figura 3C). Todavia, também apresentou as mesmas características físicas, quando na degradação do padrão após 6 h de aquecimento. Na degradação oxidativa foram realizadas algumas análises do extrato nas mesmas condições impostas ao padrão (H2O2 10% em 48 h), mas os resultados obtidos não demonstraram degradação da sinefrina. Devido a essas características específicas do extrato optou-se por aumentar a concentração do peróxido de hidrogênio e também o tempo de exposição (H2O2 30% em 72 h). Ao contrário do que foi visualizado na degradação oxidativa do padrão, na degradação do extrato houve pouco decaimento na área do pico da sinefrina, em torno de 5%, mas com o surgimento do produto de degradação majoritário em torno de 2 min, como ocorreu na degradação do padrão (Figura 3D). Na análise dos cromatogramas da degradação oxidativa do padrão e do extrato percebe-se menor decaimento do pico da sinefrina no extrato, mesmo com o reagente mais concentrado e maior tempo de exposição. Sugere-se que essa diferença provavelmente ocorra devido à presença de compostos com características antioxidantes no extrato de Citrus aurantium, como mencionado na literatura.20,21
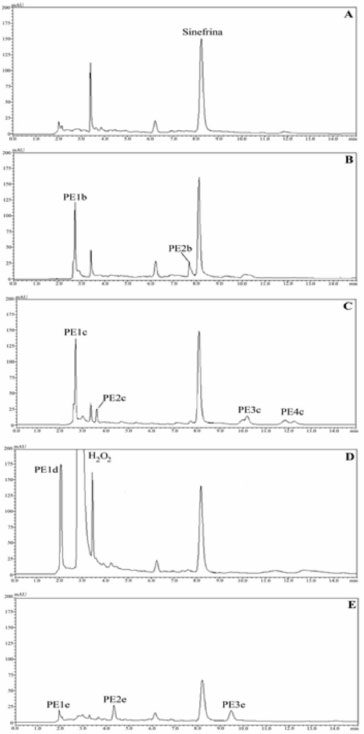 Figura 3. (A) Cromatograma típico da sinefrina 30,0 µg mL-1 em extrato de Citrus aurantium, por CLAE com detecçao em 220 nm; (B) degradaçao ácida (HCl 1 mol L-1, 5 h) e produtos de degradaçao (PE1b e PE2b); (C) degradaçao alcalina (NaOH 5 mol L-1, 6 h) e produtos de degradaçao (PE1c, PE2c, PE3c e PE4c); (D) degradaçao oxidativa (H2O2 30 %, 72 h) e produto de degradaçao (PE1d); (E) fotodegradaçao (UVC-254 nm, 20 h) e produtos de degradaçao (PE1e, PE2e e PE3e)
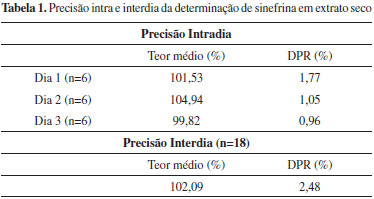
Quando submetido à degradação frente à luz por 20 h ocorreu redução de aproximadamente 42% na área do pico da sinefrina e a formação de alguns produtos de degradação (PE1e, PE2e e PE3e) que foram resolvidos do pico do fármaco, como pode ser observado na Figura 3E. A partir da análise dos cromatogramas, nos estudos de degradação do padrão e do extrato, pode-se verificar que o método proposto teve êxito na separação da sinefrina dos produtos de degradação formados. Além disso, permitiu a análise quantitativa da sinefrina na presença dos produtos de degradação e constituintes da matriz, portanto, pode-se afirmar que o método pode ser empregado como indicativo da estabilidade. Nas condições testadas, os resultados também demonstram a susceptibilidade da sinefrina quanto à degradação ácida, básica, oxidativa e fotolítica, indicando a necessidade de um maior cuidado quando na manipulação ou armazenamento de formas farmacêuticas ou suplementos alimentares à base de extrato seco de Citrus aurantium. Validação do método A validação do método foi realizada com base na avaliação dos seguintes parâmetros analíticos: especificidade, linearidade, repetibilidade, precisão intermediária, exatidão e robustez. De acordo com alguns autores e o ICH a validação deve seguir a metodologia analítica, no entanto, os resultados podem seguir os critérios de aceitação estipulados para métodos bioanalíticos, considerando-se a complexidade do extrato vegetal, permitindo, assim, limites de aceitação maiores em relação aos métodos analíticos.17,22 A linearidade do método foi verificada por meio da construção de curvas padrão de sinefrina (concentração versus área do pico). O método mostrou-se linear na faixa de 15 a 45 µg mL-1 e o estudo de regressão linear pelo método dos mínimos quadrados forneceu uma equação da reta y = 47.808,23x - 34.115,19. O coeficiente de correlação (r) de 0,9996 demonstrou concordância entre as concentrações utilizadas e as áreas absolutas dos picos obtidas. A análise por ANOVA demonstrou haver regressão linear significativa (a) sem desvio da linearidade (b): a) F calculado = 7691 > F crítico = 4,96; p < 0,05 b) F calculado = 1,109 < F crítico = 3,71; p < 0,05 Na determinação do limite de quantificação o valor teórico encontrado foi de 0,25 µg mL-1, o qual correspondeu ao obtido experimentalmente, com DPR de 1,50 (n = 6). Para o limite de detecção o valor teórico encontrado foi de 0,08 µg mL-1, o qual correspondeu ao obtido experimentalmente, com DPR de 2,20 (n = 6). Os resultados obtidos demostram boa sensibilidade do método proposto. A especificidade e a capacidade indicativa de estabilidade foram confirmadas pela capacidade do método em determinar o fármaco na presença de produtos de degradação e dos constituintes presentes no extrato de Citrus aurantium, considerado uma matriz complexa. Na análise utilizando o detector de arranjo de fotodiodos foram feitas varreduras espectrais dos picos de sinefrina e os resultados obtidos sugerem elevada pureza (> 99,9%) em todas as determinações realizadas. Esses resultados, apesar de não serem confirmatórios, corroboram com a especificidade e seletividade do método no sentido de um indicativo da não co-eluição de produtos de degradação ou compostos constituintes da matriz com a sinefrina, nas condições analisadas. Os resultados da precisão, obtidos para o método proposto, foram expressos como DPR e podem ser visualizados na Tabela 1. Em todos os testes realizados foi observado que o método, além de apresentar resultados coerentes com os limites estabelecidos pela legislação vigente, também apresentou baixos DPR, indicando o elevado nível de precisão do método.
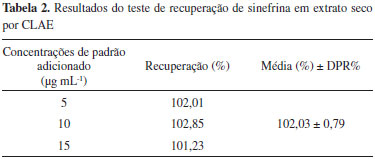
O teste de exatidão avaliou a porcentagem de recuperação obtida em cada nível de concentração de sinefrina, sendo que para cada concentração foram realizadas três determinações. A recuperação média foi de 102,03% (DPR = 0,79), como pode ser observado na Tabela 2.
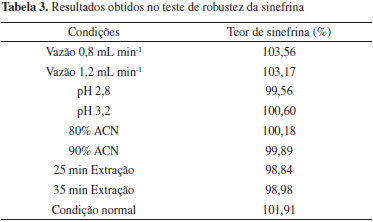
Os testes revelaram que pequenas e deliberadas modificações nas condições cromatográficas não resultaram em problemas na quantificação da sinefrina, confirmando a robustez do método proposto. Os resultados deste teste podem ser visualizados na Tabela 3.
CONCLUSÃO O método desenvolvido por CLAE-DAD comprovou ser simples, linear, preciso, exato e específico, demonstrando satisfatórios resultados frente aos parâmetros testados. Também mostrou-se adequado para quantificação da sinefrina em extrato de Citrus aurantium, podendo ser usado para análise da mesma e também de produtos de degradação em estudos de estabilidade. Nas condições testadas, os resultados demonstram a susceptibilidade da sinefrina frente à degradação forçada, indicando a necessidade de cuidados na manipulação e/ou armazenamento de produtos à base de extrato seco de Citrus aurantium.
AGRADECIMENTOS À CAPES pelo suporte financeiro.
REFERÊNCIAS 1. Fugh-berman, A.; Myers, A.; Exp. Biol. Med. 2004, 229, 698. 2. Haller, C. A.; Benowitz, N. L.; New Eng. J. Med. 2000, 343, 1833. DOI: http://dx.doi.org/10.1056/NEJM200012213432502 3. Grollman, A. P.; Thromb. Res. 2005, 117, 185. DOI: http://dx.doi.org/10.1016/j.thromres.2005.07.011 PMID: 16143370 4. Rossato, L. G.; Dissertaçao de Mestrado, Universidade do Porto, Portugal, 2009. 5. Jordan, S.; Murty, M.; Pilon, K.; Can. Med. Assoc. J. 2004, 171, 4. 6. Haaz, S.; Fontaine, K. R.; Cutter, G.; Limdi, N.; Perumean-chaney, S.; Allison, D. B.; Obes. Rev. 2006, 7, 79. DOI: http://dx.doi.org/10.1111/j.1467-789X.2006.00195.x PMID: 16436104 7. Linck, V. M.; Thiesen, F. V.; Leal, M. B.; Rev. Bras. Toxicol. 2006, 19, 89. 8. Arbo, M. D.; Larentis, E. R.; Linck, V. M.; Aboy, A. L.; Pimentel, A. L.; Henriques, A. T.; Dallegrave, E.; Garcia, S. C.; Leal, M. B.; Limberger, R. P.; Food Chem. Toxicol. 2008, 46, 2770. DOI: http://dx.doi.org/10.1016/j.fct.2008.04.037 PMID: 18571300 9. Pellati, F.; Benvenutti, S.; Melegari, M.; Firenzuoli, F.; J. Pharm. Biomed. Anal. 2002, 29, 1113. DOI: http://dx.doi.org/10.1016/S0731-7085(02)00153-X PMID: 12110397 10. Marchei, E.; Pichini, S.; Pacifici, R.; Pellegrini, M.; Zucaro, P.; J. Pharm. Biomed. Anal. 2006, 41, 1468. DOI: http://dx.doi.org/10.1016/j.jpba.2006.03.035 PMID: 16698212 11. Slezak, T.; Francis, P. S.; Anastos, N.; Barnett, N. W.; Anal. Chim. Acta. 2007, 593, 98. DOI: http://dx.doi.org/10.1016/j.aca.2007.04.038 PMID: 17531829 12. Uckoo, R. M.; Jayaprakasha, G. K.; Nelson, S. D.; Patil, B. S.; Talanta 2011, 83, 948. DOI: http://dx.doi.org/10.1016/j.talanta.2010.10.063 PMID: 21147342 13. Viana, C.; Zemolin, G. M.; Lima, F. O.; Carvalho, L. M.; Bottoli, C. B. G.; Limberger, R. P.; Food. Addit. Contam. 2013, 30, 634. DOI: http://dx.doi.org/10.1080/19440049.2013.775606 14. Bakshi, M.; Singh, S.; J. Pharm. Biomed. Anal. 2002, 28, 1011. DOI: http://dx.doi.org/10.1016/S0731-7085(02)00047-X PMID: 12049968 15. USP; The United States Pharmacopoeia, 36th ed., United States Pharmacopoeia Convention: Rockville, 2013. 16. ICH; Validation of Analytical Procedures: Text and Methodology Q1A(R2); International Conference on Harmonisation (ICH) of Technical Requirements for Registration of Pharmaceuticals for Human Use, Geneva, 2005. 17. ICH; Validation of Analytical Procedures: Text and Methodology Q2B; International Conference on Harmonisation (ICH) of Technical Requirements for Registration of Pharmaceuticals for Human Use, Geneva, 2005. 18. Ribani, M.; Bottoli, C. B. G.; Collins, C. H.; Jardim, I. C. S. F.; Melo, L. F. C.; Quim. Nova. 2004, 27, 771. DOI: http://dx.doi.org/10.1590/S0100-40422004000500017 19. Razzaq, S. N.; Khan, I. U.; Ashafaq, M.; Mariam, I.; Quim. Nova 2012, 35, 1216. DOI: http://dx.doi.org/10.1590/S0100-40422012000600028 20. Muthiah, P. L.; Int. J. Phytopharm. 2012, 2, 13. 21. Wang, Q. H.; Shu, Z. P.; Xu, B. Q.; Xing, N.; Jiao, W. J.; Yang, B. Y.; Kuang, H. X.; Int. J. Biol. Macromol. 2014, 67, 112. DOI: http://dx.doi.org/10.1016/j.ijbiomac.2014.03.004 PMID: 24631547 22. Klein, T.; Longhini, R.; Bruschi, M. L.; Mello, J. C. P.; Rev. Cienc. Farm. Basica Apl. 2009, 30, 241. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





