Artigo
|
|
| Determinação rápida e simultânea de sulfametoxazol e trimetoprima utilizando análise por injeção em batelada com detecção amperométrica e eletrodo de diamante dopado com boro Fast and simultaneous determination of sulfamethoxazole and trimethoprim using batch injection analysis with amperometric detection and boron-doped diamond electrode |
|
Polyana Fernandes Pereira; Weberson Pereira da Silva; Rodrigo Alejandro Abarza Muñoz; Eduardo Mathias Richter*
Instituto de Química, Universidade Federal de Uberlândia, 38400-902 Uberlândia - MG, Brasil Recebido em 13/11/2014 *e-mail: emrichter@iqufu.ufu.br A fast, simple procedure for simultaneous determination of sulfamethoxazole (SMX) and trimethoprim (TMP) was performed using batch injection analysis with multiple pulse amperometric detection (BIA-MPA). The sample aliquot (150 µL) was directly injected onto the boron-doped diamond (BDD) electrode (wall-jet configuration) immersed in a BIA system. The analytical characteristics of the proposed method include high analytical frequency (up to 75 injections per hour), good stability (RSD < 2.9%; n = 10), low detection limits (0.227 and 0.173 mg L-1 for SMX and TMP, respectively) and minimal waste generation. The proposed method yielded similar results to those obtained by liquid chromatography at a 95% confidence level. INTRODUÇÃO O sulfametoxazol (SMX), 4-amino-N-(5-metilisoxazol-3-il)-benzenosulfonamida, pertence ao grupo das sulfonamidas e possui atividade antibacteriana, sendo utilizado no tratamento de infecções no trato urinário, pneumonia, bronquite crônica, meningite meningocócita e toxoplasmose.1,2 O consumo em excesso de SMX pode causar perturbações gastrointestinais, hipersensibilidade e anormalidades hematológicas, tais como trombocitopenia, agranulocitose, megaloblastose, eosinofilia e sulfemoglobinemia.2 A trimetoprima (TMP), 5-[(3,4,5-trimetoxifenil)metil]-2,4-pirimidinodiamaina, é um derivado das diaminopirimidinas pertencente à classe de agentes quimioterapêuticos conhecidos como inibidores de dihidrofolato redutase.3 É um antibiótico sintético utilizado na profilaxia e no tratamento de infecções intestinais, respiratórias e do trato urinário de pacientes afetados pelo HIV.3,4 Ambos os compostos (SMX e TMP) podem ser encontrados combinados em formulações farmacêuticas na proporção de 1:5 (TMP:SMX), na forma de comprimidos ou suspensão (xarope), para terapia antimicrobiana.2 Essa associação produz uma atividade antibacteriana sinérgica devido ao bloqueio do metabolismo de ácido fólico que provoca uma queda da síntese de proteínas pelas bactérias.1,5 Devido à presença dos dois compostos concomitantemente em diversos medicamentos disponíveis no mercado, alguns métodos analíticos foram desenvolvidos e reportados na literatura para determinação simultânea de SMX e TMP, incluindo eletroforese capilar,6-8 cromatografia líquida de alta eficiência (HPLC) com detecção espectrofotométrica,5,9-12 amperométrica13 ou acoplada com espectrômetro de massas,14,15 eletrocromatografia micelar,16 voltametria de pulso diferencial1,17,18 e espectrofotometria UV-Vis.19-26 No entanto, entre os métodos listados, vários apresentam uma ou mais de uma das seguintes limitações: alto custo, baixa frequência analítica, uso de solventes orgânicos e necessidade de etapas trabalhosas de pré-tratamento de amostra. Desta forma, estudos para o desenvolvimento de novos métodos que permitam a determinação simultânea SMX e TMP sem as limitações listadas anteriormente é de grande importância. Recentemente, um procedimento alternativo denominado Análise por Injeção em Batelada com detecção por Amperometria de Múltiplos Pulsos (BIA-MPA, do inglês "Batch Injection Analysis with Multiple Pulse Amperometric detection") foi proposto para realizar determinações simultâneas.27 Como características dos sistemas BIA-MPA, pode-se citar: baixo custo, necessidade de volume reduzido de amostras e reagentes, alta frequência analítica e necessidade de procedimentos simples de preparo de amostras (solubilização e diluição). O sistema BIA-MPA tem excelentes resultados em determinações simultâneas, conforme já descrito na literatura.28-33 Em sistemas BIA com detecção amperométrica, uma alíquota de amostra ou solução padrão é injetada, com auxílio de uma micropipeta (normalmente eletrônica), diretamente na superfície do eletrodo de trabalho (configuração wall-jet), o qual está imerso em um grande volume de eletrólito suporte.34,35 Esse sistema apresenta várias características desejáveis, como a utilização de pequenos volumes de amostra, alta sensibilidade, baixo custo, simplicidade e possibilidade de desenvolvimento de procedimentos com características portáteis.36 A técnica de MPA (software GPES - Metrohm Autolab) permite a aplicação de até 10 pulsos de potenciais de forma rápida e alternada em função do tempo e a aquisição de corrente pode ser realizada em cada pulso de potencial separadamente (aquisição de até 10 amperogramas distintos simultaneamente).37 Além de determinações simultâneas, a técnica também possibilita a limpeza constante da superfície do eletrodo de trabalho por meio do uso de pulso de potencial com este propósito. Assim, a adsorção do(s) composto(s) em análise ou de seus respectivos produtos de oxidação ou redução é amenizada ou evitada e, consequentemente, resultados mais reprodutíveis podem ser obtidos, mesmo na presença de espécies que adsorvem na superfície do eletrodo de trabalho.38,39 Recentemente, o uso de eletrodos de diamante dopado com boro (BDD, do inglês "boron-doped diamond") vem recebendo destaque no desenvolvimento de novos métodos eletroquímicos de análise. Basicamente, isto se deve a algumas propriedades atrativas deste material, como: baixa e estável corrente de fundo, boa resistência à desativação ou envenenamento, estabilidade de resposta em longo prazo, ampla janela de potencial útil de trabalho e boa sensibilidade para alguns analitos.40-42 Estas características vêm sendo exploradas com sucesso no desenvolvimento de novos métodos para determinações simultâneas de espécies, tanto em sistemas estacionários (em batelada),43-48 como em sistemas hidrodinâmicos como FIA49-52 e BIA.27-33,53,54 Neste trabalho é apresentado um novo método eletroquímico para determinação rápida e simultânea de SMX e TMP usando BIA-MPA e eletrodo de diamante dopado com boro (BDD) como eletrodo de trabalho.
PARTE EXPERIMENTAL Reagentes, soluções e amostras Sulfametoxazol (SMX) e trimetoprima (TMP) foram adquiridos da Sigma-Aldrich (St. Louis, MO, USA), metanol e acetonitrila da Proquimios (Rio de Janeiro, Brazil), ácido fosfórico da Impex (São Paulo, Brazil) e hidróxido de sódio da empresa Dinâmica (Diadema, Brazil). Todas as soluções foram preparadas com água deionizada (Millipore Direct-Q3) com resistividade superior ou igual a 18 MΩ cm. Os reagentes utilizados nos experimentos foram de grau analítico e preparados sem purificação prévia. Tampão fosfato (0,1 mol L-1; pH = 7,0) em meio de água:metanol (70:30 v/v) foi utilizado como eletrólito suporte. As formulações farmacêuticas contendo SMX e TMP foram adquiridas em farmácia local na forma de suspensão (xarope) e também em comprimidos. Nas análises do xarope, uma alíquota de 1,5 mL foi diluída em metanol (solução estoque) e soluções em concentrações na faixa linear do método foram preparadas por diluição posterior em meio de eletrólito suporte. Os comprimidos (6 no total) foram pesados, pulverizados, homogeneizados e, posteriormente, uma massa de 84,9 mg foi dissolvida em metanol (solução estoque). Em seguida, uma alíquota desta solução foi adequadamente diluída em meio de eletrólito de suporte. Instrumentação As medidas eletroquímicas foram realizadas usando um potenciostato µAutolab Type III interfaceado a um computador por meio do software GPES (versão 4.9.007, Metrohm Autolab B. V.). Um eletrodo miniaturizado de Ag/AgClsat. com KCl,55 um fio de platina e diamante dopado com boro (BDD) foram utilizados como eletrodos de referência, auxiliar e trabalho, respectivamente. A célula BIA utilizada no trabalho foi construída na oficina mecânica da Faculdade de Engenharia Mecânica da Universidade Federal de Uberlândia. Maiores detalhes sobre sua construção foram descritos em trabalho publicado anteriormente.56 Nesta célula, um pedaço de BDD (0,7 × 0,7 cm) foi fixado na parte inferior da mesma com auxílio de um o-ring de borracha de 0,4 cm de diâmetro. O diâmetro do o-ring define a área do eletrodo de trabalho (0,13 cm2). Como a configuração dos eletrodos de BDD usados neste trabalho não podem ser mecanicamente polidos (filme de 1,2 µm de BDD depositado sobre uma base de sílica), o pré-tratamento ou limpeza era realizada eletroquimicamente, de forma similar ao proposto em trabalhos anteriores.57,58 Antes do eletrodo de BDD ser usado pela primeira vez, dois pré-tratamentos eletroquímicos foram realizados: o anódico (aplicação de +0,01 A durante 1000 s em meio tampão BR 0,04 mol L1; pH = 2) e, em seguida, o catódico (aplicação de -0,01 A durante 1000 s em meio de H2SO4 0,1 mol L1). Depois deste primeiro pré-tratamento, diariamente, antes das análises, somente um pré-tratamento catódico era repetido. Todos os experimentos foram realizados com a solução no interior da célula BIA sob agitação mediante o uso de um micro motor DC, conforme descrito anteriormente.59 A velocidade de agitação pode ser facilmente alterada e controlada por meio da variação da tensão aplicada com um regulador de tensão DC (3-12 V). Os experimentos foram realizados com velocidade de agitação de 1395 ± 10 rpm (com a aplicação de 5 V). A injeção das soluções (amostras e padrões) foi realizada com uma micropipeta eletrônica motorizada (Eppendorf multipette® stream) com a ponteira da mesma posicionada a uma distância constante do eletrodo de trabalho (∼2 mm), conforme recomendado anteriormente.34 Os resultados obtidos com o sistema BIA-MPA na determinação simultânea de SMX e TMP foram comparados com os obtidos por cromatografia líquida de alta eficiência (HPLC).5 O sistema HPLC era composto por uma bomba Hitachi L-2130, um detector UV-VIS Hitachi LC-4250 e uma coluna Shim-PAC CLC-ODS (25 mm × 46 mm; Shimadzu). A fase móvel foi composta de ácido fosfórico 0,01 mol L-1 (pH = 6, ajustado com hidróxido de sódio)/acetonitrila (83:17) a uma vazão de 1,0 mL min-1. O comprimento de onda foi fixado em 265 nm. Os tempos de retenção foram 8,23 e 14,59 min para SMX e TMP, respectivamente.
RESULTADOS E DISCUSSÕES Em estudos disponibilizados na literatura anteriormente, algumas informações sobre os compostos estudados neste trabalho foram obtidas: (i) os compostos apresentam baixa solubilidade em água e o uso de um solvente orgânico faz-se necessário;1,17 (ii) a melhor separação entre os picos de oxidação dos dois compostos ocorre em soluções com pH em torno de 7,0;1 (iii) o eletrodo de BDD pré-tratado catodicamente apresenta melhor desempenho na determinação dos dois compostos (SMX e TMP).1,17 A Figura 1 mostra os voltamogramas cíclicos obtidos com eletrodo BDD em meio de tampão fosfato antes (─) e após a adição de SMX (---) ou TMP (∙∙∙∙).
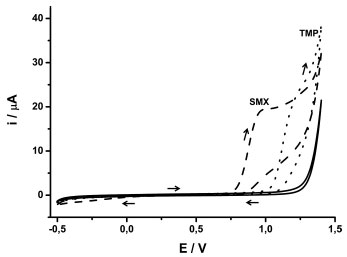 Figura 1. Voltamogramas cíclicos obtidos em meio de tampão fosfato (0,1 mol L-1; pH = 7,0) e metanol (70:30) antes (─) e após a adição de 253 mg L-1 de SMX (---) ou de 290 mg L-1 de TMP (∙∙∙∙∙). Velocidade de varredura = 50 mV s-1; Incremento de potencial = 5 mV
Nessas condições, a SMX apresentou um pico anódico em potenciais superiores a +0,75 V devido à oxidação do grupo -NH2, conforme descrito em trabalhos anteriores.2,60,61 O pico catódico observado em potenciais inferiores a 0,00 V corresponde a redução do grupo SO2.61 A eletrooxidação da TMP envolve a transferência de 4 elétrons,3 levando à formação do seu derivado nitroso em potenciais superiores a +1,0 V. O uso do eletrólito suporte tampão fosfato forneceu uma boa separação entre os picos anódicos do SMX e TMP (cerca de 200 mV), o que é conveniente se o objetivo é a determinação simultânea dos dois compostos. O comportamento eletroquímico do SMX e TMP também foi investigado usando o sistema BIA-MPA (condição hidrodinâmica). Nesse estudo, uma rampa de 10 pulsos de potenciais (0,0; 0,2; 0,4; 0,6; 0,8; 1,0; 1,1; 1,2; 1,3 e 1,4 V; 70 ms cada) foi aplicada repetidamente ao eletrodo BDD em função do tempo. A corrente em cada pulso de potencial foi monitorada separadamente e continuamente ao longo do tempo e, consequentemente, 10 amperogramas foram simultaneamente registrados em um único experimento (Figura 2A). Injeções em triplicata de soluções contendo 10 mg L-1 de TMP (■) ou 50 mg L-1 de SMX (○) foram realizadas. A média da corrente (n = 3) monitorada em cada pulso de potencial foi utilizada na obtenção do voltamograma hidrodinâmico para SMX e TMP (Figura 2B).
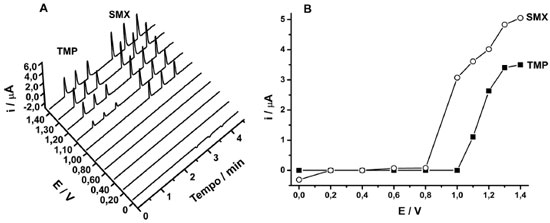 Figura 2. (A) Amperogramas obtidos com o sistema BIA-MPA após 3 injeções de uma solução contendo 10 mg L-1 de TMP ou 50 mg L-1 de SMX. (B) Voltamograma hidrodinâmico obtido plotando valores das correntes de pico em função do respectivo pulso de potencial aplicado. Eletrólito suporte: Tampão fosfato (0,1 mol L-1; pH = 7,0)/metanol (v/v; 70/30); velocidade de injeção: 75 µL s-1; volume injetado: 150 µL
Como pode ser observado na Figura 2, a oxidação de SMX e TMP ocorre em potenciais superiores a +0,8 e +1,0 V, respectivamente. Assim, podemos concluir que na região de potencial entre +0,8 e +1,0 V, somente ocorre a oxidação de SMX (sem interferência de TMP). No entanto, em potenciais superiores a +1,0 V, ambos os compostos (SMX e TMP) são oxidados. A Figura 3 apresenta os amperogramas obtidos nos dois pulsos de potenciais (+ 1,0V/ 100 ms e +1,2 V/ 50 ms) para injeções em duplicata de três soluções com composições diferentes: (i) somente 20 mg L-1 de TMP; (ii) somente 100 mg L-1 de SMX e; (iii) ambos os compostos (20 + 100 mg L-1 de TMP e SMX, respectivamente). No estudo anterior (voltamograma hidrodinâmico) e nesse estudo, a relação entre as concentrações de TMP e SMX (1:5) é a mesma encontrada nas formulações farmacêuticas disponíveis comercialmente (xarope: cada 5 mL contém 200 mg de SMX e 40 mg de TMP; comprimidos: 800 mg de SMX e 160 mg de TMP).
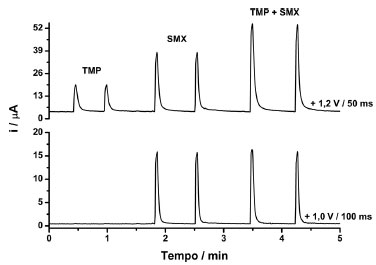 Figura 3. Amperogramas obtidos para injeções (n = 2) de soluções contendo somente TMP (20 mg L-1), somente SMX (100 mg L-1) e TMP + SMX (20 + 100 mg L-1) em dois pulsos de potenciais (+1,0 V/ 100 ms e +1,2 V/ 50 ms). Potencial de limpeza: + 0,6 V/ 300 ms; Eletrólito suporte: Tampão fosfato (0,1 mol L-1; pH = 7,0)/ metanol (v/v; 70/30); velocidade de injeção: 75 µL s-1; volume injetado: 150 µL
A partir da Figura 3 é possível observar que em +1,0 V somente SMX foi oxidado e em +1,2 V, ambos os compostos (SMX e TMP) foram oxidados. Pode ser observado também que a corrente de oxidação detectada para SMX em +1,0 V foi semelhante na presença ou ausência de TMP, indicando a ausência de qualquer interferência ou interação química entre os dois compostos. Além disso, a somadas correntes de oxidação detectadas em +1,2 V para soluções contendo somente TMP (14,9 µA) ou somente SMX (33,9 µA) é semelhante à corrente de oxidação obtida para a solução contendo TMP + SMX na mesma concentração (50,1 µA). Outra informação importante obtida a partir da Figura 3 está relacionada com a corrente de oxidação do SMX em +1,0 V (15,2 µA) e em +1,2 V (33,9 µA). Por apresentarem valores diferentes, uma simples subtração entre as correntes detectados nos dois pulsos de potenciais não dá acesso à corrente de oxidação da TMP. Para contornar este problema, o uso de um fator de correção (FC) foi proposto.32,49,52,62 O FC foi obtido por meio da injeção de uma solução contendo apenas SMX e a equação 1: 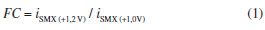 Em seguida, a corrente relacionada somente com a oxidação da TMP em +1,2 V, em soluções contendo SMX + TMP, pode ser calculada utilizando a equação 2: 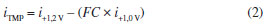 É recomendável que o FC seja calculado em cada curva de calibração, uma vez que pequenas variações podem ocorrer em FC obtidos em dias diferentes. Além disto, a faixa de concentração onde o FC apresenta valor constante necessita ser estudada. Parâmetros como velocidade de injeção (75 µL s-1) e volume de injeção (150 µL) foram otimizados com base nos parâmetros sensibilidade e repetibilidade. Em sistemas BIA, o volume de injeção de 100 µL é geralmente suficiente para alcançar a melhor sensibilidade.34 No entanto, no presente estudo, o volume de injeção foi aumentado para 150 µL, de modo que a aquisição de corrente, em cada amperograma, ocorresse mais vezes na região de corrente máxima de cada pico (sinal transiente). Assim, uma melhor repetibilidade foi obtida. No presente trabalho, a seguinte rampa de pulsos de potenciais foi otimizada: +1,0 V/ 100 ms; +1,2 V/ 50 ms e +0,6 V / 300 ms (pulso de potencial de limpeza). Desta forma, a leitura de corrente, em cada amperograma, foi realizada a cada 450 ms. A influência da agitação da solução contida no interior da célula BIA também foi estudada. A Figura 4 mostra os resultados obtidos utilizando o sistema BIA-MPA com e sem agitação da solução contida no interior da célula.
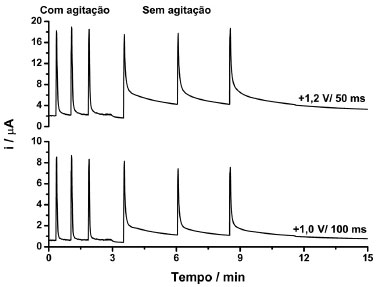 Figura 4. Comparação entre os resultados obtidos por BIA-MPA com e sem agitação da solução no interior da célula. Velocidade de agitação: 1395 ± 10 rpm; solução injetada: 10 mg L-1 de TMP + 50 mg L-1 de SMX. Outras condições ver na Figura 3
Como pode ser observado, sob agitação, a corrente do pico retorna rapidamente para a linha de base e a frequência de amostragem pode ser aumentada de 18 para 75 injeções h-1. Além disso, os analitos e seus respectivos produtos de oxidação são rapidamente removidos da superfície do eletrodo de trabalho (diluição rápida na solução contida na célula BIA), o que reduz a possibilidade de contaminação do eletrodo de trabalho. A Figura 5 apresenta os resultados obtidos para injeções em triplicata de 20 mg L-1 de SMX (usada para o cálculo do FC) e injeções sucessivas (n = 10) de soluções contendo 2 + 10 mg L-1 (a) ou 10 + 50 mg L-1 (b) de TMP + SMX, respectivamente.
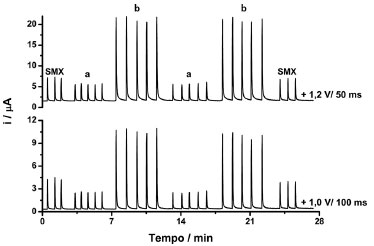 Figura 5. Amperogramas obtidos para injeções em triplicata de 20 mg L-1 de SMX e injeções sucessivas (n = 10) de soluções contendo 2 + 10 mg L-1 (a) ou 10 + 50 mg L-1 (b) de TMP + SMX, respectivamente. Outras condições ver Figura 3
Nesse estudo, o DPR (n = 10) foi de 1,8% (a) e 1,3% (b) para SMX e de 2,9% (a) e 2,4% (b) para TMP. Esses resultados indicam que o sistema BIA-MPA apresentou boa repetibilidade, uma vez que não foi observado nenhum efeito de memória entre sucessivas injeções, mesmo injetando alternadamente soluções de concentrações muito diferentes. Esses resultados somente foram obtidos após a inclusão de um terceiro pulso de potencial (+0,6 V por 300 ms; limpeza eletroquímica) na rampa de potenciais aplicada de forma contínua e cíclica durante todo o experimento. O uso deste pulso de potencial previne ou retarda a contaminação do eletrodo de BDD. Na ausência deste pulso de potencial, DPRs superiores a 5% foram obtidos em todos os testes realizados. A Figura 6 apresenta os amperogramas obtidos para injeções em triplicata de uma solução contendo 20 mg L-1 de SMX (usada para calcular o FC), cinco soluções padrão contendo simultaneamente TMP e SMX (a-e: TMP 2-10 mg L-1 e SMX 10-50 mg L-1) e quatro amostras (f, g, h e i) adequadamente diluídas em eletrólito suporte. As curvas analíticas para ambos os compostos foram preparadas levando em consideração o intervalo de concentração para a qual o FC foi relativamente constante (1,36 ± 0,02; n = 5) e a proporção da concentração encontrada em amostras farmacêuticas comerciais (aproximadamente 5 vezes mais SMX que TMP).
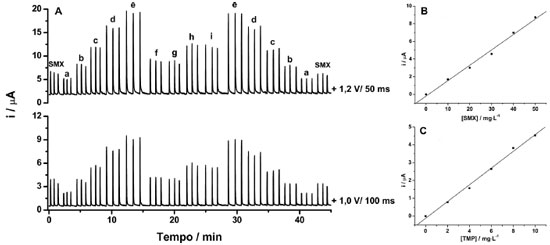 Figura 6. (A) BIA-AMP amperogramas obtidos após injeções de SMX (20 mg L-1), cinco soluções padrão contendo simultaneamente concentrações crescente de TMP (a-e: 2-10 mg L-1) e SMX (a-e: 10-50 mg L-1) e quatro amostras farmacêuticas devidamente diluídas (f, g, h e i). (B) Curva analítica para TMP e (C) Curva analítica para SMX. Outras condições ver Figura 3
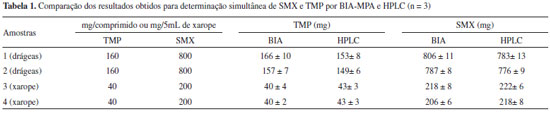
As curvas analíticas (Figuras 6B e C) mostraram boa linearidade nas faixas de concentrações estudadas, com as seguintes equações de reta: SMX: i (µA) = - 0,196 ± 0,237 + 0,174 ± 0,007 c (mg L-1); r = 0,996 TMP: i (µA) = - 0,122 ± 0,107 + 0,496 ± 0,018c (mg L-1); r = 0,997 As soluções padrão injetadas em ordem crescente ou decrescente de concentração apresentaram respostas semelhantes (baixo desvio no valor de inclinação das curvas), o que indica mais uma vez que o fenômeno de contaminação do eletrodo ou o efeito de memória foi prevenido. Os limites de detecção (LD) foram calculados em 0,227 e 0,173 mg L-1 para SMX e TMP, respectivamente (LD = 3 SB/b; onde SBé o desvio padrão do branco, n = 10, e b é o coeficiente angular da curva de calibração). A frequência analítica foi calculada em aproximadamente 75 injeções h-1. O desempenho método BIA-MPA proposto também foi avaliado na determinação simultaneamente SMX e TMP em 4 amostras farmacêuticas (duas amostras líquidas e duas sólidas) e os resultados obtidos foram comparados com os obtidos por HPLC. A Tabela 1 mostra os resultados obtidos com seus respectivos desvios padrão (n = 3).
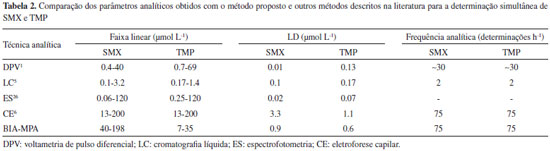
O método BIA-MPA apresentou resultados similares aos obtidos por HPLC. Segundo o teste t de Student para dados pareados, os resultados médios de ambos os métodos podem ser considerados similares em um nível de confiança de 95% (tcalculado= 3,00 < tcrítico= 3,18; n = 3). Além disso, o teste f foi utilizado para avaliar a igualdade entre os desvios padrão dos resultados obtidos em ambos os métodos e, em todos os casos, o fcalculado foi inferior ao fcrítico (19,0) num nível de confiança de 95%. Na Tabela 2 é apresentada uma comparação entre os resultados obtidos com o método proposto e os reportados anteriormente usando quatro diferentes técnicas analíticas na determinação simultânea de SMX e TMP.
A faixa linear e os limites de detecção obtidos com o método proposto são maiores aos reportados em alguns trabalhos anteriores.1,5-26 Quando comparado ao método empregando eletroforese capilar,6 os resultados obtidos podem ser considerados similares. No entanto, na análise de amostras farmacêuticas, baixos limites de detecção não são necessários. Por outro lado, o método de BIA-MPA é mais rápido (∼75 injeções h-1) e gera menor quantidade de resíduo por análise. Mais de 200 injeções são possíveis sem a troca da solução do interior da célula BIA (~150 mL).
CONCLUSÕES O método proposto de determinação simultânea de SMX e TMP em formulações farmacêuticas usando BIA-MPA apresenta diversas características que podem ser consideradas favoráveis: baixo custo operacional, procedimento simples de preparo das amostras (somente dissolução e diluição), alta frequência analítica (~75 injeções h-1), alta precisão, baixo consumo de reagente e amostras e, consequentemente, geração de pequena quantidade de resíduos por análise. Além disso, os resultados obtidos com o método proposto são similares aos obtidos por HPLC a um nível de confiança de 95%. Adicionalmente, devido às características portáteis dos sistemas BIA, o método tem potencial para ser usado no controle de qualidade de formulações farmacêuticas em farmácias de manipulação ou em laboratórios com infraestrutura mínima.
AGRADECIMENTOS Ao CNPq (processo número 472465/2012-0), CAPES (processo número 23038.007073/2014-12) e FAPEMIG (processo número CEX - PPM-00503-13) e Rede Mineira de Química pelo suporte financeiro.
REFERÊNCIAS 1. Andrade, L. S.; Rocha-Filho, R. C.; Cass, Q. B.; Fatibello-Filho, O. Electroanalysis 2009, 21, 1475. DOI: http://dx.doi.org/10.1002/elan.200804551 2. Arvand, M.; Ansari, R.; Heydari, L.; Mater. Sci. Eng., C 2011, 31, 1819. DOI: http://dx.doi.org/10.1016/j.msec.2011.08.014 3. Rajith, L.; Jissy, A. K.; Kumar, K. G.; Datta, A.; J. Phys. Chem. C 2011, 115, 21858. DOI: http://dx.doi.org/10.1021/jp208027s 4. da Silva, H.; Pacheco, J. G.; Magalhaes, J. M. C. S.; Viswanathan, S.; Delerue-Matos, C.; Biosens. Bioelectron. 2014, 52, 56. DOI: http://dx.doi.org/10.1016/j.bios.2013.08.035 PMID: 24021656 5. Pereira, A. V.; Cass, Q. B.; J. Chromatogr. B 2005, 826, 139. DOI: http://dx.doi.org/10.1016/j.jchromb.2005.08.006 6. da Silva, I. S.; Rajh Vidal, D. T.; do Lago, C. L.; Angnes, L.; J. Sep. Sci. 2013, 36, 1405. DOI: http://dx.doi.org/10.1002/jssc.201201013 PMID: 23519989 7. Li, Q. F.; Zhang, H. Y.; Wang, H. W.; Chen, X. G.; Hu, Z. D.; Chin. J. Anal. Chem. 2000, 28, 793. 8. Teshima, D.; Otsubo, K.; Makino, K.; Itoh, Y.; Oishi, R.; Biomed. Chromatogr. 2004, 18, 51. DOI: http://dx.doi.org/10.1002/bmc.291 PMID: 14872549 9. Amini, H.; Ahmadiani, A.; J. Pharm. Biomed. Anal. 2007, 43, 1146. DOI: http://dx.doi.org/10.1016/j.jpba.2006.09.004 PMID: 17034977 10. Bedor, D. C. G.; Goncalves, T. M.; Ferreira, M. L. L.; de Sousa, C. E. M.; Menezes, A. L.; Oliveira, E. J.; de Santana, D. P.; J. Chromatogr. B 2008, 863, 46. DOI: http://dx.doi.org/10.1016/j.jchromb.2007.12.027 11. Coutinho, R. C.; Barbosa, E. T.; Sena, M. M.; Perez, C. N.; Quim. Nova 2009, 32, 2214. DOI: http://dx.doi.org/10.1590/S0100-40422009000800038 12. Sayar, E.; Sahin, S.; Cevheroglu, S.; Hincal, A. A.; Eur. J. Drug Metab. Pharmacokinet. 2010, 35, 41. DOI: http://dx.doi.org/10.1007/s13318-010-0006-9 PMID: 21495265 13. Andrade, L. S.; de Moraes, M. C.; Rocha-Filho, R. C.; Fatibello-Filho, O.; Cass, Q. B.; Anal. Chim. Acta 2009, 654, 127. DOI: http://dx.doi.org/10.1016/j.aca.2009.09.035 PMID: 19854343 14. Mistri, H. N.; Jangid, A. G.; Pudage, A.; Shah, A.; Shrivastav, P. S.; Microchem. J. 2010, 94, 130. DOI: http://dx.doi.org/10.1016/j.microc.2009.10.002 15. Wang, X.; Zhang, Y.; Qin, K.; Nian, S.; Xiao, T.; Zhang, Q.; Wang, X.; Ma, J.; J. Liq. Chromatogr. Relat. Technol. 2012, 35, 951. DOI: http://dx.doi.org/10.1080/10826076.2011.597066 16. Injac, R.; Kac, J.; Karljikovic-Rajic, K.; Strukelj, B.; J. Food Drug Anal. 2008, 16, 18. 17. Andrade, L. S.; Rocha-Filho, R. C.; Cass, Q. B.; Fatibello-Filho, O.; Anal. Methods 2010, 2, 402. DOI: http://dx.doi.org/10.1039/b9ay00092e 18. Cesarino, I.; Cesarino, V.; Lanza, M. R. V.; Sens. Actuators, B 2013, 188, 1293. DOI: http://dx.doi.org/10.1016/j.snb.2013.08.047 19. de Cordova, M. L. F.; Barrales, P. O.; Torne, G. R.; Diaz, M.; J. Pharm. Biomed. Anal. 2003, 31, 669. DOI: http://dx.doi.org/10.1016/S0731-7085(02)00685-4 20. Geng, X.; Li, J. H.; Gao, L. R.; Zhu, X. H.; Chin. J. Anal. Chem. 2001, 29, 1036. 21. Ghanem, A.; Meshali, M.; Foda, A.; J. Pharm. Pharmacol. 1979, 31, 122. DOI: http://dx.doi.org/10.1111/j.2042-7158.1979.tb13450.x PMID: 33248 22. Givianrad, M. H.; Mohagheghian, M.; E-J. Chem. 2012, 9, 680. DOI: http://dx.doi.org/10.1155/2012/274396 23. Goodarzi, M.; Shahbazikhah, P.; Sohrabi, M. R.; Fathabadi, M.; Nouri, S. H.; J. Chil. Chem. Soc. 2009, 54, 309. 24. Hajian, R.; Haghighi, R.; Shams, N.; Asian J. Chem. 2010, 22, 6569. 25. Hassouna, M. E. M.; Anal. Lett. 1997, 30, 2341. DOI: http://dx.doi.org/10.1080/00032719708001746 26. Toral, M. I.; Lara, N.; Tapia, A. E.; Torres, C.; Richter, P.; Bol. Soc. Chil. Quim. 2002, 47, 241. 27. Silva, R. A. B.; Gimenes, D. T.; Tormin, T. F.; Munoz, R. A. A.; Richter, E. M.; Anal. Methods 2011, 3, 2804. DOI: http://dx.doi.org/10.1039/c1ay05395g 28. Gimenes, D. T.; Cunha, R. R.; Araujo de Carvalho Ribeiro, M. M.; Pereira, P. F.; Munoz, R. A. A.; Richter, E. M.; Talanta 2013, 116, 1026. DOI: http://dx.doi.org/10.1016/j.talanta.2013.08.020 PMID: 24148511 29. Pereira, P. F.; Marra, M. C.; Lima, A. B.; Pio dos Santos, W. T.; Munoz, R. A. A.; Richter, E. M.; Diamond Relat. Mater. 2013, 39, 41. DOI: http://dx.doi.org/10.1016/j.diamond.2013.07.010 30. Tormin, T. F.; Cunha, R. R.; Richter, E. M.; Munoz, R. A. A.; Talanta 2012, 99, 527. DOI: http://dx.doi.org/10.1016/j.talanta.2012.06.024 PMID: 22967589 31. Gimenes, D. T.; Marra, M. C.; Munoz, R. A. A.; Angnes, L.; Richter, E. M.; Anal. Methods 2014, 6, 3261. DOI: http://dx.doi.org/10.1039/c4ay00272e 32. Pereira, P. F.; Marra, M. C.; Cunha, R. R.; da Silva, W. P.; Munoz, R. A. A.; Richter, E. M.; J. Electroanal. Chem. 2014, 713, 32. DOI: http://dx.doi.org/10.1016/j.jelechem.2013.11.031 33. Freitas, J. M.; da Costa Oliveira, T.; Silva, P. L.; Tofanello Gimenes, D.; Munoz, R. A. A.; Richter, E. M.; Electroanalysis 2014, 26, 1905. DOI: http://dx.doi.org/10.1002/elan.201400300 34. Quintino, M. S. M.; Angnes, L.; Electroanalysis 2004, 16, 513. DOI: http://dx.doi.org/10.1002/elan.200302878 35. Wang, J.; Taha, Z.; Anal. Chem. 1991, 63, 1053. DOI: http://dx.doi.org/10.1021/ac00010a025 36. Tormin, T. F.; Cunha, R. R.; Bezerra da Silva, R. A.; Munoz, R. A. A.; Richter, E. M.; Sens. Actuators, B 2014, 202, 93. DOI: http://dx.doi.org/10.1016/j.snb.2014.04.096 37. Santos, W. T. P.; Gimenes, D. T.; Richter, E. M.; Angnes, L.; Quim. Nova 2011, 34, 1753. DOI: http://dx.doi.org/10.1590/S0100-40422011000100025 38. Gimenes, D. T.; de Freitas, J. M.; Munoz, R. A. A.; Richter, E. M.; Electroanalysis 2011, 23, 2521. DOI: http://dx.doi.org/10.1002/elan.201100126 39. Stefano, J. S.; de Lima, A. P.; Montes, R. H. O.; Richter, E. M.; Munoz, R. A. A.; J. Braz. Chem. Soc. 2012, 23, 1834. DOI: http://dx.doi.org/10.1590/S0103-50532012005000055 40. Pedrosa, V. A.; Codognoto, L.; Avaca, L. A.; Quim. Nova 2003, 26, 844. DOI: http://dx.doi.org/10.1590/S0100-40422003000600012 41. de Barros, R. D. M.; Ribeiro, M. C.; An-Sumodjo, P. T.; Juliao, M. S. S.; Serrano, S. H. P.; Ferreira, N. G.; Quim. Nova 2005, 28, 317. DOI: http://dx.doi.org/10.1590/S0100-40422005000200024 42. Medeiros, R. A.; Carvalho, A. E.; Rocha-Filho, R. C.; Fatibello-Filho, O.; Quim. Nova 2008, 31, 1405. DOI: http://dx.doi.org/10.1590/S0100-40422008000600024 43. Svorc, L.; Sochr, J.; Tomcik, P.; Rievaj, M.; Bustin, D.; Electrochim. Acta 2012, 68, 227. DOI: http://dx.doi.org/10.1016/j.electacta.2012.02.071 44. Eisele, A. P. P.; Clausen, D. N.; Tarley, C. R. T.; Dall'Antonia, L. H.; Sartori, E. R.; Electroanalysis 2013, 25, 1734. DOI: http://dx.doi.org/10.1002/elan.201300137 45. Eisele, A. P. P.; Mansano, G. R.; de Oliveira, F. M.; Casarin, J.; Tarley, C. R. T.; Sartori, E. R.; J. Electroanal. Chem. 2014, 732, 46. DOI: http://dx.doi.org/10.1016/j.jelechem.2014.08.033 46. Lima, A. B.; Torres, L. M. F. C.; Guimaraes, C. F. R. C.; Verly, R. M.; Silva, L. M.; Júnior, A. D. C.; dos Santos, W. T. P.; J. Braz. Chem. Soc. 2014, 25, 478. 47. Medeiros, R. A.; Rocha-Filho, R. C.; Fatibello-Filho, O.; Food Chem. 2010, 123, 886. DOI: http://dx.doi.org/10.1016/j.foodchem.2010.05.010 48. Santos, M. C. G.; Tarley, C. R. T.; Dall'Antonia, L. H.; Sartori, E. R.; Sens. Actuators B 2013, 188, 263. DOI: http://dx.doi.org/10.1016/j.snb.2013.07.025 49. de Miranda, J. A. T.; Cunha, R. R.; Gimenes, D. T.; Munoz, R. A. A.; Richter, E. M.; Quim. Nova 2012, 35, 1459. DOI: http://dx.doi.org/10.1590/S0100-40422012000700029 50. dos Santos, V. B.; Fava, E. L.; Pessoa-Neto, O. D.; Bianchi, S. R.; Faria, R. C.; Fatibello-Filho, O.; Anal. Methods 2014, 6, 8526. DOI: http://dx.doi.org/10.1039/C4AY01811G 51. Medeiros, R. A.; Lourencao, B. C.; Rocha-Filho, R. C.; Fatibello-Filho, O.; Talanta 2012, 99, 883. DOI: http://dx.doi.org/10.1016/j.talanta.2012.07.051 PMID: 22967638 52. Silva, W. C.; Pereira, P. F.; Marra, M. C.; Gimenes, D. T.; Cunha, R. R.; da Silva, R. A. B.; Munoz, R. A. A.; Richter, E. M.; Electroanalysis 2011, 23, 2764. DOI: http://dx.doi.org/10.1002/elan.201100512 53. Lima, A. B.; Chaves, S. C.; da Silva, L. M.; Pereira, P. F.; Richter, E. M.; dos Santos, W. T. P.; Quim. Nova 2013, 36, 1296. DOI: http://dx.doi.org/10.1590/S0100-40422013000900004 54. Silva, R. A. G.; Silva, L. A. J.; Munoz, R. A. A.; Richter, E. M.; Oliveira, A. C.; J. Electroanal. Chem. 2014, 733, 85. DOI: http://dx.doi.org/10.1016/j.jelechem.2014.09.025 55. Pedrotti, J. J.; Angnes, L.; Gutz, I. G. R.; Electroanalysis 1996, 8, 673. DOI: http://dx.doi.org/10.1002/elan.1140080713 56. Tormin, T. F.; Gimenes, D. T.; Richter, E. M.; Munoz, R. A. A.; Talanta 2011, 85, 1274. DOI: http://dx.doi.org/10.1016/j.talanta.2011.06.008 PMID: 21807182 57. Salazar-Banda, G. R.; de Carvalho, A. E.; Andrade, L. S.; Rocha-Filho, R. C.; Avaca, L. A.; J. Appl. Electrochem. 2010, 40, 1817. DOI: http://dx.doi.org/10.1007/s10800-010-0139-1 58. Terashima, C.; Rao, T. N.; Sarada, B. V.; Kubota, Y.; Fujishima, A.; Anal. Chem. 2003, 75, 1564. DOI: http://dx.doi.org/10.1021/ac020583q PMID: 12705586 59. Pereira, P. F.; Marra, M. C.; Munoz, R. A. A.; Richter, E. M.; Talanta 2012, 90, 99. DOI: http://dx.doi.org/10.1016/j.talanta.2012.05.024 PMID: 22340122 60. Fabianska, A.; Bogdanowicz, R.; Zieba, P.; Ossowski, T.; Gnyba, M.; Ryl, J.; Zielinski, A.; Janssens, S. D.; Haenen, K.; Siedlecka, E. M.; Phys. Status Solidi A 2013, 210, 2040. DOI: http://dx.doi.org/10.1002/pssa.201300094 61. Souza, C. D.; Braga, O. C.; Vieira, I. C.; Spinelli, A.; Sens. Actuators, B 2008, 135, 66. DOI: http://dx.doi.org/10.1016/j.snb.2008.07.020 62. Gimenes, D. T.; Pereira, P. F.; Cunha, R. R.; Bezerra da Silva, R. A.; Munoz, R. A. A.; Richter, E. M.; Electroanalysis 2012, 24, 1805. DOI: http://dx.doi.org/10.1002/elan.201200254 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access