Educação
|
|
| Fundamentos de eletroforese capilar: uma abordagem por animações Fundamentals of capillary electrophoresis: an animation approach |
|
Fernando Antonio Simas VazI,*; Cledson Lopes Marta de OliveiraII; Marcone Augusto Leal de OliveiraI
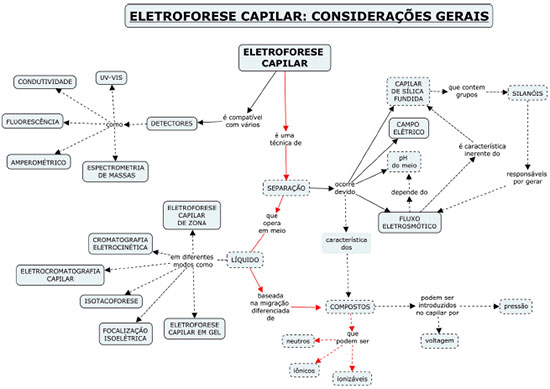
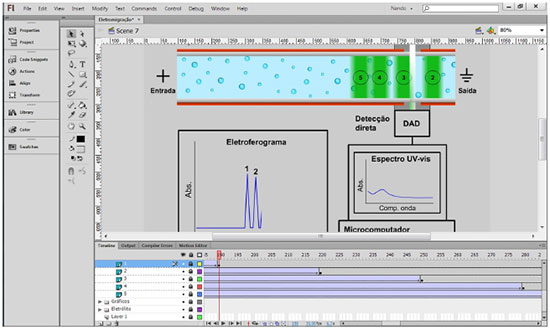
IDepartamento de Química, Instituto de Ciências Exatas, Universidade Federal de Juiz de Fora, 36036-330 Juiz de Fora - MG, Brasil Recebido em 22/10/2014 *e-mail: nando.simas.vaz@gmail.com Among the analytical separation techniques, capillary electrophoresis (CE) has attracted attention in both academic and industrial fields, mainly owing to its efficiency, short analysis times, low reagent consumption and residue generation. This is also the case in Chemistry courses, books and papers, demonstrating CE's well-established status. However, despite the range of available bibliographic material, there is a lack of animations showing the CE dynamic process. Therefore, the aim of this work was to show the development of a group of animations available for public access, where electrolyte and analytes movements under different CE modes; electropherogram formation; and online ultraviolet-visible spectra can be viewed. The normal or reverse electroosmotic flow generation in the vicinity of the silica capillary wall and the partition motion of neutral compounds between micellar and aqueous phases are also shown. Capillary zone electrophoresis, micellar electrokinetic chromatography, capillary electrochromatography, capillary isoelectric focusing, capillary isotachophoresis and capillary gel electrophoresis, are included in this package. This animation approach can be highly didactic and can complement the theoretical study of CE techniques, which may aid researchers, teachers and students interested in understanding the dynamism and potential of different CE modes. INTRODUÇÃO Desde o início da Eletroforese Capilar (CE, "capillary electrophoresis"), na década de 1980, o avanço desta técnica analítica de separação é, no mínimo, considerável. Parte deste crescimento pode ser atribuída às elevadas eficiências alcançadas, curtos tempos de análise e baixa geração de resíduos para a análise de amostras de importância ambiental, industrial, clínica, biomédica, entre outras.1-5 Outra grande vantagem é a simplicidade da instrumentação, o que possibilita, em um mesmo equipamento, a realização dos mais variados modos de análise empregando a aplicação de tensão. Com isso, um grande número de "subtécnicas" de eletromigração em capilares surgiu com o objetivo de analisar variados analitos em matrizes complexas.3 Naturalmente, a literatura abrange grande parte de todos estes conceitos e aplicações. Entretanto, apesar da variedade de material bibliográfico disponível, em forma de textos, figuras e equações, existe uma carência de material didático que aborde o processo da CE em movimento, o que, na prática, define o curso da análise. Assim como uma figura qualquer pode simplificar o entendimento de um texto, um vídeo pode diminuir substancialmente o tempo necessário para a assimilação de um conteúdo. É neste contexto que os autores deste trabalho vêm com o objetivo de apresentar e divulgar um conjunto de animações disponíveis gratuitamente ao público, no qual é possível visualizar os movimentos dos analitos e eletrólito durante uma análise, bem como a obtenção do eletroferograma e espectros ultravioleta-visível, por diferentes técnicas de CE. Também são mostradas a formação do fluxo eletrosmótico (EOF, "electroosmotic flow") normal e invertido nas proximidades da parede de capilares de sílica e a partição diferenciada de compostos neutros em fases micelares. Modos como eletroforese capilar de zona (CZE, "capillary zone electrophoresis"), cromatografia eletrocinética micelar (MEKC, "micellar electrokinetic chromatography"), eletrocromatografia capilar (CEC, "capillary electrochromatography"), focalização isoelétrica capilar (CIEF, "capillary isoelectric focusing"), isotacoforese capilar (CITP, "capillary isotachophoresis") e eletroforese capilar em gel (CGE, "capillary gel electrophoresis") estão contidos neste pacote. A Figura 1 mostra um mapa conceitual sobre a organização dos conceitos gerais da CE. Acredita-se que esta abordagem por animações pode complementar o aprendizado inicial da técnica, embora não seja recomendada para substituir o conteúdo teórico sobre CE, podendo servir para pesquisadores, professores e alunos interessados em entender o dinamismo e potencial da CE em seus diferentes ramos. EXPERIMENTAL Software As animações foram produzidas no software Adobe Flash Professional e a programação envolvida foi desenvolvida no ActionScript 3.0. Este programa permite desde a construção inicial dos elementos gráficos, passando pelas suas movimentações até a exportação do projeto final para um formato de arquivo apropriado. A interface do usuário (Figura 2) é relativamente simples e intuitiva, de tal forma que, em pouco tempo de uso é possível se habituar aos controles e funções. Para um maior aprofundamento sobre a utilização desse software, existem diversos tutoriais específicos para cada tipo de desenvolvedor ou aplicação, em função do interesse.6 Uma versão de demonstração pode ser baixada no mesmo endereço. Objetos e símbolos gráficos O Flash permite a criação dos objetos a partir de vetores contendo propriedades como tamanho, posição, orientação, cor, transparência entre outras. Uma vez criado um objeto qualquer, este pode ser transformado em um símbolo e inserido em sua biblioteca de símbolos. Posteriormente, uma unidade deste símbolo (instância) pode ser reaproveitada por várias vezes, sem ocupação excessiva de memória, o que pode contribuir para o tamanho reduzido dos arquivos. Assim, para se representar diferentes analitos em uma separação analítica, é memorizado um único objeto (por exemplo, "Analito") e diferentes instâncias ("Analito_1", "Analito_2"...) podem ser utilizadas como citações desse objeto. Qualquer alteração de alguma propriedade como a cor, por exemplo, feita em uma instância é aplicada em todas as instâncias do símbolo correspondente. Se isso não for o desejado, uma instância pode ser transformada em um novo símbolo e as próximas alterações serão aplicadas somente a ela. Como cada analito possui um número diferente (geralmente de "1" a "5") que o acompanha durante a corrida, o conjunto "Analito_1" e o numeral "1" é transformado em um novo símbolo. Camadas Uma característica importante dos trabalhos realizados em Flash está no agrupamento dos objetos em diferentes camadas sobrepostas, de acordo com suas classes. As camadas, em si, são transparentes e somente os objetos nelas contidos são visíveis. Porém, um objeto contido em camada superior esconde outro objeto de uma camada inferior. Com isso, foram criadas camadas como "Eletrólito", "Gráficos", "Amostra", "Capilar", "Detecção", "Legendas" e "Controle". Dentro destas camadas, foram criadas subcamadas como "Bolhas do eletrólito", "Analito 1", "Eletroferograma", "Lâmpada" e assim por diante. Se, por exemplo, a luz do sistema de detecção está indevidamente passando por trás do capilar, a camada "Luz" precisa ser movida para alguma posição superior à camada "Capilar", fazendo com que a luz seja exibida à frente do capilar. Linha do tempo Cada projeto de animação é organizado em uma escala que representa a dimensão tempo. Cada segundo dessa escala é subdividido em quadros estáticos (frames). Quando a animação é executada, uma linha do tempo (imaginária) percorre pela escala, de forma a exibir cada quadro, na ordem em que foram organizados. Durante a programação da animação, a linha do tempo é visível e manipulável, possibilitando a navegação pelos quadros. A velocidade com a qual os quadros são exibidos um a um é definida pela taxa de quadros por segundo (fps, "frames per second"). Baixos valores dessa taxa (em geral abaixo de 24 fps) fazem com que a animação tenha aspecto lento e trêmulo (dificultando, por exemplo, a visualização do número do analito em movimento), enquanto valores muito altos exigem mais memória de vídeo. No presente trabalho, a taxa de exibição foi ajustada em 30 fps, de forma a suavizar os movimentos, sem comprometer o desempenho do sistema. Assim, para programar o movimento retilíneo de um objeto de um ponto A a um ponto B, levando um segundo (30 quadros), o objeto é inicialmente posicionado no ponto A, no quadro 1. A linha do tempo é levada ao quadro 31 (1 + 30) e o objeto é posicionado em B. Um comando de interpolação deve então ser aplicado (motion tween), de forma que, nos quadros intermediários aos quadros 1 e 31, o objeto é automaticamente recolocado em posições ligeiramente diferentes. Dessa forma, cada analito e eletrólito tem sua movimentação própria. Os pontos A e B estão nas extremidades do capilar e cada componente leva um tempo diferente (mais ou menos quadros) para se mover de um lado a outro. É exatamente essa estratégia que dá impressão do movimento ser mais ou menos rápido. Cenas Além da organização pelas camadas e pela escala de tempo, cada técnica de CE foi disposta em uma cena (como se fossem subprojetos dentro do projeto principal). Quando uma técnica é escolhida pelo usuário, na verdade, um comando é enviado ao programa indicando qual cena específica deve ser carregada. Ao todo, existem quinze cenas. O próprio Menu está contido em uma cena ("Scene 1") e as demais foram destinadas às animações, as quais serão discutidas posteriormente. Comandos e controle Grande parte das tarefas executadas no projeto são por meio da linguagem de programação Actionscript 3.0. Basicamente, um roteiro (script) inicialmente em branco é preenchido com códigos específicos, destinados a funções diversas. Durante a execução, o software faz uma leitura dos códigos inseridos e os executa, conforme foram programados. Como exemplo, para que um determinado quadro não avance, um código "stop();" deve ser inserido no roteiro deste quadro. Com isso nenhum quadro avançará até que outra condição seja atendida ou outro comando seja executado. O mesmo foi feito com os textos do menu, ou seja, cada opção está relacionada com um endereço de cena (para animações) ou de outro quadro da cena do menu (para os submenus). Para que as animações sejam executadas de qualquer computador, mesmo que não esteja instalado o software de desenvolvimento, o projeto final foi compilado em um arquivo de extensão swf. Essa conversão reúne todas as funcionalidades necessárias para ler e executar os comandos inseridos pelos desenvolvedores. A resolução da área de exibição deste projeto foi configurada em 1024 × 768 pixels que corresponde ao formato 4 × 3, o qual permite tirar um bom aproveitamento da área disponível nos retroprojetores comuns (Datashow). ORIENTAÇÃO DAS CENAS Nesta seção será dada alguma orientação sobre o que é exibido em cada técnica de CE. O menu principal, submenus e os créditos contendo as informações sobre os desenvolvedores ocupam cinco quadros estáticos no total. Todas as animações são carregadas a partir destes menus. Formação do fluxo eletrosmótico A primeira opção destina-se a um submenu contendo três animações. A cena "Silanização do capilar" mostra como a superfície de um capilar de sílica fundida (a priori sem nenhum tratamento prévio), que inicialmente apresenta os grupos siloxanos (Si - O - Si) e silanóis (Si - OH), é transformada em uma superfície negativamente carregada, contendo os silanatos (Si - O-).1 Com a passagem de solução de NaOH 1,0 mol L-1 por pressurização (flush), íons OH- removem íons H+ dos silanóis e rompem ligações dos siloxanos. Como a concentração do íon Na+ é grande e à medida que a superfície se torna mais negativa, esses cátions podem ser atraídos para a sílica. Com a passagem de água (ou solução de HCl 0,1 mol L-1) é possível removê-los, deixando a interface capilar/solução efetivamente negativa. O próximo passo é a passagem do eletrólito para o condicionamento (que é tratado com mais detalhes na próxima cena). A segunda cena, "Fluxo eletrosmótico normal", mostra o condicionamento do capilar e o movimento do eletrólito nas proximidades da sua superfície. Enquanto é feita a passagem de eletrólito, o plano interno de Helmholtz (IHP, "inner Helmholtz plane") é formado pela primeira camada de cátions (desidratados).1,7 Moléculas de água também podem ser atraídas. Nessa animação, que foi feita em duas dimensões, pode ser vista apenas a dimensão longitudinal (na horizontal) do IHP. Num capilar "real", o IHP é, na verdade uma superfície cilíndrica, já que o capilar é cilíndrico. Como a quantidade de cátions do IHP não é suficiente para neutralizar a carga negativa da parede, mais cátions (agora hidratados) são atraídos, formando o plano externo de Helmholtz (OHP, "outer Helmholtz plane"). A região entre IHP e OHP é definida como camada compacta, com alta concentração de cátions. Essa concentração diminui à medida que os cátions estão mais afastados da parede, até um ponto onde não há influência da superfície. O gradiente de concentração formado é a camada difusa. A próxima etapa desta cena consiste na aplicação de um campo elétrico longitudinal ao capilar. As setas azuis representam a força exercida sobre os cátions em função do campo elétrico gerado pela superfície negativa do capilar (presente desde o início) e as setas vermelhas indicam a força em função do campo elétrico (presente após aplicação de tensão nas extremidades do capilar). A região entre as partes móvel e imóvel da camada difusa é definida como plano de cisalhamento.1,2 Finalmente é mostrado o EOF numa região mais afastada da parede do capilar. A terceira cena, "Fluxo eletrosmótico invertido", mostra o condicionamento e o movimento invertido do eletrólito, útil para análise de ânions.8 O condicionamento é feito com um eletrólito contendo tensoativo catiônico, que é atraído à superfície e organizado de maneira a formar uma camada positivamente carregada. Esta camada atrai ânions solvatados do eletrólito (contra-íons do tensoativo) de maneira similar ao modo explicado anteriormente. Como, neste caso, são os ânions os responsáveis pela movimentação da solução, a polaridade da tensão aplicada deve ser invertida, para que o FEO seja em direção à detecção (para a direita, "Saída"). Eletroforese capilar de zona Quatro cenas foram destinadas a representar a CZE. Na "Análise de cátions - Fluxo normal" é possível visualizar o diagrama padrão da CE, contendo o capilar preenchido com um eletrólito, a zona de amostra já inserida, o sistema de detecção por arranjo de diodos (DAD), uma janela para o espectro UV-visível e outra janela para o eletroferograma. À medida que a tensão é aplicada, é possível observar o EOF por meio do movimento das bolhas claras. Aqui é importante destacar que estas bolhas estão presentes apenas para evidenciar o movimento do eletrólito. Numa corrida real, bolhas de gases são totalmente indesejáveis. A velocidade do EOF (veo) pode ser obtida pela Equação 1:1,2,7 onde Lef é a distância do capilar entre a entrada do capilar e a janela de detecção e teo é o tempo que o fluxo leva para percorrer esta distância. A velocidade observada dos analitos (ou velocidade total, vtot) pode ser obtida pela Equação 2: onde vep é a velocidade do analito, tendo como referencial o eletrólito. Na prática, vep é calculado pela Equação 2, fazendo-se vtot = Lef / tm, sendo tm o tempo de migração do analito. Uma forma comum de abordar o movimento do eletrólito e dos analitos é a partir do conceito de mobilidade (µ), no qual a velocidade é dividida pela magnitude do campo elétrico (E) estabelecido ao longo do capilar: na qual o índice i se refere ao eletrólito ou aos analitos. A mobilidade do eletrólito (mobilidade eletrosmótica, µeo) pode ser relacionada com a permitividade da solução (εr), a permitividade do vácuo (ε0), o potencial eletrocinético (ou potencial zeta, ζ) e a viscosidade da solução (η), conforme a Equação 4: Já a mobilidade do analito (mobilidade eletroforética, µep) depende do número de cargas elementares na sua forma iônica (z), da carga elementar (e), de η e do raio esférico (r) (Equação 5). Assim, é comum afirmar que os analitos são separados em função das diferenças entre suas mobilidades.9 Como os analitos dessa cena não absorvem radiação UV (por isso, representados em branco semitransparente), estes não são detectados diretamente. Portanto, é necessário que o eletrólito contenha um agente cromóforo (representado pela coloração azul escuro), capaz de absorver a radiação no decorrer da análise. O espectro UV do cromóforo é, então, continuamente observado e um determinado comprimento de onda (preferencialmente onde haja alta absorbância) é monitorado com o tempo, gerando o eletroferograma. Quando os analitos que não absorvem passam pelo detector, há um aumento da passagem da radiação (representado pelo feixe de luz que se torna branco). Esta queda de absorbância é evidenciada no eletroferograma pela formação dos picos negativos. Este é o modo denominado "detecção indireta", podendo ser encontrado em trabalhos recentes.10-13 A cena "Exemplo (K+, Ba2+, Ca2+, Na+, Mg2+)" mostra uma aplicação deste modo de análise, na qual é possível observar a separação destes analitos. Esse exemplo foi baseado em trabalho reportado na literatura.10 A cena "Análise de ânions, contrafluxo" mostra o modo de CZE, no qual são analisados analitos aniônicos com massa molar e absortividade molar consideradas.12-14 O EOF é normal com tensão positiva no lado da injeção. Como os analitos possuem cargas negativas, eles tendem a migrar para o polo positivo. Entretanto, se |µeo| > |µep|, como é o caso, o EOF consegue arrastá-los para o sentido da detecção. É possível notar que o eletrólito é mais claro que o anterior, por não possuir cromóforos. Quando as moléculas absorventes da amostra passam pelo detector, essas são indicadas com seus respectivos espectros no UV-vis, gerando picos positivos no eletroferograma. Já a cena "Análise de ânions, Fluxo invertido" ilustra o modo que é normalmente feito para este tipo de amostra.11,15 É possível observar que o EOF não é necessariamente elevado, pois o sentido de µeo e µep é o mesmo. Assim, |vtot| > |veo|. Cromatografia eletrocinética A primeira cena relacionada à MEKC, a "Partição do analito entre fase aquosa e micela", mostra a interação analito/micela. A ideia é mostrar que o composto neutro polar "A" tem mais afinidade pela fase aquosa e, portanto, passa mais tempo em contato com ela, enquanto o composto apolar "E" passa mais tempo no interior da micela. Posteriormente, os compostos de A a E, com polaridade decrescente, são comparados sob este aspecto. A cena seguinte, "Partição entre fases em movimento", mostra como o movimento lento da fase micelar e o movimento rápido da fase aquosa interferem no movimento dos compostos de A a E. O composto A, mais polar, migrará mais rapidamente com a fase aquosa e assim por diante. Na cena "Cromatografia Eletrocinética Micelar", compostos neutros são separados em razão das diferenças de partição entre fase micelar e fase aquosa.2,3 O composto "1" é altamente polar e, portanto, migra levando o mesmo tempo que a fase aquosa (teo). Já o composto "5", por ser altamente apolar, migra com a mesma velocidade das micelas (indicada por tmc). Os compostos de "2" a "4" possuem comportamentos intermediários. No cromatograma gerado, a região entre teo e tmc é denominada janela de tempo de migração16 ou intervalo útil de separação3 e os picos dos compostos neutros ficam necessariamente neste intervalo. Eletrocromatografia capilar A cena relativa à CEC mostra a separação de substâncias neutras ao longo de uma fase estacionária monolítica (FEM) contida entre a entrada e o meio do capilar (representada pelas manchas escuras).17‑19 As FEM são altamente porosas, permitindo a passagem da fase móvel (geralmente solução aquosa de eletrólito mais solvente orgânico), além de possuírem grande área superficial, garantindo sua interação diferenciada com os analitos. No caso de os analitos possuírem carga (não mostrado), a migração será resultado da combinação de mecanismos cromatográficos e eletroforéticos.20 O composto "1" não interage com a FEM e, portanto, migra praticamente com o EOF. Já o composto "5" possui grande afinidade pela FEM, ficando mais tempo retido nela. É possível notar que, após a passagem pela FEM, a vtot de todos os analitos (já separados) é igual à veo, uma vez que vep para compostos neutros é nula. Isso pode ser confirmado atribuindo-se z = 0 na Equação 5, que resulta em µi = 0 na Equação 3 e, finalmente vep = 0 na Equação 2. Focalização isoelétrica capilar A cena sobre a CIEF é mostrada em três etapas. A primeira etapa é a introdução de uma mistura da amostra de compostos anfotéricos com uma solução de anfólitos com diferentes pontos isoelétricos (pI). Diferentemente das demais técnicas, aqui um grande volume de amostra é introduzido. A segunda etapa é a focalização, que consiste na aplicação de tensão, sendo que o reservatório de entrada contém uma solução ácida e o de saída contém uma solução básica. Inicialmente, o pH da mistura dentro do capilar é único. Anfólitos e analitos com baixos pI (negativamente carregados) irão migrar em direção ao anodo sob ação do campo elétrico e os compostos com altos pI migrarão no sentido oposto.21 Este movimento cria um gradiente de pH ao longo do capilar. Quando um componente alcança uma região cujo pH é igual ao seu pI, este adquire carga nula e, portanto, não migra mais. Essa focalização dos analitos em função de seus pI é tão eficiente quanto o número de anfólitos presentes.3 Estando os compostos anfotéricos focalizados separadamente, a próxima etapa é a detecção. É feita uma mobilização (a apresentada na animação é do tipo catódica, mas pode ser anódica ou por pressão), na qual o reservatório de solução básica é substituído por mistura de solução básica mais um sal inerte. Quando a diferença de potencial é aplicada, os ânions desse reservatório (OH- e Cl-, por exemplo) tendem a migrar para dentro do capilar. Esta competição para a entrada de ânions não ocorre do lado oposto, de forma que grande quantidade de íons H+ (do reservatório de solução ácida) entra no capilar. O pH no interior do capilar é reduzido e os compostos separados adquirem carga e migram, em direção à detecção.22 Isotacoforese capilar Na cena sobre CITP é apresentado um modo de eletromigração onde o eletrólito no reservatório de entrada (terminador) é diferente do de saída (líder). O capilar é previamente preenchido com o eletrólito líder e, então, uma quantidade de amostra (de cátions ou ânions) é injetada. Durante a corrida, a zona de amostra permanece entre os eletrólitos líder e terminador. Para a análise de cátions, o eletrólito líder deve conter um cátion de alta mobilidade (maior que as mobilidades dos cátions analitos) e o eletrólito terminador deve conter um cátion de baixa mobilidade. Dessa forma, os analitos possuirão mobilidades intermediárias às dos eletrólitos. Para a análise de ânions, o mesmo critério de mobilidade deve ser adotado. À medida que o campo elétrico é aplicado, os analitos se focalizam em regiões distintas e adjacentes, migrando com a mesma velocidade isotacoforética, em um só conjunto.3,23-25 Os isotacoferogramas se diferem bastante dos eletroferogramas. Em CITP, a largura da banda de um analito diz respeito à sua concentração na amostra. No caso da detecção por UV-vis (em azul), só é possível identificar a passagem de analitos adjacentes se eles tiverem absortividades molares distintas no comprimento de onda selecionado. Caso contrário, eles são representados por uma única banda. Para isso, pode ser utilizado um composto espaçador, que possua mobilidade intermediária e baixa absortividade molar (como o composto "2", por exemplo). Já na detecção condutométrica (em vermelho), o sinal inicial, durante a passagem do eletrólito líder, é alto, devido a sua alta condutividade. Quando os analitos passam pela detecção, o sinal diminui formando degraus. A largura do degrau também indica a quantidade do analito sob a detecção.3,23 Eletroforese capilar em gel Por fim, a cena relativa à CGE mostra a separação de macromoléculas iônicas em um sistema de peneiramento.2,3 Moléculas com maiores razões massa/carga têm mais dificuldade de atravessar a rede polimérica de um gel inserido no capilar, migrando, portanto, com velocidades menores. Os géis são substâncias porosas cujas estruturas poliméricas são interligadas química ou mecanicamente. As distâncias ente as ligações definem a porosidade dos géis. Poliacrilamida, polietilenoglicol, dextran, dentre outros podem ser usados como matriz de peneiramento, com ampla aplicação na separação de proteínas em variadas amostras.26 CONCLUSÃO Neste trabalho foram mostradas informações importantes para o desenvolvimento de um pacote de animações de simples acesso e de fácil utilização, que ilustra as técnicas de eletromigração em capilares, a formação do fluxo eletrosmótico e a partição de compostos neutros em meios micelares. Tais animações foram utilizadas em aulas de graduação, pós-graduação e seminários de grupo, facilitando o processo de ensino-aprendizagem de forma eficiente. É conclusivo, portanto, que a abordagem das técnicas por meio de animações atendeu satisfatoriamente aos objetivos descritos nesse trabalho, podendo complementar o entendimento inicial desta elegante técnica de separação tanto para alunos quanto para professores e pesquisadores em geral. CRÉDITOS Recomenda-se que as atividades realizadas com as animações sejam creditadas aos desenvolvedores, autores deste trabalho, cujos endereços eletrônicos, grupo de pesquisa e instituições de trabalho estão disponíveis na última opção do menu principal. A utilização das animações deve ser apenas de caráter didático, não sendo autorizada para fins comerciais. MATERIAL SUPLEMENTAR O endereço onde é possível abrir o conjunto das animações produzidas neste trabalho, bem como um material com instruções e recomendações para sua utilização está disponível em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre. AGRADECIMENTOS Os autores agradecem à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES - PNPD 23038.007000/2011-70), ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq: 475055/2011-0 e 301689/2011-3) e Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG: CEX-APQ 02420/11 CEX-PPM 00205/11) pelo suporte financeiro. REFERÊNCIAS 1. Tavares, M. F. M.; Quim. Nova 1996, 19, 173. 2. Silva, J. A. F. da; Coltro, W. K. T.; Carrilho, E.; Tavares, M. F. M.; Quim. Nova 2007, 30, 740. DOI: http://dx.doi.org/10.1590/S0100-40422007000100025 3. Tavares, M. F. M.; Quim. Nova 1997, 20, 493. DOI: http://dx.doi.org/10.1590/S0100-40421997000500010 4. Wätzig, H.; Kaupp, S.; Graf, M.; Trends Anal. Chem. 2003, 22, 588. DOI: http://dx.doi.org/10.1016/S0165-9936(03)01102-6 5. Righetti, P. G.; J. Chromatogr. A 2005, 1079, 24. DOI: http://dx.doi.org/10.1016/j.chroma.2005.01.018 PMID: 16038288 6. http://www.adobe.com/br/products/flash.html, acessada em Setembro 2014. 7. Landers, J. P. Em Handbook of Capillary and Microchip Electrophoresis and Associated Microtechniques; Landers, J. P., ed.; 3rd ed.; CRC Press: New York, 2008; cap. 1. 8. Colombara, R.; Tavares, M. F. M.; Massaro, S.; Quim. Nova 1997, 20, 512. DOI: http://dx.doi.org/10.1590/S0100-40421997000500011 9. Jager, A. V; Tavares, M. F. M.; Quim. Nova 2001, 24, 363. DOI: http://dx.doi.org/10.1590/S0100-40422001000300013 10. Piovezan, M.; Costa, A. C. O.; Jager, A. V.; Oliveira, M. A. L.; Micke, G. A.; Anal. Chim. Acta 2010, 673, 200. DOI: http://dx.doi.org/10.1016/j.aca.2010.05.031 PMID: 20599036 11. Vaz, F. A. S.; Silva, P. A.; Passos, L. P.; Heller, M.; Micke, G. A.; Costa, A. C. O.; Oliveira, M. A. L.; Phytochem. Anal. 2012, 23, 569. DOI: http://dx.doi.org/10.1002/pca.2355 PMID: 22407535 12. Sato, R. T.; Castro, R. de J. C.; Barra, P. M. de C.; Oliveira, M. A. L.; Phytochem. Anal. 2014, 25, 241. DOI: http://dx.doi.org/10.1002/pca.2499 PMID: 24453169 13. Fernandes, V. N. O.; Fernandes, L. B.; Vasconcellos, J. P.; Jager, A. V.; Tonin, F. G.; Oliveira, M. A. L.; Anal. Methods 2013, 5, 1524. DOI: http://dx.doi.org/10.1039/c3ay26187e 14. Dutra, L. S.; Leite, M. N.; Brandao, M. A. F.; Almeida, P. A.; Vaz, F. A. S.; Oliveira, M. A. L.; Phytochem. Anal. 2013, 24, 513. DOI: http://dx.doi.org/10.1002/pca.2425 PMID: 23508832 15. Oliveira, M. A. L.; Soares, D. do C.; Tostes, G. S.; Guimaraes, M. do C.; Vaz, F. A. S.; Am. J. Anal. Chem. 2012, 3, 484. DOI: http://dx.doi.org/10.4236/ajac.2012.37064 16. Hiroyuki, N.; Terabe, S.; J. Chromatogr. A 1996, 735, 3. DOI: http://dx.doi.org/10.1016/0021-9673(95)01381-4 17. Vaz, F. A. S.; Moutinho, A. D.; Mendonça, J. P. R. F.; Araújo, R. T.; Ribeiro, S. J. L.; Polachini, F. C.; Messaddeq, Y.; Oliveira, M. A. L.; Microchem. J. 2012, 100, 21. DOI: http://dx.doi.org/10.1016/j.microc.2011.08.003 18. Vaz, F. A. S.; Castro, P. M.; Molina, C.; Ribeiro, S. J. L.; Polachini, F. C.; Messaddeq, Y.; Nunes, A. P.; Oliveira, M. A. L.; Talanta 2008, 76, 226. DOI: http://dx.doi.org/10.1016/j.talanta.2008.02.007 PMID: 18585266 19. Oliveira, M. A. L.; Vaz, F. A. S.; Ribeiro, S. P.; Marques, R. Em Química Supramolecular e Nanotecnologia; Alves, W. A., ed.; 1st ed., LTC: Sao Paulo, 2014; cap. 27. 20. Pyell, U.; J. Chromatogr. A 2000, 892, 257. DOI: http://dx.doi.org/10.1016/S0021-9673(99)01295-9 PMID: 11045492 21. Koshel, B. M.; Wirth, M. J.; Proteomics 2012, 12, 2918. DOI: http://dx.doi.org/10.1002/pmic.201200213 PMID: 22930445 22. Silvertand, L. H. H.; Toraño, J. S.; van Bennekom, W. P.; de Jong, G. J.; J. Chromatogr. A 2008, 1204, 157. DOI: http://dx.doi.org/10.1016/j.chroma.2008.05.057 PMID: 18565533 23. Krivánková, L.; Bocek, P.; J. Chromatogr. B 1997, 689, 13. DOI: http://dx.doi.org/10.1016/S0378-4347(96)00339-8 24. Blatny, P.; Kvasnicka, F.; J. Chromatogr. A 1999, 834, 419. DOI: http://dx.doi.org/10.1016/S0021-9673(98)00905-4 PMID: 10189697 25. Malá, Z.; Gebauer, P.; Boček, P.; Electrophoresis 2013, 34, 19. DOI: http://dx.doi.org/10.1002/elps.201200323 PMID: 23161365 26. Zhu, Z.; Lu, J. J.; Liu, S.; Anal. Chim. Acta 2012, 709, 21. DOI: http://dx.doi.org/10.1016/j.aca.2011.10.022 PMID: 22122927 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access