Artigo
|
|
| Constituintes químicos e atividade fitotóxica das folhas de Annona nutans Chemical constituents and phytotoxic activity of leaves of Annona nutans |
|
Nathália Lucca SilvaI; Nathalia Novak ZobioleII; Denise Brentan da SilvaIII; Angela Lucia Bagnatori SartoriIV; Rodrigo Juliano OliveiraII; Maria Eduarda Amaral PintoI; Flávio José Leite dos SantosI; Joao Máximo de SiqueiraI,*
IUniversidade Federal de São João Del-Rei, Campus Centro-Oeste Dona Lindu, 35501-296 Divinópolis - MG, Brasil Recebido em 23/09/2014 *e-mail: jmaximo@ufsj.edu.br The phytochemical investigation and evaluation of the phytotoxic effect of the extract and fractions obtained from the leaves of Annona nutans (R. E. Fr.) R. E. Fr. were performed. Phytotoxic activity was assessed on radicle and hypocotyl of Allium cepa and Lactuca sativa, where chloroform and ethyl acetate fractions proved active. Phytochemical investigation of the chloroform fraction was allowed identification of polyketides derivatives: triacontanal, 16-hentriacontane, octacosanol and triacontanol, using the 1H NMR technique associated with data from GC/MS. Using ethyl acetate fraction, with low activity, flavonoids 3-O-β-D-galactopyranosyl-isorhamnetin, 3-O-β-D-galactopyranosyl-quercetin and 3-O-β-D-apiofuranosyl-(1→2)-galactopyranosyl-quercetin were identified, determined by spectrometric techniques one and two-dimensional NMR, combined with mass spectral data. All substances are being reported for the first time in Annona nutans. The phytotoxic activity of chloroform fraction may be related to the presence of triacontanol and similar substances. Triacontanol stimulates growth at very low concentrations, but can have an inhibitory effect at higher concentrations, such as those reported for auxin analogs. The toxicity assay using Artemia salina (BST) was also performed, with the chloroform fraction showing a negligible lethal dose, LD50 = 500 mg mL-1, while the other fractions and extracts showed no activity. Thus, the presence of acetogenins was ruled out. INTRODUÇÃO Annona está entre os 27 gêneros da família Annonaceae e é um dos mais importantes quando se considera o número de espécies. Este gênero está representado, até o momento, por 120 espécies, sendo 110 delas nativas da região tropical das Américas e outras 10 nativas da África tropical.1 Annona nutans é classificada também como A. spinescens var. nutans e seu habitat natural é preferencialmente terrenos arenosos à margem dos rios. É um arbusto pequeno e há registro de nomes populares de origem guarani, Araticû-Mi e Araticû-Ñu, entretanto ela possui nomes populares comuns às demais espécies do mesmo gênero. A espécie vegetal é característica do cerrado brasileiro, sendo encontrada nos estados de Mato Grosso, Mato Grosso do Sul e Minas Gerais.2 A. nutans (syn. A. spinencis var. nutans) não deve ser confundida com a A. spinescens, cujo estudo fitoquímico e algumas avaliações biológica e farmacológica são encontrados mais extensivamente na literatura.3 As contribuições fornecidas para o conhecimento químico de A. nutans são escassas, somente dois artigos descrevem o isolamento de acetogeninas, as cohibinas C e D, das cascas da raiz de um exemplar coletado no Paraguai.4 Dando continuidade ao estudo das espécies da família Annonaceae,5 o presente trabalho constitui uma investigação fitoquímica de folhas de A. nutans. Neste artigo registra-se o resultado obtido do estudo fitoquímico das frações clorofórmica (FCHCl3) e em acetato de etila (FAcOEt) obtidas a partir do extrato hidrometanólico das folhas de A. nutans, descrevendo a identificação de policetídeos na fração clorofórmica e o isolamento e a identificação de flavonoides na fração AcOEt. Algumas espécies da família Annonaceae6 apresentam o comportamento de espécies infestantes ou invasoras,5 não somente adaptando-se facilmente aos distúrbios antropogênicos,5,7 como podem também dificultar a germinação de outras espécies por meio do fenômeno de alelopatia.5 As espécies A. glabra,6 A. crassiflora6 e Duguetia furfuracea5 demonstraram efeitos alelopáticos em ensaios da atividade fitotóxica. Geralmente, os ensaios de atividade fitotóxica de extratos e substâncias isoladas têm sido a ferramenta mais usual para condução e avaliação alelopática em laboratórios, podendo fornecer novos protótipos com possível atividade herbicida.6 Assim, o objetivo do presente trabalho foi avaliar a atividade fitotóxica de extratos de A. nutans frente às sementes de monocotiledôneas (cebola) e dicotiledôneas (alface), visando a obtenção e a identificação de substâncias potencialmente herbicidas.
PARTE EXPERIMENTAL Procedimentos experimentais gerais Os espectros de RMN 1H e 13C, uni (1D) e bidimensionais (2D), foram obtidos em espectrômetros Bruker, modelo Avance DPX-300, DRX-400 e DRX-500, operando na frequência de 300, 400 e 500 MHz para 1H, e de 75, 100 e 125 MHz para 13C, respectivamente. Para a obtenção dos espectros foram utilizados os solventes deuterados DMSO-d6 e D2O. Os espectros de massas foram obtidos por Espectrômetro de Massas Bruker Daltonics (modelo ULTROTOFQ - ESI-TOF), nas seguintes condições: voltagem do capilar 4000 V, nitrogênio como gás nebulizador, temperatura do gás 160 ºC, fluxo de 4 L/h. As análises por CG/EM das frações selecionadas da FCHCl3 foram realizadas em um equipamento de cromatografia gasosa Shimadzu QP 2010, acoplada a espectrômetro de massas (CG/EM), sistema operando com ionização por elétrons (70 eV), equipado com injetor automático AOC-20i. A coluna utilizada na análise foi DB-5MS (30 m x 0,25 mm x 0,25 µm) da Shimadzu. O gás de arraste utilizado foi o He, com fluxo de 1,6 mL min-1, temperatura inicial da coluna de 100 ºC, temperatura do injetor de 260 ºC, modo de injeção split (1/10) e volume injetado de 1 µL. O aquecimento com programação de temperatura foi de 100-300 ºC a 3 ºC/min e 300 ºC por 10 min. Os compostos foram identificados por comparação com os dados disponíveis na biblioteca de padrões Wiley. As porcentagens relativas das substâncias identificadas pela biblioteca foram obtidas a partir dessa única injeção. Na cromatografia de adsorção em coluna (CC) foi utilizado gel de sílica 230-400 mesh, 60 Å, Mecherey-Nagel. Para a eluição das amostras foram usados os seguintes solventes de qualidade P.A.: hexano, CHCl3, AcOEt e MeOH. Para a cromatografia em camada delgada (CCD) utilizou-se gel de sílica 60 G combinada com sílica 60 F254, na proporção 9:1, sobre suporte de vidro, utilizando CHCl3 e MeOH (7:3) como fase móvel. As revelações das substâncias foram realizadas pela aspersão em solução de NP/PEG (2-aminoetil difenilborinato/Polietilenoglicol) seguido de luz UV 365 nm. Na avaliação da FAcOEt em CCD foram utilizados como padrões rutina e quercetina (SIGMA).8 Material vegetal Annona nutans foi coletada em abril de 2011, em Porto Murtinho - MS, Brasil, e identificada pelo Prof. R. Mello Silva. A exsicata de número 27648 encontra-se depositada no Herbário CGMS. Extração e isolamento Folhas secas e pulverizadas de A. nutans (283 g) foram submetidas à extração por percolação com 6 litros de uma mistura de MeOH:água (9:1). O extrato resultante foi concentrado sob vácuo até à secura, obtendo-se 66 g de extrato hidrometanólico (EHMB). Sendo que 63 g de EHMB foram novamente solubilizados em MeOH:água (9:1) e submetidos a partições sucessivas com solventes de crescentes polaridades e então, foram obtidas as frações hexânica, FHx (5,3 g), clorofórmica, FCHCl3 (1,9 g), acetato de etila, FAcOEt (6,5 g) e a fração hidrometanólica residual, FHMeOH-3, com 36,9 g. O extrato hidrometanólico e suas frações foram avaliadas quanto a atividade fitotóxica (Figura 2).
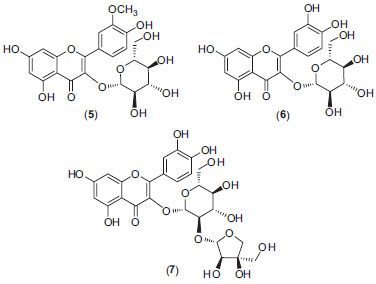 Figura 1. Flavonoides da fração AcOEt (FAcOEt) obtida do extrato hidrometanólico (EHMB) das folhas de Annona nutans
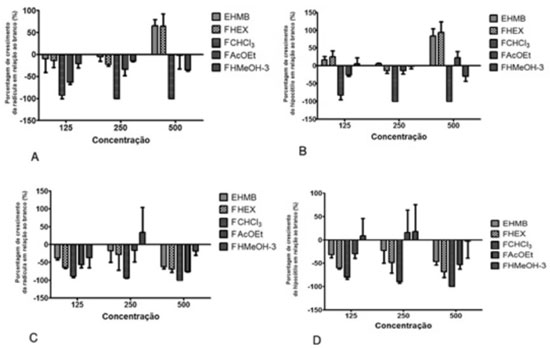 Figura 2. Atividade fitotóxica sobre hipocótilo (A) e rádicula (B) de Lactuca sativa e hipocótilo (C) e radícula de Allium cepa (D) do extrato hidrometanólico (EHMB) e frações hexânica (FHEX), clorofórmica (FCHCl3), AcOEt (FacOEt) e hidrometanólica das das folhas de Annona nutans
A FCHCl3, a qual apresentou atividade fitotóxica, foi submetida ao fracionamento cromatográfico em gel de sílica (150 g). Essa fração (1,0 g) foi então fracionada utilizando-se misturas de hexano, CHCl3 e MeOH em gradiente crescente de polaridade como eluentes. Ao todo, foram coletadas 140 frações de aproximadamente 25 mL cada (Tabela 1S).As frações foram reunidas de acordo com seu perfil cromatográfico e aquelas que apresentavam uma maior massa e uma única mancha em CCD (sílica gel; CHCl3:Hexano 8:2), posteriormente elas foram submetidas as análises por CG/EM, RMN de 1H e de 13C. Foram selecionados 3 grupos, a saber: O G3 (7,8 mg) foi caracterizado como uma mistura, com predominância de triacontanal (1) (64,4%) e a 16-hentriacontanona (2), (20,0%). O G6 foi caracterizado como uma mistura, mas com predominância de triacontanol (79,9%) (3); e o G8, como uma mistura de triacontanol (59,6%) (3) e o octacosanol (33,4%) (4). A identificação foi realizada com base na análise de seus dados espectrais de RMN e CG/EM. A FAcOEt (4,7 g), com baixa atividade fitotóxica, apresentou um perfil compatível com a presença de flavonoides.6 Essa fração foi submetida à cromatografia em coluna (350 g de sílica gel) e eluída em sistema gradiente de eluição, com CHCl3 - MeOH (até 90% de MeOH ), obtendo 77 frações, que foram reunidas em 18 grupos, os quais foram combinados de acordo com seus perfis em CCD (sílica gel; CHCl3:MeOH 7:3, AcOEt:AcOH:H2O 100:11:10; revelador NP/ PEG).8 Destes, do grupo 7 isolou-se a substância 5 (110 mg), 3-O-β-D-galactopiranosil-isoramnetina, do grupo 12 foram isoladas as substâncias 6 (70 mg), 3-O-β-D-galactopiranosil-quercetina e a 7 (28 mg), 3-O-β-D-apiofuranosil-(1→2)-galactopiranosil quercetina. Avaliação da atividade fitotóxica A atividade fitotóxica foi verificada por meio do ensaio biológico que consiste no acompanhamento do crescimento e desenvolvimento de hipocótilo e radícula das plântulas de sementes de alface (Lactuca sativa) e cebola (Allium cepa). Placas de Petri foram previamente submetidas à assepsia com álcool etílico 70%, nas quais foram adicionadas papéis de filtro. Utilizou-se solução tampão MES (ácido 4-morfolinoetanosulfônico - SIGMA) na concentração de 1,95 g L-1,9 com o pH ajustado para 6,0 para os testes. As soluções das amostras teste foram então preparadas nas concentrações de 500, 250 e 125 µg mL-1 solubilizando-as primeiramente em dimetilsulfóxido (DMSO), 0,5% v/v, completando o volume final com a solução tampão MES. Em cada placa de Petri adicionou-se 25 sementes e 5 mL de solução das amostras teste. Foi também preparado o grupo controle nas mesmas condições, mas somente constituído de 25 sementes de cada espécie testada, com DMSO e tampão. As diferentes concentrações utilizadas das amostras, bem como do controle, foram testadas em triplicata.9 As placas foram mantidas em incubadora B.O.D, na ausência de luz, durante 10 dias, com temperatura controlada a 25 ± 1 ºC. Após este período, as placas foram retiradas da incubadora e resfriadas a -10 ºC durante 24 h a fim de impedir a continuação do processo de crescimento das plântulas. A leitura do comprimento do hipocótilo e radícula foi realizada e os efeitos sobre o crescimento foram dados como diferenças na porcentagem em relação ao grupo controle.9 Toxicidade sobre Artemia salina O ensaio de toxicidade sobre a Artemia salina, TAS, foi também desenvolvido de acordo com a metodologia proposta por McLaughlin.10 Análise estatística Os dados foram analisados utilizando ANOVA através do GraphPad Prisma Software version 5.0 (GraphPad Software, Inc., San Diego, CA), com P < 0,05, como nível de significância, quando comparado ao controle.
RESULTADOS E DISCUSSÃO O ensaio de toxicidade sobre Artemia salina, TAS, por ser um bioensaio rápido, de baixo custo e de simples execução, tem sido utilizado para o fracionamento biomonitorado de extratos, frações de espécies vegetais na busca de substâncias ativas.10 Em décadas anteriores, McLaughlin e colaboradores10 descreveram o uso desse bioensaio associado ao fracionamento de extratos de diferentes espécies da família Annonaceae, em especial o gênero Annona. Dentre as substâncias químicas isoladas, destacam-se aquelas denominadas acetogeninas de anonáceas, as quais apresentaram uma maior sensibilidade de detecção frente ao bioensaio, mesmo em baixas concentrações e, por conseguinte, foram as substâncias mais potentes encontradas nessa família. A FCHCl3, que exibiu atividade fitotóxica, apresentou uma dose letal pouco significativa frente a Artemia salina, DL50 = 500 µg mL-1, as demais frações e extratos não apresentaram atividade. Dessa forma, pôde-se descartar a presença de acetogeninas.10 Elucidação estrutural dos constituintes químicos obtidos da FCHCl3 Os dados espectrais das substâncias da fração clorofórmica (FCHCl3) são muito semelhantes entre si. Os constituintes puderam ser identificados por meio de informações obtidas nos espectros de RMN 1H e 13C, sugerindo a proposta inicial de serem derivados de policetídeos de cadeia longa. Os dados de RMN associados aos obtidos por CG/EM e em comparação com os dados da biblioteca auxiliaram na proposta da extensão da cadeia homóloga de CH2. Os dados de RMN 1H e 13C encontrados para essas substâncias FCHCl3 foram compatíveis com aqueles encontrados na literatura. Assim, foram identificados como constituintes majoritários da fração clorofórmica o triacontanal (1) e 16-hentriacontanona (2), em G3 com 19,96% e 68,44% respectivamente; triacontanol (3) (59,63%) e octacosanol (4) (33,40%) em G6. Estes compostos já foram descritos em outras espécies da família Annonaceae como em folhas de A. squamosa.11 Elucidação estrutural dos constituintes químicos obtidos da FAcOEt As substâncias 5, 6 e 7, Figura 1, apresentaram coloração semelhante aos padrões de flavonoides utilizados quando analisadas em cromatografia em camada delgada e reveladas com NP/PEG.8 A possibilidade de 5, 6 e 7 serem derivados de quercetina foi corroborada pelos dados obtidos no UV.12 A partir do espectro de massas de alta resolução de 5, 6 e 7 obteve-se os picos m/z 477,1036 [M- H]-, 463,0874 [M-H]- e 595,1296 [M-H]-, respectivamente. No espectro RMN 1H de 5 foram identificados cinco sinais na região de hidrogênios aromáticos e o padrão de substituição em meta do anel A, bem como as substituições do tipo catecol no anel B, confirmados pelos deslocamentos químicos observados no espectro de RMN 13C dos carbonos C-3' e C-4' (δ 147,6 e 149,9). O mapa de contornos HMBC revelou a correlação entre o singleto em δ 3,82, característico de uma metoxila aromática, com o sinal do C-3' em δ 147,6. Tais dados permitiram estabelecer que a aglicona é a isoramnetina. Foi também observado o sinal condizente com hidrogênio anomérico de piranoses, apresentando J de 7,5 Hz, característico de ligações beta.12,13 A partir dos deslocamentos químicos dos carbonos e hidrogênios, bem como das constantes de acoplamentos entre os hidrogênios, pode-se confirmar que o açúcar trata-se de β-galactopiranose, uma vez que H-4" (δ 3,66, dl) e H-3''(δ 3,42) apresentaram J de 3,3 Hz e 7,0 Hz característicos de acoplamentos equatorial-axial e trans-diaxial, respectivamente, confirmando a configuração axial da hidroxila em C-4".12,13 Portanto, a partir de todos esses dados foi possível confirmar que a substância 5 tratava-se da 3-O-β-D-galactopiranosil-isoramnetina. A substância 6 apresentou-se como um sólido amorfo, de coloração alaranjada, solúvel em CHCl3 e MeOH. Os dados espectrais são bastante semelhantes aos descritos para a substância 5, mas observa-se a ausência do sinal correspondente ao grupamento metoxila presente em 5. Portanto, a partir da análise criteriosa de todos os dados espectrais da substância 6 confirmou-se tratar da 3-O-β-galactopiranosil quercetina. A substância 7 apresentou deslocamentos químicos e valores de acoplamento observados no espectro de RMN 1H são semelhantes à genina de 6, além de serem observados dois sinais com deslocamentos químicos relativos a dois hidrogênios anoméricos em δ 5,47, (d, J = 7,8 Hz), correlacionado com o carbono em δ 99,6 no mapa de contornos HMQC, o que caracteriza um açúcar do tipo piranose, com ligação do tipo β-O-glicosídica. O outro sinal de hidrogênio anomérico é em δ 5,25 (d, J = 1,6 Hz), correlacionado ao carbono em δ 109,3 pelo HMQC e pelo HMBC havia uma correlação com o carbono em δ 75,6 (C-2"). A partir de seus deslocamentos químicos de 13C e 1H, incluindo o padrão de desdobramento dos sinais nos espectros de RMN 1H e de suas constantes de acoplamentos, confirmou-se um açúcar do tipo furanose e uma ligação entre os dois açúcares do tipo β. 12,13 As demais informações contidas nos mapas de contorno COSY, HMQC e HMBC, comparados aos dados da literatura, possibilitaram estabelecer todas as atribuições da substância 7, que trata-se do 3-O-β-D-apiofuranosil-(1→2)-galactopiranosil quercetina.12,13 Há relatos de vários flavonoides isolados na família Annonaceae,11 o flavonoide de A. nutans identificado como 3-O-β-D-galactopiranosil isoramnetina (5) foi identificado anteriormente em Duguetia furfuracea, assim como o 3-O-β-D-galactopiranosil quercetina (6) na A. crassiflora e na A. dioica,11 sendo a substância 7 descrita pela primeira vez família Annonaceae. Esta substância foi encontrada na família Euphorbiaceae, na espécie Croton campestris.12,13 Crescimento de sementes de Lactuca sativa e Allium cepa Ao analisar os percentuais de crescimento de sementes de L. sativa e A. cepa frente ao extrato de A. nutans e das frações obtidas por partição, observou-se uma significativa inibição do crescimento das radículas e hipocótilos frente à FCHCl3 (Figuras 2). Pode-se observar que a FCHCl3 se destacou entre as demais pela seu efeito de inibição em relação a concentração utilizada, inibindo germinação e crescimento de 100% radículas e hipocótilos de L. sativa e A. cepa nas concentrações 500 e 250 µg/mL (p<0,05). As substâncias descritas na FCHCl3 apresentam algumas atividades biológicas como a atividade hepatoprotetora do triacontanal em ratos, a 16-hentriacontanona, também conhecida como palmitona, foi relatada sua atividade antimicrobiana Staphylococcus aureus, S. albus, Streptococcus viridans, Escherichia coli, Pseudomonas pyocyanea, entre outras atividades.11,14 Além disso, o álcool triacontanol apresenta atividade estimulante de crescimento de radículas e hipocótilos de vegetais, indicando ter um efeito sobre a fotossíntese, pois há aumento da massa seca e da área foliar. Essa substância foi utilizadas como estimulante de crescimento de plantas como arroz, tomate, milho, alface, entre outras.15 Com relação ao efeito fitotóxico das substâncias presentes na FAcOEt, pode-se inferir sua atuação na inibição do crescimento de sementes de cebola e alface, uma vez que os flavonoides possuem potencial fitotóxico, como por exemplo o 3-O-α-L-ramnopiranosil-quercetina (quercetrina), quercetina, rutina e apigenina.16 Pode-se observar que a FCHCl3 das folhas de A. nutans foi capaz de inibir de maneira significativa o desenvolvimento de radículas e hipocótilos de sementes de cebola e alface. O efeito fitotóxico pode estar relacionado à concentração das substâncias presentes nesta fração. Alguns compostos podem agir como indutor do crescimento em baixas concentrações, mas em maiores concentrações podem atuar como herbicidas, a exemplo da auxina. O triacontanol, identificado na fração clorofórmica, é reconhecido com um estimulante do crescimento de plantas. A concentração testada do triacontanol como hormônio do crescimento foi em fentomol, ou seja, concentrações de pulverização tão baixas quanto em nanograma por decímetro cúbico.17 A fitotoxicidade da fração clorofórmica pode estar relacionada com a concentração, uma vez que a concentração mínima testada foi de 125 µg mL-1. 17
CONCLUSÃO O estudo fitoquímico do extrato hidrometanólico das folhas de A. nutans conduziu ao isolamento de três derivados de quercetina, da FAcOEt. Estes flavonóides já foram descritos anteriormente na literatura, porém, todos são inéditos na espécie trabalhada e o 3-O-β-D-apiofuranosil-(1→2)-galactopiranosil quercetina (7) está sendo descrito pela primeira vez na família Annonaceae. Da FCHCl3 foram identificados alguns derivados policetídeos, que podem estar relacionados com a atividade fitotóxica detectada nessa fração frente ao modelo de atividade fitotóxica sobre as sementes de L. sativa e A. cepa.
MATERIAL SUPLEMENTAR Os dados espectrais (RMN uni- e bidimensionais, UV, HRMS) das substâncias 5, 6 e 7 encontram-se disponíveis na forma de arquivo PDF em http://quimicanova.sbq.org.br, com acesso livre.
AGRADECIMENTOS Ao prof. Dr. Paulo Robson de Souza (UFMS) por ter cedido a foto da espécie trabalhada. Ao prof. Dr. Norberto Peporine Lopes por ter facilitado as análises espectrais. Os autores J. M. Siqueira e A. L. B. Sartori agradecem ao CNPq pela bolsa de produtividade. Este projeto tem fomento da FAPEMIG (PPM V), CAPES/PNPD/2011 e bolsista do PIBIC/UFSJ/CNPq. Este trabalho tem o Certificado de Registro no Cadastro Nacional de Biodiversidade - 2011-0106526.
REFERÊNCIAS 1. Pinto, A. C. de. Q.; Cordeiro, M. C. R.; de Andrade, S. M. R.; Ferreira, F. R.; Filgueiras, H. A. de C.; Alves. R. E.; Kinpara, D. I. Em Annonas Species; Willians, J. T.; Smith, R. V.; Hughes, A.; Haq, N.; Clement, C. R., eds.; ICUC: Southampton, 2005. 2. Corrêa, M. P.; Dicionario das Plantas Uteis do Brasil e das Exoticas Cultivadas, Imprensa Nacional, Rio de Janeiro, 1926. 3. Queiroz, E. F.; Roblot F.; Fournet, A. C. Q. P.; J. Nat. Prod. 1996, 59, 438; Queiroz, E. F.; Roblot F.; Laprvote, O.; Serani, L.; Cave, A.; J. Nat. Prod. 1997, 60, 760; Queiroz, E. F.; Roblot F.; Figadere, B.; Laurens, A.; Duret, P.; Hocquemiller, R.; Cave, A.; J. Nat. Prod. 1998, 61, 34; Queiroz, E. F.; Roblot F.; Duret, P.; Figadre, B.; Gouyette, A.; Laprvote, O.; Serani, L.; Hocquemiller, R.; J. Med. Chem. 2000, 43, 1604. DOI: http://dx.doi.org/10.1021/np960223w PMID: 8699188 4. Gleye, C.; Raynaud, S.; Fourneau, C.; Laurens, A.; Lapre'vote, O.; Serani, L.; Fournet, A.; Hocquemiller, R.; Roblot, F.; Leboeuf, M.; de Arias, A. R.; Figadère, B.; Cavé, A.; Phytochemistry 1998, 47, 749; Gleye, C.; Raynaud, S.; Fourneau, C.; Laurens, A.; Lapre'vote, O.; Serani, L.; Fournet, A.; Hocquemiller, R.; J. Nat. Prod. 2000, 63, 1192. DOI: http://dx.doi.org/10.1016/S0031-9422(97)00908-4 5. Pereira, N. F. G.; Carollo, C. A.; Garcez, W. S.; de Siqueira, J. M.; Quim. Nova 2003, 26, 512; Carollo, C. A.; de Siqueira, J. M.; Garcez, W. S.; Diniz, R.; Fernandes, N. G.; J. Nat. Prod. 2006, 69, 1222; Yoshida, N. C.; de Siqueira, J. M.; Rodrigues, R. P.; Correia, R. P.; Garcez, W. S.; J. Braz. Chem. Soc. 2013, 24, 529; http://livros01.livrosgratis.com.br/cp002012.pdf, acessada em Novembro 2014. DOI: http://dx.doi.org/10.1590/S0100-40422003000400013 6. Lorenzi, H.; Plantas daninhas do Brasil: terrestres, aquáticas, parasitas e tóxicas, 3º ed., Ed. Plantarum Ltda.: Nova Odessa, 2000; Inoue, M. H.; Santana, D. C.; Souza Filho, A. P. S.; Possamai, A. C. S.; Silva, L. E.; Pereira, M. J. B.; Pereira, K. M.; Planta Daninha 2010, 28, 489; Matsumoto, S.; Varela, R. M.; Palma, M.; Molinillo, J. M. G.; Lima, I. S.; Barroso, C. G.; Macías, F. A.; Ultrason. Sonochem. 2014, 21, 1578. 7. Grassi, R. F.; Resende, U. M.; Silva, W.; Macedo, M. L. R.; Butera, A. P.; Tulli, E. O.; Saffran, F. P.; de Siqueira, J. M; Quim. Nova 2005, 28, 199. DOI: http://dx.doi.org/10.1590/S0100-40422005000200006 8. Wagner, H.; Bladt, S.; Plant Drug Analysis: A Thin Layer Chromatography Atlas, 2nd ed., Springer: Berlin, 2001. 9. Macias, F. A.; Simonet, A. M.; Esteban, M. D.; Phytochemistry 1994, 36, 1369; Macias, F. A.; Castellano, D.; Molinillo, J. M. G.; J. Agric. Food Chem. 2000, 48, 2512. DOI: http://dx.doi.org/10.1016/S0031-9422(00)89726-5 10. McLaughlin, J. L. Em Methods in Plant Biochemistry, Hostettmann, K., ed.; Academic Press: London, 1991, cap. 6; McLaughlin, J. L.; Rogers, L. L.; Anderson, J. E.; Drug Inf. J. 1998, 32, 513; McLaughlin, J. L.; J. Nat. Prod. 2008, 71, 1311. 11. González-Trujano, M. E.; Navarrete, A.; Reyes, B.; Cedillo-Portugal, E.; Hong, E.; Planta Med. 2001, 67, 136; Lorenz, P.; Berger, M.; Bertrams, J.; Wende, K.; Wenzel, K.; Lindequist, U.; Meyer, U.; Stintizing, F. C.; Anal. Bioanal. Chem. 2008, 391, 633; Spectral Database for Organic Compounds SDBS, http://sdbs.riodb.aist.go.jp, acessada em Março 2013; Shankaram, A. V. B.; Murthy, M. M.; Akkewar, D. M.; Subramanyam, M.; Rao, A. N.; US pat. 6,991,818 B2; Pandey, N.; Barve, D.; Int. J. Res. Pharm. Biomed. Sci. 2011, 2, 1404. DOI: http://dx.doi.org/10.1055/s-2001-11504 PMID: 11301859 12. Markham, K. R.; Techniques of flavonoid identification, 1st ed., Academic Press: London, 1982; Andersen, Φ. M.; Markham, K. R.; Flavonoids : chemistry, biochemistry, and applications, 1st ed., CRC Press; London, 2006; Agrawal, P. K.; Phytochemistry 1992, 31, 10; Sakakibara, H.; Honda, Y.; Nakagawa, S.; Ashida, H.; Kanazawa, K.; J. Agric. Food Chem. 2003, 51, 571; Harborne, J. B.; The Flavonoids - Advances in Research since 1986, 1st ed., Chapman & Hall/CRC Press: London, 1993; dos Santos, P. M. L.; Schripsema, J.; Kuster, R. M.; Rev. Bras. Farmacogn. 2005, 15, 321. 13. Santos, D. Y. A. C.; Salatino, M. L. F.; Phytochemistry 2000, 55, 567; Leboeuf, M.; Cave, A.; Bhaumik, P. K.; Mcikherjee, B.; Murkher, R.; Phytochemistry 1982, 21, 2783; Formagio, A. S. N.; Kassuya, C. A. L.; Neto, F. F.; Volobuff, C. R. F.; Iriguchi, E. K. K.; Vieira, N. C.; Foglio, M. A.; BMC Complementary Altern. Med. 2013, 13, 14. DOI: http://dx.doi.org/10.1016/S0031-9422(00)00227-2 PMID: 11130666 14. Syamasundar, K. V.; Singh, B.; Thakur, R. S.; Husain, A.; Kiso, Y.; Hikino, H.; J. Ethnopharmacol. 1985, 14, 41; Sharma, R. K.; Bioorg. Chem. 1993, 21, 49; Carballo, A. I.; Martínez, A. L.; González-Trujano, M. E.; Pellicer, F.; Ventura-Martínez, R.; Díaz-Reval, M. I.; López-Muñoz, F. J.; Pharmacol., Biochem. Behav. 2010, 95, 6. DOI: http://dx.doi.org/10.1016/0378-8741(85)90026-1 PMID: 4087921 15. Castro, P. R. C.; Henrique, A. A.; Fumis, T. F.; Babboni Junior, A. C.; Minarelli, A. M.; Stasi, L. C. D.; Rodrigues, J. D.; An. Esc. Super. Agric. Luiz de Queiroz, Piracicaba, Brasil, 1987; Chen, X.; Yuan, H.; Chen, R.; Zhu, L.; Du, B.; Weng, Q.; He, G.; Plant Cell Physiol. 2002, 43, 869; Ries, S. K.; Wert, V.; Sweeley, C. C.; Leavitt, R. A.; Science 1977, 195, 1339. 16. Tonelli, M. F. P.; de Siqueira, J. M.; Maia, G. A. S.; Soares, L. F.; da Silva, D. B.; Carollo, C. A.; Sartori, A. L. B; Allelopathy J. 2014, 33, 277; Basile, A.; Sorbo, S.; Giordano, S; Ricciardi, L.; Ferrara, S.; Montesano, D; Cobianchi, R. C.; Vuotto, M. L.; Ferrara, L; Fitoterapia 2000, 71 (S110-S116), 110; Saldanha, L. L.; Dissertaçao de Mestrado, UNESP, Brasil, 2013. 17. Schuster, M. Z.; Szymczak, L. S.; Lustosa, S. B. C.; Ramalho, K. R. O.; Applied Research & Agrotechnology 2011, 4, 122 Laughlin, R. G.; Munyon, R. L.; Ries, S. K.; Wert, V. F.; Science 1983, 219, 1219. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





