Nota Técnica
|
|
| Determinação espectrofotométrica de metildopa em ensaio de dissolução de comprimidos utilizando extrato de rabanete como fonte de peroxidase Spectrophotometric determination of methyldopa in a dissolution test of tablets using an extract of radish as a source of peroxidase |
|
Natielle Gianine Bueno; Airton Vicente Pereira*
Departamento de Ciências Farmacêuticas, Universidade Estadual de Ponta Grossa, 84030-900 Ponta Grossa - PR, Brasil Recebido em 05/03/2015 *e-mail: airtonvp@uepg.br An enzymatic spectrophotometric method for the determination of methyldopa in a dissolution test of tablets was developed using peroxidase from radish (Raphanus sativus). The enzyme was extracted from radish roots using a phosphate buffer of pH 6.5 and partially purified through centrifugation. The supernatant was used as a source of peroxidase. The methyldopachrome resulting from the oxidation of methyldopa catalyzed by peroxidase was monitored at 480 nm. The enzymatic activity was stable for a period of at least 25 days when the extract was stored at 4 or -20 ºC. The method was validated according to RDC 899 and ICH guidelines. The calibration graph was linear in the range 200-800 µg mL-1, with a correlation coefficient of 0.9992. The limits of detection and quantification in the dissolution medium were 36 and 120 µg mL-1, respectively. Recovery was greater than 98.9%. This method can be applied for the determination of methyldopa in dissolution tests of tablets without interference from the excipients. INTRODUÇÃO A metildopa (α-metil-3,4-di-hidroxifenilalanina) é um fármaco anti-hipertensivo que possui um anel catecólico (Figura 1). É amplamente utilizada no controle da hipertensão arterial moderada a grave. Atua como um agonista dos receptores α2-adrenérgicos pré-sinápticos, inibindo a liberação de norepinefrina. Como resultado, ocorre menor ativação do sistema nervoso autônomo simpático, diminuição da resistência vascular periférica e, consequentemente, redução da pressão arterial.1
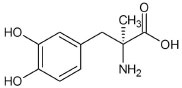 Figura 1. Estrutura química da metildopa
Há diversos métodos espectrofotométricos propostos para o doseamento de metildopa, baseados principalmente em reações de oxidação ou complexação. Vários reagentes cromogênicos já foram propostos para a quantificação da metildopa: cério IV,2 bismuto de sódio,3 ferro III-fenantrolina,4 p-fenilenodiamina,5 molibdato de amônio,6 cloreto de tetrazólio,7 N-bromosuccinamida,8 p-dimetilaminocinamaldeído,9 p-cloranil/peróxido de hidrogênio,10 2,6-dicloroquinona-4-clorimida11 e ácido barbitúrico.12 Na literatura, encontram-se ainda vários outros métodos como cromatografia líquida de alta eficiência,13-15 potenciometria,16-19 titulometria,20,21 fluorimetria,22 e voltametria.23 A Farmacopeia Brasileira 5ª edição24 preconiza o método espectrofotométrico baseado na reação da metildopa com tartarato ferroso em tampão acetato de amônio pH 8,5 e leitura da absorbância em 520 nm. Este método também é proposto pela Farmacopeia Americana25 (USP 29) para a quantificação da metildopa no teste de dissolução de comprimidos. Apesar da simplicidade do método, a desvantagem está na instabilidade da solução de tartarato ferroso que deve ser preparada no momento de uso. O emprego de enzimas em métodos analíticos é uma estratégia tradicional e abrangente, enquanto o uso de extratos vegetais como fonte de enzimas é uma abordagem que combina a seletividade da reação enzimática com a redução do custo do reagente, quando comparado ao emprego de enzimas comerciais.26-28 Essa combinação é vantajosa, ainda que haja uma diminuição da sensibilidade. Extratos vegetais contendo enzimas (polifenol oxidase e peroxidase) foram utilizados como reagentes analíticos na quantificação de fármacos com anel fenólico ou catecólico. Os extratos brutos de batata doce29 e abacate30 contendo a enzima polifenol oxidase são descritos nas determinações espectrofotométricas por injeção em fluxo da metildopa e dopamina. Um biossensor de pasta de carbono contendo o extrato bruto de abobrinha como fonte de enzima peroxidase foi construído para a determinação de paracetamol.31 Diversos vegetais como abobrinha, alcachofra, batata doce, inhame, mandioca, nabo, pêssego e rabanete são ricos em peroxidase.26 Esses vegetais são facilmente encontrados e constituem uma fonte enzimática de baixo custo para o emprego como reagentes analíticos. Polifenol oxidase e peroxidase são enzimas oxidativas que catalisam a oxidação de substratos fenólicos em derivados o-quinonas.26 A oxidação de compostos catecólicos (adrenalina, dopamina, metildopa) pela peroxidase na presença de H2O2 resulta em derivados de cor alaranjada que absorvem em 480 nm.32 Tais compostos possuem apenas pequenas diferenças na cadeia lateral, que não influenciam na oxidação enzimática dos anéis catecólicos; entretanto, não são encontrados em associação em produtos farmacêuticos. Apesar da existência de inúmeros métodos espectrofotométricos para a quantificação de metildopa, não há outros, além dos farmacopeicos, validados para o teste de dissolução de comprimidos. A dissolução é o processo através do qual o fármaco é liberado de formas farmacêuticas sólidas administradas por via oral e se torna disponível para ser absorvido. O ensaio de dissolução in vitro determina o percentual de um fármaco que passa da forma farmacêutica para a forma solúvel no meio de dissolução.33 O resultado é expresso em porcentagem da quantidade declarada no rótulo e, no caso da metildopa, não menos que 80% deve se dissolver em até 20 minutos.24 A quantificação espectrofotométrica da metildopa com emprego da peroxidase em presença de H2O2/tiroxina já foi descrita anteriormente,32 mas com a enzima comercial. No presente trabalho, apresentamos o desenvolvimento e a validação de um método espectrofotométrico simples e de baixo custo utilizando extrato bruto de rabanete como fonte de peroxidase e a aplicação nos ensaios de dissolução e doseamento de metildopa em comprimidos. O método é baseado na oxidação da metildopa catalisada pela peroxidase com a formação de um derivado quinona que absorve em 480 nm.
PARTE EXPERIMENTAL Materiais e equipamentos A metildopa (Sigma-Aldrich) foi utilizada sem purificação adicional. As amostras de comprimidos de metildopa foram adquiridas em Farmácias da cidade de Ponta Grossa-PR, Brasil. A solução de peróxido de hidrogênio 0,1 mol L-1 foi preparada pela diluição de 2,8 mL de uma solução comercial 40 volumes (Biotec), em um balão volumétrico de 100 mL, com água destilada. As demais soluções com concentrações inferiores foram preparadas por diluições da solução 0,1 mol L-1 com água destilada. As soluções de tampão fosfato (pH 6,2 a 6,6) foram preparadas pela mistura de volumes adequados de soluções de fosfato de sódio dibásico 0,2 mol L-1 (3,5624 g de Na2HPO4 dihidratado dissolvidos em 100 mL de água destilada) e fosfato de sódio monobásico 0,2 mol L-1 (6,2532 g de NaH2PO4 dihidratado dissolvidos em 200 mL de água destilada). Os valores de pH foram medidos e ajustados, quando necessário, com uma solução de NaOH ou HCl 1,0 mol L-1, utilizando-se um medidor de pH Digimed DMPH-2 equipado com um eletrodo de vidro combinado com eletrodo de prata-cloreto de prata, calibrado com soluções tampão pH 4,00 e 7,00. A solução de tartarato ferroso foi preparada no momento do uso dissolvendo-se 1 g de sulfato ferroso (Vetec), 2 g de tartarato de sódio e potássio (Synth) e 0,1 g de bissulfito de sódio (Synth) em 100 mL de água destilada. A solução de tampão acetato de amônio pH 8,5 foi preparada dissolvendo-se 50 g de acetato de amônio (Vetec) em 1000 mL de uma solução aquosa de etanol a 20% (v/v). O pH foi ajustado para 8,5 com hidróxido de amônio (Merck) 6 mol L-1. As medidas de absorbância foram realizadas empregando-se um espectrofotômetro de varredura Genesys 10S e uma cubeta de quartzo com caminho óptico de 1 cm. O teste de dissolução foi realizado com um dissolutor Nova Ética modelo 299-6A TTS, utilizando-se o aparato II, temperatura de 37 ± 0,5 ºC e velocidade de rotação de 50 rpm. Obtenção do extrato enzimático Os extratos vegetais contendo peroxidase foram obtidos segundo o método descrito por Fatibello-Filho et al.,26 com modificações. Após lavagem com água corrente, 50 g dos vegetais descascados foram picados e homogeneizados em liquidificador com 100 mL de uma solução de tampão fosfato 0,2 mol L-1 pH 6,5 (previamente refrigerada a 4 ºC) e 5,0 g de polivinilpirrolidona (Polyclar). Em seguida, o homogenato foi filtrado através de algodão e centrifugado por 15 minutos a 15000 rpm. A solução sobrenadante foi armazenada em refrigerador e utilizada no procedimento analítico. Determinação da atividade enzimática A atividade da peroxidase foi determinada medindo-se a variação da absorbância durante a reação de oxidação da metildopa. Em um balão volumétrico de 10,00 mL foram adicionados 1 mL do extrato enzimático, 1 mL da solução de metildopa 500 µg mL-1, 1 mL da solução de H2O2 0,1 mol L-1 e o volume completo com a solução de tampão fosfato 0,2 mol L-1 (pH 6,5). A solução foi incubada a 35 ºC por 15 minutos e a leitura da absorbância foi realizada em 480 nm. Uma unidade de atividade (unidade mL-1) é definida como a quantidade de enzima capaz de produzir um aumento de 0,001 unidades de absorbância por minuto nas condições descritas.28 Validação da metodologia analítica O método foi validado conforme preconizado na Resolução RE nº 899 de 29/5/2003 (Anvisa) e de acordo com as recomendações da ICH (The International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use).34,35 As figuras de mérito avaliadas foram especificidade, linearidade, limites de quantificação (LQ) e detecção (LD), precisão, exatidão e robustez. Especificidade A especificidade do método, definida como a capacidade de um método analítico em medir exatamente um analito na presença de outros componentes da matriz, foi avaliada através de análises comparativas entre as formulações de comprimidos de metildopa e comprimidos placebo. Linearidade A linearidade do método foi determinada através da obtenção de curvas de calibração (n = 3) com concentrações de 200, 400, 500, 600 e 800 µg mL-1. A equação da reta foi determinada através da regressão linear pelo método dos mínimos quadrados. Limites de detecção (LD) e quantificação (LQ) Os valores de LD e LQ foram calculados matematicamente através das curvas de calibração, utilizando os valores de desvio padrão da resposta (σ) e coeficiente angular (s), segundo as Equações 1 e 2:   Precisão A precisão (repetibilidade) foi avaliada através da análise de seis soluções amostra na concentração de 500 µg mL-1 em um mesmo dia e pelo mesmo analista. A precisão intermediária foi determinada pela análise de seis soluções na mesma concentração (500 µg mL-1) em dias e analistas diferentes. Exatidão A exatidão do método foi determinada através do ensaio de adição de soluções padrão de metildopa nas concentrações de 100, 400 e 700 µg mL-1 às soluções amostra (100 µg mL-1), estando as concentrações finais compreendidas na faixa de linearidade. Robustez A robustez do método proposto foi determinada por meio da análise de soluções amostra (400 µg mL-1) em três diferentes valores de pH (6,2, 6,4 e 6,6). Doseamento de metildopa em comprimidos O doseamento foi realizado em quatro amostras comerciais de comprimidos de metildopa de 500 mg, denominadas A, B, C e D. Os comprimidos foram pesados e pulverizados . Em seguida, preparou-se uma solução amostra com concentração teórica de metildopa a 500 µg mL-1. Em um balão volumétrico de 10,00 mL, foram adicionados 1 mL da solução amostra, 2 mL do extrato enzimático, 1 mL de peróxido de hidrogênio 0,06 mol L-1 e o volume completado com tampão fosfato 0,2 mol L-1 pH 6,5. A solução foi mantida em banho de aquecimento a 35 ºC por 15 minutos e, em seguida, a leitura da absorbância foi realizada em 480 nm. Para comparação dos resultados, o doseamento foi realizado pelo método descrito na Farmacopeia Brasileira 5ª edição.24 Ensaio de dissolução de comprimidos de metildopa As amostras A, B, C e D foram submetidas ao ensaio de dissolução conforme descrito na Farmacopeia Brasileira 5ª edição.24 Utilizou-se o sistema com pá rotatória com velocidade de 50 rpm, cubas contendo 900 mL de HCl 0,1 mol L-1, temperatura de 37 ºC e tempo de 20 minutos. Após a dissolução, alíquotas do meio foram coletadas, filtradas e analisadas pelo procedimento proposto, conforme descrito no item anterior. Doseamento da metildopa pelo método farmacopeico Foram pesados e pulverizados 20 comprimidos. Uma quantidade do pó equivalente a 100 mg de metildopa foi transferida para balão volumétrico de 100 mL. Adicionou-se 50 mL de ácido sulfúrico 5 × 10-2 mol L-1 e agitou-se mecanicamente por 15 minutos. O volume foi completado com o mesmo solvente, seguido de homogeneização e filtração. Foram transferidos 5 mL das soluções padrão (metildopa a 1 mg mL-1 em ácido sulfúrico 5 × 10-2 mol L-1) e amostra para balões volumétricos de 100 mL. O branco foi preparado utilizando-se 5 mL da solução de ácido sulfúrico 5 × 10-2 mol L-1. Em cada balão volumétrico, foram adicionados 5 mL de tartarato ferroso e o volume completado com uma solução de tampão acetato de amônio pH 8,5. As absorbâncias das soluções resultantes foram medidas em 520 nm. A quantidade de metildopa foi calculada a partir das leituras obtidas.24
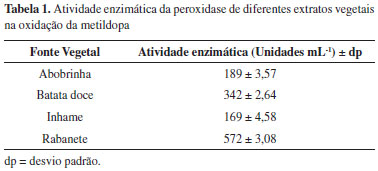
RESULTADOS E DISCUSSÃO Desenvolvimento de método analítico Os resultados de estudos com extratos brutos de vários vegetais contendo peroxidase e diferentes substratos estão descritos na literatura.26 Pode-se observar de tais resultados que a atividade enzimática de um extrato pode variar com a fonte vegetal, a natureza do substrato e as condições experimentais (pH e temperatura) do ensaio. Neste trabalho, uma triagem foi conduzida com quatro vegetais para escolha da fonte de peroxidase (abobrinha, batata doce, inhame e rabanete). A atividade enzimática de cada extrato (Tabela 1) foi avaliada utilizando-se uma solução de metildopa 500 µg mL-1. Uma unidade de atividade (unidade mL-1) é definida como a quantidade de enzima capaz de gerar um aumento de 0,001 unidades de absorbância por minuto. O extrato de rabanete apresentou maior atividade enzimática, expressa pela maior intensidade da absorção do cromóforo formado, e foi escolhido para o desenvolvimento do método analítico.
Adicionalmente, avaliou-se o tempo de prateleira do vegetal escolhido. Não foi observada diferença estatística significativa com o rabanete fresco (dia da colheita) e com uma semana de prateleira, com valores médios de atividade enzimática de 580 e 576 U mL-1, respectivamente. Vieira et al. realizaram um estudo da atividade da enzima peroxidase de extratos brutos de abobrinha, rabanete, batata doce e nabo.31 Os resultados mostraram que a atividade permaneceu praticamente constante por todo o tempo de estudo (80 dias), quando armazenados a 4 ºC. No presente estudo, a atividade da peroxidase do extrato de rabanete foi avaliada por um período de 60 dias. Os resultados mostram que não há diferença entre os valores da atividade enzimática nas temperaturas de armazenamento avaliadas (4 ºC e -20 ºC), conforme ilustrado na Figura 2. Entretanto, após 25 dias observa-se que a atividade enzimática diminuiu gradualmente. Nas etapas de validação e aplicação do método, o extrato vegetal foi utilizado por até 25 dias após o preparo, sem diferença significativa na atividade da peroxidase.
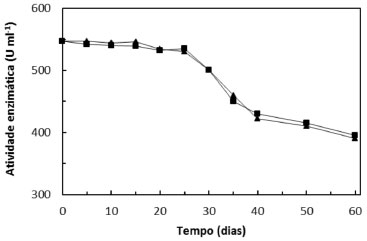 Figura 2. Atividade da peroxidase do extrato de rabanete armazenado a 4 ºC (■) e -20 ºC (▲)
Tem sido evidenciado que a oxidação de compostos fenólicos catalisada pela enzima peroxidase depende da concentração de H2O2, com ocorrência de inativação da enzima na presença de excesso do reagente.36,37 Os estudos dos efeitos da concentração e do volume da solução de H2O2 foram realizados mantendo-se constante o volume da solução do extrato de rabanete (1 mL). Da mesma forma, nas avaliações dos efeitos do volume e da diluição do extrato foram mantidos fixos o volume (1 mL) e a concentração da solução de peróxido de hidrogênio (6,0 × 10-2 mol L-1). Os resultados estão resumidos na Tabela 2. Foram selecionados os parâmetros em que ocorreu a melhor combinação entre a quantidade de peroxidase e a concentração de H2O2, resultando na máxima intensidade de absorção em 480 nm.

A temperatura ideal para o efeito catalítico da peroxidase varia de acordo com a fonte vegetal.38,39 Os estudos dos efeitos do tempo e da temperatura na cinética da reação de oxidação enzimática da metildopa foram realizados em três diferentes temperaturas (30, 35 e 40 ºC) no intervalo de 5 a 30 minutos. Em todos os valores de temperatura testados, observa-se um aumento da absorbância com o tempo de reação até 15 minutos, seguido de estabilização e um ligeiro decréscimo, acima de 25 minutos (Figura 3). A temperatura de 35 ºC e o tempo de 15 minutos foram selecionados para o restante do trabalho por resultarem na maior intensidade de oxidação da metildopa.
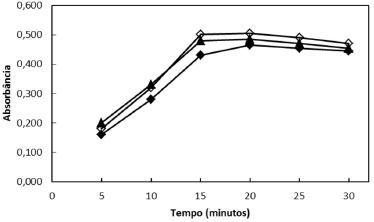 Figura 3. Perfil cinético da reação de oxidação da metildopa com peroxidase em diferentes temperaturas: 30 ºC (■), 35 ºC (◊) e 40 ºC (▲)
Validação do método bioanalítico Especificidade O espectro de absorção na região do visível do produto formado pela oxidação enzimática do núcleo catecólico da metildopa mostra que o comprimento de onda de máxima absorção ocorre em de 480 nm (Figura 4). O teste com uma formulação de comprimidos placebo (amido (100 mg), talco (20 mg), carboximetilcelulose (50 mg), lactose (50 mg), estearato de magnésio (10 mg)) mostrou que não ocorre interferência na determinação do produto de oxidação da metildopa. Na Figura 4, estão os espectros de varredura de amostras de metildopa padrão, metildopa comprimidos e dos excipientes submetidos às mesmas condições experimentais do método enzimático. O branco foi preparado da mesma maneira, exceto pela substituição da solução de metildopa por água destilada.
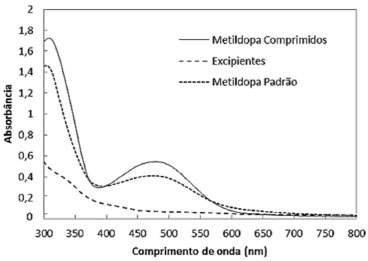 Figura 4. Espectros de absorção da metildopa (padrão 700 µg mL-1), amostra de metildopa comprimidos (450 µg mL-1) e da formulação de comprimidos placebo
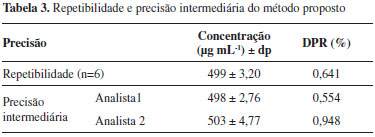
Linearidade A linearidade do método foi avaliada pelo preparo de curvas de calibração em triplicata. O método apresentou linearidade no intervalo de concentração de 200 a 800 µg mL-1 de metildopa. A equação da reta (y = 0,000503x + 0,1772), calculada pelo método dos mínimos quadrados, apresentou um coeficiente de correlação médio (n= 3) de 0,9992. Limite de Detecção (LD) e Limite de Quantificação (LQ) O limite de detecção (LD, menor quantidade da metildopa detectada) e o limite de quantificação (LQ, menor quantidade de metildopa determinada com precisão e exatidão) foram 36 e 120 µg mL-1, respectivamente. Precisão O método apresentou-se preciso nos dois níveis analisados (Tabela 3). No ensaio de repetibilidade, foram analisadas seis amostras com concentração de 500 µg mL-1 e o desvio padrão relativo (DPR) foi de 1,56%. Para precisão intermediária as amostras foram analisadas em dias e por analistas diferentes e os valores de desvio padrão relativo foram inferiores a 5%, valor máximo aceito pela legislação.34
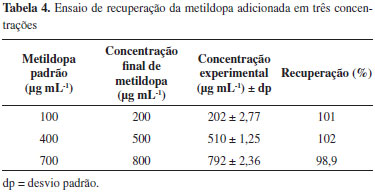
Exatidão A avaliação da exatidão do método foi realizada pelo ensaio de adição de padrão. Os resultados estão apresentados na Tabela 4. Todos os valores estão dentro dos limites estabelecidos pela legislação (± 5% da concentração teórica de metildopa).34,35
Robustez A robustez avalia a confiabilidade do método quando sujeito a pequenas mudanças. O valor de pH ótimo para a máxima atividade da peroxidase de diferentes vegetais26 é 6,5 e foi adotado neste trabalho. No método proposto, avaliou-se a influencia de pequenas variações no pH da reação (6,2 - 6,6). Os resultados estão na Tabela 5 e demonstram que o método é robusto, pois apresentou valor de p maior que 0,05 e F calculado menor que F critico, comprovando assim que não há diferença estatística entre os valores obtidos.

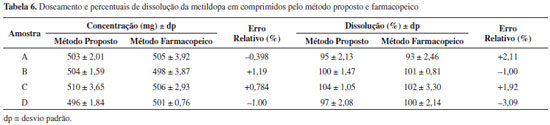
Doseamento e ensaio de dissolução de comprimidos de metildopa Após a validação, o método foi aplicado em ensaios de doseamento e dissolução de quatro amostras (A, B, C e D) de comprimidos de metildopa 500 mg. Ambos os ensaios foram realizados também pelos métodos preconizados pela Farmacopeia Brasileira 5ª edição.24 Os resultados obtidos para os ensaios de doseamento e dissolução estão expressos na Tabela 6. Os resultados da quantificação da metildopa obtidos pelo método analítico proposto mostram baixos valores de erros relativos quando comparados com os valores obtidos com os métodos farmacopeicos.
CONCLUSÃO Este trabalho confirma a potencialidade do uso de extratos vegetais como fonte de enzimas para a quantificação de fármacos. O procedimento de extração da peroxidase do rabanete é muito simples e rápido, exigindo apenas uma etapa de centrifugação antes da utilização como reagente analítico. O método proposto foi validado conforme a RE 899/2003 (ANVISA) e pode ser aplicado nos ensaios de dissolução e doseamento de metildopa em comprimidos.
REFERÊNCIAS 1. Hardman, J. G.; Limbird, L. E. Goodman & Gilman: As bases Farmacológicas da Terapêutica; 12ª ed., McGraw: Rio de Janeiro, 2012. 2. Helaleh, M. I. H.; Rahman, N.; Abu-Nameh, E. S. M.; Anal. Sci. 1997, 13, 1007. DOI: http://dx.doi.org/10.2116/analsci.13.1007 3. Sajjan, A. G.; Melwanki, M. B.; Setharamappa, J.; Egypt. J. Anal. Chem. 2001, 9, 827. DOI: http://dx.doi.org/10.1023/A:1016756212217 4. Afkami, A.; Nouri-Zadeh, A.; Asian J. Chem. 2002, 14, 867. 5. Basyoni, S.; J. Pharm. Belg. 1985, 40, 185. 6. Ribeiro, P. R. S.; Pezza, L.; Pezza, H. R.; Eclet. Quim. 2005, 30, 23. DOI: http://dx.doi.org/10.1590/S0100-46702005000100001 7. Issopoulos, P. B.; Pharm. Weekbl., Sci. Ed. 1989, 11, 213. DOI: http://dx.doi.org/10.1007/BF01959413 8. Nagaraja, P.; Murthy, K. C.; Rangappa, K. S.; Gowda, N. M.; Talanta 1998, 46, 39. DOI: http://dx.doi.org/10.1016/S0039-9140(97)00245-2 PMID: 18967125 9. Walash, M. I.; Abou, O. A.; Salem, F. B.; J. Assoc. Off. Anal. Chem. 1985, 68, 91. PMID: 3980422 10. Gotardo, M. A.; Eclet. Quim. 2008, 33, 7. DOI: http://dx.doi.org/10.1590/S0100-46702008000100001 11. Gadkariem, E. A.; Ibrahim, K. E. E.; Kamil, N. A. A.; Haga, M. E. M.; El-Obeid, H. A.; Saudi Pharm. J. 2009, 17, 289. DOI: http://dx.doi.org/10.1016/j.jsps.2009.10.005 PMID: 23960712 12. Aman, T.; Khan, I. U.; Aslam, N.; Ahmad, I.; Anal. Lett. 1998, 31, 1007. DOI: http://dx.doi.org/10.1080/00032719808002838 13. Ting, S.; J. Assoc. Off. Anal. Chem. 1984, 67, 1118. PMID: 6520085 14. Ting, S.; J. Assoc. Off. Anal. Chem. 1986, 69, 169. PMID: 3081485 15. Zecević, M.; Zivanović, L.; Agatonovic-Kustrin, S.; Minic, D.; J. Pharm. Biomed. Anal. 2001, 24, 1019. DOI: http://dx.doi.org/10.1016/S0731-7085(00)00536-7 PMID: 11248497 16. Athanasiou-Malaki, E. M.; Koupparis, M. A.; Anal. Chim. Acta 1984, 161, 349. DOI: http://dx.doi.org/10.1016/S0003-2670(00)85805-5 17. Beitollahi, H.; Tajik, S.; Asadi, M. H.; Biparva, P.; J. Anal. Sci. Technol. 2014, 5, 29. DOI: http://dx.doi.org/10.1186/s40543-014-0029-y 18. Gholivand, M. B.; Amiri, M.; J. Electroanal. Chem. 2013, 694, 56. DOI: http://dx.doi.org/10.1016/j.jelechem.2013.01.014 19. Salmanipour, A.; Taher, M. A.; Hadi Beitollahi, H.; Anal. Methods 2012, 4, 2982. DOI: http://dx.doi.org/10.1039/c2ay25459j 20. Amin, D.; Analyst 1986, 111, 255. DOI: http://dx.doi.org/10.1039/an9861100255 PMID: 3706765 21. Pathak, V. N.; Shukla, S. R.; Shukla, I. C.; Analyst 1982, 107, 1086. DOI: http://dx.doi.org/10.1039/an9820701086 PMID: 7149267 22. Salem, F. B.; Anal. Lett. 1993, 26, 281. DOI: http://dx.doi.org/10.1080/00032719308017385 23. Rezaei, B.; Askarpour, N.; Ensafi, A. A.; Colloids Surf., B 2013, 109, 253. DOI: http://dx.doi.org/10.1016/j.colsurfb.2013.04.004 24. Farmacopeia Brasileira, 5ª. ed., ANVISA: Brasília, Brasil, 2010. 25. United States Pharmacopoeia, 36th ed., United States Pharmacopoeia Convention: Rockville, 2013. 26. Fatibello-Filho, O.; Vieira, I. C.; Quim. Nova 2002, 25, 455. DOI: http://dx.doi.org/10.1590/S0100-40422002000300019 27. Rosatto, S. S.; Freire, R. S.; Durán, N.; Kubota, L. T.; Quim. Nova 2001, 24, 77. DOI: http://dx.doi.org/10.1590/S0100-40422001000100014 28. Zeraik, A. E.; Souza, F. S.; Fatibello-Filho, O.; Leite, O.; Quim. Nova 2008, 31, 731. DOI: http://dx.doi.org/10.1590/S0100-40422008000400003 29. Vieira, I. C.; Fatibello-Filho, O.; Talanta 1998, 46, 559. DOI: http://dx.doi.org/10.1016/S0039-9140(97)00317-2 30. Lupetti, K. O.; Ramos, L. A.; Fatibello-Filho, O.; Quim. Nova 2003, 26, 197. 31. Vieira, I. C.; Lupetti, K. O.; Fatibello-Filho, O.; Quim. Nova 2003, 26, 39. DOI: http://dx.doi.org/10.1590/S0100-40422003000100009 32. Poliakov, A. E.; Dumshakova, A. V.; Muginova, S. V.; Shekhovtsova, T. N.; Talanta 2011, 84, 710. DOI: http://dx.doi.org/10.1016/j.talanta.2011.01.074 PMID: 21482272 33. Marcolongo, R.; Dissertação de Mestrado, Universidade de São Paulo, Brasil, 2003. 34. Agência Nacional de Vigilância Sanitária - ANVISA; RE nº 899, de 29/5/2003: Guia para validação de métodos analíticos e bioanalíticos, Ministério da Saúde: Brasil 2003. 35. ICH International Conference on Harmonization of Technical Requeriments for registration of Pharmaceutical for Human use; Q 2B- validation of Analytical procedure: methodology, 1996. 36. Tarr, M. A. Chemical Degradation Methods for Wastes and Pollutants; Marcel Dekker: New York, 2003. 37. Baynton, K. J.; Bewtra, J. K.; Biswas, N.; Taylor, K. E; Biochim. Biophys. Acta 1994, 1206, 272. DOI: http://dx.doi.org/10.1016/0167-4838(94)90218-6 PMID: 8003531 38. Fatibello-Filho, O.; Souza, M. G.; Vieira, I. C.; Eclet. Quim. 2002, 27, 51. 39. Bania, I.; Mahanta, R.; International Journal of Scientific and Research Publications 2012, 2, 1. DOI: http://dx.doi.org/10.15373/22778179/OCT2013/45 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access