Artigo
|
|
| Emissões de óxido nitroso e metano do solo em áreas de recuperação de pastagens na amazônia matogrossense Emission of nitrous oxide and methane in soil from pasture recovery areas in the amazon matogrossense |
|
Anna K. da S. NogueiraI,II; Renato de A. R. RodriguesI,V,*, Bruno S. CastroIII, Thiago F. NogueiraIII,IV, Jacqueline J. N. da SilvaI,II, Maurel BehlingI, Mircéia MombachI, Natassia ArmacoloI e Júlia Graziela SilveiraI,II
IEmbrapa Agrossilvipastoril, 78550-970 Sinop - MT, Brasil Recebido em 10/02/2015 *e-mail: renato.rodrigues@embrapa.br This study evaluates the chemical processes responsible for the nitrous oxide (N2O) and methane (CH4) fluxes in the managed pasture (PM) and unmanaged pasture (PNM). In addition, the impact of nitrogen fertilization on the N2O and CH4 fluxes was assessed. The experiments were conducted on three farms in Alta Floresta city in the state of Mato Grosso. Both regular and intensive samples were collected from PM, PNM, and forest areas for each of the properties. The gases were sampled using static chambers in the morning. Higher N2O fluxes were recorded in the PMs, whereas the CH4 fluxes showed no influence of nitrogen fertilization in both regular and intensive samples. Low fertilizer levels resulted in low N2O emissions. INTRODUÇÃO A pecuária brasileira ocupa 25% da área total do Brasil, que corresponde a 220 milhões de hectares, dos quais cerca de 50% encontram-se em processo de degradação e 25% com baixa capacidade de suporte (taxa de lotação menor ou igual a 0,75 UA ha-1 ano-1).1 Alguns fatores levam ao processo de degradação de pastagens, como a quantidade de animais em uma taxa não suportada pela disponibilidade de pastagem e o manejo inadequado destas, associados com outras condições, como a falta de adubações periódicas.2-4 Uma das alternativas para promover melhorias nas condições das forrageiras é a recuperação de pastagens. Essa estratégia visa reestabelecer a produção de forragem mantendo-se a mesma espécie ou cultivar. A recuperação pode ser direta ou indireta, dependendo do grau de degradação em que a pastagem se encontra.5 Na maioria dos casos é necessário o preparo do solo, realizando adubação. Nas regiões tropicais, a baixa disponibilidade de nutrientes no solo é um dos principais fatores que interferem na produtividade e na qualidade da forragem e a aplicação de nutrientes em quantidades e proporções adequadas é uma prática fundamental quando se pretende aumentar a produção de forragem.6 A aplicação de adubos nitrogenados promove melhorias ao desenvolvimento das pastagens, pois o nitrogênio é um dos nutrientes mais importantes para o bom desenvolvimento das gramíneas forrageiras.7 Quando o fertilizante nitrogenado é aplicado ao solo, ocorre a oxidação biológica do amônio (NH4+) a nitrito (NO2-) pelas bactérias do gênero Nitrossomonas e a formação do nitrato (NO3-) pelas bactérias do gênero Nitrobacter, no processo denominado nitrificação.8 O NO3- formado é reduzido aos gases de N (nitrogênio), dentre eles o N2O (óxido nitroso), durante a desnitrificação. Várias bactérias, principalmente heterotróficas, podem realizar esse processo, elas usam NO3- ao invés de O2 (oxigênio) como um receptor terminal de elétrons durante a respiração. Usualmente a desnitrificação começa a ocorrer quando os espaços porosos do solo preenchidos por água (EPPA) estão acima de 60%.9 Em Seropédica-RJ foram avaliados dois tratamentos com e sem a adição de fertilizante nitrogenado, o objetivo foi quantificar as perdas por volatilização de NH3 e emissões de N2O provenientes do preparo do solo em três ciclos de cultivo de capim-elefante no período de 20 meses.10 Concluiu-se que fluxos significativos de N2O aconteceram especialmente após o preparo do solo e aplicação de fertilizantes nitrogenados. Em uma pesquisa realizada no estado do Pará, os fluxos de N2O do solo de pastagens de Brachiaria brizantha na área manejada foi de 2,84 µg N m-2 h -1, enquanto que na área degradada foi de 0,68 µg N m-2 h-1. Os fluxos de uma floresta primária e de outra secundária foram de 27,6 µg N m-2 h-1 e 10,6 µg N m-2 h-1, respectivamente. Constatou-se, ainda, que houve influxo de N2O na estação da seca e produção na estação chuvosa nas áreas de pastagem e nas áreas de floresta, houve produção desse gás durante todo ano, sendo maior na estação chuvosa.11 A produção de metano (CH4) no solo ocorre por meio das bactérias metanogênicas, em condições anaeróbicas, e a oxidação acontece pela ação das bactérias metanotróficas, na presença de oxigênio. Em solos úmidos, a produção de CH4 é afetada pela composição, textura do solo e pelo teor de aceptores inorgânicos de elétrons, sendo que o período entre a inundação do solo e início de metanogênese pode variar de acordo com o tipo de solo.12,13 Em estudo conduzido na Costa Rica, avaliou-se o efeito do manejo de pastagens nos fluxos de CH4 no curto e longo prazo.14 O pasto manejado era constituído por Brachiaria decumbens e foi adubado com NH4NO3 cinco anos antes do estudo. Nesse estudo, os fertilizantes eram aplicados um dia após o gado ter sido retirado do pastejo (a cada 23 dias) e foram aplicados 300 kg N ha-1 ano-1 (dividido em 16 aplicações no ano). O pasto não manejado era constituído de Ischaeum indicum e não recebeu aplicação de fertilizantes. Na estação de seca, os autores notaram que houve emissões de CH4, porém ao longo do ano, o consumo de CH4 foi o processo predominante. A área manejada teve um elevado consumo de CH4, que poderia contrariar os dados da literatura, que afirmam que o NH4 inibe a oxidação desse gás. Contudo, o resultado poderia ser explicado pela elevada produção de matéria seca na pastagem manejada, exigindo grande consumo de água, que provavelmente resultaria na baixa quantidade de espaços porosos preenchidos por água, ao longo do ano. Dessa forma, é necessário avaliar a dimensão do impacto da adubação nitrogenada nas emissões de metano (CH4) e de óxido nitroso (N2O) nas pastagens. Esses gases são importantes para a química da atmosfera e o balanço radiativo da Terra por causa do tempo de vida atmosférico longo de aproximadamente 12,2 e 120 anos, para o CH4 e N2O, respectivamente, e pelo potencial de aquecimento global do CH4 ser cerca de 25 e do N2O de 298 vezes maior que o do CO2.15 No contexto internacional, no âmbito das negociações na Convenção-Quadro das Nações Unidas sobre Mudança do Clima, o governo brasileiro assumiu voluntariamente o compromisso de reduzir as emissões desses gases de efeito estufa durante a 15ª Conferência das Partes. Esses compromissos foram internalizados pela Lei nº 12.187, de 29 de dezembro de 2009, que instituiu a Política Nacional sobre Mudanças do Clima (PNMC), e os artigos 6º, 11º e 12º foram regulamentados pelo Decreto nº 7.390 de 2010. Com esse objetivo o Brasil lançou em 2012 o Plano Setorial de Mitigação e de Adaptação às Mudanças Climáticas para a Consolidação de uma Economia de Baixa Emissão de Carbono na Agricultura (Plano ABC). Dentre os compromissos assumidos está a recuperação de 15 milhões de hectares de pastagens degradadas, por meio de manejo adequado e adubação, visando um potencial de mitigação entre 83 a 104 Mg CO2eq até o ano de 2020.16 Além das emissões diretas mitigadas pelo manejo da pastagem, o uso de áreas atualmente degradadas reduz a pressão sobre novos desmatamentos na Amazônia. Assim, a realização de pesquisas que possam contribuir com a geração de dados de emissões é imprescindível para validar as tecnologias de mitigação de gases. O objetivo deste estudo foi avaliar os processos químicos responsáveis pelos fluxos de N2O e CH4 em pastagens manejadas e determinar o impacto da adubação nitrogenada nos fluxos desses gases.
PARTE EXPERIMENTAL Área de estudo Os experimentos foram conduzidos no âmbito do Projeto Pecuária Integrada de Baixo Carbono, em áreas de produtores rurais situadas no Bioma Amazônia, no município de Alta Floresta, localizado à aproximadamente 800 km de Cuiabá (Figura 1S, material suplementar). O clima da região, de acordo com a classificação de Köppen é do tipo Awi, com nítidas estações de seca (junho a setembro) e de chuva (outubro a maio), com temperatura máxima de 36 ºC, mínima de 20 ºC e precipitação de 2.223 mm.17 As três propriedades rurais avaliadas foram: Fazenda Agropecuária Santa Carmem (FSC), Sítio Santa Luzia (SSL) e Fazenda São Matheus (FSM). Em cada propriedade, os tratamentos foram classificados como: pastagem manejada (PM), pastagem não manejada (PNM) e floresta (F). As áreas com PM foram aquelas que tiveram algum tipo de intervenção, como calagem e/ou adubação a partir de 2012 e as áreas com PNM, aquelas que não tiveram intervenções no período. As áreas de F serviram como tratamento de referência, sendo fragmentos florestais de Floresta Ombrófila Aberta, localizados em cada propriedade rural.18 A FSC possuía uma área de 177,5 ha, destes, 3,6 ha foram destinados à área com pastagem manejada e 25,64 ha para a área com pastagem não manejada. O fragmento de floresta nativa estava localizado à 1.500 m da área experimental. No ano de 1985 houve, na FSC, supressão da floresta nativa para o plantio de Brachiaria brizantha cv. Marandu. Em 1990 houve a reforma da pastagem, com a semeadura de milho e em 1991 ocorreu novamente o plantio de Brachiaria brizantha cv. Marandu, que permaneceu na área de PNM até os dias atuais. Em 2012, na área de PM foram realizadas calagens (1 Mg ha-1 de calcário dolomítico) nos meses de outubro e novembro, adubação e semeadura de Panicum maximum cv. Mombaça em dezembro. Na mesma área, em 2013, foram feitas adubações de cobertura em fevereiro e abril e adubação em dezembro (100 kg ha-1 de ureia; 50 kg ha-1 de cloreto de potássio). No SSL a área com pastagem manejada foi de 0,75 ha e a área com pastagem não manejada foi de 0,975 ha, de uma área total de 29,0 ha. A área de floresta nativa estava a uma distância de 400 m do experimento. Em 1989 houve a abertura de metade da área do sítio e em 1992 da outra metade. Entre 1996 e 1997 ocorreu a semeadura de Brachiaria brizantha cv Marandu, e em 2002 adubações de cobertura com 250 kg ha-1 de NPK (4:30:10) e 100 kg ha-1 de ureia e semeadura de arroz. Em 2003 aconteceu a semeadura de Brachiaria brizantha cv Marandu. No ano de 2012, nas áreas de PM e PNM, foi realizada calagem (1 Mg ha-1 de calcário dolomítico) em outubro e novembro, adubação (100 kg ha-1 de fosfato supertriplo), nivelamento e semeadura de Brachiaria brizantha cv. Mombaça e, no ano seguinte, em fevereiro, março e abril, adubações de cobertura na área de PM (200 kg ha-1 de ureia e 50 kg ha-1 de cloreto de potássio). A FSM contava com uma área total de 348,43 ha, sendo que 4,0 ha foram usados para a área com pastagem manejada e 4,62 ha para a área com pastagem não manejada. A floresta nativa estava localizada a 1.500 m do local de estudo. Em 1986 a floresta nativa foi suprimida para o plantio de cacau e em 1998 foi semeada a Brachiaria brizantha cv Marandu, sendo essa ainda utilizada atualmente na área de PNM. Em 2012, na área de PM, foi feita uma calagem com 4 Mg ha-1 de calcário dolomítico. No ano seguinte houve a semeadura de Panicum maximum cv. Tanzânia, após nivelamento, duas gradagens e adubação de plantio (100 kg ha-1 de superfosfato triplo). Em março de 2014 ocorreu uma adubação (87,5 kg ha-1 de ureia; 37,5 kg ha-1 de KCl). Coleta das amostras A coleta de amostras ocorreu por meio de câmaras estáticas, modelo base-topo (Figura 1). As bases das câmaras com dimensões de 40 cm x 60 cm com 11 cm de altura, feitas de metal, foram instaladas no campo um dia antes do início da primeira coleta e fixadas no solo a uma profundidade de 5 cm, permanecendo no solo durante todo período de estudo.
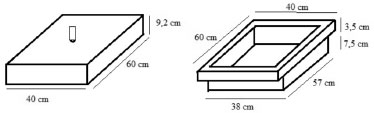 Figura 1. Desenho esquemático da câmara estática modelo topo-base
Os topos foram confeccionados com bandejas de cloreto de polivinil (PVC) de dimensões 9,2 x 40,0 x 60,5 cm, revestidas com manta térmica de dupla face para diminuir a absorção de luz solar.19 Em cada câmara, uma seringa de insulina (1 ml) acoplada a uma válvula de 3 vias na área central da bandeja foi usada para a coleta do ar e foram usados termohigrômetros para aferir as temperaturas interna, externa e a umidade relativa do ar. Para retirar as amostras de gases foram utilizadas seringas de polipropileno de 60 cm3 conectadas a válvulas de 3 vias para sua vedação.20 As coletas ocorreram sempre no período da manhã, entre 8:00 h e 10:00 h, horário representativo dos fluxos médios diários de gases de efeito estufa.21 Imediatamente após o acoplamento da câmara na base metálica foi coletada uma amostra de ar atmosférico e mais três coletas de ar de dentro de cada câmara a cada 20 min, para área de pastagem, até o tempo de 60 min e a cada 15 min para área de floresta nativa, até o tempo de 45 min. Os tempos de coleta estipulados estão de acordo com o protocolo, no qual recomenda-se que a coleta não ultrapasse o tempo de 60 min e que seja coletado o tempo zero e no mínimo mais três tempos, visando aprimorar o cálculo do fluxo pela equação.19 Foram feitas campanhas de coletas simples (CS) e intensivas (CI) baseadas em metodologia adaptada da literatura.22 As CS aconteceram aproximadamente a cada 15 dias, de novembro de 2013 a setembro de 2014. Já as CI foram feitas nos três dias que antecederam, no dia (menos de uma hora após) e no período posterior às adubações nitrogenadas, visando acompanhar os padrões de fluxos de óxido nitroso em decorrência das adubações. Na FSC foi feita uma CI, entre os dias 25/01 e 02/02/2014. No SSL e na FSM foram realizadas duas CI. A primeira, entre os dias 25/01/14 e 03/02/14, e a segunda, do dia 28/04/14 até 07/05/14. As datas de aplicação e as doses de adubo estão indicadas na Tabela 1.
Análises laboratoriais A determinação das concentrações dos gases foi feita no laboratório da Embrapa Agrossilvipastoril, em Cromatógrafo Gasoso (modelo Shimadzu GC-2014) com detectores FID e ECD e injetor automático. Para determinação da curva padrão foram utilizados três padrões de CH4 e N2O (White Martins). Os padrões foram: 1,395; 10,090 e 100,300 micromol/mol, para CH4; e 382,800; 808,000 e 2080,000 nanomol/mol, para N2O. O tempo de corrida das amostras foi de 8 min. Análises dos dados Em cada propriedade rural foram avaliados 3 tratamentos (M, NM e F) com 3 câmaras em cada um deles. Os fluxos médios ponderados de N2O e CH4 das CS entre as áreas M, NM e F em cada uma das três fazendas foram comparados pelo teste t (p<0,05). Os fluxos médios de N2O e os CH4 das áreas de PM e PNM durante os períodos de CI foram comparados pelo erro padrão da média.
RESULTADOS E DISCUSSÃO Fluxos médios de óxido nitroso e metano Na FSC, o fluxo médio do N2O foi maior na área de PM do que na área de PNM (p=0,001), no entanto, o fluxo médio da área de F se sobressaiu em relação às duas áreas (p=0,040; p=0,037). Nas três áreas os valores médios foram maiores no período de chuva (Figura 2A).
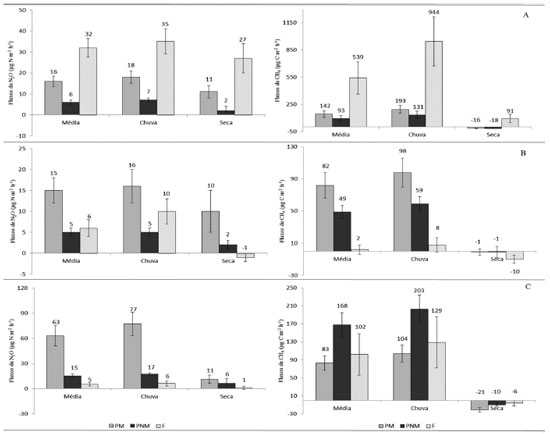 Figura 2. Fluxos médios de todo período de coleta (geral) e nos períodos de chuva e de seca de: A, N2O e CH4 na Fazenda Agropecuária Santa Carmem; B, N2O e CH4 no Sítio Santa Luzia; C, N2O e CH4 na Fazenda São Matheus (o erro padrão de estimativa é representado pelas barras)
Em relação ao CH4, observou-se que os fluxos médios em PM e PNM foram semelhantes (p=0,316), enquanto que o da F foi superior (p=0,011; p=0,009). Na estação chuvosa, os fluxos médios foram maiores nas três áreas, com valores elevados em relação aos verificados em cada área no período de seca. Houve ainda o consumo do gás nas PM e PNM e emissão baixa na área de F na estação de seca (Figura 2A). No SSL houve maior fluxo médio de N2O em PM do que em PNM, sendo que PNM teve fluxo médio semelhante com o de F (p=0,270). Os valores médios dos fluxos revelaram maiores emissões no período da chuva nas três áreas, sendo que em F o valor médio foi negativo, indicando o consumo do gás na estação da seca (Figura 2B). Os fluxos de CH4 foram maiores em PM do que em PNM e F. A sazonalidade também ficou bem evidenciada, com fluxos mais altos durante o período de chuvas nas três áreas, em comparação ao período seco, quando houve o consumo desse gás (Figura 2B). Na FSM foi verificado que o fluxo médio de N2O em PM durante a coleta simples foi maior do que em PNM, com um valor médio de 63 µg N m-2 h-1, o mais alto em comparação com os outros valores verificados. No período chuvoso foi registrado maior valor médio de fluxos nas três áreas (Figura 2C). Ainda na FSM, o fluxo médio de CH4 foi mais alto em PNM e F do que em PM. O efeito da sazonalidade nessa fazenda também se mostrou presente com altos fluxos nas três áreas durante o período chuvoso e consumo do gás no período seco (Figura 2C). O efeito da adubação nitrogenada foi o fator que mais influenciou os fluxos de N2O, justificando os fluxos maiores nas áreas de PM. O mesmo foi verificado por Hyde et al. em estudo realizado na Irlanda, em condições de clima subtropical.23 Esse fato é explicado porque quando a adubação nitrogenada é realizada, há o aumento da disponibilidade de N (nitrogênio) para as bactérias realizarem a desnitrificação.24 Quanto aos fluxos médios do CH4, não foi possível afirmar que a adubação nitrogenada teve relação com os fluxos, pois houve médias da PM maiores que as da PNM em duas propriedades rurais, enquanto em uma (FSM) o resultado foi inverso. O alto fluxo de N2O e CH4 na área de F da FSC pode ter ocorrido pelo fato do solo dessa floresta conter, visivelmente, teores de água elevados. A umidade elevada em conjunto com a alta disponibilidade de matéria orgânica (M.O.) das florestas favorecem o processo de desnitrificação e a metanogênese.25,26 Os dados encontrados nesse estudo, quanto à influência da sazonalidade nas emissões, corroboram com os resultados verificados em um estudo no estado do Pará, em que foi constatado que os solos das áreas de pastagem emitiram mais N2O na estação chuvosa e tiveram grande redução dos fluxos durante a seca.11 Fluxos de N2O podem ocorrer mesmo em solos com baixa disponibilidade de água, pois a desnitrificação acontece também dentro dos agregados do solo, onde existem espaços sem oxigênio.9 Os maiores fluxos médios de CH4 na estação chuvosa justificam-se pela produção desse gás acontecer pela decomposição anaeróbica de matéria orgânica pelas bactérias metanogênicas, dessa forma, a umidade é um dos fatores principais que regula a sua produção27 e em condições aeróbicas, como na estação de seca, o solo pode funcionar como dreno de CH4 atmosférico pela oxidação por bactérias metanotróficas.26 Fluxos médios diários de óxido nitroso e metano durante as coletas intensivas Na coleta intensiva da FSC, antes da adubação nitrogenada, os fluxos de N2O foram semelhantes nas áreas manejada e não manejada. No dia da adubação e nos dois dias posteriores o fluxo na PM foi superior ao da PNM, com um aumento mais evidente no 4º dia após a adubação (DAA) (Figura 3A). O fluxo de CH4 diminuiu após a aplicação do adubo nitrogenado, sendo semelhante nas duas áreas (Figura 4A).
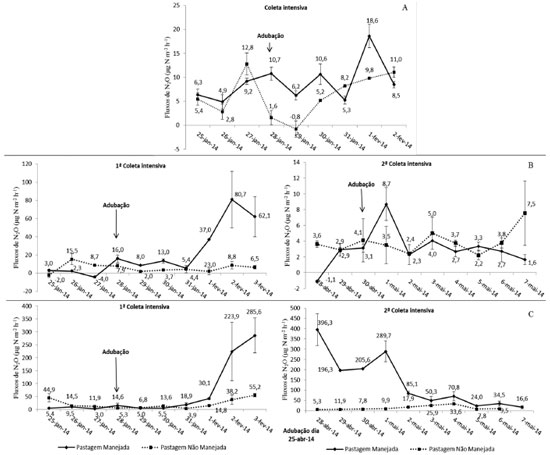 Figura 3. Fluxos médios diários de N2O do período de coleta intensiva (CI) na: A, 1ª CI na Fazenda Agropecuária Santa Carmem; B, 1ª CI e 2ª CI no Sítio Santa Luzia; C, 1ª CI e 2ª CI na Fazenda São Matheus (o erro padrão de estimativa é representado pelas barras)
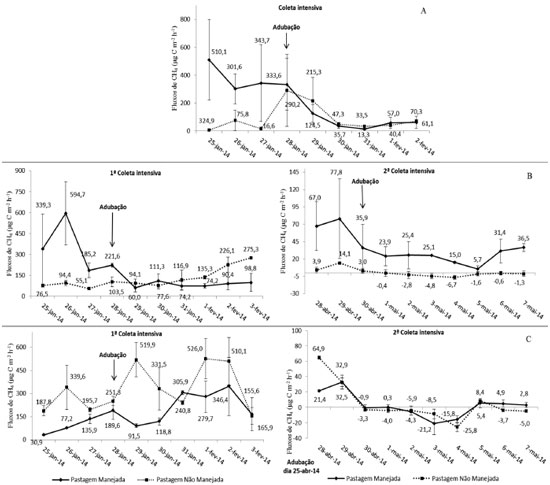 Figura 4. Fluxos médios diários de CH4 do período de coleta intensiva (CI) na: A, 1ª CI na Fazenda Agropecuária Santa Carmem; B, 1ª CI e 2ª CI no Sítio Santa Luzia; C,1ª CI e 2ª CI na Fazenda São Matheus (o erro padrão de estimativa é representado pelas barras)
Na realização da 1ª coleta intensiva do SSL verificou-se que, antes da adubação, os fluxos de N2O foram mais altos em PNM do que em PM. No dia da adubação e em todos os DAA, no entanto, essa tendência foi revertida e as emissões em PM foram até nove vezes mais altas (5º DAA) do que em PNM. Já na 2ª CI na mesma fazenda, os fluxos da PM aumentaram somente no 1º DAA e diminuíram no decorrer dos dias, sendo até mesmo inferiores aos da PNM (Figura 3B). Os fluxos de CH4 na 1ª CI diminuíram nos dias seguintes à adubação, permanecendo assim até o final da coleta, já na 2ª CI os fluxos diminuíram após a adubação e foram, na maior parte do tempo, maiores que o da PNM (Figura 4B). Na FSM, a tendência das emissões de N2O na 1ª CI foi muito semelhante à observada na 1ª CI do SSL. As emissões aumentaram no 3º DAA e se mantiveram crescentes até o final da coleta, com valores muito superiores em PM do que em PNM. Na 2ª CI, devido à adubação ter ocorrido 3 dias antes do início da coleta, os valores dos fluxos estavam elevados já no 1º dia da campanha. Os fluxos se mantiveram elevados até o 4º dia de coleta, diminuindo em seguida até atingir a valores próximos aos da PNM (Figura 3C), evidenciando que o efeito da adubação nitrogenada no aumento dos fluxos ocorre num determinado intervalo de tempo. Na 1ª CI, os fluxos de CH4 diminuíram no 1º DAA e aumentaram a partir do 2º DAA, voltando a diminuir somente no último dia de coleta. Contudo, as emissões da PNM foram superiores à da PM. Já na 2ª CI, os fluxos do 1º e 2º dia de coleta na PM foram superiores aos dos outros dias, sendo que do 3º ao 7º dia houve o consumo do gás no solo e fluxos baixos nos dias posteriores. Esse comportamento também foi observado na área de PNM (Figura 4C). No geral, notou-se que as áreas de PM na CI responderam à adubação com o aumento dos fluxos de N2O após a aplicação do adubo nitrogenado. Solos de pastagens com textura argilosa, com umidade e temperatura altas, aliados à disponibilidade de N emitem maiores quantidades de N2O.12 Apesar disso, a proporção do aumento nos fluxos gerada pela adubação só pode ser explicada em conjunto com outros fatores, tanto é que na FSC e na 2ª CI na FSM as doses de adubo foram semelhantes, porém houve picos de N2O muito superiores na FSM. Dessa forma ficou claro que doses baixas de N resultam em fluxos relativamente menores. A diminuição dos fluxos de CH4 após a aplicação do adubo pode ter ocorrido pelo efeito inibitório na produção do CH4 causado pela disponibilidade de NH3 resultante da adubação nitrogenada.14,28 Nas três fazendas foi observado que os fluxos de N2O cinco DAA ainda permaneciam elevados em relação aos dias anteriores à adubação, o que indica que para esse tipo de estudo seria recomendado um período de observação superior a cinco dias. A recomendação de adubação nitrogenada para pastagens é uma prática indicada no meio agronômico, pois a pastagem é altamente responsiva a aplicação do adubo, aumentando a quantidade de cobertura vegetal e indiretamente proporcionando aumento da matéria orgânica e do estoque de carbono no solo.6,29 No entanto, já existem práticas recomendadas para diminuir as perdas do N em forma de N2O, como a incorporação da ureia em profundidade no solo, misturar ureia e cloreto de potássio na forma líquida e misturar ureia e sulfato de amônio.30 Em conjunto, as boas práticas agrícolas como o manejo do solo, com aplicação de adubos nitrogenados em quantidades adequadas, e o manejo das pastagens contribuem para a redução das emissões de N2O por kg de peso vivo animal.
CONCLUSÃO Os fluxos médios de N2O foram maiores em áreas de pastagem manejada do que nas áreas de pastagem não manejada e os fluxos médios de CH4 não seguiram uma tendência definida. Na estação de chuva, os valores dos fluxos médios de N2O e CH4 foram sempre maiores que os da estação seca. Nesse sentido, uma estratégia de manejo eficaz para a mitigação de óxido nitroso é dividir a aplicação de fertilizante entre o período de chuva e seca e não concentrar essa prática durante o período úmido. A adubação nitrogenada, em geral, proporciona o aumento dos fluxos de N2O e a diminuição dos fluxos de CH4 nos dias seguintes à adubação. A influência da adubação nitrogenada no aumento dos fluxos de N2O ocorre num determinado intervalo de tempo, que pode variar com a quantidade de adubo aplicado e condições ambientais que favoreçam a desnitrificação. Baixas doses de adubo nitrogenado resultam em menores emissões de N2O, podendo ser uma técnica de manejo eficaz. O impacto da adubação nitrogenada nas emissões de N2O em pastagens é negativo no primeiro momento, porém práticas de manejo do solo, da pastagem e a forma de aplicação do adubo podem contribuir para mitigar emissões. A recuperação de pastagens degradadas é a principal tecnologia presente no Plano de Agricultura de Baixo Carbono (Plano ABC) do Governo Federal, com o objetivo de ampliação de área em 15 milhões de hectares até 2020.16 O estado de Mato Grosso, por ter o maior rebanho bovino do país e, em especial, o município de Alta Floresta, que possui o maior rebanho do estado, possuem importante papel para o atingimento dessa meta. O presente trabalho mostra que é possível fazer uma pecuária sustentável, com adequado manejo do solo e das pastagens, aumentando a produtividade das mesmas e mitigando emissões de gases de efeito estufa.
AGRADECIMENTOS Ao Instituto Centro de Vida (ICV), coordenador do projeto Pecuária Integrada de Baixo Carbono, ao Fundo Vale e à Fundação Moore, financiadores do projeto, aos produtores Ailton Piloni (FSC), Francisco Militão Matheus Brito (FSM) e Augusto Witmann (SSL), que disponibilizaram suas propriedades, e aos seus colaboradores, à Embrapa Agrossilvipastoril pela estrutura de disponibilizada para a realização do projeto e a toda equipe que auxiliou nas coletas de campo e análises no laboratório.
REFERÊNCIAS 1. Observatório do Plano ABC. Avaliaçao das emissoes de gases de efeito estufa (GEE) considerando as projeçoes da produçao agrícola brasileira do MAPA e da FIESP até o ano de 2023, Relatório Preliminar, 2014. 2. FAO. The state of food and agriculture. Rome: FAO, 2009. 3. Dias-Filho, M. B.; Degradaçao de pastagens: processos, causas e estratégias de recuperaçao. Ediçao do Autor, Belém, PA, 2011. 4. Dias-Filho, M. B.; Diagnóstico das Pastagens no Brasil. Embrapa Amazônia Oriental: Belém, 2014. 5. Costa, K. A. de P.; de Oliveira, I. P.; Faquin, V.; Adubaçao nitrogenada para pastagens do gênero Brachiaria em solos do Cerrado. Embrapa Arroz e Feijao: Santo Antônio de Goiás, 2006. 6. Fagundes, J. L.; Fonseca, D. M.; Gomide, J. A.; do Nascimento Junior, D.; Vitor, C. M. T.; de Morais, R. V.; Mistura, C.; Reis, G. da C.; Martuscello, J. A.; Pesq. Agropec. Bras. 2005, 40, 397. 7. Werner, J. C.; Adubaçao de pastagens. Instituto de Zootecnia: Nova Odessa, 1986. 49 p. (Boletim Técnico, 18). 8. Marcelino, R; Dissertaçao de Mestrado, Instituto Agronômico, Brasil, 2009. 9. Robertson, G. P.; Groffman, P. M. Em Soil Microbiology, Biochemistry, and Ecology; Paul, E. A., ed.; Springer: New York, 2007, cap. 13. 10. de Morais, R. F.; Boddey, R. M.; Urquiaga, S.; Jantalia, C. P.; Alves, B. J. R.; Soil. Biol. Biochem. 2013, 64, 80. DOI: http://dx.doi.org/10.1016/j.soilbio.2013.04.007 11. Verchot, L. V.; Davidson, E. A.; Cattânio, H.; Ackerman, I. L.; Erickson, H. E.; Keller, M.; Global Biogeochem. Cycles 1999, 13, 31. DOI: http://dx.doi.org/10.1029/1998GB900019 12. Mosier, A.; Wassmann, R.; Verchot, L.; King, J.; Palm, C.; Environment, Development and Sustainability 2004, 6, 11. DOI: http://dx.doi.org/10.1023/B:ENVI.0000003627.43162.ae 13. Escobar, L. F; Dissertaçao de Mestrado, Universidade Federal de Santa Maria, Brasil, 2008. 14. Veldkamp, E.; Weitz, A. M.; Keller, M.; Soil. Biol. Biochem. 2001, 33, 1493. DOI: http://dx.doi.org/10.1016/S0038-0717(01)00060-8 15. IPCC. Contribution of Working Group III to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Metz, B.; Davidson, O. R.; Bosch, P. R.; Dave, R.; Meyer, L. A., eds.; Cambridge University Press: Cambridge, 2007. 16. PLANO ABC (Agricultura de Baixa Emissao de Carbono) . Plano Setorial de Mitigaçao e de Adaptaçao às Mudanças Climáticas para a Consolidaçao de uma Economia de Baixa Emissao de Carbono na Agricultura, Brasília, 2012. 17. Ferreira, J. C. V.; Mato Grosso e seus municípios. Secretaria de Estado da Educaçao: Cuiabá, 2001, 660 p. 18. Projeto RADAMBRASIL; Departamento Nacional da Produçao Mineral. Levantamento de recursos naturais. Folha SC. 21 Juruena; geologia, geomorfologia, pedologia, vegetaçao e uso do potencial da terra. Rio de Janeiro: Gráfica Alvorada Ltda, 1980. 19. Parkin, T. B.; Venterea, R.T. Em Sampling Protocols; Follett, R. F., ed.; USDA-ARS: Washington, 2010, cap. 3. 20. Rodrigues, R. A. R.; Mello, W. Z.; Quim. Nova 2012, 35, 1549. DOI: http://dx.doi.org/10.1590/S0100-40422012000800011 21. Zuchello, F.; Dissertaçao de Mestrado, Universidade Federal Rural do Rio de Janeiro, Brasil, 2010. 22. de Carvalho, A. M.; Bustamane, M. M. C.; Kozovits, A. R.; de Miranda, L. N.; Vivaldi, L. J.; de Sousa, D. M.; Pesq. Agropec. Bras. 2006, 41, 679. DOI: http://dx.doi.org/10.1590/S0100-204X2006000400020 23. Hyde, B. P.; Hawkins, M. J.; Fanning, A. F.; Noonan, D.; Ryan, M.; O'toole, P.; Carton, O. T.; Nutr. Cycling Agroecosyst. 2006, 75, 187. DOI: http://dx.doi.org/10.1007/s10705-006-9026-x 24. Garcia-Montiel, D. C.; Steudler, P. A.; Piccolo, M. C.; Melillo, J.; Neill, C.; Cerri, C. C.; Biogeochemistry 2003, 64, 319. DOI: http://dx.doi.org/10.1023/A:1024968802018 25. de Klein, C. A. M; Van Logtestijn, R. S. P.; Soil. Biol. Biochem. 1996, 28, 231. DOI: http://dx.doi.org/10.1016/0038-0717(95)00131-X 26. Topp, E, Pattey, E.; Can. J. Soil Sci. 1997, 77, 167. DOI: http://dx.doi.org/10.4141/S96-107 27. Mojeremane, W.; International Journal of Forest, Soil and Erosion 2013, 104. 28. Conrad, R. Em Exchange of Trace Gases between Terrestrial Ecosytems and the Atmosphere; Andreae, M. O.; Schimel, D. S, eds.; John Wiley & Sons: Chischester, 1989. 29. BRASIL, Observatório do Plano ABC, Agricultura de Baixa Emissao de Carbono: A evoluçao de um novo paradigma, Sao Paulo, 2013. 30. Yamada, T.; Abdalla, S. R. S.; Informaçoes Agronômicas 2000, 91, 1. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





