Artigo
|
|
| Determinação de metais em água e folha de Aechmea blanchetiana (Baker) L.B Determination of metals in water and leaf of Aechmea blanchetiana (Baker) L.B |
|
Jaline R. RibeiroI; Sergio SiqueiraI; Cleber G. NovaesII,*; Joao H. Santos NetoII
IDepartamento de Ciências Biológicas, Universidade Estadual do Sudoeste da Bahia, 45206-190 Jequié - BA, Brasil Recebido em 13/10/2015 *e-mail: galvaonovaes@yahoo.com.br The aim of this research was to determine the concentrations of calcium, iron, manganese, zinc, potassium and sodium in the water and leaves of Aechmea blanchetiana (Baker) L.B species collected between the cities of Ilhéus and Itacaré, Bahia, Brazil and verify if the metals found in the water can be absorbed by the leaves. Flame atomic absorption spectrometry (F AAS) and flame photometry were used for the determination of metals. pH measurements, dissolved oxygen and water temperature were also made. The results obtained were used in an exploratory analysis. Principal component analysis (PCA) showed clearly the distinct formation of two clusters and the correlation analysis indicated that the leaves of A. blanchetiana seem to absorb iron, calcium, manganese and zinc from the water tank. INTRODUÇAO A Aechmea blanchetiana (Baker) L.B é uma espécie da família Bromeliaceae Juss., um importante táxon vegetal, com 58 gêneros e 3.172 espécies.1 O embricamento das folhas em forma de roseta, em muitas espécies, forma um reservatório (fitotelma) onde se acumula água e nutrientes, por isso essas bromélias sao conhecidas como bromélias-tanque. Este microhabitat é utilizado como abrigo e para reproduçao por diversos organismos, como algas, bactérias, anfíbios, répteis e insetos, sendo inclusive o único ambiente onde algumas espécies podem sobreviver.2 Esses organismos deixam restos de suas atividades metabólicas no reservatório, tornando-o um local rico em nutrientes e um importante microhabitat nos ecossistemas dos quais fazem parte.3 Na família Bromeliaceae a captaçao de nutrientes também ocorre pelos tricomas foliares, especialmente as bromélias epífitas, que utilizam essas estruturas como única forma de obtençao de água e nutrientes.4 Estes tricomas acabam absorvendo também poluentes atmosféricos e, por isso, sao muito úteis para o biomonitoramento de contaminaçao atmosférica.5,6 Essa característica faz com que esses organismos sejam bastante utilizados como uma ferramenta efetiva e de baixo custo para a avaliaçao da deposiçao de elementos traço.7,8 Zampieri et al. avaliaram a absorçao e translocaçao de Ca, Co, Fe, K e Zn em Aechmea blanchetiana com plantas cultivadas in vitro em meios de cultivo contendo diferentes concentraçoes de Zn. A espécie apresentou tolerância a altos níveis do metal, possibilitando a utilizaçao no biomonitoramento de áreas contaminadas por Zn.9 Giampaoli et al. estudaram o crescimento e desenvolvimento de Aechmea blanchetiana com plantas in vitro na presença de Cu e Zn. Acúmulo significante ocorreu para os dois elementos, caracterizando a espécie como capaz de bioacumular esses metais.10 Além de absorver água e nutrientes, alguns autores citam as bromélias como fontes de criadouros de Aedes aegypti.11,12 O uso de organismos vivos na caracterizaçao ambiental tem sido cada vez mais frequente, uma vez que estes auxiliam no mapeamento espacial e temporal da poluiçao atmosférica e das oscilaçoes naturais ocorridas nos ecossistemas.13,14 Isto só é possível porque as espécies evoluíram e se adaptaram dentro de um sistema no qual encontrou condiçoes favoráveis ao seu desenvolvimento.15 Algumas espécies químicas normalmente sao importantes para os processos biológicos, mas o caráter essencial ou toxicológico está relacionado com a concentraçao destas espécies.16 Doses mais altas que a capacidade de assimilaçao dos organismos têm efeito tóxico, assim como níveis abaixo do necessário podem comprometer alguns processos fisiológicos da planta.17 O elemento cobre, por exemplo, se estiver presente em baixas concentraçoes na planta, pode levá-la a apresentar alteraçoes genéticas e morfológicas, já o excesso pode impedir o transporte de elétrons na fotossíntese, inibindo seu crescimento.18 Certos elementos, como o As, Cd e Pb, nao apresentam funçao biológica e merecem atençao pois sao capazes de substituir elementos essenciais em macromoléculas e enzimas, proporcionando alta toxicidade mesmo em concentraçoes pequenas.19,20 O conhecimento da concentraçao de elementos-traço em águas e folhas de bromélias tanque torna-se especialmente importante. Além dessas plantas terem sido apontadas como acumuladoras de poluentes atmosféricos, a água acumulada no reservatório também pode ser contaminada pelo ambiente ao redor, prejudicando as diversas formas de vida que dependem desse microecossistema para realizar suas atividades metabólicas. Desse modo, o objetivo desse estudo foi determinar a concentraçao de metais (Ca, Fe, K, Mn, Na e Zn) em água e folha de Aechmea blanchetiana e, através da correlaçao dos resultados, avaliar o potencial dessa planta para ser utilizada no biomonitoramento de áreas contaminadas por algum desses elementos.
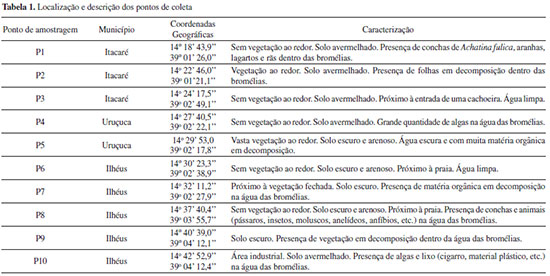
DESCRIÇAO DA AREA DE ESTUDO As coletas das amostras aconteceram na BA 001 entre os municípios de Ilhéus e Itacaré. A regiao pertence ao domínio morfoclimático da Mata Atlântica e caracteriza-se por possuir clima tropical úmido, com pequena ou nenhuma deficiência hídrica mensal, médias pluviométricas de 2000 a 2400 mm anuais e pequenas oscilaçoes de temperatura do ar, entre 20 e 25 °C ao longo do ano.21 As florestas úmidas desta regiao sao caracterizadas por árvores altas, com folhas sempre verdes, abundância de epífitas e conservam ainda uma grande diversidade de espécies da fauna.22 Ilhéus é o maior entre os municípios onde houve a coleta, ocupando uma área de 1.584,693 km2, e o mais antropizado entre os municípios estudados. Sua economia baseia-se na agricultura, sendo o principal produtor de cacau do estado da Bahia; turismo e indústrias, abrigando um polo de informática; sendo também um importante centro regional de serviços.23 Atualmente possui importantes empreendimentos como o Porto Sul, o novo aeroporto internacional, obras da Ferrovia Oeste-Leste (FIOL) e o funcionamento da Zona de Processamento de Exportaçoes (ZPE). Serra Grande localiza-se entre as cidades de Ilhéus e Itacaré, às margens da BA 001, fazendo parte da porçao costeira do Município de Uruçuca. O município possui uma área de 391,975 km2 e se destaca por ser o segundo município da Bahia e o quarto do Brasil em área com remanescente de Mata Atlântica, com 85% de seu território em área de unidades de conservaçao (APA Itacaré Serra Grande, APA Lagoa Encantada e Parque Estadual Serra do Conduru).23 Itacaré ocupa uma área territorial de 726,167 Km2, possui economia agrícola e ganhou destaque no turismo a partir dos anos de 1990, sendo um importante destino de ecoturismo do estado, pois assim como Serra Grande abriga uma diversidade de belezas naturais.24
PARTE EXPERIMENTAL Reagentes e soluçoes Todos os reagentes empregados foram de grau analítico e as soluçoes foram preparadas utilizando água ultrapura (resistividade de 18,2 MΩ cm) obtida de um sistema de purificaçao Milli-Q (Millipore, Bedford, MA, USA). Todas as vidrarias e frascos usados no procedimento de coleta foram previamente descontaminados em banhos contendo HNO3 10% v/v por 24 h e abundantemente enxaguados com água deionizada. Soluçoes de ácido nítrico foram preparadas pela diluiçao de soluçao estoque 65% v/v (Vetec, Rio de Janeiro, Brasil). Soluçoes padroes multielementares para obtençao das curvas analíticas foram preparadas por diluiçao de soluçoes estoque 1000 µg mL-1 (Sigma-Aldrich, St. Louis, USA) de Ca, Fe, Mn, Na, K e Zn. Peróxido de hidrogênio 30% m/v (Vetec) foi utilizado como fonte geradora de oxigênio. Coleta das amostras As coletas de Aechmea blanchetiana foram realizadas em 10 pontos na BA 001 entre os municípios de Ilhéus e Itacaré, Bahia, no mês de junho de 2014. A Figura 1 ilustra um mapa com os pontos de coleta e a Tabela 1 resume algumas características desses pontos. Em cada ponto, constituído por três bromélias diferentes, coletou-se 0,5 L de água do reservatório em cada bromélia utilizando seringa descartável (marca Vonder) e transferidas para frascos de polietileno previamente lavados e identificados. Após a coleta, as amostras de água foram acidificadas com HNO3 e acondicionadas em caixas isotérmicas até sua chegada ao laboratório, onde foram filtradas em papel filtro quantitativo de 0,45 µm de porosidade (marca Quanty) e armazenadas a 4 °C em refrigerador até o momento da análise. Na planta em que foi coletada a água, também coletou-se uma folha da bromélia, com auxílio de tesoura de lâminas de aço inoxidável. Foram escolhidas folhas consideradas sadias, sem a presença de manchas, murchas ou amareladas. As folhas foram retiradas de maneira que nao houvesse prejuízo maior da planta. Posteriormente foram acondicionadas em sacos estéreis e mantidas em caixas isotérmicas até sua chegada ao laboratório. A Figura 2 ilustra um dos pontos de coleta e o reservatório de água de uma bromélia.
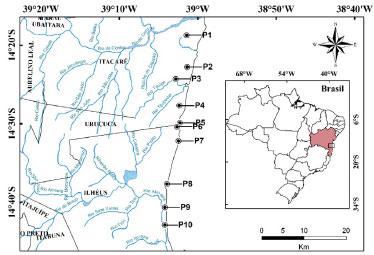 Figura 1. Mapa com a localizaçao dos pontos de amostragem (P1 a P10)
 Figura 2. Ponto de coleta de Aechmea blanchetiana: (A) uma unidade inteira e (B) reservatório de água
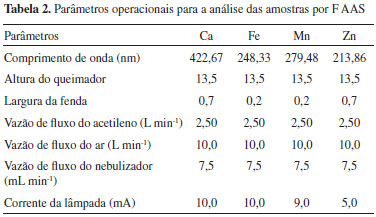
Digestao das amostras As folhas de Aechmea blanchetiana foram cortadas em pedaços pequenos (aproximadamente 1,0 x 1,0 cm), pesadas e secas em estufa a 100 °C por 24 h e, posteriormente, trituradas em um processador de alimentos. O procedimento de trituraçao foi realizado para cada folha separadamente. Após esta etapa, cerca de 200 mg da folha seca foi pesada e, em seguida, transferida para um tubo de digestao. Foram adicionados 3,0 mL de ácido nítrico (HNO3 P.A. 65% v/v) + 2,0 mL de peróxido de hidrogênio (H2O2 P.A. 30% m/v) e levado à digestao em bloco digestor até quase secura, por um período de aproximadamente 1 h, a uma temperatura de 100 ± 5 ºC até digestao completa, quando nao se observou nenhum resíduo. Em seguida, os tubos foram retirados do bloco digestor e resfriados à temperatura ambiente. O digerido foi transferido para balao volumétrico de 10 mL, avolumado com água ultrapura e acondicionado, a 4 ºC, em refrigerador até o momento da análise. Este procedimento foi utilizado seguindo metodologia adaptada da literatura.25,26 Para validar a metodologia empregada foi feita a análise de materiais de referência certificado (agulhas de pinho NIST 1575a e folhas de maça NIST 1515). Aproximadamente 100 mg de material foi pesado e submetido ao mesmo procedimento das amostras e no final avolumadas para balao volumétrico de 25 mL com água ultrapura. Soluçoes preparadas contendo todos os reagentes na ausência da amostra (branco analítico) foram preparadas analogamente, a fim de avaliar a contaminaçao pelos reagentes utilizados. Instrumentaçao A determinaçao de Na e K foi realizada no Fotômetro de Chama, marca Benfer (Sao Paulo, Brasil), modelo BFC-300 e os metais Fe, Ca, Mn e Zn foram determinados por espectrometria de absorçao atômica com chama (F AAS), marca Perkin Elmer (Norwalk, CT, EUA), modelo AAnalyst 200 equipado com lâmpada de deutério como corretor de fundo. Lâmpadas de cátodo oco foram utilizadas como fonte de radiaçao. Na Tabela 2 sao descritas as condiçoes operacionais do espectrômetro de absorçao atômica, sugeridas pelo fabricante. Para as amostras de água as medidas de pH e oxigênio dissolvido (OD) foram realizadas com medidor multiparamétrico, marca Instruterm, modelo pH-1500 e a temperatura da água com termo-higrômetro digital, marca Digimed. Estes parâmetros (pH, OD e temperatura) foram medidos no momento da coleta, com a água ainda no reservatório da bromélia.
Análise estatística Foi utilizada análise de componentes principais (PCA) para avaliar os dados obtidos na análise das amostras. PCA é um método de reconhecimento de padrao nao supervisionado utilizado para reduzir a dimensionalidade de um conjunto de dados.27 Os dados experimentais foram processados usando os programas Microsoft ExcelTM 2003 (The Microsoft, Co, USA) e Statistica (The StatSoft, Inc., Tulsa, OK, USA). Para verificar as correlaçoes entre metais na água e nas folhas, visando determinar possíveis padroes de transferência de metais entre essas duas matrizes, utilizou-se o coeficiente de correlaçao de Pearson, com índice de significância estatística p < 0,05.28 Os testes foram tratados no software estatístico SAS 9.1 (2003).
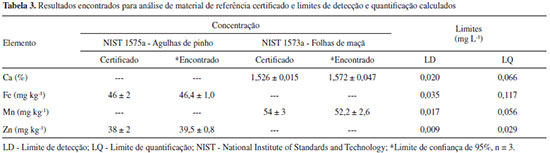
RESULTADOS E DISCUSSAO Foram realizadas curvas analíticas para cada elemento (Ca, Fe, Mn, Zn, Na e K) pela análise de uma série de soluçoes padroes e mostraram-se essencialmente lineares, com coeficiente de determinaçao (R2) maior do que 0,997, valor superior ao mínimo recomendado pelo INMETRO.29 O limite de detecçao (LD) para os elementos determinados por F AAS foi calculado como LD = 3 Sbr / m, onde Sbr é o desvio padrao do valor de 10 medidas do sinal analítico correspondente ao branco e m é a inclinaçao da curva analítica. O limite de quantificaçao (LQ) foi calculado como LQ = 10 Sbr / m. Os valores calculados para Ca, Fe, Mn e Zn estao apresentados na Tabela 3. Os limites de quantificaçao para K e Na (mg L-1), determinados por fotometria de chama foram 0,010 e 0,010, respectivamente.
Análise de material de referência certificado Para avaliar o método empregado na quantificaçao de Ca, Fe, Mn e Zn nas amostras de Aechmea blanchetiana foi feita a análise de dois materiais de referência certificado compatíveis com as amostras analisadas (agulhas de pinho NIST 1575a e folhas de maça NIST 1515) usando como técnica analítica a espectrometria de absorçao atômica com chama. Os valores encontrados na recuperaçao dos analitos e os valores dos materiais certificados nao apresentaram diferença significativa a um nível de confiança de 95%, empregando-se o teste t-Student pareado. Os resultados estao apresentados na Tabela 3. Análise das amostras Os resultados da análise da água e da folha de bromélia (Aechmea blanchetiana), representados como resultado individual, a média entre as medidas e coeficiente de variaçao (CV) estao apresentados nas Tabelas 4 e 5, respectivamente.
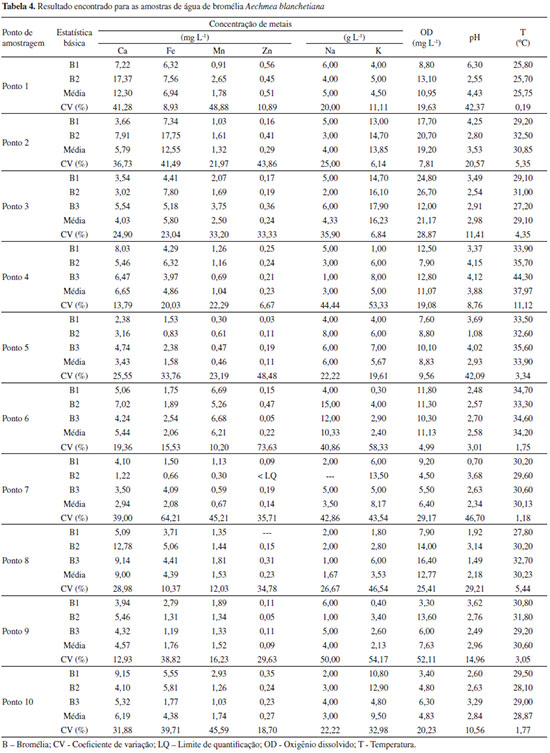
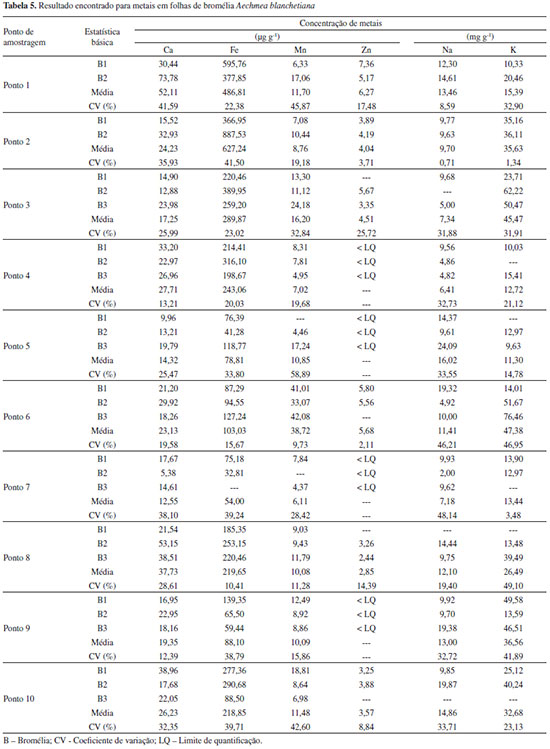
Na análise dos dados da água de bromélia (Tabela 4), a maior concentraçao para o elemento ferro (17,75 mg L-1) foi encontrada em uma das bromélias do ponto P2. Abaixo dessa concentraçao, as duas bromélias analisadas do ponto P1 e a segunda bromélia do ponto P2 apresentaram valores de concentraçao entre 6,32-7,56 mg L-1, resultado que está de acordo com a observaçao feita em relaçao ao solo no momento da coleta, pois a cor vermelha de solos indica forte presença de óxido de ferro. A menor concentraçao foi obtida em uma das bromélias do ponto P7 (0,66 mg L-1). Para o elemento cálcio, uma bromélia do ponto P1 e outra do ponto P8 apresentaram as maiores concentraçoes, 17,37 e 12,72 mg L-1, respectivamente. Foi observado dentro do reservatório dessas duas bromélias, no momento da coleta, presença de conchas de Achatina fulica, que apresentam carbonato de cálcio em sua composiçao. Manganês foi encontrado em maior quantidade nos três reservatórios do ponto P6, com concentraçoes entre 5,26 - 6,69 mg L-1. Tanto Ca quanto Mn foram encontrados em menores concentraçoes em um reservatório do ponto P5 e outro do ponto P7. O elemento zinco esteve presente em maior concentraçao nas duas bromélias do ponto P1 (0,45 e 0,56 mg L-1) e em uma bromélia do ponto P6 (0,47 e mg L-1). As menores concentraçoes foram verificadas em bromélias dos pontos P5, P7 e P9. A baixa concentraçao do zinco é comum e costuma estar abaixo de 10 µg L-1 em águas superficiais naturais.30 Para o sódio, dois reservatórios do ponto P6 apresentaram as maiores concentraçoes (12,0 e 15,0 g L-1). Os demais reservatórios apresentaram concentraçoes mais baixas (menores que 8,0 g L-1) e próximas entre si. O elemento potássio estava presente em maior quantidade nos três reservatórios do ponto P3 (14,70 - 17,90 g L-1) e em menor quantidade em todos os reservatórios dos pontos P6, P8 e P9. Variaçoes nas concentraçoes dos elementos Na e K sao comuns, pois estes estao presentes também por contribuiçao do spray marinho, que pode apresentar influências mais significativas em pontos mais próximos ao mar.31 O ponto P10, apesar de estar localizado em área industrial da cidade de Ilhéus, nao apresentou grandes concentraçoes dos metais avaliados no reservatório de água da bromélia. Em se tratando do pH da água em seus tanques foliares, é comum espécies de bromélias apresentarem valores ácidos de pH devido ao excesso de matéria orgânica morta. A acidez da água pode agir como um fator de aumento de mortalidade para diversos organismos aquáticos zooplanctônicos.32 Dos pontos de amostragem, um reservatório de bromélia do ponto P7 foi o que apresentou pH mais ácido (0,7) e o pH menos ácido (6,30) foi medido em um reservatório do ponto P1. Em relaçao ao oxigênio dissolvido, os reservatórios dos pontos P2 (20,70 mg L-1) e P3 (26,70 mg L-1) apresentaram as maiores concentraçoes. A média dos valores de OD medidos (11,34 mg L-1) entre todos os reservatórios analisados está de acordo a literatura.17,33 Analisando os dados da folha de bromélia (Tabela 5) é possível verificar que o elemento Fe foi encontrado em maior concentraçao em uma bromélia do ponto P1 (595,76 µg g-1) e em outra do ponto P2 (887,53 µg g-1). Concentraçoes baixas foram encontradas em todas as folhas dos pontos P5, P6, P7 e P9 (32,81 - 139,35 µg g-1). Para o cálcio, a folha de uma bromélia do ponto P1 e outra do ponto P8 apresentaram as maiores concentraçoes, 73,78 e 53,15 µg g-1, respectivamente. Assim como no reservatório da bromélia, manganês foi encontrado em maior quantidade nas três folhas de bromélia do ponto P6, com concentraçoes entre 33,07 - 42,08 µg g-1. Tanto Ca quanto Mn foram encontrados em menores concentraçoes em uma folha de bromélia do ponto P7. Para o elemento Zn, a maior concentraçao esteve presente em uma das folhas de bromélia do ponto P1 (7,36 µg g-1). Demais folhas dos pontos P1, P2, P3, P6, P8 e P10 apresentaram concentraçoes próximas, na faixa entre 2,44 - 5,80 µg g-1. O zinco presente nas folhas das bromélias dos pontos P4, P5, P7 e P9 nao puderam ser quantificados porque apresentou concentraçao abaixo do limite de quantificaçao da técnica. Para o elemento K as maiores concentraçoes foram encontradas nas folhas de bromélia dos pontos P3 (62,22 mg g-1) e P6 (76,46 mg g-1) e a menor concentraçao em uma folha de bromélia do ponto P5 (9,63 mg g-1). Avaliando os dados para o elemento sódio, que estao compreendidos na faixa de 2,00 - 24,09 mg g-1, verifica-se que nao há muita diferença entre os resultados. Foi possível constatar que as principais observaçoes elencadas na avaliaçao dos resultados da água de bromélia foram as mesmas para a folha, com exceçao do potássio, que apresentou maiores variaçoes entre os pontos amostrados na análise da folha. Isso demonstra uma alta correlaçao (e positiva) entre os nutrientes presentes na água e na folha da bromélia, especialmente Ca, Fe, Mn e Zn, ou seja, quanto mais esses nutrientes estiverem presentes na água, maiores serao as concentraçoes dos mesmos nas folhas, indicando que a Aechmea blanchetiana das áreas estudadas provavelmente absorve estes nutrientes do tanque através dos tricomas foliares. Para ratificar essa afirmaçao foi feita a análise de correlaçao de Pearson entre as duas matrizes estudadas (água e folha), apresentadas na Tabela 6. O coeficiente de Pearson (r) pode variar de -1 a +1, e quanto mais próximos desses valores mais forte a associaçao das variáveis em estudo. Há significância estatística quando p-valor é menor que o nível de significância adotado, geralmente p < 0,05.28
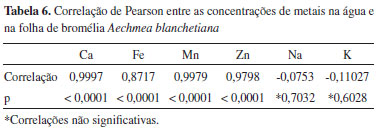
Os elementos Na e K apresentaram correlaçoes nao significativas (0,7032 e 0,6028, respectivamente). Isso pode estar relacionado à forte contribuiçao do spray marinho e à alta demanda destes metais na planta, uma vez que o K é cofator de mais de 40 enzimas e o principal cátion utilizado no estabelecimento da turgidez e manutençao da eletronulidade celular. Além disso, o Na pode substituir o K em algumas funçoes e estes dois nutrientes também estao envolvidos em reaçoes redox.34 Os valores apresentados nas Tabelas 4 e 5 apresentaram alto coeficiente de variaçao (CV), na maioria das análises. Essa dispersao ocorre muitas vezes quando se trata de informaçao atreladas às características biológicas, geralmente com CV na faixa entre 5 e 50%.35 Além disso, bromélias de uma mesma espécie vivendo em ambientes com disponibilidades diferentes de nutrientes e luz podem desenvolver fenótipos distintos.36 Estas características, somadas às condiçoes abióticas (índice de pluviosidade, taxas de evaporaçao, clima e posiçao da planta em relaçao à vegetaçao circundante), interferem na composiçao química da bromélia, o que pode justificar os altos coeficientes de variaçao encontrados. Observaçoes semelhantes foram reportadas por Souza et al.37 em estudo sobre parâmetros limnológicos de água acumulada nas espécies de bromélias Neoregeria cruenta (Graham) e Aechmea nudicaulis (L.) Griseb. Em outro trabalho, Kono e Tomiyasu realizaram o biomonitoramento de níveis de mercúrio com epífitas Lepisorus thunbergianus e encontraram também altos desvios e alto coeficiente de variaçao.38 Análise exploratória Para identificar as relaçoes entre os dados obtidos foi utilizada a análise de componentes principais.39 Este método pode resumir em poucas e importantes dimensoes a maior parte da variabilidade de um grande conjunto de dados.40 Foi construída uma matriz de dados para a água da bromélia (9 variáveis x 10 amostras) e outra para a folha (6 variáveis x 10 amostras). Para a análise da água, o resultado da PCA revelou que as quatro primeiras componentes principais representam 89,96% das informaçoes originais do conjunto de dados. A PC1, caracterizada pelas variáveis Ca, Fe, Zn e pH, representa 35,79% da variância total. A segunda PC (PC2) é representada apenas pelo elemento K, com 22,26%. Os elementos Mn e Na sao explicados pela PC3, com 19,94%. Finalmente, a PC4, com 11,97%, é representada pela variável OD. A Figura 3 apresenta o gráfico de escores para duas componentes principais (PC1 versus PC3), no qual é possível observar um agrupamento correspondente aos pontos P5, P7 e P9, característico pelas baixas concentraçoes dos elementos Ca, Fe, Mn e Zn. O outro grupo é correspondente aos pontos P4, P8 e P10, que apresentam valores intermediários dos parâmetros analisados. A formaçao desses grupos apresenta relaçao com as características dos pontos de amostragem descritas na Tabela 2. Os pontos P1, P2, P3 e P6 aparecem de forma isolada na Figura 3, pois estes apresentam concentraçoes elevadas para um ou mais parâmetros analisados.
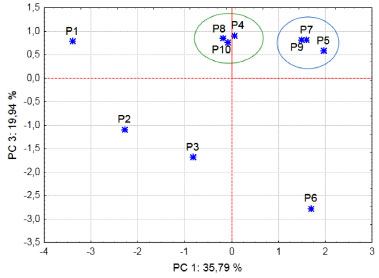 Figura 3. Gráfico de escores para análise da água de bromélia. P1 a P10 - pontos de amostragem; PC - Componente Principal
Para a análise da folha, um modelo contendo 3 PCs foi suficiente para descrever 87,11% do conjunto de dados. Na PC1 apenas o elemento Zn foi representado, com 39,03% da variância total e PC2 representou os elementos Ca, Fe, Mn e K, com 29,24%. A terceira PC tem maior contribuiçao do elemento Na. Esta PC apresenta 18,84% de variância explicada. O gráfico de escores para PC1 versus PC2 está apresentado na Figura 4, em que é possível observar um agrupamento correspondente aos pontos P5, P7 e P9 e outro correspondente aos pontos P8 e P10. Os pontos P1, P2, P3 e P6 também aparecem de forma isolada. Os grupos formados na análise dos dados da folha de bromélia (Figura 4) sao muito similares aos obtidos para água (Figura 3), corroborando com a informaçao de que existe alta correlaçao para os nutrientes Ca, Fe, Mn e Zn entre a água e a folha de bromélia.
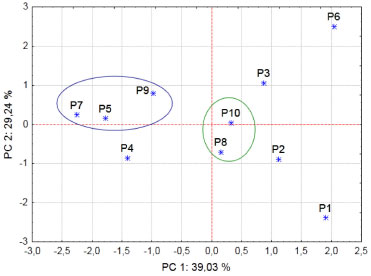 Figura 4. Gráfico de escores para análise da folha de bromélia. P1 a P10 - pontos de amostragem; PC - Componente Principal
CONCLUSAO O método de digestao utilizado mostrou-se eficaz para a decomposiçao das folhas de bromélia e do material de referência certificado. As técnicas utilizadas, espectrometria de absorçao atômica com chama e fotometria de chama, foram efetivas para quantificar os elementos Ca, Fe, K, Mn, Na e Zn em água e folha de bromélia. O uso de análise de componentes principais facilitou a interpretaçao do conjunto de dados, demonstrando claramente os pontos de amostragem que apresentam composiçao química similar, tanto na análise da água quanto da folha de bromélia. Todos os parâmetros avaliados estao associados com o lugar onde a bromélia se encontra e podem sofrer alteraçoes significativas, seja pela presença de luz, corrente de ar, presença de folhas no reservatório, se existem insetos mortos no tanque, etc. Assim, bromélias vizinhas podem apresentar composiçao química bem diferentes. Através dos resultados ficou nítida a alta correlaçao entre os nutrientes Ca, Fe, Mn e Zn presentes nas matrizes estudadas, evidenciando assim que a folha da espécie Aechmea blanchetiana absorve esses nutrientes diretamente do reservatório de água da bromélia. Deste modo, a espécie se afirma como uma planta com potencial para ser utilizada no biomonitoramento de áreas contaminadas por algum desses elementos.
AGRADECIMENTOS Ao Programa de Formaçao de Recursos Humanos da Petrobras - PFRH PB 211. A Coordenaçao de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) e Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). Os autores também expressam seus agradecimentos a M. A. Bezerra (LQA/UESB) pela concessao de instrumentaçao analítica.
REFERENCIAS 1. Luther, H. E.; An alphabetic List of Bromeliad Binomials, 12th ed., Bromeliad Society and Marie Selby Botanical Gardens: Sarasota, 2010. 2. Schuttz, R., Araújo, L. C.; Sá, F. S.; Natureza on line 2012, 10, 89. 3. Araújo, V. A.; Melo, S. K.; Araújo, A. P. A.; Gomes, M. L. M.; Carneiro, M. A. A.; Brazilian Journal of Biology 2007, 67, 611. DOI: http://dx.doi.org/10.1590/S1519-69842007000400004 4. Benz, B. W.; Martin, C. E.; J. Plant Physiol. 2006, 163, 648. DOI: http://dx.doi.org/10.1016/j.jplph.2005.05.008 PMID: 16545998 5. Wannaz, E. D.; Hebe, A. C.; Rodriguez, J. H.; Pignata, M. L.; Ecol. Indic. 2012, 20, 163. DOI: http://dx.doi.org/10.1016/j.ecolind.2012.02.022 6. Elias, C.; Fernandes, E. A. N.; França, E. J.; Bacchi, M. A.; Tagliaferro, F. S.; J. Radioanal. Nucl. Chem. 2008, 278, 435. DOI: http://dx.doi.org/10.1007/s10967-008-0815-3 7. Abril, G. A.; Wannaz, E. D.; Mateos, A. C.; Invernizzi, R.; Plá, R. R.; Pignata, M. L.; Ecol. Indic. 2014, 40, 153. DOI: http://dx.doi.org/10.1016/j.ecolind.2014.01.008 8. Wannaz, E. D.; Abril, G. A.; Rodriguez, J. H.; Pignata, M. L.; J. Environ. Chem. Eng. 2013, 1, 1028. DOI: http://dx.doi.org/10.1016/j.jece.2013.08.012 9. Zampieri, M. C. T.; Saiki, M.; Tavares, A. R.; de Pinna, G. F. A. M.; Hoehnea 2012, 39, 379. DOI: http://dx.doi.org/10.1590/S2236-89062012000300003 10. Giampaoli, P.; Tresmondi, F.; Lima, G. P. P.; Kanashiro, S.; Alves, E. S.; Domingos, M.; Tavares, A. R.; Biol. Plant. 2012, 56, 83. DOI: http://dx.doi.org/10.1007/s10535-012-0020-7 11. Varejao, J. B. M.; dos Santos, C. B.; Rezende, H. R.; Bevilacqua, L. C.; Falqueto, A.; Revista da Sociedade Brasileira de Medicina Tropical 2005, 38, 238. PMID: 15895175 12. Forattini, O. P.; Marques, G. R. A. M.; Rev. Saúde Pública 2000, 34, 543. DOI: http://dx.doi.org/10.1590/S0034-89102000000100007 PMID: 11105120 13. Marengoni, N. G.; Klosowski, E. S.; de Oliveira, K. P.; Chambo, A. P. S.; Gonçalves Junior, A. C.; Quim. Nova 2013, 36, 359. DOI: http://dx.doi.org/10.1590/S0100-40422013000300002 14. Branquinho, C.; Gaio-Oliveira, G.; Augusto, S., Pinho, P.; Máguas, C.; Correia, O.; Environ. Pollut. 2008, 151, 292. DOI: http://dx.doi.org/10.1016/j.envpol.2007.06.014 PMID: 17664032 15. Pedroso, A. N. V.; Poluentes Atmosféricos e Plantas Bioindicadoras, Instituto de Botânica, Sao Paulo, 2007, disponível em http://www.biodiversidade.pgibt.ibot.sp.gov.br/Web/pdf/Poluentes_Atmosfericos_&_Plantas_Bioindicadoras_Andrea_N_V_ 16. Khan, N.; Choi, J. Y.; Nho, E. Y.; Jamila, N.; Habte, G.; Hong, J. H.; Hwang, I. M.; Kim, K. S.; Food Chem. 2014, 158, 200. DOI: http://dx.doi.org/10.1016/j.foodchem.2014.02.103 PMID: 24731332 17. Manahan, S. E.; Enviromental Chemistry, 9th ed., Boca Raton, Flórida, 2009. 18. Yruela, I.; Braz. J. Plant Physiol. 2005, 17, 145. DOI: http://dx.doi.org/10.1590/S1677-04202005000100012 19. de Souza, A. O.; Pereira, C. C.; Jado, B. M.; Oreste, E. Q.; Vieira, M. A.; Ribeiro, A. S.; Vendruscolo, C. T.; Nunes, A. M.; Quim. Nova 2015, 38, 209. 20. Souza, J. M. O.; Carneiro, M. F. H.; Paulelli, A. C. C.; Grotto, D.; Magalhaes Júnior, A. M.; Barbosa Júnior, F.; Batista, B. L.; Quim. Nova 2015, 38, 118. 21. de Santana, S. O.; Ramos, J. V.; Ruiz, M. A. M.; de Araújo, Q. R.; Almeida, H. A.; Faria Filho, A. F.; Mendonça, J. R.; Santos, L. F. C.; Boletim Técnico n. 186. 44 p. Ilhéus, CEPLAC/CEPEC, 2003. 22. Araújo, M.; Alger, K.; Rocha, R.; Mesquita, C. A. B.; Instituto Florestal do Estado de Sao Paulo, Caderno nº 8 - Série Estados e Regioes do RBMA, 1998. 23. Instituto Brasileiro de Geografia e Estatística (IBGE), 2014. Disponível em http://www.cidades.ibge.gov.br, acessado em Março de 2016. 24. Oliveira, E. S.; Interaçoes 2007, 8, 193. 25. Reis, P. S.; Estevam, I. H. S.; Santos, W. P. C.; Korn, M. G. A.; David, J. M.; David, J. P.; Araújo, R. G. O.; Pimentel, M. F.; Ferreira, S. L. C.; J. Braz. Chem. Soc. 2010, 21, 1905. DOI: http://dx.doi.org/10.1590/S0103-50532010001000015 26. Damim, I. C. F.; Silva, M. M.; Vale, M. G. R.; Welz, B.; Spectrochim. Acta Part B 2007, 62, 1037. DOI: http://dx.doi.org/10.1016/j.sab.2007.05.007 27. Brereton, R. G.; Chemometrics, data analysis for the laboratory and chemical plant, Chichester: Wiley, 2003. 28. Raposo Junior, J. L.; Ré-Poppi, N.; Honda, N. K.; Quim. Nova 2007, 30, 582. DOI: http://dx.doi.org/10.1590/S0100-40422007000300015 29. Instituto Nacional de Metrologia, Normalizaçao e Qualidade Industrial (INMETRO), Orientaçoes sobre validaçao de métodos de ensaios químicos, DOQ-CGCRE-008, 2003. 30. CETESB; Qualidade das Aguas Interiores no Estado de Sao Paulo, Secretaria do Meio Ambiente, Sao Paulo, 2009. 31. Migliavacca, D. M.; Teixeira, E. C.; Machado, A. C. M.; Pires, M. R.; Quim. Nova 2005, 28, 371. DOI: http://dx.doi.org/10.1590/S0100-40422005000300002 32. Yin, X. W.; Niu, C. J.; Aquat. Ecol. 2008, 42, 607. DOI: http://dx.doi.org/10.1007/s10452-007-9136-9 33. Baird, C.; Cann, M.; Química Ambiental, 4ª ed., Porto Alegre: Bookman, 2011. 34. Zeiger, E.; Taiz, L.; Fisiologia Vegetal, 4ª ed., Editora Artmed: Porto Alegre, 2009. 35. Clemente, A. L; Muniz, J. A.; Agrotécnica 2002, 26, 197. 36. Cogliatti-Carvalho, L.; Almeida, D. R.; Rocha, C. F. D.; Selbyana 1998, 19, 240. 37. Guimaraes-Souza, B. A.; Mendes, G. B.; Bento, L.; Marotta, H.; Santoro, A. L; Esteves, F. A.; Pinho, L.; Farjalla, V. F.; Enrich-Prast, A.; Acta Limnol. Bras. 2006, 18, 47. 38. Kono, Y.; Tomiyasu, T.; Chemosphere 2009, 77, 1387. DOI: http://dx.doi.org/10.1016/j.chemosphere.2009.09.017 PMID: 19879631 39. Correia, P. R. M.; Ferreira, M. M. C.; Quim. Nova 2007, 30, 481. DOI: http://dx.doi.org/10.1590/S0100-40422007000200042 40. Yabe, M. J. S.; Oliveira, E.; Quim. Nova 1998, 21, 551. DOI: http://dx.doi.org/10.1590/S0100-40421998000500003 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access