Nota Técnica
|
|
| Avaliação da eficiência do método TO-15 para determinação de compostos orgânicos voláteis em condições típicas de ambiente urbano Evaluation of TO-15 method eficiency to determine volatile organic compounds in typical urban conditions |
|
Cleyton Martins da SilvaI,II; Elaine Cesar C. A. SouzaII; Luane Lima da SilvaII; Rafael Lopes OliveiraII; Graciela ArbillaII; Sergio Machado CorrêaI,*
IDepartamento de Química e Ambiental, Faculdade de Tecnologia, Universidade do Estado do Rio de Janeiro. 27537-000 Resende - RJ, Brasil Recebido em 16/05/2016 *e-mail: sergiomc@uerj.br The efficiency of U.S.EPA TO-15 Method was evaluated under typical conditions of an urban environment with natural and anthropic emission sources. The performance criteria which should be met for a system to qualify, were fulfilled: a detection limit of ≤0.2 ng for all target compounds, replicate precision for a calibration standard and ambient samples within 20%. The stability of the target compounds during storage of sampled air in canisters was also evaluated at atmospheric pressure and relative humidity of 50%. Results show that, in the sampling conditions, compounds are not stable for more than a week. For validation experiments, samples were collected at the entrance of Tijuca National Park, located at the city of Rio de Janeiro. Isoprene was selected as a marker of biogenic emissions, and aromatic compounds were selected as markers of anthropogenic emissions, primarily vehicular emissions. Then, samples were collected in Saens Peña Square, a central area in the Tijuca District, in the northern part of the city, approximately 10 km from the entrance of Tijuca National Park. Volatile organic compounds were determined and the results were compared with previous data obtained in the same local using other methods. INTRODUÇAO Sao definidos como compostos orgânicos voláteis (COVs) os compostos orgânicos cuja pressao de vapor a 20 ºC é inferior à pressao atmosférica normal (1,013×105 Pa) e maior do que 130 Pa.1 A legislaçao dos Estados Unidos2 lista ainda 189 COVs considerados potencialmente perigosos para a saúde humana. Com o objetivo de atender às exigências da legislaçao, a Agência Ambiental dos Estados Unidos (U.S.EPA) desenvolveu o método TO-15,3 que permite a determinaçao dos 97 principais compostos dessa lista. O método TO-15 estabelece os procedimentos gerais para a coleta de COVs usando canisters, botijoes de aço inox eletropolidos internamente, e sua determinaçao utilizando a técnica de cromatografia gasosa acoplada à espectrometria de massas e termodessorçao para injeçao das amostras (CG-EM-DT). Estabelece também critérios de qualidade que devem ser atingidos na implementaçao do método: limite de detecçao ≤ 0,5 ppbv, precisao das replicatas dentro de 25% e exatidao dentro do 30% para as concentraçoes esperadas em amostras ambientais (0,5 a 25 ppbv). Contudo, os resultados dependem de diversos fatores, tais como o processo de limpeza dos canisters, a umidade do ar coletado, o método de coleta, a estabilidade das amostras, as condiçoes utilizadas na transferência das amostras e as condiçoes cromatográficas, entre outras. A estabilidade das amostras é um fator crítico. Sob as condiçoes normalmente encontradas em amostras ambientais é geralmente aceito que as amostras podem ser guardadas por trinta dias.3-5 Entretanto, a estabilidade nao é conhecida sobre condiçoes variadas. Existe a possibilidade de perdas devidas à adsorçao física dos compostos nas paredes do canister e dissoluçao dos compostos na água condensada nas paredes. Estes processos geralmente acontecem numa escala de tempo de minutos a horas e depende da temperatura, o material do revestimento interno do canister, a pressao e a umidade. Geralmente num prazo maior (dias ou semanas) podem acontecer perdas por reaçoes químicas. Também podem acontecer perdas devidas a outros processos pouco conhecidos como degradaçao biológica. Os COVs sao provenientes tanto de fontes naturais quanto antrópicas.6-10 As plantas emitem grandes quantidades de COVs, isopreno (2-metil-1,3-butadieno), monoterpenos, sesquiterpenos e compostos orgânicos oxigenados. Dados da literatura mostram que o isopreno nao é acumulado nas plantas e que as emissoes dependem da quantidade de radiaçao e da temperatura, sendo maiores nas regioes tropicais e durante o verao.7,10 Os compostos de origem antrópica sao devidos principalmente aos processos de queima de combustíveis fosseis e queima de biomassa. As emissoes antrópicas acontecem principalmente nas regioes industrializadas (95% no Hemisfério Norte com um pico entre 40º N e 50º N), e nas grandes cidades devido ao trânsito de veículos.6-10 A cidade de Rio de Janeiro apresenta características peculiares. Com uma populaçao de 6.476.631 habitantes11 e uma frota veicular de 2.960.380 veículos,12 as emissoes veiculares sao a maior fonte de poluentes. Ao mesmo tempo, a cidade abriga o Parque Nacional da Tijuca, que com 39,53 km2 é a maior floresta secundária urbana do mundo, com acesso pelas zonas sul, norte e oeste da cidade,13 e o Parque Estadual da Pedra Branca na zona oeste do município do Rio de Janeiro.14 Este último compreende todas as áreas situadas acima da linha de cota de 100 m do Maciço da Pedra Branca e seus contrafortes e, com uma área de 124,92 km2, é considerada a maior floresta urbana primária do mundo. Destas e de outras importantes áreas verdes da cidade, pode ser esperada uma contribuiçao importante das emissoes biogênicas, principalmente isopreno. Existem poucos estudos sobre as concentraçoes de compostos orgânicos nessas áreas verdes15,16 principalmente no referido às concentraçoes de isopreno.17 Esses estudos poderiam contribuir para um melhor conhecimento da composiçao do ar desta regiao e, da interaçao entre as áreas verdes e as áreas urbanizadas. Já a maior parte das determinaçoes de compostos orgânicos voláteis nao oxigenados na cidade de Rio de Janeiro foi realizadas em áreas com predominância de emissoes veiculares e tiveram como objetivo a determinaçao de compostos aromáticos usando o método de coleta com cartuchos adsorvedores18-21 ou a especiaçao de COVs para a realizaçao de modelagens numéricas da qualidade do ar,22,23 motivo pelo qual foram feitas poucas coletas de material. Num trabalho publicado em 2006, Alves et al.10 discutiram a importância das contribuiçoes das fontes naturais, assim como diversas técnicas de coleta e análise de COVs, usando canisters e tubos de aço inox com Tenax TA, que foram aplicadas para um estudo numa área rural de Portugal. O método TO-15 se mostra como um dos mais apropriados para estudos em áreas de floresta e/ou urbanizadas, por nao requerer infraestrutura de apoio, tal como energia elétrica no local da coleta nem a utilizaçao de bombas de ar, e por permitir, ainda, a amostragem durante períodos de tempo entre 1 minuto e 24 horas, cobrindo assim diversas necessidades. Nao existem dados na literatura a respeito das incertezas sobre a reprodutibilidade do método, especialmente no caso de compostos muito reativos como o isopreno, e no caso de amostras coletadas em locais com alta umidade como é o ambiente perto da floresta e outras áreas verdes. Assim, o presente trabalho avalia o método TO-15 e suas várias modificaçoes com respeito aos métodos discutidos previamente.10 O principal objetivo deste estudo é avaliar a eficiência do método TO-15 na determinaçao de compostos orgânicos voláteis em amostras coletadas no ambiente urbano do Rio de Janeiro, principalmente em regioes próximas à área verde da cidade. Para atingir este objetivo foram realizados diversos testes para verificar o desempenho do método e analisados os principais compostos orgânicos voláteis de origem antropogênica e o isopreno, que é o mais abundante composto orgânico volátil de origem biogênica. Finalmente, o método foi aplicado para determinar as concentraçoes dos compostos orgânicos voláteis coletados numa área urbana próxima à Floresta da Tijuca.
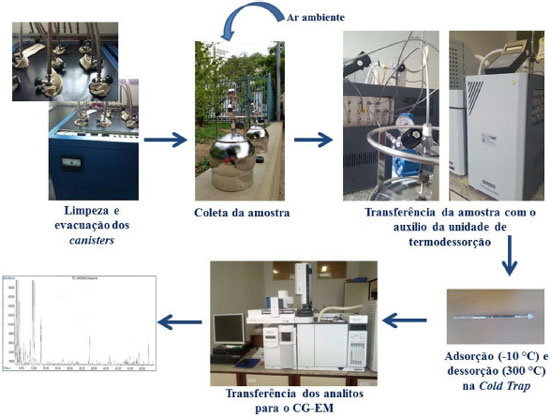
PARTE EXPERIMENTAL Descriçao geral do método TO-15 O método TO-15 foi desenvolvido e avaliado pela U.S.EPA.3 As amostras de ar sao coletadas em canisters, botijoes de aço inox tratados para garantir uma superfície inerte. Em geral os canisters sao eletropolidos internamente e posteriormente submetidos a um tratamento químico para passivaçao. As amostras podem ser introduzidas nos canisters, previamente submetidos a vácuo, à pressao atmosférica ou menor, permitindo uma coleta passiva sem o uso de uma bomba auxiliar, ou a pressoes maiores que a atmosférica para o qual é necessário um sistema auxiliar para pressurizaçao. Neste trabalho se optou pela amostragem passiva e a introduçao de amostra até atingir pressao atmosférica. Após a coleta, a válvula do canister é fechada e o mesmo é transportado ao laboratório para análise. A análise é realizada transferindo um volume conhecido diretamente do canister através de um sistema concentrador multiadsorvente. A eliminaçao da água da amostra é realizada durante a etapa de concentraçao e depende da composiçao do multiadsorvente, do tempo de passagem do gás de arrastre e da temperatura, condiçoes a serem detalhadas. Após a concentraçao da amostra e a eliminaçao da água, a amostra é dessorvida termicamente e concentrada na entrada da coluna para iniciar a etapa de separaçao cromatográfica. Para o método TO-153 a identificaçao e quantificaçao dos COV sao realizadas por espectrometria de massas em modo SCAN ou monitoramento seletivo de íons (MSI). As principais diferenças entre os métodos TO-15 e TO-14A residem no tratamento da água, no método de concentraçao da amostra e no tipo de detectores usados na determinaçao cromatográfica.3 No método TO-14A a eliminaçao da água é realizada usando uma membrana permeável Nafion® (baseada num copolímero de tetrafluoroetileno). A amostra passa por esta membrana antes de ser pré-concentrada. Por este motivo, compostos leves polares serao também retidos na membrana permeável e nao poderao ser determinados. A concentraçao da amostra é realizada usando um tubo de níquel (geralmente de 0,32 cm de diâmetro interno) com esferas de vidro Pyrex® de 60-80 mesh, ou equivalente, resfriado com nitrogênio líquido. Posteriormente a amostra é aquecida (de -160 ºC a 120 ºC em 60 segundos) e injetada no cromatógrafo. O método TO-14A contempla o uso de diversos detectores (espectrometria de massas, ionizaçao de chama, fotoionizaçao ou captura de elétrons).3,5 O método TO-15 fornece um sistema alternativo de tratamento da água, usando concentradores multiadsorventes a temperaturas próximas à ambiente, permitindo a purga seletiva da água e a posterior análise de compostos polares como álcoois, cetonas e ésteres. A concentraçao da amostra é feita num pequeno tubo contendo diversos multiadsorventes a temperaturas geralmente entre -25 ºC e 25 ºC, segundo o tratamento prévio que tenha sido feito com a água. Eventualmente, dependendo da configuraçao do aparelho, o leito adsorvedor pode ser resfriado com dióxido de carbono ou por um sistema Peltier, desde que a água seja retida previamente. Em alguns casos, nos quais nao serao analisados compostos polares, a membrana permeável Nafion® é utilizada para eliminar a água. O método TO-15 contempla apenas o uso de espectrometria de massas como sistema de detecçao e estabelece critérios mínimos de qualidade que devem ser atingidos. Na Figura 1 é apresentado um esquema geral do método com as diversas etapas: limpeza dos canisters, coleta das amostras, transferência e análise. Os detalhes de cada um dos procedimentos sao discutidos em continuaçao.
Descriçao dos canisters Um canister é um recipiente de aço inoxidável com uma válvula, também totalmente em aço inox, desenhada para conservar amostras no intervalo de pressoes 10 mm Hg a 40 psig. Existem canisters de diversos tamanhos, geralmente entre 400 mL e 6 L dependendo da utilizaçao que será dada. Em geral, canisters menores sao usados para amostras mais concentradas. O interior do canister deve ser inerte para evitar a degradaçao das amostras. Existem dois tipos de tratamento: os canisters SUMMA® ou TO-Can® sao eletropolidos num procedimento no qual a parede interna é enriquecida em óxido de cromo-níquel (NiCrOx), protegendo a amostra do contato direto com o material do canister, que contem 70% de ferro, metal muito reativo e catalítico. O revestimento de NiCrOx (500-1000 Å) evita a exposiçao ao ferro e evita o processo de corrosao devido ao ozônio, oxigênio, NOx e outros compostos oxidantes. Já os canisters SilcoCan® recebem um tratamento adicional (Silonite®) com um revestimento cerâmico de aproximadamente 500 Å que os torna inertes nao apenas para os compostos orgânicos menos reativos, mas também para os compostos com enxofre. Neste trabalho foram utilizados canisters de 6 L, marca Restek, com tratamento Silonite® e válvula TOV-2TM. Limpeza dos canisters O procedimento básico consiste na realizaçao de seis ciclos de limpeza, sendo que nos três primeiros é introduzida uma mistura He-vapor de água e nos três seguintes é introduzido He. A funçao da água no gás umidificado é hidrolisar as impurezas no canister e ocupar os sítios ativos na superfície interior, deslocando as impurezas e permitindo que sejam evacuadas. Durante cada ciclo, os canisters sao despressurizados e no último ciclo é realizado vácuo abaixo de 0,05 mm Hg. Durante todo o processo de limpeza, a temperatura do sistema é mantida em 120 ºC. Alternativamente, dependendo do equipamento utilizado, pode ser usado N2 ou ar sintético ultrapuros e, inclusive, realizar a limpeza só com ciclos secos. Neste trabalho foi utilizado um equipamento da empresa Teledyne Hasting Instruments, modelo Omega CN9000A e realizados, em média, quatro ciclos de limpeza usando uma mistura He-vapor de água e, posteriormente, 4 ciclos com He seco para atingir os critérios de qualidade desejados. O controle do procedimento de limpeza deve ser realizado inicialmente em todos os canisters. Após a limpeza, os canisters sao pressurizados com He ou ar ultrapuro e analisados por CG-EM. Conforme as recomendaçoes do método TO-15,3 o processo de limpeza é considerado eficiente se a concentraçao dos compostos de interesse é menor que 0,2 ppbv. Nesse caso os canisters sao evacuados novamente (< 0,05 mm Hg) e guardados até sua utilizaçao, caso contrário, deverao ser submetidos a um novo procedimento de limpeza. Após certificado o funcionamento apropriado do sistema de amostragem, o procedimento de controle pode, eventualmente, ser reduzido para um número menor de canisters (brancos). Para canisters novos, que nao foram utilizados previamente, é geralmente necessário fazer um maior número de ciclos de limpeza até atingir os critérios de qualidade estabelecidos, eliminando compostos adsorvidos nas paredes e que presumivelmente foram utilizados no processo de fabricaçao. A fim de evitar a adsorçao de amostra residual ou a entrada de ar ambiente através da válvula, é recomendável que canisters que serao armazenados durante algum tempo sejam previamente submetidos a dois ciclos de limpeza com He-vapor de água e guardados com He no seu interior até serem utilizados novamente. A limpeza completa, tal como descrita, é realizada preferencialmente no dia anterior à coleta de amostra. Coleta das amostras Como já mencionado, as amostras de ar podem ser coletadas de duas formas: coleta passiva, a pressao atmosférica ou menor, e coleta a pressao maior que a atmosférica usando uma bomba de ar. Neste trabalho foi realizada a coleta passiva à pressao atmosférica. O método TO-15 contempla duas formas de introduzir o ar atmosférico no canister previamente evacuado: coleta instantânea, na qual a válvula é aberta até igualar a pressao interna e externa (normalmente de 10 a 30 segundos) e coleta com um restritor de fluxo durante um período determinado e em condiçoes controladas. Normalmente, usando este tipo de válvulas, a velocidade de entrada do gás no canister diminui na medida em que a pressao interna aumenta. O uso do restritor de fluxo permite que a entrada da amostra seja realizada de forma controlada. Neste trabalho foram usados ambos os procedimentos para comparaçao. O controle da entrada do ar para dentro do canister foi realizado usando um restritor com uma válvula Restek com um fluxo de 67-83 mL min-1 calibrado de forma que, utilizando um canister de 6 L, fosse atingida a pressao final de 1 atm em uma hora de coleta (Passive Canister Sampler CS1200E com um filtro de Silonite®). Análise por cromatografia As amostras de ar foram analisadas utilizando a técnica de cromatografia gasosa/espectrometria de massas, utilizando termodessorçao para injeçao das amostras (DT-CG-EM). Inicialmente, a transferência das amostras para o cromatógrafo foi realizada através da unidade amostradora de canisters CIA Advanced da Markes. Um volume pré-determinado (100 a 500 mL) de amostra gasosa foi transferido do canister e passou através de um loop de peneira molecular a fim de reter a umidade (Nafion®). Em seguida, os COVs foram retidos em uma armadilha fria (cold trap) contendo 3 leitos (Air Toxics Analyser contendo Tenax TA, Carbograph 1TD e Carboxen 1003) dentro da unidade de termodessorçao a uma temperatura de -10 ºC e posteriormente dessorvidos a 300 ºC. Em seguida, os analitos foram concentrados na entrada da coluna para iniciar o processo de separaçao cromatográfica. As amostras foram analisadas em um cromatógrafo a gás Agilent 7890A acoplado a um espectrômetro de massas Agilent 5975C. A separaçao dos COVs foi realizada utilizando uma coluna capilar DB-624, com 60 m de comprimento, 0,32 mm de diâmetro interno e 1,8 µm de espessura de filme. A DB-624 é composta de 6% de cianopropil-fenil e 9% de dimetilsiloxano e possui média polaridade, podendo ser utilizada no intervalo de temperatura de 40 ºC a 260 ºC. Os parâmetros utilizados na etapa de injeçao das amostras foram: temperatura de adsorçao (traplow): -10 ºC; temperatura de dessorçao (trap high): 300 ºC; temperatura da linha de transferência: 150 ºC; tempo de purga da linha: 1 minuto; vazao de purga da linha: 20 mL min-1; vazao de purga do trap: 50 mL min-1; injeçao (em modo split): 20 mL min-1. Para a análise cromatográfica, os seguintes parâmetros foram utilizados: temperatura inicial do forno: 25 ºC; isoterma: 2 minutos; rampa de 25 ºC a 50 ºC: 0,8 ºC min-1; rampa de 50 ºC a 250 ºC: 5 ºC min-1; post run: 3 minutos a 250 ºC; pressao: 20 psi (constante) sem divisao de fluxo; temperatura da linha de transferência para o detector: 250 ºC. O espectrômetro de massas operou a 70 eV em modo seletivo de íons. Curvas e parâmetros analíticos Para a obtençao das curvas analíticas, utilizou-se o método da padronizaçao externa (com superposiçao de matriz), pela comparaçao da área do pico cromatográfico do COV a ser quantificado na amostra com as áreas obtidas utilizando padroes de concentraçoes conhecidas. Esta comparaçao é realizada por uma equaçao da reta, com respectivo coeficiente de determinaçao. Um valor de coeficiente de determinaçao de 0,999 é considerado ótimo,24 entretanto a ANVISA25 sugere um valor de 0,98, valor que coincide com o recomendado por outros autores.26 O método TO-15 descreve o procedimento para preparo de padroes de trabalho (working standards) pela técnica de diluiçao dinâmica, que requer um sistema complexo de manipulaçao de gases e controladores de vazao mássicos (massflow). A alternativa utilizada neste trabalho é injetar no cromatógrafo diferentes volumes do padrao gasoso, utilizando o próprio controlador de vazao mássico equipamento. O instrumento determina o valor da massa de gás por unidade de tempo e este valor depende da densidade do gás, que por sua vez depende da temperatura, pressao e composiçao do gás. É importante salientar que o padrao certificado deverá estar em uma concentraçao próxima à da amostra, tal que seja possível obter a curva analítica com precisao. A identificaçao dos analitos foi realizada preliminarmente com auxílio do espectro de massas e, posteriormente, as curvas analíticas foram obtidas utilizando padrao gasoso certificado (Linde Spectra Restek), contendo 57 componentes. A fim de cobrir todo o intervalo de concentraçoes foram usados dois padroes: Restek 34445 (Padrao 1, Padrao de calibraçao de gases para monitoramento do ar, percursor de Ozônio/PAMS Mix, com concentraçoes na faixa 20-60 ppbC em nitrogênio) e Restek 26369 (Padrao 2, Padrao de calibraçao de gases para monitoramento do ar, percursor de Ozônio/PAMS Mix, com concentraçoes de 100 ppb em nitrogênio). Diferentes volumes foram injetados para obtençao da curva analítica e, uma vez que o gás contido no padrao foi submetido às condiçoes de adsorçao, foi possível determinar a massa de cada analito de interesse que ficou retida na armadilha fria. O software do equipamento forneceu o valor exato de cada volume injetado através do medidor de vazao mássico. Utilizando cada valor de volume injetado e as respectivas concentraçoes fornecidas pelo certificado de análise do padrao, foi possível determinar a massa (em ng) injetada de cada analito de interesse e obter as curvas analíticas. A fim de considerar todas as concentraçoes possíveis nos ambientes estudados, foram construídas duas curvas, uma em um intervalo de concentraçoes menores, com o padrao de concentraçoes 20-60 ppbC (Padrao 1), e outra em um intervalo de concentraçoes maiores, com o padrao de 100 ppb (Padrao 2). Cada curva analítica foi construída com 10 pontos em triplicata, sendo injetados para os dois padroes volumes na faixa 10 a 350 mL. Para todos os compostos as curvas analíticas tiveram R2 ≥ 0,99 e apresentaram linearidade no intervalo de trabalho. As faixas de massa para cada composto variaram, já que as concentraçoes dos compostos nos padroes sao diferentes. A modo de exemplo, o intervalo da curva para o benzeno foi de 0,37 a 7,44 (Padrao 1) e 5,10 a 63,80 µg m-3 (Padrao 2) e os coeficientes de determinaçao de 0,996 para ambas as curvas. Para o tolueno os intervalos de concentraçao foram de 0,50 a 10,10 (Padrao 1) e 7,22 a 90,30 µg m-3 (Padrao 2) e os coeficientes de correlaçao 0,991 e 0,997, respectivamente. Diariamente foram realizados brancos do sistema de injeçao e conferido um ponto da curva de calibraçao (100 mL), conforme recomendado nas especificaçoes do método TO-15.3 No Material Suplementar é mostrado um cromatograma do branco (Figura 1S), dos compostos de contidos no padrao Restek, obtido em modo SCAN (Figura 2S) e de uma amostra típica, obtido em modo monitoramento seletivo de íons (Figura 3S). Na Tabela 1S sao listados os COVs analisados e os íons utilizados para a quantificaçao e as massas moleculares correspondentes. Para o procedimento de controle de qualidade foram analisados os seguintes compostos: propeno, buteno, isopreno, hexano, benzeno, tolueno, etil benzeno, m+p-xilenos e o-xileno. Limite de detecçao (LD): é a menor quantidade de substância que pode ser detectada, mesmo que nao necessariamente possa ser quantificada.24 Os dois métodos mais usados para sua determinaçao sao o baseado na relaçao sinal-ruído e o baseado nos parâmetros da curva analítica.24 No primeiro caso é realizada a comparaçao entre a mediçao dos sinais de amostras em baixas concentraçoes conhecidas do composto de interesse na matriz e um branco (matriz isenta do composto de interesse) destas amostras. Neste trabalho foi admitido que uma relaçao sinal-ruído de 3:1 era aceitável como LD. Posteriormente, usando os parâmetros da curva analítica construída com valores de concentraçao de padrao próximos ao LD determinado anteriormente, foi calculado um valor como:  em que s é a estimativa do desvio padrao do coeficiente linear da equaçao e S é a inclinaçao ou coeficiente angular da curva analítica.24 O LD foi determinado em unidades de massa do composto de interesse e, assim, para uma dada concentraçao esperada do composto no ar atmosférico que está sendo estudado, foi estimado o volume mínimo de ar (na realidade massa de ar) que deveria ser injetado no CG. Limite de quantificaçao (LQ): é a mínima quantidade que pode ser medida para o procedimento experimental que está sendo utilizado. 24 Os mesmos critérios de LD podem ser adotados para o LQ, utilizando a relaçao:  Repetitividade: representa a concordância entre os resultados de mediçoes sucessivas de um mesmo método, efetuadas sob as mesmas condiçoes de mediçao, chamadas condiçoes de repetitividade: mesmo procedimento; mesmo analista; mesmo instrumento usado sob as mesmas condiçoes; mesmo local; repetiçoes em um curto intervalo de tempo. Neste caso foi determinada passando iguais volumes do padrao certificado.24 Neste trabalho foram realizadas 10 determinaçoes de uma quantidade de padrao predeterminada (50 mL do padrao 2). Conforme recomendaçao do método TO-15,3 a precisao das replicatas deve ser calculada como: 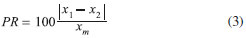 em que x1 e x2 sao os valores obtidos para duas determinaçoes e xm é o valor médio. Neste trabalho foi usada a equaçao:  em que xmax e xmin sao o maior e o menor valores, respectivamente obtidos para as dez determinaçoes e xm é o valor médio. Avaliaçao da qualidade das coletas A fim de verificar a qualidade do método de coleta, foram realizadas as seguintes determinaçoes: determinaçao da estabilidade da amostra guardada no canister, determinaçao da repetitividade de replicatas verdadeiras e de sucessivas determinaçoes cromatográficas da mesma amostra, avaliaçao do uso de restritores de fluxo em comparaçao a coletas instantâneas. Estabilidade das amostras: A estabilidade das amostras nos canisters foi certificada realizando coletas simultâneas de ar atmosférico em condiçoes reais. Foi escolhido um local de coleta com condiçoes críticas de umidade e composiçao, com contribuiçao de fontes biogênicas e antrópicas. Foram coletadas 3 amostras simultâneas usando os canisters de 6 L e analisadas no dia seguinte a coleta, 15 e 30 dias depois. Foram analisados os seguintes compostos: propeno, buteno, isopreno, hexano, benzeno, tolueno, etil benzeno, m + p-xilenos e o-xileno. Repetitividade dos resultados para coletas simultâneas: Foram feitas duas coletas simultâneas, com os canisters de 6 L, usando um restritor de fluxo de 1 hora. Comparaçao das coletas com e sem restritor de fluxo: Foram comparados os resultados obtidos coletando as amostras usando um restritor de uma hora (duas coletas) e coletas instantâneas (abertura da válvula do canister previamente evacuado que permite a entrada do gás de 30 a 60 segundos). Local de coleta das amostras As amostras utilizadas para a avaliaçao do método foram coletadas na Praça Afonso Viseu, no Alto da Boa Vista, Rio de Janeiro (coordenadas -22º57'40,43"S e -43º16'24,20"W). O local, na entrada do setor Floresta da Tijuca do Parque Nacional da Tijuca, é arborizado, com construçoes residenciais, fluxo moderado de pessoas e veículos e a circulaçao de duas linhas de ônibus que unem a Rodoviária Novo Rio e a Barra da Tijuca. Abriga um restaurante de médio porte, o chafariz do francês Grandjean de Montigny e é ponto de encontro de grupos de caminhada e lugar de recreaçao de crianças e adultos. Em torno da praça, visitantes do parque frequentemente estacionam veículos. O local foi escolhido porque está sujeito a emissoes naturais e antropogênicas e apresenta condiçoes ambientais típicas da área urbana cercada pela Mata Atlântica. Nos dias de coleta a temperatura ambiente foi de 25 a 27 ºC e a umidade do ar em torno de 50%. Todas as amostras foram coletadas entre as 11 e 13 horas em dias úteis, nos quais o movimento de pessoas na praça é reduzido em comparaçao com dias de final de semana e feriados. Para ilustrar a aplicabilidade do método, foram coletadas, também, outras amostras na Praça Saens Peña, no bairro da Tijuca da Cidade de Rio de Janeiro (22º55'29.9"S 43º13'57.2"W). A regiao se encontra aproximadamente a 10 km de uma das entradas do Parque Nacional da Tijuca e a menos de 1 km do Morro de Sumaré, com 700 m de altitude e vegetaçao da mata Atlântica. O local possui grande número de estabelecimentos comerciais e intenso fluxo de veículos, principalmente veículos leves, assim como uma estaçao de metrô. As concentraçoes de COVs nesse local já tinham sido estudadas previamente usando cartuchos adsorvedores16,18 e o método TO-14A23 e, por isto, esse lugar de coleta parece apropriado para avaliar a aplicabilidade do método. Durante o período de coleta a temperatura foi de 26 a 32,9 ºC e a umidade do ar em torno de 65%.
RESULTADOS E DISCUSSAO Limites de detecçao e quantificaçao e precisao das replicatas Inicialmente a seletividade do método foi avaliada para garantir que o pico de resposta dos analitos, no tempo de retençao característico, fosse proveniente exclusivamente do mesmo. Os valores de LD determinados neste trabalho se encontraram no intervalo 0,1 a 0,2 ng. Isso significa que sendo injetados volumes de 500 mL de ar, como geralmente recomendado,3 será possível detectar compostos que estao em concentraçoes de aproximadamente 0,2-0,4 mg m-3. Esses valores estao num bom acordo com o LD indicado para o método TO-15 de 0,2 ppbv.3 A precisao determinada para a análise de 10 amostras, em condiçoes de concentraçao próxima a que encontrada nas amostras, como já descrito, foi estimada usando a Equaçao 4, dando um desvio ≤ 20%. Esses valores sao afetados por diversos fatores, como massa molecular, solubilidade em água, polarizabilidade etc., sendo que, em geral, a precisao é maior para compostos nao polares.3 Os valores achados estao em bom acordo com os reportados no método TO-15 (valor típico ≤ 25%)3 e podem ser considerados razoáveis dado que envolvem todos o procedimento de transferência (determinaçao do volume de amostra gasosa, adsorçao e dessorçao na armadilha fria) e análise da amostra. A exatidao dos resultados nao pode ser verificada porque nao existe material de referência certificado para este método. Esse problema poderá ser contornado no futuro comparando os resultados do método TO-15 com os de outro método ou fazendo calibraçao interlaboratorial. Avaliaçao da qualidade das coletas Estabilidade das amostras: A estabilidade das amostras depende de diversos fatores como material do canister, pressao e umidade da amostra, solubilidade em água e reatividade dos compostos. Por esse motivo, neste trabalho as amostras foram coletadas em condiçoes próximas às esperadas no meio ambiente (pressao atmosférica, 50% de umidade e 27 ºC). De uma forma geral, o método TO-153,4 e os diversos fabricantes de canisters indicam que as amostras sejam analisadas em até 30 dias, mas recomendam que este período seja verificado para as condiçoes específicas de cada estudo e considerando compostos de diversas reatividades. Neste trabalho foram escolhidos compostos muito reativos (isopreno, propeno e buteno), compostos aromáticos e o hexano que apresenta baixa reatividade em condiçoes atmosféricas. Os resultados sao mostrados na Tabela 1, na qual foram representados os valores de PR calculados como: 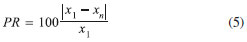
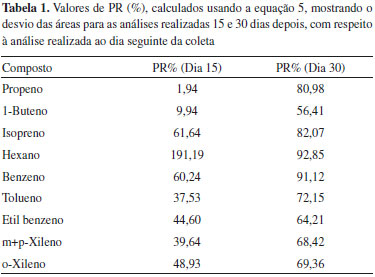
em que x1 é o sinal analítico para a análise ao dia seguinte da coleta, xn é o sinal analítico para a amostra considerada (dia 15 ou 30). Todas as amostras foram analisadas em duplicata. Os valores de PR sao sempre apresentados como valores absolutos, mas podem acontecer desvios negativos ou positivos.20 Neste trabalho os desvios foram negativos para todos os compostos exceto para o hexano. Os desvios negativos sao mais frequentes e geralmente sao devidos à adsorçao na parede do canister, reaçoes químicas com água ou outros compostos presentes.4 Desvios positivos podem ser atribuídos à partiçao dos COVs entre a fase gás e a água condensada na superfície do canister, que depende da temperatura, pressao e umidade. Análises sucessivas levam à diminuiçao de pressao, que reduz a quantidade de água condensada nas paredes e, portanto, aumenta a fraçao de composto orgânico na fase gás.20 Os valores de PR obtidos neste trabalho, para as condiçoes de coleta, sao, na maior parte dos casos, maiores que 25, indicando que as amostras nao sao estáveis para esses períodos de estocagem. É importante mencionar que os estudos de estabilidade sao geralmente realizados com amostras de padrao gasoso. Como discutido na literatura,27 amostras ambientais sao muito mais complexas, já que contêm água, ozônio, compostos oxigenados, nitrogenados e compostos de enxofre que, além de reagir, podem interferir no processo de coleta, armazenamento e análise. Assim, é esperado que a estabilidade de amostras ambientais seja menor que a informada na literatura para amostras preparadas através da diluiçao de um padrao. Os resultados para os compostos de maior interesse neste trabalho, isopreno e compostos aromáticos, mostram que a mudança na concentraçao é de aproximadamente 2-3% por dia. Repetitividade dos resultados para coletas simultâneas: Foram calculados os valores de PR para as duas coletas simultâneas, com os canisters de 6 L, usando um restritor de fluxo de 1 hora. Os valores calculados para a primeira análise das amostras, usando a Equaçao 3, foram 6%, 19%, 21%, 22%, 20%, 21%, 14%, 15% e 19% para propeno, buteno, isopreno, hexano, benzeno, tolueno, etil benzeno, m + p-xilenos e o-xileno, respectivamente. Posteriormente foram realizadas análises sucessivas (replicatas, até um total de quatro injeçoes) de cada canister. Os resultados sao mostrados na Tabela 2 onde foram representados os valores de PR calculados como: 
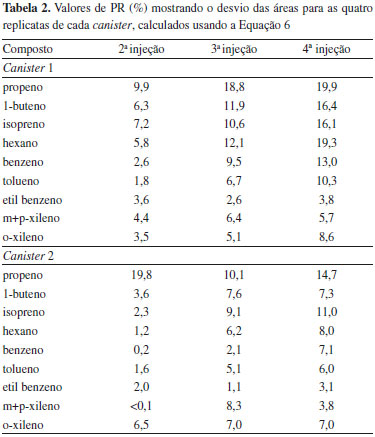
em que xn injeçao é o sinal analítico para a enésima injeçao de cada um dos canisters, e x1º injeçao é o sinal analítico da primeira injeçao do mesmo canister e xm é o valor médio de ambos os valores. Assim, este valor representa o desvio das sucessivas replicatas devido nao apenas ao erro da determinaçao cromatográfica, mas também, às diferenças inerentes as injeçoes sucessivas devidas à mudança de pressao residual dentro do canister, que é agravada a cada injeçao e a processos de adsorçao/dessorçao dos compostos. Os resultados da Tabela 2 mostram que as análises sucessivas do mesmo canister, nas condiçoes que foram utilizadas neste trabalho, sao reproduzíveis dentro de uma incerteza de aproximadamente ≤20%, que satisfaz o requerimento do método TO-15 de 25%.3 Note-se que foram injetados 500 mL de gás em cada injeçao, correspondendo para a quarta injeçao a uma diminuiçao de pressao de aproximadamente 0,66. O volume de 500 mL é geralmente apropriado para amostras ambientais, fornecendo sinais acima do LQ para os compostos de interesse e permitindo, caso sejam usados canisters de 6 L, a realizaçao de triplicatas com um valor de PR dentro dos critérios de qualidade. Testes realizados no laboratório com canisters de menor capacidade (1,5 L) nao se mostraram satisfatórios para a realizaçao de triplicatas na análise de amostras ambientais em baixa concentraçao, provavelmente pela diminuiçao de pressao. Porém seriam apropriados para a análise de amostras provenientes de emissoes veiculares, túneis e ambientes internos, com concentraçoes próximas as do Padrao 2 (100 ppb) para as quais seria possível injetar volumes menores de amostra. Comparaçao das coletas com e sem restritor de fluxo: Como já mencionado para duas coletas simultâneas usando restritores de fluxo (1 h), os valores de PR calculados para a primeira análise das amostras, usando a Equaçao 3, foram 6%, 19%, 21%, 22%, 20%, 21%, 14%, 15% e 19% para propeno, buteno, isopreno, hexano, benzeno, tolueno, etil benzeno, m+p-xilenos e o-xileno, respectivamente, o que indica uma reprodutibilidade aceitável em comparaçao com os critérios de qualidade estabelecidos para o método TO-15.3 Na Tabela 3 sao comparados os resultados obtidos coletando as amostras usando um restritor de uma hora (duas coletas) com coletas instantâneas (abertura da válvula do canister previamente evacuado que permite a entrada do gás de 30 a 60 segundos). As coletas instantâneas foram realizadas durante a coleta de 1 hora com restritor (nos minutos 0, 15, 30, 45 e 60). A comparaçao foi feita para a primeira injeçao usando a relaçao da Equaçao 7: 
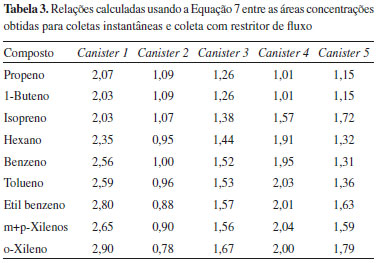
em que xcanister n é o sinal analítico para a primeira injeçao de cada um dos canisters (coleta instantânea), e xmédia restritor é a média do sinal analítico da primeira injeçao dos dois canisters para os quais foi usado restritor de fluxo. Como pode ser observada na Tabela 3, a maioria dos valores obtidos para as coletas instantâneas sao maiores (em alguns casos num fator 2-3) que os valores obtidos para a coleta com restritor de fluxo. Assim, os valores médios para as coletas instantâneas (a média das cinco coletas) sao significativamente maiores que o valor para a coleta de 1 hora, apresentando valores de PR de até 190%. Os motivos dessa diferença podem estar relacionados a diversos fatores, tais como variaçoes instantâneas das concentraçoes e, principalmente, fatores relacionados à abertura da válvula do canister, que determinam que o processo aconteça num tempo variável, geralmente 10 a 30 segundos. Contudo o método de coleta instantânea é considerado apropriado pela US-EPA3 e bastante prático em condiçoes extremas de coleta, por exemplo, em locais de difícil acesso ou com temperaturas extremas, como é o caso da Antártica, e, portanto, seria necessário realizar outros experimentos no futuro para elucidar esta questao, em especial com amostragens em atmosferas de concentraçao conhecidas. De uma forma geral, os resultados mostrados neste trabalho indicam que o método, tal como implementado, satisfaz os critérios de qualidade estabelecidos pela U.S.EPA, sendo recomendado para amostras ambientais o uso de canisters de 6 L e restritor de fluxo para controle da entrada da amostra, assim como a análise cromatográfica no prazo máximo de 3 a 4 dias. Finalmente, indicam que, como acontece em geral na determinaçao de concentraçoes de amostras ambientais, os resultados podem ser rigorosamente comparados apenas como outros obtidos nas mesmas condiçoes de coleta e análise já que dependem de diversos fatores inerentes ao método e, também, das condiçoes ambientais, como temperatura, umidade e composiçao da mistura. O método de coleta com canisters e análise por cromatografia gasosa com detecçao por ionizaçao em chama ou espectrometria de massas tem sido avaliado por outros autores em diversas condiçoes. Em alguns desses trabalhos10,28,29 foi comparado o desempenho da coleta com tubos de adsorçao e com canisters. No trabalho desenvolvido por Colón et al.28 usando o método TO-14A e cartuchos de adsorçao, os autores encontram uma precisao entre amostras coletadas com canisters em duplicatas, para compostos orgânicos voláteis nao oxigenados, de 3 a 22%, em bom acordo com os valores obtidos neste estudo. Em geral os autores consideram o método com canisters mais eficiente, apesar de ser mais caro e mais difícil de implementar. Por outro lado, como já mencionado, a coleta com canisters nao requer energia elétrica nem equipamento adicional e pode ser realizada em diversos períodos de tempo. Aplicaçao do método O método foi aplicado a amostras coletadas na Praça Saens Peña no período 02 a 16 de março de 2015. Foram coletadas 8 amostras, usando canisters de 6 L com restritor de fluxo de 1 hora entre as 8 e 9 horas. Foram determinados 51 compostos (C4 - C12). Cada amostra foi analisada por triplicata injetando 500 mL e usando as condiçoes já descritas. Todas as amostras foram analisadas em um período de, no máximo, três dias após a coleta. A curva de calibraçao e amostras de branco foram verificadas diariamente para garantir a qualidade das determinaçoes. Os resultados (valores médios e desvio padrao) obtidos para os 25 compostos mais abundantes sao mostrados na Tabela 4, assim como valores obtidos previamente neste local, em outros trabalhos, usando o método TO-14A e cartuchos ou tubos adsorvedores (método TO-2 da US.EPA).
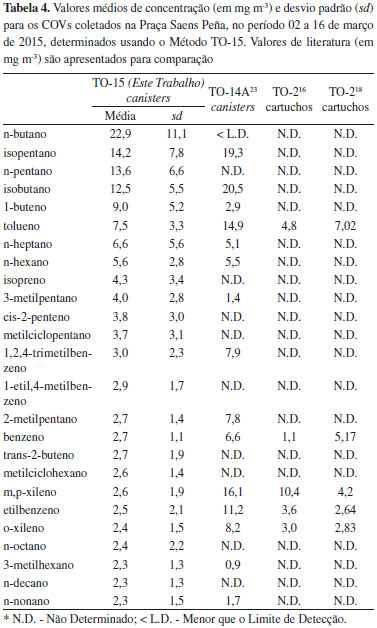
O valor médio para a concentraçao de COVs totais foi de 162,86 µg m-3, sendo que os 25 COVs mais abundantes representam 86,7% da massa total dos compostos determinados. Estes valores sao comparáveis ao determinado, no mesmo local, para 4 canisters, coletados às 9 horas, em março de 2004 (COVs totais = 220,5 µg m-3).23 Nesse trabalho foram determinados 66 COVs (C3 - C12) através do método TO-14A, usando coleta instantânea. Os compostos aromáticos foram determinados, também, usando o método de cartuchos adsorvedores, extraçao com solvente e cromatografia gasosa, por Custodio et al.16 e por Martins et al.18 No primeiro caso foram coletadas 15 amostras, no período Janeiro a Agosto de 2008, e no segundo 30 amostras, entre Abril de 2012 e Fevereiro de 2013. Rigorosamente, os resultados nao podem ser comparados em forma direta, já que os métodos de coleta e análise foram diferentes e as condiçoes ambientais (principalmente as condiçoes meteorológicas) também foram diferentes. Contudo, os resultados estao dentro da mesma ordem de grandeza e podem ser considerados satisfatórios. As concentraçoes de benzeno determinadas neste trabalho se encontraram no intervalo 1,45 a 3,78 com um valor médio de 2,72 µg m-3. Este valor é da mesma ordem de grandeza aos obtidos em 2012 e 201318 e mostrados na Tabela 4, porém, aproximadamente a metade dos obtidos anteriormente. O benzeno é considerado um composto carcinogênico, e é responsável por 68% do risco de câncer associado a poluentes veiculares.30 Ainda que no Brasil existam limites quanto às concentraçoes atmosféricas de benzeno, estas somente estao disponíveis para legislaçao trabalhista (3,19-7,98 mg m-3) que sao referentes à riscos ocupacionais de exposiçao a este. No entanto, para limites de qualidade do ar, nao existe nenhuma especificaçao para tal poluente. A Uniao Européia31 estabelece na foma de Diretriz (2008/50/Ec), limite para a concentraçao ambiental de benzeno, associando este à proteçao à saúde humana. Nesta, o limite é de 5,0 µg m-3, sendo este um valor máximo médio para o período de 1 ano. Já o Departamento de Meio Ambiente, Alimentos e Atividades Rurais do Reino Unido32 estabelece, para o mesmo período, um objetivo a ser alcançado como valor limite de benzeno, de 3,25 µg m-3, para países como a Escócia e Irlanda, e um valor de 5,0 µg m-3, para a Inglaterra e País de Gales, em consonância com as recomendaçoes da Uniao Européia. Assim, os valores obtidos neste trabalho se encontram dentro dos limites estabelecidos pela Uniao Européia. A relaçao Benzeno/Tolueno determinada para estas amostras é de 0,36. Em geral, uma relaçao de aproximadamente 0,5 é considerada característica de emissoes urbanas (fontes veiculares sem contribuiçoes industriais).33 Quanto ao isopreno, considerado na literatura como o principal COV de origem biogênica, as concentraçoes individuais se encontram na faixa de 2,65 - 11,91 µg m-3, com um valor médio de 4,34 µg m-3. Para a cidade do Rio de Janeiro, conforme o nosso conhecimento, tal composto ainda nao havia sido publicado, exceto por Martins et al.,22 que obtiveram, para diversas ruas da cidade, um valor médio de 1,39 µg m-3. Recentemente, Oliveira34 determinou em sua Tese de Doutorado valores médios de concentraçao de isopreno igual a 3,82 µg m-3, para 7 canisters coletados na UERJ, campus Maracana, e 4,53 µg m-3, para 14 canisters coletados na Floresta da Tijuca, (Casa do Pesquisador). As concentraçoes de isopreno encontradas neste trabalho sao consideravelmente maiores que o valor determinado para Porto Alegre35 em 1996 - 1997, de 0,7 µg m-3, e em Sao Paulo36 em 2006 (1,5 a 2,3 µg m-3), usando o método TO-14A. Ao comparar a relaçao média Benzeno/Isopreno determinada neste trabalho (0,63) com os valores obtidos em Porto Alegre (35,6)35 e Sao Paulo (2,2)36 se observa que a contribuiçao relativa das emissoes de origem biogênica na cidade de Rio de Janeiro é muito maior que em outras cidades do Brasil. A mesma conclusao é obtida ao comparar com valores obtidos recentemente em Bogotá, Colombia (3,1)37 e na cidade de Pequim, China, em 2006 (2,36).33 Os valores relativamente altos de isopreno na Praça Saens Peña podem ser explicados por esta ser uma regiao muito próxima à Mata Atlântica (Floresta da Tijuca e Morro de Sumaré), com abundante vegetaçao, e as amostras terem sido coletadas em dias ensolarados, que favorecem as emissoes de isopreno e outros compostos de emitidos pelas plantas.
CONCLUSAO O método TO-15 se mostrou apropriado para a determinaçao de COVs em concentraçoes ambientais, sendo o LD nas faixas compreendidas entre 0,2 e 0,4 mg m-3 e 0,1 e 0,2 mg m-3 injetando um volume de amostra de 500 mL e 1 L, respectivamente. Os resultados para os compostos de maior interesse neste trabalho, isopreno e compostos aromáticos, mostram que a mudança na concentraçao, geralmente com desvio negativo, é de aproximadamente 2-3% por dia, assim, as amostras deverao ser analisadas preferencialmente no prazo de até 8 dias de forma a garantir um erro menor que 25% preconizado pelo método. A repetitividade dos resultados, dentro dos critérios de qualidade estabelecidos pelo método, é atendida usando canisters de 6 L e injeçoes de 500 mL. O uso de canisters de volume menor para amostras ambientais nao se mostrou adequado porque nao possibilita a realizaçao de triplicatas. O uso de restritores de fluxo, para obtençao de uma amostra integrada, faz-se necessário para garantir a homogeneidade e reprodutibilidade dos resultados, condiçao que nao é atingida com amostras instantâneas. Quando aplicado a amostras coletadas num ambiente urbano, o método se mostra satisfatório, fornecendo resultados compatíveis com valores da literatura.
MATERIAL SUPLEMENTAR A Figura 1S (Cromatograma do branco), Figura 2S (Cromatograma dos compostos contidos no padrao Restek (57 COVs em nitrogênio), obtido em modo SCAN) e Figura 3S (Cromatograma de uma amostra típica coletada na Praça Afonso Viseu (Alto da Boa Vista, Rio de Janeiro) e a Tabela 1S (COVs analisados e íons usados para a quantificaçao) utilizados neste trabalho estao disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Os autores agradecem o financiamento de FAPERJ (Processo E-26/110.440/2014), CNPq (Processo 490252/2011-7 e Processo 446158/2014-3) e Petrobras (Projeto 14281) e a colaboraçao do laboratório CENPES/PDEDS/AMA. ECCS e RLO agradecem ao CNPq e à CAPES, respectivamente, por bolsas de Doutorado. SMC e GA agradecem ao CNPq por bolsas de Produtividade.
REFERENCIAS 1. Hester, R. E.; Harrinson, R.; Volatile organic compounds in the atmosphere, The Royal Society of Chemistry: London, 1995. 2. Clean Air Act Amendments of 1990. htpp://www.epw.senate.gov/envlaws/cleanair.pdf. Acessada em fevereiro 2016. 3. U.S. Environmental Protection Agency; Compendium Method TO-15, Determination of Volatile Organic Compounds (VOCs) in U. S. Air Collected in Specially-Prepared Canisters and Analyzed by Gas Chromatography-Mass Spectrometry (GC-MS), 1999. http://www.epa.gov/ttnamti1/files/ambient/airtox/to-15r.pdf, acessada em fevereiro 2016; U.S. Environmental Protection Agency. Compendium of Methods for the Determination of Toxic Organic Compounds in Ambient Air - Second Edition, 1999. http://www.epa.gov/ttnamti1/files/ambient/airtox/tocomp99.pdf, acessada em fevereiro de 2016. 4. Coutant, R.W.; Theoretical Evaluation of Stability of Volatile Organic Chemicals and Polar Volatile Organic Chemicals in Canisters, U. S. Environmental Protection Agency, EPA Contract No. 68-DO-0007, Work Assignment No. 45, Subtask 2, Battelle, Columbus, OH, June 1993. http://nepis.epa.gov/Exe/ZyPDF.cgi/30003VZY.PDF?Dockey=30003VZY.PDF. Acessada em fevereiro de 2016. 5. U.S. Environmental Protection Agency; Compendium of Methods for the Determination of Toxic Organic Compounds in Ambient Air. Second Edition. Compendium Method TO-14A. 1999. http://www.epa.gov/ttnamti1/files/ambient/airtox/to-14ar.pdf, acessada em fevereiro 2016. 6. http://www.ipcc.ch/ipccreports/tar/wg1/140.htm, acessada em fevereiro de 2016. 7. Finalyson-Pitts, B. J.; Pitts Jr., J. N.; Chemistry of the upper and lower atmosphere: Theory, Experiments, and Applications. Academic Press: California, 2000. 8. Atkinson, R.; Atmos. Environ. 2000, 34, 2063. 9. Atkinson, R.; Arey, J.; Atmos. Environ. 2003, 37 (Spp. 2), S191. 10. Alves, C.; Pio, C.; Gomes, P.; Quim. Nova 2006, 29, 477. 11. http://cidades.ibge.gov.br/xtras/perfil.php?codmun=330455, acessada em fevereiro de 2016. 12. http://www.detran.rj.gov.br/_estatisticas.veiculos/07.asp, acessada em fevereiro de 2016. 13. http://www.parquedatijuca.com.br/files/guia_de_campo_PNT.pdf, acessada em fevereiro de 2015. 14. http://www.inea.rj.gov.br/Portal/Agendas/BIODIVERSIDADEEAREASPROTEGIDAS/UnidadesdeConservacao/INEA_008594, acessada em fevereiro de 2015. 15. Azevedo, D. de A.; Moreira, L. S.; de Siqueira, D. S.; Atmos. Environ. 1999, 33, 4987. 16. Custodio, D.; Guimaraes, C. S.; Varandas, L.; Arbilla, G.; Chemosphere 2010, 79, 1064. 17. da Silva, C. M.; da Silva, L; L.; Correa, S. M. Arbilla, G.; Bull. Environ. Contam. Toxicol. submetido. 18. Martins, E. M.; Arbilla, G.; Bauerfeldt, G. F.; de Paula, M.; Chemosphere 2007, 67, 2096. 19. Fernandes, M. B.; Brickus, L.S.R.; Moreira, J. C.; Cardoso, J. N.; Chemosphere 2002, 47, 417. 20. Kelly, T. J.; Holdren, M. W.; Atmos. Environ. 1995, 29, 2595. 21. Corrêa, S. M.; Arbilla, G.; J. Braz. Chem. Soc. 2007, 18, 539. 22. Martins, E. M.; Nunes, A. C. L.; Correa, S. M.; J. Braz. Chem. Soc. 2015, 26, 197. 23. Martins, E. M.; Arbilla, G.; Gatti, L. V.; Bull. Environ. Contam. Toxicol. 2010, 84, 175. 24. Ribani, M.; Botolli, C. B. G.; Collins, C. H.; Sales, I. C.; Jardim, F.; Melo, L. F. C.; Quim. Nova 2004, 27, 771. 25. http://portal.anvisa.gov.br/wps/wcm/connect/4983b0004745975da005f43fbc4c6735/RE_899_2003_Determina+a+publica%C3%A7%C3%A3o+do+Guia+para+valida%C3%A7%C3%A3o+de+m%C3%A9todos+anal%C3%ADticos+e+bioanal%C3%ADticos.pdf?MOD=AJPERES, acessada em fevereiro de 2016. 26. Paschoal, J. A.; Rath, S.; Airoldi, F. P. Da S.; Reyes, F. G. R.; Quim. Nova 2008, 31, 1190. 27. Rappengluck, B.; Apel, E.; Bauerfeind, M.; Bottenheim, J.; Brickell, P.; Cavolka, P.; Ceche, J.; Gatti, L.; Hakola, H. , Honzak, J.; Junek, R.; Martin, D.; Noone, C.; Plass-Dulmer, Ch.; Travers, D.; Wang, D.; Atmos. Environ. 2006, 40, 7508. 28. Colón, M.; Pleila, J. D.; Hartlage, T. A.; Guardani, M. L.; Martins, M. H.; Atmos. Environ. 2001, 35, 4017. 29. Heo, G. S.; Lee, J. H.; Kim, S. W.; Lee, D. W.; Microchem. J. 2001, 70, 265. 30. Chan, C. Y.; Chan, L. Y.; Wang, X. M.; Liu, Y. M.; Lee, S. C.; Zou, S. C.; Sheng, G. Y.; Fu, J. M.; Atmos. Environ. 2002, 36, 2039. 31. European Union. Directive 2008/50/Ec of The European Parliament and of the Council of 21 May 2008 on Ambient Air Quality and Cleaner Air for Europe. Official Journal of the Europe, 2008. 32. DEFRA - Department for Environment, Food and Rural Affairs. The Air Quality Strategy for England, Scotland, Wales and Northern Ireland. Reino Unido, 2011, 2. 33. Duan, J.; Tan, J.; Yang, L.; Wu, S.; Hao, J.; Atmos. Res. 2008, 88, 25. 34. Oliveira, R. L.; Tese de Doutorado, Universidade Federal do Rio de Janeiro, Brasil, 2015. 35. Grosjean, E.; Rasmussen, R. A.; Grosjean, D.; Atmos. Environ. 1998, 32, 3371. 36. Alvim, D. S.; Gatti, L. V.; Correa, S. M.; Pretto, A.; Rossatti, C. de S.; Orlando, J. P.; Ciência & Natura 2014, 36, 434. 37. Franco, J. F.; Pacheco, J.; Belalcázar, L. C.; Behrentz, E.; Atmósfera 2015, 28, 1. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access