Artigo
|
|
| Aplicação de amidoximas como catalisadores da reação de alilação por aliltrifluoroborato de potássio em meio bifásico Application of amidoximes as catalysts for the allylation reaction by potassium allyltrifluoroborate in organic biphasic |
|
Dmistocles de AndradeI; Joao Rufino de Freitas FilhoI; Juliano Carlo Rufino FreitasI,II,*
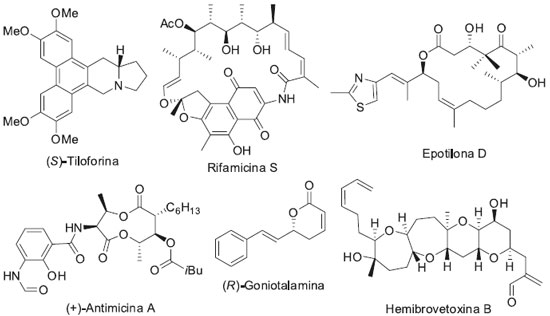
IDepartamento de Química, Universidade Federal de Rural de Pernambuco, Av. Dom Manoel de Medeiros, s/n, 52171-900, Recife - PE, Brasil Recebido em 25/05/2016 *e-mail: julianocrufino@pq.cnpq.br We describe the application of an amidoxime as catalyst in the synthesis of homoallylic alcohols from the allylation reaction of aldehydes with different features using potassium allyltrifluoroborate. The reaction was conducted with a catalytic amount of the appropriate amidoxime in a biphasic system (water:dichloromethane), open atmosphere and ambient temperature. The products were obtained in yields ranging from moderate to excellent in short reaction times without the need for further purifications for almost all examples. Additionally, the reaction has proved chemo- and regioselective. INTRODUÇAO As amidoximas sao importantes e versáteis blocos de construçao para a síntese de vários núcleos heterocíclicos como oxadiazol,1 triazol,2 quinazolinas,3 entre outros.4 Adicionalmente, estes compostos apresentam uma gama de aplicaçoes biológicas/farmacológicas5 e tecnológicas,6 em parte devido às amidoximas atuarem como pró-fármacos das amidinas7 e por poderem complexar com diferentes íons metálicos.8 Recentemente, foi descrito a síntese e o uso de uma resina amidoxímica complexada com Pd(II) como agente promotor da reaçao de formaçao de novas ligaçoes C-C em um acoplamento cruzado do tipo Suzuki.9 Dentre os inúmeros métodos para formaçao de novas ligaçoes C-C, o mais amplamente utilizado é a reaçao de alilaçao e crotilaçao de compostos carbonílicos.10 Os produtos resultantes desta reaçao sao os alcoóis homoalílicos, importantes precursores sintéticos na preparaçao de diversos produtos naturais e moléculas biologicamente ativas como, por exemplo, a (S)-Tiloforina,11 Rifamicina S,12 Epotilona D,13 (+)-Antimicina A,14 (R)-Goniotalamina15 e Hemibrovetoxina B16 (Figura 1).
Na literatura, é comum encontrar relatos da reaçao de alilaçao de compostos carbonílicos empregando-se espécies organometálicas alílicas de Li ou Mg,17 os quais apresentam uma elevada nucleofilicidade (comprometendo a quimiosseletividade da reaçao quando o composto carbonílico apresenta outros grupos funcionais) e sao instáveis ao ar e água (o que limita seu uso em condiçoes verdes). Uma alternativa a estas desvantagens é o uso dos sais de trifluoroboratos orgânicos neste tipo de reaçao. Estes reagentes sao estáveis ao ar e termoestáveis, de fácil manipulaçao e podem ser estocados por longos períodos sem apresentar degradaçao. Além disso, por serem sais, a sua utilizaçao possibilita o emprego da água como um dos solventes da reaçao.18 Adicionalmente, os subprodutos desta reaçao sao compostos inorgânicos de boro, atóxicos e solúveis em água.18 Embora a literatura cite diversas metodologias para a alilaçao de compostos carbonílicos empregando sais orgânicos de trifluoroboratos utilizando ou nao promotores ou catalisadores,19 esta reaçao apresenta alguns desafios relacionados ao emprego da água como cossolvente e controle da estereosseletividade, entre outros fatores. Diante do exposto, este trabalho descreve a síntese de diferentes álcoois homoalílicos através da reaçao de alilaçao de aldeídos por organotrifluoroborato de potássio mediada por aril-amidoximas utilizando um sistema bifásico.
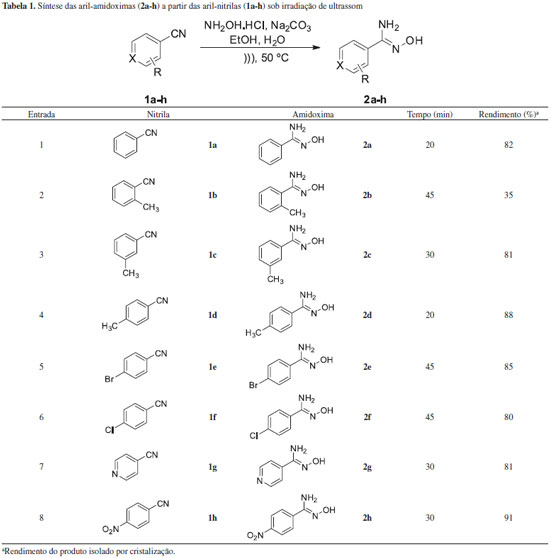
PARTE EXPERIMENTAL Generalidades Os solventes foram purificados de acordo com os métodos descritos na literatura.20 O hexano e o acetato de etila foram destilados com coluna de vigreaux, o diclorometano foi destilado sob CaH2, o etanol foi destilado sob magnésio metálico. Os solventes foram evaporados em um evaporador rotativo da Büchi Rotavapor modelo R-114 conectado a uma bomba de vácuo modelo KNF Neuberger, e o solvente remanescente foi eliminado utilizando uma bomba de alto vácuo da Edwards modelo RV3. Os espectros de ressonância magnética nuclear foram registrados em um espectrômetro Varian Unity Plus de 300 MHz ou em um espectrômetro Varian URMNS de 400 MHz. Os deslocamentos químicos estao expressos em ppm (partes por milhao) em relaçao ao pico residual do clorofórmio (7,25 ppm) ou dimetilsulfóxido (2,50 ppm) para os espectros de hidrogênio, em relaçao ao pico central do CDCl3 (77,0 ppm) ou DMSO-d6 (39,7 ppm) para os espectros de carbono. Todas as constantes de acoplamento (J) foram descritas em hertz (Hz). Os espectros de infravermelho foram registrados em um em espectrofotômetro de IV com transformada de Fourier no instrumento Bruker Modelo IFS66, sendo as amostras preparadas como filmes finos ou pastilhas de KBr. Os pontos de fusao foram realizados no Electro-thermal série IA 9100 Digital Melting Point. As purificaçoes por cromatografia em coluna foram efetuadas utilizando-se sílica-gel (230-400 mesh) seguindo o método descrito por Still e colaboradores.21 A cromatografia em camada delgada (CCD) foi realizada utilizando placas de sílica-gel contendo indicador fluorescente F254 da Merck. Para visualizaçao, as placas foram colocadas em luz ultravioleta, vapor de iodo, soluçao ácida (EtOH/H2SO4, 95:5) e soluçao de vanilina. Procedimento para preparaçao das aril-amidoximas 2a-h22 Em um balao de fundo redondo de 50 mL contendo a aril-nitrila apropriada 1a-h (2,5 mmol) dissolvida em etanol (5 mL), foi adicionada uma soluçao aquosa contendo cloridrato de hidroxilamina (518 mg; 7,5 mmol) e carbonato de sódio (392 mg; 3,7 mmol) dissolvido em 5 mL de água. Esta mistura reacional foi irradiada por ultrassom, a uma temperatura de 50 ºC, pelo tempo descrito na Tabela 1. O término da reaçao foi verificado através de cromatografia de camada delgada (CCD) e a mistura reacional foi concentrada por evaporaçao rotativa sob pressao reduzida. Ao sistema bifásico formado foi adicionado acetato de etila (50 mL) e a soluçao foi entao lavada com soluçao saturada de cloreto de amônio (2 x 25 mL). A fase orgânica foi separada, seca sob MgSO4 anidro e filtrada. O solvente foi removido por evaporaçao rotativa à pressao reduzida e cristalizado utilizando clorofórmio/hexano (90:10) como solventes para levar às aril-amidoximas (2a-h) desejadas em rendimentos que variaram de 35 a 91%.
Benzamidoxima (2a): Obtido 0,27 g (82%); sólido branco, P.F. 79-80 ºC (lit.22 P.F. 78,5 ºC); IV (Pastilha de KBr): ν 3453, 361, 3057, 2369, 2293, 1649, 1529, 1387, 927, 691 cm-1. RMN 1H (DMSO-d6, 400 MHz): δ 9,63 (s, 1H, OH); 7,69-7,67 (m, 2H, Haromático); 7,38-7,35 (m, 3H, Haromático); 5,80 (s, 2H, NH2). RMN 13C (DMSO-d6, 100 MHz): δ 151,0;133,5; 129,0; 128,2; 125,5. 2-Metilbenzamidoxima (2b): Obtido 0,13 g (35%); sólido branco, P.F. 145-147 ºC (lit.22 P.F. 145-146 ºC); IV (Pastilha de KBr): ν 3479, 3362, 2918, 2356, 1655, 1588, 1377, 905, 771 cm-1. RMN 1H (DMSO-d6, 400 MHz): δ 9,30 (s, 1H, OH); 7,29-7,26 (m, 2H, Haromático); 7,22-7,16 (m, 2H, Haromático); 5,71 (s, 2H, NH2); 2,35 (s, 3H, CH3). RMN 13C (DMSO-d6, 100 MHz): δ 152,4; 136,4; 134,4; 130,2; 129,0; 128,6; 125,5; 19,9. 3-Metilbenzamidoxima (2c): Obtido 0,30 g (81%); sólido branco, P.F. 91-92 ºC (lit.22 P.F. 91-91,5 ºC); IV (Pastilha de KBr): ν 3452, 3349, 3042, 2370, 2278, 1648, 1588, 1386, 933, 894, 707 cm-1. RMN 1H (DMSO-d6, 400 MHz): δ 9,57 (s, 1H, OH); 7,50 (sl, 1H, Haromático); 7,46 (d, 1H, J = 8,0 Hz, Haromático); 7,25 (dd, 1H, J = 8,0 e 7,2 Hz, Haromático); 7,17 (d, 1H, J = 7,2 Hz, Haromático); 5,75 (s, 2H, NH2); 2,31 (s, 3H, CH3). RMN 13C (DMSO-d6, 100 MHz): δ 151,1; 137,3; 133,5; 129,7; 128,1; 126,1; 122,7; 21,2. 4-Metilbenzamidoxima (2d): Obtido 0,33 g (88%); sólido branco, P.F. 145-146 ºC (lit.22 P.F. 146 ºC); IV (Pastilha de KBr): ν 3499, 3370, 3054, 1918, 1667, 1588, 1391, 937, 825, 751 cm-1. RMN 1H (DMSO-d6, 400 MHz): δ 9,52 (s, 1H, OH); 7,56 (d, 2H, J = 8,4 Hz, Haromático); 7,16 (d, 2H, J = 8,4 Hz, Haromático); 5,73 (s, 2H, NH2); 2,30 (s, 3H, CH3). RMN 13C (DMSO-d6, 100 MHz): δ 150,5; 138,0; 130,3; 128,4; 125,0; 20,5. 4-Bromobenzamidoxima (2e): Obtido 0,45 g (85%); sólido branco, P.F. 136-137 ºC (lit.22 P.F. 135-136 ºC); IV (Pastilha de KBr): ν 3474, 3356, 3150, 2361, 1657, 1587, 1388, 919, 835,740 cm-1. RMN 1H (DMSO-d6, 400 MHz): δ 9,73 (s, 1H, OH); 7,62 (d, 2H, J = 8,8 Hz, Haromático); 7,56 (d, 2H, J = 8,8 Hz, Haromático); 5,85 (s, 2H, NH2). RMN 13C (DMSO-d6, 100 MHz): δ 150,1; 132,7; 131,2; 127,6; 122,2. 4-Clorobenzamidoxima (2f): Obtido 0,34 g (80%); sólido branco, P.F. 133-135 ºC (lit.22 P.F. 133 ºC); IV (Pastilha de KBr): ν 3478, 3372, 3153, 1659, 1492, 1414, 1097, 1016, 965, 802, 736 cm-1. RMN 1H (DMSO-d6, 400 MHz): δ 9,73 (s, 1H, OH); 7,69 (d, 2H, J = 8,4 Hz, Haromático); 7,43 (d, 2H, J = 8,4 Hz, Haromático); 5,82 (s, 2H, NH2). RMN 13C (DMSO-d6, 100 MHz): δ 149,7; 133,2; 131,9; 127,9; 126,9. 4-Piridinoamidoxima (2g): Obtido 0,28 g (81%); sólido branco, P.F. 194-196 ºC (lit.22 P.F. 209 ºC); IV (Pastilha de KBr): ν 3459, 3312, 3101, 2464, 2364, 1633, 1599, 1420, 1387, 947, 664 cm-1. RMN 1H (DMSO-d6, 400 MHz): δ 10,11 (s, 1H, OH); 8,57 (d, 2H, J = 6,4 Hz, Hheteroaromático); 7,64 (d, 2H, J = 6,4 Hz, Hheteroaromático); 6,01 (s, 2H, NH2). RMN 13C (DMSO-d6, 100 MHz): δ 149,9; 149,1; 140,7; 119,8. 4-Nitrobenzamidoxima (2g): Obtido 0,41 g (91%); sólido amarelo, P.F. 168-170 ºC (lit.22 P.F. 169,2-169,9 ºC); IV (Pastilha de KBr): ν 3463, 3358, 3111, 1662, 1602, 1517, 1341, 927, 864, 704 cm-1. RMN 1H (DMSO-d6, 400 MHz): δ 10,13 (s, 1H, OH); 8,22 (d, 2H, J = 8,8 Hz, Haromático); 7,94 (d, 2H, J = 8,8 Hz, Haromático); 6,06 (s, 2H, NH2). RMN 13C (DMSO-d6, 100 MHz): δ 149,6; 147,6; 139,7; 126,6; 123,5. Procedimento para alilaçao de aldeídos por aliltrifluoroborato de potássio (3) catalisada pela 4-bromobenzamidoxima (2e)19 Em um balao de fundo redondo contendo o aldeído apropriado 4a-x (0,5 mmol) em diclorometano (2 mL), foi adicionada a 4-bromobenzamidoxima (2e, 5,3 mg; 0,025 mmol; 5 mol%), o aliltrifluoroborato de potássio (3, 89 mg; 0,6 mmol) e a água (2 mL). A mistura foi deixada sob agitaçao e monitorada por CCD, utilizando como sistema de eluiçao uma mistura de hexano/AcOEt (7:3). Ao término da reaçao foi adicionado AcOEt (15 mL) e a mistura foi lavada com uma soluçao saturada de bicarbonato de potássio (3 x 15 mL). A fase orgânica foi separada, seca sob MgSO4 anidro e filtrada. O solvente foi removido sob vácuo fornecendo os álcoois homoalílicos 5a-x sem a necessidade de purificaçao posterior. 1-(Naftalen-2-il)but-3-en-1-ol (5a): Obtido 90 mg (91%); RMN 1H (300 MHz, CDCl3) δ 7,86-7,80 (m, 4H, Haromático); 7,54-7,46 (m, 3H, Haromático); 5,84 (ddt, 1H, J = 17,1; 10,2 e 7,5 Hz, CH=CH2); 5,25-5,14 (m, 2H, CH=CH2); 4,91 (dd, 1H, J = 7,2 e 5,1 Hz, CHOH); 2,63-2,56 (m, 2H, CHCH2); 2,10 (sl, 1H, OH). RMN 13C (75 MHz, CDCl3) δ 141,1; 134,2; 133,2; 132,8; 128,1; 127,8; 127,5; 126,0; 125,8; 124,2; 123,9; 118,4; 73,3; 43,6. 1-Fenil-but-3-en-1-ol (5b): Obtido 60 mg (81%); RMN 1H (300 MHz, CDCl3) δ 7,36-7,23 (m, 5H, Haromático); 5,87-5,72 (m, 1H, CH=CH2); 5,18-5,11 (m, 2H, CH=CH2); 4,73 (dd, 1H, J = 7,5 e 5,4 Hz, CHOH); 2,54-2,47 (m, 2H, CHCH2); 2,00 (sl, 1H, OH). RMN 13C (75 MHz, CDCl3) δ 143,7; 134,3; 128,2; 127,3; 125,7; 118,0; 73,2; 43,5. 1-4-tolylbut-3-en-1-ol (5c): Obtido 75 mg (93%), RMN 1H (300 MHz, CDCl3): δ 7,23 (d, 2H, J = 7,8 Hz, Haromático); 7,16 (d, 2H, J = 7,8 Hz, Haromático); 5,92-5,77 (m, 1H, CH=CH2); 5,23-5,14 (m, 2H, CH=CH2); 4,74 (t, 1H, J = 6,6 Hz, CHOH); 2,55-2,49 (m, 2H, CHCH2); 2,38 (s, 3H, CH3); 1,79 (sl, 1H, OH). RMN 13C (75 MHz, CDCl3) δ 141,2; 137,5; 134,9; 129,0; 125,7; 118,6; 73,5; 44,1; 21,4. 1-(4-Metoxifenil)but-3-en-1-ol (5d): Obtido 75 mg (84%); RMN 1H (300 MHz, CDCl3) δ 7,78 (d, 2H, J = 9,0 Hz, Haromático); 7,38 (d, 2H, J = 9,0 Hz, Haromático); 6,29 (ddt, 1H, J = 16,8; 9,9 e 6,6 Hz, CH=CH2); 5,68-5,58 (m, 2H, CH=CH2); 5,17 (t, 1H, J = 6,6 Hz, CHOH); 4,29 (s, 3H, OMe); 3,02-2,95 (m, 2H, CHCH2); 2,50 (sl, 1H, OH). RMN 13C (75 MHz, CDCl3) δ 159,3; 136,4; 134,9; 127,4; 116,5; 114,1; 74,3; 55,6; 44,1. 1-(3-Metoxifenil)but-3-en-1-ol (5e): Obtido 78 mg (88%); RMN 1H (300 MHz, CDCl3) δ 7,30 (dd, 1H, J = 8,1 e 7,8 Hz, Haromático); 6,98-6,94 (m, 2H, Haromático), 6,84 (ddd, 1H, J= 8,1; 2,7 e 1,2 Hz, Haromático); 5,85 (ddt, 1H, J = 17,1; 10,2 e 7,5 Hz, CH=CH2); 5,23-5,15 (m, 2H, CH=CH2); 4,74 (dd, 1H, J = 7,5 e 5,4 Hz, CHOH); 3,83 (s, 3H, OMe); 2,56-2,50 (m, 2H, CHCH2); 2,06 (sl, 1H, OH). RMN 13C (75 MHz, CDCl3) δ 159,9; 145,9; 134,7; 129,7; 118,5; 118,4; 113,2; 111,6; 73,5; 55,5; 44,0. 1-(2-Metoxifenil)but-3-en-1-ol (5f): Obtido 76 mg (86%); RMN 1H (300 MHz, CDCl3) δ 7,32 (dd, 1H, J = 7,5 e 1,8 Hz, Haromático); 7,27 (td, 1H, J = 7,5 e 1,8 Hz, Haromático); 6,94 (td, 1H, J = 8,4 e 1,2 Hz, Haromático); 6,86 (d, 1H, J = 8,4 Hz, Haromático); 5,84 (ddt, J = 17,1; 10,2 e 7,5 Hz, 1H, CH=CH2); 5,16-5,07 (m, 2H, CH=CH2); 4,94 (dd, J = 8,1 e 5,1 Hz, 1H, CHOH); 3,83 (s, 3H, OMe); 2,63-2,42 (m, 2H, CHCH2); 2,40 (sl, 1H, OH). RMN 13C (75 MHz, CDCl3) δ 156,2; 136,1; 131,6; 128,1; 126,6; 120,5; 117,4; 110,2; 69,4; 55,1; 41,7. 1-(4-Nitrofenil)but-3-en-1-ol (5g): Obtido 76 mg (79%); RMN 1H (300 MHz, CDCl3) δ 8,20 (d, 2H, J = 8,7 Hz, Haromático); 7,53 (d, 2H, J = 8,7 Hz, Haromático); 5,85-5,71 (m, 1H, CH=CH2); 5,22-5,16 (m, 2H, CH=CH2); 4,86 (dd, 1H, J = 7,8 e 4,5 Hz, CHOH); 2,61-2,39 (m, 2H, CHCH2); 2,15 (sl, 1H, OH). RMN 13C (75 MHz, CDCl3) δ 151,1; 147,1; 133,1; 126,5; 123,5; 119,5; 72,1; 43,8. 1-(3-Nitrofenil)but-3-en-1-ol (5h): Obtido 72 mg (75%); RMN 1H (300 MHz, CDCl3) δ 8,24 (t, 1H, J = 1,5 Hz, Haromático); 8,13 (ddd, 1H, J = 8,1; 2,1 e 0,9 Hz, HAr); 7,69 (d, 1H, J = 8,1 Hz, Haromático); 7,53 (t, 1H, J = 8,1 Hz, Haromático); 5,86-5,71 (m, 1H, CH=CH2); 5,22-5,14 (m, 2H, CH=CH2); 4,86 (dd, 1H, J = 8,1 e 5,1 Hz, CHOH); 2,62-2,42 (m, 2H, CHCH2); 2,17 (sl, 1H, OH). RMN 13C (75 MHz, CDCl3) δ 147,8; 145,4; 132,7; 131,5; 128,8; 121,9; 120.3; 119,1; 71,5; 43,4. 1-(2-Nitrofenil)but-3-en-1-ol (5i): Obtido 87 mg (90%); RMN 1H (300 MHz, CDCl3) δ 7,93 (dd, 1H, J = 8,1 e 1,2 Hz, Haromático); 7,84 (dd, 1H, J = 8,1 e 1,5 Hz, Haromático); 7,68 (td, 1H, J = 8,1 e 1,2 Hz, Haromático); 7,43 (td, 1H, J = 8,1 e 1,2 Hz, Haromático); 5,97-5,83 (m, 1H, CH=CH2); 5,32 (dd, 1H, J = 8,4 e 3,6 Hz, CHOH); 5,24-5,18 (m, 2H, CH=CH2), 2,76-2,67 (m, 1H, CHCH2), 2,47-2,36 (m, 2H, CHCH2 e OH). RMN 13C (75 MHz, CDCl3) δ 148,0; 139,6; 134,3; 133,8; 128,5; 128,4; 124,7; 119,4; 68,7; 43,2. 1-(2-Fluorofenil)but-3-en-1-ol (5j): Obtido 49 mg (59%); RMN 1H (300 MHz, CDCl3) δ 7,42 (t, 1H, J = 7,6 Hz, Haromática); 7,21-7,14 (m, 1H, Haromática); 7,08 (t, 1H, J = 7,6 Hz, Haromático); 6,96-6,91 (m, 1H, Haromático); 5,81-5,70 (m, 1H, CH=CH2); 5,12-5,07 (m, 2H, CH=CH2); 5,02 (dd, 1H, J = 7,6 e 4,4 Hz, CHOH); 2,56-2,39 (m, 2H, CHCH2); 1,82 (sl, 1H, OH). RMN 13C (75 MHz, CDCl3) δ 160,0 (d, JC-F = 183,5 Hz); 134,3; 131,1 (d, JC-F = 9,9 Hz); 129,1 (d, JC-F = 6,4 Hz); 127,5; 119,0; 115,5 (d, JC-F = 16.3 Hz); 67,5; 42,9. 1-(4-Fluorofenil)but-3-en-1-ol (5k): Obtido 33 mg (40%); RMN 1H (300 MHz, CDCl3) δ 7,29-7,24 (m, 2H, Haromática); 6,97 (t, 2H, J = 8,4 Hz, Haromática); 5,80-5,66 (m, 1H, CH=CH2); 5,13-5,08 (m, 2H, CH=CH2); 4,67 (dd, 1H, J = 7,2 e 5,7 Hz, CHOH); 2,51-2,39 (m, 2H, CHCH2); 1,86 (sl, 1H, OH). RMN 13C (75 MHz, CDCl3) δ 162,5 (d, JC-F = 182,9 Hz); 139,9; 134,4; 127,7 (d, JC-F = 6,4 Hz); 119,0; 115.5 (d, JC-F = 15,7 Hz); 72,9; 44,3. 1-(4-Clorofenil)but-3-en-1-ol (5l): Obtido 81 mg (89%); RMN 1H (300 MHz, CDCl3) δ 7,27-7,18 (m, 4H, Haromático); 5,78-5,61 (m, 1H, CH=CH2); 5,13-5,04 (m, 2H, CH=CH2); 4,66 (dd, J = 7,5 e 5,4 Hz, CHOH); 2,48-2,31 (m, 2H, CHCH2); 2,04 (sl, 1H, OH). RMN 13C (75 MHz, CDCl3) δ 142,2; 133,9; 131,0; 128,4; 127,1; 118,8; 72,5; 43,8. 1-(4-Bromofenil)but-3-en-1-ol (5m): Obtido 82 mg (73%); RMN 1H (300 MHz, CDCl3) δ 7,42 (d, 2H, J = 8,7 Hz, Haromático); 7,18 (d, 2H, J = 8,7 Hz, Haromático); 5,79-5,63 (m, 1H, CH=CH2); 5,14-5,05 (m, 2H, CH=CH2); 4,65 (dd, 1H, J = 7,8 e 5,4 Hz, CHOH); 2,49-2,33 (m, 2H, CHCH2); 1,99 (sl, 1H, OH). RMN 13C (75 MHz, CDCl3) δ 143,1; 134,3; 131,8; 127,9; 121,6; 119,3; 72,9; 44,2. 1-(5-Bromo-2-metoxifenil)but-3-em-1-ol (5n): Obtido 104 mg (82%); RMN 1H (400 MHz, CDCl3) δ 7,49 (d, 1H, J = 2,4 Hz, Haromático); 7,33 (dd, 1H, J = 8,4 e 2,4 Hz, Haromático); 6,74 (d, 1H, J = 8,4 Hz, Haromático); 5,88-5,78 (m, 1H, CH=CH2); 5,17-5,12 (m, 2H, CH=CH2); 4,94 (dd, 1H, J = 8,0 e 4,4 Hz, CHOH); 3,83 (s, 3H, OMe); 2,60-2,53 (m, 1H, CHCH2); 2,46-2,38 (m, 1H, CHCH2). RMN 13C (100 MHz, CDCl3) δ 155,5; 134,8; 134,4; 131,0; 129,8; 118,4; 113,4; 112,3; 68,7; 55,8; 42,0. 1-(Furan-2-ilbut-3-en-1-ol (5o): Obtido 42 mg (61%); RMN 1H (300 MHz, CDCl3) δ 7,39 (dd, 1H, J = 1,8 e 0,9 Hz, Hheteroaromático); 6,33 (dd, 1H, J = 2,1 e 1,8 Hz, Hheteroaromático); 6,26 (dd, 1H, J = 2,1 e 0,9 Hz, Hheteroaromático); 5,82 (ddt, 1H, J = 17,1; 10,2 e 6,9 Hz, CH=CH2); 5,23-5,12 (m, 2H, CH=CH2); 4,75 (dd, 1H, J = 6,6 e 6,3 Hz, CHOH); 2,66-2,60 (m, 2H, CHCH2); 2,15 (sl, 1H, OH). RMN 13C (75 MHz, CDCl3) δ 155,9; 141,9; 133,6; 118,6; 110,1; 106,0; 66,9; 40,0. (E)-1-Fenilhexa-1,5-dien-3-ol (5p): Obtido 80 mg (92%); RMN 1H (300 MHz, CDCl3) δ 7,41-7,20 (m, 5H, Haromático); 6,62 (dd, 1H, J = 15,9 e 1,2 Hz, PhCH=CH); 6,23 (dd, 1H, J = 15,9 e 6,3 Hz, PhCH=CH); 5,86 (ddt, 1H, J = 17,1; 10,2 e 6,9 Hz, CH=CH2); 5,22-5,14 (m, 2H, CH=CH2); 4,39-4,33 (m, 1H, CHOH); 2,50-2,34 (m, 2H, CHCH2); 1,78 (sl, 1H, OH). RMN 13C (75 MHz, CDCl3) δ 136,5; 133,9; 131,4; 130,2; 128,4; 127,5; 126,3; 118,3; 71,6; 41,8. 2-Metilhex-5-en-3-ol (5q): Obtido 34 mg (59%); RMN 1H (300 MHz, CDCl3) δ 5,82 (dddd, J = 17,1; 10,8; 8,1 e 6,3 Hz, 1H, CH=CH2); 5,17-5,10 (m, 2H, CH=CH2); 3,42-3,36 (m, 1H, CHOH); 2,36-2,26 (m, 2H, CHCH2); 2,16-2,05 (m, 1H, CH3CH); 1,67 (sl, 1H, OH); 0,93 (d, 6H, J = 3,9 Hz, CH3CH). RMN 13C (75 MHz, CDCl3) δ 135,8, 118,3, 75,7, 39,2, 33,4, 19,1, 17,9. Non-1-en-4-ol (5r): Obtido 44 mg (62%); RMN 1H (300 MHz, CDCl3) δ 5,88-5,75 (m, 1H, CH=CH2); 5,28-5,09 (m, 2H, CH=CH2); 3,69-3,58 (m, 1H, CHOH); 2,35-2,24 (m, 2H, CHCH2); 2,18-2,07 (m, 2H, CHOH); 1,65 (sl, 1H, OH); 150-1,24 (m, 6H, CH3CH2CH2CH2); 0,87 (t, 6H, J = 6,3 Hz, CH3CH2). RMN 13C (75 MHz, CDCl3) δ 134,8; 118,0; 70,6; 41,9; 36,7; 31,8; 25,3; 22,7, 14,0. Acido 4-(1-hidroxibut-3-enil)benzoico (5s): Obtido 72 mg (75%); RMN 1H (400 MHz, CDCl3) δ 8,10 (d, 2H, J = 7,6 Hz, Haromático); 7,48 (d, 2H, J = 7,6 Hz, Haromático); 5,86-5,76 (m, 1H, CH=CH2); 5,21-5,17 (m, 2H, CH=CH2); 4,84 (dd, 1H, J = 8,0 e 4,8 Hz, CHOH); 2,61-2,45 (m, 2H, CHCH2); 1,26 (sl, 1H, OH). RMN 13C (100 MHz, CDCl3) δ 172,0; 150,1; 133,9; 130,6; 128,7; 126,1; 119,4; 73,0; 44,1. Metil 4-(1-hidroxibut-3-enil)benzoato (5t): Obtido 79 mg (77%); RMN 1H (400 MHz, CDCl3) δ 8,01 (d, 2H, J = 7,2 Hz, Haromático); 7,42 (d, 2H, J = 7,2 Hz, Haromático); 5,84-5,73 (m, 1H, CH=CH2); 5,19-5,15 (m, 2H, CH=CH2); 4,80 (dd, 1H, J = 7,6 e 5,2 Hz, CHOH); 3,91 (s, 3H, OMe); 2,56-2,43 (m, 2H, CHCH2); 2,19 (sl, 1H, OH). RMN 13C (100 MHz, CDCl3) δ 167,2; 149,2; 134,1; 130,0; 129,5; 126,0; 119,2; 73,0; 52,3; 44,1. 4-(1-hidroxibut-3-enil)benzonitrila (5u): Obtido 80 mg (93%); RMN 1H (400 MHz, CDCl3) δ 7,62 (d, 2H, J = 8,4 Hz, Haromático); 7,46 (d, 2H, J = 8,4 Hz, Haromático); 5,81-5,72 (m, 1H, CH=CH2); 5,18-5,14 (m, 2H, CH=CH2); 4,80 (dd, 1H, J = 8,4 e 4,4 Hz, CHOH); 2,56-2,49 (m, 1H, CH2CH=CH2); 2,47-2,41 (m, 1H, CH2CH=CH2); 2,27 (sl, 1H, OH). 13C NMR (100 MHz, CDCl3) δ 149,3; 133,1; 132,2; 128,7; 119,7; 119,1; 111,4; 72,6; 44,1. 1-(4-(1-hidroxibut-3-enil)fenil)etanona (5v): Obtido 82 mg (86%); RMN 1H (400 MHz, CDCl3) δ 7,93 (d, 2H, J = 8,0 Hz, Haromático); 7,44 (d, 2H, J = 8,0 Hz, Haromático); 5,84-5,74 (m, 1H, CH=CH2); 5,19-5,14 (m, 2H, CH=CH2); 4,81 (dd, 1H, J = 8,0 e 5,2 Hz, CHOH); 2,59 (s, 3H, CH3); 2,58-2,43 (m, 2H, CH2CH=CH2); 2,21 (sl, 1H, OH). RMN 13C (100 MHz, CDCl3) δ 198,1; 149,4; 133,6; 128,8; 126,2; 119,3; 72,9; 44,1; 26,9. 1-(3-((tert-butildimetilsilil)oxi)-4-metoxifenil)but-3-en-1-ol (5w): Obtido 249,6 mg (81%); RMN 1H (400 MHz, CDCl3) δ 6,92 (s, 1H, Haromático); 6,73 (sl, 2H, Haromático); 5,79-5,69 (m, 1H, CH=CH2); 5,14 (d, 1H, J = 4 Hz, CHOH); 5,00-4,93 (m, 2H, CH=CH2); 4,50-4,46 (m, 1H, CHOH); 3,70 (s, 3H, OMe); 2,40-2,27 (m, 2H, CH2CH=CH2); 0,93 (s, 9H, CH3); 0,09 (s, 6H, CH3); RMN 13C (100 MHz, CDCl3) δ 150,0; 142,9; 139,5; 135,8; 119,7; 118,0; 116,4; 110,1; 72,1; 55,3; 43,8; 25,6; 18,1; -4,8.
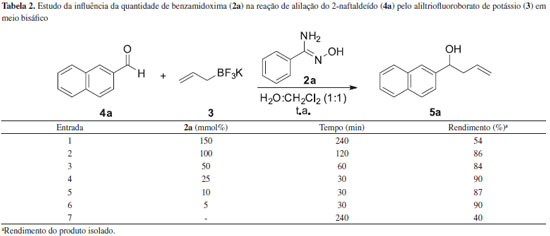
RESULTADOS E DISCUSSAO A primeira etapa do trabalho consistiu na síntese das aril-amidoximas (2a-h) a partir da reaçao das respectivas aril-nitrilas (1a-h) com cloridato de hidroxilamina, carbonato de sódio em meio hidroetanólico sob irradiaçao de ultrassom.23 Os resultados estao sumarizados na Tabela 1. De acordo com a Tabela 1, quando foram utilizadas nitrilas aromáticas contendo o grupo metila no anel, foi observado que dependendo da posiçao deste grupo (orto-, meta-, para-) houve um aumento no rendimento e uma diminuiçao no tempo reacional (Tabela 1, entradas 2, 3 e 4). Uma provável explicaçao pode ser atribuída ao impedimento estérico causado pelo grupo metila, o que dificultaria a aproximaçao do nucleófilo (NH2OH) ao carbono do grupo nitrila. Quando nitrilas contendo grupos retiradores de densidade eletrônica foram utilizadas, as respectivas amidoximas 2e, 2f e 2g foram obtidas em bons rendimentos (Tabela 1, entradas 5, 6, e 8). Adicionalmente, quando uma nitrila heteroaromática foi utilizada, a amidoxima correspondente (2g) foi obtida em um rendimento de 81% após 30 min (Tabela 1, entrada 7). Uma vez que o aliltrifluoroborato de potássio (3) foi obtido comercialmente, foi iniciado o estudo da viabilidade da aplicaçao das amidoximas como agentes de transferência de fase em reaçoes de alilaçao. Desse modo, a primeira variável estudada foi a quantidade de benzamidoxima (2a) a ser empregada nesta reaçao. Para isso, o 2-naftaldeído (4a), a benzamidoxima (2a) e o aliltrifluoroborato de potássio (3), utilizados como substratos modelo, foram tratados à temperatura ambiente em um sistema bifásico H2O:CH2Cl2 na proporçao de 1:1. Todos os experimentos foram acompanhados por cromatografia de camada delgada (CCD). Os resultados estao descritos na Tabela 2.
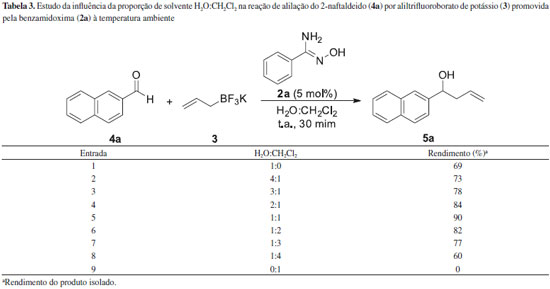
De acordo com a Tabela 2, quando a reaçao foi conduzida sem a presença da benzamixodima (2a) nao houve o consumo completo dos reagentes de partida mesmo após um intervalo de tempo de 240 min (Tabela 2, entrada 7). Contudo, nos casos em que foi utilizada a benzamidoxima (2a) a reaçao foi completa (Tabela 2, entradas 1-6). É interessante notar que a reduçao da quantidade de benzamidoxima (2a) de 100 para 5 mmol% levou ao produto desejado, 5a, em um rendimento de 90% após 30 minutos (Tabela 2, entrada 6), demonstrando a capacidade da benzamidoxima (2a) de atuar possivelmente como um catalisador de transferência de fase. Um baixo rendimento foi observado quando foram utilizados 150 mmol% de benzamidoxima (2a) (Tabela 2, entrada 1). Em seguida foi estudado o efeito do solvente na reaçao, em que diferentes proporçoes de H2O e CH2Cl2 foram avaliadas. Os resultados estao descritos na Tabela 3.
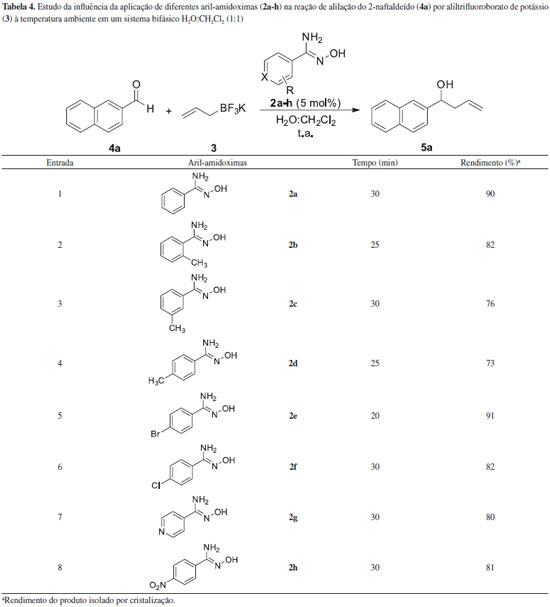
De acordo com a Tabela 3, quando apenas CH2Cl2 foi utilizado como solvente, nenhum produto de reaçao foi observado (Tabela 3, entrada 9), possivelmente devido à baixa solubilidade do alil-trifluoroborato de potássio (3) neste solvente. Quando apenas H2O foi utilizada na reaçao, o produto foi obtido em um rendimento de 69% (Tabela 3, entrada 1). O melhor resultado foi observado quando um sistema bifásico H2O:CH2Cl2 foi utilizado, sendo que o produto desejado foi obtido em 90% de rendimento (Tabela 3, entrada 5). O estudo do efeito de diferentes aril-amidoximas (2a-h) na reaçao de alilaçao também foi realizado e os resultados estao descritos na Tabela 4.
De acordo com a Tabela 4, todas as aril-amidoximas 2a-h atuaram como catalisadores na reaçao de alilaçao, no entanto, o composto 2e levou ao produto desejado em menor tempo reacional (Tabela 4, entrada 5). Diante destes resultados, foi realizado um estudo baseado na espectroscopia na regiao do Ultravioleta-Vísivel (UV-vis) (Figura 2), a fim de fornecer indícios da açao do composto 2e como agente de transferência de fase.
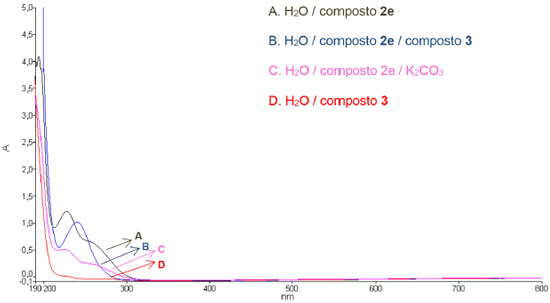 Figura 2. Espectros de absorçao na regiao ultravioleta-visível de (A) Soluçao aquosa do composto 2e; (B) Soluçao aquosa dos compostos 2e e 3; (C) Soluçao aquosa do composto 2e e K2CO3; (D) Soluçao aquosa do composto 3
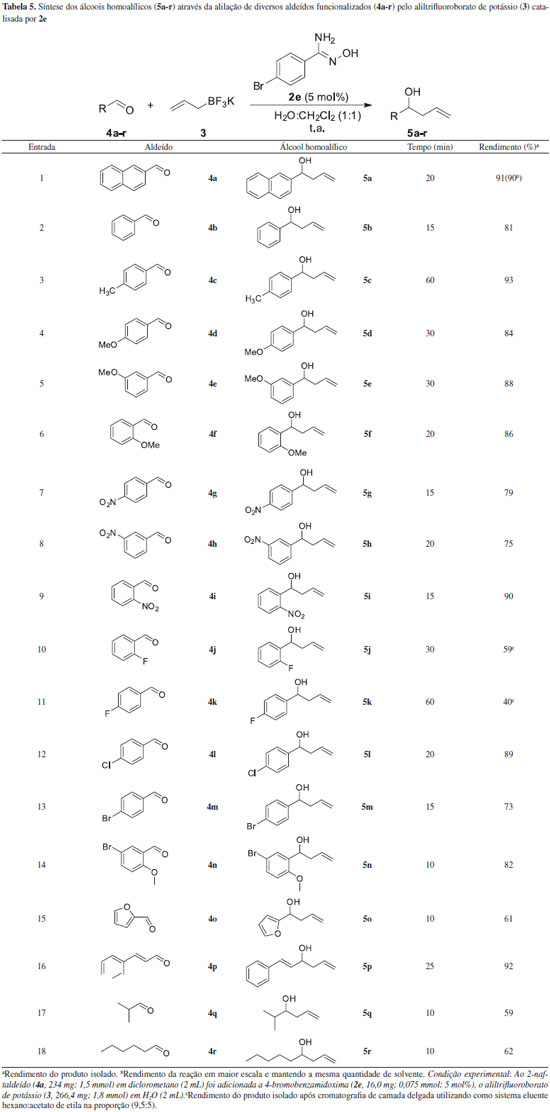
De acordo com a Figura 2, o composto 2e apresentou duas bandas de absorçao (em 228 e 253 nm, referente às transiçoes n→π* e π→π*, respectivamente - Soluçao A), enquanto que o composto 3 nao apresentou absorçao na regiao de estudo (Soluçao D). Em contrapartida, no espectro de UV-vis da soluçao aquosa contendo os compostos 3 e 2e (Soluçao B, Figura 2) houve a supressao da transiçao n→π* e deslocamento batocrômico da transiçao π→π* para a regiao de 240 nm, implicando em uma possível interaçao da funçao química amidoxima do composto 2e com o potássio do composto 3. Apesar dessa evidencia, a literatura descreve que as bandas de absorçao de substâncias ácidas ou básicas podem variar significativamente dependendo do valor do pH.24 Devido a isto, foi realizado o espectro de UV-vis da soluçao aquosa contendo o composto 2e e K2CO3 (Soluçao C, Figura 2), no entanto, nao foi observado mudança no perfil de absorçao quando comparado ao da soluçao aquosa do composto 2e (Soluçao A, Figura 2). Com este resultado preliminar é possível conjecturar que as amidoximas podem atuar, provavelmente, como agente de transferência de fase, porém, outros experimentos sao necessários. Diante dos resultados descritos nas Tabelas 2, 3 e 4, a melhor condiçao para promover a reaçao de alilaçao foi observada quando foi utilizado composto 2e (5 mol%) em um sistema bifásico H2O:CH2Cl2 (1:1), sendo que o produto desejado foi obtido após 20 min. Esta condiçao foi entao aplicada a outros aldeídos visando a síntese dos álcoois homoalílicos correspondentes. Os resultados estao descritos na Tabela 5.
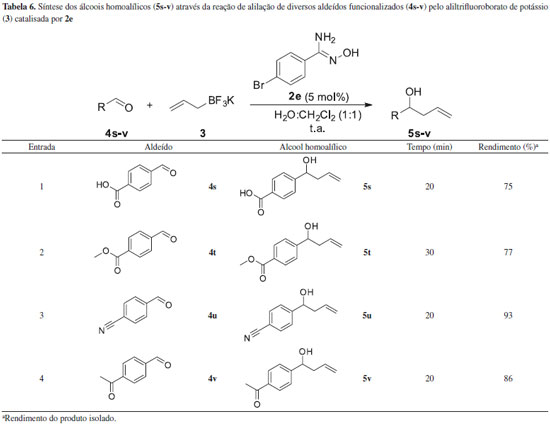
De acordo com a Tabela 5, o emprego do composto 2e na reaçao de alilaçao de diferentes aldeídos levou aos correspondentes álcoois homoalílicos (5a-r) em rendimentos que variaram de moderados a excelentes em intervalos de tempo de 10 a 60 minutos. A alilaçao de aldeídos contendo grupos doadores de densidade eletrônica no anel, compostos 4c-f, levou aos alcoóis homoalílicos 5c-f em elevados rendimentos (Tabela 5, entradas 3-6). O mesmo foi constatado quando foram utilizados aldeídos contendo grupos retiradores de densidade eletrônica no anel, compostos 4g-i (Tabela 5, entradas 7-9). Quando foram utilizados substratos halogenados, compostos 4j-n, foi constatado que o aumento da eletronegatividade implicou em uma elevaçao do tempo reacional, ou seja, para os aldeídos (4-fluor-, 4-cloro- e 4-bromo-)benzaldeído os tempos reacionais foram 60, 20 e 15 minutos, respectivamente (Tabela 5, entradas 10-14). Quando o aldeído heterocíclico 4o foi submetido às condiçoes reacionais de alilaçao, o álcool homoalílico 5o foi obtido em moderado rendimento (Tabela 5, entrada 15). A reaçao de alilaçao de aldeídos alifáticos 4q-r levou à formaçao dos álcoois homoalílicos 5q-r com rendimentos de 59 a 62% (Tabela 5, entrada 17 e 18), sendo este baixo rendimento atribuído, de acordo com a literatura,25 a volatilidades dos produtos de partida 5q-r. Adicionalmente, este método mostrou-se quimiosseletivo, pois foi observado apenas produto de adiçao 1,2 ao composto 4p, em bom rendimento após 25 minutos (Tabela 5, entrada 11). Devido a esse resultado foi avaliada a quimiosseletividade da reaçao de alilaçao utilizando aldeídos contendo outras funcionalidades mais reativas quando comparadas aos exemplos da Tabela 5. Os resultados estao sumarizados na Tabela 6.
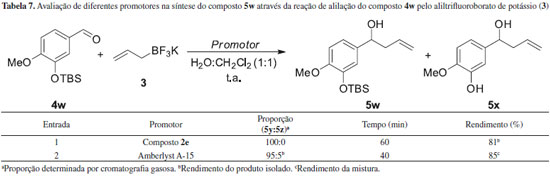
De acordo com a Tabela 6 observou-se que a reaçao foi quimiosseletiva, uma vez que a adiçao do grupo alil apenas ocorreu na funçao aldeído apesar dos substratos apresentarem outras funcionalidades. Adicionalmente, em todos os casos os álcoois homoalílicos 5s-v foram obtidos com rendimentos que variaram de 77 a 93% após um tempo reacional que variou de 20 a 30 minutos. Finalmente, para avaliar se o método era seletivo na presença de um substrato contendo um grupo protetor, foi realizada a reaçao de alilaçao do composto 4w empregando tanto a amidoxima 2e quanto a amberlyst A-15. A amberlyst A-15 foi escolhida, uma vez que o nosso grupo de pesquisa propôs recentemente o seu emprego como promotor heterogêneo da alilaçao.25 Os resultados estao sumarizados na Tabela 7.
De acordo com a Tabela 7, a reaçao de alilaçao do composto 4w empregando o composto 2e levou à formaçao exclusiva do álcool homoalílico 5w quando comparado à reaçao utilizando a amberlyst A-15, apesar da necessidade de um maior tempo reacional.
CONCLUSAO Neste trabalho foi demonstrada a eficácia da utilizaçao de aril-amidoximas como catalisadores de transferência de fase na reaçao de alilaçao de aldeídos. A partir do método desenvolvido, os álcoois homoalílicos desejados foram obtidos em rendimentos que variaram de moderados a excelentes, em curtos períodos de tempo, utilizando um sistema bifásico (água:diclorometano) e à temperatura ambiente. Adicionalmente, a reaçao demonstrou ser quimiosseletiva, podendo ser aplicada como método complementar às demais metodologias já existentes na literatura visando a síntese de moléculas de maior complexidade estrutural.
MATERIAL SUPLEMENTAR Os espectros de RMN 1H e 13C de todos os compostos sintetizados neste trabalho estao disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Os autores agradecem ao CNPq (447361/2014-7), ao PRONEM (APQ-0476-1.06/14) pelo suporte financeiro e à CAPES pela bolsa concedida. A Central Analítica do Departamento de Química Fundamental da Universidade Federal de Pernambuco pelas análises dos compostos sintetizados. Ao aluno de mestrado C. R. Dantas pela montagem do resumo gráfico.
REFERENCIAS 1. Neves Filho, R. A. W.; da Silva Alves, D. C. B.; dos Anjos, J. V.; Srivastava, R. M.; Synth. Commun. 2013, 43, 2596; Cai, J.; Wei, H. T.; Hong, K. H.; Wu, X. Q.; Cao, M.; Zong, X.; Li, L. S.; Sun, C. L.; Chen, J. Q.; Ji, M.; Eur. J. Med. Chem. 2015, 96, 1; Barros, C. J. P.; de Souza, Z. C.; de Freitas, J. J. R.; da Silva, P. B. N.; Militao, G. C. G.; da Silva, T. G.; Freitas, J. C. R.; de Freitas Filho, J. R.; J. Chil. Chem. Soc. 2014, 59, 2359; de Freitas, J. J. R.; Freitas, J. C. R.; da Silva, L. P.; de Freitas, J. R.; Kimura, G. Y. V.; Srivastava, R. M.; Tetrahedron Lett. 2007, 48, 6195; Jiang, C.-S.; Fu, Y.; Zhang, L. Gong, J.-X.; Wang, Z.-Z.; Xiao, W.; Zhang, H.-Y.; Guo, Y.-W.; Bioorg. Med. Chem. Lett. 2015, 25, 216. 2. Xu, H.; Ma, S.; Xu, Y.; Bian, L.; Ding, T.; Fang, X.; Zhang, W.; Ren, Y.; J. Org. Chem. 2015, 80, 1789; Khalil, K. D.; Al-Matar, H. M.; Molecules 2012, 17, 12225. 3. Adib, M., Ansari, S.; Mohammadi, A.; Bijanzadeh, H. R.; Tetrahedron Lett. 2010, 51, 30. 4. Yavolovskii, A. A.; Grishchuk, L. V.; Rakipov, I. M.; Stepanov, D. E.; Ivanov, Y. E.; Kamalov, G. L.; Chem. Heterocycl. Compd. 2013, 48, 1487; Bassayouni, F. A.; Saleh, T. S.; El-Hefnawi, M. M.; El-Moez, S. I. A.; El-Senousy, W. M.; Abdel-Rehim, M. E.; Arch. Pharm. Res. 2012, 35, 2063; Clement, B.; Drug Metab Rev. 2002, 34, 565. 5. Karamtzioti, P.; Papastergiou, A.; Stefanakis, J. G.; Koumbis, A. E.; Anastasiou, I.; Koffa, M.; Fylaktakidou, K. C.; Med. Chem. Commun. 2015, 6, 719; Kalvinsh, I.; Abele, R.; Golomba, L.; Rubina, K.; Visnevska, J.; Beresneva, T.; Shestakova, I.; Jaschenko, E.; Bridane, V.; Abele, E.; Heterocycl. Lett. 2011, 1, 47; Oresmaa, L.; Kotikoski, H.; Haukka, M.; Oksala, O.; Pohjala, E.; Vapaatalo, H.; Moilanen, E.; Vainiotalo, P.; Aulaskari, P.; Eur. J. Med. Chem. 2006, 41, 1073; Bouhlel, A.; Curti, C.; Dumètre, A.; Laget, M.; Crozet, M. D.; Azas, N.; Vanelle, P.; Bioorg. Med. Chem. 2010, 18, 7310; Fylaktakidou, K. C.; Hadjipavlou-Litina, D. J.; Litinas, K. E.; Varella, E. A.; Nicolaides, D. N.; Curr. Pharm. Des. 2008, 14, 1001; Doulou, I.; Kontogiorgis, C.; Koumbis, A. E.; Evgenidou, E.; Hadjipavlou-Litina, D.; Fylaktakidou, K. C.; Eur. J. Med. Chem. 2014, 80, 145. 6. Hu, C. G.; Wang, S. L.; Wu, Z. Z.; Zao, Z.; Li, G.; Revista Materia 2014, 19, 350; Mahurin, S. M.; Gorka, J.; Nelson, K. M.; Mayes, R. T.; Dai, S.; Carbon 2014, 67, 457; Shoushtari, A. M.; Zargaran, M.; Abdouss, M.; J. Appl. Polym. Sci. 2006, 101, 2202; Zulfiqar, S.; Karadas, F.; Park, J.; Deniz, E.; Stucky, G. D.; Jung, Y.; Atilhan, M.; Yavuz, C. T.; Energ. Environ. Sci. 2011, 4, 4528; Huang, F.; Xu, Y.; Liao, S.; Yang, D.; You-Lo, Q.; Wei, Q.; Materials 2013, 6, 969. 7. Saulter, J. Y.; Kurian, J. R.; Trepanier, L. A.; Tidwell, R. R.; Bridges, A. S.; Boykin, D. W.; Stephens, C. E.; Anbazhagan, M.; Hall, J. E.; Drug Metab. Dispos. 2005, 33, 1886; Cohrs, B.; Zhao, Y.; Lutzen, U.; Culman, J.; Clement, B.; Zuhavra, M.; Int. J. Pharm. 2014, 477, 167. 8. Metwally, S. S.; Ayoub, R. R.; Aly, H. F.; Sep. Sci. Technol. 2013, 48, 1830; Liu, X.; Chen, H.; Wang, C. H.; Qu, R. J.; Ji, C. N.; Sun, C. M.; Xu, Q.; Polymer. Adv. Tech. 2011, 22, 2032; Zhao, Y.; Li, J.; Zhao, L.; Zhang, S.; Huang, Y.; Wu, X.; Wang, X.; Chem. Eng. J. 2014, 235, 275; Coskun, R.; Dilci, Y.; J. Macromol. Sci., Part A: Pure Appl. Chem. 2014, 51, 767. 9. Wu, Z.-C.; Huang, Y.; Lu, Y.-N.; Tao, T.-X.; Zhang, Z.; Catal. Commun. 2012, 29, 158. 10. Thadani, A. N.; Batey, R. A.; Tetrahedron Lett. 2003, 44, 8051; Barbosa, F. C. G.; Freitas, J. C. R.; Melo, C. F.; Menezes, P. H.; Oliveira, R. A.; Molecules 2012, 17, 14099; Mass, A.; Acocella, M. R.; De Sio, V.; Villano, R.; Scettri, A.; Tetrahedron: Asymm. 2009, 20, 202; Arndt, M.; Reinhold, A.; Hilt, G.; J. Org. Chem. 2010, 75, 5203. 11. Su, B.; Zhang, H.; Deng, M.; Wang, Q.; Org. Biomol. Chem. 2014, 12, 3616; de Souza, R. F. M.; Areias, M. C. C.; Bieber, L. W.; Navarro, M.; Green Chem. 2011, 13, 1118. 12. Chen, M.; Roush, W. R.; J. Org. Chem. 2013, 78, 3; Roush, W.; Palkowitz. A.; J. Am. Chem. Soc. 1987, 109, 953. 13. Sang, F.; Feng, P.; Chen, J.; Ding, Y.; Duan, X.; Zhai, J.; Ma, X.; Zhang, B.; Zhang, Q.; Lin, J.; Chen, Y.; Eur. J. Med. Chem. 2013, 68, 321. 14. Janetzko, J.; Batey, R. A.; J. Org. Chem. 2014, 16, 7415. 15. de Fátima, A.; Kohn, L. K.; de Carvalho, J. E.; Pilli, R. A.; Bioorg. Med. Chem. 2006, 14, 622; Nahra, F.; Riant, O.; J. Chem. Educ. 2015, 92, 179. 16. Zakarian, A.; Batch, A.; Holton, R. A.; J. Am. Chem. Soc. 2013, 125, 7822. 17. Fleury, L. M.; Ashfeld, B. L.; Tetrahedron Lett. 2010, 51, 2427; Yamamoto, Y.; Asao, N.; Chem. Rev. 1993, 93, 2207; Denmark, S. E.; Fu, J.; Chem. Rev. 2003, 103, 2763; Omae, I.; Applications of Organometallic Compounds, John Wiley and Sons: Chichester, 1998; Li, S.; Wang, J.-X.; Wen, X.; Ma, X.; Tetrahedron 2011, 67, 849. 18. Stefani, H. A.; Cella, R.; Vieira, A. S.; Tetrahedron 2007, 63, 3623; Darses, S.; Genet, J.-P.; Chem. Rev. 2008, 108, 288; Alves, D.; Pena, J. M.; Vieira, A. S.; Botteselle, G. V.; Guadagnin, R. C.; Stefani, H. A.; J. Braz. Chem. Soc. 2009, 20, 988; Nascimento, W. S.; Oliveira, J. L.; Freitas, J. C. R.; Navarro, M.; Menezes, P. H.; Synthesis 2014, 2579; Lennox, A. J. J.; Lloyd-Jones, G. C.; Angew. Chem., Int. Ed. 2012, 51, 9385. 19. Nowrouzi, F.; Thadani, A. N.; Batey, R. A.; Org. Lett. 2009, 11, 2631; Ramadhar, T. R.; Bansagi, J.; Batey, R. A.; J. Org. Chem. 2013, 78, 1216; Freitas, J. C. R.; de Oliveira, C. K.; Cunha, E. C.; Malvestiti, I.; Alves, S.; Longo, R. L.; Menezes, P. H.; Tetrahedron Lett. 2013, 54, 1558; Nakamura, H.; Shimizu, K.; Tetrahedron Lett. 2011, 52, 426; Thadani, A. N.; Batey, R. A.; Org. Lett. 2002, 4, 3827; Matsuoka, H.; Kondo, K.; Tetrahedron Lett. 2009, 50, 2320; Lautens, M.; Maddess, M. L.; Org. Lett. 2004, 6, 1883. 20. Perrin, D. D.; Amarego, W. L. F.; Purification of Laboratory Chemicals, Pergamon Press: Oxford, 1996. 21. Still, W. C.; Kahn, M.; Mitra, A.; J. Org. Chem. 1978, 43, 2923. 22. Srivastava, R. M.; Brinn, I. M.; Machuca-Herrera, J. O.; Faria, H. B.; Carpenter, G. B.; Andrade, D.; Venkatesh, C. G.; Morais, L. P. F.; J. Mol. Struct. 1997, 406, 159; da Silva, R. L. Dissertaçao de Mestrado, Universidade Federal Rural de Pernambuco, Brasil, 2015; Parra, M.; Hidalgo, P.; Alderete, J.; Liq. Cryst. 2005, 32, 449. 23. Barros, C. J. P.; de Freitas, J. J. R.; de Oliveira, R. N.; Freitas Filho, J. R.; J. Chil. Chem. Soc. 2011, 56, 721. 24. Pavia, D. L.; Lampman, G. M.; Kriz, G. S.; Vyvyan, J. R.; Introduçao à Espectroscopia, CENGAGE Learning: Sao Paulo, 2010. 25. Couto, T. R.; Freitas, J. C. R.; Cavalcanti, I. H.; Oliveira, R. A.; Menezes, P. H.; Tetrahedron 2013, 69, 7006. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access