Artigo
|
|
| Detecção de inibidores de proteases em sementes de Punica granatum Detection of protease inhibitors in seeds of Punica granatum |
|
Lara Franca Colares1,*; Antero Ricardo Santos Neto1; Isac Henrique Cordeiro1; Sandra Bertelli Ribeiro de Castro2; Rodrigo Moreira Verly3; Caio Cesar de Souza Alves4; Alessandra de Paula Carli1
1. Instituto de Ciências, Engenharia e Tecnologia, Universidade Federal dos Vales do Jequitinhonha e Mucuri, 39803-371 Teófilo Otoni - MG, Brasil Recebido em 25/07/2016 *e-mail: laraf_colares@hotmail.com The use of plants as a way to prevent and treat disease comes from ancient times. With the increasing return on consumption of plants for medicinal purposes, the plant-based medicines have gained greater appreciation. Protease inhibitors are compounds that can decrease activity of an enzyme. They are found in plants, especially in Fabaceae, Poaceae, and Solanaceae families, and show satisfactory use to treat diseases due to their regulatory activities and selective proteolytic degradation of target substrates. This study aimed to obtain protease inhibitors in the seeds of Punica granatum, due its use in traditional medicine. The alcohol-acid solution was used to extract and isolate the protease inhibitors in P. granatum seeds and Glycine max grains. The extract of P. granatum seeds showed similar concentration of protease inhibitors when compared to G. max. A 14 kDa band was detected by electrophoresis on polyacrylamide gel, which was characterized by high-performance liquid chromatography as protease inhibitors. The extract of P. granatum seeds showed a potent trypsin inhibitor activity (EC50 18.2 ng mL-1). This study showed for the first time the extraction, purification, and identification of protease inhibitors in Punica granatum seeds. INTRODUÇAO As plantas biossintetizam substâncias, conhecidas como metabólitos secundários, que desempenham importantes atividades biológicas na adaptaçao e na propagaçao das espécies vegetais.1 Assim como os metabólitos secundários, os inibidores de proteases estao presentes em plantas e sao encontrados principalmente em leguminosas em geral, das famílias Fabaceae, Poaceae e Solanaceae.2,3 Os inibidores de proteases apresentam diferentes funçoes como: proteína de reserva, agente regulador de proteases endógenas, proteçao dos fluídos e tecidos da degradaçao pela atividade proteolítica,4 além da defesa direta ou indireta contra os ataques de insetos e infecçoes por patógenos.5 Por terem a capacidade de diminuir a atividade de uma enzima, os inibidores de proteases podem ser enquadrados em três grupos diferentes, levando em consideraçao suas especificidades: inibidores que reagem com mais de uma classe de proteases, os que sao específicos para uma das classes e aqueles que apresentam alta especificidade para uma única protease.6 Quando se analisa a estrutura, estes podem ser classificados em grupos que apresentam baixo peso molecular e grupos dos inibidores peptídicos com uma ou mais cadeias polipeptídicas. Existe ainda a classificaçao de acordo com o tipo de protease que inibem: serino, aspartato, treonino, cisteíno e metalo-proteases.7 As serino-proteases possuem seus inibidores subdivididos em 16 classes, entretanto, destacam-se: os inibidores de tripsina do tipo Kunitz, os inibidores de Bowman-Birk (BBI) e os inibidores presentes na batata do tipo I e II.8 Pesquisas têm demonstrado a utilizaçao de inibidores de proteases no tratamento de enfermidades devido suas funçoes de regulaçao de diferentes processos em que as proteases estao envolvidas, que englobam a quebra de proteínas intracelulares, transcriçao, ciclo celular, invasao celular e apoptose, através da degradaçao seletiva de substratos alvo.4,9 A Punica granatum é árvore de pequeno porte oriunda da Africa boreal, facilmente cultivada nas regioes quentes e temperadas do mundo inteiro, que pertence à família Lythraceae (antiga Punicaceae) e apresenta taninos, alcaloides, amido, ácido gálico, vitaminas B2, C e D, magnésio e ferro em seus constituintes.10 Apesar dos inibidores de proteases serem tradicionalmente encontrados em leguminosas, a P. granatum foi selecionada para se avaliar a capacidade de obtençao de inibidores de proteases, nunca encontrados nas sementes dessa espécie vegetal, visto a sua utilizaçao na medicina tradicional.
PARTE EXPERIMENTAL Purificaçao de inibidores de proteases em sementes de Punica granatum Os frutos, para separaçao das sementes de P. granatum, foram coletados no município de Araçuaí-MG em outubro e novembro de 2015. O grao de Glycine max foi adquirido no comércio local de Teófilo Otoni-MG. A extraçao proteica na G. max foi realizada como medida padrao de comparaçao para inibidores de proteases, seguindo a metodologia proposta por Yavelow e seus colaboradores,11 a qual foi adaptada para as sementes de P. granatum. Para a extraçao, 100 g das sementes foram trituradas. Após a trituraçao foi acrescentado 10% p/v de etanol a 60% e mantido por 1 h a 55 ºC com agitaçao constante e, em seguida, foi resfriado rapidamente em banho de gelo e disposto em repouso por 24 horas a 4 °C. O material oriundo desse tratamento foi submetido à centrifugaçao a 6.500 × g, por 30 min a 4 °C para remoçao de fibras insolúveis presentes. A mistura foi entao filtrada em gaze e acidificada com HCl até atingir pH 5,3. Procedeu-se a precipitaçao dos inibidores de proteases, com a adiçao de volumes crescentes de Acetona P.A. (-20 ºC), mantido em banho de gelo. O extrato enriquecido obtido foi submetido à centrifugaçao a 6.500 × g por 30 min. O precipitado foi suspenso em 5 mL de água destilada e armazenado a -80 °C para posterior análise. Espectrofotometria do extrato enriquecido de inibidores de proteases A concentraçao de proteínas foi determinada pelo método de Bradford12 e a análise foi realizada no espectrofotômetro AJX-6100PC (Espectrofotômetro Duplo Feixe, MICRONAL) no comprimento de onda 595 nanômetros (nm). Os dados foram gerados pelo software UV-Vis Analyst versao 5.3. Após este procedimento, os extratos enriquecidos de sementes de P. granatum e graos de G. max foram diluídos em água destilada (100x) e submetidos à varredura de comprimento de onda entre 199 e 700 nm (UV-Vis Cary 50, Varian). Os dados foram gerados pelo software Scan versao 3.0 e analisados pelo programa OriginPro versao 8.0. Eletroforese em gel de poliacrilamida e SDS: Detecçao dos inibidores de proteases As amostras provenientes da purificaçao foram submetidas à detecçao por eletroforese em gel de poliacrilamida a 12% SDS-PAGE. Foi usado o padrao de peso molecular de 10 a 250 kDa (PageRuler Plus Prestained Protein Ladder, Thermo Scientific). A coloraçao foi realizada com Coomassie Blue R-250 a 0,025% em metanol 25% e 5% de ácido acético, em agitaçao branda de 2 horas. Em seguida os géis foram descorados em soluçao de 40% metanol e 10% ácido acético até a visualizaçao plena das bandas. Cromatografia líquida de alta eficiência dos extratos enriquecidos de inibidores de proteases As amostras dos sobrenadantes dos extratos enriquecidos de P. granatum e G. max foram diluídas em água destilada (1:10). 20 µL desta diluiçao foram submetidos à cromatografia líquida de alta eficiência em coluna LC18 (25 cm x 4,6 mm) (Supelcosi, Sigma-Aldrich) em sistema de HPLC (ProStar, Varian) sob um fluxo de 0,8 mL min-1 durante 45 minutos e os dados analisados no programa Origin. Potencial Zeta do extrato enriquecido de inibidores de proteases As amostras para determinaçao do potencial Zeta dos inibidores de proteases foram preparadas a partir da diluiçao de 10 vezes do sobrenadante do extrato enriquecido da P. granatum em água destilada, e medida por meio de espalhamento de luz dinâmico (DLS) (Zetasizer Nano - ZS, Malvern) no software Zetasizer versao 7.11. Atividade inibitória anti-tripsina O substrato utilizado foi o cloridrato de N-α-benzoil-DL-arginil-p-nitroanilida (DL-BApNA), preparado dissolvendo 196 mg do composto em 5 mL de DMSO (dimetilsulfóxido) para uma concentraçao final de 9 x 10-2 mol L-1. Esta soluçao foi mantida no congelador como soluçao estoque e diluída no momento do uso com Tris-HCl 0,1 mol L-1 contendo MgCl2, 20 mmol L-1 e pH 8,1 para a concentraçao de 9 x 10-4 mol L-1. Para obter uma concentraçao que inibe entre 50% da atividade da tripsina, foram realizadas diluiçoes seriadas do inibidor. A cada tubo de ensaio se adicionou-se 200 µL de DL-BApNA, 20 µL de tripsina (0,05 mg mL-1) e 20 µL do inibidor. Nos tubos brancos foram adicionados 200 µL de substrato e 40 µL de água, enquanto que os tubos controles de atividade enzimática continuaram com 200 µL de substrato, 20 µL de enzima e 20 µL de água. Os tubos de reaçao passaram por agitaçao em vórtex e foram posteriormente incubados em banho-maria a 37 ºC por aproximadamente 40 minutos. A reaçao foi interrompida com 40 µL de ácido acético 60% v/v e adicionado 250 µL de água destilada. A quantificaçao da atividade inibitória ocorreu em espectrofotômetro AJX-6100PC (Espectrofotômetro Duplo Feixe, MICRONAL) no comprimento de onda 410 nanômetros (nm). Os dados foram gerados pelo software UV-Vis Analyst versao 5.3. A concentraçao do extrato enriquecido a base de sementes de P. granatum que induz metade do efeito máximo (EC50) foi calculada através da análise da regressao nao-linear da curva.
RESULTADOS E DISCUSSAO Punica granatum apresenta quantidade de proteínas semelhante à Glycine max O extrato enriquecido a base de sementes de P. granatum teve uma concentraçao de proteínas semelhante à obtida na G. max grao (Figura 1).
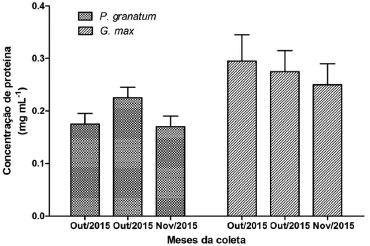 Figura 1. Quantificaçao de inibidores de proteases do extrato enriquecido de sementes de Punica granatum e de Glycine max. Os extratos enriquecidos de sementes de P. granatum e a base de G. max grao, obtidos de extraçoes em diferentes datas foram detectadas pelo método de Bradford (1976) a uma absorbância de 595 nm. Barras=média±desv.padrao
A metodologia para extraçao proteica proposta por Yavelow e seus colaboradores11 foi empregada pela primeira vez em sementes de P. granatum para isolamento e purificaçao de inibidores de proteases. Intensidade de absorbância para inibidores de proteases em Punica granatum O espectro de absorçao mostrou para cada espécie dois picos para inibidores de proteases. O extrato enriquecido de P. granatum teve seus picos em 212 nm e 268 nm e o extrato de G. max apresenta seus picos em 235 nm e 268 nm (Figura 2).
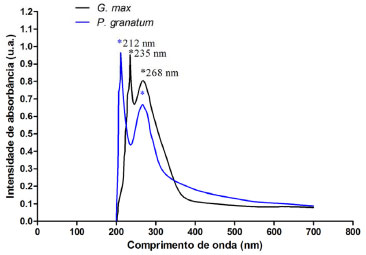 Figura 2. Espectro de absorçao molecular de inibidores de proteases dos extratos enriquecidos a base de sementes de Punica granatum ( - ) e graos de Glycine max ( - ). As amostras apresentaram curvas analíticas de absorçao em 212 nm para P. granatum, 235 nm para G. max e 268 nm para ambos os extratos, sendo monitorados de 199 a 700 nm. A varredura foi realizada com as amostras diluídas em água destilada e a temperatura ambiente
Os picos identificados na P. granatum podem ser caracterizados como inibidores de proteases de acordo com o demonstrado por Leal13 e Clemente e colaboradores14 em seus estudos com extratos de G. max, que observaram picos de intensidade de absorbância. Os valores diferentes podem ser referentes à absorçao dos dois sítios ativos dos inibidores de proteases, podendo ser a absorçao em 268 nm referente à quimotripsina que, como demonstrado por estudos de Apura e colaboradores,15 está bem próxima da absorbância em UV de 250 nm da α-quimotripsina, isso devido sua constituiçao por vários aminoácidos aromáticos, e, quanto à absorçao em 212 nm para o extrato de semente de P. granatum, a mesma se refere à absorbância da tripsina. Detecçao de inibidores de proteases em Punica granatum por eletroforese O gel de poliacrilamida identificou a presença de uma banda de inibidor de proteases na altura de 14 kDa (Figura 3). Uma banda com o mesmo peso molecular foi encontrada no extrato a base de Glycine max grao, utilizado como padrao de comparaçao. Em G. max também foram detectadas bandas nas alturas de 17, 21 e 30 kDa aproximadamente.
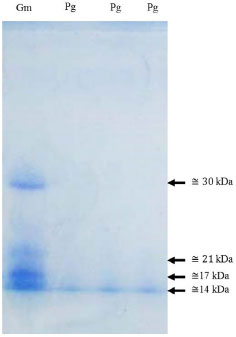 Figura 3. Perfil eletroforético (12% SDS-PAGE) do extrato enriquecido a base de sementes de Punica granatum. Legenda: Gm: extrato a base de Glycine max grao (padrao de inibidores de proteases). Pg: extrato a base de sementes de P. granatum. Foi aplicado em cada poço, 20 µl de amostra. Gel corado com Coomassie Blue R-250. Seta=peso molecular aproximado das bandas (kDa)
Estudos com a leguminosa da espécie Vigna sp. têm demonstrado o peso molecular dos inibidores de proteases de tripsina e do tipo Bowman-Birk (BBI) como sendo de 10-16 kDa,16,17 podendo essa banda representar a forma do dímero do inibidor, comportamento recorrente em inibidores BBI encontrado em várias leguminosas.18 Desta forma, no presente trabalho, a banda de 14 kDa pode ser considerada como sendo um dímero de inibidor de quimotripsina e tripsina. A presença de diversas massas moleculares proteicas na preparaçao do extrato a base de G. max grao é justificável pelo fato da mesma possuir ampla distribuiçao de inibidores de proteases do tipo Kunitz e lectinas em suas sementes, que apresentam massas moleculares em torno de 21-22 e 30-35 kDa,19 respectivamente, sugerindo, assim, que as demais bandas aparentes no perfil eletroforético sejam das mesmas. Diante disso, o extrato enriquecido de sementes de P. granatum demonstrou por meio do perfil eletroforético a presença de inibidor de proteases detectado pela absorbância apresentada no espectro e absorçao (Figura 2). A intensidade da curva analítica de absorçao do extrato de P. granatum relativamente semelhante com a da G. max grao pode estar relacionada com a concentraçao de inibidores de proteases presente nos extratos, como demonstrado por meio das bandas aparentes no gel de poliacrilamida. Perfil cromatográfico igual para a Punica granatum e a Glycine max para presença de inibidores de proteases O cromatograma detectou para ambos os extratos dois picos simétricos com tempos de retençao em 12 e 13 minutos, e outros dois picos em 28 e 40 minutos com intensidades diferentes (Figura 4).
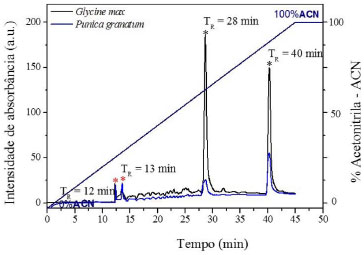 Figura 4. Perfil cromatográfico em HPLC obtido da leitura da amostra do extrato enriquecido a base de sementes de Punica granatum e Glycine max grao. Condiçoes cromatográficas: Coluna utilizada LC18 (25 cm x 4,6 mm) Supelcosil, 2,2 mL. Fase Móvel: A: H2O + TFA 0,1%; B: ACN + TFA 0,08%. Eluiçao por gradiente: 0 a 100% B em 45 min; fluxo: 0,8 mL min-1. *Picos de absorçao de inibidores de proteases de interesse
Os dois primeiros picos de retençao (12 e 13 minutos) possivelmente representam na G. max os inibidores de proteases da família Bowman-Birk (BBI),13,20 e sao os mesmos referentes ao dímero do inibidor de proteases detectados no gel de poliacrilamida em 14 kDa. O fato de aparecerem dois picos no cromatograma referentes a apenas uma banda de inibidor de proteases no gel, pode estar relacionado com a nao divisao do dímero em duas isoformas, comportamento recorrente para inibidores de proteases.18 O cromatograma apresentou, ainda, outros dois picos em tempos de retençao de 28 e 40 minutos, que supostamente representam alguma proteína que nao foi detectada no extrato de P. granatum pelo gel de poliacrilamida, devido a sua baixa sensibilidade comparada ao sistema de HPLC para detecçao de partículas, ou possível falha no processo de coloraçao do gel. Já para o extrato de G. max os picos nos tempos de retençao de 28 e 40 minutos tiveram uma maior intensidade e simetria, podendo ser a representaçao das outras bandas aparentes no gel, uma vez que a G. max possui ampla distribuiçao de inibidores de proteases do tipo Kunitz e das lectinas em suas sementes, que apresentam massas moleculares em torno de 21-22 e 30-35 kDa, respectivamente.19 Sendo assim, tendo o perfil cromatográfico do extrato de graos de G. max como padrao de comparaçao, pode-se supor que os tempos de retençao de 12 e 13 minutos sao referentes à presença de inibidores de proteases do tipo BBI. Os demais picos em 20 e 48 minutos, assim como descrito para as leguminosas, nos extratos de P. granatum e G. max, possivelmente sao relativos aos inibidores de proteases do tipo Kunitz e lectina. No que se refere à afinidade com a coluna, os dois primeiros picos de ambos os extratos enriquecidos tiveram uma hidrofobicidade de 40 e 43,3%, referentes aos tempos de retençao de 12 e 13 minutos respectivamente, o que pode confirmar que essas proteínas detectadas sao relativamente hidrofílicas e detentoras de baixo peso molecular, característica de inibidores de proteases do tipo BBI.9 Distribuiçao do potencial Zeta dos inibidores de proteases Conforme demonstrado na Tabela 1, a amostra do extrato de Punica granatum obteve um valor negativo como o esperado para proteínas.

Considerando que a concentraçao de proteínas exerce um aumento no valor do potencial Zeta, indicando assim a formaçao de partículas com maior densidade de carga superficial,21 o extrato de sementes de P. granatum mostrou uma concentraçao significativa de inibidores de proteases. Atividade anti-tripsina Para a caracterizaçao dos inibidores obtidos no gel de poliacrilamida e no HPLC foi realizada a atividade anti-tripsina do extrato enriquecido a base de sementes de P. granatum. O extrato apresentou uma potente açao inibitória da atividade da tripsina (Figura 5). A inibiçao de 50% da atividade da tripsina (EC50) foi alcançada na concentraçao de 1,82x10-5 mg mL-1.
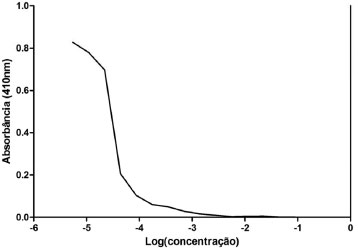 Figura 5. Atividade anti-tripsina do extrato enriquecido a base de sementes de Punica granatum. 20 µL de diluiçoes seriadas do inibidor foram adicionadas a cada tubo de ensaio que continha 200 µL de DL-BApNA (N-α-benzoil-DL-arginil-p-nitroanilida) e 20 µL de tripsina (0,05 mg mL-1). A quantificaçao da atividade inibitória foi analisada em 410 nm. A EC50 foi calculada através da análise da regressao nao-linear da curva
O inibidor do tipo BBI, que apresenta banda característica entre 10 e 17 kDa e com picos de tempo de retençao aos 12 e 13 minutos no HPLC, é descrito como um potente redutor da atividade da tripsina,9 sugerindo que o produto obtido no extrato enriquecido das sementes de P. granatum seja do tipo BBI. Novos estudos devem ser realizados para a caracterizaçao dos picos com tempo de retençao em 28 e 40 min encontrados no HPLC.
CONCLUSAO O presente estudo demonstrou pela primeira vez a detecçao e purificaçao de inibidores de proteases em sementes de Punica granatum. A caracterizaçao do inibidor de protease da família Bowman-Birk em sementes de Punica granatum foi comprovada por meio do gel de poliacrilamida com a detecçao da presença de bandas, dos perfis cromatográficos em HPLC e da atividade enzimática característicos deste inibidor.
AGRADECIMENTOS Os autores agradecem ao LASEB - Laboratório de Síntese e Estrutura de Biomoléculas da Universidade Federal dos Vales do Jequitinhonha e Mucuri - UFVJM / Campus JK e ao PPGTAS - Programa de Pós-Graduaçao em Tecnologia, Ambiente e Sociedade da UFVJM / Campus Mucuri pelo apoio ao desenvolvimento desse estudo.
REFERENCIAS 1. Dewick, P. M.; Medicinal Natural Products - A Biosynthetic Approach, 2ª ed., John Wiley & Sons: England, 2002. 2. Hammond, R. W.; Foard, D. E.; Larkins, B. A.; J. Biol. Chem. 1984, 259, 9883. 3. Baek, J. M.; Song, J. C.; Choi, Y. D.; Kim, S. I.; Biosci., Biotechnol., Biochem. 1994, 58, 843. 4. Ryan, C. A.; Annu. Rev. Phytopathol. 1990, 28, 425; Richardson, M.; Methods Plant Biochem. 1991, 5, 259; Walker, A. J.; Ford, L.; Majerus, M. E. N.; Geoghegan, A. E.; Birch, N.; Gatehouse, J. A.; Gatehouse, A. M. R.; Insect Biochem. Mol. Biol. 1997, 28, 173. 5. Carlini, C. R.; Grossi-de-Sa, M. F.; Toxicon 2002, 40, 1515; Lawrence. P. K.; Koundal. K. R.; Electron. J. Biotechnol. 2002, 5, 93. 6. Tremacoldi, C. R.; Proteases e inibidores de proteases na defesa de plantas contra pragas, 1ª ed. Versao Eletrônica, Embrapa Amazônia Oriental: Belém, 2009. 7. Power, J. C.; Asgian, J. L.; Ekici, O. C.; James, K. E.; Chem. Rev. 2002, 102, 4639. 8. Ryan, C. A.; Annu. Rev. Phytopathol. 1990, 28, 425. 9. Touil, T.; Ciric, B; Ventur, E; Shindler, K.; S.; Gran, B.; Rostami, A.; J. Neurol. Sci. 2008, 271, 191; Clardy, J.; Walsh, C.; Nature 2004, 432, 829. 10. Grandi, T. S. M.; Tratado das plantas medicinais: mineiras, nativas e cultivadas, 1ª ed., Adaequatio Estúdio: Belo Horizonte, 2014. 11. Yavelow, J.; Collins, M.; Birk, Y.; Troll, W.; Kennedy, A. R.; Proc. Natl. Acad. Sci. U. S. A. 1985, 82, 5395. 12. Bradford, M.; Anal. Biochem. 1976, 72, 248. 13. Leal, S. C.; Dissertaçao de Mestrado, Universidade Federal de Ouro Preto, Brasil, 2010. 14. Clemente, A.; Moreno, F. M.; Manzono, M. Del C. M.; Jimenez, E.; Domoney, C.; Mol. Nutr. Food Res. 2010, 54, 396. 15. Apura, J.; Mendes, M.; Uva, M.; Instituto Superior Técnico 2012, 14. 16. Kumar, K.; Kansal, R.; Subrahmanyam, B.; Koundal, K. R.; Miglani, K.; Gupta, V. K.; Acta Physiol. Plant. 2013, 35, 1887. 17. Sammour, R. H. A.; Turk. J. Biol. 2006, 30, 207. 18. Bergeron, D.; Nielsen, S. S.; J. Agric. Food Chem. 1993, 41, 1544; Fields, C.; Mallee, P.; Muzard, J.; Lee, G. U.; Food Chem. 2012, 134, 1831. 19. Song, H. K.; Suh, S. W.; J. Mol. Biol. 1998, 275, 347; Sharon, N.; Lis, H.; FASEB J. 1990, 4, 3198. 20. Gariani, T.; Leatherbarrow, R. J.; J. Pept. Res. 1997, 49, 467. 21. Fayad, S. J.; Ramos, B. G. Z.; Soldi, V.; Minatti, E.; Quim. Nova 2015, 38, 91. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





