Educação
|
|
| Determinação de fosfato em refrigerantes utilizando um scanner de mesa e análise automatizada de dados: um exemplo didático para ensino de químic Phosphate colorimetric analysis using a desktop scanner and automated digital image analysis: a didatical example to teach colorimetric analyses |
|
Heloisa Colzani1; Quethelen Elizabeth Araujo Garcez Rodrigues1; Claudia Fogaça2; Jane Mary Lafayette Neves Gelinski2; Edenir R. Pereira-Filho3; Endler Marcel Borges1,2,*
1. Departamento de Química, Universidade Regional de Blumenau, Campus 1, Rua Antônio da Veiga, 140, Victor Konder, 89012-900 Blumenau - SC, Brasil Recebido em 19/10/2016 *e-mail: marcelborgesb@gmail.com We propose here the quantification of the phosphorus content in cola drinks by molybdenum blue method. Molybdenum blue method was carried out in the wells of a microplate, where method miniaturization represents reduction in reagents required, improved safety, reduced waste stream, and increased sample throughput. The phosphate concentration was determinate using scanned images of the microplate. Extraction of RGB values was carried out using ImageJ, the pugling Readplate was used allowing extraction of RGB values of all wells simultaneously. A Microsoft Excel spreadsheet is afforded in Google Drive, it organize data taken from ImageJ to afford calibrations curves and phosphate concentration in cola drinks. Calibration curves were prepared at 500-2500 µg L-1 of P with good linearity (R > 0.95). Phosphate concentrations in cola drinks determinate using digital images method are statistically equivalent to concentrations determined using a spectroscopic method at a 95% confidence interval. INTRODUÇAO Nas últimas décadas, vários métodos colorimétricos foram adaptados para microplacas, em especial, na área clínica e em análises ambientais. As vantagens de adaptar os métodos tradicionais sao a reduçao no uso de reagentes e consequente menor geraçao de resíduos químicos. No entanto, o uso de técnicas de microescala empregando microplacas, em sala de aula, é provavelmente limitada pelo custo elevado (ordem de US$ 10.000) dos leitores de microplacas.1 Normalmente, as imagens digitais utilizam o sistema Red, Green e Blue (RGB) para a definiçao de cores. Nesse sistema, cada tom de cor é definido por três canais: R (vermelho), G (verde) e B (azul), que variam como índices inteiros entre 0 e 255, onde o 0 corresponde à cor preta e o 255 corresponde ao R ou G ou B puros. Desta forma, no sistema RGB, um tom de cor corresponde a um ponto em um espaço tridimensional formado pelos eixos R, G e B, sendo possível a geraçao de 16 milhoes de cores diferentes (2563).2 A absorbância é definida de acordo com a Equaçao 1. A potência de um feixe (P), transmitida através de uma célula com a soluçao do analito, é comparada com a potência que atravessa uma célula idêntica contendo somente o solvente ou o branco dos reagentes (P0). De acordo com a lei Beer-Lambert, a absorbância (A) é proporcional a concentraçao do analito.1  Kohl et al.3 desenvolveram uma prática de ensino que mostrou que o princípio da absorbância pode ser facilmente demonstrada utilizando soluçoes coloridas e análises de imagens digitais. A prática de ensino consistia em fotografar um conjunto de cubetas contendo corante amarelo em diferentes concentraçoes e uma cubeta contendo apenas água destilada. Os valores de G foram obtidos para as cubetas que continham o corante amarelo e G0 foi obtido da cubeta que continha apenas água destilada. Posteriormente, estes valores foram utilizados para determinar a absorbância e preparar curvas analíticas de calibraçao. Atualmente, o processamento de imagens digitais tem atraído grande atençao como uma ferramenta analítica para a análise colorimétrica devido a sua versatilidade, compreendendo procedimentos simples, rápidos e de baixo custo. Existem vários exemplos relevantes descritos na literatura, tais como para a determinaçao de nitrito em alimentos, amostras ambientais e amostras clínicas,4 na determinaçao do diclofenaco sódico, dipirona sódica e gluconato de cálcio em drogas injetáveis,5 análise de chás,6 quantificaçao de etanol em bebidas,7 e quantificaçao de sulfito em bebidas.8 Além disso, o uso de imagens digitais pode ser uma alternativa para ensaios clínicos, como demonstrado recentemente para creatinina9 e determinaçao de glucose,10 alanina aminotransferase.11 Por sua vez, as imagens digitais também podem ser utilizadas para controle de qualidade. Por exemplo, Santos et al.,12,13 utilizaram imagens digitais obtidas com um scanner de mesa para verificar adulteraçoes do leite. Recentemente, Christodouleas et al.14 mostraram que um scanner de mesa pode substituir um leitor de microplacas, fazendo a quantificaçao de diversos corantes e leituras de placas de teste ELISA (ensaio de imunoabsorçao enzimática, Enzyme-Linked Immunosorbent Assay). No intuito de associar o cotidiano do aluno de graduaçao com as práticas de laboratório, foi proposta a determinaçao da concentraçao de fosfato em refrigerantes utilizando o método do azul de molibdênio.15,16 O método do azul de molibdênio consiste na formaçao de um complexo entre o ânion fosfato com um composto de molibdato em soluçao ácida (Reaçao 1). Reaçao 1: PO43- + 12MoO42- + 27H+ ⇆ H3PO4(MoO3)12 + 12H2O O complexo fosfato molibdênio hexavalente incolor é reduzido a uma forma pentavalente azul por um agente redutor (ácido ascórbico) em meio ácido (Reaçao 2). Reaçao 2: H3PMo(VI)12O40 + Redutor ⇆ [H4PMo(VI)8Mo(V)4O40]3- A intensidade da cor azul é medida espectrofotometricamente a 600, 650 e 800 nm.17 Cola é uma bebida carbonatada doce (denominada refrigerante ou gasosa), e normalmente contém corante de caramelo, cafeína, mistura de baunilha, canela e sabores cítricos. O nome vem da castanha de cola que originalmente é usada para obter a cafeína.18 Bebidas de cola sao bastante consumidas e populares entre os estudantes. Muita atençao está sendo dada para possíveis consequências do consumo excessivo para a saúde humana. Estudos vem sendo feitos para avaliar o efeito destas bebidas na erosao dentária,15, na ingestao de altos níveis de cafeína que podem causar hipertensao, reaçoes alérgicas e distúrbios gastrointestinais.19,20 Além disso, estas bebidas podem acaretar efeitos adversos no metabolismo do cálcio devido ao seu alto teor de ácido fosfórico, que combinado com a baixa ingestao de cálcio na dieta pode aumentar o risco de doenças ósseas.21,22 Desta forma, o presente estudo utiliza o método do azul de molibdênio para determinar a concentraçao de fosfato em refrigerantes a base de cola. As reaçoes sao feitas diretamente nos poços das microplacas de cultura celular (resultando em baixo consumo de reagentes) e a concentraçao de fosfato é determinada utilizando imagens digitais. Os valores de RGB foram extraídos simultaneamente de todos os poços utilizando um plugin do programa ImageJ.23,24
PARTE EXPERIMENTAL Reagentes No desenvolvimento da parte experimental foram utilizados os seguintes reagentes: Tartarato de antimônio e potássio, C4H4KO7Sb1/2H2O, 99,8%, fosfato de potássio monóbasico anidro, KH2PO4, 99%, molibdato de amônio, NH4Mo7O244H2O, 81%, ácido L(+) Ascórbico, C6H8O6, 99%. Todos os reagentes sao da marca Vetec (Rio de Janeiro, Brasil). Equipamentos As imagens foram obtidas com um scanner HP Scanjet G2710 e o software do scanner era o HP Scanning. A concentraçao de fosfato também foi determinada utilizando-se um leitor de microplacas Tecan Infinite 200 PRO (TECAN, Suiça). Soluçoes Para a aquisiçao das imagens foram preparadas as soluçoes listadas a seguir:
Para a preparaçao do reagente misto as soluçoes A a D foram misturadas nas seguintes proporçoes e ordem: 5 mL da soluçao A + 1 mL da soluçao B + 5 mL da soluçao C + 5 mL da soluçao D. Soluçao estoque de KH2PO4: 220 mg de KH2PO4 diluído em 1 L de água deionizada que representa 50 mg L-1 de P (fósforo). Por exemplo, 220 mg L-1 de KH2PO4 representam 1,62 mmol L-1 de KH2PO4, visto que, a massa molecular do KH2PO4 é 136,09 g mol-1 (220 mg L-1/136,09 g mol-1 = 1,62 mmol L-1), como a massa molecular do fósforo (P) é de 30,97 g mol-1, a concentraçao de P na soluçao em mg é 1,62 mmol L-1 x 30,97 g mol-1 = 50 mg L-1 Na preparaçao das soluçoes padroes para estabelecer as curvas de calibraçao foi empregada uma soluçao de trabalho: 5 mL da soluçao estoque de KH2PO4 em 100 mL de água deionizada (2,5 mg L-1 de P).
CURVA DE CALIBRAÇAO A curva de calibraçao foi preparada colocando 2, 4, 6, 8 mL da soluçao de trabalho de KH2PO4 em baloes de 10 mL, com o auxílio de uma bureta de 25 mL, e completando o volume até o menisco com água deionizada. O último ponto da curva de calibraçao era a própria soluçao de trabalho. A concentraçao de fosfato foi expressa como µg L-1 de fósforo. A concentraçao de cada ponto da curva foi calculada utilizando a Equaçao 2, em que a concentraçao de soluçao de trabalho (2,5 mg L-1) é C2, V2 é o volume da soluçao de trabalho adicionado ao balao volumétrico de 10 mL e V1 é 10 mL. Portanto, a concentraçao de cada ponto da curva analítica foi de 500, 1000, 1500, 2000 e 2500 µg L-1.  Preparo das soluçoes de refrigerante. Devido à elevada concentraçao de fosfato nos refrigerantes, estes foram diluídos da seguinte forma: 1 mL de refrigerante foi diluído em um balao de 100 mL (100 vezes diluída) e 1 ml de refrigerante foi diluído em um balao de 50 mL (50 vezes diluída). Os refrigerantes utilizados foram Pepsi, Coca Zero, Coca-Cola e Guaraná Antártica Black. Método do Azul de molibdênio. Duzentos µL de cada amostra de refrigerante diluída foram colocadas em 4 poços da microplaca. Na Figura 1, linhas de E a H e colunas 1 a 5 correspondem aos poços da microplaca que contém as soluçoes da curva de calibraçao. Em seguida, 200 µL de cada soluçao de refrigerante foram adicionados a 4 poços da placa, na Figura 1, linhas A a D e colunas 4 a 11. Cada refrigerante foi preparado com duas diluiçoes, 1:50 e 1:100. Por fim, adicionou-se 50 µL do reagente misto a cada poço da placa. Após 15 minutos, foram realizadas as leituras em 650 nm no leitor de microplacas. Posteriormente, as placas foram colocadas em um scanner e as imagens obtidas em 300 pontos por polegada (dots per inch, dpi).
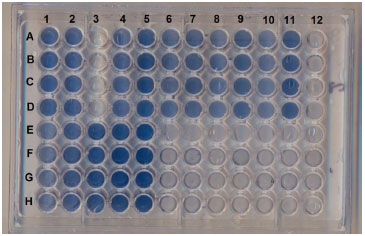 Figura 1. Imagem obtida com scanner de mesa da microplaca frente a um fundo branco
Obtençao das imagens digitais As imagens foram obtidas colocando as microplacas em um scanner HP Scanjet G2710, cobertas com um fundo branco, por exemplo, folha branca de EVA (etil, vinil e acetato). As imagens foram obtidas com 300 dpi no formato Joint Photographics Experts Group (JPEG). As opçoes de correçao automática da imagem pelo software foram desabilitadas e o software do scanner era o HP Scanning. Obtençao dos valores de RGB Os valores de RGB foram extraídos das imagens utilizando o software ImageJ, software de uso livre.23 Os valores de cada canal (RGB) de todos os poços da microplaca pode ser extraído simultaneamente utilizando o plugin "ReadPalte" do ImageJ. Por exemplo, para obter os valores R na Figura 1, no ImageJ, clique em Plugins e depois em ReadPlate. Ao clicar em ReadPlate, a janela Measureme... aparecerá. Na janela Measureme... (Figura 2), basta selecionar o canal (Channel) que se deseja extrair. Ao selecionar o canal e clicar em OK, a janela Grid Parameters aparecerá (Figura 3).
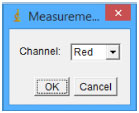 Figura 2. Janela Measureme.... Seleçao da canal que se deseja extrair de uma micro placa
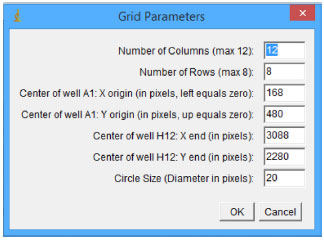 Figura 3. Janela Grid Parameters. Seleçao das coordenadas dos poços da microplaca
Na janela Grid Parameters (Figura 3), em Number of columns, seleciona-se o número de colunas da placa, sendo permitidas no máximo 12 colunas. Em Number of Rows, seleciona-se o número de linhas, sendo permitidas no máximo 8 linhas (de A até H). Em Center of Well A1:X e Center of Well A1:Y, sao colocadas as coordenadas em X e Y do primeiro poço A1 (Figura 1). Em Center of Well H12:X e Center of Well H12:Y sao colocadas as coordenadas em X e Y do último poço H12 (Figura 1). No imageJ, as coordenadas dos poços A1 e H12 podem ser determinadas posicionando o cursor sobre a micro placa. Circle size é o diâmetro do círculo, na placa da onde sao extraídos os valores de RGB. Neste trabalho utilizou-se 20 pixel. Na janela Grid Parameters, após clicar em OK, aparecerá uma janela chamada "Results" contendo (Figura 4), na seguinte ordem, as informaçoes: nome, área, mediana, mínimo, máximo, linha, coluna. Na janela Results, clique "Ctrl + A" para selecionar todos os valores, em seguida clique em "Ctrl + C" para copiar estes valores e para colar estes valores no Microsoft Excel, clique em "Ctrl + V".
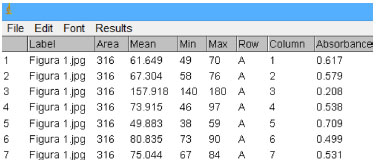 Figura 4. Janela results. Janela que mostra os valores de RGB para cada poço da microplaca
Depois de extrair os valores de RGB e exportar os dados para o Microsoft Excel, os valores de R, G e B podem ser exportados para a Tabela 1S, do Microsoft Excel, disponível em um link Google drive.25 Na Planilha do Microsoft Excel, os valores de R, G e B foram copiados para as planilhas 1, 2 e 3 respectivamente. Nestas planilhas, a média dos valores está na coluna D, os valores das médias de R, G e B foram exportados para as colunas A, B e C, respectivamente, da planilha 4. Na planilha 4, os valores de R, G e B de cada poço sao rearranjados de maneira a fornecer as curvas analíticas e a concentraçao de fosfato em cada um dos refrigerantes utilizando as equaçoes (3-5). As equaçoes de 3 a 6 sao as absorbâncias para cada um dos canais RGB, a Equaçao 6 é a distância euclidiana. 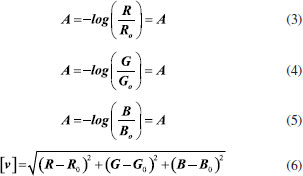 Na planilha 4, os valores extraídos de R, G e B sao transferidos para as colunas R, S, T e U, a média (m) dos valores dos quatro poços que contém a curva de calibraçao sao colocados na coluna N, o desvio padrao (s) destes quatro valores na coluna O e o intervalo de confiança na coluna Q, o intervalo de confiança foi calculado com a Equaçao 7, em que n é o número de poços (n =4), t é o valor do t de Student, em um intervalo de confiança de 95% para três graus de liberdade (t =3,18), e s é o desvio padrao dos valores de RGB em cada poço. Como é ilustrado na Figura 5. 
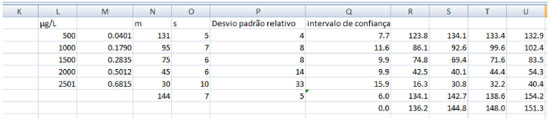 Figura 5. Tabela 1S disponível no Google Drive, utilizada para converter os valores de RGB extraídos da Figura 1 nas curvas analíticas de calibraçao
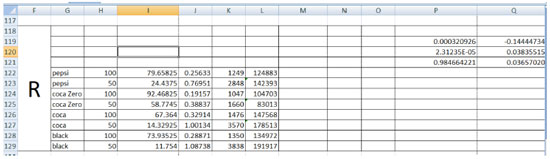
Nas colunas H-V, a curva analítica obtida com a Equaçao 3 está entre as linhas 2 a 7. A curva analítica obtida com a equaçao 4 está entre as linhas 27 a 33. A curva analítica obtida com a equaçao 5 está entre as linhas 51 a 57. A curva analítica obtida com a equaçao 6 está entre as linhas 74 a 79. A absorbância e [v] de cada amostra de refrigerante, assim como suas respectivas concentraçoes que foram determinadas utilizando-se as Equaçoes 1 a 4 estao entre as colunas G a Q e linhas 118 a 129, 132 a 142, 145 a 155 e 158 a 168, respectivamente. A concentraçao de fósforo em cada refrigerante, determinada com as equaçoes de 1 a 4, estao nas colunas H a L, respectivamente, nas linhas 174 a 181. A Figura 6 mostra como a concentraçao de P é calculada em cada um dos refrigerantes. A coluna F mostra que estas sao as concentraçoes calculadas com a equaçao 3, utilizando os valores de R. Na coluna G estao os nomes das amostras. Na coluna H estao os fatores de diluiçao de cada refrigerante. Na coluna J estao as absorbâncias de cada um dos refrigerantes utilizando-se a equaçao 3. Na coluna K está representada a concentraçao de P (µg L-1). Na coluna L as concentraçoes determinadas para cada refrigerante após multiplicaçao por seus respectivos fatores de diluiçao, por exemplo, um refrigerante que foi diluído 100 vezes, teve a sua concentraçao determinada na coluna K e este valor foi multiplicado por 100 na coluna L. Na Linha 119, P é o coeficiente angular da equaçao 3 e Q é o coeficiente linear da equaçao 1.
RESULTADOS E DISCUSSAO Existem práticas de ensino descritas na literatura que utilizaram imagens digitais para realizar determinaçoes colorimétricas25-27 e de pH.28,29 Nestas práticas de ensino, os valores de RGB foram extraídos utilizando softwares como r-Project25,27 Octave e Matlab.28,29 Quando este experimento foi testado com alunos de graduaçao em engenharia química, no segundo semestre de 2016, poucos estavam acostumados com este tipo de software, especialmente nos dois primeiros anos de graduaçao, e se mostram desconfortáveis em trabalhar com os mesmos. Além disto, com estes softwares é necessário recortar as imagens de onde deseja-se extrair os valores de RGB, o que pode ser um procedimento demorado, visto que teríamos de recortar 52 poços separadamente e salvar cada um com um nome específico. Inicialmente, neste trabalho, os valores de RGB foram extraídos utilizando o r-project, para tanto, pequenos quadrados de 80x80 eram recortados de cada poço da placa e salvos em uma pasta. Posteriormente, os valores de RGB eram extraídos utilizando o r-project. Devido à dificuldade relatada pelos alunos, foi implementada uma nova metodologia para extrair os valores de RGB das imagens digitais. A alternativa encontrada foi o plugin ReadPlate no ImageJ, que permitiu que os valores de RGB fossem extraídos diretamente das imagens das microplacas em menos de cinco minutos. Importar os valores R, G e B para a Tabela 1S, disponível no Google drive,25 permitiu uma fácil organizaçao dos dados e uma visualizaçao imediata das curvas de calibraçao, bem como a determinaçao das concentraçoes de fosfato nos refrigerantes. Kohl et al.3 demonstram que uma soluçao contendo um corante amarelo (Bio-Tek ELx808) é amarela porque o complexo absorve o azul da radiaçao branca que penetra no frasco e transmite o componente amarelo de forma inalterada. Assim, em uma determinaçao colorimétrica de corante amarelo, o máximo de variaçao na absorbância, com a concentraçao, ocorre com a radiaçao azul. A variaçao da absorbância com a radiaçao amarela é desprezível e a radiaçao empregada em uma análise colorimétrica deve ser a cor complementar da soluçao do analito. Desta forma, os valores de R e G extraídos de soluçoes com diferentes concentraçoes de corante amarelo se mostraram praticamente constantes, enquanto os valores B apresentaram variaçoes significativas em funçao da concentraçao do corante.3 Neste estudo, o fosfato é determinado como um complexo de coloraçao azul, ou seja, este absorve a radiaçao amarela da luz branca e transmite o componente azul. Por esta razao, os métodos analíticos descritos na literatura fazem a leitura da absorbância em 650, 660 e 880 nm.17 No sistema RGB, vermelho, verde e azul representam a luz nas regioes de 600-700 nm, 500-600 nm e 400-500 nm, respectivamente. Portanto, devido à coloraçao azul do complexo, espera-se que os valores B extraídos das imagens digitais variem pouco, em funçao da concentraçao de fosfato, e que os valores de R e G diminuem em funçao do aumento da concentraçao de fosfato. O comportamento esperado foi observado na prática. A Tabela 1 mostra os valores de RGB para cada um dos pontos da curva analítica, como se esperava, os valores R apresentam a maior variaçao em funçao da concentraçao de fosfato, os valores de G variaram menos em funçao da concentraçao de fosfato que os valores de R, enquanto os valores de B variaram pouco em funçao da concentraçao de fosfato.
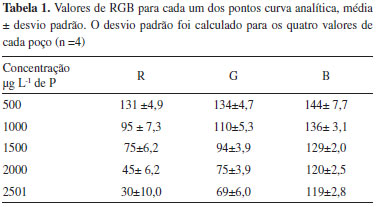
As curvas analíticas obtidas utilizando as equaçoes 3 a 6 sao mostradas na Figura 7, todas as curvas analíticas se mostraram lineares com um coeficiente de correlaçao (R2) maior que 0.96. Devido à pequena variaçao de B em funçao da concentraçao de fosfato, o coeficiente angular da Equaçao 5 foi pequeno (4 x10-5). Por sua vez, como os valores de R variam mais que os valores de G em funçao da concentraçao de fosfato, a Equaçao 3 tem um coeficiente angular (3 x 10-4) três vezes maior que a Equaçao 4 (1 x10-4).
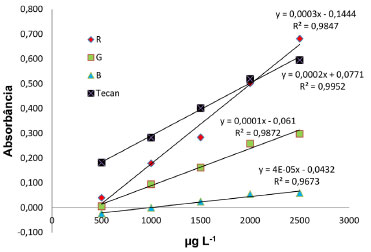 Figura 7. Concentraçao de fósforo (µg L-1) vs Absorbância. R: Equaçao 3; G: Equaçao 4 e B: Equaçao 5.
A curva analítica obtida com o leitor de microplacas (Tecan) apresentou maior linearidade que as curvas obtidas com os valores de RGB extraídos das imagens digitais e um coeficiente angular (2 x 10-4) menor que o coeficiente angular obtido com a equaçao 3. A curva analítica obtida com a Equaçao 6 se mostrou linear (Figura 8). A equaçao 6 foi utilizada, porque os valores de R, G e B variaram em funçao da concentraçao de fosfato. Desta forma, esta equaçao leva em consideraçao os valores dos três canais. Por exemplo, Moraes et al.27 determinaram a concentraçao de Fe2+, em um estudo da taxa de corrosao do ferro na água do mar, utilizando imagens digitais. Neste estudo, a absorbância foi calculada levando em conta a variaçao dos canais G e B. Em razao do complexo vermelho, formado entre o Fe2+ e a fenantrolina, apresentar pouca variaçao no canal R em funçao da concentraçao, os canais G e B apresentaram variaçoes apreciáveis em funçao da concentraçao de Fe2+ na soluçao.
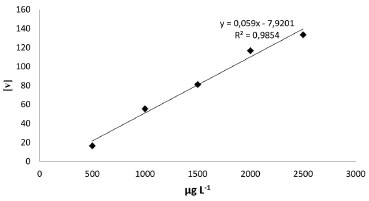 Figura 8. Curva de calibraçao obtida com a Equaçao 6 [v] vs concentraçao de fosfato
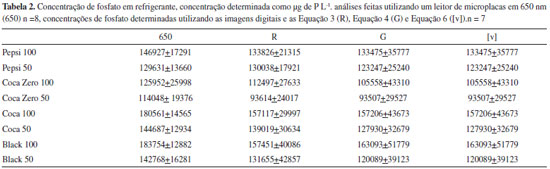
Oito microplacas foram preparadas e analisadas em 650 nm, com um leitor de microplacas. Posteriormente, sete destas microplacas foram colocadas em um scanner frente a um fundo branco e as imagens obtidas em 300 dpi no formato JPEG. Na Tabela 2 está apresentado a média e o desvio padrao (m±s), as concentraçoes obtidas com as Equaçao 3, Equaçao 4 e Equaçao 6 apresentaram valores próximos dos obtidos com o leitor de microplacas. A Equaçao 5 nao foi utilizada, porque apresenta um coeficiente angular muito pequeno (Figura 7). As amostras de refrigerante nomeadas como 50 significam que o refrigerante foi diluído na proporçao 1:50, enquanto a nomeaçao 100 significam que o refrigerante foi diluído na proporçao 1:100.
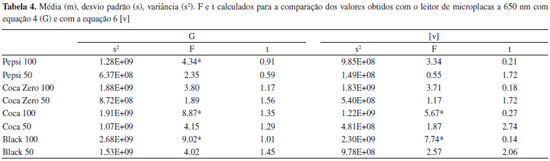
Utilizando um leitor de microplacas, o desvio padrao realtivo da concentraçao de fosfato nos refrigerantes foi de 12% em média, enquanto o desvio padrao relativo obtido com as imagens digitais ficou entre 23% e 30%. Por sua vez, o desvio padrao relativo obtido com a Equaçao 3 e Equaçao 4 foi de 23% e o desvio padrao relativo obtido com a Equaçao 6 foi de 30%. Portanto, optou-se por fazer a determinaçao da concentraçao de fosfato nos refrigerantes utilizando-se a Equaçao 3. Na execuçao da prática com alunos, os mesmos deverao escolher qual equaçao é mais adequada. Repare que na Tabela 2 o desvio padrao obtido com a Equaçao 4 é muito próximo do desvio padrao obtido com a Equaçao 6. As concentraçoes obtidas com o leitor de microplacas (n = 8) e com a equaçao 3 (n = 7) foram comparadas, inicialmente, utilizando o teste F para comparar as variâncias. Os valores de F obtidos para os refrigerantes estao mostrados na Tabela 3. Como é mostrado na Tabela 3, as variâncias obtidas com o leitor de microplacas e com a Equaçao 3, em um intervalo de confiança de 95, nao podem serem presumidas equivalentes para os refrigerantes: Guaraná Black 100 e Guaraná Black 50, visto que o valor de F crítico para 7 e 6 graus de liberdade foi de 4,2.
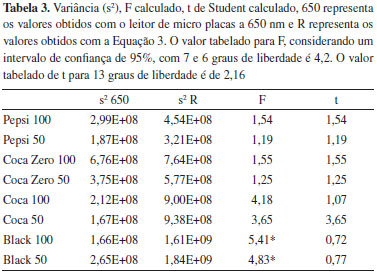
O teste t presumindo variâncias equivalentes mostrou que a Coca-Cola 50 apresenta concentraçao de fosfato diferente da obtida com o leitor de microplacas, porque o valor critico de t, em um intervalo de confiança de 95% para 13 graus de liberdade, é 2,16. O teste t presumindo variâncias distintas para a concentraçao de fosfato no Guaraná Black 100 e Guaraná Black 50 mostra que nao há diferença significativa entre os resultados obtidos com a Equaçao 3 e o leitor de microplacas, visto que o valor de t calculado é menor que o valor de t critico. Desta foram, as concentraçoes de fosfato nos refrigerantes determinadas com a Equaçao 3 nao diferem dos valores obtidos com um leitor de microplacas, em um intervalo de confiança de 95%, exceto para a Coca-Cola 50. A Tabela 4 compara os valores obtidos com o leitor de microplacas com a Equaçao 4 e Equaçao 6. A comparaçao das concentraçoes de fosfato obtidas com um leitor de microplacas e com os valores obtidos com a Equaçao 4 sao mostradas na Tabela 4. O teste F mostra que as variâncias das concentraçoes de fosfato obtidas com a equaçao 4 sao diferentes das variâncias obtidas com o leitor de microplacas para Pepsi 100, Coca-Cola 100 e Black 100.
O teste t presumindo variâncias equivalentes mostrou que nao há diferença significativa entre os resultados obtidos com a Equaçao 4 e o leitor de microplacas, porque os valores de t calculados foram menores que o valor de t critico (2,16). O teste t presumindo variâncias diferentes também mostrou que nao há diferença significativa entre os resultados obtidos com a Equaçao 4 e o leitor de microplacas, sendo que o t crítico ficou em torno de 2,36. A comparaçao das concentraçoes de fosfato obtidas com um leitor de microplacas e com os valores obtidos com a Equaçao 6 sao mostradas na Tabela 4. O teste F mostra que as variâncias das concentraçoes de fosfato obtidas com a Equaçao 3 sao diferentes das variâncias obtidas com o leitor de microplacas para Coca-Cola 100 e Black 100. O teste t presumindo variâncias equivalentes mostrou que há diferença significativa entre os resultados obtidos com a Equaçao 6 e o leitor de microplacas para a Coca-Cola 50, já que o valor de t calculado (2,74) foi maior que o valor do t critico (2,16). O teste t presumindo variâncias diferentes mostrou que nao há diferença significativa entre os resultados obtidos com a Equaçao 6 e o leitor de microplacas, sendo que o t crítico ficou em torno de 2,36. Na Tabela 4, o teste t mostrou que as concentraçoes de fosfato obtidas com as Equaçao 3 e Equaçao 6 nao apresentaram diferença significativa dos valores obtidos com o leitor de microplacas, exceto para Coca-Cola 50. Utilizando a Equaçao 6, nao se observou diferença significativa com os valores obtidos com o leitor de microplacas para nenhum dos refrigerantes, embora esta equaçao forneça valores dedesvio padrao maiores que os obtidos com as outras equaçoes. Isto indica que o método que utiliza imagens digitais fornece resultados similares aos obtidos com um leitor de microplacas. É interessante que os alunos comparem os resultados obtidos com as imagens digitais (equaçoes 3 a 6) com os resultados obtidos com um equipamento, como, por exemplo, um leitor de microplacas como foi feito neste trabalho. Provavelmente muitas instituiçoes nao tenham um leitor de microplacas, neste caso, os alunos podem fazer a quantificaçao de fosfato nos refrigerantes utilizando apenas as imagens digitais, e comparar os resultados obtidos com ambas as equaçoes, bem como observar qual das equaçoes fornece melhores resultados. No desenvolvimento de um método analítico é interessante que o desvio padrao seja o menor possível. Desta forma, os alunos podem observar qual equaçao fornece o menor desvio padrao para cada refrigerante. De um ponto de vista didático é interessante que o aluno compare as concentraçoes de fosfato nos refrigerantes utilizando diluiçoes de 1:50 e 1:100. Em todos os refrigerantes, tanto com as imagens digitais (Equaçao 3, Equaçao 4 e Equaçao 6) como no leitor de microplacas, as concentraçoes obtidas com uma diluiçao de 1:50 foram menores que as concentraçoes obtidas com uma diluiçao de 1:100 (Tabela 2). Isto indica que uma maior diluiçao dos refrigerantes diminuí o efeito da matriz. De maneira didática é interessante que os alunos utilizem as diluiçoes (1:50 e 1:100) para observar o efeito do corante presente nos refrigerantes a base de cola. Quando este experimento foi realizado, as concentraçoes de fosfato obtidas utilizando as duas diluiçoes foram comparadas utilizando-se o teste F para comparar as variâncias e o teste t para comparar as médias dos resultados. Podemos comparar a variância da concentraçao de fosfato nos refrigerantes utilizando o teste F, com base nas variâncias obtidas com a Equaçao 3 (Tabela 2 e Tabela 3). Os valores de F calculados para a Pepsi, Coca Zero, Coca-Cola e Guaraná Black sao 1,41, 1,32, 1,04 e 1,14, respectivamente. Portanto, assumimos que nao existe diferença significativa entre as variâncias obtidas com cada uma das diluiçoes, visto que o valor de F tabelado, em um intervalo de confiança de 95%, é de 3,78. Uma vez que variâncias equivalentes foram presumidas do teste F, o teste t presumindo variâncias equivalentes foi utilizado para determinar os valores de t para Pepsi, Coca Zero, Coca-Cola e Guaraná Black de 0,36, 1,36, 1,11 e 1,16, respectivamente. Portanto, assumiu-se que nao existe diferença significativa entre as concentraçoes determinadas com as diluiçoes de 1:50 e 1:100, em um intervalo de confiança de 95%.
CONCLUSAO A prática de ensino proposta introduz diversos conceitos primordiais ao ensino de ciências exatas e engenharias, como o uso de imagens digitais, a extraçao dos valores de RGB utilizando o plugin ReadPlate, exportaçao dos dados para o Microsoft Excel, construçao de curvas analíticas, comparaçao de resultados utilizando testes estatísticos e introduçao aos conceitos de espectrofotometria. O uso do plugin ReadPlate no ImageJ permite que os valores de RGB sejam extraídos de uma microplaca de 96 poços em menos de 5 minutos. Por sua vez, a exportaçao dos dados do ImageJ para a tabela 1S do Microsoft Excel permite que as curvas analíticas e a determinaçao da concentraçao de fosfato em cada refrigerante sejam determinadas imediatamente, após a aquisiçao das imagens digitais. Os resultados obtidos com a equaçao 1 sao equivalentes aos resultados obtidos com um leitor de microplacas, em um intervalo de confiança de 95%, com exceçao da Coca-Cola 50. Adicionalmente, a Equaçao 2 apresentou linearidade satisfatória (R2 = 0,98) e coeficiente angular maior que o obtido com um leitor de microplacas. A prática de ensino proposta é simples e de baixo custo, em que se utiliza 50 µL de reagente misto por poço, o que significa um gasto de 2,6 mL por microplaca. É importante ressaltar que a maioria dos métodos colorimétricos está sendo adaptada para microplacas para reduzir o uso de solventes e também o volume de resíduos. A prática pode ser realizada utilizando-se apenas um scanner de mesa ou, quando um leitor de microplacas estiver disponível, os dois podem ser utilizados e os resultados comparados.
AGRADECIMENTOS Os autores agradecem as bolsas e auxilio financeiro da FAPESC (Fundaçao de Amparo a Pesquisa do Estado de Santa Catarina), CNPq (Conselho Nacional de Desenvolvimento Científico e Tecnológico) e CAPES (Coordenaçao de Aperfeiçoamento de Pessoal de Nível Superior)
REFERENCIAS 1. Soldat, D. J.; Barak, P.; Lepore, B. J.; J. Chem. Educ. 2009, 86, 617. 2. Gomes, M. S.; Trevizan, L. C., Nóbrega, J. A.; Kamogawa, M. Y.; Quim. Nova 2008, 31, 1577. 3. Kohl, S. K.; Landmark, J. D.; Stickle, D. F.; J. Chem. Educ. 2006, 83, 644. 4. Cardoso, T. M. G.; Garcia, P. T.; Coltro, W. K. T.; Anal. Methods 2015, 7, 7311. 5. da Silva Lyra, W.; Sanches, F. A. C.; da Silva Cunha, F. A.; Diniz, P. H. G. D.; Lemos, S. G.; da Silva, E. C.; de Araujo, M. C. U.; Anal. Methods 2011, 3, 1975. 6. Diniz, P. H.; Dantas, H. V.; Melo, K. D.; Barbosa, M. F.; Harding, D. P.; Nascimento, E. C.; Araújo, M. C.; Anal. Methods 2012, 4, 2648. 7. dos Santos Benedetti, L. P.; dos Santos, V. B.; Silva, T. A.; Benedetti Filho, E.; Martins, V. L.; Fatibello-Filho, O.; Anal. Methods 2015, 7, 4138. 8. dos Santos Benedetti, L. P.; dos Santos, V. B.; Silva, T. A.; Benedetti-Filho, E.; Martins, V. L.; Fatibello-Filho, O.; Anal. Methods 2015, 7, 7568. 9. de Morais, C. D. L. M.; de Lima, K. M. G.; Anal. Methods 2015, 7, 6904. 10. Xia, M. L.; Wang, L.; Yang, Z. X.; Chen, H. Z.; Anal. Methods 2015, 7, 6654. 11. Fu, Q.; Wu, Z.; Li, X.; Yao, C.; Yu, S.; Xiao, W.; Tang, Y.; Biosens. Bioelectron. 2016, 81, 524. 12. Santos, P. M.; Wentzell, P. D.; Pereira-Filho, E. R.; Food Anal. Methods 2012, 5, 89. 13. dos Santos, P. M.; Pereira-Filho, E. R.; Anal. Methods 2013, 5, 3669. 14. Christodouleas, D. C.; Nemiroski, A.; Kumar, A. A.; Whitesides, G. M.; Anal. Chem. 2015, 87, 9170. 15. Lozano-Calero, D.; Martín-Palomeque, P.; Madueño-Loriguillo, S.; J. Chem. Educ. 1996, 73, 1173. 16. Murphy, J.; J. Chem. Educ. 1983, 60, 420. 17. Nagul, E. A.; McKelvie, I. D.; Worsfold, P.; Kolev, S. D. Anal. Chim. Acta 2015, 890, 60. 18. https://pt.wikipedia.org/wiki/Bebida_de_cola. Acessada em fevereiro de 2017. 19. Caballero, T.; García, A. C.; Pascual, C.; Díaz, J. M.; Ojeda, A.; J. Invest. Allergol. Clin. Immunol. 1993, 3, 160. 20. Hadas, H. I; Hiller, N.; Guberman, D.; Am. J. Gastroenterol. 1993, 88, 127. 21. Wyshak, G.; Frisch, R. E.; Journal of Adolescent Health 1994, 15, 210. 22. Hernandez, A; Stampfer, M. J.; Ravnikar, V. A.; Willet, W. C.; Schiff, I.; Francis, M.; Longscope, C.; Mckinlay, S. M. Epidemiology 1993, 42, 128. 23. https://imagej.nih.gov/ij/. Acessada em fevereiro de 2017. 24. https://imagej.nih.gov/ij/plugins/readplate/index.html. Acessada em fevereiro de 2017. 25. https://drive.google.com/open?id=0B1vZRL3RwwcxNHQzZjdBMkpaSzQ. Acessada em fevereiro de 2017. 26. Moraes, E. P.; da Silva, N. S.; de Morais, C. D. L.; Neves, L. S. D.; Lima, K. M. D.; J. Chem. Educ. 2014, 91, 1958. 27. Moraes, E. P.; Confessor, M. R.; Gasparotto, L. H. S.; J. Chem. Educ. 2015, 92, 1696. 28. Damasceno, D.; Toledob, T. G.; Godinho, M. S.; da Silva, C. P.; de Oliveira, S. B.; de Oliveira, A. E.; Quim. Nova 2015, 38, 836. 29. Byoung-Yong, C.; Bull. Korean Chem. Soc. 2012, 33, 549. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access