Artigo
|
|
| Comparação entre técnicas de extração de hidrocarbonetos policíclicos aromáticos em tecidos hepático e adiposo de tetrápodes marinhos e avaliação da heterogeneidade dos tecidos Comparison between soxhlet and microwave extraction techniques for polycylic aromatic hydrocarbons in liver and adipose tissues of marine tetrapods and evaluation of the heterogeneity of tissues |
|
Rafael André Lourenço*; Satie Taniguchi; Josilene da Silva; Patrick Simoes Dias; Márcia Caruso Bícego
Instituto Oceanográfico, Universidade de São Paulo, Praça do Oceanográfico, 191, 05508-120 São Paulo - SP, Brasil Recebido em: 01/09/2018 *e-mail: rafaell@usp.br For the evaluation of PAH extraction techniques in adipose and liver tissues of marine tetrapod, samples of some species (Pontoporia blainvillei, Chelonia mydas, Thalassarche melanophris, and Balaenoptera brydei) were spiked with PAH standards and extracted using soxhlet system and microwave oven. The results of both extraction techniques for the two different tissues of the four species of tetrapod were within the quality assurance and quality control criteria, that means both extraction techniques produced acceptable recoveries for surrogate and spiked compounds added to the sample tissues. Although both techniques of extraction met quality criteria and were considered suitable for extraction of marine tetrapod tissues, the soxhlet system produced a higher recovery of the spiked compounds and a lower standard deviation between the replicates than the microwave extraction; therefore the soxhlet system was considered the more efficient extraction method for PAH. The evaluation of liver and adipose tissue PAH accumulation, as well as the influence of tissue heterogeneity, was impaired as the concentrations of PAHs in almost all samples were lower than the detection limits of the analytical method. INTRODUÇAO Os hidrocarbonetos policíclicos aromáticos (HPA) sao compostos ubíquos no ambiente marinho e têm como principais fontes os processos de combustao incompleta de combustíveis fósseis e de biomassa, além de vazamentos, exsudaçoes naturais de petróleo e esgoto doméstico e industrial.1-3 Devido à baixa solubilidade em água os HPA tendem a se associar com partículas orgânicas e inorgânicas em suspensao e entao sao depositados no sedimento marinho.4 A absorçao dos HPA pelos animais marinhos pode ocorrer pelo contato da fase dissolvida e da fase particulada com as superfícies branquiais ou através da sua dieta.5-7 Organismos filtradores como moluscos bivalves podem acumular altas concentraçoes de HPA quando expostos a descargas constantes de esgoto ou vazamentos de petróleo.6 Já a acumulaçao em peixes se dá através do contato com as brânquias e pela dieta, enquanto que em vertebrados marinhos a exposiçao e absorçao de HPA ocorre principalmente através da sua dieta.6 A posiçao dos organismos marinhos na teia trófica tem relaçao nao apenas com a forma de absorçao dos HPA como também com a sua capacidade de metabolizaçao e de excreçao desses compostos. De forma contrária ao que ocorre com os poluentes orgânicos persistentes (POP) como os pesticidas clorados e as bifenilas policloradas (PCB) que sao biomagnificados ao longo da cadeia trófica, os HPA passam por um processo de diluiçao em direçao aos organismos topo de cadeia. Essa diluiçao é resultado da combinaçao da baixa capacidade de assimilaçao de HPA e alta capacidade de metabolizaçao desses compostos por organismos em posiçao superior na teia trófica.8-11 Em funçao das diferenças na forma de absorçao, na capacidade de metabolizaçao dos HPA pelos organismos e na lipofilicidade desses compostos, o acúmulo dos HPA pode ocorrer em maior ou menor grau em tecidos biológicos diferentes, como por exemplo no tecido adiposo, que funciona como reserva energética nos animais e no tecido hepático, que é onde ocorre a metabolizaçao dos compostos. Para avaliar e interpretar a bioacumulaçao de HPA por organismos marinhos é necessário realizar a análise desses compostos nos seus tecidos biológicos. Diversas técnicas sao descritas na literatura para a extraçao de HPA de amostras sólidas como os tecidos biológicos. Dentre as mais comuns estao o sistema soxhlet, as micro-ondas, o ultrassom, a agitaçao mecânica e a extraçao acelerada com solvente ou fluido pressurizado (ASE), que sao técnicas já estabelecidas e recomendadas por agências de controle ambiental.12-16 A escolha de uma outra técnica de extraçao envolve, entre diversos fatores, o tempo de extraçao, a quantidade de solvente orgânico necessário, a polaridade do solvente, a disponibilidade do equipamento, além da eficiência da extraçao para uma matriz específica e o custo da análise. O sistema soxhlet é o método de extraçao padrao e de referência para a análise de HPA em amostras sólidas,13 contudo trata-se um procedimento demorado (8 h de extraçao ou mais) e que requer grandes quantidades de solventes orgânicos (80 mL ou mais).17 A extraçao simultânea de diferentes amostras depende da disponibilidade de mantas de aquecimento, vidraria, espaço de bancada e exaustao adequada para os gases. A extraçao por micro-ondas14 é mais rápida (15 minutos de extraçao), requer uma quantidade menor de solventes orgânicos (< 50 mL)17 e é um método mais prático do que o soxhlet, visto que é realizada em único instrumento. Outro aspecto importante é a exposiçao do analista aos solventes, que é melhor controlada no caso da extraçao assistida por micro-ondas. A desvantagem é o tempo necessário para o resfriamento do sistema, que pode levar algumas horas, além do custo do equipamento, que é maior do que o Soxhlet. O número de extraçoes simultâneas possível no sistema de micro-ondas é limitada pelo suporte de frascos do próprio equipamento de micro-ondas. A técnica de extraçao acelerada por solvente15 requer um volume baixo de solvente orgânico (em geral < 20 mL) e a extraçao ocorre em um tempo curto, menos de 20 minutos.17 Contudo o equipamento extrai uma amostra por vez, entao dependendo do numero de amostras, o equipamento deixa de ser vantajoso em relaçao aos demais no quesito tempo. Diversos trabalhos foram publicados recentemente no Brasil envolvendo a análise de compostos orgânicos (HPA e POP) em tecidos biológicos de tetrápodes marinhos utilizando como método de extraçao soxhlet ou micro-ondas,6,18-24 contudo nenhum desses trabalhos apresentou a comparaçao entre as diferentes técnicas de extraçao ou uma avaliaçao sobre a homogeneidade dos tecidos de tetrápodes marinhos. O propósito deste trabalho foi o de apresentar uma avaliaçao e a validaçao desses dois métodos de extraçao de HPA (soxhlet e micro-ondas) em diferentes tecidos biológicos (tecido adiposo e hepático) de tetrápodes marinhos juntamente com a avaliaçao das diferenças na acumulaçao de HPA em um ou outro tecido. Espera-se assim fornecer subsídios aos órgaos ambientais para a avaliaçao da bioacumulaçao de HPA em tecidos de tetrápodes marinhos.
MATERIAIS E MÉTODOS Escolha dos animais e dos tecidos Para a avaliaçao dos métodos de extraçao e avaliaçao dos tecidos biológicos foram utilizadas amostras de tecido adiposo da regiao ventral e tecido hepático de carcaças código 2 (carcaça em boa condiçao ou fresca), segundo a sistemática de classificaçao de carcaças proposta por Geraci e Lounsboury,25 dos seguintes tetrápodes marinhos: Pontoporia blainvillei (toninha), Chelonia mydas (tartaruga verde), Thalassarche melanophris (albatroz de sobrancelha) e Balaenoptera brydei (baleia de bryde). Para a avaliaçao da heterogeneidade e do local de retirada do tecido foram utilizadas carcaças código 2 recém coletadas de P. blainvillei, C. mydas e Spheniscus magellanicus (pinguim de magalhaes) conforme descrito a seguir. Da carcaça de P. blainvillei foram coletadas amostras de tecido adiposo em três partes diferentes do animal, sendo elas: junto à nadadeira caudal, à nadadeira dorsal e da regiao ventral. As amostras de tecido hepático também foram coletadas em três locais diferentes do fígado, denominadas cranial (mais próximo à cabeça), medial (parte central) e caudal (mais próxima à cauda).26 Da carcaça de C. mydas foram coletadas amostras de tecido hepático e adiposo de três partes diferentes do animal, denominadas cranial, medial e caudal.26 Da carcaça de S. magellanicus foram coletadas amostras de tecido hepático de três partes distintas, cranial, medial e caudal.26 A coleta de tecido adiposo foi possível apenas em um local (ventre) devido ao baixo teor de gordura do animal encontrado. As diferenças de amostragem entre os animais tanto para a avaliaçao do método de extraçao quanto para a avaliaçao da heterogeneidade do tecido ocorreram devido à disponibilidade de tecidos. Os tecidos foram mantidos em temperatura -80 ºC desde a coleta até o momento das análises, de acordo com as recomendaçoes de Geracy e Lounsboury.25 Materiais utilizados Todo material utilizado, vidraria, pinças, lâminas, tubos de micro-ondas, etc. foi imerso em soluçao com detergente alcalino Extran® durante 24 horas, enxaguado com água da torneira e com água deionizada, seco em estufa ou, no caso de materiais volumétricos, em temperatura ambiente. Após seco, todo o material foi descontaminado com diclorometano e n-hexano (Merck, Alemanha) de pureza grau pesticida antes da utilizaçao. De forma alternativa, quando as características do material permitiram, o material foi calcinado a 400 ºC durante 4 horas. Agentes secantes e adsorventes como sulfato de sódio (J.T. Baker, EUA), sílica e alumina (Merck, Alemanha) foram calcinados a 400 ºC antes de serem utilizados. A água utilizada para desativar a sílica e a alumina foi deionizada e posteriormente extraída 5 vezes com n-hexano (30 mL de n-hexano para cada 2 L de água, a cada extraçao). Para a construçao da curva de calibraçao analítica e fortificaçao das amostras com os 16 HPA prioritários foi utilizado o padrao PAH-MIX (Z-014G), além de benzo[e]pireno, dibenzotiofeno e perileno (AccuStandard, EUA). Como padrao interno foi utilizada a mistura de HPA deuterados contendo naftaleno-d8, acenafteno-d10, fenantreno-d10, criseno-d12 e perileno-d12 (Internal Standard Mix - Z-014J, AccuStandard, EUA).27 Como padrao sub-rogado foi utilizado o p-terfenil-d14 (M-8270-SS, AccuStandard, EUA).27 Preparaçao das amostras de gordura e de fígado para a avaliaçao do método de extraçao e do tecido Para a análise de HPA, tanto em tecido adiposo quanto em tecido hepático, de cada um dos animais, C. mydas, P. blainvillei, T melanophris e B. brydei, foram feitas subamostragens da parte interna da amostra original de forma a evitar possíveis contaminaçoes que possam ter ocorrido na superfície da amostra em qualquer uma das etapas de coleta, de manuseio ou de armazenamento das amostras. Destas subamostras, separou-se 0,25 g que foram pesados sobre papel alumínio utilizando balança analítica. Essa fraçao de 0,25 g de amostra foi entao macerada com 10 g de sulfato de sódio anidro em gral com pistilo para a retençao da água presente na amostra. Nos casos em que a gordura apresentou resistência à maceraçao, como no caso da gordura do P. blainvillei, foi necessário triturar a gordura utilizando pinça e lâmina de forma a possibilitar o melhor contato entre a amostra e o sulfato de sódio. Essas amostras maceradas foram transferidas para cartuchos de vidro com fundo poroso de vidro sinterizado para a extraçao por soxhlet e para frascos de teflon GreenChem® para a extraçao por micro-ondas. As amostras foram entao fortificadas com os 16 HPA prioritários além de benzo[e]pireno, dibenzotiofeno e perileno em dois níveis de concentraçao, baixo (concentraçao final de 20 ng g-1 peso úmido) e alto (concentraçao final de 2000 ng g-1 peso úmido). Houve a necessidade de fortificaçao das amostras pois análises preliminares indicaram concentraçoes nao detectáveis nos tecidos, o que impossibilitaria a comparaçao das eficiências dos métodos de extraçao. Além da fortificaçao foi adicionado às amostras o padrao sub-rogado p-terfenil-d14 (500 ng). Esse procedimento foi repetido para a formaçao de cinco replicatas de amostras de tecido adiposo e para a formaçao de cinco replicatas de tecido hepático de cada um dos quatro animais, para cada um dos dois níveis de fortificaçao, para cada um dos dois tipos de extraçao, totalizando assim, vinte replicatas de cada tecido de cada um dos quatro animais, o que gerou um total de 160 amostras (Figura 1).
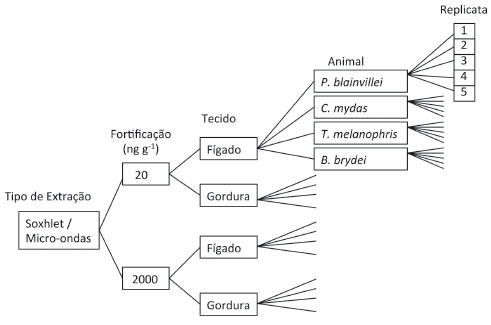 Figura 1. Esquematizaçao do experimento para a avaliaçao do método de extraçao e do tecido do animal
Preparaçao das amostras de gordura e de fígado para a avaliaçao da heterogeneidade dos tecidos e do local de retirada do tecido adiposo Para avaliar a influência da heterogeneidade dos tecidos nas replicatas foram realizadas análises de HPA em quatro amostras: três amostras de cada tecido, adiposo e hepático, coletadas em três locais diferentes; e uma quarta amostra composta de cada tecido destes três locais (Figura 2). Essa avaliaçao foi realizada de forma completa para os tecidos de P. blainvillei e de C. mydas. Para o S. magellanicus, a avaliaçao foi realizada apenas em tecido hepático devido à ausência de tecido adiposo em massa suficiente.
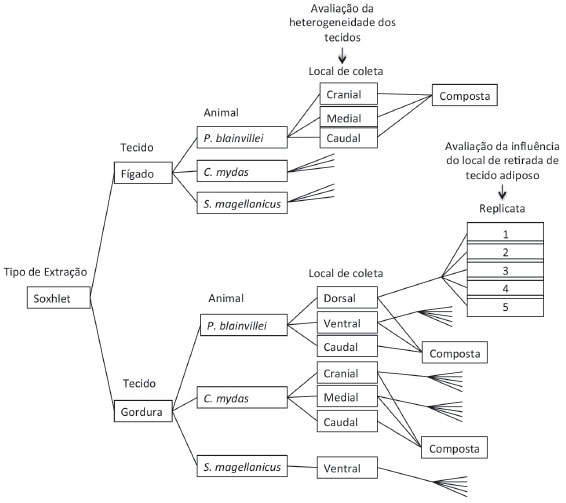 Figura 2. Esquematizaçao do experimento para a avaliaçao da heterogeneidade dos tecidos e da influência do local de coleta do tecido adiposo
As amostras compostas foram preparadas a partir de 0,25 g de cada amostra de tecido, que foram maceradas e homogeneizadas. Uma massa de 0,25 g dessa amostra composta foi separada para análise. Para avaliar a influência do local de coleta de tecido adiposo do corpo do animal foram realizadas análises de HPA em cinco replicatas de tecidos retirados de dois diferentes locais (Figura 2). Para a avaliaçao em P. blainvillei, optou-se pelos tecidos retirados junto à nadadeira dorsal e da regiao ventral. Em C. mydas optou-se pelo tecido adiposo retirado das regioes cranial e medial.26 Em S. magellanicus foram realizadas análises apenas de tecido da regiao ventral. A opçao por tais locais se deu em funçao da massa de amostra disponível. O experimento para a avaliaçao da heterogeneidade dos tecidos e da influência do local de retirada do tecido adiposo totalizou 45 amostras, que receberam o mesmo tratamento citado anteriormente, excluindo-se a fortificaçao com HPA. Extraçao das amostras por soxhlet A extraçao das amostras por soxhlet foi realizada seguindo os cuidados dispostos no protocolo da USEPA 3540c.13 Os cartuchos de vidro contendo as amostras já com padrao sub-rogado e/ou fortificadas foram inseridos nos extratores soxhlet (volume do extrator = 60 mL) acoplados a baloes de vidro de 125 mL contendo 80 mL de mistura de n-hexano com diclorometano (1:1, v:v). Em cada batelada de extraçao foram extraídas simultaneamente 23 amostras, que é o número de sistemas soxhlet disponível no laboratório. A extraçao foi realizada durante o período de 8 horas. Após a extraçao e resfriamento do sistema os extratos foram concentrados para 1 mL em evaporador rotativo com pressao reduzida, de onde se retirou 0,1 mL para determinaçao do teor lipídico. Extraçao das amostras por micro-ondas Para a extraçao por micro-ondas foi utilizado um aparelho de micro-ondas CEM modelo MARS-X 230/60 (CEM, EUA) equipado com frascos de teflon GreenChem® e agitaçao magnética individual nos frascos. O sistema permite o posicionamento simultâneo de até 14 frascos GreenChem®. A extraçao das amostras por micro-ondas foi realizada seguindo os cuidados dispostos no protocolo da USEPA 3546.14 Em cada batelada de extraçao foram extraídas simultaneamente 12 amostras, que é o número de frascos disponíveis no laboratório. Os frascos de teflon contendo as amostras já com padrao sub-rogado e/ou fortificadas foram submetidos às condiçoes de extraçao adaptadas de metodologias estabelecidas na literatura e otimizadas para análise de contaminantes orgânicos em tecidos biológicos.23,28,29 Para a extraçao foram utilizados 40 mL de mistura de n-hexano com diclorometano (1:1, v:v). O forno de micro-ondas foi programado para aquecer a 115 ºC durante 15 minutos. Após a extraçao e o resfriamento do sistema (cerca de 6 horas), os extratos foram concentrados para 1 mL em evaporador rotativo com pressao reduzida, de onde se retirou 0,1 mL para determinaçao do teor lipídico. Determinaçao do peso lipídico Para a determinaçao do peso lipídico foi seguido o método gravimétrico descrito no protocolo USEPA 1699.30 Os 0,1 mL dos extratos orgânicos foram transferidos para frascos de vidro previamente pesados em balança analítica. Após a evaporaçao total do solvente em temperatura ambiente cada frasco foi novamente pesado e a diferença de massa (resíduo) foi utilizada no cálculo da percentagem de lipídios. Purificaçao dos extratos Para a etapa de purificaçao dos extratos orgânicos contendo os HPA, tanto para as amostras de gordura quanto para as amostras de fígado, independentemente do tipo de extraçao, soxhlet ou micro-ondas, foi utilizado o mesmo procedimento, com adaptaçoes da metodologia estabelecida na literatura.31,32 Foram seguidas também as recomendaçoes e cuidados dispostos nos protocolos USEPA 3610, USEPA 3630 e USEPA 3640.33-35 Os 0,9 mL de cada um dos extratos restantes foram eluídos com 80 mL de mistura de n-hexano e diclorometano (1:1, v:v) através de coluna de vidro (25 cm de altura x 1,5 cm de diâmetro interno) contendo 8 g de sílica gel sobre 16 g de alumina e 1 g de sulfato de sódio no topo. A sílica e a alumina foram previamente desativadas em 5% com água (água deionizada e extraída com n-hexano). Esse procedimento teve como finalidade reduzir parcialmente a carga de lipídios para a purificaçao complementar além da retirada de outros compostos relativamente mais polares que os HPA. Para purificaçao complementar, o eluato da coluna de vidro foi concentrado a 0,5 mL em evaporador rotativo com pressao reduzida e injetado no cromatógrafo a líquido de alta eficiência (CLAE - Perkin Elmer LC-250) acoplado a um detector de UV/Visível (Perkin Elmer, LC-95) equipado com uma pré-coluna (Phenomenex 286039-8, Phenogel 03B-2090K0 Guard 10 µL, 50 x 7,8 mm) seguida de duas colunas de exclusao por tamanho conectadas em série (Phenogel 10µ, 100 A, 22,5 x 250 mm, Phenomenex, EUA). Diclorometano foi utilizado para a eluiçao com um fluxo de 5 mL min-1. Para o monitoramento da eluiçao dos HPA foi utilizado o detector UV/visível no comprimento de onda de 254 nm. Os lipídios remanescentes da coluna de vidro foram eluídos entre 0 e 30 min e essa fraçao foi descartada. Na sequência foi coletada a fraçao contendo os HPA, eluída entre 30 e 40 min. Os extratos das amostras que receberam fortificaçao de 20 ng g-1 foram concentrados para 90 µL em evaporador rotativo com pressao reduzida seguindo de fluxo de N2(g), onde adicionou-se 50 ng de cada padrao interno deuterado (naftaleno-d8, acenafteno-d10, fenantreno-d10, criseno-d12 e perileno-d12). Os extratos das amostras que receberam fortificaçao de 2000 ng g-1 e os extratos que nao receberam fortificaçao foram concentrados para 900 µL onde adicionou-se 500 ng de cada padrao interno deuterado citado anteriormente. Identificaçao e quantificaçao dos HPA A análise e quantificaçao dos HPA foi realizada seguindo o disposto no protocolo USEPA 8270.27 Foi preparada a curva de calibraçao analítica para a quantificaçao dos HPA (16 HPA prioritários, benzo[e]pireno, dibenzotiofeno e perileno) abrangendo a faixa de concentraçao no extrato entre 0,05 ng µL-1 e 5,0 ng µL-1. De forma a melhorar a precisao e exatidao analítica, a curva de calibraçao foi dividida em duas partes, a primeira variando entre 0,05 ng µL-1 e 1,2 ng µL-1 (0,05 ng µL-1, 0,1 ng µL-1, 0,25 ng µL-1, 0,5 ng µL-1, 0,8 ng µL-1 e 1,2 ng µL-1) e a segunda variando entre 1,2 ng µL-1 e 5,0 ng µL-1 (1,2 ng µL-1, 2,0 ng µL-1, 2,5 ng µL-1, 3,5 ng µL-1, 5,0 ng µL-1). A equaçao de reta da curva de calibraçao de cada um dos compostos apresentou coeficiente de determinaçao (R2) superior a 0,99. Os HPA foram analisados no cromatógrafo a gás equipado com espectrômetro de massas (CG-EM) Agilent Technologies 6890/5973N. A aquisiçao dos dados foi feita em modo de monitoramento seletivo de íons. A temperatura no injetor e na interface foi programada em 280 ºC e a temperatura na fonte de íons foi programada em 300 ºC. Foi utilizada uma coluna cromatográfica HP-5MS (Agilent J&W GC columns) com 30 metros de comprimento, 0,25 mm de diâmetro interno e 0,25 µm de espessura de filme de 5% fenilmetilsiloxana. A rampa de temperatura do cromatógrafo teve início em 40 ºC, com aumento de temperatura a taxa de 20 ºC min-1 até 60 ºC, entao a temperatura foi elevada até 290 ºC a 5 ºC min-1, onde permaneceu por 5 minutos e, por fim, a temperatura foi elevada até 300 ºC a taxa de 10 ºC min-1, onde foi mantida constante durante 10 minutos. A quantificaçao foi feita pelo modo de padronizaçao interna com base nas curvas de calibraçao. A identificaçao dos HPA foi feita por comparaçao dos tempos de retençao com padroes de referência da Accustandard (EUA) e através da razao massa/carga (m/z). A identificaçao dos compostos alquilados (alquil-naftalenos, alquil-fluorenos, alquil-fenantrenos/antracenos, alquil-dibenzotiofenos e alquil-fluorantenos/pirenos) foi realizada através da razao m/z e a quantificaçao baseada nos respectivos HPA nao alquilados (Tabela 1S). Os limites de detecçao do método (LDM) foram definidos como 3 vezes o desvio padrao da quantificaçao de 7 replicatas de uma amostra (LDM = 7 x DP),36 o Limite de Quantificaçao do Método foi definido como 3 vezes o LDM (Tabela 2S). Procedimentos para o controle de qualidade Para cada conjunto de amostras extraídas foi analisado também um branco analítico (10 g de sulfato de sódio). Os brancos analíticos foram analisados de forma idêntica às amostras de tecidos biológicos. Foram analisados também brancos fortificados nas mesmas concentraçoes utilizadas nas amostras de tecidos biológicos. Foram consideradas válidas as amostras e brancos nas quais a recuperaçao do padrao sub-rogado esteve entre 60 e 120%. Devido à inexistência de material de referência certificado (MR) de HPA em tecidos de tetrápodes marinhos, foi analisado o MR de tecido de mexilhao (NIST, SRM 2974a, Organics in Freeze-Dried Mussel Tissue - Mytilus edulis) utilizando tanto o soxhlet quanto micro-ondas para a extraçao. Todas as amostras de tecido adiposo e hepático dos quatro animais foram analisadas também sem fortificaçao, de forma a viabilizar a análise da recuperaçao dos compostos adicionados. Avaliaçao estatística dos resultados A avaliaçao estatística visou a avaliaçao da influência de seis fatores: animal marinho, tecido do animal, nível de concentraçao, método de extraçao, variabilidade do tecido e local de retirada do tecido para determinaçao de HPA totais. A influência de cada um dos fatores de entrada na variável de resposta (concentraçao total de HPA) foi avaliada a partir da Análise de Variância (ANOVA) com uso da Análise Fatorial para verificar a hipótese nula (H0) entre as variáveis. Todos os testes foram realizados considerando o nível de significância de α=0.05 e considerando o valor de probabilidade (p-value) de cada teste.
RESULTADOS E DISCUSSOES Avaliaçao do método de extraçao nos diferentes tecidos biológicos Sao descritos a seguir de forma resumida os resultados das extraçoes em cada um dos tecidos analisados nos diferentes animais, pelos dois métodos de extraçao, soxhlet e micro-ondas, nos dois níveis de fortificaçao. A recuperaçao do padrao sub-rogado nas amostras variou entre 60 e 100%. A análise do material de referência produziu resultados válidos pelos dois métodos de extraçao. Nao foram detectados interferentes nos brancos analíticos. Na Tabela 1 é apresentada a síntese da recuperaçao dos HPA adicionados às amostras, nas 5 replicatas de cada tecido, nos diferentes níveis de fortificaçao para os diferentes métodos de extraçao empregados. Os resultados completos das análises sao apresentados na Tabela 3S.
Pontoporia blainvillei O teor de lipídios no tecido adiposo foi de 56%, enquanto no tecido hepático o teor de lipídios foi de 7%. As concentraçoes de todos os HPA nos tecidos de P. blainvillei sem a fortificaçao foram inferiores aos limites de detecçao do método. Na Figura 3 sao apresentados os resultados médios de recuperaçao em percentagem de cada um dos HPA nas 5 replicatas de tecido hepático e de gordura nos dois níveis de fortificaçao e o desvio padrao das recuperaçoes. De forma geral a recuperaçao dos HPA foi melhor quando a extraçao foi realizada por soxhlet do que quando foi realizada por micro-ondas em todos os casos. Além disso, o desvio padrao das recuperaçoes dos HPA foi menor quando foi empregado o sistema soxhlet (Tabela 1).
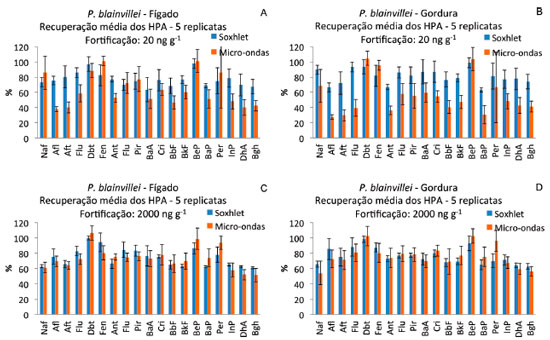 Figura 3. Recuperaçao percentual média dos HPA e desvio padrao das recuperaçoes (barras verticais) nas 5 replicatas de tecido hepático (A e C) e gordura (B e D) de P. blainvillei fortificados com 20 (A e B) e 2000 ng g-1 (C, D) de HPA (peso úmido). Naf: Naftaleno, Afl: Acenaftileno, Aft: Acenafteno, Flu: Fluoreno, Dbt: Dibenzotiofeno, Fen: Fenantreno, Ant: Antraceno, Flu: Fluoreno, Pir: Pireno, BaA: Benzo[a]antraceno, Cri: Criseno, BbF: Benzo[b]fluoranteno, BkF: Benzo[k]fluoranteno, BeP: Benzo[e]pireno, BaP: Benzo[a]pireno, InP: Indeno[1,2,3,c-d]pireno, DhA: Dibenzo[a,h]antraceno, Bghi:Benzo[g,h,i]perileno
Chelonia mydas O teor de lipídios no tecido adiposo foi de 69%, enquanto no tecido hepático o teor de lipídios foi de 8%. Nas amostras de gordura da C. mydas, sem a fortificaçao, foram detectados naftaleno (19,6 ng g-1 extraído por soxhlet e 20,6 ng g-1 extraído por micro-ondas), fenantreno (3,4 ng g-1 por soxhlet e 5,4 ng g-1 por micro-ondas), pireno (3,1 ng g-1 por soxhlet e 3,5 ng g-1 por micro-ondas) e criseno (3,4 ng g-1 por soxhlet e 3,4 ng g-1 por micro-ondas). Para a avaliaçao das recuperaçoes dos HPA adicionados, essas concentraçoes foram descontadas das concentraçoes das amostras fortificadas. Nas amostras de fígado sem fortificaçao nao foram detectados os HPA. Sao apresentados na Figura 4 os resultados médios de recuperaçao em percentagem de cada um dos HPA nas 5 replicatas de tecido hepático e de gordura nos dois níveis de fortificaçao e o desvio padrao das recuperaçoes. Assim como observado para os tecidos de P. blainvillei, a recuperaçao dos HPA em ambos os tecidos de C. mydas também foi superior quando o soxhlet foi empregado como método de extraçao e o desvio padrao das recuperaçoes dos HPA foi menor (Tabela 1).
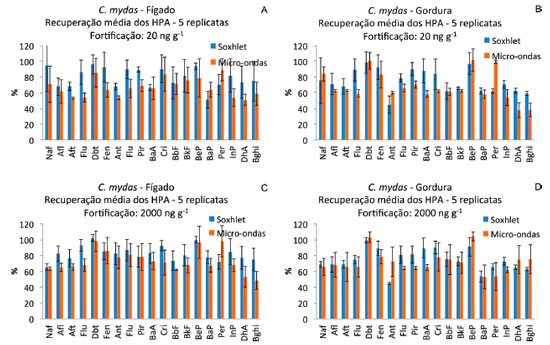 Figura 4. Recuperaçao percentual média dos HPA e desvio padrao das recuperaçoes (barras verticais) nas 5 replicatas de tecido hepático (A e C) e gordura (B e D) de C. mydas fortificados com 20 (A e B) e 2000 ng g-1 (C, D) de HPA (peso úmido)
Thalassarche melanophris O teor de lipídios no tecido adiposo foi de 50%, enquanto no tecido hepático o teor de lipídios foi de 4%. As concentraçoes de HPA nos tecidos avaliados de T. melanophris sem a fortificaçao foram inferiores aos limites de detecçao do método. Na Figura 5 sao apresentados os resultados médios de recuperaçao em percentagem de cada um dos HPA nas 5 replicatas de tecido hepático e de gordura nos dois níveis de fortificaçao e o desvio padrao das recuperaçoes. Assim como observado para os tecidos de P. blainvillei e C. mydas, a recuperaçao dos HPA em tecido de T. melanophris foi maior quando a extraçao foi realizada por soxhlet do que quando foi realizada por micro-ondas e o soxhlet produziu um menor desvio padrao na recuperaçao dos HPA (Tabela 1).
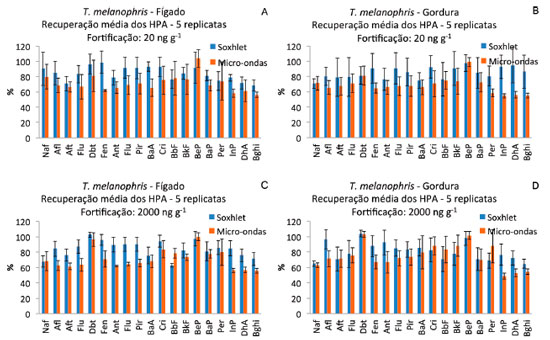 Figura 5. Recuperaçao percentual média dos HPA e desvio padrao das recuperaçoes (barras verticais) nas 5 replicatas de tecido hepático (A e C) e gordura (B e D) de T. melanophris fortificados com 20 (A e B) e 2000 ng g-1 (C, D) de HPA (peso úmido)
Balaenoptera brydei O teor de lipídios no tecido adiposo foi de 44%, enquanto no tecido hepático foi de 8%. As concentraçoes de HPA nos tecidos avaliados de B. brydei sem a fortificaçao foram inferiores aos limites de detecçao do método. Para o tecido de B. brydei (Figura 6), assim como para todas as outras espécies citadas anteriormente, a recuperaçao dos HPA foi melhor quando foi empregado o soxhlet como método de extraçao dos tecidos e este método produziu um menor desvio padrao na recuperaçao dos HPA (Tabela 1).
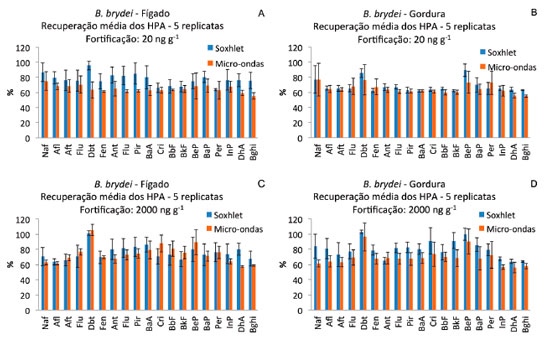 Figura 6. Recuperaçao percentual média dos HPA e desvio padrao das recuperaçoes (barras verticais) nas 5 replicatas de tecido hepático (A e C) e gordura (B e D) de B. brydei fortificados com 20 (A e B) e 2000 ng g-1 (C, D) de HPA (peso úmido)
Apesar de ambos os métodos de extraçao empregados satisfazerem os critérios de qualidade analítica, os resultados das análises de HPA em amostras de tecido adiposo e hepático dos quatro animais estudados mostraram que, independentemente do animal e do tipo de tecido, a extraçao por soxhlet foi mais exata, isto é apresentou maior recuperaçao dos compostos e, de forma geral, foi mais precisa, uma vez que produziu um menor desvio padrao na recuperaçao tanto para as amostras fortificadas com 20 quanto para as amostras fortificadas com 2000 ng g-1 (peso úmido) de HPA (Tabelas 1 e 2). A utilizaçao de micro-ondas para a extraçao dos HPA mostrou menor recuperaçao de HPA, especialmente para os HPA de 5 e 6 anéis aromáticos indeno[1,2,3-c,d]pireno, dibenzo[a,h]antraceno e benzo[ghi]perileno (Tabelas 1S e 2S, Material Suplementar). A menor eficiência de extraçao no micro-ondas em relaçao ao soxhlet, para o método empregado, pode estar relacionada à constante dielétrica (ε) baixa dos solventes utilizados, n-hexano (ε=1,9) e do diclorometano (ε=9,1) ou seja, esses solventes têm pouca capacidade de absorver micro-ondas. A USEPA14 sugere a utilizaçao da mistura hexano-acetona para a extraçao de HPA em matrizes sólidas utilizando micro-ondas devido à maior capacidade de absorçao de micro-ondas (ε=20). A opçao de nao utilizar a acetona na extraçao por micro-ondas ocorreu em funçao de testes realizados previamente, onde foram encontrados interferentes no branco analítico mesmo sendo utilizada nesses testes a acetona de grau pesticida. Podemos considerar também o fato de que os tecidos biológicos e os lipídios sofrem cozimento com as micro-ondas e nao há registro na literatura das consequências dessa degradaçao dos tecidos e lipídios para a análise de HPA em tetrápodes marinhos. A análise estatística ANOVA comparando as técnicas de extraçao, os tecidos dos tetrápodes e os níveis de fortificaçao das amostras com HPA (Tabela 4S) mostrou, em alguns casos, diferenças significativas entre as técnicas de extraçao para os diferentes tecidos biológicos e para as diferentes concentraçoes de HPA. Apesar dessas diferenças significativas apontadas pelo teste estatístico, é necessário considerar que: 1) as concentraçoes originais de HPA nas amostras utilizadas foram inferiores ao limite de quantificaçao do método, exceto o tecido adiposo de C. mydas, onde os HPA detectados foram descontados da fortificaçao para a avaliaçao; 2) as amostras dos dois tecidos foram fortificadas com os HPA nas mesmas concentraçoes, portanto as concentraçoes nominais de HPA em ambos os tecidos sao idênticas; 3) os critérios de qualidade analítico estabelecidos foram atendidos, portanto ambos os métodos de extraçao foram validados. Dessa forma a análise estatística reflete principalmente as variaçoes das recuperaçoes dos compostos entre os métodos de extraçao e entre os tecidos, e nao invalida um ou outro método visto que ambos os métodos de extraçao, para ambos os tecidos, atenderam os critérios de qualidade do método analítico. Avaliaçao da heterogeneidade dos tecidos e do local de retirada do tecido adiposo As 45 amostras de tecidos de animais marinhos (P. blainvillei, C. mydas e S. magellanicus) obtidas para a avaliaçao da heterogeneidade dos tecidos e do local de retirada do tecido adiposo foram extraídas apenas por soxhlet em funçao dos resultados apresentados na avaliaçao do método de extraçao. A recuperaçao do padrao sub-rogado em todas as replicatas, tanto de tecido adiposo quanto de tecido hepático variou entre 61% e 93%. Todas as amostras de tecidos adiposo e hepático retiradas das diferentes partes dos animais assim como as amostras compostas desses tecidos apresentaram concentraçoes de HPA inferiores aos limites de detecçao do método analítico. Este fato impediu a avaliaçao sobre alguma preferência na bioacumulaçao de HPA em uma ou outra parte no tecido destes animais.. A ausência de HPA na maioria dos tecidos analisados também nao permitiu verificar a diferença de bioacumulaçao entre o tecido hepático e adiposo.
CONCLUSOES Os resultados obtidos pelos dois métodos de extraçao, para os dois tecidos, para os quatro animais produziram recuperaçoes aceitáveis tanto do composto sub-rogado como dos HPA adicionados às amostras. Apesar do teste estatístico mostrar, em alguns casos, diferenças significativas entre os métodos de extraçao e entre os tecidos, os dois métodos de extraçao atenderam aos critérios de qualidade dos resultados analíticos. A extraçao por soxhlet produziu uma melhor recuperaçao dos HPA e um menor desvio padrao da recuperaçao entre as replicatas do que a extraçao por micro-ondas. Devido ao grande número de amostras analisadas, a extraçao pelo soxhlet ocorreu de forma mais rápida do que pelo micro-ondas em funçao da utilizaçao de 23 sistemas de soxhlet, que permitiram um maior número de extraçoes simultâneas. A avaliaçao da heterogeneidade dos tecidos e do local de retirada do tecido adiposo ficou comprometida, pois nao foram detectados HPA em nenhuma das amostras de nenhum dos tecidos analisados. Para a continuidade deste estudo sugere-se aos futuros trabalhos que envolvam a avaliaçao da bioacumulaçao de HPA por tetrápodes marinhos que sejam coletados, sempre que possível, o tecido do fígado e a gordura em diferentes partes do animal e que a análise do conjunto total de amostras seja realizada quando uma dessas amostras apresentar concentraçoes de HPA maiores que o limite de detecçao.
MATERIAL SUPLEMENTAR No Material Suplementar sao informados os íons de quantificaçao e de confirmaçao para a análise dos HPA (Tabela 1S), os limites de detecçao e de quantificaçao do método analítico (Tabela 2S), o conjunto completo de concentraçoes e de recuperaçoes dos HPA adicionados em todas as amostras de tecidos biológicos analisadas (Tabela 3S) e os resultados do teste estatístico (Tabela 4S). Esse material está disponível em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Esse trabalho foi financiado pelo Petróleo Brasileiro S.A (Petrobras) e faz parte das atividades da otimizaçao de metodologia analítica no âmbito do PMP-BS (Projeto de Monitoramento de Praias da Bacia de Santos) realizado em atendimento às exigências do processo de licenciamento ambiental da Atividade de Produçao e Escoamento de Petróleo e Gás Natural do Polo Pré-Sal da Bacia de Santos - ETAPA 2 conduzido pelo IBAMA. Os autores agradecem ao Projeto Biopesca pela disponibilizaçao de algumas das amostras de tecido utilizadas nesse trabalho. Os autores agradecem também ao Centro de Pesquisas & Desenvolvimento Leopoldo Américo Miguez de Mello (CENPES) da PETROBRAS e aos revisores anônimos da revista Química Nova pelas discussoes e valiosas sugestoes para a melhoria do trabalho.
REFERENCIAS 1. Golomb, D.; Barry, E.; Fisher, G.; Varanusupakul, P.; Koleda, M.; Rooney, T.; Atmos. Environ. 2001, 35, 6245. 2. Kowalewska, G.; Konat, J.; Oceanologia 1997, 39, 83. 3. Zhang, S.; Zhang, Q.; Darisaw, S.; Ehie, O.; Wang, G.; Chemosphere 2007, 66, 1057. 4. Yu, Y.; Xu, J.; Wang. P.; Sun, H.; Dai, S.; J. Hazard. Mater. 2009, 165, 494. 5. Baumard, P.; Budzinski, H.; Garrigues, P.; Narbonne, J. F.; Burgeot, T.; Michel, X.; Belloccq, J.; Mar. Environ. Res. 1999, 47, 415. 6. Lourenço, R. A.; Oliveira, F. F.; Souza, J. M.; Nudi, A. H.; Wagener, A. L. R.; Meniconi, M. F. G.; Francioni, E.; Environ. Sci. Pollut. Res. 2016, 23, 17113. 7. Webster, L.; Tronczynski, J.; Korytar, P.; Booij, K.; Law, R.; ICES Tech. Mar. Environ. Sci. 2009, 45, 26. 8. Wan, Y.; Jin, X.; Hu, J.; Jin, F.; Environ. Sci. Technol. 2007, 41, 3109. 9. Nakata, H.; Sakai, Y.; Miyawaki, T.; Takemura, A.; Environ. Sci. Technol. 2003, 37, 3513. 10. Broman, D.; Näuf, C.; Lundbergh, I.; Zebühr, Y.; Environ. Toxicol. Chem. 1990, 9, 429. 11. Takeuchi, I.; Miyoshi, N.; Mizukawa, K.; Takada, H.; Ikemoto, T.; Omori, K.; Tsuchiya, K.; Mar. Pollut. Bull. 2009, 58, 663. 12. Oluseyi, T.; Olayinka, K.; Alo, B.; Smith, R. M.; Afr. J. Environ. Sci. Technol. 2011, 5, 482. 13. https://www.epa.gov/sites/production/files/2015-12/documents/3540c.pdf, acessada em dezembro de 2018. 14. https://www.epa.gov/sites/production/files/2015-12/documents/3546.pdf, acessada em dezembro de 2018. 15. https://www.epa.gov/sites/production/files/2015-06/documents/epa-3545a.pdf, acessada em dezembro de 2018. 16. https://www.epa.gov/sites/production/files/2015-12/documents/3550c.pdf, acessada em dezembro de 2018. 17. Giergielewicz-Mozajska, H.; Dabrowski, L.; Namiésnik, J.; Crit. Rev. Anal. Chem. 2001, 31, 149. 18. Méndez-Fernandez, P.; Taniguchi, S.; Santos, M. C. O.; Cascao, I.; Quérouil, S.; Martín, V. Tejedor, M.; Carrillo, M.; Rinaldi, C.; Rinaldi, R.; Montone, R. C.; Environ. Pollut. 2018, 236, 785. 19. Méndez-Fernandez, P.; Polesi, G.; Taniguchi, S.; Santos, M. C. O.; Montone, R. C.; Mar. Pollut. Bull. 2016, 107, 364. 20. Montone, R. C.; Taniguchi, S.; Colabuono, F. I.; Martins, C. C.; Cipro, C. V. Z.; Barroso, H. S.; da Silva, J.; Bícego, M. C.; Weber, R. R.; Mar. Pollut. Bull. 2016, 106, 377. 21. Cipro, C. V. Z.; Colabuono, F. I.; Taniguchi, S.; Montone, R. C.; Mar. Pollut. Bull. 2013, 77, 396. 22. Colabuono, F. I.; Barquete, V.; Taniguchi, S.; Ryan, P. G.; Montone, R. C.; Mar. Pollut. Bull. 2014, 83, 241. 23. Dias, P. S.; Cipro, C. V. Z.; Taniguchi, S.; Montone, R. C.; Mar. Pollut. Bull. 2013, 74, 435. 24. Leonel, J.; Taniguchi, S.; Sasaki, D. K.; Cascaes, M. J.; Dias, P. S; Botta, S.; Santos, M. C. O.; Montone, R. C.; Chemosphere 2012, 86, 741. 25. Geraci, J. R.; Lounsbury, V. J.; Marine Mammals Ashore: a field guide for strandings, 1st ed., Texas A&M Sea Grant Publications: Texas, 1993. 26. Pugliares, K. R.; Bogomolni, A.; Touhey, K. M.; Herzig, S. M.; Harry, C. T.; Moore, M. J.; Marine Mammal Necropsy: An introductory guide for stranding responders and field biologists, 1st ed., Woods Hole Oceanographic Institution: Massachusetts, 2007. 27. https://www.epa.gov/sites/production/files/2015-07/documents/epa-8270d.pdf, acessada em dezembro de 2018. 28. Jayaraman, S.; Pruell, R. J.; McKinney, R.; Chemosphere 2001, 44, 181. 29. Tapie, N.; Budzinski, H.; Le Ménach, K.; Anal. Bioanal. Chem. 2008, 391, 2169. 30. https://www.epa.gov/sites/production/files/2015-10/documents/method_1699_2007.pdf, acessada em dezembro de 2018. 31. Sericano, J. L.; Tese de Doutorado, College of Geosciences and Maritime Studies of Texas A&M University, Estados Unidos da América, 1993. 32. Taniguchi, S.; Montone, R. C.; Bícego, M. C.; Colabuono, F. I.; Weber, R. R.; Sericano, J. L.; Mar. Pollut. Bull. 2009, 58, 129. 33. https://www.epa.gov/sites/production/files/2015-12/documents/3610b.pdf, acessada em dezembro de 2018. 34. https://www.epa.gov/sites/production/files/2015-12/documents/3630c.pdf, acessada em dezembro de 2018. 35. https://www.epa.gov/sites/production/files/2015-12/documents/3640a.pdf, acessada em dezembro de 2018. 36. Wade, T. L.; Cantillo, Y. A.; Use of Standards and Reference Materials in the Measurement of Chlorinated Hydrocarbon Residues, 1st ed., Paris, 1996. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access