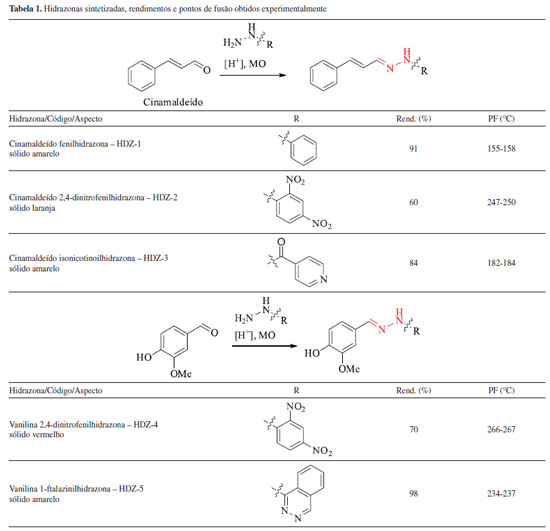
Artigo
|
|
| Síntese, atividade antileshmania e citotóxica de hidrazonas derivadas de aldeídos naturais Synthesis, antileshmania and cytotoxic activity of hydrazones from natural aldehydes |
|
Débora Caroline Marques de SouzaI; Valéria Carlos de SousaII; Lucas Pereira Lima da CruzII; Sabrina Maria Portela CarneiroII; Michel Muálem de Moraes AlvesIII; Fernando Aécio de Amorim CarvalhoIV; Marcília Pinheiro da CostaII; Cíntia Marques CorrêaI; Arlan de Assis GonsalvesI; Cleônia Roberta Melo AraújoI,*
I. Colegiado de Ciências Farmacêuticas, Universidade Federal do Vale do São Francisco, 56304-97 Petrolina - PE, Brasil Recebido em 10/07/2019 *e-mail: cleonia.araujo@univasf.edu.br Leishmaniasis is endemic anthropozoonosis considered to be a severe public health problem. The treatment with pentavalent antimonials presents high toxicity motivating the search for effective and less toxic drugs. Hydrazones and N-acylhydrazones are functional groups that are prominent in Medicinal Chemistry, including as antiprotozoals. In this context, five hydrazones derived from the natural aldehydes were synthesized and the molecular structures were suitably determined to employ uni and bidimensional 1H and 13C NMR techniques. The antileishmanial activity of all hydrazones was determined against promastigote forms of Leishmania amazonensis, and the compounds HDZ-3, HDZ-4, and HDZ-5 showed the best results, with IC50 of 9.00, 38.10 and 26.30 µM, respectively. In the cytotoxic evaluation against RAW macrophages, HDZ-4 presented the least cytotoxic (CC50 = 222.24 µM) and the higher selectivity. Lipinski's descriptors of the hydrazones were calculated, and the compounds HDZ-3 and HDZ-5 were more promising. These hydrazones are hybrids of natural aldehydes with drugs, the first is the result of the junction of the cinnamaldehyde with isoniazid, and the second of the vanillin with hydralazine. The results highlighted the Markush isonicotinoylhydrazone and phthalazinylhydrazone groups, molecular structures that are present in HDZ-3 and HDZ-5 and are therefore considered innovators in the development of antileishmanial drugs. INTRODUÇÃO As leishmanioses são doenças parasitárias negligenciadas causadas por mais de 20 espécies de protozoários do gênero Leishmania. A transmissão para os humanos ocorre durante o repasto sanguíneo de flebotomíneos da família Phlebotomus (Velho Mundo) e Lutzomyia (Novo Mundo), sendo apenas as fêmeas hematófagas responsáveis pela inoculação das formas promastigotas na pele do hospedeiro.1 As leishmanioses são consideradas endêmicas em 98 países, afetando 12 milhões de pessoas, com 350 milhões em risco de contrair a infecção, especialmente populações de baixa renda nos países subdesenvolvidos.2 A espécie Leishmania amazonensis está associada ao desenvolvimento de leishmaniose cutânea com a formação de úlceras necróticas, sendo capaz ainda de causar a forma disseminada da doença.3 Os fármacos de primeira escolha são os antimoniais pentavalentes (antimoniato de N-metilglucamina), e os de segunda escolha, anfotericina B e pentamidina.4 Nos últimos anos tem havido relatos de casos de resistência ao tratamento com antimoniais, e uma terapêutica de substituição bem sucedida é o uso clínico do fármaco Miltefosina.5, 6 Porém, até o momento, a leishmaniose configura-se como uma doença de difícil controle devido a inexistência de vacinas para humanos, e as terapias farmacológicas disponíveis apresentam variada eficácia e segurança devido ao tempo prologado de tratamento, uma gama de reações adversas, necessidade de administração parenteral, além do possível surgimento de resistência, acarretando uma baixa adesão ao tratamento por parte dos pacientes. Porém, até o momento, as terapias farmacológicas contra as leishmanioses apresentam uma série de desvantagens, tais como, alto custo, tempo prologado de tratamento, alta toxicidade e uma gama de efeitos adversos, o que acarreta uma baixa adesão ao tratamento por parte dos pacientes. Diante desses problemas novas moléculas vêm sendo estrategicamente sintetizadas para o tratamento das leishmanioses, e surgem como uma alternativa promissora para superar esses inconvenientes e proporcionar uma terapia mais adequada ao paciente. As recentes descobertas de alvos moleculares e os avanços da química computacional, em muito têm contribuído para o planejamento de novas moléculas.7, 8 A proposta que estes estudos auxiliam na busca de novos agentes para o tratamento das leishmanioses baseados em planejamentos químicos racionais, resultando na obtenção de substâncias com maior eficácia, seletividade e consequentemente, menor toxicidade. Nesse contexto, a capacidade de interagir com sistemas biológicos coloca os grupos funcionais hidrazona e N-acilhidrazona em destaque entre os compostos químicos para fins medicinais. Adicionalmente, vários são os trabalhos que apontam compostos hidrazônicos como potenciais agentes antileishmanias.9-13 Portanto, considerando a relevância de se obter novos fármacos que possam ser empregados no tratamento farmacológico das leishmanioses, cinco hidrazonas derivadas dos aldeídos naturais cinamaldeído e vanilina foram preparadas e, tiveram suas atividades biológicas avaliadas frente a formas promastigotas de Leishmania amazonensis, além da avaliação citotóxica em macrófagos murino.
PARTE EXPERIMENTAL Reagentes e equipamentos Todos os reagentes empregados, exceto a hidralazina, foram obtidos de fonte comercial e utilizados sem purificação prévia. Os compostos obtidos tiveram suas temperaturas de fusão (PF) determinadas empregando-se o fusiômetro digital Microquímica (modelo MQAPF-302). As Cromatografias em Camada Delgada Analítica (CCDA) foram realizadas em placas de alumínio de 2x4 cm, recobertas com sílica gel 60 contendo indicador de fluorescência UV254nm, sendo reveladas com luz ultravioleta (UV) ou iodo (I2), e os resultados expressos como fator de retenção (Rf). A determinação estrutural das hidrazonas foi realizada empregando-se as técnicas de Ressonância Magnética Nuclear de 1H e 13C (RMN de 1H e 13C), 13C-DEPT 135°, assim como, as técnicas bidimensionais de correlação homonuclear, 1H, 1H-COSY, e heteronuclear, 1H, 13C (HSQC e HMBC). Os espectros de RMN foram registrados em um aparelho Bruker (modelo AscendTM 400), operando a 400 MHz para o núcleo de 1H e a 100 MHz para o núcleo de 13C. Os deslocamentos químicos (δ) foram obtidos em ppm utilizando o solvente tetrametilsilano (TMS) como padrão interno. Todas as amostras foram solubilizadas em solvente deuterado (CDCl3 ou DMSO-d6). Os espectros de absorção no infravermelho com transformada de Fourier (FTIR) foram obtidos utilizando o equipamento PerkinElmer (modelo Spectrum 400). O leitor de placas de absorbância Biotek (modelo ELX800) foi empregado nos ensaios de avaliação da atividade antileishmania. Isolamento da hidralazina a partir de comprimidos de cloridrato de hidralazina (Apresolina®) Novartis A hidralazina utilizada neste trabalho foi extraída de comprimidos de cloridrato de hidralazina (Apresolina®) da marca Novartis, através da remoção do revestimento de coloração rosa (laca de eritrosina) por lavagem com água, e subsequente secagem. O sólido seco foi macerado e o pó resultante armazenado para uso nas reações. Procedimento geral de síntese das hidrazonas e N-acilhidrazona Em um balão de reação de 25 mL o aldeído, cinamaldeído (1 mmol; 152 mg) ou vanilina (1 mmol; 132 mg), foi pesado e solubilizado em etanol (2 mL), seguida da adição de 2 mL de uma solução etanólica previamente preparada da adequada hidrazina, fenilhidrazina (1 mmol; 108 mg), dinitrofenilhidrazina (1 mmol; 198 mg), isoniazida (1 mmol; 137 mg) ou hidralazina (2 mmol; 320 mg). A esta mistura foram adicionadas 3 gotas de ácido fosfórico concentrado, e o meio reacional submetido a irradiação de micro-ondas na potência 150 W, empregando um aparelho de uso doméstico, até o completo consumo dos reagentes. O progresso da reação foi verificado através de CCDA. Após o resfriamento, o sólido formado foi filtrado, lavado com água deionizada e seco a temperatura ambiente. Cinamaldeído fenilhidrazona - HDZ-1 HDZ - 1: sólido amarelo; rendimento de 91% e PF: 155-158 °C. RMN de 1H (400 MHz, CDCl3): δ [ppm] 7,52 (d, J = 9,2 Hz, 1H, HC=N-NH); 7,47-7,41 (m, 2H, Ar); 7,37-7,30 (m, 2H, Ar); 7,29-7,23 (m, 3H, Ar); 7,07-6,97 (m, 3H, Ar); 6,87 (t, J = 7,15 Hz, 1H, Ar-CH=CH); 6,67 (d, J = 15,84 Hz, 1H, HC-CH=N). RMN de 13C (100 MHz, CDCl3): δ [ppm] 144,1 (CAr-NH-N); 139,9 (HC=N); 136,6 (CAr-CH=CH); 134,3 (Ar-CH=); 129,3 (CAr); 128,7 (CAr); 128,0 (CAr); 126,5 (CAr); 125,8 (=CH-NH); 120,2 (CAr); 112,6 (CAr). IV: ṽ [cm-1] 3032 (C-H sp2); 2945 (C-H sp3); 1605 (C=C); 1565 (C=N; C=N-N=C), Figuras 1S à 7S. Cinamaldeído 2,4-dinitrofenilhidrazona - HDZ-2 HDZ - 2: sólido laranja; rendimento de 60% e PF: 247-250 °C. RMN de 1H (400 MHz, CDCl3): δ [ppm]11,27 (s, 1H, C=NH); 9,15 (s, 1H, Ar); 8,35 (m, 1H, Ar); 8,03 - 7,91 (m, 2H, Ar); 7,56-7,34 (m, 5H, CH=N, Ar); 7,05-7,00 (m, 2H, CH=CH). RMN de 13C (100 MHz, CDCl3): δ [ppm] 149,8 (HC=N); 144,4 (CAr-N); 141,2 (CAr); 138,2 (CAr-NO2); 135,4 (CAr-NO2); 130,0 (CAr); 129,6; 129,3 (CAr-C); 129,0 (CAr); 127,3 (CAr); 124,0 (CAr); 123,5 (CAr); 116,7 (CAr). IV: ṽ [cm-1] 3275 (C-H sp2); 3092 (C-H sp3); 1612 (C=N; C=N); 1490 (C=N; C=N-N=C) 1510 (NO2); 1335 (NO2), Figuras 8S à 14S. Cinamaldeído isonicotinoilhidrazona - HDZ-3 HDZ - 3: sólido amarelo claro; rendimento de 84% e PF: 182-184 °C. RMN de 1H (400 MHz, DMSO-d6): δ [ppm] 11,97 (s, 1H, NH); 8,81-8,87 (m, 2H, Ar); 8,28 - 8,22 (m, 1H, Ar); 7,84-7,79 (m, 2H, Ar); 7,68-7,61 (m, 2H, Ar); 7,45-7,31 (m, 3H, Ar); 7,13-7,08 (m, 2H, Ar). RMN de 13C (100 MHz, CDCl3): δ [ppm] 161,4 (C=O); 150,9 (HC=N); 150,2 (CAr); 140,3 (CAr); 139,8 (CAr); 135,7 (CAr); 128,9 (CAr); 128,8 (CAr); 127,1 (CAr); 125,3 (CAr); 121,4 (CAr). IV: ṽ [cm-1] 3483 (C-H sp2); 3233 (NH); 3086 (C-H sp3); 3050 (C-H sp3);1682 ((C=O); 1647 (C=C); 1541 (N-H); 1354 (C-NAr); 1307 (C-N alifático), Figuras 15S à 21S. Vanilina 2,4-dinitrofenilhidrazona - HDZ-4 HDZ - 4: sólido vermelho; rendimento de 70 % e PF: 266-267 °C. RMN de 1H (400 MHz, DMSO-d6): δ [ppm] 11,58 (s, 1H, OH); 9,75 (s, 1H, NH); 8,86-8,80 (m, 1H, Ar); 8,56 (s, 1H, HC=N); 8,37-8,27 (m, 1H, Ar); 8,11-8,02 (m, 1H, Ar); 7,37 (s, 1H, Ar); 7,20-7,06 (m, 1H, Ar); 6,90-6,83 (m, 1H, Ar); 3,87 (s, 3H, OCH3). RMN de 13C (100 MHz, DMSO-d6): δ [ppm] 150,0 (C=N); 149,5 (CAr-OH); 148,0 (CAr-OMe); 144,3 (CAr-C); 136,3 (CAr-C); 129,5 (CAr); 128,8 (CAr); 125,0 (CAr); 123,0 (CAr); 122,5 (CAr); 116,6 (CAr); 115,4 (CAr); 109,3 (CAr); 55,2 (OCH3). IV: ṽ [cm-1] 3275 (C-H sp2); 3099 (C-H sp3); 1618 (C=N); 1517 (C=N; C=N-N=C),1328 (NO2), Figuras 22S à 28S. Vanilina 1-ftalazinilhidrazona - HDZ-5 HDZ - 5: sólido amarelo; rendimento 98% e PF: 234-237 ºC. RMN de 1H (400 MHz, DMSO): δ [ppm] 14,34 (s, 1H, NH); 9,98 (s, 1H, OH); 9,26-9,17 (d, J = 7,7 Hz, 1H); 9,05 (s, 1H, Ar); 9,00 (s, 1H, HC=N); 8,31-8,08 (m, 3H, Ar); 7,87 (s, 1H, Ar); 7,31-7,28 (dd, J = 8,2, 1,8 Hz, 1H, Ar); 6,93- 6,88 (d, J = 8,1 Hz, 1H, Ar); 3,92 (s, 3H, OMe). RMN de 13C (100 MHz, DMSO): δ [ppm] 153,1(C=N); 150,2 (-HN-CAr); 148,0 (HO-CAr); 147,2 (MeO-CAr); 144,3(CAr); 135,6(CAr); 133,4(CAr); 128,0 (CAr); 127,6 (CAr); 125,2(CAr); 124,5 (CAr); 124,1 (CAr); 114,8 (CAr); 109,8 (CAr); 55,8 (OCH3). IV: ṽ [cm-1] 3590 (OH); 3483 (NH); 3124-3043 (C-H sp2); 2968 (C-H sp3); 1620 (C=N); 1596 (C=N; C=N-N=C),1370 (C-NAr); 1288 (C-N alifático), Figuras 29S à 35S. Determinação da concentração inibitória média (CI50) das hidrazonas sintéticas contra as formas promastigotas da Leishmania amazonensis Nesse ensaio foram utilizados parasitos da espécie Leishmania amazonensis (IFLA/BR/67/PH8), mantidos criopreservados em nitrogênio líquido e em meio de cultivo de Schneider (Sigma, Chemical - USA) suplementado com Soro Fetal Bovino (SFB) e 100 UI.mL-1 de penicilina-estreptomicina (Sigma) e glicerol como criopreservante. Para utilização, os parasitos foram descongelados e mantidos no mesmo meio, sem criopreservante, a 26 ± 1 °C em estufa de demanda biológica de oxigênio (BOD). Para o uso, as promastigotas em fase estacionária de crescimento foram lavadas em solução salina 0,9% estéril, contadas em câmara de Neubauer e volume ajustado para a concentração desejada. O ensaio foi realizado com formas promastigotas de Leishmania amazonensis em fase logarítmica de crescimento. Os parasitos foram semeados em placas de cultivo celular de 96 poços contendo meio Schneider's suplementado, na quantidade de 1×106 Leishmania/100 µL de meio. Em seguida as substâncias HDZ-1, HDZ-2, HDZ-3, HDZ-4 e HDZ-5 foram adicionadas aos poços em triplicata e realizadas diluições seriadas, atingindo doze faixas de concentrações (0,0097 a 20 µg.mL-1). A placa foi incubada em estufa de demanda bioquímica de oxigênio (B.O.D.) a temperatura de 26 ºC por 48 h, restando 6 h para o término deste período, foram adicionados 20 µL de resazurina 1×10-3 mol L-1, quando incubou-se novamente a placa. A leitura da placa foi realizada num leitor de placas de absorbância - Biotek (modelo ELx800), no comprimento de onda de 550 nm, e os resultados foram expressos em termos de inibição do crescimento (%). O controle positivo foi realizado com 2 µg.mL-1 de anfotericina B (Anf B) diluído em meio Schneider's contendo 1×106 promastigotas por poço. Já o controle negativo equivaleu ao meio Schneider's contendo 1×106 promastigotas por poço e, neste caso, a viabilidade foi de 100% para o parasito. A leitura do branco, para cada concentração e para os controles, fez-se necessária para desprezar a absorbância resultante do próprio meio com interferência ou não dos compostos estudados.14, 15 Determinação da concentração citotóxica média (CC50) das hidrazonas sintéticas sobre macrófagos RAW A avaliação da citotoxicidade foi realizada em placas de 96 poços utilizando o ensaio do MTT (brometo de 3-(4,5-dimetil- 2-tiazolil)-2,5-difenil-2H-tetrazólio). Foram incubados 2×105 macrófagos da linhagem RAW 264.7 por poço em 100 µL de meio RPMI 1640 (suplementado com 10% de SFB e 10.000 UI de penicilina e 1.000 UI de estreptomicina) em estufa a 37 °C e 5% de CO2, durante 4 h para a adesão celular. Após esse período retirou-se o sobrenadante para remoção das células que não aderiram. Os derivados hidrazônicos foram diluídos em meio RPMI suplementado, adicionados à placa contendo os macrófagos em concentrações seriadas atingindo doze faixas de concentrações finais, partindo de 100 µg/mL, e incubados a 37 ºC e 5% de CO2 durante 48 h. Após esse período, a citotoxicidade foi avaliada por adição de 10 % MTT na concentração de 5 mg mL-1, diluído em 100 µL de meio RPMI e incubou-se novamente a placa durante 4 h a 37 ºC e 5% de CO2. Passado esse período, o sobrenadante foi descartado e os cristais de formazan foram dissolvidos por adição de 100 µL de DMSO. Finalmente, a absorbância (550 nm) foi medida utilizando um leitor de placas Biotek (ELx800).16 O índice de seletividade (SI) foi calculado pela razão entra CC50 e CI50.17 Análises estatísticas Todos os ensaios foram realizados em três experimentos independentes. A concentração inibitória média (CI50) e a concentração citotóxica média (CC50) com limite de confiança de 95%, foram calculadas utilizando regressão. Foram realizadas análises de variância ANOVA seguida pelo teste de Bonferroni tomando-se o valor de p < 0,05 como nível máximo de significância estatística.
RESULTADOS E DISCUSSÃO Síntese e caracterização das hidrazonas As hidrazonas foram preparadas através da reação entre os aldeídos naturais, cinamaldeído ou vanilina, com uma hidrazina (a fenilhidrazina, a 2,4-dinitrofenilhidrazina ou a hidralazina), ou hidrazida (a isoniazida). A reação aconteceu com rendimentos satisfatórios em etanol, solvente verde, sob catálise ácida empregando-se ácido fosfórico, e radiação de micro-ondas, conforme os dados mostrados na Tabela 1.
Analisando o espectro de RMN de 1H (400 MHz, CDCl3) de HDZ-1 (Figura 1S) foram observados sinais na região de hidrogênio aromático, os multipletos em δH 7,47-7,41; 7,37-7,30; 7,29-7,23 e 7,07-6,97 ppm, referentes conjuntamente à 10 H. Em região mais desblindada do espectro, um dupleto em δH 7,52 ppm (J = 9,2 Hz), com integral para 1 H, refere-se ao H do grupo azometina (HC=N). E em região mais protegida, um dupleto em δH 6,67 ppm (J = 15,84 Hz) e um tripleto em δH 6,87 ppm (J = 7,15 Hz), com integrais de 1 H cada. Já o espectro de RMN de 13C (100 MHz, CDCl3) de HDZ-1 (Figura 2S) apresentou 11 linhas espectrais. Através da análise comparativa dos espectros de RMN de 13C e 13C-DEPT 135° (100 MHz, CDCl3) (Figura 3S) foi possível determinar a presença de 9 sinais de carbono monohidrogenado (CH), todos localizados na região de C com hibridização sp2 e na região de C de anel aromático, sendo o sinal em δC 139,9 ppm referente ao carbono HC=N (azometina). Também foram identificados dois sinais de carbono não hidrogenados na região de hibridização sp2 em δC 144,1 e 136,6 ppm. Por fim, no espectro bidimensional de correlação heteronuclear direta (1H,13C-HSQC - 400 MHz, CDCl3) (Figura 5S), foi observada a correlação entre o sinal em δH 7,52 ppm, referente ao H hidrazônico, com o sinal de carbono em δC 139,9 ppm (HC=N, azometina). No espectro de IV (FTIR) de HDZ-1 (Figura 7S) foi observada a banda em 1605 cm-1, referente à ligação C=C, e a banda em 1565 cm-1, referente aos estiramentos dos grupos C=N e C=N-N=C. No espectro de RMN de 1H (400 MHz, CDCl3) de HDZ-2 (Figura 8S) foram observados sinais de hidrogênio aromático, com integral conjunta para 9 H, nas regiões de δH 9,15, 8,35; 8,03-7,91; 7,56-7,34 e 7,05-7,00 ppm. Dentre estes sinais, o multipleto em δH 8,03-7,91 ppm contempla 1H aromático e 1H do grupo azometina (HC=N). O espectro bidimensional de correlação heteronuclear direta (1H,13C-HSQC - 400 MHz, CDCl3) (Figura 12S) mostra relação direta entre os sinais em δC 149,8 ppm e δH 7,96 ppm. O sinal de N-H do grupo hidrazona foi observado no espectro de RMN de 1H em δH 11,27 ppm. Já no espectro de correlação heteronuclear (1H,13C-HMBC - 400 MHz, CDCl3) (Figura 13S), o qual possibilita correlacionar os átomos de hidrogênio e carbono a duas (2JC-H) e três (3JC-H) ligações, foi observada a correlação entre o sinal do H em δH 11,27 ppm com os dos C em δC 116,7 e 144,4 ppm. Por fim, o espectro de RMN 13C (100 MHz, CDCl3) de HDZ-2 (Figura 9S) apresentou 13 linhas espectrais e, na comparação com o espectro de 13C-DEPT 135° (100 MHz, CDCl3) (Figura 10S), foi possível determinar a presença de 4 sinais referentes a carbonos não hidrogenados em região de hibridação sp2 em δC 144,4; 138,2; 135,4 e 129,3 ppm. O carbono do grupo azometina (HC=N) foi detectado em δC 149,8 ppm. No espectro de IV (FTIR) de HDZ-2 (Figura 14S) foi observada a banda em 1612 cm-1, referente à ligação C=C, e a banda em 1490 cm-1, referente aos estiramentos dos grupos C=N e C=N-N=C. As bandas de forte intensidade referente ao grupo nitro, estiramentos N-O assimétrico e simétrico, respectivamente em 1510 e 1335 cm-1, também foram registrados. O espectro de RMN de 1H (400 MHz, DMSO-d6) de HDZ-3 (Figura 16S) apresentou multipletos na região de hidrogênio aromático com integral conjunta para 9 H, sendo estes em: δH 8,81-8,87; 7,68-7,61; 7,45-7,31; 7,13-7,08 ppm. Um multipleto em δH 8,28-8,22 ppm também foi revelado, sendo este sinal referente ao H do grupo azometina (HC=N). O espectro bidimensional de correlação heteronuclear direta de HDZ-3 (1H,13C-HSQC - 400 MHz, DMSO-d6) (Figura 20S) mostra relação entre os sinais em δC 150,9 ppm e δH 8,28-8,22 ppm. Por fim, no espectro de RMN 13C (100 MHz, DMSO-d6) de HDZ-3 (Figura 17S), 11 linhas espectrais foram detectadas e, ao comparar-se com o espectro de 13C-DEPT 135° (100 MHz, DMSO-d6) (Figura 18S), foi possível determinar a presença de 3 sinais referentes a carbonos não hidrogenados em região sp2, sendo o sinal em δC 161,4 ppm, referente ao carbono carbonílico (C=O). O carbono do grupo azometina foi registrado em δC 150,9 ppm (HC=N). No espectro de IV (FTIR) de HDZ-3 (Figura 21S) foram observadas as bandas em 1682, 1647 e 1541 cm-1, referentes às ligações C=O, C=C e NH, respectivamente. A banda em 1354 cm-1 foi registrada, e corresponde à ligação C-N aromática. No espectro de RMN de 1H (400 MHz, DMSO-d6) de HDZ-4 (Figura 22S) foram identificados 6 sinais referentes a hidrogênios aromáticos, 1 simpleto do hidrogênio hidrazônico (HC=N) em δH 8,56 ppm, e os sinais de H dos grupos O-H, N-H e O-CH3 em δH 11,58; 9,75 e 3,87 ppm, respectivamente. No espectro bidimensional de correlação heteronuclear direta (1H,13C-HSQC - 400 MHz, DMSO-d6) (Figura 26S) foi revelada uma relação entre os sinais de C em δC 150,0 ppm e H em δH 8,56 ppm. Por fim, o espectro de RMN 13C (100 MHz, DMSO-d6) de HDZ-4 (Figura 23S) registrou 14 linhas espectrais e, por comparação com o espectro de RMN de 13C e 13C-DEPT 135° (100 MHz, CDCl3) (Figura 24S), foram identificados 6 carbonos aromáticos não hidrogenados. O carbono do grupo azometina (HC=N) surgiu em δC 150,0 ppm. No espectro de IV (FTIR) de HDZ-4 (Figura 29S) foram observadas as bandas em 1618, 1517 e 1328 cm-1, referentes aos estiramentos do C=N, C=N-N=C e NO2, respectivamente. No espectro de RMN de 1H (400 MHz, DMSO-d6) de HDZ-5 (Figura 29S) foram identificados 6 sinais referentes aos 8 hidrogênios aromáticos. Os sinais de H ligados a heteroátomos e os metoxílicos foram encontrados em δH 14,34; 9,98 e δH 3,92 ppm. O hidrogênio hidrazônico (N-H) foi registrado em δH 9,00 ppm e, no espectro bidimensional de correlação heteronuclear direta (1H,13C-HSQC - 400 MHz, DMSO-d6) (Figura 33S), foi revelada a relação entre os sinais de C em δC 153,1 ppm e de H em δH 9,00 ppm. Já no espectro de correlação heteronuclear (1H,13C-HMBC - 400 MHz, DMSO-d6) (Figura 34S) foi observada a relação entre o sinal de H em δH 9,00 ppm e os carbonos em δC 109,8 e 124,1 ppm, o que confirma a presença do hidrogênio hidrazônico. Por fim, o espectro de RMN 13C de HDZ-5 (100 MHz, DMSO-d6) (Figura 30S) exibiu 15 linhas espectrais e, por comparação com o espectro de RMN de 13C e 13C-DEPT 135° (100 MHz, DMSO-d6) (Figura 31S), foram identificados 4 sinais de carbonos aromáticos não hidrogenados, e o carbono do grupo azometina (HC=N) em δC 153,1 ppm. As bandas em 3549, 3483, 1620 e 1370 cm-1 registradas no espectro de IV (FTIR) de HDZ-5 (Figura 35S) são referentes aos seguintes grupos OH, NH, C=C, NH aromático, respectivamente. Os altos rendimentos sintéticos, o uso de matéria prima de baixo custo e a simplicidade metodológica utilizada na síntese das hidrazonas (HDZ-1 - HDZ-5) são características que enquadra o processo nos princípios sintéticos apontados por Barry Price, na ocorrência da descoberta da ranitidina, onde o pesquisador defende o emprego de métodos clássicos de síntese orgânica, de baixo custo e alta reprodutibilidade na produção de fármacos.18, 19 Atividade antileishmania e citotóxica das hidrazonas sintéticas A avaliação de atividade antileishmania somente em formas promastigotas tem sido realizado em diversos trabalhos de síntese química como ensaio de triagem.16, 17, 20-22 As diferentes moléculas apresentaram resultados de atividade antipromastigota com grandes variações, com valores entre 9,00 e 77,18 µM. Os resultados de CI50, CC50 e IS obtidas estão apresentadas na Tabela 2.
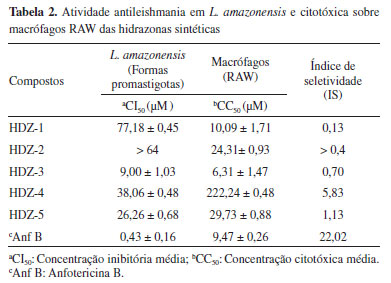
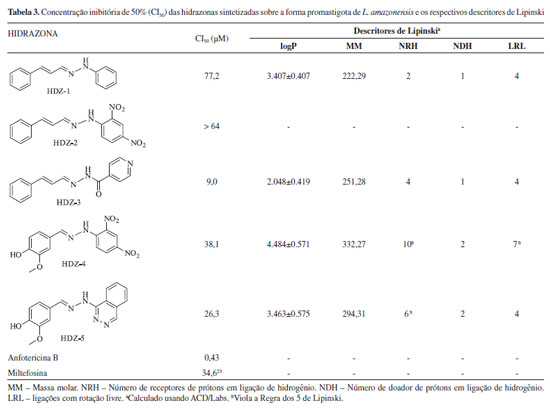
As substâncias testadas apresentaram atividade antileishmania para as formas promastigotas de L. amazonensis, onde as moléculas HDZ-3, HDZ-4 e HDZ-5 tiveram melhor atividade. A molécula HDZ-3 foi a mais citotóxica enquanto a HDZ-4 a menos citotóxica contra os macrófagos testados pelo método do MTT. As substâncias com melhor índice de seletividade foram as HDZ-4 e HDZ-5. Portanto, os resultados apontam para uma atividade promissora das hidrazonas sintéticas contra parasitas in vitro de L. amazonensis na forma promastigota, apesar de inferior à Anfotericina B. Dentre os compostos avaliados, o HDZ-4 demonstrou atividade contra a forma promastigota de L. amazonensis comparável à Miltefosina, um fármaco de referência para o tratamento da leishmaniose.23 Porém, as melhores atividades apresentadas ocorreram por ação das HDZ-3 e HDZ-5, com CI50 inferior ao da Miltefosina (CI50 34,6 µM). Nos últimos anos tem havido relatos de casos de resistência ao tratamento com antimoniais, principalmente por cepas da espécie L. donovani, responsável por causar a forma visceral em países da Ásia e África, sendo na Índia considerado ineficiente, e substituído pels Miltefosina.5, 6 Essa resistência pode surgir em função de fatores como a resposta imune do hospedeiro, a adaptação biológica das cepas, além de fatores farmacológicos.24 Em trabalhos independentes, Sharma (2017) e Lima (2017), e respectivos colaboradores, relataram a atividade contra leishmania do cinamaldeído e da vanilina.25, 26 Sendo a CI50 do cinamaldeído de 1,426 g.mL-1 (10,79 x 103 µM) contra L. major.25 Já a vanilina, na concentração de 50 µM, promoveu a inibição de 12,94% da forma amastigota de L. amazonesis.26 Estes dados, ao serem confrontados com os resultados obtidos no presente trabalho, indicam que a modificação molecular realizada promoveu um aumento da atividade antileishmania dos compostos testados, derivados do cinamaldeído e vanilina. A atividade contra as formas promastigotas de L. braziliensis da isonizada foi avaliada por Amim e colaboradores (2016) onde a CI50 obtida foi de 17,04 µM.27 O composto HDZ-3 é um derivado da isoniazida e cinamaldeído, e a CI50 obtida foi de 9,0 µM. Neste caso, percebe-se que a modificação estrutural realizada na isoniazida aumentou sua ação antileishmania. Contudo, cabe salientar, que é precipitado propor aplicação clínica a uma molécula antes de se realizar ensaios de farmacocinética e de toxicidade, já que fatores como absorção, distribuição, metabolismo e excreção são de grande relevância no contexto geral de ação dos fármacos. Considerando a relevância da farmacocinética e reconhecendo a utilidade da regra dos 5 de Lipinski28, 29 para o desenvolvimento de novos compostos bioativos, as hidrazonas do presente estudo tiveram os descritores de Lipinski calculados empregando-se o Software Advanced Chemistry Development (ACD/Labs), disponível na plataforma da American Chemical Society, o Scifinder®,30 Tabela 3.
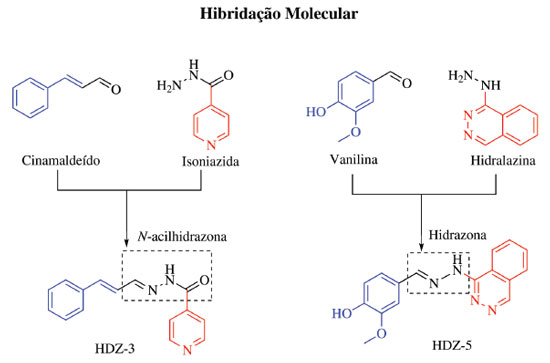
As hidrazonas HDZ-1 e HDZ-3 não violaram nenhum descritor de Lipinski, o que sugere que os mesmos podem possuir farmacocinética favorável para administração por via oral. Já a hidrazona HDZ-4, por possuir 10 receptores de prótons em ligação de hidrogênio e 7 ligações com rotação livre, e HDZ-5, por possuir 6 receptores de prótons em ligação de hidrogênio, terminam por violar a regra dos 5 de Lipinski. E entre os compostos estudados, a HDZ-3 foi a que apresentou menor CI50 contra L. amazonensis, diante destes resultados, pode-se afirmar que os compostos sintetizados mais promissores foram HDZ-3 e HDZ-5. É válido salientar que no design estrutural de HDZ-3 e HDZ-5 é resultante de um planejamento prévio efetuado com ênfase na estratégia de hibridação molecular. Esta é um método usado para o desenvolvimento de compostos bioativos que vem ganhando relevância dentro do cenário científico, e consiste na junção de estruturas farmacofóricas distintas em uma molécula.31 Tanto HDZ-3 quanto HDZ-5 são híbridos moleculares resultantes da junção de aldeídos naturais bioativos com fármacos comerciais. No primeiro caso, cinamaldeído com isonoiazida e, no segundo caso, vanilina com hidralazina. Ambos os híbridos têm um espaçador molecular, que são o grupo funcional N-acilhidrazona e hidrazona, respectivamente para HDZ-3 e HDZ-5 (Figura 1).
Coimbra e colaboradores (2013) empregaram a amodiaquine, uma 4-aminoquinolona utilizada como antimalárico, como lead compound para o planejamento de uma série de 4-hidrazoquinolonas com potencial leismanicida.23 Os resultados apresentados foram promissores contra as formas promastigota de L. amazonesis, L. brasiliensis, L. chagasi e L. major, com CI50 variando entre 1,0 e >100 µM.23 Coa e colaboradores (2015), percebendo a relevância do núcleo quinolínico e do grupo N-acilhidrazona em compostos leishmanicida, planejaram e prepararam uma série de híbridos N-acilhidrazoquinolínicos com potencial atividade contra estes protozoários.32 Ao comparar as estruturas moleculares das hidrazonas HDZ-3 e HDZ-5 com as dos compostos preparados nos trabalhos de Coimbra e Coa,23, 32 percebe-se que as semelhanças estruturais encontradas colocam em destaque os núcleos isonicotinoilhidrazona e ftalazinilhidrazona, sendo estes semelhantes as N-acilhidrazoquinolonas e 4-hidrazoquinolonas, respectivamente (Figura 2).
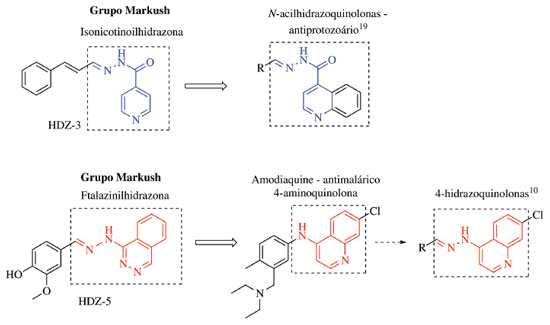 Figura 2. Esquema de comparação das estruturas moleculares das hidrazonas HDZ-3 e HDZ-5, destacando os Grupos Markush isonicotinoilhidrazona e ftalazinilhidrazona, e a estrutura geral das N-acilhidrazoquinolonas32 e 4-hidrazoquinolonas.23
A fim de encontrar publicações que relatem possíveis aplicabilidades para uso medicinal de hidrazonas semelhantes às sintetizadas neste trabalho, a plataforma Scifinder foi empregada para realizar uma busca específica pelos Grupos Markush isonicotinoilhidrazona e ftalazinilhidrazona. Grupo Markush se refere a um esqueleto molecular proposto a partir de um protótipo, e representa inúmeras moléculas que possuem o mesmo esqueleto, mas com radicais diferentes.31 A busca pelo Grupo Markush isonicotinoilhidrazona, estrutura presente em HDZ-3, resultou em 60 patentes, e apenas 36 trazem atividades biológicas. A principal bioatividade mencionada nestas publicações foi a antitumoral, presente em 8 patentes, sendo que em nenhuma delas é proposto o uso de substâncias contendo esse Grupo Markush como possível agente leishmanicida. Nesta pesquisa também foram encontradas 12 patentes citando compostos com o Grupo Markush ftalazinilhidrazona, presente em HDZ-5. Deste total, apenas 6 patentes propõem novos agentes terapêuticos. Nestes documentos é apontada a possível utilização das substâncias contendo o grupo ftalazinilhidrazona para o tratamento de desordens relacionadas com a proteína huntingtina,33 da doença de Parkinson,34 do câncer,35 de esclerose múltipla,36 e como ativador do fator de transcrição 6 (ATF6).37 Desta forma, a ausência de patentes abordando substâncias contendo os núcleos isonicotinoilhidrazona e ftalazinilhidrazona com atividade contra o parasita do gênero Leishmania, e os resultados obtidos no presente trabalho, revelam o potencial de inovação da aplicação destas estruturas para o desenvolvimento de novos fármacos para leishmanioses. CONCLUSÕES As hidrazonas HDZ (1-5) sintetizadas através de insumos de baixo custo e rotas sintéticas clássicas apresentaram altos rendimentos. Dentre as hidrazonas sintetizadas, os compostos HDZ-3 e HDZ-5 apresentaram atividade relevante contra formas promastigotas de L. amazonensis, enquanto a HDZ-4 apresentou melhor seletividade. As hidrazonas mais ativas foram resultado do planejamento estrutural empregando-se a estratégia de hibridação molecular, sendo HDZ-3 obtida pela união do cinamaldeído com isoniazida, e HDZ-5, um híbrido da vanilina com hidralazina, sendo os grupos funcionais N-acilhidrazona e hidrazona os espaçadores moleculares utilizados. Esse estudo, além de reforçar mais uma vez o potencial da hibridação molecular para o desenvolvimento de novos fármacos, e de ampliar a relevância dos grupos funcionais N-acilhidrazona e hidrazona em moléculas bioativas, também destacou os Grupos Markush isonicotinoilhidrazona e ftalazinilhidrazona como estruturas privilegiadas em moléculas com atividade antiprotozoária.
MATERIAL SUPLEMENTAR Os espectros de RMN de 1H, 13C e Dept-135 e FTIR dos compostos sintetizados neste trabalho estão disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Ao CNPq, à UNIVASF e ao IF-Sertão.
REFERÊNCIAS 1. Burza, S.; Croft, S.L.; Boelaert, M. Lancet. 2018, 392, 951. 2. Gurung, P.; Kanneganti, T. D. Cell. Microbiol., 2015, 17, 1286. 3. Marlow, M. A.; Da Silva Mattos, M.; Makowiecky, M. E. PLoS ONE, 2013, 8, e56177. 4. Handler, M. Z.; Patel, P. A.; Kapila, R.; Al-Qubati, Y.; Schwartz, R. A. J. Amer. Acad. Dermat. 2015, 73, 911. 5. Hendrickx, S.; Guerin, P.; Caljon, G.; Croft, S.; Maes, L. Parasitology. 2016, 145, 453. 6. Hefnawy, A.; Berg, M.; Dujardin, J. C.; De Muylder, G. Trends Paras. 2017, 33, 162. 7. Pandey, S. C.; Jha, A.; Kumar, A.; Samant, M. Int. J. Biol. Macromol 2019, 121, 480. 8. Kumar A.; Pandey S. C.; Samant, M. Parasitol. Open 2018, 4, 1. 9. Romero, A. H.; Medina, R.; Alcala, A.; García-Marchan, Y.; Núnez-Duran, J.; Leanez, J.; Mijoba, A.; Ciangherotti, C.; Serrano-Martín, X.; Lopez, S. Eur. J. Med. Chem. 2017, 127, 606. 10. Taha, M.; Ismail, N. H.; Imran, S.; Anouar, E. H.; Selvaraj, M.; Jamil, W.; Ali, M.; Kashif, S. M.; Rahim, F.; Khan, K. M.; Adenan, M. I. Eur. J. Med. Chem. 2017, 126, 1021. 11. Amim, R. S.; Firmino, G. S. S.; Rego, A. C. P. D.; Nery, A. L.; Da-Silva, S. A. G.; Souza, M. V. N.; Pessoa, C.; Resende, J. A. L. C.; Figueroa-Villar, J. D.; Lessa, J. A. J. Braz. Chem. Soc. 2016, 4, 769. 12. Matta, C. B. B.; Queiroz, A. C.; Santos, M. S.; Alexandre-Moreira, M. S.; Gonçalves, V. T.; Cistia, C. N. D.; Sant'Anna, C. M. R.; Da Costa, J. B. N. Eur. J. Med. Chem. 2015, 101, 1. 13. Coimbra, E. S.; Antinarelli, L. M. R.; Silva, A. D.; Bispo, M. L. F.; Kaiser, C. R.; Souza, M. V. N. Chem. Biol. Drug Des. 2013, 81, 658. 14. Soares, D. C.; Pereira, C. G.; Meireles, M. A. A.; Saraiva, A. Parasitol. Int. 2007, 2, 135. 15. Valadares, D. G.; Duarte, M. C.; Oliveira, J. S.; Chávez-Fumagalli, M. A.; Martins, V. T.; Costa, L. E.; Leite, J. P. V.; Santoro, M. M.; Régis, W. C. B.; Tavares, C. A. P.; Coelho, E. A. F. Parasitol. Int. 2011, 60, 357. 16. Maciel-Rezende, C. M.; Almeida, L.; Costa, E. D.; Pires, F. R.; Alves, K. F.; Cláudio Viegas Junior, C.; Dias, D. F.; Doriguetto, A. C.; Marques, M. J.; Santos, M. H. Bioorg. Med. Chem. 2013, 21, 3114. 17. Masood, M. M.; Hasan, P.; Tabrez, S.; Ahmad, M. B.; Yadava, U.; Daniliuc, C. G.; Sonawane, Y.A.; Azam, A.; Rub, A.; Abid, M. Bioorg. Med. Chem. Lett. 2017, 27, 1886. 18. Campos, W. R. A.; Souza, D. C. M.; Guimarães, D. G.; Santos, V. L. A.; Gonsalves, A. A.; Araújo, C. R. M. Quim. Nova 2019, 42, 305. 19. Fraga, C. A. M.; Lima, L. M.; Barreiro, E. J. Em Química Medicinal Métodos e Fundamentos em Planejamento de Fármacos; Montanari, C. A. ed.; Editora da Universidade de São Paulo, 2011, cap. 2. 20. Arshad, N.; Hashim, J.; Irfanullah; Ali Minhas, M. A.; Aslam, J.; Ashraf, T.; Hamid, S. Z.; Iqbal, T.; Javed, S. Bioorg. Med. Chem. Lett. 2018, 15, 3251. 21. Arshia, A. F.; Ghouri, N.; Kanwal, K. K. M.; Perveen, S.; Choudhary, M. I. R. Soc. Open Sci. 2018, 5, 171771. 22. Mohajeri, M.; Saghaei, L.; Ghanadian, M.; Saberi, S.; Pestechian, N.; Ostadhusseini E. Adv. Biomed. Res. 2018, 7, 64. 23. Coimbra, E. S.; Antinarelli, L. M. R.; Silva, A. D.; Bispo, M. L. F.; Kaiser, C. R.; Souza, M. V. N. Chem. Biol. Drug Des. 2013, 81, 658. 24. Gazanion, E.; Fernández-Prada, C.; Papadopoulou, B.; Leprohon, P.; Ouellette, M. Proc. Nat. Acad. Scie. 2016, 113, E3012. 25. Sharma, U. K.; Sharma, A. K.; Gupta, A.; Kumar, R.; Pandey, A.; Pandey, A. K. Cell. Mol. Biol. 2017, 6, 73. 26. Lima, T. C.; Souza, R. J.; Moraes, M. H.; Steindel, M.; Biavatti, M. W. J. Braz. Chem. Soc. 2017, 2, 367. 27. Amim, R. S.; Firmino, G. S. S.; Rego, A. C. P. D.; Nery, A. L.; Da-Silva, S. A. G.; Souza, M. V. N.; Pessoa, C.; Resende, J. A. L. C.; Figueroa-Villar, J. D.; Lessa, J. A. J. Braz. Chem. Soc. 2016, 4, 769. 28. Lipinski, C. A.; Lombardo, F.; Dominy, B. W.; Feeney, P. J.; Adv. Drug Delivery Rev. 2001, 46, 3. 29. Lipinski, C. A.; Drug Discovery Today: Technol. 2004, 4, 337. 30. Santos, V. L. A.; Gonsalves, A. A.; Araújo, C. R. M. Quim. Nova 2018, 1, 110. 31. Araújo, C. R. M.; Leite Filho, C. A.; Santos, V. L. A.; Maia. G. L. A.; Gonsalves, A. A. Quim. Nova 2015, 6, 868. 32. Coa, J. C.; Castrillón, W.; Cardona, W.; Carda, M.; Ospina, V.; Muñoz, J. A.; Vélez, I.; Robledo, S. M. Eur. J. Med. Chem. 2015, 101, 746. 33. Wanker, E.; Wiglenda, T.; Babila, J. T.; Boeddrich, A.; Schmidt, M.; Neuendorf, S.; Schiele, F. PCT Int. Appl., WO 2011020883 A1, 2011. 34. Shi, R. PCT Int. Appl., WO 2016153874 A1, 2016. 35. Halby, L.; Arimondo, P. B. PCT Int. Appl., WO 2015040169 A1, 2015. 36. Shi, R. PCT Int. Appl., WO 2012064923 A2, 2012. 37. Cooley, C.; Kelly, J. W.; Paxman, R.; Plate, L.; Wiseman, R. L. PCT Int. Appl., WO 2017117430 A1, 2017. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access