Artigo
|
|
| Impregnação do ácido 12-tungstofosfórico em sílica - Parte II: efeito de diferentes solventes na impregnação e atividade catalítica na esterificação metílica de ácido esteárico Impregnation of 12-tungstophosphoric acid on silica - Part II: effect of different solvents on the impregnation and catalytic activity in methyl esterification of stearic acid |
|
Karine Isabel Scroccaro*,I; Valcineide O. de A. TanobeII; Alan Antonio de OliveiraII; Fernando WypychIII; Carlos I. YamamotoI
IDepartamento de Engenharia Química, Universidade Federal do Paraná, Centro Politécnico, CP 19011, 81531-980 Curitiba - PR, Brasil Recebido em 24/04/2013 *e-mail: karineisabel@yahoo.com.br Materials obtained by the immobilization of 12-tungstophosphoric acid (PTA) on silica using the method of impregnation with excess solution in distinct solvents (aqueous HCl, methanol:H2O, and acetonitrile) were evaluated for use as catalysts in the methyl esterification of stearic acid. Optimum conditions were established for the impregnation of 0.5 g (w/w) of PTA on amorphous silica, under stirring at 150 rpm for 24 h, using 20 mL of 0.1 mol L-1 HCl as the solvent. After calcination at 200 ºC, high conversions were obtained under mild reaction conditions, resulting in high turnover numbers. The catalyst was evaluated in ten catalytic cycles of use, where the activity was reduced only slightly, attesting its stability and the possibility to apply it to industrial production of methylesters. INTRODUÇAO O desenvolvimento sustentável requer mudanças em processos e produtos a fim de que sejam viáveis e ambientalmente corretos. Neste sentido a indústria química busca novas alternativas para processos catalíticos homogêneos, pois estes geram resíduos potencialmente tóxicos e de tratamento mais complexo. Desta forma, a busca por novos catalisadores sólidos tem sido incorporada comercialmente devido ao fato da sua recuperaçao ser facilitada, além de diminuir o número de etapas para a obtençao dos produtos. Entre estes catalisadores, os heteropoliácidos (HPA) vêm se destacando, principalmente devido a sua alta reatividade, seletividade, entre outras propriedades.1 Entre os processos industriais, as reaçoes de esterificaçao sao de grande importância, uma vez que muitos ésteres sao utilizados em diversos produtos do cotidiano. A maioria destas sínteses ainda é realizada com o uso de catalisadores em meio homogêneo, tais como o ácido sulfúrico, tornando a etapa de purificaçao do éster um problema, uma vez que estes catalisadores sao de difícil remoçao do meio reacional, além da sua alta corrosividade e periculosidade. Assim, o desenvolvimento de catalisadores sólidos, tais como ácido 12-tungstofosfórico (PTA - H3PW12O40) imobilizados em materiais como sílicas, carvoes ativados, zeólitas, resinas de trocas iônicas, aluminas, entre outros2-9 tem sido explorado em distintas reaçoes de esterificaçao. Tais catalisadores sao considerados catalisadores verdes (Green catalysts).10,11 No estudo e aplicaçao de catalisadores, entre outros parâmetros, destaca-se a importância do conhecimento dos mecanismos de desativaçao, entre os quais podem ser citados a degradaçao térmica ocasionando perda da área superficial ativa e da área do suporte induzida termicamente e reaçoes fase-matriz; esmagamento por atritos, levando a perda da área superficial, incrustaçoes, por lixiviaçao da fase ativa, entre outros.12 Além disso, a regeneraçao e o seu reuso também sao primordiais para potenciais aplicaçoes industriais, uma vez que medem o grau de robustez dos catalisadores durante o processo catalítico, principalmente quanto a sua atividade. Desta forma, a determinaçao da atividade catalítica pode ser medida pelo número de turnover (turnover number - TON) e da frequência de turnover (turnover frequency - TOF), os quais possuem definiçoes distintas no campo da catálise. Em catálise homogênea, o TON representa o número de ciclos que um catalisador pode ser utilizado antes de desativar, isto é, o número de moléculas A que o catalisador pode converter em moléculas B. Na catálise heterogênea, TON e o TOF sao frequentemente definidos por número de sítios ativos, ou catalisador por grama. Isto porque nao se sabe exatamente quantas sítios catalíticos ativos se encontram na superfície.13,14 No estudo anteriormente realizado pelo nosso grupo de pesquisas,15 foram determinados parâmetros de impregnaçao e caracterizaçao dos materiais empregados nos catalisadores, no qual as condiçoes de impregnaçao e secagem foram estabelecidas, bem como a temperatura da reaçao de esterificaçao. Entretanto, devido à toxicidade do metanol, solvente utilizado na etapa de impregnaçao e os aspectos socioeconômicos e ambientais envolvidos buscou-se avaliar outros solventes. As consideraçoes socioeconômicas foram agora a base para esta nova etapa do estudo de Scroccaro et al.,15 bem como os resultados apresentados por Caliman et al.,16 que impregnaram o PTA em alumina com soluçoes de etanol, água, acetonitrila e soluçoes aquosas de HCl (0,1 mol L-1 e 0,5 mol L-1). Dias et al.17 usaram HCl 0,01 mol L-1 para impregnar o mesmo material em sílica gel e Bhure et al.14 utilizaram a sílica como suporte utilizando o metanol como solvente. Estes pesquisadores mostraram a viabilidade de utilizaçao de outros solventes, culminando em um catalisador eficiente e ambientalmente amigável. A partir do estudo preliminar reportado anteriormente,15 no qual foram verificadas altas conversoes do estearato de metila, optou-se pela exploraçao de outros solventes para impregnaçao do suporte, bem como de menores temperaturas de calcinaçao para se obter um material com maior estabilidade térmica e química. Além disso, o estudo em relaçao à atividade catalítica foi imprescindível, portanto estas lacunas estao agora exploradas e discutidas no presente trabalho, cujo objetivo se situa na otimizaçao das condiçoes de preparo do catalisador, bem como nas melhores condiçoes reacionais, além do estudo da possibilidade de regeneraçao do catalisador.
PARTE EXPERIMENTAL Planejamento experimental da impregnaçao do PTA em sílica com diferentes solventes O preparo do catalisador foi realizado por impregnaçao com excesso de soluçao,18 como descrito anteriormente.15 Utilizou uma sílica SI-1452 (Grace Davison) como suporte para a impregnaçao do ácido 12-tungstofosfórico - PTA (Vetec), o qual foi dissolvido em uma soluçao 1:1 de metanol (99,8 % - F. Maia) e água destilada, acetonitrila (99,5 % - Synth) e uma soluçao aquosa 0,1 mol L-1 de HCl (37 % P.A. - Merck). Esta sílica apresenta um tamanho médio das partículas de 2,10 mm, com uma área superficial de 375 m2 g-1, diâmetro médio de poros de 11 nm e um volume de poros de 1,01 cm3 g-1. Todos os reagentes, exceto os solventes, foram submetidos a uma pré-secagem, sendo a sílica a 600 ºC por 4 h e o PTA a 100 ºC por 6 h. As condiçoes de impregnaçao foram realizadas por meio de planejamento fatorial do tipo 22 (2 fatores, 3 níveis para o solvente e 4 níveis para a massa de PTA) e o volume de solvente fixado em 20 mL conforme mostra a Tabela 1.19 Utilizou-se o software MINITAB 14 nesta etapa do trabalho.
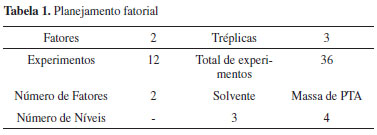
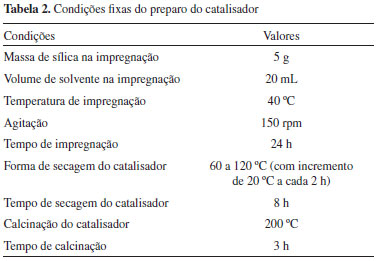
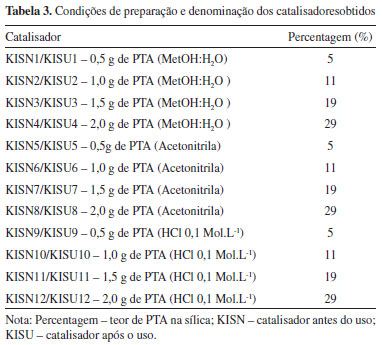
As variáveis selecionadas para a etapa de impregnaçao utilizando o planejamento fatorial foram a massa de PTA (variando entre 5, 11, 19 e 29 % de PTA), e o tipo de solvente, sendo utilizados MetOH:H2O (1:1 em volume), acetonitrila e uma soluçao aquosa de HCl 0,1 mol L-1. As condiçoes do preparo do catalisador estao apresentadas na Tabela 2 e os catalisadores obtidos, na Tabela 3.
A análise da influência das variáveis na esterificaçao foi realizada com base nas respostas da conversao do ácido graxo em éster, de acordo com o tipo de solvente e a concentraçao do PTA. Os cálculos da percentagem (%) de impregnaçao massa/massa (m/m) foram realizados com base nas características da sílica e tamanho aproximado da molécula do HPA (12 Å).16 Reaçao de esterificaçao As reaçoes de esterificaçao foram conduzidas a 100 ºC após calcinaçao dos catalisadores a 200 ºC durante 3 h. O tempo de reaçao de transesterificaçao foi fixado em 2 horas, após estudos preliminares de otimizaçao. Cada um dos catalisadores foi avaliado e as reaçoes foram realizadas em triplicatas e em um reator de batelada, um vaso Parr com um volume de 250 mL, a 100 ºC, na razao molar de 8:1 (MetOH:ácido esteárico) e 10 % de catalisador em relaçao a massa dos demais reagentes, que foram as condiçoes otimizadas anteriormente. Após as reaçoes, os catalisadores foram recuperados do meio reacional por filtraçao a quente, utilizando clorofórmio. A filtraçao foi realizada em um funil de Büchner, utilizando aproximadamente 50 mL de clorofórmio a quente, o qual removeu todo éster residual no catalisador (comprovado por técnicas instrumentais de análise). Posteriormente a esta etapa de recuperaçao do catalisador, estes foram calcinados para reutilizaçoes posteriores, visando o cálculo do TON e do TOF. A quantificaçao do éster (C19H38O2) foi realizada por cromatografia a gás (CG) com um detector FID, coluna CP-SIL 5 CB, por um procedimento de calibraçao interna com metil-heptadecanoato em clorofórmio. A conversao do éster foi definida como a percentagem do estearato de metila obtido a partir da concentraçao inicial deste no meio reacional. O cálculo da conversao do éster obtido pela análise cromatográfica (Equaçao 1), foi realizado de acordo com a Norma BS EN 14103, que é utilizada para óleos e gorduras de origem animal e vegetal.
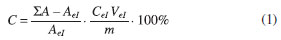
C é a conversao em % de éster, ΣA é a somatória das áreas integradas de todos os picos, AeI é a área do pico do padrao interno utilizado, neste caso o metil heptadecanoato, CeI é a concentraçao do padrao interno em mg/mL, VeI é o volume de padrao interno utilizado no preparo da amostra antes da injeçao em mL e m é a massa da amostra analisada em mg. A concentraçao em % de éster formado é dada em mg de éster por 100 mg de soluçao, e por meio de um balanço de massa é possível obter a massa de éster formada (Equaçao 2), em relaçao a massa total dos reagentes utilizados na reaçao.
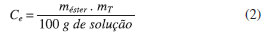
me é a massa de éster formado em relaçao a mT, que é a massa total da soluçao reacional (massa de ácido esteárico, massa de catalisador e massa de metanol). Com a massa de éster formado, foi feito um balanço de massa, de acordo com a Equaçao 3.
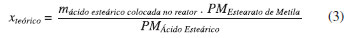
xteórico é a conversao teórica. A conversao experimental (yexp é calculada por meio da Equaçao 4.

Estabilidade térmica dos catalisadores A estabilidade térmica da sílica, do PTA e catalisador novo preparado com o HCl 0,1 mol L-1 foi avaliada por análise térmica (TGA/DTA simultâneos). As análises foram realizadas em um equipamento TG/SDTA 851 E, MetlerToledo, usando cadinhos de alumina, temperatura de 30 ºC até 1000 ºC, fluxo de O2 de 0,15 mL min-1 e taxa de aquecimento de 10 ºC min-1. Teste de lixiviaçao e recuperaçao do catalisador A avaliaçao da lixiviaçao e recuperaçao dos catalisadores foi realizada conforme estudo anterior.15 Entretanto, nesta etapa, devido às impregnaçoes terem sido realizadas também com outros solventes, fez-se necessário um novo estudo. As condiçoes de análise e o monitoramento da presença do PTA seguiram o mesmo protocolo.15 Após as reaçoes de esterificaçao, foram recolhidas alíquotas do meio alcoólico e determinadas as concentraçoes do HPA lixiviado por meio da espectrofotometria na regiao do UV/VIS, com um equipamento Varian Inc., modelo Cary 50 scan, com varredura de 800 a 200 nm e resoluçao de 1 nm. O monitoramento da presença do HPA por UV-VIS baseia-se nas bandas de absorçao em 220 nm e 265 nm (atribuídas à transferência de carga ligante-metal).20 A recuperaçao dos catalisadores do meio reacional foi realizada por meio de filtraçao à quente com 50 mL de clorofórmio a 62 ºC, para remoçao completa do éster, seguida de secagem em estufa a 100 ºC por 4 h. Determinaçao da atividade catalítica Para o estudo do reuso dos catalisadores foi utilizado o ácido 12-tungstofosfórico (PTA, Merck), com grau de pureza de 95 % no preparo do KISN/KISU9 (catalisador impregnado nas condiçoes ótimas do planejamento experimental). Os parâmetros utilizados para avaliaçao da atividade catalítica foram o TON e o TOF (Equaçao 5 e 6). O TOF é o número de vezes n que a atividade catalítica geral em questao pode ser calculada pelo número de sítios catalíticos por unidade de tempo nas condiçoes reacionais (temperatura, pressao ou concentraçao dos reagentes).21
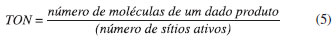
Análise estatística do planejamento fatorial A matriz foi construída por meio do delineamento fatorial, utilizando-se o MINITAB 14, no qual se fez a análise estatística (ANOVA). O planejamento indicou o número de 12 ensaios, sendo realizados em triplicatas, tendo como resposta a conversao do ácido esteárico em estearato de metila.
RESULTADOS E DISCUSSAO Análise fatorial da impregnaçao com distintos solventes A análise da influência das variáveis foi realizada com base nas respostas de conversao media de éster apresentado na Tabela 4, na qual verifica-se que as maiores conversoes médias (100 %) ocorreram quando os catalisadores foram preparados com menores concentraçoes de PTA, tendo a acetonitrila como solvente de impregnaçao (KISN5 e KISN6). Provavelmente os catalisadores com maior teor de PTA no solvente sofrem uma obstruçao dos poros e, consequentemente, uma menor conversao do éster.
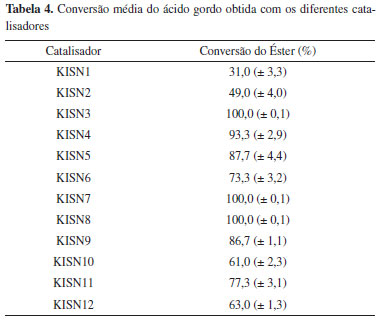
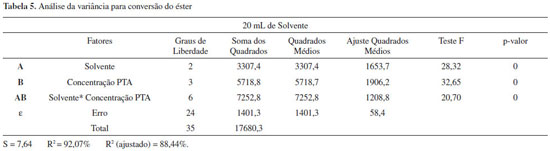
Contudo, as conversoes com os demais solventes também foram altas, em torno de 70 %. É importante ressaltar que os catalisadores preparados com o solvente HCl 0,1 mol L-1 (KISN9 à KISN12) também resultaram em conversoes expressivas, com uma media de 70 %. Sabe-se que o HCl 0,1 mol L-1 é muito menos tóxico do que os demais solventes, além do custo que também é muito menor. Esta análise é primordial sob a ótica da sustentabilidade, aliado ao custo operacional, uma vez que reduzindo o volume e a toxidade das matérias primas envolvidas nas reaçoes aliam-se características amigáveis ao produto final. A análise de variância (ANOVA) aplicada aos dados experimentais do planejamento fatorial resultou nos dados da Tabela 4. O ajuste para os dados analisados pode ser considerado muito bom para os dois solventes, pois R2 foi igual a 92,07 % e R2 ajustado em 88,44 %. Como o valor do R2 representa a fraçao da variaçao que é explicada pelo ajuste do modelo, quanto mais próximo de 100 % o valor do coeficiente R estiver, melhor estará o este ajuste às respostas observadas. Neste caso, o grau foi de 92,07 %, sobrando apenas 7,64 % de variabilidade por conta dos resíduos, os quais representam os dados que nao foram explicados pela ANOVA, podendo ser os erros aleatórios, devido ao grande número de variáveis envolvidas. Para testar a hipótese H0, utiliza-se o teste F apresentado na Tabela 5, no qual se verifica que o valor de p < 0,05, rejeita-se a hipótese nula e considera-se que há diferenças significativas entre os níveis para a resposta, que é a conversao em éster. Outro parâmetro importante é que o valor de F teórico, obtido na tabela de Fisher Snedecor com confiabilidade de 95 % foi de 3,27. Dessa forma, analisando-se o valor de F calculado na Tabela 5, observa-se que este é maior que o valor de F teórico, o que significa que a hipótese é aceitável.19
A hipótese nula H01: B1 = B2 = B3 = B4 é rejeitada, pois p = 0,00 < 0,05. Entao existe diferença estatisticamente significativa entre os níveis de PTA quanto à resposta com nível de confiança de 95%. A hipótese nula H02: A1 = A2 = A3 é rejeitada, pois p = 0,00 < 0,05. Entao existe diferença estatisticamente significativa entre os níveis de solvente quanto à resposta com nível de confiança de 95 %. A hipótese nula H03: B1:A1 = B2:A1 = B3:A1 = B4:A1 = B1:A2 = B2:A2 = B3:A2 = B4:A2 = B1:A3 = B2:A3 = B3:A3 = B4:A3 = B1:A4 = B2:A4 = B3:A4 = B4:A4 é rejeitada, pois p = 0,00 < 0,05. Entao existe diferença estatisticamente significativa entre os níveis de B:A quanto à resposta com nível de confiança de 95 %. Verifica-se que com a acetonitrila as melhores conversoes dos ésteres se deram nas concentraçoes de PTA 0,5 e 1,5 g. Entretanto, para o MetOH:H2O, as maiores conversoes foram obtidas quando da impregnaçao de 1,5 e 2,0 g do PTA. Para o HCl 0,1 mol L-1. Os melhores resultados foram obtidos quando da impregnaçao de 0,5 e 1,5 g do PTA. Esta análise estatística foi utilizada como uma ferramenta para direcionar o caminho do ótimo, porém devem-se considerar os fatores ambientais e econômicos envolvidos, que nao estao contemplados neste modelo. Entretanto, considerando a utilizaçao comercial como proposta, a utilizaçao de 0,5 g de PTA é mais viável economicamente, assim como a utilizaçao do HCl 0,1 mol L-1 que, além do fator ambiental, também proporcionou um produto mais estável e econômico em relaçao aos demais solventes. Estabilidade térmica dos catalisadores As medidas de análise térmica (TGA/DTA simultâneas) (Figura 1), mostram que o PTA apresenta três eventos endotérmicos na curva de DTA, concomitantes com dois eventos de perda de massa na curva de TGA. O primeiro evento endotérmico com um pico centrado em 100 ºC é atribuído à remoçao de água fisissorvida (perda de massa de 0,5 %). O segundo evento endotérmico centrado em 190 ºC (perda de massa de 1,5 % até 280 ºC) é atribuído à desidrataçao do PTA, e a perda das seis moléculas de água de constituiçao (H3PW12O40.6H2O). Um evento endotérmico entre 470 e 600 ºC (perda de massa de 0,5 % centrada em 450 a 470 ºC) está relacionado com a decomposiçao térmica do material.22
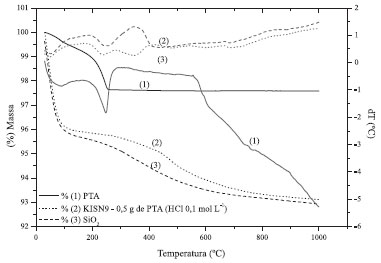
Figura 1. Curvas de análise térmica (TGA/DTA) do catalisador KISN9, sílica e PTA
A sílica e o catalisador apresentam pelo menos três eventos térmicos na curva de DTA (em 55, 250 e 430 ºC), os dois primeiros sendo atribuídos respectivamente à perda de água fisiossorvida (4,0 % até 55 ºC) e desidroxilaçao da sílica polihidroxilada (0,5 % até 250 ºC). O terceiro evento na curva (2) a partir de 250 e 430 ºC e na curva (3) entre 250 e 345 ºC, com perda de 0,5 % para ambos, estao relacionadas à cristalizaçao da sílica. Esta diferença das temperaturas do terceiro evento é ocasionada devido à presença do PTA. A decomposiçao da sílica tem início na temperatura de 430 ºC, com perda de massa total da temperatura ambiente até 1000 ºC de 0,5 % para a curva (3) e entre 345 e 1000 ºC com perda de massa de 1 % para a curva (2).23 No catalisador KISN9 (Tabela 3), os eventos térmicos basicamente consistem de uma superposiçao dos eventos da sílica e PTA, embora alguns picos tenham sido deslocados para menores temperaturas devido ao tamanho de partículas do PTA nos poros/superfície da sílica. Estabilidade química e recuperaçao dos catalisadores Os teores de PTA lixiviado no meio reacional, acompanhados por UV-VIS, sao mostrados na Tabela 3. Os resultados apresentaram menores teores de lixiviaçao (erro menor que 10-3) quando preparados com o acetonitrila e o HCl 0,1 mol L-1, com destaque para os catalisadores preparados com 0,5 g de PTA e HCl 0,1 mol L-1. Esses resultados indicam maior estabilidade do catalisador, visto que foram calcinados em temperaturas de 200 ºC, em contraste ao trabalho anterior, nos quais os materiais foram calcinados à 530 ºC.15 O meio ácido (HCl 0,1 mol L-1) propiciou um aumento na acidez do meio reacional, favorecendo a impregnaçao e evitando a hidrólise do ânion Keggin durante a evaporaçao do solvente.24 Para confirmar estes resultados outro método (qualitativo) foi empregado para avaliar-se a lixiviaçao, que foi a titulaçao da soluçao sobrenadante do meio reacional com um agente redutor (soluçao de ácido ascórbico a 10 %), a qual reagiria com o íon Keggin formando um complexo de coloraçao azul. Como nao houve o surgimento da coloraçao azul em nenhum dos ensaios, esta é evidência direta de que o catalisador é estável nas condiçoes reacionais empregadas. 25 Avaliaçao da atividade catalítica (TON e TOF) Testes de reuso do catalisador foram efetuados somente para as condiçoes otimizadas de preparo, cujo solvente empregado na impregnaçao foi o HCl 0,1 mol L-1. O HCl provavelmente conferiu um aumento da acidez de Brönsted ao material, favorecendo uma maior concentraçao de sítios ácidos e tornando-o mais ativo para a reaçao de esterificaçao.26 O catalisador perde aproximadamente 16 pontos percentuais de atividade catalítica após os 10 ciclos de uso (diferença das conversoes do primeiro (94 %) e do décimo ciclo (78 %) (Figura 2). A explicaçao pra esse fato se deve a quatro fatores principais: 1: Nem todo o catalisador foi recuperado em cada ciclo de reuso fazendo com que as massas dos reagentes tivessem que ser ajustadas à nova realidade para manter as razoes molares e teor do catalisador constante. Esse efeito causa um vazio no topo do reator que pode conter vapor de metanol, ocasionando uma menor razao molar álcool:ácido graxo, diminuindo a conversao. 2: Após sucessivos ciclos de reuso, a lixiviaçao nao detectada em um ciclo de uso pode se manifestar. 3: Desativaçao por outros efeitos como a obstruçao dos poros pelos reagentes e produtos, agregaçao dos cristais de PTA o que ocasiona diminuiçao da área superficial, desativaçao térmica, etc.27
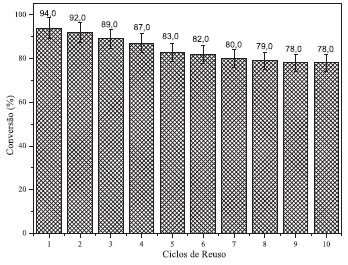
Figura 2. Ciclos de uso versus conversao de éster para o catalisador KIS9
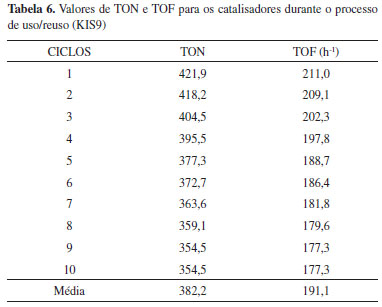
O número de turnover para o uso de 10 % de catalisador na reaçao com razao molar de 8:1 (MetOH:Acido Esteárico), na temperatura de 100 ºC foi calculado, resultando em um valor de 421,9 mols de substrato convertido por mol de PTA e um valor de TOF de 210,9 h-1. Tais valores mostram que, as altas conversoes catalíticas sao obtidas devido à alta eficiência por sítio catalítico ativo. Isto justifica a alta conversao após diversas regeneraçoes deste catalisador do meio reacional como apresentados na Figura 2. O fenômeno de desativaçao geralmente é atribuído à obstruçao dos poros do catalisador devido aos produtos de reaçao e à formaçao do coque durante o processo de calcinaçao do catalisador.27 Os valores de TON e TOF (Tabela 6) mostram que altas conversoes sao obtidas devido à alta eficiência dos sítios ativos do catalisador (esse valores sao certamente subestimados, já que certamente nem todos os sítios catalíticos do catalisador estao disponíveis). Destaca-se que a conversao, mesmo após 10 ciclos de reuso, é ainda alta (78%), e o catalisador mantêm cerca de 83 % da sua atividade catalítica original (78 %/94 %).
CONCLUSOES Os resultados apresentados mostram que catalisadores eficientes e reutilizáveis foram preparado quando PTA foi imobilizado em sílica, sob diferentes condiçoes de impregnaçao. O catalisador KISN9, que foi preparado com 0,5 g de PTA, 5 g de SiO2 e utilizando-se HCl 0,1 mol L-1 como solvente apresentou alta conversao em ésteres metílicos (94 %), bem como foi possível utilizá-lo em 10 ciclos de uso/reuso, onde se observou somente uma pequena desativaçao (16 pontos percentuais), o que demonstra que o catalisador é estável. Avaliando-se as variáveis e calculando os efeitos, observou-se que o parâmetro que mais impacta no valor da conversao é a razao molar (MetOH:ácido esteárico, 8:1). Os altos valores do TON e do TOF sao indicativos da possibilidade de uso comercial dos catalisadores investigados no presente trabalho. A contribuiçao científica deste trabalho na área de catálise foi a obtençao de catalisadores sólidos alternativos aos catalisadores convencionais utilizados em meio homogêneo (ex. ácido sulfúrico).
AGRADECIMENTOS A Coordenaçao de Aperfeiçoamento de Pessoal de Nível Superior - CAPES, pela bolsa. Ao Laboratório de Análise de Minerais e Rochas - LAMIR e ao Instituto de Tecnologia para o Desenvolvimento - LACTEC, pelo suporte técnico nas análises de caracterizaçao dos materiais. A Grace Davison, pela doaçao da sílica.
REFERENCIAS 1. Kozhevnikov, I. V.; Catalysts for Fine Chemical Synthesis-Catalysis by Polyoxometalates vol. 2, Wiley: England, 2002. 2. Ivanov, A. V.; Vasina, T. V.; Nissenbaum, V. D.; Kustov, L. M.; Timofeeva, M. N.; Houzvicka, J. I.; Appl. Catal., A 2004, 259, 65. 3. Juan, J. C.; Zhang, J.; Yarmo, M. A.; J. Mol. Catal. A: Chem. 2007, 267, 265. 4. Nandhini, K. U.; Arabindoo, B.; Palanichamy, M.; Murugesan, V.; J. Mol. Catal. A: Chem. 2006, 243, 183. 5. Patel, S.; Purohit, N.; Patel, A.; J. Mol. Catal. A: Chem. 2003, 192, 195. 6. Mallik, S.; Dash, S. S.; Parida, K. M.; Mohapatra, B. K.; J. Colloid Interface Sci. 2006, 300, 237. 7. Ferrell III, J. R.; Kuo, M. C.; Turner, J. A.; Herring, A. M.; Electrochim. Acta 2008, 53, 4927. 8. Caetano, C. S.; Fonseca, I. M.; Ramos, A. M.; Vital, J.; Castanheiro, J. E.; Catal. Commun. 2008, 9, 1996. 9. Fedotov, M. A.; Maksimovskaya, R. I.; J. Struct. Chem. 2006, 47, 952. 10. Misono, M.; Ono, I.; Koyano, G.; Aoshima, A.; Pure Appl. Chem. 2000, 72, 1305. 11 Misono, M.; Iuni, T.; Catal. Today 1999, 51, 369. 12. Bartholomew, C. H.; Appl. Catal., A 2001, 212, 17. 13. Rothenberg, G.; Catalysis - Concepts and Green Applications. Wiley-VH: Germany, 2008. 14. Bhure, M. H.; Kumar, I.; Natu, A. D.; Chikate, R. C.; Rode, C. V.; Catal. Commun. 2008, 9, 1863. 15. Scroccaro, K. I.; Tanobe, V. O. A.; Côcco, L .C.; Yamamoto, C. I.; Wypych, F.; Quim. Nova 2012, 35, 1343. 16. Dias, A. J.; Caliman, E.; Dias, S. C. L.; Paulo, M.; Thyrso, A.; de Souza, C. P.; Catal. Today 2003, 85, 39. 17. Caliman, E.; Dias, J. A.; Dias, S. C. L.; Prado, A. G. S.; Catal. Today 2005, 107-108, 816. 18. Regalbuto, J.; Catalyst Preparation, New York: CRC Press, 2007. 19. Barros Neto, B. de. Em Como fazer experimentos, 3 ed., Scarminio, I. S.; Bruns, R. E., eds.; Editora da Unicamp: Sao Paulo, 2007. 20. Santos, G. L. G. dos; Silva, C. S.; Cardoso, L. A. M.; Quim. Nova 2010, 33, 57. 21. Thomas, J. M.; Principles and Practice of Heterogeneous Catalysis; Thomas, W. J., ed.; VHC: New York, 2008. 22. Kozhevnikov, I. V.; Appl. Catal., A 2007, 262, 86. 23. Zhou, Y. W.; Jaroniec, M.; Gilpin, R. K. J.; Colloid Interface Sci. 1997, 185, 39. 24. Rao, P. M.; Wolfson, A.; Kababya, S.; Vega, S.; Landau, M. V.; J. Catal. 2005, 232, 210. 25. Gao, J.; Wei, Y.; Wang, H.; Yang, W.; Rare Met. 2007, 26, 152. 26. Bail, A.; Tese de Doutorado, Universidade Federal do Paraná, Brasil, 2012. 27. Kozhevnikov, I. V.; Appl. Catal., A 2003, 256, 3. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access