Assuntos Gerais
|
|
| A química dos saneantes em tempos de COVID-19: você sabe como isso funciona? The chemistry of sanitizers in COVID-19 times: do you know how it works? |
|
Maria L. S. O. LimaI,*; Ramon K. S. AlmeidaII; Francine S. A. da FonsecaIII; Caroline C. S. GonçalvesIV,**
I. Departamento de Ensino, Instituto Federal de Educação, Ciência e Tecnologia da Bahia - Campus Juazeiro, 48918-900 Juazeiro - BA, Brasil Recebido em 14/05/2020 *e-mail: marialair@ifba.edu.br In December 2019, the first case of severe acute respiratory syndrome (COVID-19), caused by the new coronavirus (SARS-CoV-2) was reported and the disease was declared as a worldwide pandemic in March 2020. As there is no vaccine currently available, the daily hygiene cleaning habits and social distance are the ways to fight COVID-19 indicated by the WHO. Hand and surface hygiene has become essential and the use of 60-90% ethanol is recommended for its effective biocide action. Phenol-based products are effective sanitizers, but they can cause irritation and are not recommended for surfaces that come into contact with food. There are quaternary ammonium salts that present low toxic and are good sanitizers, as they can cause the denaturation of proteins and disruption of viral lipid bilayer. Sodium hypochlorite is one of the most used sanitizers due to its low cost and effective oxidative capacity. In the same direction, peroxides are also used as a biocide, as they cause oxidation of lipids and denaturation of viral proteins. The goal of this paper is to describe the action modes and chemical concepts of the sanitizers recommended by the ANVISA-Brazil to be used against the new coronavirus. INTRODUÇÃO Embora o mundo tenha sofrido com diversas pandemias de origens bacterianas (como a cólera e a peste bulbônica) e virais (como a gripe espanhola, a varíola e a recente H1N1) e que essas tenham causado milhões de mortes em todo o planeta,1-4 é a Coronavirus disease 2019 (COVID-19), uma enfermidade causada por um agente da família dos coronavírus, o Severe Acute Respiratory Syndrome Coronavirus 2 (Coronavírus da Síndrome Respiratória Aguda 2), mais conhecido como SARS-CoV-2 ou novo coronavírus, que se apresenta como a grande protagonista da contemporaneidade.5,6 Segundo dados da Sociedade Brasileira de Infectologia, essa doença tem se destacado devido a apresentar uma elevada taxa de contaminação (considerando um curto intervalo de tempo) aliada a um agravamento significativo no número de quadros clínicos das pessoas infectadas (com especial atenção às pessoas maiores de 60 anos e às que apresentam comorbidades).7 Isso se comprova pelo número crescente de casos, diariamente atualizado pela Organização Mundial de Saúde (OMS). Desde que foi reportado o primeiro caso, em dezembro de 2019, até o dia 11 de maio de 2020, a COVID-19 já foi detectada em todos os continentes, com um total de 4.006.257 de casos e 278.892 óbitos confirmados em apenas 5 meses.8 No Brasil, até essa data, foram notificados 162.699 casos e 11.123 óbitos ocasionados pelo SARS-CoV-2 em todas as regiões do país.9 Esse número, aliado a um grande número de subnotificações, esconde o cenário real no país e leva a um ambiente de incertezas sobre o número exato de pessoas infectadas.10 Ainda, vale ressaltar que pressões político-econômicas têm dificultado a adoção de medidas de saúde públicas e contribuído para a dimuição da taxa de adesão da população às medidas de isolamento e distanciamento social, constantemente ratificadas pela OMS.11 Isso ocorre porque, embora comprovadamente eficientes no controle da doença,12 essas medidas têm impactado, de modo bastante significativo, diferentes setores da economia, afetando a oferta e a procura mundial de produtos e materiais nas mais diversas linhas de produção e consumo e também as fontes de rendas formais e informais da população como um todo.13,14 Embora impactante, esse protagonismo do isolamento como principal medida de contenção se dá porque a disseminação da COVID-19 ocorre de modo bastante semelhante ao de uma gripe comum: ao falar, tossir ou espirrar, uma pessoa infectada (sintomática ou não)15 pode expelir gotículas contendo o vírus ativo, que podem vir a contaminar objetos e superfícies. Assim, outras pessoas podem se infectar, por exemplo, inalando essas gotículas ou tocando superfícies contaminadas. Nesse último, a infecção poderá ocorrer se, em seguida, a pessoa levar as mãos aos olhos, boca ou nariz.16 É importante ressaltar que, a depender da superfície onde se encontra, o SARS-CoV-2 pode se manter ativo por diferentes períodos: até 2,5 horas em poeira, 4 horas sobre o cobre, 24 horas sobre o papelão e até 72 horas (3 dias), sobre materiais como plástico e aço inoxidável. No entanto, estudos realizados com um vírus similar, o SARS-CoV (Severe Acute Respiratory Syndrome Coronavirus, anterior ao SARS‑CoV-2 e responsável pela pandemia de SARS em 2002-2003), também avaliaram essas superfícies e outras adicionais, como o vidro e a madeira, onde o mesmo se mostrou ativo por até 5 dias em temperatura ambiente.17,18 São essas características de transmissão, associadas a um agravamento rápido no estado de saúde dos pacientes, que têm contribuído para que sistemas de saúde de muitos países e regiões tenham entrado em colapso, com muitos pacientes em estado grave a serem assistidos simultaneamente, associados à uma pouca demanda técnico-operacional para atendê-los.13,14 Por se tratar de uma síndrome respiratória aguda, a infecção causada pelo SARS-CoV-2 afeta todo o sistema respiratório e pode causar um extenso lesionamento dos pulmões, em especial dos alvéolos (onde ocorrem as trocas gasosas), e o paciente pode vir a ter tosse e dispnéia, que é comumente relatada como um sintoma de agravamento.19 Contudo, os danos causados pelos SARS-CoV-2 não se restringem ao sistema respiratório. Evidências apontam que ele pode atacar outros órgãos e tecidos, como o coração, vasos sanguíneos, intestino, olhos, rins, fígado e cérebro.20 Embora existam muitos estudos em andamento, ainda não há nenhum antiviral específico recomendado pela OMS para o tratamento de COVID-19. No entanto, aproximadamente 90 estudos visando o desenvolvendo de vacinas estão em curso ao redor do mundo e pelo menos seis grupos já iniciaram os testes com humanos, enquanto outros estão em fase de testes com animais.21 Desse modo, na ausência de vacinas e medicamentos comprovadamente eficazes e seguros, o combate da COVID-19 tem se focado no tratamento dos sintomas e em medidas simples de prevenção, como o uso de máscaras, o isolamento e distanciamento sociais, além do uso de agentes químicos saneantes, recomendados por órgãos competentes, empregados na higienização frequente das mãos, objetos e superfícies, foco de discussão desse artigo. Nesse contexto, o presente artigo visa mostrar, de maneira didática, simples e informativa, uma contextualização interdisciplinar de conceitos químicos fundamentais que permitam ao leitor, compreender, a partir da composição do vírus SARS-CoV-2, como os agentes químicos saneantes presentes nos produtos de limpeza podem auxiliar na sua erradicação. Aqui, elencamos os principais agentes químicos recomendados por órgãos de saúde mundialmente conhecidos. Ao final, o leitor será capaz de entender como importantes moléculas biocidas são capazes de auxiliar na erradicação e controle de doenças microbianas e como o papel das boas práticas de higiene e limpeza podem refletir, diretamente, dentro de um contexto e cuidado social, como o enfrentado na atualidade, com a pandemia da COVID-19.
SARS-COV-2: ORIGEM, ESTRUTURA VIRAL E INFECÇÃO Em 31 de dezembro de 2019, a Comissão Municipal de Saúde de Wuhan, China, relatou um conjunto de casos graves de pneumonia causados por um novo coronavírus, com os primeiros casos da doença detectados em indivíduos frequentadores do Mercado Atacadista de Frutos do Mar de Huanan, na China. Esse mercado é mundialmente conhecido pelo comércio de mamíferos selvagens e isso, mais tarde, corroboraria com a hipótese de que o vírus poderia ter origem zoonótica. Pouco tempo depois, em 12 de janeiro de 2020, a China compartilhou a sequência genética do agente causador da COVID-19 e o SARS-CoV-2 teve sua identidade genética conhecida em nível mundial. Com o aumento significativo do número de casos em proporções continentais, a OMS reconheceu, em 30 de janeiro de 2020, que a COVID-19 se tornara uma emergência de saúde pública internacional, sendo oficialmente reconhecida como uma pandemia em 11 de março do mesmo ano.22 Apesar de ainda existirem controvérsias sobre a origem do novo coronavírus, existe a certeza de que o mesmo não foi produzido em laboratório, segundo estudo realizado por cientistas de três diferentes países.23 Embora tenham-se isolado coronavírus de pangolins, capturados em Nanning e Guangzhou, e que estes apresentem elevada identidade genômica com o SARS-CoV-2, com similaridade de 85,3% a 89,7%, a hipótese mais aceita é que ele provavelmente é oriundo de morcegos. Em termos comparativos, a sequencia do genoma do SARS-CoV-2 apresentou elevada similaridade (de 87% a 96%) com coronavírus isolados de morcegos do gênero Rhinolophus, encontrados em diferentes regiões da China. Desse modo, é possível que o vírus tenha sofrido um processo evolutivo (no morcego ou em outro hospedeiro) com posterior transmissão para seres humanos ou, ainda, é também possível que uma forma não patogênica tenha sido transmitida para seres humanos, com o processo evolutivo ocorrendo apenas no hospedeiro final.24 De forma geral, os vírus são constituídos por duas estruturas básicas que, juntas, formam o nucleocapsídeo: o cerne (parte central) onde se encontra o genoma (DNA ou RNA) e uma capa proteica, o capsídeo. Alguns gêneros podem ser formados exclusivamente pelos nucleocapsídeo e outros podem apresentar uma membrana externa, o envelope. O envelope é uma membrana fosfolipídica que confere uma proteção extra ao vírus, além de auxiliá-lo no processo de infecção celular.25 Os coronavírus são vírus de RNA de fita simples, esféricos, com cerca de 125 nm de diâmetro e revestidos por um envelope lipoproteico. O SARS-CoV-2 tem 4 proteínas estruturais relacionadas à regulação de função e estrutura viral: a envelope (proteína E), a de membrana (proteína M), a spike (proteína S) e a nucleocapsídeo (proteína N), como representado na Figura 1. A proteína N auxilia na formação do capsídeo e de toda a estrutura viral e a S está diretamente relacionada ao processo de infecção viral.26 Quanto a aparência, esses vírus apresentam projeções em forma de espículas formadas por trímeros da proteína S, que geram aspecto de coroa, de onde deriva o nome corona (Figura 1).27
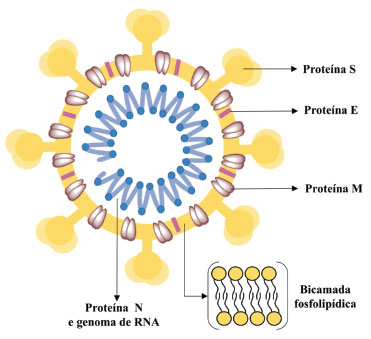 Figura 1. Estrutura viral simplificada do SARS-CoV-2
Quanto ao processo de infecção, a invasão da célula pelo SARS-CoV-2 ocorre a partir da ligação da proteína S com um receptor enzimático, a enzima conversora de angiotensina 2 (ACE2) na superfície da célula humana. O vírus então se funde à membrana e libera seu material genético (RNA viral) no interior da célula que, uma vez infectada, começa a fabricar proteínas que auxiliarão na produção de cópias do vírus. Cada célula infectada é capaz de produzir milhões de novas partículas virais, que uma vez liberadas no organismo do hospedeiro, irão infectar outras células sadias.21 O SARS-CoV-2 pertence à família Coronaviridae e à ordem Nidovirales. Membros desta família comumente causam infecções respiratórias e gastrointestinais e são amplamente distribuídos em humanos e outros mamíferos.28 Desses, sete espécies podem infectar humanos, das quais três podem produzir doenças graves, como o SARS-CoV, o MERS-CoV (causador da MERS - Middle East Respiratory Syndrome) e o SARS-CoV-2. Note que, nesses casos, o termo "CoV" é sempre referente ao coronavírus enquanto que o restante da sigla faz referência à enfermidade. Outros coronavírus, como HKU1, NL63, OC43 e 229E estão associados a doenças com sintomatologia leve. Acredita-se que, dada a grande diversidade genética, a frequente recombinação dos genomas destes vírus e a possibilidade de transmissão interespécie, novas coronaviroses deverão acometer, periodicamente, a humanidade.29
O PAPEL DOS SANEANTES NO COMBATE DA COVID-19 Quando surtos de doenças contagiosas, oriundas de micro-organismos, começam a se propagar dentre as mais diversas populações, as boas e tradicionais técnicas de higienização pessoal e de superfícies passam a atuar como grandes protagonistas no combate às suas disseminações.30 Nesse contexto, órgãos oficiais com espectro de abrangência mundial, como a OMS,16 passam a ratificar, de modo bastante incisivo, a importância de hábitos cotidianos de higienização e limpeza. Assim, torna-se cada vez mais frequente, em nosso dia a dia, ouvirmos falar não apenas sobre a importância da nossa higiene pessoal (com especial atenção à limpeza de nossas mãos, vetores de destaque na transmissão de doenças), mas também da importância de higienizar adequadamente nossos lares, locais de trabalho e também objetos de uso cotidiano, como roupas, celulares, chaves e bolsas. Esses hábitos, quando concomitantes ao uso de saneantes adequados, atuam diminuindo, consideravelmente, a transmissão de patógenos, o que influencia diretamente nos decréscimos das morbidades e mortes e também na redução dos custos associados ao sistema de saúde mundial, resultados de uma contenção mais rápida e efetiva de uma pandemia em curso.31,32 Mas, quando se fala em saneantes, quem são os grandes protagonistas químicos nessa história? As opções são muitas e esses podem apresentar formas diversificadas de ação que, por sua vez, podem estar associadas à existência de forças intermoleculares ou, até mesmo, a capacidade oxidativa de um dado agente biocida sobre as biomoléculas de interesse existentes nos micro-organismos alvos.33,34 Quando se tratam dos representantes das forças intermoleculares, tem-se os tão conhecidos sabões, detergentes, sabonetes e desinfectantes multiuso, por exemplo. É nesses produtos que podemos encontrar, como princípios ativos, moléculas aptas a atuarem na desestabilização de, por exemplo, proteínas e membranas biológicas e, assim, contribuírem para que o micro-organismo se desestruture e se inative.35,36 Vale ressaltar que outros agentes importantes e que também exploram este tipo de interação são os produtos à base de álcoois, como o etanol (utilizado na limpeza geral e em produtos que vão sobre a pele), o isopropanol e o n-propanol (indicados para a higienização de eletrônicos, sendo o n-propanol de uso mais comum no continente europeu), por exemplo.37 Além das forças intermoleculares, outra forma bastante curiosa de atuação é através das reações químicas de oxidação. Nesse caso, o hipoclorito (presente na água sanitária) e os peróxidos são ferramentas-chave para que estas reações ocorram. Assim, como os micro-organismos apresentam em suas estruturas, biocompostos orgânicos como proteínas, ácidos nucléicos e lipídeos, esses agentes biocidas podem atuar na oxidação desta matéria orgânica à subprodutos de degradação e, assim, contribuir para suas inativações.38 Desse modo, é de suma importância que os consumidores sejam devidamente informados sobre a composição, o grau de eficiência e forma de aplicação dos produtos por eles adquiridos. É significante lembrar que esses produtos são de uso externo e que não devem ser ingeridos. De fato, se observarmos os rótulos com atenção, há, inclusive, medidas a serem tomadas em caso de ingestão acidental ou contato com mucosas, por exemplo. No entanto, quem garante a veracidade e a qualidade dessas informações? Nesse caso, cada país apresenta um órgão regulamentador próprio, que define as diretrizes de fabricação e teores máximos e mínimos de um dado princípio ativo, a fim de garantir a sua eficiência para o que foi criado. É importante enfatizar que, embora se saiba da presença de um dado princípio ativo em um produto de limpeza, devemos ter certeza de sua concentração e do tempo de ação que o mesmo deve ter sobre a superfície. Desse modo, deve-se ter muito cuidado quanto ao uso de produtos de fabricação caseira, uma vez que esses, além de não terem sua qualidade certificada, podem vir a conter misturas inadequadas de diferentes ingredientes ativos. Isso pode acarretar em sérios danos à saúde, como intoxicação, queimaduras e reações adversas aos que a eles se expõem.39 Portanto, ao adquirir um produto de limpeza, devemos conferir o rótulo atentamente e buscar a informação de certificação, bem como sua correta aplicabilidade e manuseio, uma vez que, muitos deles, necessitam do uso auxiliar de equipamentos de proteção individuais (EPIs) para erradicar possíveis riscos à saúde de quem os manuseiam. No Brasil, a Agência Nacional de Vigilância Sanitária (ANVISA) é a responsável por estas informações.40 Assim, após o surto da COVID-19, a ANVISA e outros órgãos fiscalizadores de diferentes países divulgaram listas de saneantes certificados e de seus princípios ativos, que podem ser utilizados na sanitização diária de nossos lares, objetos e locais de trabalho. Na Tabela 1 temos alguns exemplos de diferentes princípios ativos encontrados em produtos de limpeza de uso cotidiano, segundo recomendações de órgãos competentes como a ANVISA,41 o Centers for Disease Control (Centro de Controle de Doenças - CDC, órgão norte-americano),37, a United States Environmental Protection Agency (Agência de Proteção Ambiental dos Estados Unidos - EPA) e o Ministerio de Sanidad, Consumo y Bienestar Social (Ministério da Saúde, Consumo e Bem-estar Social - MSCBS, entidade espanhola),42 aptos a terem uma ação virucida em meio à pandemia atual.
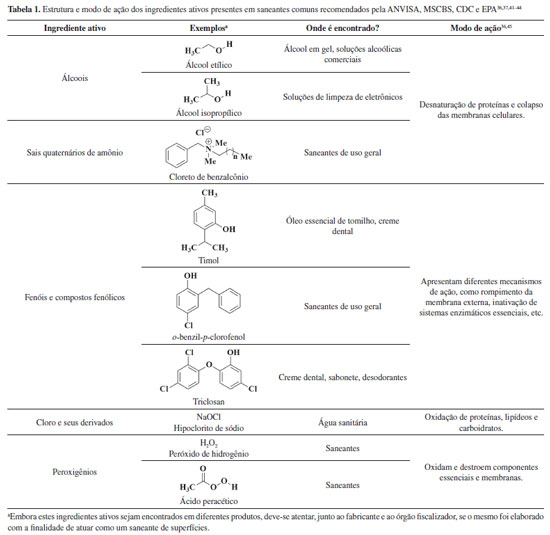
Nesse contexto, apresentamos, a seguir, como alguns dos principais saneantes recomendados pela ANVISA, MSCBS, CDC e EPA atuam, quimicamente, no combate a proliferação de micro-organismos, com especial atenção ao SARS-CoV-2, grande responsável pela pandemia atual. 36,37,41-45 Álcoois como agentes biocidas Ao se falar em higienização, limpeza e desinfecção, o termo álcool aparece com frequência e, no Brasil, se refere especificamente aos compostos químicos etanol (álcool etílico) e isopropanol (também denominado de álcool isopropílico). Esses compostos, representados na Tabela 1, apresentam dois e três átomos de carbonos, respectivamente, e são bastante solúveis em água. Isso se dá devido à formação de forças intermoleculares fortes, as ligações de hidrogênio, que ocorrem entre as hidroxilas dos álcoois e as moléculas de água quando próximas umas das outras.46 Desse modo, é bastante comum encontrarmos esses compostos (principalmente o etanol) comercializados como soluções aquosas ou derivados que tenham base aquosa em sua formulação, como o álcool em gel comercial.47 O etanol, de fórmula molecular C2H6O, é um composto orgânico biocida, incolor, tóxico, com ponto de ebulição de 78,3 °C e baixo ponto de fulgor, de valor igual a 12,8 °C. Isso significa que, a partir de 12,8 °C, o etanol já é capaz de vaporizar-se e, se em contato com alguma fonte de calor, entrará em combustão e poderá provocar acidentes. Uma forma de minimizar esse efeito é comercializá-lo como álcool em gel. Isso porque a formulação em gel possui uma maior resistência ao escoamento (uma propriedade física denominada de viscosidade),48 o que reduz consideravelmente o seu espalhamento sobre a superfície quando comparada à uma formulação líquida de igual concentração. Como consequência, isso diminui o risco de incêndios, principalmente no âmbito doméstico. Desse modo, em nosso dia a dia, é bastante comum encontramos o etanol em gel como um saneante de mãos e de superfícies. Em termos biológicos, os álcoois, em especial o etanol, se apresentam como agentes de ação biológica de largo espectro, podendo agir sobre bactérias, fungos e vírus. Quando se tratam das ações virucidas, estes apresentam uma ação bastante eficaz, com destaque para atuação sobre vírus envelopados, como o SARS-CoV-2.36,49 Devido as suas composições químicas, uma das explicações viáveis para o modo de atuação dos álcoois sobre os vírus pode estar relacionada à desnaturação das proteínas que os compõem. Quando enxergamos as proteínas como macromoléculas biológicas perfeitamente enoveladas conforme suas sequências de aminoácidos, forças intermoleculares de diferentes naturezas passam a predominar e a se definirem à medida que a cadeia polipeptídica se constrói. A presença dessas interações auxilia moldando as proteínas, de modo a formarem estruturas tridimensionais funcionais e ativas na espécie biológica a qual pertencem. Desse modo, a presença de uma solução química alcoólica pode interferir nessas interações e romper, por exemplo, ligações de hidrogênio que existam entre os resíduos de aminoácidos a partir da formação de novas interações (Figura 2). Quando essas forças se rompem, outras interações mais fracas, como as hidrofóbicas forças de London, acabam também por se romperem. Como resultado, tem-se um desarranjo estrutural das proteínas afetadas com consequente perda de suas atividades, o que pode deixar o vírus ineficiente.
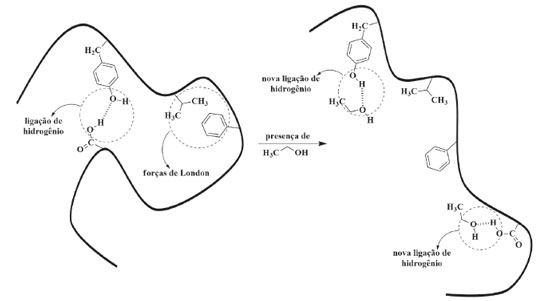 Figura 2. Representação de interações intermoleculares de uma proteína antes e depois da ação do etanol
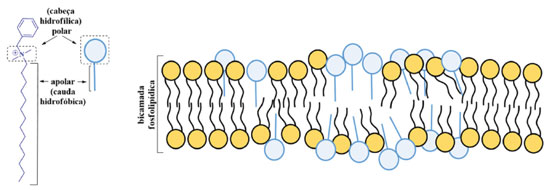
Outra ação curiosa dos álcoois está relacionada ao seu papel frente à membrana do vírus. Devido ao SARS-CoV-2 apresentar uma bicamada fosfolipídica como membrana (Figura 3-a),50,51 a ação dos álcoois também pode se dar sobre as biomoléculas que a compõe e, assim, inativar o vírus a partir da desestruturação de sua membrana biológica (Figura 3-b).
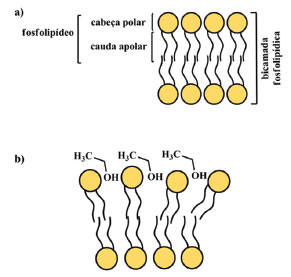 Figura 3. Exemplo de a) uma bicamada fosfolipídica e b) de modificação estrutural na presença de etanol 50,52
Na literatura científica, há relatos relevantes de estudos envolvendo técnicas como Ressonância Magnética Nuclear (RMN) e simulações computacionais que corroboram com essa hipótese.52-54 Desse modo, em se tratando de álcoois de cadeia curta, como o etanol, prevalecerão as interações de natureza polar, que só são possíveis de acontecer com a cabeça do fosfolipídeo (porção hidrofílica), conforme representado na Figura 3-b. Assim, essa ação do álcool sobre a membrana desestrutura o vírus e impossibilita seu RNA de ser replicado na célula hospedeira. Estudos semelhantes com membranas biológicas genéricas também fazem referência a álcoois de cadeias maiores, com 8 átomos de carbono, por exemplo. Nesse caso, além das ligações de hidrogênio ora descritas, ocorrem interações fracas entre as cadeias carbônicas apolares do álcool e a cauda apolar do fosfolipídio e isso também ocasiona modificações nas estruturas das membranas biológicas.55,56 Apesar desse relato, a eficiência biocida dos álcoois de cadeia curta, aliada à uma maior solubilidade em água e facilidade de obtenção, são qualidades que podem contribuir para que estes sejam mais facilmente comercializáveis. Devido a essa dupla eficiência, o etanol tem se mostrado um agente virucida bastante eficiente frente ao SARS-CoV-2, sendo utilizado, no dia-a-dia, na desinfecção das mãos por exemplo. Mas como saber qual concentração de etanol utilizar? Aqui, devemos ressaltar que as concentrações alcoólicas utilizadas com a finalidade de desinfetar são para abranger um largo espectro microbiano, não apenas ao SARS-CoV-2. Por conseguinte, é recomendado o uso de produtos com concentrações que variem de 60 a 90 %, com um tempo médio de 20 a 30 s de fricção das mãos ou de efetivo contato com a superfície.17,49,57 No entanto, embora haja estudos sobre as concentrações ideais de uso,17 é possível encontrar concentrações inferiores de álcool em produtos de limpeza e higiene comerciais. Nesse caso, os álcoois não atuam como os únicos agentes biocidas, mas como potencializadores da ação de outros agentes em questão. Sais quaternários de amônio Largamente utilizados como insumos em detergentes, amaciantes e em diversos produtos de limpeza e cuidados pessoais, os sais quaternários de amônio constituem a principal classe de surfactantes catiônicos e apresentam propriedades antiestáticas e saneantes.58 Sendo assim, eles se destacam não apenas por suas ações fungicida e bactericida, mas também pelo seu importante potencial virucida, com especial atuação sobre vírus envelopados,59 como o novo coronavírus. Vale ressaltar que suas baixas toxicidades e capacidades de serem formulados para aplicações específicas em organismos-alvo ajudam a explicar seus usos generalizados.60 Estruturalmente, os sais de quaternários de amônio são compostos por uma parte catiônica (que consiste de um átomo de nitrogênio central, ligada a quatro grupos alquilas ou arilas, como mostra a Figura 4. Geralmente, um desses grupos corresponde a uma longa cadeia de hidrocarboneto, o que resulta na porção lipofílica da molécula. Além disso, eles também apresentam uma parte aniônica (X-), comumente representada por um cloreto ou brometo, que atua como o contra-íon na formação do sal.61
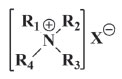 Figura 4. Estrutura geral de um sal quaternário de amônio
Os sais quaternários de amônio podem ser classificados de acordo com a natureza dos grupos R, os quais podem incluir ramificações, tamanho da cadeia carbônica, grupos aromáticos, além da presença de mais átomos de nitrogênio (como os sais que apresentam mais de um nitrogênio quaternário em sua estrutura). Essas variações podem afetar a atividade biocida desses compostos, alterando a dosagem e ação contra diferentes grupos de micro-organismos. Na literatura, há relatos de que sais com comprimentos de cadeia de grupos que vão de C12 a C16, geralmente, mostram as melhores atividades. A Figura 5, apresenta três principais representantes de sais quaternários de amônio contidos extensivamente em produtos domésticos, industriais e hospitalares.60
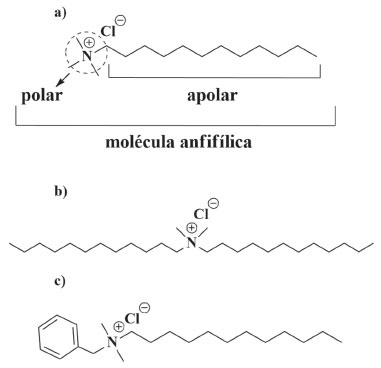 Figura 5. Exemplos de surfactantes catiônicos. Cloreto de (a) dodeciltrimetilamônio, (b) didodecildimetilamônio e (c) dodecilbenzildimetilamônio
Agora, sabendo das informações estruturais dos sais quaternários de amônio e que o SARS-CoV-2 é um vírus envelopado, por que o uso desses saneantes é tão recomendado como medida de proteção contra o vírus? Os quaternários de amônio, presentes nesses produtos, são substâncias anfifílicas, as quais apresentam, em sua estrutura, uma parte polar e hidrofílica e outra apolar e hidrofóbica, como mostrado na Figura 5-a. Por conseguinte, uma extremidade da molécula é atraída pela água e repelida por gorduras, enquanto que e o outro lado da molécula é atraído pelas gorduras e repelido pela água. É essa estrutura química de natureza dual que torna os produtos que as contém tão eficazes contra o novo coronavírus.62 De maneira simplificada, a porção hidrofóbica do quaternário de amônio irá interagir com a bicamada lipídica, fazendo com que ela perca sua estabilidade. Desse modo, a ação virucida dos sais de quaternários de amônio sobre vírus envelopados envolverá o rompimento ou separação do envelope viral com liberação subsequente do nucleocapsídeo. Essa ruptura pode ser atribuída à maior afinidade de vírus envelopados por quaternários de amônio, que se dão majoritariamente através de interações hidrofóbicas existentes, com imerção de suas cadeias apolares em meio a bicamada.59,63,64 A Figura 6 é uma representação simplificada dessas interações.
Desse modo, temos aqui uma aplicação crucial de dois importantes conceitos químicos, que podem vir a atuar de modo sinérgico sobre o vírus: a polaridade e as forças intermoleculares. Na polaridade, semelhante dissolve semelhante, ou seja, substâncias polares são solúveis (ou conseguem solubilizar/estabilizar) em substancias polares e substancias apolares são solúveis em substancias apolares.65 No contexto da membrana do vírus, a mesma é formada por uma bicamada de fosfolipídios, onde existe uma extremidade polar (cabeça) e uma cauda hidrocarbônica apolar. Tal estrutura química é semelhante aos compostos quaternários de amônio, que, por conseguinte, interage com a membrana do vírus e contribui para a dissolução da mesma; Quanto às forças intermoleculares, a parte iônica da estrutura do quaternário de amônio interage com a água por ligação de hidrogênio e a parte hidrocarbônica interage com a membrana do vírus por interações fracas de van der Walls do tipo dipolo induzido momentaneamente.65 Tais interações causam perturbação à bicamada fosfolipídica do envelope viral e provocam sua dissolução. Isso explica o fato de apenas água não ser suficiente para inativar o vírus, pois faz-se necessário moléculas com características anfifílicas, que atuem na membrana do vírus mas que sejam removidas pela ação da água, como os sais quaternários de amônio ora apresentados. Aqui, é importante ressaltar que, embora o foco esteja direcionado aos sais quaternários de amônio, também existem outros tipos de surfactantes, os aniônicos. Dentre eles, podemos citar o linear alquil sulfonato de sódio (encontrado em detergentes) e o lauril sulfato de sódio (muito usado na fabricação de shampoos e sabonetes).66 Devido apresentarem um modo de ação similar e baixas toxicidade e agressão à pele, produtos que contenham esse tipo de surfactante são também bastante recomendados na higienização das mãos, importantes vetores de transmição da COVID-19. Fenol e compostos fenólicos Com uma ampla gama de propriedades biológicas, como atividade antioxidante, antitumoral, anti-inflamatória e biocida, os compostos fenólicos constituem a principal classe de metabólitos secundários de origem vegetal.67 Cronologicamente, o fenol está entre os primeiros germicidas a serem utilizados. No princípio, ele foi empregado no tratamento de esgotos e, somente a partir de 1867, passou a ser utilizado na assepsia de material cirúrgico, sendo até hoje empregado na desinfecção hospitalar. Contudo, nos últimos 30 anos, o fenol tem dado espaço aos seus derivados, os quais, a uma concentração em torno de 5%, podem também apresentar uma ação bactericida, fungicida e virucida, com especial atuação sobre vírus envelopados,68 como o SARS-CoV-2. Assim, é possível encontrar compostos fenólicos como o triclosan, o o-benzil-p-clorofenol e o timol na formulação de produtos de limpeza e de anti-sépticos, como apresentado na Tabela 1. Embora eficientes no quesito desinfecção, deve-se ressaltar que o fenol e alguns derivados são corrosivos e, em altas concentrações, podem causar irritações oculares e na pele. Isso pode ocasionar uma rápida destruição de tecidos e uma toxicidade sistêmica fatal.69 Por conseguinte, não é recomendada a utilização de produtos à base de fenóis em superfícies que tenham contato com alimentos ou em áreas com crianças, a fim de evitar qualquer ingestão acidental dos agentes químicos em questão.70 De acordo com a ANVISA e a EPA, tanto o timol quanto o triclolosan aparecem nas listas de produtos indicados na prevenção contra o novo coronavírus. Já o o-benzil-p-clorofenol aparece entre os compostos recomentados pela ANVISA e pelo MSCBS.40,42,44 No entanto, embora se conheça a eficiência desses compostos, os seus mecanismos de ação ainda não são totalmente conhecidos. Estudos com diferentes micro-organismos, em especial os bacterianos, indicam que é possível que haja mais de um modo de ação e que esses podem envolver interações com membranas biológicas ou a formação de complexos instáveis com enzimas essenciais.71,72 Por outro lado, é importante ressaltar que, embora muitos mecanismos de ação biocidas sejam estudados em bactérias e que estes não se apliquem em sua totalidade a outros organismos, testes in vitro são comumente realizados com outras espécies biológicas (como fungos e vírus) a fim de detectar a sua concentração biocida sobre o organismo avaliado e garantir seu efeito sobre ele.36,37 Analisemos, portanto, cada composto separadamente. Timol O timol é o monoterpeno predominante dos óleos essenciais de plantas da família Lamiaceae, da qual fazem parte o tomilho, o orégano e o manjericão, por exemplo. Os óleos essenciais dessas espécies são bastante utilizados na indústria de alimentos, aplicados como flavorizantes e preservantes. Além disso, são também empregados na medicina tradicional, onde suas propriedades antioxidantes, antimicrobianas, antissépticas, analgésicas, anti-inflamatórias e antitumorais são exploradas.73 Embora pouco se saiba sobre o mecanismo da ação antimicrobiana do timol, estudos utilizando Escherichia coli como modelo indicam que o composto atua sobre a membrana. Nesse caso, demonstrou-se que o timol se insere na bicamada, o que ocasiona alterações físicas e químicas que afetam tanto o ordenamento lipídico quanto a sua estabilidade. Isso leva a um aumento de sua permeabilidade e alteração do fluxo de íons, o que resulta em sua despolarização e rompimento.74 O-benzil-p-clorofenol Outro composto regularizado pela ANVISA e também pelo MSCBS como eficaz no combate ao SARS-CoV-2, é o o-benzil-p-clorofenol.40 Esse derivado fenólico é um biocida de amplo espectro e é utilizado na formulação de saneantes para limpeza doméstica e hospitalar. Embora útil, ele é bastante irritante para os olhos e corrosivo para a pele.75 Quanto a sua atuação, essa também é descrita para outros micro-organismo, principalmente os bacterianos, onde é relatada uma ação sobre membranas: inicialmente ele penetra na membrana, perturbando sua organização, permeabilidade (permitindo que íons e moléculas escapem) e a função de suas proteínas. Nesse caso, ele passa a inibir o transporte de Adenosina Trifosfato (ATP), um nucleotídeo com importante papel no transporte de energia.76 Triclosan O triclosan é um derivado fenólico de origem sintética e que apresenta três átomos de cloro em sua composição. Ele é utilizado como conservante de cosméticos e pode ser encontrado, por exemplo, em cremes dentais, sabonetes e desodorantes. No âmbito científico, o triclosan é relatado como um composto lipofílico com atividade antibacteriana, cuja produção mundial estimada em 2015 foi de aproximadamente 4,8 mil toneladas. No entanto, desde 2017, a União Europeia proibiu a utilização do triclosan em produtos de higiene e a United States Food and Drug Administration (FDA, órgão estadunidense) proibiu sua utilização em sabões no ano de 2016. Em contrapartida, seus usos em cremes dentais, desinfectantes para as mãos e enxaguante bucal ainda são permitidos nos Estados Unidos.77 Aqui, vale ressaltar que a toxicidade do triclosan é ainda controversa. Estudos apontam que seu uso é seguro na concentração utilizada em produtos de higiene pessoal e de limpeza doméstica. Contudo, o uso prolongado dessa substância pode levar a efeitos adversos na saúde. Esse composto pode agir como disruptor endócrino, levar à resistência bacteriana e se acumular em tecidos adiposos. Além disso, ele já foi detectado no sangue e leite de lactantes e em amostras de urina. Vale ressaltar que o triclosan é também um micro-poluente, sendo detectado em diferentes ambientes, incluindo águas superficiais, águas residuais, água potável, solo, estações de tratamento de esgoto e em sedimentos.78 Embora pouco se saiba sobre seu mecanismo de ação antimicrobiana, sugere-se que ele tenha um efeito primário sobre a membrana. Adicionalmente, estudos de cristalografia demonstraram que o triclosan forma um complexo com enzima enoil-ACP redutase da Escherichia coli, indicando que sua atuação pode se dar a partir da inibição da biossíntese de lipídeos.35,36 Cloro e seus derivados Nessa categoria, incluem-se o próprio cloro (Cl2), os hipocloritos de cálcio (Ca(ClO)2) e de sódio (NaClO), o dióxido de cloro (ClO2) e as cloroaminas. No entanto, embora haja uma vasta gama de representantes, são os acessíveis hiplocloritos aqueles que mais se destacam. Enquanto o Ca(ClO)2(s) é comercializado para esterilização de águas industriais e de piscinas, o NaClO(aq) se enquadra como o composto químico essencial de um saneante de uso bastante disseminado: a água sanitária. Isso faz com que ela esteja entre os saneantes mais utilizados, com ação desodorizante, de limpeza e de branqueamento, além de contemplar um amplo espectro antimicrobiano, com comprovada ação virucida.79-81 De baixo custo e fácil utilização, o NaClO(aq) não deixa resíduos tóxicos e apresenta, nas concentrações de uso, uma relativa baixa toxicidade a humanos. Todavia, mesmo em baixas concentrações, ele pode ocasionar queimaduras no sistema digestório e irritações de membranas mucosas e oculares.79 Quando em concentrações mais elevadas, pode causar a corrosão de alguns metais e, quando misturado com amônia ou ácidos, também presentes em produtos de limpeza, podem resultar na liberação de gás cloro tóxico, o Cl2(g).82 Na Equação 1 tem-se o exemplo de uma reação química possível de acontecer ao se misturar a água sanitária e o ácido muriático (ácido clorídrico, HCl comercial), outro produto largamente utilizado como um agente de limpeza:37 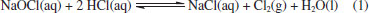 Note que, além da formação de um sal neutro (NaCl) e água, o gás cloro tóxico também é formado como produto nessa reação. Desse modo, embora dois produtos de limpeza sejam potencialmente aplicáveis em separado, seus usos como componentes de uma mesma mistura não são adequados. Como exemplificado, a mistura de um ou mais agentes químicos podem acarretar em reações indesejadas e que levem a sérios acidentes domésticos, como a intoxicação e o sufocamento. Isso ratifica a importância de seguir as instruções disponíveis nos rótulos e não misturar produtos de limpeza doméstica com composições distintas, sem a específica recomendação do fabricante. Industrialmente, o hipoclorito de sódio é preparado borbulhado-se Cl2(g) em uma solução aquosa de hidróxido de sódio, NaOH(aq), conforme representado Equação 2:  Isso faz com que as soluções comerciais de água sanitária, além de íons hipoclorito, contenham íons hidróxidos (OH-) residuais que não foram totalmente consumidos na reação. Adicionalmente, os íons hidróxido podem ser formados a partir da hidrólise do NaClO, conforme Equação 3, representada a seguir: 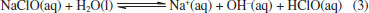 São essas reações, representadas nas Equações 2 e 3, associadas a formação e hidrólise do hipoclorito, respectivamente, que favorecem um pH alcalino (entre 12,5 e 13,5) característico da água sanitária comercial.83 Ainda, os íons hidróxido podem se envolver em reações de saponificação de ácidos graxos e de neutralização de grupos ácidos. Isso favorece as suas participações em processos que envolvam a desnaturação de proteínas, o que também vem a corroborar em uma ação saneante.84 No entanto, embora seja um oxidante forte, a característica iônica da forma ClO- (íon hipoclorito) o prejudica quanto a sua permeabilidade em membranas biológicas, impedindo-o de alcançar componentes mais internos dos micro-organismos alvos. Desse modo, estudos realizados com o ácido hipocloroso (HClO), um produto da hidrólise do hipoclorito (Equação 3) mostraram que este também é um oxidante forte e que apresenta uma significativa atividade antimicrobiana, com poder de atuação cerca de 80 vezes maior que a sua forma ionizada.81 Isso ocorre porque, diferente do hipoclorito, o ácido hipocloroso apresenta uma carga elétrica neutra, o que contribui significativamente para uma maior permeabilidade em sistemas biológicos.80 Embora seja um agente antimicrobiano bastante eficaz,80,81 o ácido hipocloroso é bastante instável, com uma constante de acidez, Ka, igual a 3,5 x 10-8, a 25 °C.85 Assim, como a forma iônica é barata e de fácil obtenção (Equação 2), se torna vantajosa a sua comercialização como solução aquosa. Como o HClO é mais estável em pH menos básico que o da água sanitária comercial (um pH em torno de 8,0), recomenda-se a diluição da água sanitária para que assim ela tenha a sua ação desinfectante potencializada.86 A diluição contribui para diminuir a concentração de íons hidróxido e, ao mesmo tempo, aumentar a concentração de H+ (a fim de manter a constante de ionização da água, Kw).85 Isso auxilia a redução do pH e, consequente, favorece a forma HOCl, como pode ser observado no equilíbrio a seguir (Equação 4):85 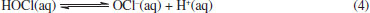 Aqui, temos um demonstrativo de que nem sempre a forma mais concentrada de um produto é a mais eficiente. Há que considerar a existência de reações químicas paralelas, regidas pelo equilíbrio químico, que podem favorecer a formação de um composto mais ativo com uma simples diluição. Embora o HClO seja um biocida mais eficiente que o OCl-,81 devemos considerar que ambos são fortes agentes oxidantes (com base em seus potenciais de redução, E°) e reagem com uma grande variedade de agentes redutores (H2S, Mn (II), Fe (II) e SO32-), com consequente redução do cloro a Cl-, como representado nas Equações 5 e 6:85,87 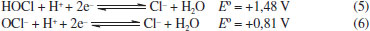 Citocromos, proteínas de ferro-enxofre e nucleotídeos também podem ser oxidados pelo HClO. Os átomos de cloro dos íons hipoclorito (ClO-) e do ácido hipocloroso (HOCl) agem como eletrófilos fortes (Cl+), atacando substratos com elevada densidade eletrônica, como ligações C=C, ligações peptídicas (amidas), grupos aminas e tióis, podendo ainda formar compostos N-clorados.79 Em conjunto, essas reações podem provocar lesões fisiológicas, afetando diferentes processos celulares e, consequentemente, causando a destruição do patógeno. Peróxidos O peróxido de hidrogênio (H2O2) é considerado como um potente agente de atividade biocida. Na natureza, ele curiosamente é encontrado em amostras de méis, cuja atividade antimicrobiana é atribuída, em parte, à presença de H2O2, que junto com ácido glucônico, é formado no processo de oxidação enzimática da glicose.88 Usado desde 1891 como saneante, o H2O2 se decompõe em produtos não tóxicos (H2O e O2) e pode ser utilizado na forma líquida ou gasosa. Isso contribui para que ele seja um dos biocidas mais empregados nos setores de saúde e industrial. Em geral, suas soluções comerciais apresentam uma concentração que varia de 3,0 % a 6,0 % de H2O2, quando para uso como desinfetante e antiséptico, mas que pode variar de 0,5 % a 35 %, a depender da aplicação.37 Com um potencial padrão de redução, E°, de 1,77 V, o H2O2 é um agente oxidante, que isoladamente é pouco eficiente, o que é evidenciado por seu tempo de meia vida relativamente longo, medido em minutos. Contudo, o H2O2 é capaz de atravessar facilmente membranas e interagir com metais de transição, principalmente Cu+ e Fe2+,89 formando espécies mais reativas, como o radical hidroxila (OH•).90 Uma representação de como isso ocorre está evidenciada na Figura 7.
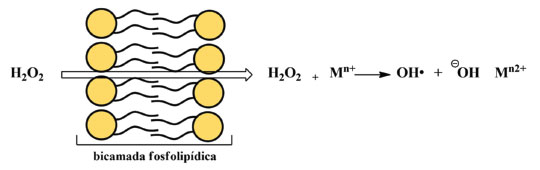 Figura 7. Representação da entrada do peróxido de hidrogênio através da membrana e posterior formação do radical OH•
O radical OH• é a mais reativa espécie de oxigênio, com uma meia vida de 1 ns em sistemas biológicos. Por ser pouco seletivo, reage com diferentes biomoléculas com constantes de velocidade na ordem de 109 a 1010 mol-1 L s-1.91 Essa baixa seletividade reflete na sua capacidade de, por exemplo, oxidar grupos sulfidrilas (-SH) e ácidos graxos polinsaturados das membranas (lipoperoxidação), abstrair átomos de hidrogênio de açúcares, se adicionar à duplas ligações de bases nitrogenadas e reagir com cadeias laterais de aminoácidos e proteínas, em especial com cisteína, histidina, triptofano, metionina e fenilalanina, que o corroboram para que seja um agente antimicrobiano em potencial.38 Com ação bactericida, fungicida e virucida, o ácido peracético (APA, H3CC(=O)OOH) é outro importante agente microbiano da família dos peroxigênios. De ação relativamente rápida, ele mostra atividade mesmo a baixas concentrações (0,0001% a 0,2%) e se decompõe em substâncias não tóxicas e não mutagênicas: água e ácido acético (H3CC(=O)OH), conforme a Equação 7:92 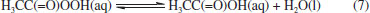 Corrosivo e irritante para olhos, pele e trato respiratório, o APA é formado a partir da reação de ácido acético com peróxido de hidrogênio, utilizando ácido sulfúrico (H2SO4) como catalisador (Equação 8): 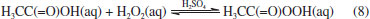 Com uma baixa estabilidade aliada a uma elevada reatividade, ele tende a se decompor nos seus materiais de origem, apresentando risco de explosão quando em concentrações superiores a 15%. Assim, formulações com APA comumente apresentam peróxido de hidrogênio e ácido acético, que contribuem para sua estabilização,79 podendo também apresentar estabilizantes como 8-hidroxiquinolina e pirofosfato de sódio. O APA é um forte agente oxidante (Eº = 1,81 V), e atua de forma similar ao H2O2: oxidando lipídeos, desnaturando proteínas e aumentando a permeabilidade da membrana a partir do rompimento das ligações -SH e -SS, afetando o transporte ativo através das membranas e os níveis de soluto no interior do micro-organismo. É isso que o torna um agente biocida em potencial.93
CONSIDERAÇÕES FINAIS No contexto da pandemia atual, a frequência com que as recomendações de higienização e limpeza alcançam as diferentes populações torna necessário o entendimento dos processos químicos que ocorrem quando os agentes saneantes atuam sobre os micro-organismos, com especial atenção ao vírus SARS-CoV-2, protagonista da atualidade. Esse vírus envelopado, constituído basicamente por biomoléculas de naturezas genômica (RNA), proteica e lipídica, tem causado sérios impactos na saúde e na economia de todos os países por onde se propagou, com reflexo em setores educacionais, turísticos, alimentícios e culturais, por exemplo. Isso ocorre porque uma das formas mais efetivas de contenção da pandemia se dá à partir do isolamento social. Embora o isolamento social seja eficiente, há também a necessidade do emprego concomitante de medidas de sanitização, que são possíveis graças aos agentes químicos específicos capazes de atuar sobre a estrutura viral e erradicar a sua capacidade de infecção. Para entender como isso ocorre, é necessário conhecer a estrutura viral e compreendê-la como uma junção de biomoléculas que podem ter suas estruturas modificadas à partir da ação de um dado agente químico e, assim, perder a sua capacidade de ação biológica. Nesse sentido, destacam-se aqueles que interagem através de forças intermoleculares, como os álcoois, surfactantes e fenóis, com expressivas atuações sobre membranas biológicas, além dos que atuam por reações de oxidação, como os clorados e peróxidos. Mais especificamente, os saneantes apresentados podem provocar o rompimento da membrana externa (bicamada), a desnaturação de proteínas e inativação de sistemas enzimáticos essenciais para a multiplicação do vírus. No entanto, é importante ressaltar que a presença de um dado princípio ativo não é suficiente para garantir a eficácia do saneante utilizado, sendo muito importante sua correta certificação pelos órgãos competentes aliada a uma utilização correta, expressamente como recomendados pelos fabricantes. Com isso, o presente trabalho apresentou os impactos socioeconômicos causados pelo novo coronavírus e como o conhecimento da estrutura viral, sob um ponto de vista químico, pôde auxiliar no entendimento da ação virucida dos saneantes bem como suas especificidades quanto às formas de atuação. Nesse contexto, o presente artigo relata, sob uma vertente interdisciplinar, como é possível unir diferentes frentes de conhecimentos (biológica, química e social, por exemplo) a fim de auxiliar na contenção de uma pandemia em curso, como a enfrentada na atualidade com a COVID-19.
AGRADECIMENTOS Os autores agradecem a todos os pesquisadores que, com maiores ou menores dificuldades, doam diariamente suas contribuições tão necessárias à construção da ciência e à disseminação do conhecimento entre os diferentes povos e nações. Graças as suas contribuições, foi possível sintetizar tudo o que fora exposto nesse trabalho e transmitir, sob um ponto de vista químico inserido em um contexto interdisciplinar, a importância da higienização e da contribuição química dos saneantes nos tempos de pandemia vividos na atualidade. Os autores também agradecem ao IFBA, à UFRPE, à UFMG e a UNILA pelo apoio.
REFERÊNCIAS 1. Hays, J. N. Epidemics and Pandemics: Their Impacts on Human History, 1st ed., ABC Clior: Santa Barbara, 2005. 2. Ujvari, S. C. A História Da Humanidade Contada Pelos Vírus, 2nd ed., Contexto: São Paulo, 2012. 3. Trilla, A.; Trilla, G.; Daer, C.; Clin. Infect. Dis. 2008, 47, 668. 4. Maines, T. R.; Jayaraman, A.; Belser, J. A.; Wadford, D. A.; Pappas, C.; Zeng, H.; Gustin, K. M.; Pearce, M. B.; Viswanathan, K.; Shriver, Z. H.; Raman, R.; Cox, N. J.; Sasisekharan, R.; Katz, J. M.; Tumpey, T. M.; Science 2009, 325, 484. 5. Li, Q.; Guan, X.; Wu, P.; Wang, X.; Zhou, L.; Tong, Y.; Ren, R.; Leung, K. S. M.; Lau, E. H. Y.; Wong, J. Y.; Xing, X.; Xiang, N.; Wu, Y.; Li, C.; Chen, Q.; Li, D.; Liu, T.; Zhao, J.; Liu, M.; Tu, W.; Chen, C.; Jin, L.; Yang, R.; Wang, Q.; Zhou, S.; Wang, R.; Liu, H.; Luo, Y.; Liu, Y.; Shao, G.; Li, H.; Tao, Z.; Yang, Y.; Deng, Z.; Liu, B.; Ma, Z.; Zhang, Y.; Shi, G.; Lam, T. T. Y.; Wu, J. T.; Gao, G. F.; Cowling, B. J.; Yang, B.; Leung, G. M.; Feng, Z.; N. Engl. J. Med. 2020, 382, 1199. 6. Li, J. Y.; You, Z.; Wang, Q.; Zhou, Z. J.; Qiu, Y.; Luo, R.; Ge, X. Y.; Microbes Infect. 2020, 22, 80. 7. https://www.infectologia.org.br/admin/zcloud/125/2020/03/a592fb12637ba55814f12819914fe6ddbc27760f54c56e3c50f35c1507af5d6f.pdf, acessada em Maio 2020 8. https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports/, acessada em Maio 2020. 9. https://coronavirus.saude.gov.br, acessada em Maio 2020. 10. https://ciis.fmrp.usp.br/covid19/exp-br/, acessada em Maio 2020. 11. Lancet (2020), doi: 10.1016/S0140-6736(20)31095-3. 12. https://revistapesquisa.fapesp.br/2020/03/19/para-conter-o-avanco-explosivo/, acessada em Maio 2020. 13. Pan, X.; Ojcius, D. M.; Gao, T.; Li, Z.; Pan, C.; Pan, C.; Microbes Infect. 2020, 22, 86. 14. Anderson, R. M.; Heesterbeek, H.; Klinkenberg, D.; Hollingsworth, T. D.; Lancet 2020, 395, 931. 15. Gandhi, M.; Yokoe, D. S.; Havlir, D. V.; N. Engl. J. Med. (2020), doi:10.1056/NEJMe2009758. 16. https://sbpt.org.br/portal/covid-19-oms/, acessada em Maio 2020. 17. Kampf, G.; Todt, D.; Pfaender, S.; Steinmann, E.; Journal of Hospital Infection 2020, 104, 246. 18. van Doremalen, N.; Bushmaker, T.; Morris, D. H.; Holbrook, M. G.; Gamble, A.; Williamson, B. N.; Tamin, A.; Harcourt, J. L.; Thornburg, N. J.; Gerber, S. I.; Lloyd-Smith, J. O.; de Wit, E.; Munster, V. J.; N. Engl. J. Med. 2020, 382, 1564. 19. https://revistapesquisa.fapesp.br/2020/05/11/uma-doenca-assustadora/, acessada em Maio 2020. 20. Wadman, M.; Couzin-Frankel, J.; Kaiser, J.; Matacic, C.; Science (2020), doi: 10.1126/science.abc3208. 21. Le, T. T.; Andreadakis, Z.; Kumar, A.; Román, R. G.; Tollefsen, S.; Saville, M.; Mayhew, S.; Nature 2020, 19, 305. 22. https://www.who.int/news-room/detail/27-04-2020-who-timeline---covid-19, acessada em Maio 2020. 23. Andersen, K. G.; Rambaut, A.; Lipkin, W. I.; Holmes, E. C.; Garry, R. F.; Nature Medicine 2020, 26, 450. 24. Lau, S. K. P.; Luk, H. K. H.; Wong, A. C. P.; Li, K. S. M.; Zhu, L.; He, Z.; Fung, J.; Chan, T. T. Y.; Fung, K. S. C.; Woo, P. C. Y.; Emerging Infect. Dis. (2020), doi:10.3201/eid2607.200092. 25. Molinaro, E. M.; Caputo, L. F. G.; Amendoeira, M. R. R.; Conceitos e Métodos Para a Formação de Técnicos Em Laboratórios de Saúde, 1st ed., EPSJV: Rio de Janeiro, 2009. 26. Vellingiri, B.; Jayaramayya, K.; Iyer, M.; Narayanasamy, A.; Govindasamy, V.; Giridharan, B.; Ganesan, S.; Venugopal, A.; Venkatesan, D.; Ganesan, H.; Rajagopalan, K.; Rahman, P. K. S. M.; Cho, S. G.; Kumar, N. S.; Subramaniam, M. D.; Sci. Total Environ. (2020), doi: 10.1016/j.scitotenv.2020.138277. 27. Huang, C.; Wang, Y.; Li, X.; Ren, L.; Zhao, J.; Hu, Y.; Zhang, L.; Fan, G.; Xu, J.; Gu, X.; Cheng, Z.; Yu, T.; Xia, J.; Wei, Y.; Wu, W.; Xie, X.; Yin, W.; Liu, M.; Xiao, Y.; Gao, L.; Guo, L.; Xie, J.; Wang, G.; Jiang, R.; Gao, Z.; Jin, Q.; Wang, J.; Cao, B.; Lancet 2020, 395, 497. 28. Richman, D. D.; Whitley, R. J.; Hayden, F. G.; Clinical Virology, 4th ed., ASM Press: Washington, 2017. 29. Wang, H.; Li, X.; Li, T.; Zhang, S.; Wang, L.; Wu, X.; Liu, J.; Eur. J. Clin. Microbiol. Infect. Dis. (2020), doi: 10.1007/s10096-020-03899-4. 30. https://www.health.gov.au/sites/default/files/documents/2020/03/coronavirus-covid-19-environmental-cleaning-and-disinfection-principles-for-health-and-residential-care-facilities.pdf, acesada em Abril 2020. 31. https://www20.anvisa.gov.br/segurancadopaciente/index.php/publicacoes/item/diretrize-as-omshigienizacaomaos-versaoprelim-avancada, acessada em Abril 2020. 32. Vermeil, T.; Peters, A.; Kilpatrick, C.; Pires, D.; Allegranzi, B.; Pittet, D.; Journal of Hospital Infection 2019, 101, 383. 33. Felipe, L. O.; Dias, S. C.; QNEsc. 2017, 39, 228. 34. Lechevallier, M. W.; Au, K.-K. Water treatment and pathogen control, 1st ed., IWA: London, 2004. 35. Stewart, M. J.; Parikh, S.; Xiao, G.; Tonge, P. J.; Kisker, C.; J. Mol. Biol. 1999, 290, 859. 36. McDonnell, G.; Russell, A. D.; Clin. Microbiol. Rev. 1999, 12, 147. 37. https://www.cdc.gov/infectioncontrol/guidelines/disinfection/disinfection-methods/chemical.html, acessada em Abril 2020. 38. Barreiros, A. L. B. S.; David, J. M.; Quim. Nova 2006, 29, 113. 39. Silva, A. A. R.; Passos, R. S.; Simeone, L. A.; Neves, F. A. R.; Carvalho, E.; Jornal de Pediatria 2014, 90, 149. 40. http://portal.anvisa.gov.br/registros-e-autorizacoes/saneantes/produtos/classificacao, acessada em Abril 2020. 41. http://portal.anvisa.gov.br/noticias/-/asset_publisher/FXrpx9qY7FbU/content/saneantes-populacao-deve-usar-produtos-regularizados/219201, acessada em Abril 2020. 42. https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov-China/documentos/Listado_virucidas.pdf, acessada em Abril 2020. 43. https://www.cdc.gov/infectioncontrol/guidelines/disinfection/disinfection-methods/index.html#anchor_1554328072, acessada em Abril 2020. 44. https://www.epa.gov/pesticide-registration/list-n-disinfectants-use-against-sars-cov-2, acessada em Abril 2020. 45. Shek, W. R.; Smith, A. L.; Pritchett-Corning, K. R.; Em Laboratory Animal Medicine; Anderson, L.; Otto, G.; Pritchett-Corning, K.; Whary, M.; eds., Elsevier: Oxford, 2015, cap 11. 46. Rocha, W. R.; Cad. Temáticos QNEsc. 2001, 4, 31. 47. https://jornal.usp.br/wp-content/uploads/2020/03/Guia-produ%C3%A7%C3%A3o-de-gel-antiss%C3%A9ptico-OMS.pdf, acessada em Abril 2020. 48. Buiochi, F.; Furukawa, C. M.; Higuti, R. T.; Silva, E. C. N.; Adamowski, J. C.; Control. Autom. 2003, 14, 330. 49. Kampf, G.; Journal of Hospital Infection 2018, 98, 331. 50. Khattari, Z.; Brotons, G.; Akkawi, M.; Arbely, E.; Arkin, I. T.; Salditt, T.; Biophys. J. 2006, 90, 2038. 51. Ashour, H. M.; Elkhatib, W. F.; Rahman, M. M.; Elshabrawy, H. A.; Pathogens (2020), doi:10.3390/pathogens9030186. 52. Barry, J. A.; Gawrisch, K.; Biochemistry 1994, 33, 8082. 53. Goldstein, D. B.; Annals of Emergency Medicine 1986, 15, 1013. 54. Ingólfsson, H. I.; Andersen, O. S.; Biophys. J. 2011, 101, 847. 55. Rifici, S.; D'Angelo, G.; Crupi, C.; Branca, C.; Nibali, V. C.; Corsaro, C.; Wanderlingh, U.; J. Phys. Chem. B 2016, 120, 1285. 56. Ho, C.; Stubbs, C. D. Biochemistry;1997, 36, 10630. 57. Rabenau, H. F.; Kampf, G.; Cinatl, J.; Doerr, H. W.; J. Hosp. Infect. 2005, 61, 107. 58. Zhang, C.; Cui, F.; Zeng, G.; Jiang, M.; Yang, Z.; Yu, Z.; Zhu, M.; Shen, L.; Sci. Total Environ. 2015, 518-519, 352-362. 59. Jiao, Y.; Niu, L.; Ma, S.; Li, J.; Tay, F. R.; Chen, J.; Prog. Polym. Sci. 2017, 71, 53. 60. Gerba, C. P.; Appl. Environ. Microbiol. 2015, 81, 464. 61. Jennings, M. C.; Minbiole, K. P. C.; Wuest, W. M.; ACS Infect. Dis. 2015, 1, 288. 62. Rutala, W. A.; Weber, D. J.; Am. J. Infect. Control 2019, 47, A3. 63. Tuladhar, E.; Koning, M. C.; Fundeanu, I.; Beumer, R.; Duizer, E.; Appl. Environ. Microbiol. 2012, 78, 2456. 64. https://www.vox.com/science-and-health/2020/3/11/21173187/coronavirus-covid-19-hand-washing-sanitizer-compared-soap-is-dope, acessada em Abril 2020. 65. Daltin, D.; Tensoativos: Química, Propriedades e Aplicações, 1st ed.; Blucher: São Paulo, 2011. 66. Penteado, J. C. P.; Seoud, O. A. E.; Carvalho, L. R. F.; Quim. Nova 2006, 29, 1038 67. Tungmunnithum, D.; Thongboonyou, A.; Pholboon, A.; Yangsabai, A.; Medicines 2018, 5,1. 68. https://www.labour.gov.hk/eng/public/os/C/Disinfectants.pdf, acessada em Maio 2020. 69. DeBono, R.; Laitung, G.; Burns 1997, 23, 182. 70. https://www.who.int/csr/resources/publications/biosafety/BisLabManual3rdwebport.pdf?ua=1, acessada em Abril 2020. 71. Bouarab-Chibane, L.; Forquet, V.; Lantéri, P.; Clément, Y.; Léonard-Akkari, L.; Oulahal, N.; Degraeve, P.; Bordes, C. Front. Microbiol. (2019), doi: 10.3389/fmicb.2019.00829. 72. Springthorpe, V. S.; Sattar, S. A.; Crit. Rev. Environ. Control 1990, 20, 169. 73. Marchese, A.; Orhan, I. E.; Daglia, M.; Barbieri, R.; Di Lorenzo, A.; Nabavi, S. F.; Gortzi, O.; Izadi, M.; Nabavi, S. M.; Food Chem. 2016, 210, 402. 74. Xu, J.; Zhou, F.; Ji, B.-P.; Pei, R.-S.; Xu, N. Lett. Appl. Microbiol. 2008, 47, 174. 75. Stouten, H.; Bessems, J. G. M.; J. Appl. Toxicol. 1998, 18, 271. 76. https://echa.europa.eu/documents/10162/06b44bac-d140-b256-5c6c-c1f295f084b4, acessada em Maio 2020. 77. Weatherly, L. M.; Gosse, J. A.; J. Toxicol. Environ. Health, Part B. 2017, 20, 447. 78. Olaniyan, L. W. B.; Mkwetshana, N.; Okoh, A. I.; Springerplus 2016, 5, 1. 79. Fu, E.; McCue, K.; Boesenberg, D. Em Handbook for Cleaning/Decontamination of Surfaces; Johansson, I.; Somasundaran, P. eds. ScienceDirect: Oxford, 2007, cap. F-1. 80. Tortora, G. J.; Funke, B. R.; Case, C. L.; Microbiologia, 12th ed.; Artmed: São Paulo, 2016. 81. Nuvolari, A.; Esgoto Sanitário: Coleta, Transporte, Tratamento e Reúso Agrícola, 2nd ed.; Blucher: São Paulo, 2011. 82. https://cloud.cnpgc.embrapa.br/wp-content/igu/fispq/laboratorios/Ácido_muritico.pdf, acessada em Abril 2020. 83. Fukuzaki, S.; Biocontrol Sci. 2006, 1, 147. 84. Estrela, C.; Estrela, C. R. A.; Barbin, E. L.; Spanó, J. C. E.; Marchesan, M. A.; Pécora, J. D.; Braz. Dent. J. 2002, 13, 113. 85. Kotz, J. C.; Treichel, P. M.; Townsend, J. R.; Treichel, D. A.; Química Geral e Reações Químicas 2, 3rd ed.; Cengage Learning: São Paulo, 2016. 86. http://cfq.org.br/wp-content/uploads/2020/03/Review_água_sanitária-versão-23_03_-2020-versão_3.pdf, acessada em Abril 2020. 87. https://www.who.int/ipcs/publications/ehc/ehc_216/en/, acessada em Maio 2020. 88. Poli, J.-P.; Guinoiseau, E.; Luciani, A.; Yang, Y.; Battesti, M.-J.; Paolini, J.; Costa, J.; Quilichini, Y.; Berti, L.; Lorenzi, V.; Lett. Appl. Microbiol. 2018, 66, 427. 89. Chaturvedi, U. C.; Shrivastava, R.; FEMS Immunol. Med. Microbiol. 2005, 43, 105. 90. Linley, E.; Denyer, S. P.; McDonnell, G.; Simons, C.; Maillard, J. Y.; J. Antimicrob. Chemother. 2012, 67, 1589. 91. Kehrer, J. P.; Robertison, J. D.; Smith, C. V.; Em Comprehensive Toxicology; McQueen, C. A. ed.; Elsevier: Oxford, 2010, vol. 1., cap. 14. 92. Costa, S. A. S.; Paula, O. F. P.; Silva, C. R. G.; Leão, M. V. P.; Santos, S. S. F.; Brazilian Oral Research 2015, 29, 1. 93. Cavallini, G. S.; Campos, S. X. de; Souza, J. B. de; Vidal, C. M.; Semina: Cienc. Exatas Tecnol. 2012, 33, 27. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access