Revisão
|
|
| N-nitrosaminas em medicamentos: um problema atual, uma realidade antiga N-nitrosamines in pharmaceuticals: a current problem, an old reality |
|
Tharcilla de Castro AglioI; Vinicíus DinizI; Maria Fernanda Araujo Vieira MatosI; Paulo Pires Cesar RosaII; Susanne RathI,*
I. Departamento de Química Analítica, Instituto de Química, Universidade Estadual de Campinas, 13084-971 Campinas - SP, Brasil Recebido em: 10/01/2022 *e-mail: rath@unicamp.br The presence of N-nitrosamines - potentially carcinogenic compounds - is being reported for more than 50 years in pharmaceutical products. However, it only gained notorious prominence in 2018, when regulatory agencies became aware of the presence of N-nitrosodimethylamine in angiotensin II receptor antagonists, drugs that are known as sartans. It did not take long for N-nitrosamine impurities to be identified in other medicines, alerting government agencies and pharmaceutical industries to evaluate and control these impurities in their products to mitigate the risk. The sources of contamination can be numerous, including the use of contaminated raw material, formation in the synthesis of active pharmaceutical ingredients or during storage, the water used in the process, and the packaging material. This review article presents the timeline of the presence of N-nitrosamines in consuming products, toxicological aspects, legislation, and analytical methods. It provides relevant information on possible sources of contamination in the production and storage process that may explain the presence of these compounds considered a cohort of concern in pharmaceuticals. INTRODUÇÃO O conhecimento da presença de N-nitrosaminas em produtos de consumo humano é de longa data e tem preocupado cientistas ao redor do mundo por décadas por suas propriedades mutagênicas, genotóxicas e potencialmente carcinogênicas observadas em uma variedade de animais de laboratório, incluindo primatas.1-3 A Agência Internacional de Pesquisa sobre o Câncer (IARC) classifica boa parte das N-nitrosaminas como prováveis agentes carcinógenos para humanos.3,4 A possível contaminação de alimentos, medicamentos e cosméticos por N-nitrosaminas parecia estar sob controle, uma vez que as principais fontes de contaminação eram majoritariamente conhecidas e, tanto as indústrias alimentícias, farmacêuticas, como as cosméticas já haviam implementado ações para mitigar a contaminação de seus produtos. Algumas das adaptações dos processos de fabricação incluem a substituição de compostos nitrosáveis por análogos mais seguros e evitar o uso concomitante de agentes nitrosantes. Mais recentemente, ou mais precisamente em 2018, um episódio, a nível mundial, revelou uma falha no controle de impurezas na indústria farmacêutica que resultou na presença de compostos potencialmente tóxicos. N-nitrosaminas foram detectadas como impurezas em vários medicamentos, incluindo os antagonistas de receptor de angiotensina II, conhecidas como "sartanas", que são amplamente empregados para tratar a pressão arterial e no hipoglicemiante metformina indicado para o tratamento de diabetes mellitus tipo 2. Conforme classificação do Guia ICH M75 sobre "Avaliação e controle de impurezas reativas ao DNA em produtos farmacêuticos com o objetivo de limitar o risco carcinogênico" as N-nitrosaminas são consideradas "Grupo de Preocupação" (cohort of concern). No Brasil, alguns medicamentos chegaram a ser recolhidos ou tiveram sua fabricação suspensa pela Agência Nacional de Vigilância Sanitária (ANVISA). Atualmente, a Agência recomenda que as empresas farmacêuticas revisem os processos de síntese e controlem os insumos quanto a presença de N-nitrosaminas. Essas ações da ANVISA estão alinhadas com agências internacionais, como a Agência Europeia de Medicamentos (EMA, European Medicines Agency) e a Agência de Medicamentos e Alimentos dos Estados Unidos da América (FDA, Food and Drug Administration). Nesse cenário, ainda existem muitos questionamentos em relação às fontes ou processos que contribuem para a presença de N-nitrosaminas em medicamentos. Devem ser consideradas de extrema importância investigações em todos os processos unitários, desde o insumo farmacêutico ativo, solventes, excipientes, embalagem, e até mesmo uma possível formação durante a estocagem. A presente revisão tem como objetivo trazer informações relevantes sobre a origem e presença de N-nitrosaminas em medicamentos, assim como os limites aceitáveis, aspectos de legislação e métodos analíticos.
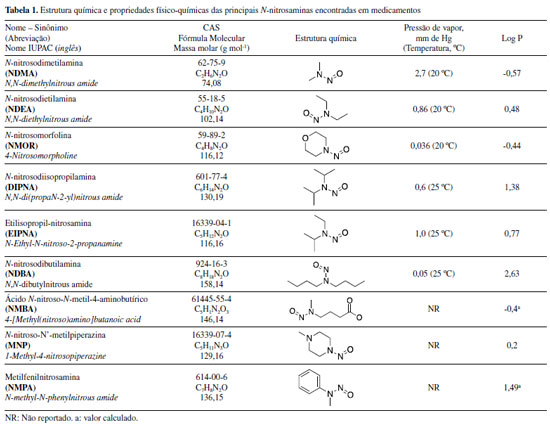
HISTÓRICO As N-nitrosaminas são compostos N-nitrosos que apresentam um grupo funcional nitroso ligado a um átomo de nitrogênio. A constatação da formação e/ou contaminação de medicamentos por N-nitrosaminas data da segunda metade do século passado: em 1972, Lijinsky et al.6 relataram a possível formação de N-nitrosaminas in vivo pela ingestão de alimentos ricos em nitrito (agente nitrosante) com insumos farmacêuticos ativos (IFA) contendo aminas terciárias em suas estruturas. Ainda, os autores investigaram a formação in vitro de N-nitrosaminas em medicamentos. Para tanto, incubaram vários IFA com nitrito de sódio em condições fisiológicas (37 °C, pH de 3,5 a 5,5) e determinaram a concentração de N-nitrosaminas no meio reacional. Dentre os IFA avaliados, a aminofenazona e a oxitetraciclina foram as mais reativas, produzindo 73% e 65% de N-nitrosodimetilamina (NDMA), respectivamente. Lijinsky7 aprofundou seus estudos sobre as reações de nitrosação de IFA, usando o ácido nitroso em vez do nitrito de sódio e concentrações menores dos IFA (de 0,25 mg mL-1 a 40 mg mL-1) no meio reacional do que no trabalho anterior (de 20 mg mL-1 a 160 mg mL-1). Os IFA avaliados foram aminofenazona, clorfeniramina, metapirileno, clorpromazina, dextropropoxifeno, tolazamida, quinacrina, lucantona, ciclizina, dissulfiram e metadona, sendo que, assim como observado anteriormente, a aminofenazona foi a que gerou o maior percentual de NDMA (cerca de 40%, Tabela 1S).7 Embora a concentração observada de N-nitrosaminas formadas a partir de IFA ter sido pequena, os autores enfatizaram sobre o risco uma vez que muitos destes medicamentos são consumidos de forma crônica pela maioria dos pacientes, podendo gerar N-nitrosaminas pela ingestão concomitante de alimentos ricos em nitritos e, em casos graves, levar ao desenvolvimento de câncer no estômago.6,7 Essa descoberta criou um alerta e uma preocupação inédita quanto ao risco decorrente da nitrosação de medicamentos in vivo. LaBar e Sander8 confirmaram essa hipótese quando verificaram a presença de NDMA na urina de ratos que receberam por via oral o analgésico amidopirina e nitrito e estimaram em 30% a extensão da nitrosação in vivo. Alguns anos mais tarde, Eisenbrand e colaboradores (1979)9 identificaram a presença de NDMA em 68 medicamentos contendo aminofenazona e notaram que 50% das amostras analisadas apresentaram concentrações de NDMA entre 1 10 mg kg-1, 40% entre 11-50 mg kg-1, 7% entre 51 100 mg kg-1 e 1,5% na concentração de 370 mg kg-1 de NDMA. A análise de medicamentos anti-histamínicos contendo difenidramina, doxilamina e metapirileno também revelou a presença de NDMA e N-nitrosodietilamina (NDEA)10 em concentrações de 0,22 a 3,6 µg kg-1 e 0,35 a 2,7 µg kg-1, respectivamente. Em 1981, a presença de NDMA e NDEA também foi detectada em formulações de medicamentos contendo aminofenazona, oxitetraciclina, e dissulfiram.11 De 37 amostras de medicamentos contendo aminofenazona, NDMA foi detectada em níveis variando de 1 a 900 µg kg-1, e em nove medicamentos que continham oxitetraciclina na formulação, foi detectado NDMA em concentrações de até 7 µg kg-1. Os medicamentos contendo dissulfiram apresentaram teores de NDEA em concentrações na faixa de 94 a 980 µg kg-1. Em adição à contaminação inerente do medicamento por N-nitrosaminas, o paciente também pode ser exposto a essas substâncias após a reação de nitrosação do IFA in vivo. Foi reportado um aumento na concentração de NDMA e N-nitrosopiperidina (NPIP) na urina de voluntários tratados com oxitetraciclina12 ou piperazina,13 respectivamente. No caso da piperazina, a excreção de NPIP na urina de cinco voluntários que receberam uma dieta normal foi de 9,2 a 80,1 µg em 24 h. No entanto, quando a dieta foi suplementada com 250 mg de nitrato, o teor de NPIP excretado em 24 h foi de 25,7 a 163,7 µg, confirmando a hipótese da nitrosação in vivo.14 Em 1984, Sakai et al.15 avaliaram a formação de N-nitrosaminas em medicamentos em condições fisiológicas utilizando o nitrito como agente nitrosante. Os IFA na concentração de 10 mmol L-1 foram incubados com nitrito (40 mmol L-1) em pH 3,0 a 27 ºC por 1 e 4 horas. Em 24 dos 28 medicamentos avaliados, foi identificada a presença de NDMA, NDEA, N-nitrosodipropilamina (NDPA), N-nitrosoeptametilenoimina (NHPI), N-nitrosoexametilenoimina (NHXI), N-nitroso-N'-metilpiperazina (NMP), N-nitrosopiperidina (NPIP) e N-nitrosopirrolidina (NPYR). Os autores também verificaram que o ácido ascórbico, na concentração de 40 mmol L-1, inibe a formação de N-nitrosaminas nos meios avaliados em 88 a 100%. O ácido ascórbico, α-tocoferol, polifenois, entre outros, são reconhecidos como scavengers de nitrito e, consequentemente, inibidores da reação de nitrosação.16 Um ano depois, Akintonwa17 avaliou IFA que contêm aminas secundárias (cloroquina, primaquina e fenacetina) e terciárias (clorpromazina, metadona) em sua estrutura e apresentou possíveis mecanismos de formação de N-nitrosaminas no trato gastrointestinal humano. O autor reportou que a ingestão de medicamentos contendo esses IFA podia levar à formação de N-nitrosaminas in vivo, considerando como agente nitrosante o anidrido nitroso formado a partir de nitritos e nitratos presentes na dieta (água, produtos cárneos curados, peixe curado e vegetais). A flora bacteriana do trato intestinal e bexiga podem reduzir o nitrato a nitrito, sendo mediado pela nitrato-redutase. Finalmente, o nitrito é protonado formando ácido nitroso e anidrido nitroso (Equações 1 a 3). 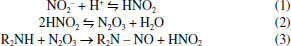 Nesse cenário, o anidrido nitroso atua como espécie nitrosante e a reação com a amina leva a formação da N-nitrosamina. A metadona leva a formação de NDMA, e a clorpromazina e cloroquina levam a formação de NDEA. As aminas terciárias podem ser biotransformadas em aminas secundárias por reações de fase I (oxidação, hidrólise e redução), geralmente envolvendo monooxigenases, NADPH e oxigênio. Ademais, as aminas terciárias podem sofrer reações de conjugação mediadas pela glutationa-S-transferase durante a fase II do sistema de metabolização. Após serem previamente metabolizadas à aminas secundárias, essas moléculas podem ser nitrosadas pelo anidrido nitroso no organismo levando a formação das N-nitrosaminas correspondentes. No entanto, outros componentes da formulação de medicamentos podem ser responsáveis pela geração de N-nitrosaminas. Dawson e Lawrence18 reportaram em 1987 a contaminação de medicamentos comercializados no Canadá por N-nitrosaminas. Dos 34 medicamentos analisados, 21 estavam contaminados com NDMA e NDEA em concentrações de até 12 µg kg-1 e 0,6 µg kg-1, respectivamente. Na maioria dos casos, os IFA dos medicamentos não continham em sua estrutura os precursores para justificar a presença das N-nitrosaminas determinadas. De acordo com os autores, é provável que as N-nitrosaminas tenham sido formadas a partir dos excipientes e, também, possam ter sido carreadas pela água e/ou de solventes usados no processo de fabricação. Os medicamentos avaliados nesse estudo continham os IFA amitriptilina, cloranfenicol, clorpromazina, dimenidrinato, eritromicina, imipramina, promazina, propoxifeno, trimipramina e tetraciclina. Já em 1994, Atawodi e Spiegelhalder19 verificaram que preparações medicinais com plantas tropicais de origem nigeriana continham níveis variados de aminas primárias e secundárias e, em menor concentração, também nitratos e nitritos. Diante da descoberta e, uma vez que o uso generalizado de preparações de plantas medicinais para fins terapêuticos e profiláticos poderia expor a população à compostos N-nitrosos formados endogenamente, os mesmos autores, no ano seguinte, investigaram a possível formação de N-nitrosaminas voláteis expondo as preparações medicinais em uma solução que simula as condições gástricas.20 A NDMA foi formada em 31% das amostras testadas, com concentrações que variaram de 7,1 µg kg-1 a 57,5 µg kg-1, enquanto a presença de NDEA foi observada em apenas em 7% das formulações avaliadas em níveis de 23,3 µg kg-1 a 26,6 µg kg-1 (Tabela 2S). Em meados de 2002, no Japão, 12 pessoas apresentaram lesões hepáticas graves que foram associadas ao consumo de suplementos dietéticos de ervas chinesas nos quais foram detectadas a presença da substância sintética N-nitrosofenfluramina. A fenfluramina era prescrita para tratamento de obesidade, mas foi suspensa do uso clínico por causar complicações cardíacas. Embora não tenha sido explicada a presença da N-nitrosofenfluramina, os pesquisadores sugeriram que ela tinha sido adicionada pelos fabricantes para aumentar o efeito de perda de peso ou para mascarar a presença de fenfluramina.21 Mais recentemente, em julho de 2018, a possível contaminação de medicamentos por N-nitrosaminas voltou a ser uma preocupação de saúde pública quando a EMA foi notificada de que o fabricante Zhejiang Huahai Pharmaceutical havia detectado NDMA em seu IFA valsartana. Essa notificação ocasionou o recolhimento deste medicamento nos países membros da União Europeia. Em sequência, vários estudos confirmaram que a presença de N-nitrosaminas não estava limitada aos medicamentos contendo o IFA valsartana, mas também foram identificadas em outros IFA da classe das "sartanas", como a losartana e a ibersartana.22 Em janeiro de 2019, o Hetero Labs, localizado na Índia, informou às autoridades da União Europeia e a Direção Europeia para a Qualidade dos Medicamentos e Cuidados de Saúde (EDQM, European Directorate for the Quality of Medicines & HealthCare) que havia identificado a impureza NDMA em alguns dos seus lotes do IFA pioglitazona, usado em medicamentos destinados ao tratamento da diabetes. O laboratório observou que 15 dos 161 lotes de pioglitazona apresentavam níveis de NDMA entre 0,65 mg kg-1 e 1,5 mg kg-1 (limite de quantificação do método de 0,63 mg kg-1). Embora essas concentrações estivessem abaixo do limite provisório aceitável de 1,9 mg kg-1 (em "sartanas") e nenhum recolhimento dos medicamentos no mercado fosse necessário, a presença de uma N-nitrosamina em um IFA não pertencente a classes das "sartanas" foi um alerta importante do ponto de vista regulatório.23 Após esses episódios, N-nitrosaminas foram detectadas em níveis preocupantes em medicamentos contendo IFA pertencentes tanto à classe das "sartanas" quanto em outros medicamentos, o que desencadeou o recolhimento de centenas de lotes de medicamentos do mercado em nível mundial.24 Dentre as N-nitrosaminas detectadas, destacam-se a NDMA, NDEA, N-nitroso-diisopropilamina (DIPNA), etilisopropil-nitrosamina (EIPNA), ácido N-nitroso-N-metil-4-aminobutírico (NMBA), N-nitroso-N'-metilpiperazina (MNP) e metilfelinnitrosamina (NMPA). As estruturas químicas dessas N-nitrosaminas e algumas de suas propriedades físico-químicas estão apresentadas na Tabela 1.25
Só nos Estados Unidos, mais de 1.400 lotes de produtos foram recolhidos do mercado nos últimos dois anos devido à presença de N-nitrosaminas acima de seu limite diário aceitável. Incluem-se nessa lista, medicamentos contendo os IFA valsartana, irbesartana, losartana, metformina, ranitidina e nizatidina (Figura 1).
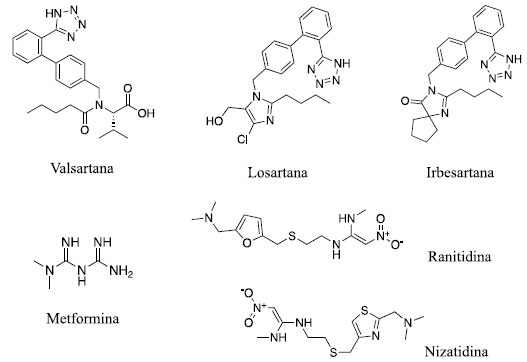 Figura 1. Estruturas químicas de insumos farmacêuticos ativos (IFA) em medicamentos que apresentaram N-nitrosaminas
Nos últimos anos, diversos IFA foram sendo alvos de estudo por serem considerados possíveis precursores da NDMA, dentre eles: aminopiramina, amitriptilina, azitromicina, cloreto de benzalcônio, carbinozamina, cloranfenicol, clorfenamina, clorpromazina, clorprotixeno, clortetraciclina, citalopram, claritromicina, clomipramina, dimenidrinato, diltiazem, difenidramina, doxepina, doxilamina, erotrimicina, escitalopram, imipramina, meropenem, metformina, metapirileno, mifepristona, minocilina, nizatidina, oleandomicina, oxitetraciclina, piramidon, promazina, propoxifeno, quinupristina, ranitidina, roxitromicina, espiramicina, sumatriptano, trimipramina, tetraciclina, tramadol e venlafaxina.26 Em julho de 2019, a FDA e a EMA verificaram a presença de NDMA nos medicamentos ranitidina e nizatidina. Estes fármacos são inibidores dos receptores de H2 e são amplamente utilizados no tratamento de acidez estomacal e úlceras gástricas.27,28 As ações regulatórias adotadas frente a estas descobertas variaram ao redor do mundo. Como medidas mais conservadoras, agências governamentais da Suíça (Swiss Medic) e do Canadá (Health Canada) decidiram recolher e/ou suspender todos os medicamentos à base de ranitidina disponíveis no mercado até que fossem realizadas as análises quanto à presença de NDMA nestes lotes.29,30 A EMA iniciou uma investigação para avaliar se os pacientes que fazem uso de ranitidina corriam algum risco devido a presença de NDMA nesses medicamentos.31 Em contrapartida, a FDA solicitou apenas o recolhimento dos lotes que apresentaram concentrações de NDMA acima dos níveis considerados aceitáveis. Muitas empresas iniciaram recolhimentos voluntários de seus produtos de ranitidina como medidas preventivas.32 Os laboratórios do Departamento de Saúde da Austrália (TGA, Therapeutic Goods Administration) avaliaram um total de 135 lotes de medicamentos contendo ranitidina comercializados no país.33 Foram analisadas diferentes dosagens em diversas formas farmacêuticas, como comprimidos, ampolas, xaropes e comprimidos efervescentes. As amostras de comprimidos, incluindo comprimidos efervescentes, foram as que apresentaram maiores concentrações de NDMA em relação à quantidade de IFA presente, em concentrações < 0,1 mg kg-1 à 14 mg kg-1. No caso do xarope, os resultados ficaram entre 1,0 mg kg-1 e 3,2 mg kg-1. Já para as ampolas, as concentrações foram menores, com resultados menores que 0,1 mg kg-1 a 0,3 mg kg-1. Todos os medicamentos que apresentaram contaminação com NDMA superiores a 0,3 mg kg-1 foram retirados do mercado. Em dezembro de 2019, a FDA tomou conhecimento de que alguns lotes de medicamentos contendo metformina apresentaram NDMA, todavia, em concentrações inferiores as preconizadas para seu recolhimento.34 No início de 2020, a NDMA foi encontrada em alguns lotes de metformina comercializados na Europa.22 Como medida preventiva, a EMA solicitou que todos os fabricantes realizassem o controle de qualidade de seus medicamentos quanto à presença de N-nitrosaminas antes de serem disponibilizados no mercado. Em meados de 2020, a FDA iniciou uma investigação a respeito da presença de 1-metil-4-nitrosopiperazina (MNP) e 1-ciclopentil-4-nitrosopiperazina (CPNP) em amostras comercializadas dos antibióticos rifampicina e rifapentina, respectivamente (Esquema 1).
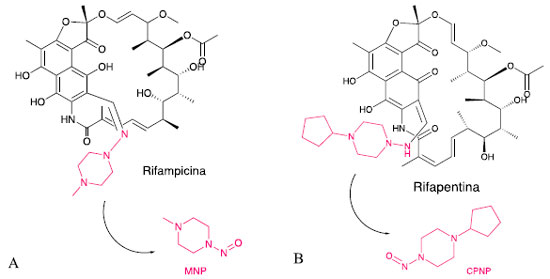 Esquema 1. Estruturas químicas da rifampicina e 1-metil-4-nitrosopiperazina (MPN) (A) e rifapentina e 1-ciclopentil-4-nitrosopiperazina (CPNP) (B)
Esses medicamentos são utilizados para o tratamento da tuberculose e a rifampicina também é indicada para o tratamento de infecções bacterianas graves. Foram analisadas amostras de medicamentos contendo rifampicina de 11 diferentes empresas de vários lotes (totalizando 38 amostras). As concentrações de MPN variaram de 0,80 a 3,47 mg kg-1. Ainda foram analisados três lotes de medicamentos contendo rifapentina de uma mesma empresa e as concentrações de CPNP variaram de 8,10 a 14,18 mg kg-1.35 As autoridades regulatórias da União Europeia também realizaram uma avaliação de alguns lotes de rifampicina comercializados na Europa. De acordo com a EMA, o risco para os pacientes de não tomarem esse medicamento supera qualquer risco potencial relacionado à MNP, e a agência orientou que os profissionais de saúde deveriam, portanto, continuar a prescrever rifampicina normalmente de acordo com a informação do produto.36 Recentemente foi detectada a presença da N-nitroso-vareniclina (NNV) como impureza acima dos níveis aceitáveis em um medicamento antitabagismo contendo o tartarato de vareniclina produzido pela Pfizer. Houve um recall e pausa global na distribuição do medicamento a partir de junho de 2021.37 Segundo a FDA, a impureza na vareniclina recolhida fornece um risco acima dos aceitáveis para os pacientes.37 Outras agências, como a EMA e a TGA, além da FDA, estão sugerindo que os profissionais da saúde recomendem outras opções de tratamento disponíveis para os pacientes que fazem uso desse medicamento.
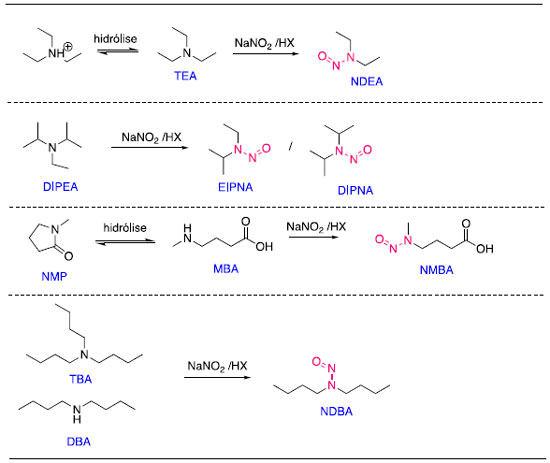
FONTES DE N-NITROSAMINAS NOS MEDICAMENTOS Cientistas ao redor do mundo tem evidenciado esforços para investigar e explicar a presença de N-nitrosaminas em medicamentos e identificar as possíveis fontes dessa contaminação. De um modo geral, nitrito de sódio e aminas secundárias ou terciárias são percursores chave para a geração de N-nitrosaminas.6,7,38 Esses precursores ou mesmo N-nitrosaminas podem estar presentes em solventes, reagentes, catalisadores, água, matérias primas, embalagens e outros, assim como também podem ser formadas durante o processo de fabricação do medicamento ou mesmo durante o armazenamento.38 Água A NDMA tem sido encontrada em águas com um subproduto de processos industriais e como contaminante de alguns agrotóxicos, como o bromacil, 2,4-D, dicamba e mecoprop.39 Os processos industriais que mais contribuem para a liberação de N-nitrosaminas em seus efluentes são os de curtimento de couro, fabricação de borrachas, processamento de alimentos, cosméticos e corantes. A NDMA pode ser também formada nas estações de tratamento de esgoto a partir de reações de alquilaminas com nitratos e/ou nitritos.40 A NDMA pode ser formada no processo de desinfecção de águas com monocloroamina (NH2Cl), dicloroamina (NHCl2) ou hipoclorito.41,42 O mecanismo de formação de N-nitrosaminas a partir de cloroaminas ainda não foi totalmente elucidado, mas existem evidências que a diminuição de dicloroaminas no processo reduz a formação de N-nitrosaminas.43 Uma das fontes de aminas em águas superficiais e, mais especificamente, a dimetilamina, é proveniente do setor agropecuário. Dimetilamina tem sido encontrada em fezes de bovinos,44 que uma vez depositadas em solos podem lixiviar para a água superficial. Outras fontes de aminas nitrosáveis são compostos que tem um grupo -CH2-arila na estrutura (e.g., furfuril), compostos tais quais têm sido identificados com alto potencial de formação de NDMA. Nesse grupo se inclui o IFA ranitidina. Outros 20 fármacos foram identificados como compostos precursores da formação de N-nitrosaminas: amitriptilina, azitromicina, carbinoxamida, clorfenamina, claritromicina, DEET, diltiazem, difenidramina, doxilamina, eritromicina, escitalopram, lidocaína, metformina, nizatadina, ranitidina, roxitromicina, sumatriptan, tetraciclina, tramadol, e venlafaxina.45 A contaminação de águas superficiais por esses IFA pode ocorrer pelo lançamento de efluentes de esgoto doméstico ou industrial nos quais os processos de tratamento não tenham sido capazes de remover de forma eficiente esses IFA. A NDMA também pode ser um subproduto formado a partir do uso de colunas aniônicas ou de polímeros de amônio quaternário como coagulantes nos processos de tratamento de água.42,46 Em adição, processos de ozonização também podem contribuir para a geração de N-nitrosaminas. Durante a ozonização, dimetilaminas ou amônia na presença de brometo podem formar oxidantes bromo-nitrogenados. Eles podem reagir com dimetilaminas, levando à formação de dimetilhidrazinas, que na presença de ozônio podem levar à formação de N-nitrosaminas.47 A remediação e mitigação de N-nitrosaminas em água pode ser alcançada pela destruição das N-nitrosaminas presentes (e.g., radiação UV, UV/ozônio, ozônio/peróxido de hidrogênio, UV/peroxodisulfato),48-50 remoção física (e.g., filtração sob materiais adsorventes), ou por medidas de prevenção da sua formação.42 Indubitavelmente, não existe uma estratégia única ou melhor solução global, porque a presença de precursores da formação de N-nitrosaminas varia em função das condições ambientais e dos dejetos. As diretrizes para qualidade de água da Organização Mundial da Saúde (OMS) definem um limite máximo de NDMA em água potável de 0,1 µg L-1.39 No entanto, vale ressaltar que alguns países estabelecem seus próprios limites seguros. Por exemplo, o Ministério da Saúde da Alemanha (BGA, Bundesgesundsheitsamt) estabelece um valor máximo de 0,01 µg L-1 de NDMA na água potável, equivalente a uma ordem de magnitude menor do que o recomendado pela OMS. Excipientes Os nitratos e nitritos podem ser encontrados em muitos excipientes usados em medicamentos em níveis de partes por milhão (ppm). Glicolato de amido sódico, croscarmelose sódica, amido pré-gelatinizado, povidona, crospovidona e lactose são exemplos de excipientes que podem conter níveis residuais de nitrato e/ou nitrito.51 Compostos farmacêuticos contendo nitrogênio têm o potencial de formar compostos N-nitrosos provenientes das interações fármaco-excipientes durante o processo de produção e/ou durante o tempo de prateleira (validade do medicamento).51 De acordo com a EMA, até o segundo semestre de 2020, não havia relatos sobre a formação de N-nitrosaminas em medicamentos atribuídos a este tipo de interação. O órgão ressalta, porém, que essa fonte de contaminação potencial ainda não poderia ser descartada.23 Em 2021, foram recebidos pela FDA relatórios adicionais onde constam a presença de N-nitrosaminas formadas em diversos medicamentos pela nitrosação do IFA. Tais N-nitrosaminas são identificadas como impurezas de N-nitrosaminas relacionadas ao IFA e denominadas de NDSRI (nitrosamine drug substance-related impurities). As NDSRI podem ser formadas durante o processo de fabricação do medicamento ou durante a vida de prateleira do produto. A principal fonte deste tipo de impureza tem sido atribuída à presença de nitrito nos excipientes. A FDA recomenda que os fabricantes verifiquem a presença de N-nitrosaminas, incluindo os NDSRI, usando estratégias de mitigação segundo orientações desta Agência.52 Solventes, reagentes e catalisadores Solventes empregados na síntese de IFA podem ser uma fonte importante da contaminação de medicamentos por N-nitrosaminas. Foi constatado que alguns solventes com grupos funcionais amida em suas estruturas podem sofrer degradação sob certas condições e formar aminas secundárias. Um exemplo é o uso de N,N-dimetilformamida (DMF) que pode sofrer hidrólise ou degradação térmica e formar a dimetilamina, que por sua vez reage com nitrito de sódio em meio ácido, levando à formação de NDMA (Esquema 2).38
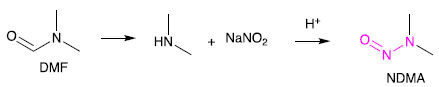 Esquema 2. Degradação da dimetilformamida (DMF) formando N-nitrosodimetilamina (NDMA)
Do mesmo modo, a N-metilpirrolidona também pode sofrer hidrólise ou degradação térmica, formando o ácido aminobutírico que pode ser nitrosado e levar à formação da NMBA (Esquema 3).
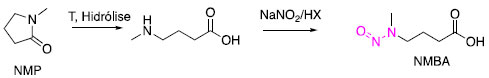 Esquema 3. Degradação da N-metilpirrolidona (NMP)
Outros solventes que podem formar aminas secundárias por rotas similares apresentadas nos Esquemas 2 e 3 são a N,N dimetilacetamida e N,N-dietilacetamida.32 Em alguns casos, a geração de N-nitrosaminas pode ocorrer durante a própria produção do solvente, quando se faz uso de aminas como reagentes. Um exemplo é a dimetilacetamida produzida em escala industrial pela reação da dimetilamina com ácido acético, anidrido acético ou ésteres do acetato, que podem conter impurezas de dimetilamina.53 A trietilamina também é amplamente empregada na síntese de IFA. Esse solvente pode apresentar impurezas como a dimetilamina e/ou N-nitrosaminas. Existem vários relatos na literatura sobre contaminações de solventes com NDMA e NDEA.54,55 Aminas secundárias e terciárias também têm sido detectadas em tolueno, o-xileno e diclorometano32 e a FDA identificou que esses solventes tinham sido contaminados durante a transferência entre recipientes de armazenamento. Algumas rotas adicionais que contribuem na formação de N-nitrosaminas estão apresentadas no Esquema 4.
Uma outra possível fonte de contaminação é durante a recuperação de solventes, reagentes e catalisadores. Alguns processos de recuperação de solventes usam reagentes para decomposição de outros, como o caso do emprego de ácido nitroso para destruição de azidas residuais.32 Síntese dos insumos farmacêuticos ativos A avaliação do processo da síntese como contribuinte da formação de N-nitrosaminas teve início com as "sartanas", mais especificamente a valsartana e com foco na formação do anel tetrazol.56,57 A valsartana é produzida por diferentes laboratórios que empregam rotas sintéticas distintas. Na rota de síntese do IFA desenvolvido pela Novartis,58 empresa detentora da patente da valsartana, a formação do anel tetrazol (Esquema 5) é obtida pela reação do intermediário nitrilo (1) com a azida de tributilestanho (2). Por sua vez, o éster contendo o anel tetrazol (3) é hidrolisado levando a formação da valsartana.59-61 Essa rota sintética é semelhante às adotadas pelo laboratório Dr. Reddys e a abordagem adotada por Wang et al.62
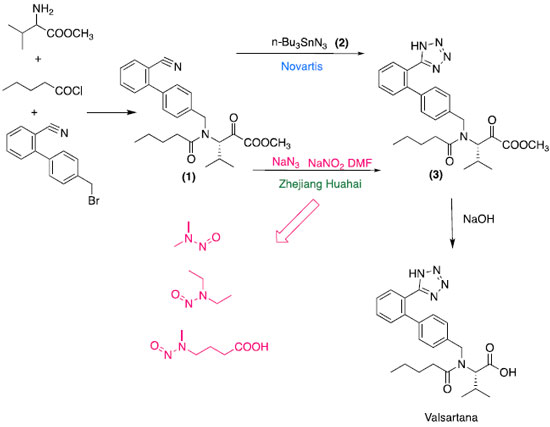 Esquema 5. Fonte de N-nitrosaminas na valsartana: Rota sintética da valsartana pela Novartis e Zhejiang Huahai Pharmaceuticals
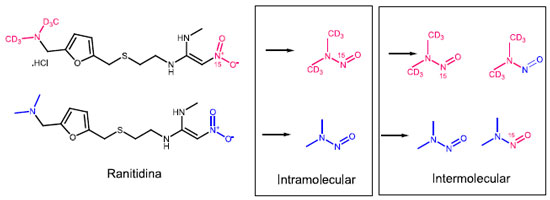
Uma vez expirada a patente, em 2011, várias empresas usaram o processo de síntese original e, no intuito de aumentar o rendimento da reação, realizaram modificações como a substituição da azida de tributilestanho por azida de sódio. A rota proposta pela empresa Zhejiang Huahai (Esquema 5), descreve a utilização de nitrito de sódio (NaNO2) e dimetilformamida (DMF) para a remoção do excesso de azida de sódio no meio reacional. Segundo Buschmann e Holzgrabe, a estabilidade limitada da dimetilformamida pode ter resultado em traços de dimetilamina e, consequentemente, a formação de NDMA, NDEA, e NMBA, nos lotes de IFA fabricados por esta rota.63 A constatação de que a formação de N-nitrosaminas em medicamentos pode ocorrer durante a síntese fez com que as empresas revisassem as rotas empregadas visando identificar as possíveis fontes. No caso do medicamento pioglitazona que apresentou a presença de NDMA, a empresa farmacêutica destacou como possível fonte o uso de nitrito de sódio e ácido bromídrico em uma primeira etapa, e DMF e ácido clorídrico em uma etapa posterior na síntese do IFA. O nitrito de sódio é usado na diazotação nitrosativa de um derivado da anilina. No entanto, ainda existem poucos estudos reportados na literatura que tratam sobre rotas sintéticas e formação de N-nitrosaminas o que de fato é esperado, uma vez que as empresas de modo geral não divulgam seus estudos. Embalagens A importância de considerar a embalagem em processos de contaminação de produtos por N-nitrosaminas já foi evidenciada em alimentos. A partir de estudos de migração, foi constatado que redes de elastômeros usados em presuntos processados podem liberar aminas nitrosáveis que contaminam o alimento com diferentes N-nitrosaminas, entre essas a NDMA e NDBA.64,65 Borrachas sintéticas ou naturais também podem ser fontes de contaminação e tem uma ampla aplicação em uma infinidade de produtos, tais como bexigas,66 luvas,67 e bicos de mamadeira.68 Trabalhos científicos têm reportado a presença de um número bastante variado de N-nitrosaminas nesses materiais. A formação de N-nitrosaminas em borrachas é consequência da reação de aceleradores de vulcanização, como 2-mercaptobenzotiazólio, ditiocarbamatos e tiuram com óxidos de nitrogênio (NOx).64,69 Em 2019, foi reportada a possível contaminação de medicamentos por NDMA e NDEA tendo como fonte a embalagem.38 A hipótese é que as N-nitrosaminas tenham sido formadas durante a impressão dos blisters pela reação da nitrocelulose da embalagem com aminas (dimetilamina e dietilamina) da tinta de impressão. Cabe destacar que a nitrocelulose tem uma ampla aplicação em tintas líquidas para rotogravura e flexografia. A transferência das N-nitrosaminas para o produto poderia ocorrer durante o selamento do blister, que é realizado sob aquecimento. Ainda durante o aquecimento, a nitrocelulose pode sofrer decomposição liberando óxidos nitrosos que são potentes agentes nitrosantes. Ainda não se tem um cenário claro como as embalagens podem contribuir na formação de N-nitrosaminas em medicamentos, e investigações são necessárias para melhor entendimento e extensão da contaminação. Armazenamento As condições de armazenamento desempenham um papel crítico na estabilidade do IFA no medicamento. Apesar de não existirem muitos estudos que comprovem que a presença de N-nitrosaminas em medicamentos seja decorrente da degradação do IFA no produto, algumas empresas indicam que a presença de NDMA na ranitidina seja oriunda da degradação do IFA mesmo na ausência de agentes nitrosantes, como o nitrito. Estudos recentes de degradação forçada e estabilidade acelerada realizados por Abe et al.70 demonstraram que umidade relativa e temperatura elevadas, além da presença de luz e oxigênio, desencadeiam uma degradação rápida da ranitidina levando a formação de NDMA. King et al.71 comprovaram essa hipótese utilizando cloridrato de ranitidina isotopicamente marcado em dois pontos estratégicos da molécula (Esquema 6).
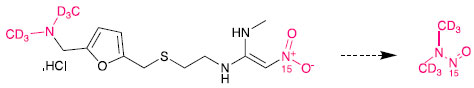 Esquema 6. Degradação da ranitidina
A fim de elucidar se a formação de NDMA ocorre por um mecanismo intermolecular ou intramolecular, os autores avaliaram amostras expostas a condições de estresse contendo apenas os grupos funcionais isotopicamente marcados e amostras contendo uma mistura 1:1 de moléculas isotopicamente marcadas com moléculas não marcadas. A identificação dos quatro isótopos da NDMA (Esquema 7) no meio reacional indicou que o processo de degradação ocorre por via intermolecular. Além disso, os autores provaram que a degradação prossegue sem a participação de qualquer outro reagente adicional. Os autores também demonstraram que a NDMA não é proveniente ou introduzida no processo de síntese, uma vez que ela não é detectada em lotes recém preparados de medicamentos contendo a ranitidina.71
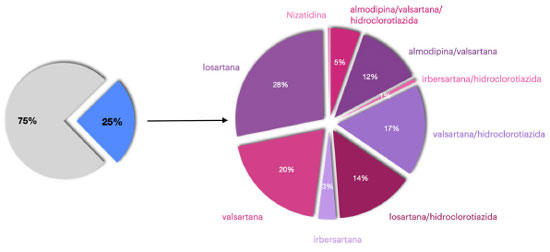
OCORRÊNCIA RECENTE DE N-NITROSAMINAS EM MEDICAMENTOS Embora a possível contaminação de medicamentos por N-nitrosaminas seja conhecida há décadas, foi em 2018 que o assunto passou a ser intensamente discutido e investigado. A FDA tomou conhecimento de que a valsartana produzido pela Zheijiang Huahai Pharmaceutical Co. Ltd estava contaminada por NDMA, o que motivou a análise de medicamentos de outros fabricantes de antagonistas de receptor de angiotensina II. Nessas análises foram identificadas contaminações de outros medicamentos por NDMA e, também, por NDEA, resultando no recall voluntário de um lote de irbesartana e sete lotes de medicamentos contendo irbesartana associada a hidroclorotiazida. No ano de 2020, aproximadamente 25% dos recalls de medicamentos realizados pela FDA foram devido à presença das N-nitrosaminas, sendo os medicamentos contendo os IFA losartana e metformina àqueles com maior número de lotes retirados do mercado (Figura 2).72
Desde então, a FDA vem analisando diversos medicamentos quanto a presença de N-nitrosaminas contendo os IFA metformina,73 valsartana,74 ranitidina,75 nizatadina,75 rifampicina, e rifampina.76 As concentrações de NDMA, NDEA, MNP, e CPNP estão apresentados na Figura 3, com destaque para os valores de NDMA no IFA valsartana (0,125 µg mg-1 IFA). Nessa figura estão sumarizados os resultados das análises de medicamentos oriundos de 43 empresas farmacêuticas e totalizando 200 amostras.
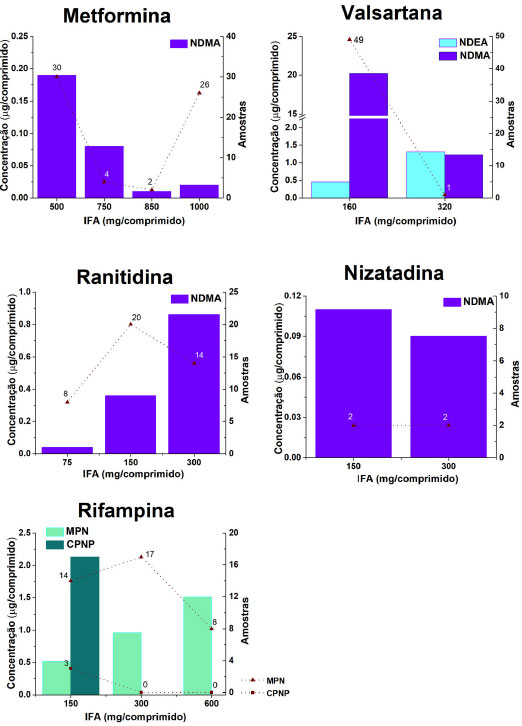 Figura 3. Concentrações de NDMA, NDEA, MPN e CPNP determinadas em diferentes lotes analisados pelo FDA em medicamentos contendo os IFA metformina, valsartana, ranitidina, nizatadina, rifampicina e rifampina
ASPECTOS TOXICOLÓGICOS Os aspectos toxicológicos das N-nitrosaminas foram intensivamente investigados na década de 1950 e impulsionados pela descoberta dos cientistas britânicos Magee e Barnes. Os pesquisadores realizaram estudos em roedores e reportaram, em 1954, que existe uma associação entre danos hepáticos e a exposição à NDMA.2,77 Dois anos mais tarde, os mesmos pesquisadores confirmaram a indução de tumores hepáticos em ratos que receberam uma dieta contendo 50 mg kg-1 de NDMA por um período menor do que um ano.1 Durante o período de 1957 a 1962, na Noruega, foi observado que animais alimentados com ração de peixe, à qual tinha sido adicionada de elevadas concentrações de nitrito, apresentaram desordens hepáticas e câncer. Análises da ração revelaram que a mesma estava contaminada com NDMA.78 A constatação de que as N-nitrosaminas poderiam ser formadas pela reação de aminas e nitrito levou à hipótese de que esses compostos potencialmente carcinogênicos poderiam estar presentes em uma variedade de produtos, incluindo alimentos e bebidas, o que foi confirmado ao longo dos anos. Foram determinadas N-nitrosaminas na cerveja,79,80 produtos cárneos,3,81-84 produtos lácteos,3, 82, 85 peixes e frutos do mar,84,86,87 cereais,85 óleos,84 entre outros. Além de serem substâncias carcinogênicas, as N-nitrosaminas exercem ação teratogênica e mutagênica em animais de laboratório. Os efeitos carcinogênicos de N-nitrosaminas já foram notados em mais de 40 espécies de animais, inclusive primatas.1-3 A IARC, na sua classificação de agentes carcinogênicos, considera as N-nitrosaminas como pertencentes ao Grupo 2A (substâncias para as quais há suficiente evidência de efeito carcinogênico em muitas espécies de animais e, ainda, têm sido demonstradas similaridades no seu metabolismo entre humanos e roedores) ou ao Grupo 2B (substâncias para as quais há suficiente evidência de efeito carcinogênico em algumas espécies de animais). Embora não existam evidências diretas da incidência de câncer em humanos como resultado da exposição às N-nitrosaminas, presume-se que o homem também seja sensível à ação tóxica desses compostos. Portanto, a IARC estabelece que as N-nitrosaminas devem ser consideradas como agentes carcinogênicos a humanos.4 A indução de tumores pode ocorrer em diferentes órgãos (e.g., fígado, pulmão, rins, bexiga, pâncreas, esôfago e língua), dependendo da estrutura química do composto N-nitroso, da dose, da via de exposição e da espécie animal, o que dificulta a extrapolação de dados obtidos em animais de laboratório para o homem.88 No entanto, não há evidências de tumores na pele, cérebro, cólon ou ossos.89 As N-nitrosaminas voláteis tem o maior potencial carcinogênico, incluindo a NDMA. Outro ponto relevante acerca dos efeitos carcinogênicos das N-nitrosaminas está relacionado à frequência e à dose. Doses pequenas e repetidas levam a maiores riscos de desenvolvimento de tumores quando comparadas a doses únicas e de elevada concentração.90 Esta situação é relevante para um cenário de exposição crônica como pela ingestão de alimentos ou medicamentos terapêuticos para tratamento de doenças crônicas. As N-nitrosaminas requerem ativação metabólica para formarem diferentes íons diazônio e desempenharem sua ação carcinogênica. A primeira etapa abarca uma hidroxilação do carbono α do grupo alquila, catalisada por uma monooxigenase de função mista do citocromo P450, principalmente o CYP2E1 e sua isoforma CYP2A6. Nessa etapa ocorre a formação de um aldeído ou cetona e uma N-nitrosamina primária que pode tautomerizar para um alquildiazoidróxido e levar a formação de um íon diazônio. Íons alquildiazônios são percursores de íons carbênio, que reagem diretamente com DNA formando adutos estáveis com os átomos de nitrogênio e oxigênio de guanina, citosina e timina. A estrutura do íon diazônio formada depende da estrutura química da N-nitrosamina91,92 e o potencial mutagênico é dependente da estabilidade do ion diazônio.22 Os adutos de DNA, por sua vez, dependem da natureza do íon diazônio formado. Os adutos são reparados por diferentes mecanismos de reparo celular. O alto potencial mutagênico e carcinogênico de algumas N-nitrosaminas voláteis está associado a α hidroxilação. Alquil-nitrosaminas que apresentam um menor número de hidrogênios alfas disponíveis apresentam menor potencial mutagênico.22 Alguns substituintes também podem reduzir ou mesmo eliminar o potencial mutagênico e carcinogênico de N-nitrosaminas, como grupos ramificados, volumosos ou não metabolizáveis no carbono α ou próximo a ele, inibindo a ativação metabólica.93
ATRIBUIÇÃO DE LIMITES DE ACEITAÇÃO E RISCO CARCINOGÊNICO PARA N-NITROSAMINAS EM MEDICAMENTOS O Guia harmonizado do ICH M7(R1)5 descreve considerações de gerenciamento do risco à segurança e à qualidade no estabelecimento de níveis de impurezas reativas de DNA (mutagênicas), as quais se esperam que apresentem riscos carcinogênicos desprezíveis. O Guia é um documento orientativo para novas substâncias medicamentosas e novos medicamentos durante seu desenvolvimento clínico, e petições de registro e submissões pós-registro de produtos comercializados. Em relação a compostos químicos que ainda não foram avaliados e que apresentam um risco desprezível de carcinogenicidade ou outros efeitos tóxicos, tem sido empregado o conceito do "Limiar de Preocupação Toxicológica" (TTC, Threshold of Toxicological Concern) para definir uma ingestão aceitável em um cenário conservador. O TTC envolve uma extrapolação linear simples a partir da dose que fornece uma incidência de tumor de 50% (TD50) na espécie mais sensível e local mais sensível da indução do tumor, a um nível de probabilidade de 1:100.000. Considerando esse procedimento para o estabelecimento de limites aceitáveis de impurezas mutagênicas em medicamentos, é possível justificar uma ingestão aceitável (AI, Acceptable Intake) de 1,5 µg/pessoa/dia. Essa abordagem pode ser usada para impurezas mutagênicas presentes em medicamentos para tratamento ao longo da vida (>10 anos) e quando não houver dados disponíveis de carcinogenicidade. As N-nitrosaminas por serem agentes genotóxicos carcinogênicos pertencem ao grupo denominado "Grupo de Preocupação" (Cohort of Concern) e por se tratarem de impurezas mais potentes que a maioria de compostos mutagênicos, o cálculo do limite baseado no conceito TTC não deve ser aplicado.94 Nesse caso, o cálculo da AI deve ser feito para cada N-nitrosamina de forma individual - levando em consideração estudos de carcinogenicidade em animais -, ou de relação estrutura-atividade (SAR, Structure Activity Relationship), conforme procedimentos descritos no Guia ICH M7(R1). Os valores da AI para as principais N-nitrosaminas identificadas em medicamentos, considerando exposições por toda a vida (>70 anos) estão apresentadas na Tabela 2, sendo estes estabelecidos em base a TD50 em roedores. A partir dos valores da AI e conhecendo-se a Dose Máxima Diária (DMD) do IFA pode ser calculado o limite diário aceitável.
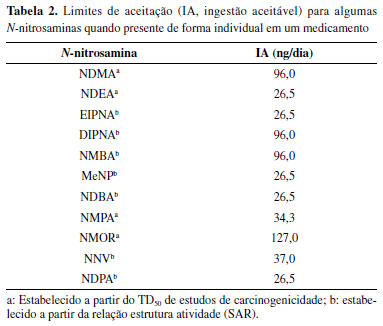
Quando o medicamento contém mais de uma N-nitrosamina como impureza existem duas alternativas para definir o limite da soma das N-nitrosaminas: (1) a soma de todas as N-nitrosaminas presentes no produto não deve ultrapassar o limite de aceitação referente à N-nitrosamina mais potente presente, e (2) os limites individuais de cada N-nitrosamina são ajustados para assegurar que o risco total da exposição não ultrapasse o risco negligenciável (o risco final não deve exceder a razão de 1:100.000 que foi definido no Guia ICH M7(R1) como risco aceitável de câncer). No caso de N-nitrosaminas às quais ainda não tem limites estabelecidos, mas que existem dados de carcinogenicidade disponíveis, deverá ser adotado o limite com base no TD50. Se não existirem TD50 disponíveis apontam-se duas opções: (1) derivação do limite a partir da comparação do SAR com N-nitrosaminas conhecidas, e (2) limite a partir do TTC específico para a classe das N-nitrosaminas (18 ng/pessoa/dia). No caso de medicamentos, deve ser considerado também que nem todos são de uso crônico, ou seja, não necessitam ser administrados diariamente ao longo da vida. Cabe destacar que as avaliações de risco de câncer são baseadas nas exposições ao longo da vida conforme descrito anteriormente na explicação do conceito TTC e assumem que o risco de câncer aumenta em função da dose cumulativa. Sendo assim, o risco de câncer de uma baixa dose contínua por toda a vida seria equivalente ao risco de câncer associado a uma dose equivalente em um período de menor de exposição.95 Para a avaliação de risco de medicamentos contendo impurezas mutagênicas administrados em um tempo menor do que a vida toda, pode ser considerado um outro procedimento para avaliação da ingestão diária, o qual é baseado no conceito denominado less than lifetime (LTL), e que considera uma exposição menor que a vida toda. Os valores de exposição ao longo da vida podem ser convertidos em LTL, considerando a frequência da ingestão, a dose do IFA e usando o valor de TTC. Por exemplo, considerando o valor de TTC de 1,5 µg dia-1 (exposição >10 anos) por um período de 25.550 dias, calcula-se uma dose aceitável cumulativa de 38,3 mg. Esse procedimento pode levar a uma ingestão diária maior da impureza mutagênica do que se fosse usado o procedimento TTC para uma exposição durante a vida toda e, ainda sim, manter níveis de risco comparáveis.
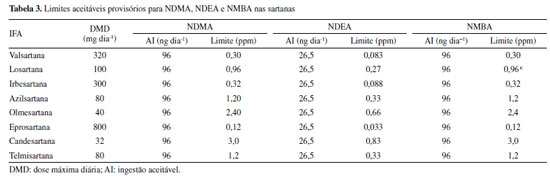
ASPECTOS DE LEGISLAÇÃO Food and Drug Administration Visto que não havia limites aceitáveis para a presença de impurezas de N-nitrosaminas em medicamentos, a FDA adotou limites aceitáveis provisórios para subsidiar o monitoramento de medicamentos da família das "sartanas" (Tabela 3). Os valores adotados foram baseados na metodologia proposta pelo ICH M7 (R1).5
A FDA também recomendou que para medicamentos com uma DMD inferior a 880 mg/dia, o limite para N-nitrosaminas totais de 0,03 ppm é aceitável uma vez que a AI de 26,5 ng/dia não seria excedida. No caso de medicamentos com DMD superior a 880 mg dia 1, este valor precisa ser ajustado conforme recomendação da ICH M7 (R1) de modo que AI recomendada não seja ultrapassada. A fim de mitigar a presença N-nitrosaminas em medicamentos, a FDA determinou que os fabricantes façam uma avaliação de risco dividida em três etapas.32 A primeira etapa consiste em determinar o risco de formação/presença de N-nitrosaminas no IFA, produtos comercializados e produtos com aplicações aprovadas e pendentes. A segunda etapa consiste na confirmação da presença das N-nitrosaminas nos produtos e deve ser realizada somente se for detectado risco na primeira etapa. A terceira e última etapa consiste no envio à FDA das alterações implementadas para a prevenção ou redução da presença de N-nitrosaminas nos produtos. Para essa avaliação, a agência exige o uso de métodos analíticos com limites de quantificação menores ou iguais a 0,03 ppm ou que sejam capazes de quantificar as N-nitrosaminas considerando uma AI de 26,5 ng/dia. European Medicines Agency A EMA iniciou as suas investigações relacionadas à presença de N-nitrosaminas em medicamentos em julho de 2018 e constatou impurezas em medicamentos da família das "sartanas", resultando em diversos recalls.96 Desde então, a EMA vem se aprofundando no assunto e lançando diversos guias e informativos em relação à presença de impurezas em medicamentos. A cronologia das ações está apresentada de forma resumida no Esquema 8.
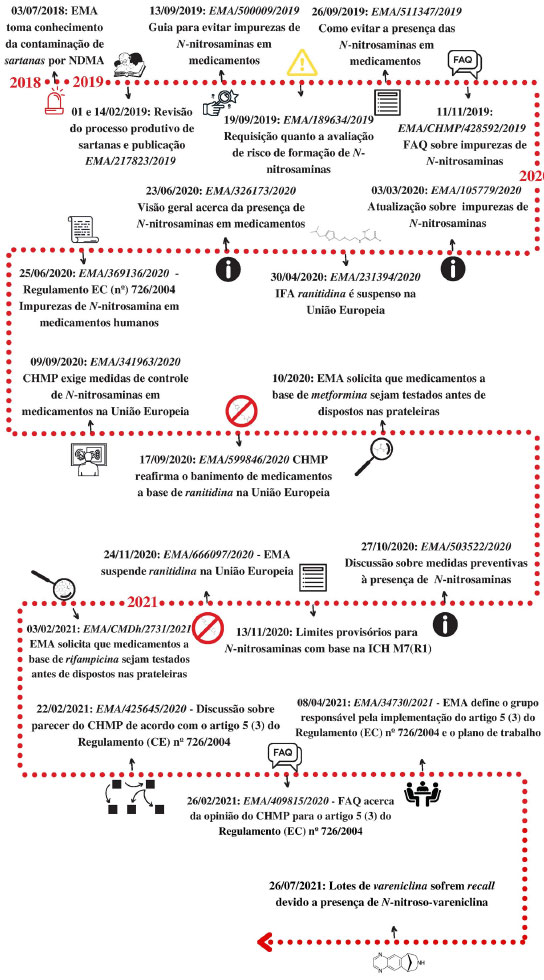 Esquema 8. Principais guias e informativos da Agência Europeia de Medicamentos em relação as impurezas de N-nitrosaminas em medicamentos (Elaborado pelos autores)
Na União Europeia, a EMA estabeleceu limites provisórios para NDMA e NDEA em agosto de 2019, os quais são mesmos adotados pela FDA. No entanto, a potencial contaminação por outras N-nitrosaminas (i.e., NMBA, DIPNA e EIPNA) levou o Grupo de Trabalho de Segurança (SWP, Safety Working Party) a avaliar criticamente os dados toxicológicos experimentais disponíveis sobre essas N-nitrosaminas na literatura. Apesar de existirem dados para a NMBA e DIPNA, o SWP considerou que os estudos não permitiam o estabelecimento de uma TD50 robusta devido ao tamanho amostral insuficiente. Em relação à EIPNA, não foram encontrados dados na literatura. Dessa forma, o SWP apenas pôde concluir que a NMBA e DIPNA são potentes carcinógenos em ratos e decidiu por utilizar a SAR para estimar o AI. Baseando-se na metodologia proposta pelo ICH M7 para correlacionar a estrutura das N-nitrosaminas, o SWP realizou um estudo de SAR e concluiu que os dados disponíveis para NDMA e NDEA poderiam ser utilizados para derivar uma AI para a NMBA, DIPNA e EIPNA. O estudo SAR levou à correlação entre NDMA e NMBA e NDEA e DIPNA/EIPNA devido à similaridade na estrutura e formação de íons alquildiazônicos por biotransformação via alfa-hidroxilação.97 Uma outra abordagem que o SWP propõe para definir limites para N-nitrosaminas para as quais não há dados suficientes disponíveis, é a utilização do TTC específico da classe de 18 ng/dia. Esse TTC foi derivado do banco de dados de potência carcinogênica da Lhasa e é considerado conservador, sendo suficientemente protetor para ser usado para qualquer N-nitrosamina. Diante disso, o SWP considera apropriado usar este TTC específico de classe para N-nitrosaminas sem dados toxicológicos disponíveis como uma abordagem padrão. Em setembro de 2019, o comitê de medicamentos humanos (CHMP, Committee for Medicinal Products for Human Use) da EMA, publicou o documento EMA/189634/2019 requerendo uma avaliação de risco sobre da presença de N-nitrosaminas em medicamentos humanos contendo insumos ativos quimicamente sintetizados. Caso as N-nitrosaminas fossem detectadas, os titulares de registro dos medicamentos deveriam informar às autoridades para que as ações regulatórias apropriadas pudessem ser tomadas. Em julho de 2020, este órgão regulador emitiu o documento EMA/369136/2020, ampliando o escopo do procedimento de avaliação de risco e incluindo todos os medicamentos para uso humano autorizados na União Europeia e Reino Unido. Por fim, em 22 de fevereiro de 2021, a EMA detalhou a abordagem para a avaliação de risco no documento EMA/425645/2020. Dessa forma, produtos medicinais biológicos também fariam parte desta avaliação, além dos já citados IFA quimicamente sintetizados. O guia contém 3 passos para os fabricantes de medicamentos avaliarem o risco da presença de impurezas de N-nitrosaminas: Passo 1: Para os fabricantes de medicamentos baseados em IFA sintéticos, realizar uma avaliação de risco para a presença de impurezas de N-nitrosaminas de acordo com a Perguntas e Respostas (Q&A, Questions and Answers) 7 do Artigo 5(3) até 31 de março de 2021. Já para aqueles que utilizam produtos medicinais biológicos, a avaliação deveria ser feita até 01 de julho de 2021. Passo 2: Caso o risco de contaminação seja identificado, os fabricantes devem confirmar ou refutar a presença de impurezas de N-nitrosaminas de acordo com Q&A 8 e 9 do Artigo 5(3). A partir do resultado das análises, cada fabricante pode se enquadrar em um dos quatro cenários: Cenário a: no caso em que o total da N-nitrosamina detectada é superior a AI estabelecida pelos princípios da ICH M7 (R1) ou a soma do total detectado é superior a AI da N-nitrosamina mais potente, uma avaliação adicional de relatores deverá ser realizada e passará para o Passo 3. Cenário b: caso o total da N-nitrosamina detectada estiver entre 10% e 100% da AI estabelecida pelos princípios da ICH M7 (R1) ou a soma do total detectado estiver entre 10% e 100% da AI da N-nitrosamina mais potente, deverá seguir para o Passo 3. Cenário c: caso o total da N-nitrosamina detectada estiver abaixo de 10% da AI estabelecida pelos princípios da ICH M7 (R1) ou a soma do total detectado estiver abaixo de 10% da AI da N-nitrosamina mais potente, o caso é arquivado. Cenário d: caso uma nova N-nitrosamina não considerada no Artigo 5(3) seja detectada, deve-se avaliar a quantidade e estabelecer a AI de acordo com ICH M7 (R1). Passo 3: Caso a contaminação seja confirmada, o fabricante que utilizar IFA sintético tem até 26 de setembro de 2022 para implementar um programa de redução de risco e submetê-lo ao órgão competente. Em contrapartida, aqueles que utilizam produtos medicinais biológicos têm até 01 de julho de 2023. Em 30 de abril de 2020, a EMA publicou o documento EMA/231394/2020 que suspendia o uso de medicamentos à base de ranitidina na União Europeia devido à presença de NDMA. Em 17 de setembro de 2020, foi publicado uma avaliação de risco em relação ao consumo de medicamento à base de ranitidina (EMA/599846/2020), e o CHMP considerou que a relação risco-benefício não era favorável, mantendo a suspensão. Em 24 de novembro de 2020, a EMA confirmou a suspensão de todos os medicamentos à base de ranitidina em toda a União Europeia (EMA/666097/2020). Com o tempo, outros IFA também chamaram a atenção da EMA e, em outubro de 2020, a agência recomendou que todos os fabricantes de medicamento que contém metformina testassem seus produtos para a presença de N-nitrosaminas, enquanto, em fevereiro de 2021, o mesmo foi recomendado para os fabricantes de medicamentos contendo rifampicina. Em 08 de abril de 2021, a EMA definiu o grupo de especialistas com a responsabilidade de supervisionar a implantação do Artigo 5(3) referente ao parecer do CHMP em relação às impurezas de N-nitrosaminas em medicamentos e fornecer atualizações de progresso às Autoridades da Rede Reguladora de Medicamentos da Europa. O grupo é composto por 16 membros e 6 suplentes que trabalham em parceria com agências internacionais e associações de indústrias farmacêuticas para minimizar a presença de N-nitrosaminas em medicamentos. Por fim, o guia EMA/409815/2020 Rev.698 com perguntas e respostas relacionadas a presença de N-nitrosaminas foi atualizado em 14 de outubro de 2021 e apresenta as principais evidências científicas até o momento. Outras agências internacionais O governo australiano, por intermédio da Administração de Boas Práticas Terapêuticas (TGA, Therapeutic Goods Administration), instaurou um período de transição entre 13 de setembro de 2019 e 13 de setembro de 2021 no qual os fabricantes de "sartanas" deveriam tomar medidas para mitigar a presença de N-nitrosaminas nos medicamentos, implementando testes analíticos rigorosos. Durante esse período, os fabricantes deveriam informar o governo caso encontrassem N-nitrosaminas em seus produtos e, se necessário, realizar mudanças no processo produtivo. Essas mudanças deveriam ser apresentadas como uma solicitação de 'categoria 3' sob a seção 9D (3) da Lei de Bens Terapêuticos de 1989. O TGA ainda reitera que todos os medicamentos dentre os quais os níveis de N-nitrosaminas estejam acima dos aceitáveis (i.e., os mesmos adotados pela EMA e FDA) não devem ser liberados para venda e/ou devem ser recolhidos. A Agência Canadense de Saúde, Health Canada, recomendou o recolhimento de diversos lotes de medicamentos com o IFA valsartana em 2018 devido a presença de NDMA. Dois anos depois, em 30 de novembro de 2020, a Health Canada publicou uma lista atualizada de medicamentos aos quais se tem conhecimento da presença de impurezas de N-nitrosaminas. Os medicamentos citados são as "sartanas", a metformina, a nizatidina, a pioglitazona, a ranitidina, a rifampicina, a rifapentina e o rifadim IV, dos quais a ranitidina, a nizatidina, a metformina e a "sartanas" tiveram lotes recolhidos no país. Na Croácia, no ano de 2019, medicamentos contendo o IFA ranitidina foram recolhidas do mercado por medidas preventivas.99 Agência Nacional de Vigilância Sanitária A ANVISA, alinhada com agências internacionais como a FDA e a EMA, vem desde julho de 2018 acompanhando a presença de N-nitrosaminas em medicamentos da classe das "sartanas" e reportando níveis considerados inaceitáveis delas. Em 17 de maio de 2018, a agência publicou a RDC 283/2019100 que dispõe sobre investigação, controle, e eliminação de N-nitrosaminas potencialmente carcinogênicas em antagonistas de receptor de angiotensina II. A RDC 283/2019 estabelece que todas as empresas fabricantes, importadoras e fracionadoras de insumos farmacêuticos, assim como empresas fabricantes e importadoras de medicamentos, e farmácias de manipulação devem avaliar a presença de impurezas de N-nitrosaminas (e.g., NDEA, NDMA, DIPNA, NMBA e EIPNA) em seus produtos de acordo com metodologia validada nos termos da RDC 166/2017101 ou Guia Q2 do ICH (2005). A RDC 283/2019 ainda apresenta prazos para as etapas de avaliação de risco de presença de impurezas de N-nitrosaminas. Uma vez constatado o risco da presença de impurezas, as empresas devem qualificar e quantificar (adotando, preferencialmente, metodologias da EMA, FDA ou Health Canada) as impurezas em até 60, 120 ou 180 dias para o risco de formação de NDMA e NDEA; DIPNA, NDMA e EIPNA; e outras N-nitrosaminas, respectivamente. Caso as empresas observem impurezas acima do limite provisório estabelecido - os mesmos adotados pelo FDA e pela EMA - estas devem notificar a ANVISA em até 48 h e recolher os medicamentos distribuídos. Desde então, a RDC 283 sofreu pequenas alterações sobre a legislação de pós-registro as quais foram publicadas na Resolução RDC Nº 500, de 27 de maio de 2021.102 Em 22 de abril de 2021, a ANVISA publicou a RDC 494/2021103 que altera o tempo limite para que não sejam observadas quaisquer N-nitrosaminas (<0,03 ppm) em IFA da classe dos antagonistas do receptor de angiotensina II para 31 de dezembro de 2021. Em agosto de 2019, após a detecção de NDMA em medicamentos contendo ranitidina, a ANVISA suspendeu a importação, uso, e comercialização do insumo farmacêutico ranitidina por meio da RE 3.259/2020.104 Foram realizados, também, 255 recolhimentos voluntários de medicamentos comercializados no Brasil até 22 de janeiro de 2020, além da interdição de vários lotes de medicamentos devido à falta de dados disponíveis sobre a presença de N-nitrosaminas. Além da ranitidina, a ANVISA também suspendeu 14 processos de fabricação, importação, distribuição e comercialização de medicamentos contendo losartana, valsartana e irbesartana. No início de 2020, a ANVISA divulgou a NOTA INFORMATIVA Nº 1/2020 com o assunto "Anvisa recomenda controle de N-nitrosaminas por parte dos fabricantes de medicamentos". Neste documento a Agência traz recomendações acerca do controle da presença de impurezas de N-nitrosaminas, de acordo com a RDC 55/2005, RDC 283/2019, RDC 301/2019 e o Guia da ICH M7 (R1). Ademais, o documento traz informações sobre os efeitos toxicológicos das N-nitrosaminas e recomendações para que os pacientes continuem o tratamento normalmente. Em setembro de 2020, a ANVISA lançou o "Programa Especial de Monitoramento de Nitrosaminas em Medicamentos" com foco nas investigações sobre a presença de impurezas de N-nitrosaminas em IFA e medicamentos, com especial atenção para a classe das "sartanas". Segundo a Agência, no programa participam a Gerência de Laboratórios de Saúde Pública (GELAS), Gerência-Geral de Medicamentos e Produtos Biológicos (GGMED), Gerência de Inspeção e Fiscalização de Medicamentos e Insumos Farmacêuticos (GIMES/GGFIS), e Instituto Nacional de Controle de Qualidade em Saúde (INCQS) da Fiocruz, visando monitorar os limites de N-nitrosaminas em medicamentos utilizando métodos adequados e respeitando os limites estabelecidos. O programa é dividido em duas etapas, sendo que na primeira as empresas interessadas poderão enviar voluntariamente amostras de seus medicamentos e dos IFA losartana e valsartana ao INCQS. Na segunda etapa, com duração prevista até junho de 2021, a ANVISA espera analisar 460 amostras de nove IFA diferentes (losartana, valsartana, irbesartana, candesartana, telmisartana, olmessartana, ranitidina, metformina e pioglitazona). O resultado das análises será compartilhado com os detentores dos produtos para que possam ser adotadas medidas de redução de impurezas de N-nitrosaminas, se necessário. Em julho de 2021, a ANVISA disponibilizou o "Guia sobre o Controle de Nitrosaminas em Insumos Farmacêuticos Ativos e Medicamentos" (Guia nº 50/2021 - versão 1)105 no qual está expresso o entendimento da Agência sobre as práticas aconselháveis em relação a procedimentos, rotinas e métodos apontados como adequados ao cumprimento de requisitos técnicos ou administrativos requeridos pelos marcos legislativos ou regulatório da Agência. O Guia possui caráter recomendatório e não vinculante, portanto abordagens alternativas podem ser empregadas somente se compatíveis com os requisitos elencados ao caso concreto. A ANVISA definiu o período de 13/07/2021 a 13/09/2021 para recebimento de contribuições que serão avaliadas e poderão subsidiar a revisão do Guia, consequentemente podendo ser publicada uma versão atualizada. A versão 1 do documento descreve recomendações em relação ao controle de N-nitrosaminas em todos os IFA sintetizados quimicamente e medicamentos destinados a uso humano que os contenham, assim como produtos biológicos, quando aplicável. MÉTODOS ANALÍTICOS Para fins analíticos, as N-nitrosaminas têm sido divididas em substâncias voláteis e não-voláteis.106 As N-nitrosaminas voláteis compreendem compostos apolares, de baixa massa molar, com alta pressão de vapor e que possam ser removidos da matriz por destilação (e.g., NDMA, NDEA, NMEA, NPIP, NPYR).107 Já as N-nitrosaminas não-voláteis apresentam baixa pressão de vapor e incluem as N-nitrosaminas de cadeia longa como dialquilnitrosaminas, nitrosopeptídeos e nitrosoaminoácidos. Na década de 80, com a identificação de NDMA em produtos alimentícios e bebidas, as pesquisas foram majoritariamente direcionadas para a determinação de N-nitrosaminas voláteis.106,108-117 De modo geral, o preparo de amostras consistia na extração das N-nitrosaminas da matriz (alimento) por vácuo,113,118 arraste de vapor,119 ou óleo mineral e destilação,120,121 e quantificação por cromatografia a gás com detector de quimioluminescência, conhecido como TEA (Thermal Energy Analyzer).122,123 Esse detector tem a vantagem de ser seletivo para o grupo N-N=O e até hoje é usado em alguns laboratórios.81 Por outro lado, a seletividade desse detector não permite aplicação abrangente e sendo assim muitos laboratórios optaram por empregar o espectrômetro de massas associado a cromatografia a gás. O desenvolvimento de métodos para a determinação de N-nitrosaminas não voláteis sofreu um atraso devido à necessidade do emprego da cromatografia líquida para a separação e da dificuldade da associação deste equipamento ao detector TEA ou mesmo ao espectrômetro de massas. Alguns trabalhos empregam a derivatização pós-coluna, no qual é gerado nitrito por fotólise e seguida da reação de Gries para formação de um azo composto que absorve na região do UV-Vis e permite o emprego de um detector UV/Vis ou de arranjo de fotodiodos (DAD, photodiode array detector).106,122,124 Como o aprimoramento das interfaces de ionização por eletronebulização (ESI, Electrospray ionization) e a ionização química a pressão atmosférica (APCI, Atmospheric-pressure chemical ionization) se abriu a possibilidade da determinação de N-nitrosaminas voláteis e não-voláteis simultaneamente por cromatografia líquida, o que certamente é uma grande vantagem. A fonte APCI tem sido a mais recomendada uma vez que sofre menor supressão iônica quando comparada com a fonte de ESI.125 Na última década, verifica-se um aumento considerável de artigos publicados na literatura científica visando a determinação de N-nitrosaminas em níveis de concentração de ppt a ppb por cromatografia líquida associada a espectrometria de massas sequencial (LC-MS/MS) nos mais variados tipos de amostras (água,126 alimentos, cosméticos,127-129 produtos de higiene pessoal,130 medicamentos26). Embora a instrumentação esteja disponível para viabilizar a separação e quantificação, o grande desafio ainda é o preparo de amostras, uma vez que o efeito matriz pode vir a prejudicar a determinação dos analitos em concentrações traços. No preparo de amostras, visando a eliminação de interferentes da matriz e concentração dos analitos, diversos procedimentos tem sido estudados e recomendados, entre esses a destilação a vácuo113,118 ou óleo mineral,121 extração por solvente (LLE, liquid-liquid extraction), extração em fase sólida (SPE, solid phase extraction),21-25 micro-extração em fase sólida (SPME, solid phase microextraction),81,131 micro-extração líquido-líquido dispersiva (DLLME, dispersive liquid-liquid microextraction),132 dispersão da matriz em fase sólida (MSPD, matrix solid phase dispersion)123,133 e, mais recentemente, o procedimento QuEChERS134 proposto por Anastasides e colaboradores135 e adaptado por Abedi e Talebpour.136 Para a SPE tem sido usados diferentes fases sorventes e o carvão ativado tem mostrado vantagens frente a sorventes de fase reversa que têm sido menos eficientes.137 Para a extração com solventes na extração de N-nitrosaminas têm sido empegados diclorometano, metanol ou acetona. No entanto, especial atenção deve ser dada ao pH e à possível fotólise ao realizar-se análises de amostras contendo NDMA.138,139 A possível formação de N-nitrosaminas durante o procedimento de preparo de amostras deve ser inibida, o que pode ser alcançado pela adição de ácido sulfâmico, ácido ascórbico e tocoferol.91 Devido aos baixos níveis em que as N-nitrosaminas ocorrem nos IFA e medicamentos, as agências governamentais e cientistas ao redor do mundo têm se movimentado para o desenvolvimento de métodos analíticos para a sua quantificação. Os laboratórios oficiais de controle de medicamentos (OMCL, Official Medicines Control Laboratories) da Rede Europeia Geral de OMCL (General European OMCL Network, GEON) desenvolveram e validaram métodos para a quantificação das principais N-nitrosaminas em "sartanas", ranitidina e metformina. Para tanto, são recomendados métodos cromatográficos, incluindo a cromatografia líquida e a gás. Os métodos de cromatografia líquida utilizam colunas de fase reversa C8, C18 e HSS T3, enquanto os de cromatografia gasosa são realizados com colunas RTX 624. Um resumo desses métodos está apresentado na Tabela 3S. A ionização das moléculas na interface do cromatógrafo líquido geralmente emprega a ionização APCI. Diversos outros métodos cromatográficos para a determinação de N-nitrosaminas em medicamentos estão disponíveis na literatura, como pode ser observado na revisão feita por Parr e Joseph.26 A FDA recomenda o uso de cromatografia líquida acoplada ao espectrômetro de massas de alta resolução para a quantificação de NDMA em ranitidina devido as baixas temperaturas empregadas no método; altas temperaturas podem ocasionar a formação de NDMA durante o procedimento de análise.24 A ANVISA recomenda que os métodos utilizados para a quantificação das N-nitrosaminas sigam as diretrizes da RDC 166/2017,101 e que as empresas deem preferência para os métodos publicados pela EMA, pela FDA e pela Health Canada.100
CONCLUSÕES Desde a descoberta da presença N-nitrosodimetilamina em ração animal, na década de 1950, associada à comprovação científica do potencial tóxico e carcinogenicidade das N-nitrosaminas em mamíferos, extensas pesquisas têm sido realizadas para entender a formação e ocorrência destes contaminantes nos mais diversos produtos de consumo, visando mitigar o risco. Nas décadas de 80 e 90, os estudos foram focados na determinação de N-nitrosaminas voláteis em alimentos, uma vez que se tinha disponível, na época, técnicas analíticas que permitissem a sua identificação e quantificação nestas amostras, principalmente produtos cárneos. Muitas pesquisas foram realizadas para entender a presença e formação de N-nitrosaminas em alimentos e bebidas. A identificação de precursores de nitrosação e agentes nitrosantes, assim como inibidores e catalisadores da formação de N-nitrosaminas, possibilitou que as indústrias de alimentos adaptassem seus processos para reduzir a contaminação dos produtos. Não menos importante foi a descoberta da migração de N-nitrosaminas de embalagens para alimentos, levando à investigação da presença de N-nitrosaminas em diferentes materiais de embalagens e à identificação da presença de N-nitrosaminas em chupetas e bicos de mamadeiras. Sem dúvida, a área de segurança do alimento tem recebido destaque com o maior número de artigos publicados sobre N-nitrosaminas na literatura. Não obstante, a indústria de cosméticos passou por processo similar quando foram identificadas N-nitrosaminas em cosméticos e produtos de higiene pessoal, sendo neste caso o principal foco as N-nitrosaminas não voláteis (e.g. N-nitrosodietanolamina), que requerem técnicas baseadas na cromatografia líquida. Os esforços e ações tomadas pelas indústrias de alimentos e de cosméticos foram bem-sucedidos, considerando que as concentrações de N-nitrosaminas em diversos produtos nas décadas de 80 e 90 eram na ordem de mg kg-1 e atualmente se situam em µg kg-1. Uma revisão sobre a presença de N-nitrosaminas em cosméticos foi publicada pelo próprio grupo de pesquisa.140 A presença de N-nitrosaminas em medicamentos, embora já tenha sido reportada por autores nas décadas de 70 e 80, ganhou apenas destaque notório em 2018 quando foram detectadas em medicamentos da família das "sartanas". As fontes de contaminação podem ser inúmeras, incluindo o emprego de matéria-prima contaminada, formação na síntese do IFA, água usada no processo, material de embalagem e formação durante a estocagem. Fica evidente que qualquer produto farmacêutico pode conter impurezas da família das N-nitrosaminas e que há necessidade de que essas impurezas sejam controladas de forma rotineira. O processo envolvido na produção de medicamentos não segue uma rota única e, sendo assim, a via de contaminação não pode ser generalizada. Sem dúvida, a indústria farmacêutica necessita implementar ações no sentido de rastrear as possíveis vias de contaminação e controlar os seus processos para minimizar a presença destes compostos nos medicamentos acabados. Para tanto, ainda existe uma carência de métodos analíticos robustos e acessíveis que permitam determinar as N-nitrosaminas voláteis e não-voláteis em medicamentos, na qual se tem a presença de excipientes e IFA em altas concentrações. A presença de N-nitrosaminas pode ser impraticável por razões tecnológicas, e nesse sentido, é imprescindível que as agências reguladoras realizem avaliações de risco e definam valores máximos toleráveis de N-nitrosaminas nos medicamentos para nortear as ações das indústrias. MATERIAL SUPLEMENTAR O Material Suplementar apresenta três tabelas (1S, 2S e 3S) e é de acesso livre a partir do website da revista Química Nova (http://quimicanova.sbq.org.br/).
AGRADECIMENTOS Os autores agradecem à Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP - 2021/0323-9) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq 301737/2017-7) pelo auxílio financeiro, e à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior pela bolsa concedia a V. D. (CAPES, 88887.619586/2021-00).
REFERÊNCIAS 1. Magee, P. N.; Barnes, J. M.; Adv. Cancer Res, 1967, 10, 163. [Crossref] 2. Magee, P. N.; Barnes, J. M.; Br. J. Cancer 1956, 10, 114. [Crossref] 3. Tricker, A. R.; Preussmann, R.; Mutat. Res. 1991, 259, 277. [Crossref] 4. IARC; Some N-nitroso compounds, IARC: Lyon, France, 1978. 5. https://www.ema.europa.eu/en/documents/scientific-guideline/ich-guideline-m7r1-assessment-control-dna-reactive-mutagenic-impurities-pharmaceuticals-limit_en.pdf, acessada em abril 2022. 6. Lijinsky, W.; Conrad, E.; Van de Bogart, R.; Nature 1972, 239, 165. [Crossref] 7. Lijinsky, W.; Cancer Res. 1974, 34, 255. 8. LaBar, J.; Sander, J.; Arzneimittelforschung 1976, 26, 1340. 9. Eisenbrand, G.; Spiegelhalder, B.; Kann, J.; Klein, R.; Preussmann, R.; Arzneimittelforsch. 1979, 29, 867. [Crossref] [https://doi.org/10.1002/chin.197938327]. 10. Taylor, P.; Braddock, P.; Carter, D.; IARC Sci .Publ. 1980, 30, 575. 11. Castegnaro, M.; Pignatelli, B.; Walker, E. A.; Food Cosmet. Toxicol. 1981, 19, 489. [Crossref] 12. Webb, K. S.; Wood, B. J.; Gough, T. A.; J. Anal. Toxicol. 1983, 7, 181. [Crossref] 13. Kumar, R.; Siddiqi, M.; Fazili, Z.; Wacker, C. D.; Spiegelhalder, B.; Preussmann, R.; Cancer Lett. 1992, 65, 139. [Crossref] 14. Brambilla, G.; Martelli, A.; Mutat. Res. 2007, 635, 17. [Crossref] 15. Sakai, A.; Inoue, T.; Tanimura, A.; Gan 1984, 75, 245. 16. Bartsch, H.; Ohshima, H.; Pignatelli, B.; Mutat. Res. 1988, 202, 307. [Crossref] 17. Akintonwa, D. A. A.; Ecotoxicol. Environ. Saf. 1985, 9, 64. [Crossref] 18. Dawson, B. A.; Lawrence, R. C.; JAOAC 1987, 70, 554. 19. Atawodi, S. E.; Spiegelhalder, B.; Cancer Lett. 1994, 79, 107. [Crossref] 20. Atawodi, S. E.; Lamorde, A. G.; Spiegelhalder, B.; Preussman, R.; Food Chem.Toxicol. 1995, 33, 43.. [Crossref] 21. Adachi, M.; Saito, H.; Kobayashi, H.; Horie, Y.; Kato, S.; Yoshioka, M.; Ishii, H.; Ann Intern Med 2003, 139, 488. [Crossref] 22. https://www.ema.europa.eu/en/documents/referral/nitrosamines-emea-h-a53-1490-assessment-report_en.pdf, acessada em abril 2022. 23. https://www.ema.europa.eu/en/documents/other/lessons-learnt-presence-n-nitrosamine-impurities-sartan-medicines-implementation-plan_en.pdf, acessada em abril 2022. 24. https://www.who.int/medicines/publications/drugalerts/InformationNote_Nitrosamine-impurities/en/, acessada em abril 2022. 25. https://pubchem.ncbi.nlm.nih.gov/, acessada em abril 2022. 26. Parr, M. K.; Joseph, J. F.; J. Pharm. Biomed. Anal. 2019, 164, 536. [Crossref] 27. https://www.fda.gov/media/141720/download, acessada em abril 2022. 28. https://www.ema.europa.eu/en/documents/referral/ranitidine-article-31-referral-assessment-report_en.pdf, acessada em abril 2022. 29. https://recalls-rappels.canada.ca/en/alert-recall/status-ranitidine-drugs-canada, acessada em abril 2022. 30. https://www.swissmedic.ch/swissmedic/en/home/news/mitteilungen/rueckrufe_praeparaten_ranitidin.html, acessada em abril 2022. 31. https://www.ema.europa.eu/en/documents/press-release/ema-review-ranitidine-medicines-following-detection-ndma_en.pdf, acessada em abril 2022. 32. https://www.fda.gov/media/141720/download, acessada em abril 2022. 33. https://www.tga.gov.au/sites/default/files/tga-laboratories-testing-ranitidine-medicines.pdf, acessada em abril 2022. 34. https://www.fda.gov/news-events/press-announcements/statement-janet-woodcock-md-director-fdas-center-drug-evaluation-and-research-impurities-found, acessada em em abril 2022. 35. https://www.fda.gov/drugs/drug-safety-and-availability/fda-updates-and-press-announcements-nitrosamines-rifampin-and-rifapentine, acessada em abril 2022. 36. Cloez, S. F. M.; TAG Information Note, February 2021, 1. 37. https://www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/pfizer-expands-voluntary-nationwide-recall-include-all-lots-chantixr-varenicline-tablets-due-n, acessada em abril 2022. 38. https://www.ema.europa.eu/en/documents/referral/nitrosamines-emea-h-a53-1490-assessment-report_en.pdf, acessada em abril 2022. 39. https://www.who.int/water_sanitation_health/dwq/chemicals/ndma_2add_feb2008.pdf, acessada em abril 2022. 40. Ayanaba, A.; Alexander, M.; J. Environ. Quality 1974, 3, 83. [Crossref] 41. Richardson, S. D.; TrAC - Trends Anal. Chem. 2003, 22, 666. [Crossref] 42. Beard, J. C.; Swager, T. M.; J. Org. Chem. 2021, 86, 2037. [Crossref] 43. Huang, M. E.; Huang, S. Y.; McCurry, D. L.; Environ. Sci. Technol. Lett. 2018, 5, 154. [Crossref] 44. van Rheenen, D.; Nature 1962, 193, 170. [Crossref] 45. Shen, R.; Andrews, S. A.; Water Res. 2011, 45, 944.. [Crossref] 46. Park, S. H.; Wei, S.; Mizaikoff, B.; Taylor, A. E.; Favero, C.; Huang, C. H.; Environ. Sci. Technol. 2009, 43, 1360. [Crossref] 47. Sgroi, M.; Roccaro, P.; Oelker, G. L.; Snyder, S. A.; Environ. Sci. Technol. 2014, 48, 10308. [Crossref] 48. Lee, C.; Yoon, J.; Von Gunten, U.; Water Res. 2007, 41, 581. [Crossref] 49. Xu, B. B.; Chen, Z. L.; Qi, F.; Ma, J.; Wu, F. C.; J. Hazard. Mater. 2010, 179, 976. [Crossref] 50. Mitch, W. A.; Sharp, J. O.; Trussell, R. R.; Valentine, R. L.; Alvarez-Cohen, L.; Sedlak, D. L.; Environ. Eng. Sci. 2003, 20, 389. [Crossref] 51. Wu, Y.; Levons, J.; Narang, A. S.; Raghavan, K.; Rao, V. M.; AAPS PharmSciTech 2011, 12, 1248. [Crossref] 52. https://www.fda.gov/drugs/drug-safety-and-availability/updates-possible-mitigation-strategies-reduce-risk-nitrosamine-drug-substance-related-impurities, acessada em abril 2022. 53. La Berre, C.; Ullmann's Encyclopedia of Industrial Chemistry, 2013. 54. Spiegelhalder, B.; Eisenbrand, G.; Preussmann, R.; Angew. Chem., Int. Ed. 1978, 17, 367. [Crossref] 55. Bontoyan, W. R.; Law, M. W.; Wright Jr., D. P.; J. Agric. Food Chem. 1979, 27, 631. [Crossref] 56. Das, B.; Reddy, C. R.; Kumar, D. N.; Krishnaiah, M.; Narender, R.; Synlett 2010, 391. [Crossref] 57. Tatarkiewicz, J.; Bujalska-Zadrzny , M.; Folia Cardiol. 2019, 14, 564. [Crossref] 58. Buhlmayer, P.; Ostermayer, F.; Schmidlin, T.; Eur. Pat. Appl. EP443983 1991. 59. Bharate, S. S.; J. Med. Chem. 2021, 64, 2923. [Crossref] 60. Baumann, M.; Baxendale, I. R.; Ley, S. V.; Nikbin, N.; Beilstein J. Org. Chem. 2011, 7, 442. [Crossref] 61. Heravi, M. M.; Zadsirjan, V.; RSC Adv. 2020, 10, 44247. [Crossref] 62. Wang, G. X.; Sun, C. H.; Peng, C. H.; Org. Process Res. Dev. 2011, 15, 986. [Crossref] 63. Buschmann, H.; Holzgrabe, U.; Deutsche Apotheker-Zeitung 2018, 158, 22. 64. Bouma, K.; Nab, F. M.; Schothorst, R. C.; Food Addit. Contam. 2003, 20, 853. [Crossref] 65. Pensabene, J. W.; Fiddler, W.; Gates, R. A.; J. Agric. Food Chem. 1995, 43, 1919. [Crossref] 66. Altkofer, W.; Braune, S.; Ellendt, K.; Kettl-Gromminger, M.; Steiner, G.; Mol. Nutr. Food Res. 2005, 49, 235. [Crossref] 67. Feng, D.; Liu, L.; Zhao, L.; Zhou, Q.; Tan, T.; J. Chromatogr. Sci. 2012, 50, 733. [Crossref] 68. Sung, J. H.; Kwak, I. S.; Park, S. K.; Kim, H. I.; Lim, H. S.; Park, H. J.; Kim, S. H.; Food Addit. Contam., Part A 2010, 27, 1745. [Crossref] 69. Sen, P. In Food and Packaging Interactions; Hotchkiss, J. H., ed.; ACS Symposium Series, American Chemical Society: Washington DC, 1988. [Crossref] 70. Abe, Y.; Yamamoto, E.; Yoshida, H.; Usui, A.; Tomita, N.; Kanno, H.; Masada, S.; Yokoo, H.; Tsuji, G.; Uchiyama, N.; Hakamatsuka, T.; Demizu, Y.; Izutsu, K. I.; Goda, Y.; Okuda, H.; Chem. Pharm. Bull. 2020, 68, 1008. [Crossref] 71. King, F. J.; Searle, A. D.; Urquhart, M. W.; Org. Proc. Res. Dev. 2020, 24, 2915. [Crossref] 72. https://www.fda.gov/drugs/drug-safety-and-availability/drug-recalls, acessada em abril 2022. 73. https://www.fda.gov/drugs/drug-safety-and-availability/laboratory-tests-metformin, acessada em abril 2022. 74. https://www.fda.gov/drugs/drug-safety-and-availability/laboratory-analysis-valsartan-products, acessada em abril 2022. 75. https://www.fda.gov/drugs/drug-safety-and-availability/laboratory-tests-ranitidine, acessada em abril 2022. 76. https://www.fda.gov/drugs/drug-safety-and-availability/laboratory-analysis-rifampinrifapentine-products, acessada em abril 2022. 77. Barnes, J. M.; Magee, P. N.; Br. J. Ind. Med. 1954, 11, 167. [Crossref] 78. Ender, F.; Ceh, L.; Madsen, R.; Koppang, N.; Havre, G.; Helgebostad, A.; Naturwissenschaften 1964, 51, 637. [Crossref] 79. Tricker, A. R.; Pfundstein, B.; Theobald, E.; Preussmann, R.; Spiegelhalder, B.; Food Chem. Toxicol. 1991, 29, 729. [Crossref] 80. Tricker, A. R.; Preussmann, R.; J. Cancer Res. Clin. Oncol. 1991, 117, 130. [Crossref] 81. Andrade, R.; Reyes, F. G. R.; Rath, S.; Food Chem. 2005, 91, 173. [Crossref] 82. Mavelle, T.; Bouchikhi, B.; Debry, G.; Food Chem. 1991, 42, 321. [Crossref] 83. Park, J. E.; Seo, J. E.; Lee, J. Y.; Kwon, H.; Toxicol. Res. 2015, 31, 279. [Crossref] 84. Yurchenko, S.; Molder, U.; Food Chem. 2007, 100, 1713. [Crossref] 85. Biaudet, H.; Mavelle, T.; Debry, G.; Food Chem. Toxicol. 1994, 32, 417. [Crossref] 86. Lee, S. J.; Shin, J. H.; Sung, N. J.; Kim, J. G.; Hotchkiss, J. H.; Food Addit. Contam. 2003, 20, 31. [Crossref] 87. Mitacek, E. J.; Brunnemann, K. D.; Suttajit, M.; Martin, N.; Limsila, T.; Ohshima, H.; Caplan, L. S.; Food Chem. Toxicol. 1999, 37, 297. [Crossref] 88. Druckrey, H.; Preussmann, R.; Ivankovic, S.; Schmahl, D.; Z. Krebsforsch. 1967, 69, 103. [Crossref] 89. Lijinsky, W.; Mutat. Res. 1999, 443, 129. [Crossref] 90. Walters, C. L.; Food Addit. Contam. 1992, 9, 441. [Crossref] 91. Douglass, M. L.; Kabacolff, B. L.; Anderson, G. A.; Cheng, M. C.; J. Soc. Cosmet. Chem. 1978, 29, 581. 92. Mirvish, S. S.; Toxicol. Appl. Pharmacol. 1975, 31, 325. [Crossref] 93. Benigni, R.; Chem. Rev. 2005, 105, 1767. [Crossref] 94. Bercu, J. P.; Masuda-Herrera, M.; Johnson, G.; Czich, A.; Glowienke, S.; Kenyon, M.; Thomas, R.; Ponting, D. J.; White, A.; Cross, K.; Waechter, F.; Rodrigues, M. A. C.; Regul. Toxicol. Pharmacol. 2021, 123, 104926. [Crossref] 95. https://www.ema.europa.eu/en/documents/scientific-guideline/ich-guideline-m7r1-assessment-control-dna-reactive-mutagenic-impurities-pharmaceuticals-limit_en.pdf, acessada em abril 2022. 96. Shaikh, T.; Gosar, A.; Sayed, H.; J. Adv. Pharm. Pract. 2020, 28, 48. 97. Sulc, M.; Hodek, P.; Stiborova, M.; Gen. Physiol. Biophys. 2010, 29, 175. [Crossref] 98. https://www.ema.europa.eu/en/documents/referral/nitrosamines-emea-h-a53-1490-questions-answers-marketing-authorisation-holders/applicants-chmp-opinion-article-53-regulation-ec-no-726/2004-referral-nitrosamine-impurities-human-medicinal-products_en.pdf, acessada em abril 2022. 99. Sedlo, I.; Kolonic, T.; Tomic, S.; Arh. Hig. Rada Toksikol. 2021, 72, 1. [Crossref] 100. https://www.in.gov.br/web/dou/-/resolucao-rdc-n-283-de-17-de-maio-de-2019-118357341, acessada em abril 2022. 101. https://www.in.gov.br/materia/-/asset_publisher/Kujrw0TZC2Mb/content/id/19194581/do1-2017-07-25-resolucao-rdc-n-166-de-24-de-julho-de-2017-19194412, acessada em abril 2022. 102. https://www.latinigroup.com.br/images/legis/DOU_02_06_2021.pdf, acessada em abril 2022. 103. https://www.in.gov.br/en/web/dou/-/resolucao-rdc-n-494-de-15-de-abril-de-2021-315224985, acessada em abril 2022. 104. https://www.in.gov.br/en/web/dou/-/resolucao-re-n-3.259-de-26-de-agosto-de-2020-274384354, acessada em abril 2022. 105. http://antigo.anvisa.gov.br/documents/10181/6279847/(1)Guia_50_Nitrosaminas_rev_final_para+publica%C3%A7%C3%A3o.pdf/12af2904-e5a7-4774-9528-f4f633cac2bf, acessada em abril 2022. 106. Rath, S.; Reyes, F. G. R. Em Safety Analysis of Foods of Animal Origin, Taylor & Francis: Boca Raton, USA, 2011; cap. 13. [Crossref] 107. Rath, S.; Reyes, F. G. R. Em Handbook of Processed Meats and Poultry Analysis.; Nollet, L. M. L., Toldra, F., eds.; CRC Press: Boca Raton, 2009, cap. 32. [Crossref] 108. Fazio, T.; Havery, D. C.; Howard, J. W.; IARC Sci. Publ. 1980, 31, 419. 109. Kawabata, T.; Uibu, J.; Ohshima, H.; Matsui, M.; Hamano, M.; Tokiwa, H.; IARC Sci. Publ. 1980, 31, 481. 110. Spiegelhalder, B.; Eisenbrand, G.; Preussmann, R.; IARC Sci. Publ. 1980, 31, 467. 111. Spiegelhalder, B.; Eisenbrand, G.; Preussmann, R.; Oncology 1980, 37, 211. [Crossref] 112. Bogovskii, P. A.; Vopr. Pitan. 1981, 2, 3. 113. Sen, N. P.; Seaman, S.; J Agric Food Chem 1981, 29, 787. [Crossref] 114. Yin, F.; Ding, J. H.; Liu, S. L.; Food Chem. Toxicol. 1982, 20, 213. [Crossref] 115. Yamamoto, M.; Iwata, R.; Ishiwata, H.; Yamada, T.; Tanimura, A.; Food Chem. Toxicol. 1984, 22, 61. [Crossref] 116. Gloria, M. B. A.; Barbour, J. F.; Scanlan, R. A.; J. Agric. Food. Chem. 1997, 45, 1816. [Crossref] 117. Izquierdo-Pulido, M.; Barbour, J. F.; Scanlan, R. A.; Food Chem. Toxicol. 1996, 34, 297. [Crossref] 118. Sen, N. P.; Seaman, S. W.; Bergeron, C.; Brousseau, R.; J. Agric. Food Chem. 1996, 44, 1498. [Crossref] 119. Sen, N. P.; Seaman, S. W.; Page, B. D.; J .Chromatogr. A 1997, 788, 131. [Crossref] 120. Greenfield, E. L.; Smith, W. J.; Malanoski, A. J.; JAOAC 1982, 65, 1319. [Crossref] 121. Greenfield, E. L.; Vasco, G. A.; Legette, L.; Malanoski, A.; JAOAC 1982, 65, 1316. [Crossref] 122. Fine, D. H.; IARC Sci. Publ. 1983, 45, 309. 123. Pensabene, J. W.; Miller, A. J.; Greenfield, E. L.; Fiddler, W.; JAOAC 1982, 65, 151. [Crossref] 124. Massey, R. C.; Key, P. E.; McWeeny, D. J.; Knowles, M. E.; IARC Sci. Publ. 1984, 57, 131. 125. Lee, J. H.; Lee, S. U.; Oh, J. E.; Int. J. Environ. Anal. Chem. 2013, 93, 1261. [Crossref] 126. Zhao, Y. Y.; Boyd, J.; Hrudey, S. E.; Li, X. F.; Environ. Sci. Technol. 2006, 40, 7636. [Crossref] 127. Liu, F. J.; Xian, Y. P.; Chen, J. W.; Dong, H.; Liu, H. D.; Guo, X. D.; Chen, M. Y.; Li, H.; Anal. Methods 2016, 8, 4245. [Crossref] 128. Joo, K. M.; Shin, M. S.; Jung, J. H.; Kim, B. M.; Lee, J. W.; Jeong, H. J.; Lim, K. M.; Talanta 2015, 137, 109. [Crossref] 129. Ma, Q.; Wang, C.; Bai, H.; Wang, X.; Dong, Y.; Wu, T.; Zhang, Q.; Wang, J.; Tang, Y.; Chin. J. Chromatogr. 2009, 27, 283. 130. Tada, A.; Rodrigues-Silva, C.; Rath, S.; J .Pharm. Biomed. Anal. 2021, 202, 114132. [Crossref] 131. Davarani, S. S.; Masoomi, L.; Banitaba, M. H.; Zhad, H. R.; Sadeghi, O.; Samiei, A.; Talanta 2013, 105, 347. [Crossref] 132. Chisvert, A.; Benede, J. L.; Peiro, M.; Pedron, I.; Salvador, A.; Talanta 2017, 166, 81. [Crossref] 133. Raoul, S.; Gremaud, E.; Biaudet, H.; Turesky, R. J.; J. Agric. Food Chem. 1997, 45, 4706. [Crossref] 134. Lehotay, S. J.; Sapozhnikova, Y.; Han, L.; Johnston, J. J.; J. Agric. Food Chem. 2015, 63, 10341. [Crossref] 135. Anastassiades, M.; Lehotay, S. J.; Stajnbaher, D.; Schenck, F. J.; JAOAC Int. 2003, 86, 412. [Crossref] 136. Abedi, G.; Talebpour, Z.; Anal. Methods 2017, 9, 5165. [Crossref] 137. Boyd, J. M.; Hrudey, S. E.; Richardson, S. D.; Li, X. F.; TrAc - Trends Anal. Chem. 2011, 30, 1410. [Crossref] 138. Grebel, J. E.; Young, C. C.; Suffet, I. H.; J. Chromatogr. A 2006, 1117, 11. [Crossref] 139. Roux, J. L.; Gallard, H.; Croue, J. P.; Papot, S.; Deborde, M.; Environ. Sci. Technol. 2012, 46, 11095. [Crossref] 140. Rath, S.; Canaes, L. S.; Quim. Nova 2009, 32, 59. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access