Artigo
|
|
| Ativação de composto orgânico com ácido fosfórico e os efeitos na adsorção de Pb e Cd Activation of organic compost with phosphoric acid and the effects on Pb and Cd adsorption |
|
Giulia Meneguel ColtroI; Jacqueline Zanin LimaI,II; Osni José PejonI; Valéria Guimarães Silvestre RodriguesI,*
I. Departamento de Geotecnia, Escola de Engenharia de São Carlos, Universidade de São Paulo, 13566-590 São Carlos - SP, Brasil Recebido em 15/09/2022 *e-mail: valguima@usp.br Application of adsorbents derived from waste in contaminated areas remediation is aligned with sustainable development goals and circular economy principles. As chemical activation can result in increased adsorption capacity, it is an alternative to improve the performance of materials and enable their use. This study evaluated whether activated compost derived from the organic fraction of municipal solid waste would be an efficient and low-cost adsorbent. Chemical activation was performed by impregnating 1 mol L-1 of phosphoric acid for 12 h at 25 ºC. Characterization and batch equilibrium tests were carried out to confirm if chemical activation would positively affect the retention of lead (Pb) and cadmium (Cd). Surface functional groups and minerals were verified through Fourier Transform Infrared Spectroscopy (FTIR) and X-Ray Diffractometry (XRD) before and after batch equilibrium test. Removal percentages ranged from 52.49 to 91.22% for Pb (initial concentrations of 20.11 to 889.20 mg L-1) and from 13.33 to 87.13% for Cd (initial concentrations from 1.56 to 667.50 mg L-1). Compared to the original material, activation did not increase Cd adsorption capacity. However, was observed an improvement in adsorption performance for Pb between 76.86 and 443.30 mg L-1. The Langmuir isotherm best fitted the experimental data obtained both for Pb and Cd. INTRODUÇÃO A forma como a sociedade produz e utiliza os materiais se caracteriza por práticas lineares, ou seja, existe uma lógica de "extrair-produzir-descartar" que promove a disposição prematura de recursos.1 A economia circular surge como um esforço para se implementar estratégias de desenvolvimento sustentável.2 Sob este novo modelo econômico, processos cíclicos, inspirados na natureza, são propostos. De acordo com a Fundação Ellen MacArthur, existem dois tipos de fluxos cíclicos possíveis na economia circular, o técnico (i), que apoia estratégias de reuso, reparo, remanufatura e reciclagem de produtos e materiais, e o biológico (ii), cujo objetivo é regenerar sistemas naturais, através do uso de recursos renováveis, do consumo de materiais biológicos e da reinserção de nutrientes no ecossistema natural.3 Deste modo, a reutilização de resíduos por meio do emprego na remediação de áreas contaminadas está em consonância com os princípios da economia circular, colaborando para ambos os fluxos cíclicos. Além disso, considerando os 17 objetivos chave da ONU para o desenvolvimento sustentável, com metas em diversas frentes para o ano de 2030, a aplicação de resíduos na remediação de áreas contaminadas está alinhada especialmente com o objetivo 12, de garantir padrões de consumo e de produção sustentáveis, no qual destaca-se a meta de reduzir substancialmente a geração de resíduos por meio da prevenção, redução, reciclagem e reuso, assim como, com o objetivo 15, de proteger, recuperar e promover o uso sustentável dos ecossistemas terrestres, gerir de forma sustentável as florestas, combater a desertificação, deter e rever a degradação da terra e deter a perda da biodiversidade.4 No Brasil, a quantidade de resíduos sólidos urbanos (RSU) coletada está em torno de 225.965 toneladas/dia,5 dos quais, cerca de 51,4% consistem em materiais orgânicos. Segundo a Política Nacional de Resíduos Sólidos (PNRS), é necessário que os municípios estabeleçam uma gestão integrada da fração orgânica dos resíduos, sendo que a compostagem é uma alternativa econômica e ambientalmente amigável.6,7 Estima-se que apenas 1,6% dos resíduos orgânicos seja encaminhado para compostagem, enquanto a maior parte é disposta em aterros controlados, aterros sanitários e lixões.8 O composto é o produto da compostagem e contém substâncias húmicas biologicamente estáveis, podendo ter diversas aplicações. Seu principal uso é o fornecimento de nutrientes para as plantas. Contudo, estudos também têm sido desenvolvidos no sentido de avaliar a capacidade de adsorção de metais potencialmente tóxicos (MPT) por este material.9-13 Neste contexto, a produção de materiais adsorventes eficientes e de baixo custo derivados do composto contribuiria tanto para a remediação das áreas contaminadas, quanto para o tratamento adequado e reutilização da fração orgânica dos RSU. Apesar dos resultados promissores, dependendo das condições de ensaio e do MPT analisado, as porcentagens de remoção podem variar consideravelmente.9-13 Para aumentar a eficiência de remoção de MPT e melhorar a estabilidade, processos de ativação ou modificação têm sido desenvolvidos e estudados em diversos resíduos e materiais orgânicos.14-19 Os processos de ativação envolvem desde tratamentos térmicos e químicos, com utilização de agentes ácidos ou alcalinos, até a adição de elementos com propriedades magnéticas ou adsorventes.17 A aplicação da ativação busca aprimorar o desempenho dos adsorventes, de modo que as eficiências alcançadas na retenção de MPT sejam comparáveis a produtos comercialmente disponíveis, mantendo-se um bom custo-benefício.18 Com relação ao composto derivado da fração orgânica dos RSU, não foram verificados estudos envolvendo a ativação do material com o objetivo de aumentar sua capacidade de adsorção de MPT. Deste modo, o presente estudo objetivou a produção de adsorventes eficientes e de baixo custo, por meio da ativação de composto orgânico por ácido fosfórico. Para isso, o método de ativação foi descrito e os resultados quanto a capacidade de adsorção de Pb e Cd, incluindo isotermas e mecanismos de adsorção, foram a seguir discutidos.
MATERIAIS E MÉTODOS Os resíduos orgânicos empregados na geração do composto foram principalmente restos de frutas, legumes e verduras (crus e sem tempero), cedidos por restaurantes parceiros do município de São Carlos (SP). Os resíduos foram triturados, homogeneizados e dispostos em leira. A composteira foi alimentada de forma intermitente com entradas semanais durante 1 mês, sendo que, ao final, a leira continha aproximadamente 250 kg de resíduos triturados. A composteira operou de novembro de 2017 até março de 2018, em condições externas estando, portanto, sujeita a influência do sol, vento e precipitações. Após maturados, o composto foi seco em temperatura ambiente e passado em peneira com abertura de 4# (4,76 mm), a fim de se retirar o excesso de matéria seca e resíduos grosseiros que não foram decompostos, como caroços. O material foi também quarteado, pelo método de pilhas alongadas, lavado com água deionizada, seco em temperatura de 60 a 65 ºC, destorroado e passado nas peneiras de 10# (2,00 mm) e 35# (0,50 mm) para seleção das partículas com dimensões entre 0,50 e 2,00 mm. A ativação consistiu no seguinte procedimento: aproximadamente 40,00 gramas de composto homogeneizado, lavado, seco e peneirado foram misturados com cerca de 220 mL de solução de H3PO4 1 mol L-1; o material e a solução ácida foram mantidos em contato por 12 horas sob temperatura controlada de 25 ºC; após o período de contato, a amostra foi filtrada e lavada com sucessivos enxágues de água deionizada até que o pH do filtrado permanecesse constante; em seguida, o material retido no filtro foi seco em estufa sob temperatura de 120 ºC por 1 h. A solução empregada na ativação foi preparada com ácido fosfórico P.A. (Orto), da marca Vetec, com concentração de 85% e densidade de 1,71 g mL-1. O material resultante do processo de ativação foi nomeado como composto ativado (CA). Ensaios de caracterização O CA foi caracterizado através da determinação dos seguintes parâmetros: potencial hidrogeniônico (pH);20 delta pH (ΔpH);21 ponto de carga zero (PCZ);21 potencial de óxido-redução (Eh);20 condutividade elétrica (CE);20 capacidade de troca catiônica (CTC);22 porcentagem de matéria orgânica e resíduo mineral;23 concentrações de potássio (K), fósforo (P), cálcio (Ca) e magnésio (Mg); composição elementar, em porcentagem, com relação a presença de carbono (C), hidrogênio (H), nitrogênio (N) e enxofre (S); e concentrações pseudo-totais de metais24 (incluindo Pb e Cd). Os grupos funcionais superficiais e a presença de minerais foram verificados, respectivamente, por meio dos ensaios de espectroscopia de infravermelho por transformada de Fourier (EITF) e difratometria de raios-X (DRX),25 antes e após o ensaio de equilíbrio em lote. Ensaios de equilíbrio em lote Os ensaios de equilíbrio em lote foram realizados para avaliar a capacidade de adsorção do CA em relação ao Pb e Cd. Esses metais foram escolhidos, pois estão associados a diversas contaminações no Brasil e no mundo. As soluções empregadas no ensaio foram preparadas a partir da diluição da respectiva solução-mãe, obtendo-se concentrações entre 20,11 e 889,20 mg L-1 de Pb e 1,56 e 667,50 mg L-1 de Cd. Para o preparo da solução-mãe de cada metal utilizou-se as seguintes soluções padrões: cloreto de cádmio (II) hemipentahidratado (pureza de 79,5-81%) e cloreto de chumbo (II) (pureza de 98%). O contato ocorreu entre 2,00 g de CA e 100 mL de solução com Pb ou Cd (na proporção de 1/50),13 sob constante agitação (120 rpm) e temperatura ambiente controlada em 25 ± 2 ºC. Após decorridos 24 h de agitação, as amostras foram centrifugadas por 10 min (2.500 rpm) e filtradas empregando-se papel filtro de gramatura 80 g m-2. Com o filtrado obtido, a determinação das concentrações de Pb e Cd foi realizada em espectrômetro de emissão ótica com plasma acoplado indutivamente (ICP-OES). Ao longo do processo de adsorção, o pH não foi ajustado e a variação deste parâmetro foi obtida pela medição do seu valor imediatamente após a mistura entre CA e a solução do respectivo metal (tempo 0) e depois de 24 h de contato. Os ensaios de equilíbrio em lote foram realizados em triplicata e cada conjunto de amostras foi acompanhado de brancos (contendo apenas a solução contaminante ou apenas o composto ativado e água deionizada). Isotermas de adsorção A partir dos resultados, buscou-se descrever o processo de adsorção por meio dos modelos matemáticos de Langmuir e Freundlich, avaliando-se o ajuste alcançado em relação aos dados experimentais e obtendo-se as respectivas isotermas de adsorção. O modelo de Langmuir assume que o adsorvente possui finitos e idênticos sítios, onde as moléculas e íons são adsorvidos e não exercem interferência nos adsorvatos vizinhos, bem como, não migram para outro sítio. A adsorção máxima ocorre quando todos os sítios foram ocupados formando uma monocamada de adsorvato.26,27 Nesse contexto, o adsorvato refere-se à molécula ou íon retidos e o adsorvente, ao material que interage com o adsorvato.27,28 A Equação 1 expressa matematicamente o modelo, onde qm é a capacidade máxima de adsorção por unidade de massa de adsorvente (mg g-1), KL é a constante de adsorção de Langmuir (L mg-1), relacionada com a entalpia do sistema, qe descreve a quantidade de adsorvato no equilíbrio por unidade de massa de adsorvente (mg g-1) e C, a concentração da substância presente na solução no equilíbrio (mg L-1).29  Para indicar a natureza do processo de adsorção, o fator de separação (RL) pode ser calculado a partir da concentração inicial de metal (C0) e pela constante de adsorção de Langmuir (KL), de acordo com a Equação 2.29  Sendo que, para RL igual a 1, a adsorção apresenta natureza linear e para RL igual a 0, trata-se de um processo irreversível. A adsorção é considerada favorável quando o RL resulta entre 0 e 1, enquanto, para valores acima de 1, considera-se o processo não favorável.29 O modelo de Freundlich fornece uma equação empírica (Equação 3), utilizada para descrever o comportamento da adsorção em sistemas com adsorventes com superfícies heterogeneamente energizadas e formação de multicamadas de adsorvatos.28  Este modelo também permite a análise da natureza do processo de adsorção, utilizando-se o inverso do coeficiente exponencial de Freundlich, sendo que para valores de 1/n maiores que 0 e menores que 1, a adsorção é considerada favorável. O processo seria não favorável para valores maiores que 1 e irreversível para resultados de 1/n iguais a 1.29 Mecanismos de adsorção Visando o entendimento acerca dos mecanismos que contribuíram para o processo de adsorção do Pb e do Cd nos materiais estudados, avaliou-se a alteração do pH ao longo do ensaio de equilíbrio em lote e as concentrações presentes de K, Na, Ca e Mg, ao final do ensaio.30-32 A variação do pH, ao longo da adsorção, foi obtida por meio da medição dos valores de pH no início do ensaio de equilíbrio em lote (tempo 0) e na sua finalização (após 24 h). Além disso, os ensaios de EITF e DRX foram conduzidos com os materiais antes e após ensaio de equilíbrio em lote.
RESULTADOS As principais características do CA estão listadas na Tabela 1. A fim de comparação, foi incluído a caracterização do mesmo composto homogeneizado e seco à 60-65 ºC (sem lavagem e ativação), sendo o material referido como composto original (CO).12,13
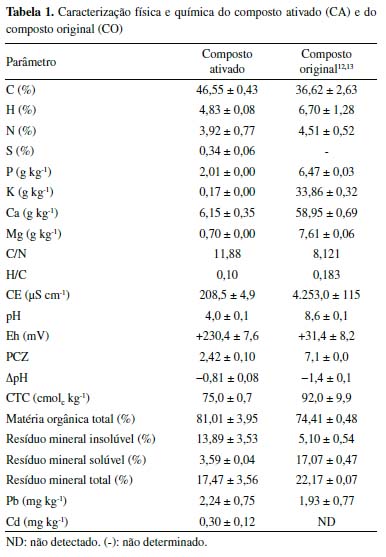
A partir dos resultados descritos na Tabela 1, verifica-se que o CA é constituído, principalmente, por C (46,55%), H (4,83%) e N (3,92%). O mesmo composto, não ativado, possui 36,62% de C, 6,70% de H e 4,51% de N em sua composição,12,13 indicando que a ativação com ácido fosfórico promoveu o aumento de C e a diminuição de N e H no material. Deste modo, a razão de C/N variou de 8,12 no CO para 11,88 no CA, e a razão H/C, diminuiu de 0,18 no CO para 0,10 no CA. A razão H/C representa a aromaticidade do adsorvente, sendo que, razões menores podem indicar maior aromaticidade e melhor estabilidade do material.12 O CA apresentou pH de 4,0 ± 0,1 e Eh de +230,4 ± 7,6 mV. Para o CO, empregando-se metodologias idênticas de determinação, o pH médio obtido foi de 8,6 ± 0,1 e o Eh foi de +31,4 ± 8,2 mV.12,13 Verifica-se que o processo de ativação foi responsável pela diminuição do pH em mais da metade do valor original, enquanto o Eh aumentou em cerca de 7 vezes no CA em comparação ao CO. Os valores positivos visualizados em ambos os materiais para o Eh não favorecem a mobilidade do Pb e Cd no ambiente. Por outro lado, as espécies ionizadas e mais móveis destes metais (Cd+2 e Pb+2) são predominantes em ambientes ácidos, dado a solubilidade destes metais em função do pH.33,34 Além disso, pelo princípio de Le Chatelier, em meios com concentração elevada de H+ (pH ácido), os grupos funcionais com hidrogênio presentes nas superfícies de materiais orgânicos encontram-se, preferencialmente, na sua forma deionizada, diminuindo a quantidade de sítios carregados negativamente, capazes de interagir com os cátions metálicos.35 Dessa forma, a adsorção de MPT, decorrida de forças eletrostáticas, pode ser menor no CA em comparação ao CO. Vale ressaltar que, este fato deve ser analisado em conjunto com o PCZ, parâmetro utilizado para análise das cargas superficiais existentes nos materiais, sendo que valores de pH acima do PCZ, indicam o predomínio de cargas superficiais negativas e, abaixo, de cargas positivas.36 Para o CA, o PCZ obtido foi de 2,4, indicando que, para valores de pH acima deste, o material apresenta predominantemente cargas superficiais negativas. Deste modo, mesmo para valores de pH caracterizados como ácidos, a retenção dos cátions de Pb e Cd pode ser favorável, desde que o pH esteja acima de 2,4. O valor de PCZ verificado nos estudos conduzidos com o CO foi de 7,1012,13 sugerindo que a capacidade de adsorção do material será maior em soluções alcalinas, com contribuição tanto da precipitação do Pb e Cd quanto das interações ocorridas entre estes metais e os grupos funcionais carregados negativamente. Em concordância, a partir dos valores negativos observados para o parâmetro de ΔpH, conclui-se que tanto o CO (em pH igual a 8,6) quanto o CA (em pH igual a 4,0) possuem, predominantemente, cargas superficiais negativas.13 Para caracterização dos grupos funcionais existentes nos materiais, apresenta-se os resultados de EITF na Figura 1.
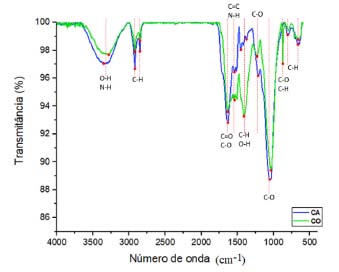 Figura 1. Ensaio de EITF: CO (composto original) e CA (composto ativado)
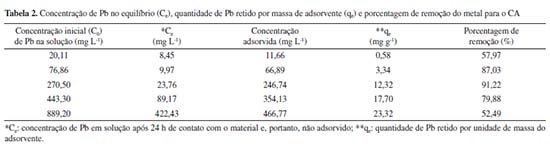
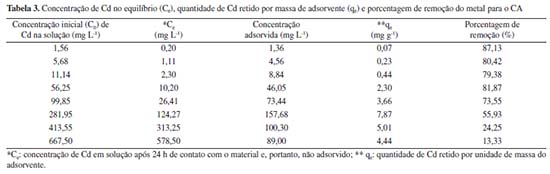
Observa-se que as bandas identificadas são similares em ambos os materiais, exceto pelos picos em 1412 cm-1 e em 873 cm-1, identificados exclusivamente no CO e correspondentes às estruturas alifáticas, ácidos carboxílicos ou grupos fenóis (C-H/O-H)37 e ao estiramento da ligação C-O ou à deformação da ligação aromática entre C-H (C-O/C-H),11,38 respectivamente. O desaparecimento destes picos no CA, sugere que a ativação ocasionou a degradação de parte da estrutura do CO, com perda de grupos funcionais. Outros picos identificados em ambos os materiais foram: 3350/3281 cm-1, atribuídos ao estiramento da ligação O-H (grupos hidroxilas, álcoois e fenóis) com possível contribuição de ligações N-H (grupos amina e amida) (O-H/N-H);11,39,40 2920 e 2851 cm-1, relacionados ao estiramento de ligações entre C e H de grupos alquila, como metileno, metil e metóxi (C-H);38,41-43 1633/1636 cm-1, correspondentes ao estiramento de ligações C=O de grupos carboxílicos, amida, cetonas, aldeídos e ésteres ou ao estiramento da ligação C-O de grupos carboxílicos ionizados (C=O/C-O);11,44,45 1542/1540 cm-1, decorridos da deformação da ligação N-H (grupos amina e amida) ou C=C aromático (C=C/N-H);40,46,47 1214/1229 cm-1, relacionados ao estiramento de C-O em éteres, álcoois e fenóis e deformação de OH em grupos carboxílicos (C-O);40,45,48,49 e 1056/1056 cm-1, atribuídos à ligação C-O de fenóis, álcoois, ésteres e éter (C-O), ou ainda, a grupos funcionais contendo P (PO2, P-OH).39,41,50,51 A presença de grupos funcionais contendo O pode ser considerado um importante fator para o bom desempenho dos adsorventes em relação aos MPT.52 Além da possível degradação da estrutura química do CO indicada pelo desaparecimento de grupos funcionais, observou-se que a ativação com ácido fosfórico e a realização de sucessivos enxágues causou a liberação de parte dos sais e dos elementos de maior mobilidade, de modo que a CE diminuiu de 4.253,0 µS cm-1 no CO para 208,5 µS cm-1 no CA e o resíduo mineral reduziu de 22,17 ± 0,07% no material original para 17,47 ± 3,56%, no ativado, sendo que, neste último material, os minerais insolúveis predominaram, enquanto que no CO, a maior parte do resíduo mineral encontrava-se em sua forma solúvel. Ainda nesse sentido, as concentrações de P, K, Ca e Mg foram reduzidas no material ativado em, respectivamente: 69%, 99%, 90% e 91%. Porém, essa modificação não impactou significativamente na CTC do CA. A CTC indica diretamente a quantidade de cátions trocáveis presentes na superfície de determinado material, ou seja, fornece informações sobre a quantidade de cátions em condições de serem permutados por outros.35 No caso do composto, o valor da CTC foi ligeiramente maior no CO em relação ao CA: 92,0 ± 9,9 cmolc kg-1 para o material original e 75,0 ± 0,7 cmolc kg-1. A degradação da estrutura química e a liberação dos sais e de elementos móveis, pode ser negativa ao reduzir o número de grupos funcionais disponíveis para complexação com os MPT, porém, pode também ser positiva caso esse processo resulte no aumento da porosidade e na área superficial do material. Por fim, ressalta-se que os valores verificados para Pb e Cd foram, respectivamente, 0,30 ± 0,12 mg kg-1 e 2,24 ± 0,75 mg kg-1 no CA. Estes valores são consideravelmente inferiores aos limites máximos admitidos em fertilizantes orgânicos segundo a Instrução Normativa nº 27/2016 (Pb: 150 mg kg-1 e Cd: 3,00 mg kg-1),53 assim como, aos valores de referência de qualidade do solo (VRQ) previstos na Decisão de Diretoria nº 195-2005-E da CETESB (Pb: 17 mg kg-1 e Cd: 0,5 mg kg-1).54 Adsorção de Pb e Cd O desempenho do CA na retenção de Pb e Cd foi avaliado por meio dos ensaios de equilíbrio em lote (Tabelas 2 e 3). A concentração inicial (C0) foi obtida por meio da análise em ICP-OES das amostras em branco, constituídas apenas pelas soluções de Pb e Cd.
A capacidade de adsorção do CA foi maior nas concentrações iniciais de Pb entre 76,86 e 443,30 mg L-1. Para estes casos, as porcentagens de remoção resultaram iguais ou acima de aproximadamente 80,00%. Para as concentrações iniciais de Pb de 20,11 e 889,20 mg L-1, as porcentagens de remoção foram de, respectivamente, 57,97 e 52,49% (Tabela 2). Nos ensaios conduzidos com soluções de Cd, de modo geral, a capacidade de adsorção do CA diminuiu com o aumento da concentração inicial do metal, alcançando apenas 13,33% de porcentagem de remoção na maior concentração inicial estudada (667,50 mg L-1) (Tabela 3). No geral, para o composto ativado, as porcentagens de remoção variaram de 52,49 a 91,22% para o Pb, considerando as concentrações iniciais de 20,11 a 889,20 mg L-1. O mesmo material, em contato com solução com Cd em concentrações iniciais de 1,56 a 667,50 mg L-1, apresentou porcentagens de remoção de 13,33 a 87,13%. Em estudo realizado com o CO, observou-se porcentagens de remoção entre 45 e 100% para as concentrações iniciais de Cd de aproximadamente 1, 5, 10, 50, 100, 300, 500 e 1.000 mg L-1, sendo que, para as concentrações menores ou iguais a 300 mg L-1, a retenção foi de 100,00% em todas as amostras. Da mesma forma que no CA, as porcentagens de remoção diminuíram em função do aumento da concentração inicial de Cd. Considerando as concentrações iniciais de Pb de 50, 100, 300, 500 e 1.000 mg L-1 as porcentagens de remoção no CO resultaram em 58,9%, 46,6%, 68,3%, 77,4% e 87,5%, respectivamente. Enquanto no CA, a maior porcentagem de remoção (de 91,22%) ocorreu para a concentração de 270,50 mg L-1, no CO, a máxima retenção (87,5%) foi verificada na maior concentração inicial de Pb (1.000 mg L-1). Isotermas de adsorção As isotermas de adsorção descrevem graficamente a relação dinâmica de equilíbrio entre a quantidade do MPT que permanece em solução (Ce) e a quantidade adsorvida por unidade de massa do adsorvente (qe). A Tabela 4 apresenta as constantes de Langmuir e de Freundlich e os respectivos coeficientes de determinação obtidos para os ensaios de equilíbrio em lote conduzidos com CA e soluções contendo Cd e Pb. Além disso, as Figuras 2 e 3 exibem as isotermas de adsorção para o Pb e para o Cd, respectivamente.
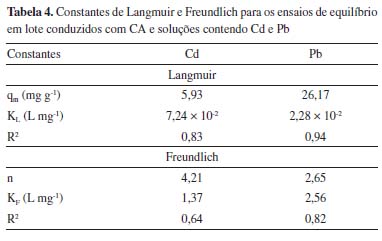
 Figura 2. Isoterma de adsorção com valores experimentais obtidos nos ensaios conduzidos com o CA e soluções de Pb e isotermas de Langmuir e Freundlich (não linearizadas)
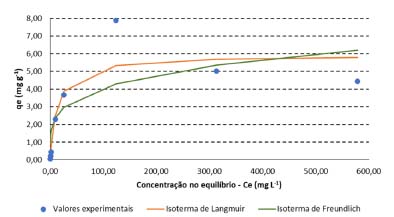 Figura 3. Isoterma de adsorção com valores experimentais obtidos nos ensaios conduzidos com o CA e soluções de Cd e isotermas de Langmuir e Freundlich (não linearizadas)
A isoterma de Langmuir apresentou melhor ajuste aos dados experimentais obtidos com o CA, tanto para o Pb quanto para o Cd. Conforme Tabela 2, verifica-se que os valores experimentais de qe aumentaram continuamente em função do acréscimo da concentração inicial de Pb. Deste modo, a isoterma de Langmuir da Figura 2 indica o início de um platô, com tendência de crescimento após concentrações de 889,20 mg L-1, de modo que o valor de qe pode alcançar o qm calculado de 26,17 mg g-1. Para o Cd, observa-se, na isoterma de Langmuir, a formação de uma região bem definida de menor inclinação - platô (Figura 3). Este fato em conjunto com o valor obtido para o qm de 5,93 mg g-1 sugere que o material está próximo da saturação para as concentrações iniciais acima de 281,95 mg L-1 de Cd. Na Figura 3, também é possível observar a existência de um resultado experimental que se apresentou destoante à isoterma de Langmuir. Para esta isoterma, decorrente deste valor, o coeficiente de determinação resultou em apenas 0,83, apesar de ter sido o modelo com melhor ajuste (Tabela 4). Considerando todas as concentrações iniciais estudadas, o fator de separação (RL) calculado pela Equação 2 variou, nos ensaios de adsorção de Pb, de 0,05 a 0,69, enquanto nos ensaios de adsorção de Cd, resultou entre 0,02 e 0,90. Como os valores se apresentam entre 0 e 1, o processo de adsorção, para ambos os metais, pode ser interpretado como favorável. Mecanismos de adsorção Nos ensaios conduzidos com soluções preparadas de Cd e Pb, foi verificada a diminuição do pH após 24 h de contato com o CA. Com isso, por meio da diferença entre o pH no tempo 0 e após 24 h, foi calculado a quantidade de íons H+ liberados ao longo do processo de adsorção (Tabela 5). Neste caso, a ocorrência de reações de complexação envolvendo Pb e Cd, como as descritas nas Equações 4 e 5, podem explicar a liberação de íons H+ e a diminuição do pH durante o ensaio de equilíbrio em lote.30-32,55 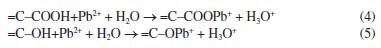
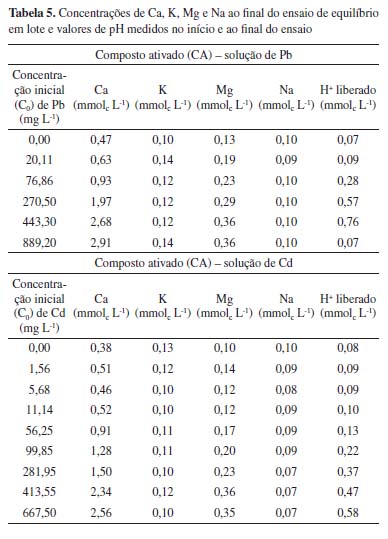
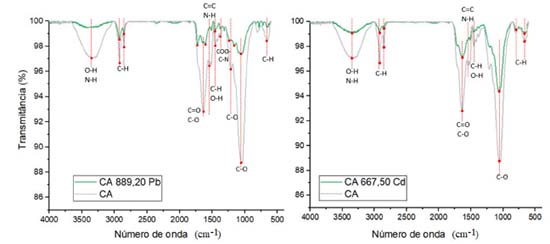
Além disso, diante das concentrações de Ca e Mg verificadas após o equilíbrio (contato de 24 h com o composto ativado), pode-se observar que, possivelmente, a troca catiônica apresenta grande importância na adsorção do Pb e Cd, visto que houve um aumento considerável da quantidade dos cátions em solução em função do aumento da concentração inicial destes metais. As concentrações de Na e K também foram determinadas, porém mantiveram-se aproximadamente similares entre as amostras dos ensaios de equilíbrio em lote (Tabela 5). Vale ressaltar que as concentrações de K, Na, Ca e Mg também foram analisadas por ICP-OES nas soluções preparadas de Pb e Cd (sem mistura com o composto ativado), sendo que os resultados variaram de 0,00 a 0,08 mmolc L-1 para o Ca, de 0,01 a 0,05 mmolc L-1 para o K, 0,00 a 0,002 mmolc L-1 para o Mg e 0,03 a 0,07 mmolc L-1 para o Na. Diante de tais resultados, conclui-se que concentrações elevadas destes cátions nas amostras após contato por 24 h com o CA foi proveniente exclusivamente do próprio adsorvente e das interações entre os materiais e as soluções de Pb e Cd. A análise de EITF no CA antes e após ensaio de equilíbrio em lote (com solução de concentração inicial de Pb de 889,20 mg L-1) demonstrou que houve redução na intensidade da maioria dos picos e/ou uma ligeira alteração no número de onda verificado, demonstrando que houve interações entre os metais e os grupos funcionais superficiais (Figura 4).40,51 Ressalta-se, após a adsorção do Pb, houve uma expressiva diminuição ou até o desaparecimento dos seguintes picos: 3350 cm-1 (O-H/N-H);11,39,40 1633/1605 cm-1 (C=O/C-O);11,44,45 e 1056/1060 cm-1 (C-O).50,51 Outros picos que também apresentaram alterações, foram: 2920/2924 e 2851/2855 cm-1 (C-H);38,41-43 1454/1458 cm-1 (C-O/C-H)42,45 e 1214/1240 cm-1 (C-O).40,45,48,49
Da mesma forma, observa-se a diminuição dos picos após ensaio de adsorção com o CA e solução contendo Cd na concentração de 667,50 mg L-1 (Figura 4). Neste caso, as bandas que se destacaram pela mudança foram: 3350 cm-1 (O-H/N-H);11,39,40 2919 e 2851 cm-1 (C-H);38,41-43 1633/1605 cm-1 (C=O/C-O);11,44,45 e 1056/1060 cm-1 (C-O).50,51 Deste modo, evidencia-se a relevância dos grupos funcionais contendo O na adsorção de Pb e Cd no CA. As mudanças nos picos anteriormente mencionados, para os dois metais analisados, indicam que os grupos ácidos, carboxila e hidroxila, são contribuintes predominantes na captação destes íons metálicos. Além do EITF, foram realizados ensaios de DRX (Figura 5). Comparando os resultados antes e após adsorção, não foi observado o surgimento de novos picos, indicando que, para o CA, a precipitação não foi um mecanismo de adsorção relevante, o que pode estar relacionado ao pH ácido das amostras.
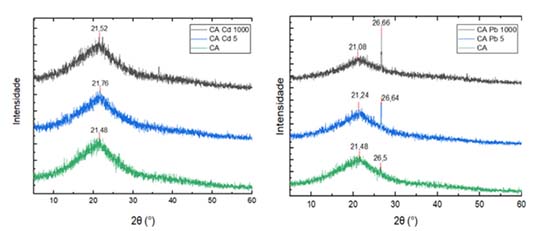 Figura 5. Difratogramas resultantes do ensaio de DRX com CA antes e após ensaio de equilíbrio em lote com soluções de Cd e Pb
De acordo com as análises, pode-se concluir que os principais mecanismos envolvidos na adsorção do Cd e Pb no CA foram as reações de troca catiônica e a complexação com grupos funcionais superficiais. No composto de torta de cana, também observou-se o predomínio destas reações.56
CONCLUSÃO O composto ativado se apresentou como um material orgânico (81,01% de matéria orgânica), de pH ácido em água, contendo grupos funcionais, como álcoois e carboxílicos, capazes de atuar na adsorção de metais por meio da complexação. Além disso, em função do valor reduzido do PCZ, para valores de pH acima de 2,4, os grupos funcionais ocorrem, predominantemente, na sua forma ionizada (carregados negativamente), favorecendo a retenção de Pb2+ e Cd2+ por meio da atração eletrostática. Apesar do contato com o ácido e os sucessivos enxágues diminuírem a concentração de cátions, a CTC resultante foi próxima à obtida no material original. Diante de tais características, o potencial de adsorção do composto ativado foi avaliado pelos ensaios de equilíbrio em lote, onde as porcentagens de remoção variaram de 52,49 a 91,22% para o Pb (concentrações iniciais de 20,11 a 889,20 mg L-1) e de 13,33 a 87,13% para o Cd (concentrações iniciais de 1,56 a 667,50 mg L-1). Em comparação com o material original, a ativação não resultou no aumento da capacidade de adsorção de Cd. Porém, para o Pb nas concentrações iniciais intermediárias (entre 76,86 e 443,30 mg L-1) foi observado uma melhora no desempenho do composto após ativação. A isoterma de Langmuir apresentou melhor ajuste aos dados experimentais obtidos com o CA, tanto para o Pb quanto para o Cd, e o processo de adsorção foi caracterizado como favorável de acordo com o fator de separação de Langmuir (RL). Os mecanismos de adsorção foram, especialmente, reações de troca catiônica e complexação com os grupos funcionais contendo oxigênio. O possível aproveitamento do composto, tanto ativado como sem ativação, na adsorção de MPTs, contribui para a minimização da fração orgânica do RSU, seguindo, portanto, os princípios da economia circular.
AGRADECIMENTOS O presente trabalho foi realizado com apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brasil (CAPES) - Código de Financiamento 001. Os autores agradecem também a Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) (Processo nº 2017/16961-0) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) (Processo nº 310989/2020-5- Bolsa de Produtividade em Pesquisa).
REFERÊNCIAS 1. Blomsma, F.; Brennan, G.; J.Ind. Ecol. 2017, 21, 603. [Crossref] 2. Murray, A.; Skene, K.; Haynes, K.; Journal of Business Ethics 2017, 140, 369. [Crossref] 3. https://www.ellenmacarthurfoundation.org/, acessada em maio 2023. 4. https://brasil.un.org/pt-br/sdgs, acessada em maio 2023. 5. https://abrelpe.org.br/panorama/, acessada em maio 2023. 6. BRASIL. Lei nº 12.305, de 2 de agosto de 2010. [Link] acessado em maio 2023 7. BRASIL. Decretonº10.936, de 12 de janeiro de 2022. [Link} acessado em maio 2023 8. Instituto de Pesquisa Econômica Aplicada (IPEA); Diagnóstico dos Resíduos Sólidos Urbanos: Relatório de Pesquisa, Brasília, 2012. [Link] acessado em maio 2023 9. Shah, G. M.; Imran, M.; Bakhat, H. F.; Hammad, H. M.; Ahmad, I.; Rabbani, F.; Khan, Z. U. H. J.; Environ. Sci. Technol. 2019, 16, 3839. [Crossref] 10. Lima, J. Z.; Raimondi, I. M.; Schalch, V.; Rodrigues, V. G.; J. Environ. Manage. 2018, 226, 386. [Crossref] 11. Lima, J. Z.; Lupion, R. M.; Raimondi, I. M.; Pejon, O. J.; Rodrigues, V. G. S.; Sustainability 2021, 13, 12847. [Crossref] 12. Lima, J. Z.; da Silva, E. F.; Patinha, C.; Durães, N.; Vieira, E. M.; Rodrigues, V.; Environ. Res. 2022, 204, 111988. [Crossref] 13. Lima, J. Z.; da Silva, E. F.; Patinha, C.; Rodrigues, V.; J. Environ. Manage. 2022, 321, 115968. [Crossref] 14. Ngah, W. W.; Hanafiah, M. A. K. M.; Bioresour. Technol. 2008, 99, 3935. [Crossref] 15. Tan, G.; Yuan, H.; Liu, Y.; Xiao, D.; J. Hazard. Mater. 2010, 174, 740. [Crossref] 16. Bulgaria, L.; Bulgaria, D.; Macoveanu, M.; Sep. Sci. Technol. 2011, 46, 1023. [Crossref] 17. Rajapaksha, A. U.; Chen, S. S.; Tsang, D. C.; Zhang, M.; Vithanage, M.; Mandal, S.; Gao, B.; Bolan, N. S.; Ok, Y. S.; Chemosphere 2016, 148, 276. [Crossref] 18. Ogunlalu, O.; Oyekunle, I. P.; Iwuozor, K. O.; Aderibigde, A. D.; Emenike, E. C.; Curr. Res. Green Sustainable Chem. 2021, 4, 100188. [Crossref] 19. Mirmohammadmakki, F.; Gharaschorloo, M.; Ghavami, M.; Abdossi, V.; Azizinezhad, R.; Biomass Convers. Biorefin. 2022, 12, 1. [Crossref] 20. Embrapa; Manual de Métodos de Análise de Solo, Rio de Janeiro, 2011. [Link] acessado em maio 2023 21. Keng, J. C. W.; Uehara, G.; Soils and Crop ScienceSociety of Florida 1973, 33, 119. [Link] acessado em maio 2023 22. Ministério da Agricultura, Pecuária e Abastecimento (MAPA); Manual de Métodos Analíticos Oficiais para Fertilizantes e Corretivos, Brasília, 2017. [Link] acessado em maio 2023 23. Alcarde, J. C.; Manual de Análise de Fertilizantes, 1a ed.; FEALQ: Piracicaba, 2009. 24. Moraes, T. T.: Biocarvão de Poda como Adsorvente de Chumbo (Pb) e Cádmio (Cd): Caracterização, Ensaios de Equilíbrio em Lote e Avaliação da Fitotoxicidade; Dissertação de Mestrado, Universidade de São Paulo, São Paulo, Brasil, 2022. 25. Lima, J. Z.: Caracterização Geológica-Geotécnica e Estudo da Adsorção de Pb, Zn e Cd por Turfa e Compostos Orgânicos; Dissertação de Mestrado, Universidade de São Paulo, São Paulo, Brasil, 2022. [Link] acessado em maio 2023 26. Largitte, L.; Pasquier, R.; Chem. Eng. Res. Des. 2016, 109, 495. [Crossref] 27. Fomina, M.; Gadd, G. M.; Bioresour. Technol. 2014, 160, 3. [Crossref] 28. Weber, W. J. J.; Physicochemical Processes for Water Quality Control, 1st ed.; Wiley: New York, 1972. 29. Al-Ghouti, M. A.; Da'ana, D. A.; J. Hazard. Mater. 2020, 393, 122383. [Crossref] 30. Wang, Z.; Liu, G.; Zheng, H.; Li, F.; Ngo, H. H.; Guo, W.; Liu, C.; Chen, L.; Xing, B.; Bioresour. Technol. 2015, 177, 308. [Crossref] 31. Cui, X.; Fang, S.; Yao, Y.; Li, T.; Ni, Q.; Yang, X.; He, Z.; Sci. Total Environ. 2016, 562, 517. [Crossref] 32. Deng, J.; Liu, U.; Liu, S.; Zeng, G.; Tan, X.; Huang, B.; Tang, X.; Wang, S.; Hua, Q.; Yan, Z.; J. Colloid Interface Sci. 2017, 506, 355. [Crossref] 33. Sheng, G.; Wang, S.; Hu, J.; Lu, Y.; Li, J.; Dong, Y.; Wang, X.; Colloids Surf., A 2009, 339, 159. [Crossref] 34. Liu, H.; Gao, Q.; Dai, P.; Zhang, J.; Zhang, C.; Bao, N.; J. Anal. Appl. Pyrolysis 2013, 102, 7. [Crossref] 35. Knox, R. C.; Sabatini, D. A.; Cartes, L. W.; Subsurface Transport and Fate Processes, 1st ed.; CRC Press: Boca Raton, 1993. 36. Zhou, Z.; Liu, Y. G.; Liu, S. B.; Liu, H. Y.; Zeng, G. M.; Tan, X. F.; Yang, C. P.; Yang, D.; Cai, X. X.; Chem. Eng. Technol. 2017, 314, 223. [Crossref] 37. Anastopoulos, I.; Massas, I.; Ehaliotis, C.; Chem. Eng. Technol. 2013, 231, 245. [Crossref] 38. Shakoor, M. B.; Niazi, N. K.; Bibi, I.; Shahid, M.; Saqib, Z. A.; Nawaz, M. F.; Shaheen, S.; Wang, H.; Tsang, D.; Bundschuh, J.; Ok, Y.; Rinklebe, J.; Environ. Int. 2019, 123, 567. [Crossref] 39. Huang, Y.; Li, S.; Chen, J.; Zhang, X.; Chen, Y.; Appl. Surf. Sci. 2014, 293, 160. [Crossref] 40. Meseguer, V. F.; Ortuño, J. F.; Aguilar, M. I.; Pinzón-Bedoya, M. L.; Lloréns, M.; Sáez, J.; Pérez-Marín, A. B.; Environ. Sci. Pollut. Res. 2016, 23, 24032. [Crossref] 41. Tang, Y.; Chen, L.; Wei, X.; Yao, Q.; Li, T.; J. Hazard. Mater. 2013, 244, 603. [Crossref] 42. Raimondi, I. M.: Turfa, Composto de Torta de Cana-de-Açúcar e Zeólitas como Sorventes de Pb, Cd e Zn: Equilíbrio em Lote, Cinética, Dessorção e Bioacessibilidade; Tese de Doutorado, Universidade de São Paulo, São Paulo, Brasil, 2019. 43. Pennanen, T.; Srivastava, V.; Sillanpää, M.; Sainio, T.; J. Cleaner Prod. 2020, 273, 122736. [Crossref] 44. Díaz-Muñoz, L. L.; Bonilla-Petriciolet, A.; Reynel-Ávila, H. E.; Mendoza-Castillo, D. I.; J. Mol. Liq. 2016, 215, 555. [Crossref] 45. Silvetti, M.; Demurtas, D.; Garau, G.; Deiana, S.; Castaldi, P.; Clean: Soil, Air, Water 2017, 45, 1. [Crossref] 46. Droussi, Z.; D'orazio, V.; Provenzano, M. R.; Hafidi, M.; Ouatmane, A.; J. Hazard. Mater. 2009, 164, 1281. [Crossref] 47. Licona-Aguilar, Á. I.; Torres-Huerta, A. M.; Domínguez-Crespo, M. A.; Palma-Ramírez, D.; Conde-Barajas, E.; Negrete-Rodríguez, M. X. L.; Rodríguez-Salazare, A. E.; García-Zaleta, D. S.; Sci. Total Environ. 2022, 831, 154883. [Crossref] 48. Milojković, J. V.; Stojanović, M. D.; Mihajlović, M. L.; Lopičić, Z. R.; Petrović, M. S.; Šoštarić, T. D.; Ristić, M. Đ.; Water, Air, Soil Pollut. 2014, 225, 1. [Crossref] 49. Sadeek, S. A.; Negm, N. A.; Hefni, H. H.; Wahab, M. M. A.; Int. J. Biol. Macromol. 2015, 81, 400. [Crossref] 50. Melo, D. Q.; Vidal, C. B.; da Silva, A. L.; Teixeira, R. N.; Raulino, G. S. C.; Medeiros, T. C.; Fechine, P. B. A.; Mazzeto, S. E.; Keukeleire, D.; Nascimento, R. F.; J.Appl. Polym. Sci. 2014, 131, 40883. [Crossref] 51. Reynel-Avila, H. E.; Mendoza-Castillo, D. I.; Olumide, A. A.; Bonilla-Petriciolet, A.; J. Mol. Liq. 2016, 224, 1041. [Crossref] 52. Uchimiya, M.; Chang, S.; Klasson, K. T.; J. Hazard. Mater. 2011, 190, 432. [Crossref] 53. BRASIL. Instrução Normativa SDA nº 27, 05 de junho de 2006. [Link] acessado em maio 2023 54. Companhia de Tecnologia de Saneamento Ambiental (CETESB); Decisão de Diretoria nº 195-2005, de 23 de novembro de 2005. [Link] acessado em maio 2023 55. Cao, X.; Ma, L.; Gao, B.; Harris, W.; Environ. Sci. Technol. 2009, 43, 3285. [Crossref] 56. Raimondi, I. M.; Rodrigues, V. G. S.; Lima, J. Z.; Marques, J. P.; Vaz, L. A. A.; Water, Air, Soil Pollut. 2020, 231, 365. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access