Revisão
|
|
| O gênero Fridericia (Bignoniaceae): composição química e potencial biológico The genus Fridericia (Bignoniaceae): chemical composition and biological potential |
|
Camila Y. HenriqueI; Osvaine J. A. AlvesI; Márcio L. A. e SilvaI; Wilson R. CunhaI; Ana H. JanuarioI; Patrícia M. PaulettiI,*
I. Núcleo de Pesquisa em Ciências Exatas e Tecnológicas, Universidade de Franca, 14404-600 Franca - SP, Brasil Recebido em: 14/03/2023 *e-mail: patricia.pauletti@unifran.edu.br The genus Fridericia belongs to the family Bignoniaceae and comprises 60 species that occur in humid to dry forests, cerrado, and caatinga vegetation. It may be found from Mexico to Argentina and southern Brazil. This article reviews studies conducted on this genus, primarily focusing on its chemical composition and biological activities. Of the 60 known Fridericia species, only 14 have been the object of chemical and biological studies, accounting for 23% of the researched species. Eighty-four compounds, mainly flavonoids, terpenes, xanthones, and phenylethanoids, have been isolated from these species. The biological properties described in this review include antimicrobial, antioxidant, anti-inflammatory, hepatoprotective, antiviral, healing, antiproliferative, trypanocidal, and antileishmania activities. Notably, the species F. chica has been the most studied, as it is listed in the National List of Medicinal Plants of Interest to the Brazilian Unified Health System (RENISUS). INTRODUÇÃO O gênero Fridericia pertence à família Bignoniaceae que inclui 80 gêneros e 840 espécies que estão distribuídas principalmente em regiões pantropicais.1 Na mais recente classificação, realizada com base em análise filogenética molecular, Fridericia está disposta na tribo Bignonieae, a maior tribo da família, que agrupa 21 gêneros e 393 espécies. Fridericia inclui 60 espécies que ocorrem em florestas úmidas a secas, cerrado e vegetações de caatinga, do México à Argentina e sul do Brasil. Plantas deste gênero pertenciam ao gênero polifilético Arrabidaea que foi reclassificado e as espécies realocadas nos gêneros: Cuspidaria, Fridericia, Tanaecium e Xylophragma.2,3 Além disso, estudo filogenético de Fridericia reportou sete clados, pelas características morfológicas, Acrodromous venation (2 espécies), Fridericia s. str. (24 espécies), Neomacfadya (12 espécies), Petastoma (7 espécies), Piriadacus (2 espécies), Sampaiella (7 espécies) e Tanaecioid (5 espécies).3 Este trabalho teve como objetivo compilar informações sobre o uso popular, a fitoquímica e o potencial biológico de plantas de Fridericia. Esta revisão traz dados das bases SciFinder e Web of Science usando como palavras-chaves Arrabidaea e Fridericia, a pesquisa foi realizada levando-se em conta o período de 1945 até 2023. Os artigos encontrados foram depois selecionados de acordo com a nova classificação filogenética, isto é, apenas as espécies classificadas no gênero Fridericia tiveram seus artigos selecionados para discussão. Este trabalho vem também fornecer subsídios adicionas a artigos de revisão de Batalha et al.4 sobre a planta medicinal F. chica e Nascimento et al.5 sobre o gênero Arrabidaea. Uso tradicional Das plantas do gênero Fridericia estudadas, a que tem maior destaque sobre seu uso popular é a F. chica (Bonpl.) L.G. Lohmann, conhecida também pelos nomes populares: "Cipó-pau", "Cipó-cruz", "Carapiranga", "Carajeru", "Crejer", "Pariri", "Crajiru", "Carajuru" ou "Carajiru", ela é muito comum na região amazônica e é utilizada como analgésico, anti-inflamatório, antianemico,6 adstringente, no tratamento de cólica intestinal, diarreia, leucorreia, leucemia, afecções da pele e cicatrização de feridas.7 Estudo etnofarmacológico, no Mato Grosso, no Vale do Juruena, indicou que F. chica é empregada também no tratamento de queixas geniturinárias, queixas de saúde da mulher, febre, dores e reumatismo.8 Outro estudo etnobotânico e etnofarmacológico, no Amapá, na várzea do Rio Mazagão, indicou algumas formas de utilização desta planta medicinal. As folhas de F. chica são aplicadas em lavagem de feridas, anemia, diarreia, pele amarelada e corpo inchado de gestante, preparado em decocção e maceração, 1 xícara três vezes ao dia durante 7 dias. Além disso, as indicações terapêuticas observadas também foram para malária, distúrbios cardiovasculares, parasitas, distúrbios renais, hepáticos e biliares e doenças metabólicas.9 Além destas aplicações, as folhas de F. chica possuem uso pelos índios brasileiros como corante em pinturas corporais.10 Essa planta figura na lista da Relação Nacional de Plantas Medicinais de Interesse ao Sistema Único de Saúde (RENISUS), lista lançada em 2009 e que impulsionou as pesquisas científicas com F. chica.11 A segunda espécie de destaque no gênero em termos de número de estudos foi F. platyphylla (Cham.) L.G. Lohmann ou "Cipó-una", as suas raízes são usadas na medicina tradicional no sudeste e nordeste do Brasil para pedras nos rins e dores nas articulações.12 Fridericia rego (Vell.) L.G. Lohmann ou "Cipó-rego", uma planta muito pouco investigada, é empregada na medicina popular em infecções da pele e para gonorreia.7 Cabe destacar também que F. elegans (Vell.) L.G. Lohmann pertence à um grupo muito importante de plantas tóxicas para animais de produção, por afetarem o funcionamento do coração devido à presença principalmente do composto monofluoroacetato de sódio, e causa grandes perdas econômicas para a pecuária.13 Fitoquímica Das 60 espécies de Fridericia, apenas 11 foram investigadas em estudos químicos tradicionais de isolamento, onde as plantas estudadas pertencem aos clados: Acrodromous venation: F. platyphylla e F. prancei (A.H. Gentry) L.G. Lohmann; Fridericia s. str.: F. candicans (Rich.) L.G. Lohmann, F. caudigera (S. Moore) L.G. Lohmann, F. chica e F. speciosa Mart.; Neomacfadya: F. triplinervia (Mart. ex DC.) L.G. Lohmann; Petastoma: F. formosa (Bureau) L.G. Lohmann, F. patellifera (Schltdl.) L.G. Lohmann e F. samydoides (Cham.) L.G. Lohmann, e Tanaecioid: F. elegans. Apenas as plantas do clado Piriadacus não foram estudadas. Nesses trabalhos descreveram-se 84 substâncias, a parte do vegetal de onde foram isolados os metabólitos secundários, a espécie e o nome das substâncias estão apresentados na Tabela 1.
Substâncias pertencentes à classe das benzofenonas, feniletanóide glicosídeos, fenilpropanóide glicosídeos, flavonoides, terpenos, xantonas e diversos foram isoladas no gênero Fridericia. A proporção da ocorrência destas classes é mostrada na Figura 1.
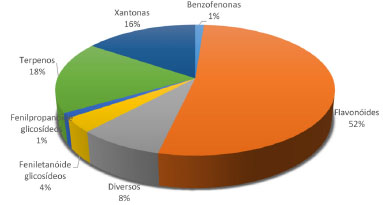 Figura 1. Distribuição por classe de metabólitos secundários das 84 substâncias isoladas no gênero Fridericia
As estruturas químicas das 84 substâncias isoladas encontram-se ilustradas nas Figuras 2-7. Análise dos dados coletados permitiu concluir que 44 destes produtos naturais pertenciam à classe dos flavonoides (Figura 2), onde seis são antocianinas, dezoito são flavonas, cinco são flavonols, uma flavanona, quatro chalconas e dez biflavonoides com estrutura não usual, sendo com isso a classe de metabólitos secundários mais abundantes em Fridericia e com ampla distribuição nas plantas investigadas. Entretanto, os biflavonoides com estrutura incomum até o presente momento foram relatados nas espécies F. prancei e F. platyphylla que estão localizadas no mesmo grupamento (Acrodromous venation).36 Estes flavonoides diméricos, brachydinas A (55), B (56) e C (57), foram avaliados em relação ao seu comportamento eletroquímico e os dados mostraram que os processos de oxidação são favorecidos em pH mais alto e o transporte de massa controlado por difusão. A brachydina A oxidou-se no menor valor de potencial (0,48 V) e brachydina B e brachydina C mostraram os maiores potenciais de oxidação, 0,71 V e 0,57 V, respectivamente.43
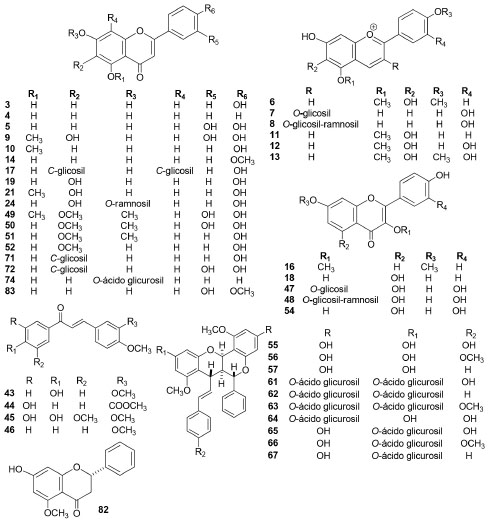 Figura 2. Estrutura química dos flavonoides isolados de espécies de Fridericia
Em seguida aparecem os terpenos com quinze substâncias isoladas (Figura 3), onde nove são triterpenos pentacíclicos e seis monoterpenos da classe dos iridoides. Os iridoides aparecem restritos à F. elegans, porém esta espécie encontra-se no clado Tanaecioid, que possuem uma colocação filogenética incerta.3
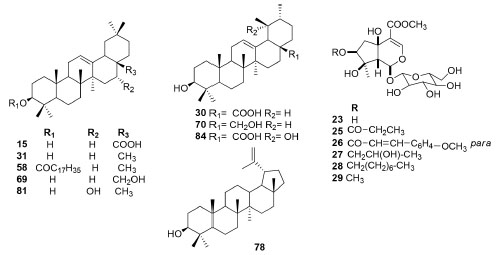 Figura 3. Estrutura química dos terpenos isolados de espécies de Fridericia
As xantonas C-glicosiladas isoladas (Figura 4) foram treze, sendo o terceiro maior grupo de metabólitos. Os dados aqui apresentados indicam que essa classe de substâncias parece estar restrita as espécies F. samydoides, F. patellifera e F. formosa e que estão localizadas no mesmo clado (Petastoma). Cabe destacar que isolou-se a mangiferina (32) com elevado rendimento 8,3%38 e 9,0%40 em relação ao extrato bruto, 32 ocorre também nas famílias Anacardiaceae (manga) e Gentianaceae.44,45 A descrição da benzofenona (75)39 em F. samydoides constitui um dado interessante, pois é um dos intermediários na biossíntese das xantonas.
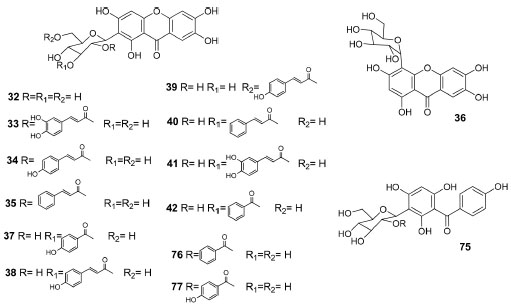 Figura 4. Estrutura química das xantonas e benzofenona isoladas de espécies de Fridericia
Três substâncias da classe dos glicosídeos feniletanoides foram isolados juntamente com um glicosídeo fenilpropanoide (Figura 5). A classe dos glicosídeos feniletanoides são um grupo de substâncias solúveis em água e ocorrem em várias famílias de plantas, inclusive em outros gêneros de Bignoniaceae (Campsis chinensis (Lam.) Voss, Deplanchea speciosa Vieill).46 Neste estudo identificou-se esta classe em F. samyoides e F. platyphylla que encontram-se em clados distintos, isto é, em Petastoma e Acrodromous. Assim, do ponto de vista quimiotaxonômico, não estabeleceu-se uma ocorrência restrita para esta classe de produtos naturais em Fridericia. Um destaque pode ser dado ainda para a ocorrência desta classe de metabólitos em outras plantas da tribo Bignonieae, como é o caso para Cuspidaria pulchra (Cham.) L.G.Lohmann, sinonímia Arrabidaea pulchra (Cham.) Sandwith, de onde isolou-se o verbascosídeo (53),47 Xylophragma harleyi (A. H. Gentry ex M. M. Silva & L. P. Queiroz) L. G. Lohmann, sinonímia Arrabidaea harleyi A. H. Gentry, de onde descreveu-se a mistura do verbascosídeo (53) e isoverbascosídeo48 e também de Bignonia hyacinthina (Standl.) Sandwith.46 As duas espécies, C. pulchra e X. harleyi, na nova classificação proposta por Lohmann e Taylor,2 encontram-se realocadas em outros gêneros: Cuspidaria e Xylophragma, respectivamente.
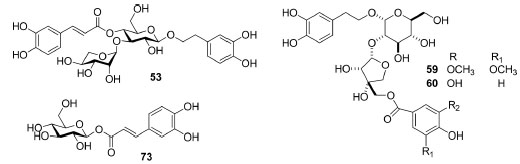 Figura 5. Estrutura química dos glicosídeos feniletanoides e glicosídeos fenilpropanoides isolados de espécies de Fridericia
Nos dados levantados, encontrou-se também substâncias contendo nitrogênio, trans-4-hidroxiprolina betaina (1), glicina betaina (2), alantoina (22) e trigonelina (68) e os fitoesteroides (Figura 6).
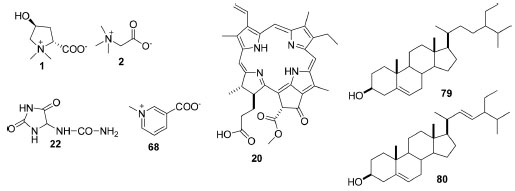 Figura 6. Estrutura química de classes diversas isoladas de espécies de Fridericia
ESTUDOS METABOLÔMICOS O desenvolvimento das técnicas hifenadas que acoplam a separação cromatográfica, cromatografia líquida de alta performace (ultra performance liquid chromatography - UPLC), cromatografia líquida de alta eficiência (high performance liquid chromatography - HPLC) e cromatografia gasosa (gas chromatography - GC) a detectores, principalmente de espectrometria de massas (mass spectrometry - MS), DAD (diode array detector) e ultravioleta visível (UV-Vis), contribuiu de modo importante para avaliar a qualidade, o perfil dos constituintes químicos e autenticidade dos extratos vegetais de modo rápido, fornecendo confiabilidade e repetibilidade das pesquisas farmacológicas com plantas.49,50 No Brasil, o uso destas ferramentas também aumentou, porém Berlinck et al.51 destacam que estes estudos devem tentar aprofundar em questões relacionadas aos organismos em junção com as características químicas, deste modo não ficando apenas em aspectos da composição química. Outra ferramenta importante para o estudo do metabolismo secundário de plantas é a análise por redes moleculares (molecular networking) que permite o trabalho com muitos dados, emprega dados espectrais fornecidos e ajuda na identificação de padrões nas amostras, permitindo a rápida identificação das classes de substâncias presentes e anotação das conhecidas.52 Estas técnicas hifenadas também têm sido aplicadas em estudos de Fridericia, com destaque novamente para F. chica, e permitiram traçar um perfil da composição química dos extratos bioativos. Normalmente, estes estudos combinavam atividade biológica do extrato com a determinação do perfil químico. Um dos primeiros estudos realizados usando este tipo de abordagem para Fridericia utilizou espectrometria de massa por inserção direta do extrato etanólico das folhas de F. chica de três variedade cultivadas pela Embrapa Amazônia Ocidental. Os autores estabeleceram as impressões digitais com base na presença das substâncias carajurina (6), carajurona (11), 5-metil-6-hidroxiluteolinidina (12) e 5,4'-dimetil-6-hidroxiluteolinidina (13) o que permitiu diferenciar as variedades estudadas (Tabela 2).53
Por HPLC-DAD-ESI-MS/MS analisou-se o extrato bruto (etanol-água 9:1, v/v) das folhas de F. chica, os dados obtidos possibilitaram a identificação de seis flavonas: apigenina (3), luteolina (5), scutellareina (19), hispidulina (52), isoscutellareina e 6-hidroxiluteolina (Tabela 2).54 Uma fração obtida a partir do extrato hexânico das folhas de F. chica passou por análise de GC-MS, o que permitiu a identificação das substâncias: ácido n-hexadecanóico, fitol, ácido linoleico, ácido linolênico metil éster, ácido octadecanoico, ácido eicosanoico, vitamina E, campesterol, sitosterol (79) e estigmasterol (80) (Tabela 2).55 Gemelli et al.56 extraíram, por infusão em água e em seguida por partição com n-butanol, as partes aéreas de F. chica e avaliaram por HPLC-UV, os dados permitiram confirmar a presença das substâncias: ácido gálico, ácido elágico, luteolina (5) e rutina (48). Em outro estudo com o extrato hidroetanólico das folhas de F. chica, também por HPLC-MS, identificou-se vinte e duas substâncias por desreplicação: luteolina (5), carajurina (6), 5-metil-6-hidroxiluteolinidina (12), 5,4' dimetil-6-hidroxiluteolinidina (13), kaempferol (18), feoforbideo A (20), hispidulina (52), 2'-hidroxi-α-naftoflavona, catequina, 5,7-dimetoxi-4'-hidroxi flavona, epicatequina, quercetina-O-galato, quercetina-O-glicosideo, amentoflavona, isorhamnetina-3-O-glicosideo, chrisoeriol, chrisoeriol-O-glicosideo, isorhamnetina, 6-hidroxiluteolina, cirsimarina, hiperina-6"-galato e catequina dímero (Tabela 2).57 Examinou-se o perfil de carotenoides por técnicas hifenadas (HPLC-DAD-MS) no extrato acetônico das folhas de F. chica o que permitiu a identificação da (13 Z)-violaxatina, (todas E)-violaxantina; (todas E)-luteoxantina; Z-luteina, epoxicarotenoide, (todas E)-luteina, (todas-E)-zeaxantina (13 Z)-β-caroteno, (todas-E)-α-caroteno, (todas-E)-β-caroteno e (9Z)-β-caroteno. Neste mesmo trabalho, verificou-se o perfil dos compostos fenólicos no extrato metanol/água (8:2 v/v) das folhas, identificou-se dois isômeros da feruloil hexose, um derivado feruloíla, scutellarin, apigenina glucuronídeo, um derivado flavona glucuronídeo, metil apigenina glucuronídeo, apigenina (3) e scutellareina (19) (Tabela 2).58 Analisou-se por UPLC-MS o extrato etanol-água (7:3, v/v) das folhas de F. chica o que possibilitou a detecção da apigenina (3), carajurina (6), 5-metil-6-hidroxiluteolinidina (12), 5,4' dimetil-6-hidroxiluteolinidina (13), scutellareina (19), 5-O-metilscutellareina (21), hispidulina (52), 6,7,3',4'-tetrahidroxi-5-metoxiflavilium-O-glucuronideo, scutellareina-O-glucuronideo e 5-metil-scutellareina-O-glucuronideo (Tabela 2).59 O extrato etanólico das folhas de F. chica foi examinado por UPLC-MS e os dados obtidos permitiram anotar as substâncias: apigenina (3), 5-O-metilscutellareina (21), hispidulina (52), vicenina-2, 6-hidroxiluteolina-7-rhamnosideo, scutellareina-O-glucuronideo, nepetina, pectolinarigenina, thevetiaflavona (10) e acacetina (14) (Tabela 2).60 Os resultados de UPLC-HRMS possibilitaram a detecção da fórmula molecular de trinta e nove flavonoides (Tabela 2) do extrato etanólico das folhas de F. chica. Os dados de fragmentação, os espectros de ultravioleta e dados de RMN permitiram a caracterização parcial das estruturas destas substâncias pelos autores, que identificaram uma série de flavonas e antocianidinas já descritas em F. chica.61 Estudo este que confirma a prevalência desta classe de produtos naturais em F. chica. A partir das análises por UPLC-HR ESI MS/MS das folhas de F. chica identificaram-se vinte e sete substâncias do extrato etanólico e apenas uma substância do extrato aquoso. No extrato etanólico, das substâncias identificadas 10 eram alcaloides, 6 terpenoides, 9 flavonoides e um ácido graxo (Tabela 2). Segundo os autores, uma das substâncias poderia ser uma antraquinona ou flavonoide. No extrato aquoso dessa mesma espécie identificou-se uma benzoquinona alquilada (Tabela 2).62 Análise por GC-GC-MS do extrato hexânico, diclorometano e acetato de etila das folhas F. elegans foram anotadas 55 substâncias, com base na comparação com a biblioteca de espectros de massas NIST 2005, entre elas hidrocarbonetos lineares e ramificados, ácidos graxos, metil ésteres de ácidos graxos, álcoois de cadeia longa, alcalóides, vitaminas, glicosídeos, compostos aromáticos e compostos com enxofre (Tabela 2).26 Estudo por GC-MS de F. elegans confirmou a presença do composto monofluoroacetato de sódio (Tabela 2).63 Carvalho et al.64 estudaram as espécies F. cinnamomea (DC.) L.G. Lohmann e F. nigrescens (Sandwith) L.G. Lohmann que pertencem ao clado Sampaiella apenas com ferramentas hifenadas. Neste trabalho, analisou-se por GC-MS o extrato da cera cuticular das folhas de F. cinnamomea, F. nigrescens, F. prancei e F. triplinervia, os dados permitiram identificar n-alcanos, álcoois primários, α-amirina, ácido ursólico (30) e sitosterol (79) (Tabela 2). Apenas nas amostras de F. triplinervia não identificou-se o 30. As substâncias presentes na cera cuticular das folhas foram identificadas por comparação da fragmentação de massas usando a bilbioteca de espectros digital NIST 2.0 (2008). Os n-alcanos foram caracterizados com base na comparação do tempo de retenção com a série homóloga C19-C40. Empregou-se a análise por LC-DAD-MS nos extratos das folhas e caules de F. samydoides e os dados possibilitaram a detecção de dezenove flavonas (Tabela 2), entre elas C-glicosil flavonas, O-glicosil flavonas e agliconas, a presença de xantonas também foi confirmada sendo o total de quinze (Tabela 2), corroborando resultados de estudos anteriores sobre a presença de xantonas em F. samydodes.38
PROPRIEDADES BIOLÓGICAS A Tabela 3 detalha as atividades biológicas dos extratos de espécies de Fridericia que passaram por ensaios biológicos in vitro e em modelos animais. Estes testes incluem principalmente atividade antimicrobiana, antioxidante, tripanocida, anti-inflamatória, cicatrizante de feridas e antiviral. O maior número de estudos desta natureza foi realizado em F. chica seguida de F. platyphylla, numa clara tentativa dos grupos de pesquisa do Brasil em colaborar com o aumento das informações sobre esta planta medicinal.
Semissíntese A halogenação direta de compostos fenólicos presentes no extrato diclorometano das raízes de F. platyphylla efetuou-se com NaBr, NaI e NaCl em meio aquoso e com o objetivo principal de obter novos derivados das substâncias: brachydina A (55), brachydina B (56) e brachydina C (57) uma vez que estas substâncias apresentaram diversas atividades biológicas, entre elas, atividade tripanocida33 e leishmanicida.102 Os autores otimizaram as condições das reações em pequena escala para a obtenção de derivados mono, di ou trihalogenados (Figura 7) e então fizeram o isolamento por HPLC-UV semipreparativo. Os derivados halogenados preparados apresentaram atividade para os parasitas: Leishmania amazonensis e Trypanosoma cruzi.103
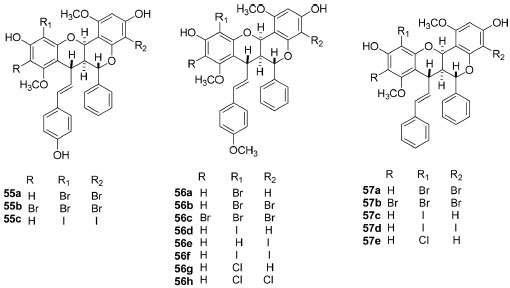 Figura 7. Estrutura química dos derivados semissintéticos obtidos de F. platyphylla
CONCLUSÕES Apenas algumas plantas do gênero Fridericia, que possui cerca de 60 espécies concentradas do México à Argentina, apresentam investigação de seus metabólitos e atividades biológicas. Com base nos dados obtidos, pode-se concluir que a maioria dos trabalhos associou o perfil químico, por meio de técnicas hifenadas, com a avaliação farmacológica, concentrando-se principalmente em F. chica, uma planta medicinal de interesse para o Sistema Único de Saúde. Isso justifica o grande interesse no estudo dessa espécie. Portanto, estudos futuros poderiam ser direcionados para outras espécies de Fridericia. Os flavonoides são metabólitos frequentes e amplamente distribuídos nas espécies estudadas do gênero e a presença de biflavonoides incomuns, juntamente com as xantonas, permitiram estabelecer um padrão de distribuição destas classes de substâncias em Fridericia corroborando com a classificação proposta.1-3
AGRADECIMENTOS Ao CNPq, à CAPES e à FAPESP (2017/24860-0) pelas bolsas de estudo. À FAPESP pelos auxílios financeiros (2013/09280-6 e 2016/10313-4).
REFERÊNCIAS 1. Lohmann, L. G.; Iheringia, Ser. Bot. 2018, 73, 157. [Crossref] 2. Lohmann, L. G.; Taylor, C. M.; Ann. Mo. Bot. Gard. 2014, 99, 348. [Crossref] 3. Kaehler, M.; Michelangeli, F. A.; Lohmann, L. G.; Taxon 2019, 68, 751. [Crossref] 4. Batalha, A. D. S. J.; Souza, D. C. M.; Ubiera, R. D.; Chaves, F. C. M.; Monteiro, W. M.; da Silva, F. M. A.; Koolen, H. H. F.; Boechat, A. L.; Sartim, M. A.; Biomolecules 2022, 12, 1208. [Crossref] 5. do Nascimento, J. R.; Miranda, A. J. A.; Vieira, F. C.; Rodrigues, C. D. P.; Vasconcelos, L. N.; Pereira Filho, J. L.; Lopes, A. C. C. B.; Tangerina, M. M. P.; Vilegas, W.; da Rocha, C. Q.; Pharmaceuticals 2022, 15, 658. [Crossref] 6. Silva, E. M.; Souza, J. N. S.; Rogez, H.; Rees, J. F.; Larondelle, Y.; Food Chem. 2007, 101, 1012. [Crossref] 7. Brandão, G. C.; Kroon, E. G.; dos Santos, J. R.; Stehmann, J. R.; Lombardi, J. A.; de Oliveira, A. B.; Rev. Bras. Farmacogn. 2010, 20, 742. [Crossref] 8. Bieski, I. G. C.; Leonti, M.; Arnason, J. T.; Ferrier, J.; Rapinski, M.; Violante, I. M. P.; Balogun, S. O.; Pereira, J. F. C. A.; Figueiredo, R. D. C. F.; Lopes, C. R. A. S.; da Silva, D. R.; Pacini, A.; Albuquerque, U. P.; Martins, D. T. O.; J. Ethnopharmacol. 2015, 173, 383. [Crossref] 9. Sarquis, R. S. F. R.; Sarquis, I. R. Sarquis, I. R.; Fernandes, C. P.; da Silva, G. A.; Silva, R. B. L.; Jardim, M. A. G.; Sánchez-Ortíz, B. L.; Carvalho, J. C. T.; J. Evidence-Based Complementary Altern. Med. 2019, 2019, 6087509. [Crossref] 10. Devia, B.; Llabres, G.; Wouters, J.; Dupont, L.; Escribano-Bailon, M. T.; de Pascual-Teresa, S.; Angenot, L.; Tits, M.; Phytochem. Anal. 2002, 13, 114. [Crossref] 11. Rezende, M. A.; Oliveira, A. C. D.; Rev. Fitos 2019, 13, 126. [Crossref] 12. Alcerito, T.; Barbo, F. E.; Negri, G.; Santos, D. Y. A. C.; Meda, C. I.; Young, M. C. M.; Chávez, D.; Blatt, C. T. T.; Biochem. Syst. Ecol. 2002, 30, 677. [Crossref] 13. Nascimento, N. C. F.; Aires, L. D. A.; Pfister, J. A.; Medeiros, R. M. T.; Riet-Correa, F.; Mendonça, F. S.; Pesquisa Veterinária Brasileira 2018, 38, 1239. [Crossref] 14. Adrian-Romero, M.; Blunden, G.; Patel, A. V.; Armstrong, N.; Meléndez, P.; Cuervo, A. C.; Nat. Prod. Commun. 2007, 2, 863. [Crossref] 15. Torres, C. A.; Nuñez, M. B.; Isla, M. I.; Castro, M. P.; Gonzalez, A. M.; Zampini, I. C.; J. Herb. Med. 2017, 8, 24. [Crossref] 16. Scogin, R.; Biochem. Syst. Ecol. 1980, 8, 273. [Crossref]] 17. Takemura, O. S.; Iinuma, M.; Tosa, H.; Miguel, O. G.; Moreira, E. A.; Nozawa, Y.; Phytochemistry 1995, 38, 1299. [Crossref] 18. Zorn, B.; García-Pieres, A. J.; Castro, V.; Murillo, R.; Mora, G.; Merfort, I.; Phytochemistry 2001, 56, 831. [Crossref] 19. Barbosa, W. L. R.; Pinto, L. D. N.; Quignard, E.; Vieira, J. M. D. S.; Silva, J. O. C.; Albuquerque, S.; Rev. Bras. Farmacogn. 2008, 18, 544. [Crossref] 20. Siraichi, J. T. G.; Pedrochi, F.; Natali, M. R. M.; Ueda-Nakamura, T.; Dias Filho, B. P.; Bento, A. C.; Baesso, M. L.; Nakamura, C. V.; Appl. Spectrosc. 2013, 67, 1179. [Crossref] 21. Miranda, N.; Gerola, A. P.; Novello, C. R.; Ueda-Nakamura, T.; Silva, S. O.; Dias-Filho, B. P.; Hioka, N.; de Mello, J. C. P.; Nakamura, C. V.; Photodiagn. Photodyn. Ther. 2017, 19, 256. [Crossref] 22. Lima, J. C. S.; de Oliveira, R. G.; Silva, V. C.; de Sousa, P. T.; Violante, I. M. P.; Macho, A.; Martins, D. T. O.; Nat. Prod. Res. 2020, 34, 726. [Crossref] 23. Krebs, H. C.; Zeitschrift für Naturforschung B 1987, 42b, 1361. [Crossref] 24. Krebs, H. C.; Zeitschrift für Naturforschung B 1991, 46b, 1258. [Crossref] 25. Ali, S. M.; Uzair, S. S.; Krebs, H. C.; Jahangir, M.; Habermehl, G. G.; Phytochemistry 2000, 55, 359. [Crossref] 26. Wahid, S.; Versiani, M. A.; Jahangir, S.; Jawaid, K.; Shafique, M.; Khan, H.; Faizi, S.; Chem. Biodiversity 2017, 14, e1700222. [Crossref] 27. Brandão, G. C.; Kroon, E. G.; Souza Filho, J. D.; Oliveira, A. B.; J. Trop. Med. 2017, 2017, 6106959. [Crossref] 28. Martin, F.; Hay, A. E.; Cressend, D.; Reist, M.; Vivas, L.; Gupta, M. P.; Carrupt, P. A.; Hostettmann, K.; J. Nat. Prod. 2008, 71, 1887. [Crossref] 29. Rezende Júnior, L. M.; Andrade, L. M. S.; Leal, A. L. A. B.; Mesquita, A. B. S.; Santos, A. L. P. A. D.; Lima Neto, J. S.; Siqueira Júnior, J. P.; Nogueira, C. E. S.; Kaatz, G. W.; Coutinho, H. D. M.; Martins, N.; da Rocha, C. Q.; Barreto, H. M.; Antibiotics 2020, 9, 351. [Crossref] 30. Blatt, C. T. T.; dos Santos, M. D.; Salatino, A.; Plant Syst. Evol. 1998, 210, 289. [Crossref] 31. Bertanha, C. S.; Gimenez, V. M. M.; Furtado, R. A.; Tavares, D. C.; Cunha, W. R.; Silva, M. L. A. E.; Januario, A. H.; Borges, A.; Kawano, D. F.; Parreira, R. L. T.; Pauletti, P. M.; J. Braz. Chem. Soc. 2020, 31, 849. [Crossref] 32. da Rocha, C. Q.; Vilela, F. C.; Cavalcante, G. P.; Santa-Cecília, F. V.; Silva, L. S.; dos Santos, M. H.; Paiva, A. G.; J. Ethnopharmacol. 2011, 133, 396. [Crossref] 33. da Rocha, C. Q.; Queiroz, E. F.; Meira, C. S.; Moreira, D. R. M.; Soares, M. B. P.; Marcourt, L.; Vilegas, W.; Wolfender, J. L.; J. Nat. Prod. 2014, 77, 1345. [Crossref] 34. da Rocha, C. Q.; Vilela, F. C.; Santa-Cecília, F. V.; Cavalcante, G. P.; Vilegas, W.; Paiva, A. G.; dos Santos, M. H.; Rev. Bras. Farmacogn. 2015, 25, 228. [Crossref] 35. da Rocha, C. Q.; de Faria, F. M.; Marcourt, L.; Ebrahimi, S. N.; Kitano, B. T.; Ghilardi, A. F.; Ferreira, A. L.; de Almeida, A. C. A.; Dunder, R. J.; Souza-Brito, A. R. M.; Hamburger, M.; Vilegas, W.; Queiroz, E. F.; Wolfender, J. L.; Phytochemistry 2017, 135, 93. [Crossref] 36. Carvalho, J. C. S.; Lohmann, L. G.; Ferreira, M. J. P.; Biochem. Syst. Ecol. 2022, 105, 104533. [Crossref] 37. Pauletti, P. M.; Bolzani, V. S.; Young, M. C. M.; Quim. Nova 2003, 26, 641. [Crossref] 38. da Fonseca, J. M.; Reis, A. C. C.; Pereira, G. R.; de Moura, H. M. M.; Souza-Filho, J. D.; Silva, B. M.; Brandão, G. C.; Braz. J. Pharm. Sci. 2022, 58, e18802. [Crossref] 39. Pauletti, P.: Constituintes Químicos de Arrabidaea samydoides (Bignoniaceae): Uma Contribuição para a Pesquisa de Bioprospecção da Flora Paulista; Tese de Doutorado, Universidade Estadual Paulista, Araraquara, São Paulo, 2004. [Crossref] acessado em julho 2023 40. Pauletti, P. M.; Castro-Gamboa, I.; Silva, D. H. S.; Young, M. C. M.; Tomazela, D. M.; Eberlin, M. N.; Bolzani, V. D. S.; J. Nat. Prod. 2003, 66, 1384. [Crossref] 41. Milani, R. R.; Alves, O. J. A.; Bertanha, C. S.; Gimenes, V. M. M.; Squarisi, I. S.; Nicolella, H. D.; Pagotti, M. C.; Tavares, D. C.; Silva, M. L. A.; Cunha, W. R.; Magalhães, L. G.; Januario, A. H.; Pauletti, P. M.; Quim. Nova 2020, 43, 1404. [Crossref] 42. Leite, J. P. V.; Oliveira, A. B.; Lombardi, J. A.; Souza Filho, J. D.; Chiari, E.; Biol. Pharm. Bull. 2006, 29, 2307. [Crossref] 43. do Nascimento, J. R.; Ribeiro, G. A. C.; Serrano, S. H. P.; de Lima, R. B.; Tanaka, A. A.; da Silva, I. S.; da Rocha, C. Q.; J. Braz. Chem. Soc. 2021, 32, 1286. [Crossref] 44. Correia, S. D. J.; David, J. P.; David, J. M.; Quim. Nova 2006, 29, 1287. [Crossref] 45. Kshirsagar, P. R.; Gaikwad, N. B.; Pai, S. R.; Bapat, V. A.; S. Afr. J. Bot. 2017, 108, 81. [Crossref] 46. Jiménez, C.; Riguera, R.; Nat. Prod. Rep. 1994, 11, 591. [Crossref] 47. Alvarenga, T. A.; Bertanha, C. S.; de Oliveira, P. F.; Tavares, D. C.; Gimenez, V. M. M.; Silva, M. L. A.; Cunha, W. R.; Januário, A. H.; Pauletti, P. M.; Nat. Prod. Res. 2015, 29, 1083. [Crossref] 48. Lima, C. S. A.; de Amorim, E. L. C.; de Sena, K. X. F. R.; Chiappeta, A. A.; Nunes, X. P.; Agra, M. F.; da Cunha, E. V. L.; da Silva, M. S.; Barbosa-Filho, J. M.; Braz. J. Pharm. Sci. 2003, 39, 77. [Crossref] 49. Li, C.; Wang, Y.; Crit. Rev. Anal. Chem. 2022, 21, 1. [Crossref] 50. Klein-Junior, L. C.; de Souza, M. R.; Viaene, J.; Bresolin, T. M. B.; de Gasper, A. L.; Henriques, A. T.; Heyden, Y. V.; Planta Med. 2021, 87, 964. [Crossref] 51. Berlinck, R. G. S.; Borges, W. S.; Scotti, M. T.; Vieira, P. C.; Quim. Nova 2017, 40, 706. [Crossref] 52. Pilon, A. C.; Vieira, N. C.; Amaral, J. G.; Monteiro, A. F.; da Silva, R. R.; Spíndola, L. S.; Castro-Gamboa, I.; Lopes, N. P.; Quim. Nova 2021, 44, 1168. [Crossref] 53. Schiozer, A. L.; Cabral, E. C.; de Godoy, L. A. F.; Chaves, F. C. M.; Poppi, R. J.; Riveros, J. M.; Eberlin, M. N.; Barata, L. E. S.; J. Braz. Chem. Soc. 2012, 23, 409. [Crossref] 54. Siraichi, J. T. G.; Felipe, D. F.; Brambilla, L. Z. S.; Gatto, M. J.; Terra, V. A.; Cecchini, A. L.; Cortez, L. E. R.; Rodrigues Filho, E.; Cortez, D. A. G.; PLoS One 2013, 8, e72733. [Crossref] 55. Rodrigues, I. A.; Azevedo, M. M. B.; Chaves, F. C. M.; Alviano, C. S.; Alviano, D. S.; Vermelho, A. B.; BioMed Res. Int. 2014, 2014, 985171. [Crossref] 56. Gemelli, T. F.; Prado, L. S.; Santos, F. S.; de Souza, A. P.; Guecheva, T. N.; Henriques, J. A. P.; Ferraz, A. B. F.; Corrêa, D. S.; Dihl, R. R.; Picada, J. N.; J. Toxicol. Environ. Health, Part A 2015, 78, 1170. [Crossref] 57. Vasconcelos, C. C.; Lopes, A. J. O.; Sousa, E. L. F.; Camelo, D. S.; Lima, F. C. V. M.; da Rocha, C. Q.; Silva, G. E. B.; Garcia, J. B. S.; Cartágenes, M. S. S.; Int. J. Mol. Sci. 2019, 20, 4717. [Crossref] 58. de Siqueira, F. C.; Leitão, D. S. T. C.; Mercadante, A. Z.; Chisté, R. C.; Lopes, A. S.; Food Res. Int. 2019, 126, 108597. [Crossref] 59. Takenaka, I. K. T.; Amorim, J. M.; de Barros, P. A. V.; Bradão, G. C.; Contarini, S. M. L.; Melo, E. L. S. S.; Leite, C. M. A.; Martins, F. S.; Cardoso, V. N.; Castilho, R. O.; Fernandes, S. O. A.; Rev. Bras. Farmacogn. 2020, 30, 559. [Crossref] 60. Alvarez-Ortega, N.; Caballero-Gallardo, K.; Taboada-Alquerque, M.; Franco, J.; Stashenko, E. E.; Juan, C.; Juan-García, A.; Olivero-Verbel, J.; Toxins 2021, 13, 748. [Crossref] 61. da Cruz, A. F. G.; Reis, A. C. C.; Sousa, J. A. C.; Vaz, L. B. A.; Silva, B. M.; Magalhães, C. L. B.; Kohlhoff, M.; de Oliveira, A. B.; Bradão, G. C.; Molecules 2022, 27, 6043. [Crossref] 62. Carvalho, C. M.; de Almeida Neto, S. G.; Reis, C. L. F.; de Freitas, J. M. R.; Camargo, K. C.; de Aguilar, M. G.; Riccardi, A. F. A.; de Sousa, G. F.; Rev. Virtual Quim. 2023, no prelo. [Crossref] 63. Santos-Barbosa, J. M.; Lee, S. T.; Cook, D.; Gardner, D. R.; Viana, L. H.; Ré, N.; J. Agric. Food Chem. 2017, 65, 1428. [Crossref] 64. Carvalho, J. C. S.; Frazão, A.; Lohmann, L. G.; Ferreira, M. J. P.; Biochem. Syst. Ecol. 2021, 98, 104325. [Crossref] 65. Torres, C. A.; Zampini, I. C.; Nuñez, M. B.; Isla, M. I.; Castro, M. P.; Gonzalez, A. M.; Nat. Prod. Res. 2013, 27, 2144. [Crossref] 66. Torres, C. A.; Zamora, C. M. P.; Nuñez, M. B.; Gonzalez, A. M.; J. Integr. Med. 2018, 16, 255. [Crossref] 67. Michel, A. F. R. M.; Melo, M. M.; Campos, P. P.; Oliveira, M. S.; Oliveira, F. A. S.; Cassali, G. D.; Ferraz, V. P.; Cota, B. B.; Andrade, S. P.; Souza-Fagundes, E. M.; J. Ethnopharmacol. 2015, 165, 29. [Crossref] 68. Ribeiro, A. F. C.; Telles, T. C.; Ferraz, V. P.; Souza-Fagundes, E. M.; Cassali, G. D.; Carvalho, A. T.; Melo, M. M.; Rev. Bras. Farmacogn. 2012, 22, 364. [Crossref] 69. Coe, F. G.; Parikh, D. M.; Johnson, C. A.; Pharm. Biol. 2010, 48, 439. [Crossref] 70. Olivero-Verbel, J.; la Parra-Guerra, A. D.; Caballero-Gallardo, K.; Sierra-Marquez, L.; Fuentes-Lopez, K.; Franco-Marmolejo, J.; Jannasch, A. S.; Sepulveda, M. S.; Stashenko, E.; Comp. Biochem. Physiol., Part C: Toxicol. Pharmacol. 2021, 244, 109026. [Crossref] 71. Brandão, D. C.; Lima, P. M. A. P.; Martins, I. C.; Cordeiro, C. S.; Cordeiro, A. O.; Vecchi, L.; Guerra, J. F. C.; Orsolin, P. C.; Gazolla, M. C.; Costa, D. S.; da Silva Filho, A. A.; Araújo, T. G.; BMC Complementary Med. Ther. 2022, 22, 18. [Crossref] 72. Höfling, J. F.; Anibal, P. C.; Obando-Pereda, G. A.; Peixoto, I. A. T.; Furletti, V. F.; Foglio, M. A.; Gonçalves, R. B.; Brazilian Journal of Biology 2010, 70, 1065. [Crossref] 73. de Sá, J. C.; Almeida-Souza, F.; Mondêgo-Oliveira, R.; Oliveira, I. S. S.; Lamarck, L.; Magalhães, I. F. B.; Ataídes-Lima, A. F.; Ferreira, H. S.; Abreu-Silva, A. L.; BMC Complementary Altern. Med. 2016, 16, 1. [Crossref] 74. Machado Júnior, R. J.; Camilli, J. C.; Basting, R. T.; Zago, P. M. W.; Sousa, I. M. D. O.; Buglio, K. E.; Ruiz, A. L. T. G.; Carvalho, P. R. N.; de Carvalho, J. E.; Saad, S. T. O.; Foglio, M. A.; Nat. Prod. Res. 2022, 13, 1. [Crossref] 75. Kohn, L. K.; Foglio, M. A.; Rodrigues, R. A.; Sousa, I. M. O.; Martini, M. C.; Padilla, M. A.; de Lima Neto, D. F.; Arns, C. W.; Revista Brasileira de Ciência Avícola 2015, 17, 275. [Crossref] 76. Vasconcelos, C. C.; Lopes, A. J. O.; Ataide, E. J. G.; Carvalho, K. W. P.; de Brito, M. F. F.; Rodrigues, M. S.; de Morais, S. V.; Silva, G. E. B.; da Rocha, C. Q.; Garcia, J. B. S.; Cartágenes, M. S. S.; Inflammopharmacology 2021, 29, 735. [Crossref] 77. Violante, I. M. P.; Carollo, C. A.; Silva, L. I.; Oliveira, A. Q. C.; Pardinho, F. C.; Garcez, W. S.; Garcez, F. R.; de Oliveira, R. G.; Arunachalam, K.; Martins, D. T. O.; Nat. Prod. Res. 2021, 35, 5287. [Crossref] 78. Mafioleti, L.; da Silva Junior, I. F.; Colodel, E. M.; Flach, A.; Martins, D. T. O.; J. Ethnopharmacol. 2013, 150, 576. [Crossref] 79. Martins, F. J.; Caneschi, C. A.; Vieira, J. L. F.; Barbosa, W.; Raposo, N. R. B.; J. Photochem. Photobiol., B 2016, 161, 34. [Crossref] 80. Ribeiro, F. M.; Volpato, H.; Lazarin-Bidóia, D.; Desoti, V. C.; de Souza, R. O.; Fonseca, M. J. V.; Ueda-Nakamura, T.; Nakamura, C. V.; Silva, S. O.; J. Photochem. Photobiol., B 2018, 178, 175. [Crossref] 81. de Siqueira, F. C.; Costa-Leitão, D. S. T.; Mercadante, A. Z.; Chisté, R. C.; Lopes, A. S.; Food Res. Int. 2019, 126, 108597. [Crossref] 82. Lopes, G. F. M.; Lima, W. G.; Santos, F. R. S.; Nunes, D. A. F.; Passos, M. J. F.; Fernandes, S. O. A.; de Magalhães, J. C.; dos Santos, L. L.; J. Ethnopharmacol. 2022, 299, 115685. [Crossref] 83. Rocha, K. B. F.; Oliveira, C. N.; Azevedo, I. M.; de Macedo, R.; Medeiros, A. C.; Acta Cirúrgica Brasileira 2019, 34, e201901001. [Crossref] 84. Barreto, M. S. O.; Carvalho, J. L.; Michel, A. F. R. M.; Corrêa, N. C. R.; Silva, F. C.; Gomes, D. A.; Goes, A. M.; Melo, M. M.; Arq. Bras. Med. Vet. Zootec. 2021, 73, 513. [Crossref] 85. de Medeiros, B. J. L.; Costa, K. S.; Ribeiro, J. F. A.; Silva, J. O. C.; Barbosa, W. L. R.; Carvalho, J. C. T.; Pharmacogn. Res. 2011, 3, 79. [Crossref] 86. Silva-Silva, J. V. S.; Moragas-Tellis, C. J.; Chagas, M. S. S.; Souza, P. V. R.; Moreira, D. L.; Hardoim, D. J.; Taniwaki, N. N.; Costa, V. F. A.; Bertho, A. L.; Brondani, D.; Zapp, E.; de Oliveira, A. S.; Calabrese, K. S.; Behrens, M. D.; Souza, F. A.; Pharmaceuticals 2022, 15, 331. [Crossref] 87. Silva-Silva, V.; Moragas-Tellis, C. J.; Chagas, M. S. S.; Souza, P. V. R.; Moreira, D. L.; de Souza, C. S. F.; Teixeira, K. F.; Cenci, A. R.; de Oliveira, A. S.; Souza, F. A.; Behrens, M. D.; Calabrese, K. S.; Biomed. Pharmacother. 2021, 141, 111910. [Crossref] 88. Zago, P. M. W.; Sousa, I. M. O.; Servat-Medina, L.; Jorge, M. P.; Lima Neto, L. G.; Hass, V.; Li, X.; Ruiz, A. L. T. G.; Saxena, D.; Foglio, M. A.; Clin., Cosmet. Investig. Dent. 2020, 12, 327. [Crossref] 89. Jorge, M. P.; Madjarof, C.; Ruiz, A. L. T. G.; Fernandes, A. T.; Rodrigues, R. A. F.; Sousa, I. M. O.; Foglio, M. A.; de Carvalho, J. E.; J. Ethnopharmacol. 2008, 118, 361. [Crossref] 90. Taffarello, D.; Jorge, M. P.; Sousa, I. M. O.; Duarte, M. C. T.; Figueira, G. M.; Queiroz, N. D. C. A.; Rodrigues, R. A. F.; de Carvalho, J. E.; Goes, A. L. T. R.; Foglio, M. A.; Riveros, J. M.; Eberlin, M. N.; Cabral, E. C.; Quim. Nova 2013, 36, 431. [Crossref] 91. Aro, A. A.; Simões, G. F.; Esquisatto, M. A. M.; Foglio, M. A.; Carvalho, J. E.; Oliveira, A. L. R.; Gomes, L.; Pimentel, E. R.; Injury 2013, 44, 884. [Crossref] 92. Servat-Medina, L.; González-Gómez, A.; Reyes-Ortega, F.; Sousa, I. M. O.; Queiroz, N. C. A.; Zago, P. M. W.; Jorge, M. P.; Monteiro, K. M.; de Carvalho, J. E.; San Román, J.; Foglio, M. A.; Int. J. Nanomed. 2015, 10, 3897. [Crossref] 93. dos Santos, V. C.; Longo, T. B.; Garcia, A. L. H.; Richter, M. F.; Guecheva, T. N.; Henriques, J. A. P.; Ferraz, A. D. B. F.; Picada, J. N.; J. Toxicol. Environ. Health, Part A 2013, 76, 381. [Crossref] 94. de Souza, A. S.; Pagadigorria, C. L. S.; Ishii-Iwamoto, E. L.; Bracht, A.; Cortez, D. A. G.; Yamamoto, N. S.; Pharm. Biol. 2009, 47, 154. [Crossref] 95. Rodrigues, M. C.; Muehlmann, L. A.; Longo, J. P. F.; Silva, R. C.; Graebner, I. B.; Degterev, I. A.; Lucci, C. M.; Azevedo, R. B.; Garcia, M. P.; J. Nanomed. Nanotechnol. 2015, 6, 286. [Crossref] 96. Andrade, L. M. S.; de Oliveira, A. B. M.; Leal, A. L. A. B.; Oliveira, F. A. A.; Portela, A. L.; Lima Neto, J. S.; de Siqueira-Júnior, J. P.; Kaatz, G. W.; da Rocha, C. Q.; Barreto, H. M.; Microb. Pathog. 2020, 140, 103935. [Crossref] 97. Resende, F. A.; Nogueira, C. H.; Espanha, L. G.; Boldrin, P. K.; Oliveira-Höhne, A. P.; de Camargo, M. S.; da Rocha, C. Q.; Vilegas, W.; Varanda, E. A.; Regul. Toxicol. Pharmacol. 2017, 90, 29. [Crossref] 98. Salgado, C.; Morin, H.; de Aquino, N. C.; Neff, L.; da Rocha, C. Q.; Vilegas, V.; Marcourt, L.; Wolfender, J. L.; Jordan, O.; Queiroz, E. F.; Allémann, E.; Molecules 2020, 25, 5219. [Crossref] 99. Rodrigues, V. P.; da Rocha, C. Q.; Périco, L. L.; dos Santos, R. C.; Ohara, R.; Nishijima, C. M.; Queiroz, E. F.; Wolfender, J. L.; da Rocha, L. R. M.; Santos, A. R. S.; Vilegas, W.; Hiruma-Lima, C. A.; Int. J. Mol. Sci. 2017, 18, 2304. [Crossref] 100. Serpeloni, J. M.; Specian, A. F. L.; Ribeiro, D. L.; Benício, L. M.; Nunes, H. L.; Franchi, L. P.; Rocha, C. Q.; Vilegas, W.; Varanda, E. A.; Cólus, I. M. S.; Hum. Exp. Toxicol. 2020, 39, 338. [Crossref] 101. de Lima, C. A.; Cubero, M. C. Z.; Franco, Y. E. M.; Rodrigues, C. D. P.; Nascimento, J. R.; Vendramini-Costa, D. B.; Sciani, J. M.; Rocha, C. Q.; Longato, G. B.; BioMed. Res. Int. 2022, 2022, 3319203. [Crossref] 102. Rocha, V. P. C.; da Rocha, C. Q.; Queiroz, E. F.; Marcourt, L.; Vilegas, W.; Grimaldi, G. B.; Furrer, P.; Allémann, E.; Wolfender, J. L.; Soares, M. B. P.; Molecules 2019, 24, 1. [Crossref] 103. Neuenschwander, A.; Rocha, V. P. C.; Bastos, T. M.; Marcourt, L.; Rocha, Q. C.; Grimaldi, G. B.; de Sousa, K. A. F.; Borges, J. N.; Morin, H.; Rivara-Minten, E.; Wolfender, J. L.; Soares, M. B. P.; Queiroz, E. F.; J. Nat. Prod. 2020, 83, 2631. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access