Revisão
|
|
| Inibidores do fotossistema II: uma perspectiva aleloquímica Photosysthem II inhibitors: an allelochemical perspective |
|
Anthony da SilvaI; Jéssica M. de SouzaI; Geilly Mara S. de PáduaI; Arielly Celestino Rodrigues SantosI; Leonardo G. de VasconcelosI; Evandro Luiz Dall'ÓglioI; Barbara S. BelleteII; Thiago André M. VeigaIII; Lucas C. C. VieiraI; Olívia M. SampaioI,*
I. Departamento de Química, Instituto de Ciências Exatas e da Terra, Universidade Federal de Mato Grosso, 78060-900 Cuiabá - MT, Brasil Recebido em 02/02/2023 *e-mail: olivia.sampaio@ufmt.br The process of photosynthesis involves the absorption of light energy by photosynthetic pigments found in the thylakoid membrane of chloroplasts in order to produce chemical energy. In the presence of photosynthetic inhibitors, plant development is affected mainly by the reduction of the electron chain, which leads to growth inhibition. In this context, chlorophyll a (Chl a) fluorescence is an important technique used to identify the effects of inhibitors on the photosynthetic apparatus employing the JIP-test, which correlates the Chl a fluorescence transient to biophysical parameters, providing valuable information about the efficiency of photosystems I and II. Natural products have been highlighted as photosynthesis inhibitors due to the continued use of synthetic herbicides, which leads to the development of invasive plants resistant to these pesticides, in addition to the toxicity caused to humans and the environment. Thus, this review describes the main applications of extracts and isolated secondary metabolites obtained from plants and microorganisms in the investigation of electron transport inhibition on photosystem II. FLUORESCÊNCIA DA CLOROFILA a: UMA COMPREENSÃO DE EVENTOS DA FOTOSSÍNTESE As clorofilas são pigmentos encontrados em plantas, cianobactérias e algas, as quais têm em sua estrutura química porfirinas conjugadas e complexadas com íons de magnésio, sendo de fundamental importância no processo da fotossíntese aeróbica. Dentre as clorofilas existentes, a clorofila a (Chl a) (Figura 1) é o cromóforo principal de sistemas de proteínas e pigmentos de organismos fotossintetizantes, encarregada de absorver fótons de luz em uma distribuição regulada de energia de excitação, o que resulta em um processo redox e um gradiente de prótons dentro do aparato fotossintético.1
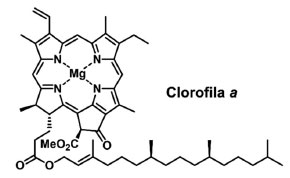 Figura 1. Representação da estrutura química da molécula da clorofila a
No processo de absorção de fótons pela Chl a tem-se uma alta eficiência quântica e uma pequena fração dos fótons absorvidos é reemitido na forma de fluorescência, a qual é dependente do metabolismo e funcionamento da fotossíntese. Nesse contexto, a Chl a é um composto fundamental para que a fotossíntese ocorra, e a análise dos dados obtidos a partir da fluorescência deste composto fornece dados relevantes para o entendimento do processo fotossintético.2 A fluorescência da Chl a é um fenômeno físico usado como método não invasivo para o estudo do funcionamento do fotossistema II (FSII), sendo esta uma técnica comumente empregada na avaliação da fisiologia vegetal. A análise das variações no desempenho do FSII afetado por fatores abióticos e bióticos tem demonstrado ser uma técnica fundamental na compreensão dos mecanismos fotossintéticos e também usada para a investigação do comportamento das plantas às mudanças ambientais.3 Fatores bióticos e abióticos podem prejudicar a integridade fisiológica das células vegetais, afetando a fluorescência da Chl a e consequentemente o processo de fotossíntese.4 Nesse contexto, a análise cinética da fluorescência da Chl a tem se mostrado uma ferramenta importante no estudo da fotossíntese, pois as mudanças no rendimento quântico da fluorescência em função do tempo indicam significativas alterações no aparato fotossintético. A indução da fluorescência da Chl a mediada pela exposição de uma amostra à luz actínica após adaptação ao escuro, resulta em uma curva polifásica a qual tem sido empregada no estudo do FSII há várias décadas.5 As alterações observadas no funcionamento do aparato fotossintético podem ser empregadas como indicadores de estresses existentes em organismos fotossintetizantes, sejam estes ocasionados pela intensidade luminosa, radiação ultravioleta, deficiência de nutrientes ou redução hídrica. Desse modo, o monitoramento da cinética da fluorescência da Chl a representa uma importante ferramenta na avaliação de alterações nos mecanismos fisiológicos envolvidos na fotossíntese.6,7 Sob condições fisiológicas normais, a fotossíntese tem início no complexo de evolução do oxigênio, do inglês oxygen-evolving complex (OEC), também chamado de complexo de divisão da água, local onde ocorre a foto-oxidação da água no FSII. Na reação global de oxidação da água, duas moléculas de água (H2O) geram uma molécula de oxigênio (O2), quatro prótons (H+) e quatro elétrons, os quais são transportados para os centros de reação localizados no complexo P680*.8 Moléculas de Chl a presentes no complexo antena são responsáveis pela absorção de fótons de luz e transferência desta energia para um par de clorofilas especiais no P680*; o qual transfere estes elétrons para a feofitina (Pheo), o primeiro aceptor de elétrons do FSII. Consequentemente, os elétrons são transferidos para as quinonas A (QA) e B (QB) por meio de uma série de reações redox, e ao final do FSII, os elétrons presentes no citocromo b6f são transferidos para o fotossistema I (FSI) por meio da plastocianina (PC) (Figura 2).9,10
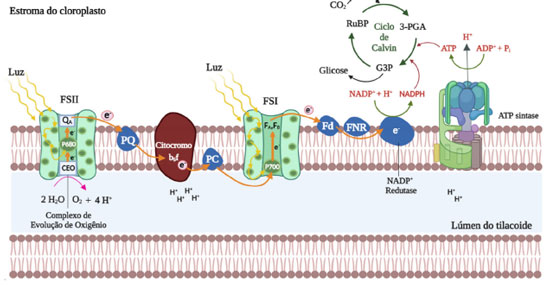 Figura 2. Representação do esquema de transferência de elétrons na fase luminosa da fotossíntese com produção de ATP e NADPH utilizados no ciclo de Calvin (fixação do CO2)
No FSI, os elétrons presentes no complexo antena reduzem a proteína ferredoxina (Fd), e posteriormente, são transferidos para a nicotinamida adenina dinucleotídeo fosfato (NADP+) levando a síntese de sua forma reduzida, o NADPH. Ao final da fase fotoquímica, a enzima ATP sintase catalisa a conversão de adenosina difosfato (ADP) em adenosina trifosfato (ATP) empregando gradiente de prótons presente entre o estroma e o lúmen dos tilacoides (Figura 2). As diversas reações químicas que ocorrem durante a fotossíntese nas plantas podem ser divididas em duas classes: as reações fotossintéticas de transferência de elétrons (reações luminosas), que ocorrem no tilacoide, e as reações de fixação de carbono (reações de escuro), que ocorrem no estroma.11 Na presença de inibidores fotossintéticos ou em condições de estresse, as plantas têm o seu desenvolvimento reduzido ou até mesmo a ocorrência de morte do vegetal, devido à inibição do processo de evolução do oxigênio e a redução do fluxo de elétrons no nível do complexo das plastoquinonas QA e QB, o que consequentemente interrompe a fixação de CO2 e a produção de ATP e NADPH, os quais são componentes essenciais para o desenvolvimento e crescimento do vegetal.12-14 Nesse contexto, a fluorescência da Chl a pode ser utilizada na avaliação de danos causados ao aparato fotossintético. Sob condições adversas, as plantas frequentemente apresentam uma diminuição da atividade fotossintética, caracterizada por um decréscimo significativo de rendimento quântico da fotossíntese. Os métodos para mensurar a fluorescência da Chl a são baseados nos modos como a energia luminosa absorvida por moléculas de Chl é liberada, os quais ocorrem por dissipação fotoquímica (fotossíntese), dissipação não fotoquímica (emissão de calor) ou reemissão em comprimentos de onda maiores que os absorvidos pelos pigmentos.15 Portanto, os dados de fluorescência estão correlacionados à absorção e aprisionamento de energia, transporte e fluxo de elétrons, os quais são processos bioquímicos essenciais em organismos fotossintetizantes.16,17 A teoria da fluorescência da Chl a é baseada em princípios da mecânica quântica, na relação existente entre a energia total absorvida e a energia que não foi utilizada pelo aparato fotossintético. A emissão de fluorescência da Chl a corresponde a uma pequena dissipação da energia do aparato fotossintético e é amplamente aceita como informação para a compreensão e funcionalização de toda a estrutura do FSII. Nesse sentido, a análise dos transientes da fluorescência da Chl a pode ser realizada empregando o JIP-test, o qual fornece informações de parâmetros biofísicos que quantificam o desempenho dos FSI e FSII.18-21 Embora a medida da fluorescência da Chl a seja uma técnica poderosa, ela também é limitada. Mesmo com o fácil manuseio e o conhecimento da teoria subjacente, o entendimento do processo das medições e o ajuste do instrumento utilizado para as medidas precisam ser compreendidos, caso contrário, os dados produzidos poderão ocasionar interpretações equivocadas. Neste contexto, esta revisão traz informações relevantes das últimas décadas sobre o emprego da fluorecência da Chl a e na análise de compostos aleloquímicos como inibidores da fotossíntese.
PRINCÍPIOS DA ANÁLISE DE FLUORESCÊNCIA DA CLOROFILA a E PARÂMETROS ASSOCIADOS Os eventos bioquímicos que ocorrem dentro da membrana dos tilacoides durante o fenômeno de fluorescência são relevantes para a compreensão da fotossíntese. A fluorescência da Chl a ocorre quando um tecido ou organismo fotossintetizante é iluminado no comprimento de onda na região de 680 nm, capaz de excitar moléculas de Chl a que ao retornarem para seu estado não-excitado, emitem luz na região vermelha do espectro eletromagnético.22 Em condições experimentais, folhas de plantas são adaptadas ao escuro para que os centros reacionais do FSII estejam abertos e não haja nenhum processo quântico. Então, ocorre a incidência de uma luz actínica (600 W m2 (3200 µmol fótons m-2 s-1)) de baixa intensidade para a indução do fluxo de elétrons através do FSII, e suficiente para obter um valor mínimo de fluorescência de Chl a, chamado de F0. Após a aplicação do pulso saturado de luz, há a indução de um valor máximo de fluorescência (FM) onde os centros reacionais estão fechados. A diferença entre os parâmetros F0 e FM resulta na fluorescência variável (FV), a qual representa um importante parâmetro para o cálculo do rendimento quântico máximo de todos os centros reacionais do FSII (FV/FM). Uma redução do parâmetro FV/FM é observada quando existem danos ao FSII, ou a inativação do FSII foi ocasionada pela presença de compostos inibidores, ou mediante a alterações nas condições experimentais, pois a fluorescência transitória da Chl a está relacionada com as reações primárias da fotossíntese, constituindo uma ferramenta importante no estudo do aparato fotossintético das plantas.23 A cinética de indução da fluorescência da Chl a, foi primeiramente descrita como monofásica, na qual a incidência de luz promove eventos fotossintéticos descritos por uma curva de transientes de origem O (0,02 ms) a P (1 s), sendo estes transientes os marcadores do fechamento dos centros reacionais, indicando a redução dos aceptores de elétrons (QA e QB).24,25 Strasser et al. ,26 baseados no efeito Kautsky (fluorescência transiente), demonstraram que os transientes de fluorescência da Chl a têm comportamento polifásico, incluindo os eventos intermediários J (2 ms) e I (30 ms), o que é atualmente caracterizado como JIP-test (Figura 3).
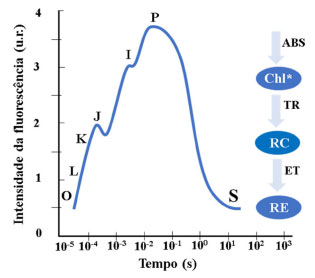 Figura 3. Representação simplificada da curva polifásica transiente OJIP (JIP-test) de indução da fluorescência da Chl a, com os principais eventos envolvidos no processo
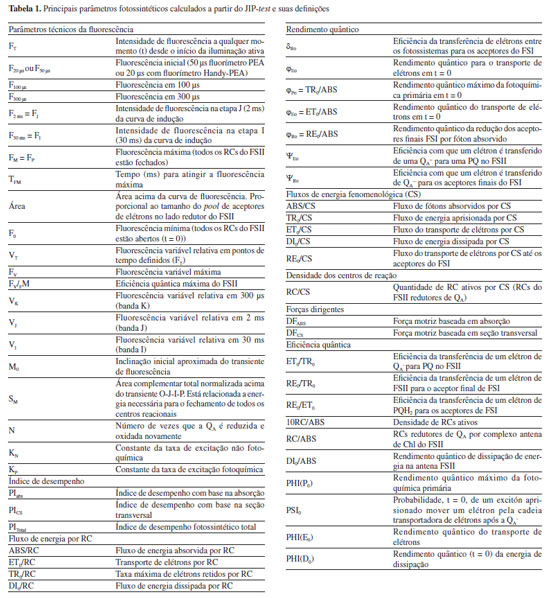
A partir da análise do JIP-test é possível identificar etapas presentes entre os transientes do fluxo de energia do FSII, sendo os transientes L (100 µs) e K (300 µs) presentes entre os estados O e J, e o transiente G (0,3 ms) entre os estados I e P.27-30 A sequência O-(L)-(K)-J-I-(G)-P representa a sequência simplificada dos transientes referentes aos eventos biofísicos de redução das plastoquinonas A (PQA) e B (PQB) nas suas formas reduzidas PQA- e PQB-, respectivamente, e também a redução da plastoquinona (PQ) em plastoquinol (PQH2).31-33 Os transientes O-J-I-P da curva polifásica fornecem dados sobre o fluxo de energia do FSII, os quais estão relacionados a quatro efeitos principais: absorção de fótons pelo FSII (ABS), aprisionamento da energia (TR), transporte de elétrons (ET) e redução dos aceptores finais do FSII (RE). O efeito ABS ocorre no complexo antena, na qual os pigmentos fotossintéticos absorvem fótons na região de 680 nm, excitando os elétrons provenientes da oxidação da água, os quais são transportados por um resíduo de tirosina até o par de Chl especiais no centro reacional do FSII (P680).34-36 O efeito TR representa o processo de fotoquímica primária, responsável pelas reações de redução da Pheo e QA. Os efeitos ET e RE estão relacionados às reações que ocorrem entre a quinona A reduzida (QA-) e a PC, e a transferência de elétrons para os aceptores do FSI, respectivamente.37 A associação dos dados de fluorescência da Chl a com os transientes permite o cálculo de parâmetros fenomenológicos, os quais relacionam informações biofísicas usadas para quantificar a eficiência do aparato fotossintético. Dentre os principais parâmetros funcionais e estruturais destacam-se o índice de desempenho (PI), os fluxos de energia por centro reacional (RC), rendimentos quânticos, fluxo de energia fenomenológica por seção transversal (CS) e a concentração de centros reacionais ativos por seção transversal (RC/CS). É importante destacar que nenhum dos parâmetros derivados do JIP-test é específico para um determinado tipo de estresse, sendo a interpretação dos danos causados ao FSII, uma combinação dos dados obtidos por um conjunto de parâmetros.38 Um resumo dos principais parâmetros obtidos a partir do JIP-test e utilizados no estudo do FSII está disposto na Tabela 1.39-42
Os parâmetros fotossintéticos descritos na Tabela 1 são calculados a partir das informações primárias obtidas com as análises da fluorescência da Chl a. Por exemplo, os parâmetros de rendimento quântico são calculados utilizando as seguintes fórmulas: 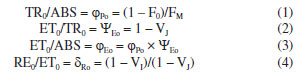 Os parâmetros relacionados aos fluxos específicos por centro reacional utilizam as fórmulas: 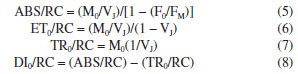 Estes e outros parâmetros de fluorescência da Chl a podem ser obtidos utilizando o programa Biolyser HP3 (Bioenergetics Laboratory, Universidade de Geneva, Suíça). Este programa utiliza a planilha de dados registrados pelo fluorímetro Handy Pea (Hansatech Instruments Ltd. , Reino Unido) para calcular automaticamente todos os parâmetros da curva OJIP, em função de quatro fenômenos principais que ocorrem durante a fluorescência da Chl a: fenomenológicos, específicos, rendimentos quânticos e índices de desempenho.
ATIVIDADE ALELOPÁTICA DE PRODUTOS NATURAIS NO FOTOSSISTEMA II Compostos aleloquímicos são substâncias produzidas e liberadas por organismos vivos, as quais possuem efeitos de indução ou inibição do desenvolvimento de organismos alvo.43,44 Neste contexto, os aleloquímicos podem ser metabólitos secundários liberados de maneira volátil ou extraídos das plantas, com o papel de induzir o crescimento ou inibir a sobrevivência de outra planta.45-48 Estudos envolvendo a atividade aleloquímica de inibição da fotossíntese despertam o interesse de pesquisadores diante da necessidade do desenvolvimento de produtos ambientalmente sustentáveis. Produtos naturais inibidores da fotossíntese têm recebido destaque diante do uso continuado de herbicidas sintéticos, o que leva ao desenvolvimento de plantas invasoras resistentes a esses defensivos agrícolas, além da toxicidade provocada aos seres humanos e ao meio ambiente.49-51 Nesse contexto, compostos aleloquímicos, por serem de origem natural e apresentarem diferentes mecanismos de ação, estão sendo estudados na inibição do transporte de elétrons do FSII como uma ferramenta importante na compreensão do processo fotoquímico de plantas, algas e cianobactérias.52-55 Os primeiros relatos do estudo de efeitos fitotóxicos com aleloquímicos relacionados a medidas de fluorescência da Chl a e atividades fotossintéticas foram descritos no final do século XX. A sorgoleona (1), um derivado de p-benzoquinonas, foi descrita como um inibidor da evolução fotossintética de plantas a baixa concentração (10 µmol L-1), e uma diminuição da eficiência fotossintética (FV/FM) foi observada como parâmetro de medida de fluorecência.56 Nos anos seguintes, o composto 1 e derivados foram estudados como inibidores do transporte de elétrons no FSII.57,58 Outros metabólitos secundários, como o ácido barbático (2),59 xantorrizol (3),60 tricolorina A (4),61 odoratol (5),62 ácido traciloban-19-oico (6),63 esquamocina (7)64 e antraquinona (8)65 foram analisados e seus efeitos como inibidores do transporte de elétrons no FSII confirmados em concentrações de 10 µmol L-1 a 200 µmol L-1 (Figura 4). Todas as substâncias apresentaram uma redução da taxa fotossintética demonstrada pelos parâmetros de fluorescência da Chl a como F0, FM, FV/FM, e para algumas substâncias foi observado o surgimento da banda J na curva polifásica transiente OJIP, indicando efeitos no lado aceptor de elétrons do FSII.
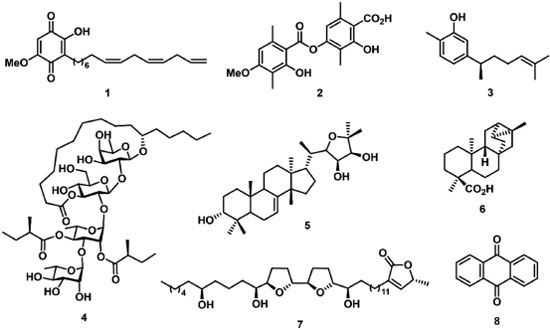 Figura 4. Metabólitos secundários inibidores do transporte de elétrons no FSII
Yang et al. 66 investigaram o uso do óleo essencial extraído de Artemisia ordosica na inibição da atividade do FSII da alga Palmellococcus miniatus. Os resultados obtidos demonstram que o óleo essencial inibe o transporte de elétrons do FSII após 24 h do tratamento. Os parâmetros FV/FM, ET0/ABS, ET0/TR0 e RC/CS0 foram significantemente reduzidos, quando comparado ao controle, e houve o surgimento da banda K entre os transientes O e J, indicando a redução no fluxo de elétrons além de QA-, e em danos no lado doador de elétrons do FSII. O extrato aquoso de Cyperus rotundus, constituído majoritariamente por ácidos fenólicos, foi empregado no estudo da inibição da proliferação, eficiência fotossintética e alterações na microestrutura intracelular da alga Phaeocystis globosa. A análise das curvas de indução transitória da fluorescência da Chl a demonstrou uma inibição da eficiência fotossintética quantificada pela redução dos parâmetros de vitalidade FV/FM e PIabs, e pelo aumento dos parâmetros relacionados a absorção, dissipação e aprisionamento de energia por RC (ABS/RC, DI0/RC e TR0/RC), e pela redução dos valores obtidos para o parâmetro ET0/RC.67 Yuan et al. 68 demonstraram o efeito alelopático algistático do extrato aquoso de Spartina alterniflora na redução da atividade fotossintética da cianobactéria Microcystis aeruginosa. Os resultados obtidos utilizando o extrato aquoso de S. alterniflora a 0,05 g mL-1, sugerem uma diminuição na concentração de Chl a, reduzindo a atividade fotossintética. Resultado semelhante foi observado no emprego do extrato aquoso de Hordeum vulgare (palha de cevada) na inibição do crescimento da M. aeruginosa, o qual levou a uma redução da fluorescência relativa da Chl a em relação ao tempo.69 Nesse contexto, Wang et al. 70 estudaram os efeitos do extrato das folhas de Dracontomelon duperreanum sobre o crescimento e a atividade fotossintética da alga M. aeruginosa. Os resultados obtidos sugerem que o extrato de D. duperreanum, na concentração de 2,0 g L-1, suprime eficientemente o crescimento de M. aeruginosa, diminuindo a eficiência da fotossíntese, a taxa máxima relativa de transporte de elétrons e eficiência fotoquímica máxima do FSII (FV/FM). Wu et al. 71 estudaram o uso do extrato aquoso das folhas de Mikania micranta sobre a inibição da germinação e crescimento de 26 espécies de plantas nativas da China. Dentre os indicadores utilizados para avaliação do desenvolvimento vegetal, destaca-se o parâmetro FV/FM, o qual teve uma redução superior a 50% para 4 espécies avaliadas em uma concentração de 0,5% m/v. Pouresmaeil et al. 72 realizaram o estudo do uso do óleo essencial de Artemisia fragrans no controle da planta daninha Convolvulus arvensis, com ênfase nos efeitos causados ao aparato fotossintético e estresse oxidativo. O óleo essencial da A. fragrans, rico em terpenos como a α-tujona (9), β-tujona (10), cânfora (11) e 1,8-cineol (12), inibiu a germinação e reduziu o crescimento de C. arvensis, afetando a biossíntese de pigmentos fotossintéticos, e interrompendo o fluxo de elétrons do FSII, o que levou ao estresse oxidativo da planta daninha. O óleo essencial de A. fragrans afetou significativamente (p ≤ 0,05) os parâmetros de fluorescência da Chl a na concentração de 4,0% v/v, aumentando os parâmetros F0 e de extinção não fotoquímica de Stern-Volmer (NPQ) em 25,79% e 51,68%, respectivamente. Também foram observadas as reduções nos parâmetros FV/FM, jPSII e de extinção fotoquímica (qP) em 17,30%; 50,00% e 24,12%, respectivamente, indicando uma limitação da cadeia transportadora de elétrons, a qual leva à redução da eficiência máxima do FSII (Figura 5).
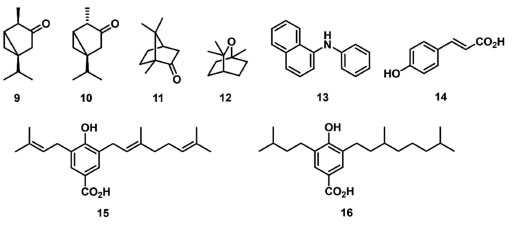 Figura 5. Monoterpenos e compostos aromáticos inibidores do transporte de elétrons no FSII
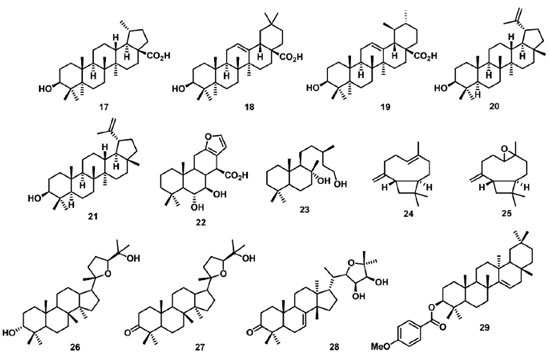
O composto N-fenil-1-naftilamina (13) foi utilizado como aleloquímico na inibição do crescimento e da atividade fisiológica de M. aeruginosa em um padrão de exposição repetida de baixa dosagem (50 mg L-1), simulando a liberação contínua de aleloquímicos realizada pelas plantas. O composto 13 reduziu a eficiência quântica do FSII em dependência do tempo, observadas para esse parâmetro porcentagens de 78% e 10% no segundo e nono dia do experimento, respectivamente.73 O ácido p-cumárico (14) foi reportado com potencial efeito inibitório na atividade fotossintética, no controle do crescimento vegetal da espécie Panax quinquefolium, o ginseng americano. Dentre os parâmetros fotossintéticos avaliados neste trabalho, o composto 14 na concentração de 0,06 mg L-1 reduziu os parâmetros relacionados a taxa fotossintética e transporte de elétrons em 64% e 41%, respectivamente.74 Outros compostos ácidos avaliados como inibidores da fotossíntese em experimento in vitro, foram o ácido myrsinoico A (15) e seu derivado (16), ambos isolados da Myrsine cuneifolia. Esses compostos reduziram os parâmetros fotossintéticos no FSII, diminuindo a absorção de fótons pelo complexo antena e o aprisionamento de elétrons pelos RCs, assim impedindo a redução de P680+, e consequentemente gerando um acúmulo de elétrons P680+, Pheo+ e QA-.75 Os triterpenos pentacíclicos ácidos betulínico (17), oleanólico (18) e ursólico (19) (Figura 6), isolados a partir de extratos aquosos e metanólicos de Alstonia scholaris, foram avaliados como inibidores do crescimento vegetal de plantas daninhas. Os parâmetros relacionados a máxima eficiência quântica do FSII (Fv/FM), fluorescência inicial (F0), fluorescência máxima (FM), e a taxa de transporte de elétrons (ETR) foram usados para avaliação do crescimento vegetal. Nesse estudo, os compostos 17 e 19 na concentração de 2 mmol L-1 reduziram o parâmetro ETR em 40% e 30%, respectivamente.76 Outros triterpenos como o lupeol (20) e acetato de 3β-lup-20(29)-en-3-il (21) (Figura 6), foram isolados de Maytenus acanthophylla Reissek e avaliados na inibição da fotossíntese. Destes compostos, o 20 demonstrou os melhores resultados na concentração de 300 µmol L-1, aumentando em 30% os valores dos parâmetros ABS/RC e TR0/RC, e reduzindo o parâmetro RC/CS0 em 20%. No entanto, o composto 20 não promoveu alterações significativas nos parâmetros TR0/CS0, ET0/RC, PHI(D0), PHI(P0) e ET0/CS, sugerindo uma porcentagem do fluxo de energia sendo dissipada como calor. Portanto, o composto 20 inibe parcialmente a enzima de separação de água e também interage com os RCs do FSII, modificando a estrutura da membrana do tilacoide e afetando suas propriedades de migração de energia.77
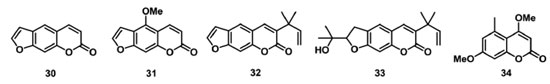
O diterpeno ácido 6α,7β-diidroxivouacapan-17β-oico (22) (Figura 6), isolado de Pterodon polygalaeflorus, e seus derivados sintéticos foram avaliados como inibidores do transporte de elétrons do FSII em concentrações de 50 µmol L-1 a 300 µmol L-1. Foi observada a redução dos parâmetros relacionados ao índice de desempenho PIabs, aos RCs (ABS/RC e ET0/RC) e por CS (ABS/CS0, TR0/CS e ET0/CS), indicando que a cadeia transportadora de elétrons do FSII foi afetada, assim como foi observado o surgimento da banda K em 300 µs, demonstrando um desequilíbrio entre os lados doador e aceptor de elétrons do FSII.78,79 Outro diterpeno, o labdano-8α,15-diol (23) (Figura 6), isolado de Croton ciliatoglanduliferus, reduziu o parâmetro φPo em 0,012 unidades nas concentrações de 300 μmol L-1 e 600 μmol L-1 em comparação ao controle. Esse resultado indica que QA- não é acumulada quando o FSII é inibido pelo aleloquímico. Os decréscimos observados no tamanho do complexo antena por RC (ABS/RC), no transporte de elétrons por RC, M0 e FM, sugerem que o 23 afeta mais o lado doador de elétrons do FSII que os centros reacionais.80 Os sesquiterpenos β-cariofileno (24) e óxido de cariofileno (25) (Figura 6), isolados de Senecio salignus, foram avaliados como inibidores fotossintéticos em experimentos de fluorescência da Chl a na concentração de 100 µg L-1. O composto 24 reduziu os parâmetros ET0/CS, PHI(P0), PSI0, RC/CS0, TR0/CS e ET0/CS em 50%, e aumentou em 20% os valores dos parâmetros dV/dt0, ABS/RC e TR0/RC. Esses resultados sugerem que os RCs do FSII foram transformados em dissipadores de calor ou centros de reação silenciosos, pois esses RCs não podem reduzir a QA e sua energia de excitação é dissipada na forma de calor.81 Os triterpenos cabraleadiol (26), ocotilona (27) e odoratona (28) isolados de Cabralea canjerana Mart. , e 4-metóxibenzoato de traxerol (29) (Figura 6) isolado Pavonia multiflora A. St-Hil. , foram avaliados em experimentos in vitro como inibidores da fotossíntese. Os dados de fluorescência da Chl a mostram que 27 e 28 inibem parcialmente a enzima de quebra da molécula de água, e agem no transporte de elétrons de P680 a QA, com ação no lado doador do FSII e no complexo OEC.17 O composto 29 promoveu um aumento da intensidade da fluorescência entre 2 ms e 4 ms, indicando o surgimento da banda J, a qual fornece informações sobre reações fotoquímicas primárias, em especial, referente a redução de QA. Isso indica que o transporte de elétrons além de QA é bloqueado no nível QB, um aceptor de elétrons de quinona secundária de FSII.82 Os terpenos 22-29 têm ação aleloquímica em toda cadeia transportadora de elétrons do FSII. Estes compostos bloqueiam o transporte dos elétrons, resultando no aparecimento das bandas transientes K e J, o que indica o desequilíbrio no fluxo eletrônico nos lados doadores e aceptores de elétrons do FSII. Pontanto, os terpenoides atuam no complexo enzimático responsável pela quebra da molécula de água no centro de reação silencioso incapacitando a redução de QA, e também têm ação no intervalo P680+, Pheo e QA-QB, inibindo o processo redox no pool das quinonas. Cumarinas também são uma classe de metabólitos secundários com atividade alelopática no FSII. Sampaio et al. 83 descreveram o estudo de 4 furanocumarinas isoladas da Ruta graveolens, psoraleno (30), bergapteno (31), chalepensina (32) e chalepina (33) (Figura 7) como inibidores da cadeia transportadora de elétrons do FSII. Dos compostos avaliados, 31 e 33 apresentaram os melhores resultados na concentração de 300 µmol L-1, ambos os compostos reduzindo o parâmetro PIabs em 60%, comparado com o controle. Outros parâmetros que sofreram redução foram ET0/CS0, TR0/CS0, RC/CS0, PSI0 e PHI(E0), demonstrando que a energia absorvida nessas seções e o transporte de elétrons foram limitados. A presença dos compostos 31 e 33 levou ao surgimento da banda J na curva transiente de fluorescência, indicando a ação das furanocumarinas no lado aceptor de elétrons do FSII. A siderina (34) (Figura 7), uma cumarina isolada do extrato metanólico de Toona ciliata, foi avaliada no experimento de fluorescência da Chl a, demonstrando uma redução dos parâmetros ΦP0 e ET0/RC, o que indica um decréscimo no rendimento quântico máximo da fotoquímica primária, e a redução da taxa de transporte de elétrons além da QA-. Também foi observada a redução de FM e valores constantes para F0, indicando a formação de centros de reação silenciosos, o que sugere que 34 atua como um inibidor dos lados doador e aceptor de elétrons entre P680 e QA.84
Sampaio et al. 85 descreveram o isolamento de alcaloides (35-42) (Figura 8) do extrato etanólico de R. graveolens e a avaliação como inibidores da fotossíntese. Dos alcaloides estudados, o composto graveolina (38) apresentou os melhores resultados, aumentando dV/dt0 e diminuindo PIabs ambos em 60% na concentração de 150 μmol L-1. A associação destes resultados com a redução de PSI0, PHI(E0), SM, ET0/CS0, e ET0/RC em 40%, demonstra que o transporte de elétrons no processo redox das quinonas foi interrompido, indicando danos ao FSII. Nesse contexto, Veiga et al. 86 descreveram o estudo de alcaloides furoquinolínicos (43-47) (Figura 8) isolados do extrato diclorometano de Balfourodendron riedelianum, empregando a fluorescência da Chl a e o JIP-test. O composto evolitrina (43) mostrou os melhores resultados com o aumento de δRo e jRo em 60% na concentração de 400 µmol L-1, comparado ao controle. Além desses resultados, houve um aumento do rendimento quântico para a redução de aceptores finais do FSI por fóton absorvido, sugerindo que os aceptores finais do FSI não podem ser reduzidos porque os elétrons do FSII não estão sendo transferidos. Portanto, a evolitrina demonstra efeito inibidor nos lados doador e aceptor de elétrons do FSII.
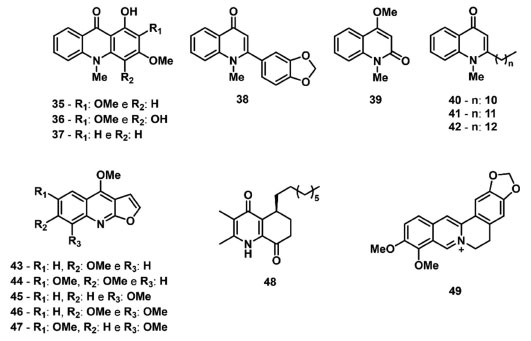 Figura 8. Alcaloides inibidores do transporte de elétrons no FSII
A antidesmona (48) (Figura 8), um alcaloide isolado de Waltheria brachyepetala, possui características químicas estruturais semelhantes a plastoquinona, e demostrou ser um inibidor das reações de Hill, bloqueando o fluxo de elétrons no lado aceptor de elétrons do FSII, efeito semelhante ao encontrado para o herbicida comercial Diuron. Esses resultados foram evidenciados pela redução dos parâmetros ψ0, jE0, Sum K, KP, ET0/RC e PIabs em 21%, 24%, 12%, 16%, 17% e 52%, respectivamente, na concentração de 300 μmol L-1, indicando o acúmulo de QA- devido ao bloqueio da passagem dos elétrons para QB.87 O alcaloide berberina (49) (Figura 8), presente em plantas das famílias Annonaceae, Berberidaceae, Menispermaceae, Papaveraceae, Ranunculaceae e Rutaceae,88 levou a reduções significativas na cadeia transportadora de elétrons do FSII da alga M. aeruginosa, diminuindo os parâmetros Fv/FM e ETR em 28% e 57%, respectivamente, na concentração de 0,47 mg L-1.89 Dentre os parâmetros de fluorescência da Chl a avaliados na atividade aleloquímica das cumarinas 30-33 e dos alcaloides 34-49, é possível identificar uma correlação na redução dos parâmetros relacionados ao índice de desempenho e transferência de elétrons, indicando um mesmo sítio de ação para essas duas classes de metabólitos secundários. King-Díaz et al. 90 descreveram os efeitos dos flavonoides acacetina (50), crisina (51) e 4',7-dimetilnaringenina (52) (Figura 9) nas reações da fase luminosa da fotossíntese. Os dados de fluorescência da Chl a demonstraram que os flavonoides 51 e 52 reduzem o parâmetro FV/FM e promovem o surgimento da banda J, indicando a inibição no lado aceptor de elétrons do FSII. O flavonoide 3,5-dihidroxi-6,7,3',4'-tetrametóxiflavunol (53) (Figura 9), isolado a partir de Pluchea sagittalis foi descrito por Carvalho et al. 91 como um inibidor fotossintético. A análise dos dados obtidos indica que 53 ocupa a posição do aceptor secundário de quinona (QB) do sítio de ligação da proteína D1 do FSII, e o aumento da fluorescência ocorre principalmente pelo estado redox de QA-, indicando que 53 interage no lado aceptor de elétrons do FSII. As acetogeninas glaucafilina (54), gigantetrocina (55), cherimolina (56) e gigantecina (57) (Figura 9), isoladas das folhas de Annona coriacea Mart. , demonstraram atividade na inibição do fluxo de elétrons do FSII nas concentrações de 300 μg mL-1 e 600 μg mL-1, reduzindo o parâmetro PIabs em 15% e 25%, respectivamente. A mistura contendo os compostos 54-57 também levou a redução de ET0/CS0 e da área normalizada abaixo da curva OJIP, indicando que as acetogeninas inibem o fluxo de elétrons do FSII.92 Nos dados de fluorescência da Chl a obtidos para os flavonoides e as acetogininas, foi possível identificar a presença da banda J, indicando um evento de rotatividade das reações primárias, principalmente, o que demonstra o bloqueio do transporte de elétrons entre QA e QB.
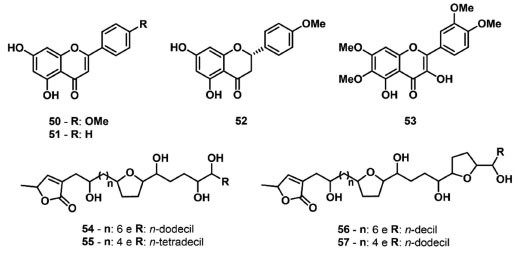 Figura 9. Flavonoides e acetogeninas inibidores do transporte de elétrons no FSII
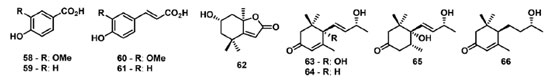
Lopes et al. 82 descreveram o isolamento e avaliação da atividade fotossintética dos derivados fenólicos: ácidos vanilíco (58), ferúlico (59), p-hidróxibenzoico (60) e p-cumárico (61); e dos norisoprenoides: loliolide (62), vomifoliol (63), 3-oxo-α-ionol (64), 4,5-dihidroblumenol A (65) e blumenol C (66) (Figura 10). Dos metabólitos avaliados, o composto 62 mostrou os melhores resultados, reduzindo os parâmetros relacionados a CS0, ET0/CS0, RC/CS0 e TR0/CS0 em aproximadamente 90%, e PHI(P0) foi reduzido em 30%. Estas informações sugerem que alguns RCs do FSII foram transformados em centros de reação silenciosos, os quais não reduzem a QA e sua energia de excitação é dissipada na forma de calor.
Além dos extratos e substâncias isoladas de plantas, os microrganismos têm demonstrado ser uma fonte promissora na descoberta de novos compostos com ação alelopática na inibição da fotossíntese. Moura et al. 93 reportaram o uso de extratos metanólicos dos fungos endofíticos Diaporthe phaseolorum,Penicillium simplicissimum e Trichoderma spirale na inibição da fotossíntese e do crescimento vegetal de Senna occidentalis e Ipomoea grandifolia. O fungo T. spirale mostrou os melhores resultados frente a S. occidentalis, reduzindo os parâmetros PIabs, ET0/CS0, PHI(E0) e PSI0 em 64%, 28%, 40% e 38%, respectivamente, indicando a inibição do transporte de elétrons no lado aceptor do FSII. Os fungos endofíticos também representam fontes naturais de metabólitos secundários para a atividade alelopática inibitória da fotossíntese, por exemplo, Medeiros et al. 94 reportaram a avaliação dos efeitos na fluorescência da Chl a provocados por depsídeos (67 e 68) (Figura 11) produzidos pelo fungo Cladosparium uredinicola. Os resultados obtidos mostram que 67 e 68 inibem o transporte de elétrons nos lados doador e aceptor de elétrons do FSII, na concentração de 300 µmol L-1. O ácido tenuazônico (69) (Figura 11), um metabólito secundário isolado a partir do extrato etanólico de Alternaria alternata, foi avaliado na inibição do FSII. Os dados de fluorescência da Chl a mostraram que 69 interrompe o transporte de elétrons entre QA e QB no lado aceptor do FSII, com um valor de I50 de 48 μg mL-1. O bloqueio da transferência de elétrons foi evidenciado pelo acúmulo de QA-, observado pelo aumento de F0 e FM, e um decréscimo dos parâmetros ET0/RC, ET0/CSM, jEo e ψ0.95
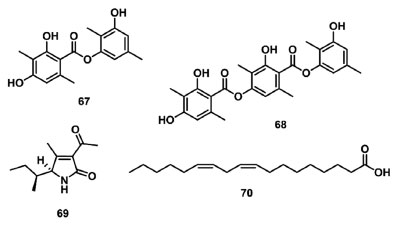 Figura 11. Metabólitos secundários isolados de fungos com atividade inibitória do fluxo de elétrons no FSII
Em outro trabalho envolvendo metabólitos secundários isolados de microrganismos, Quian et al. 96 realizaram o estudo da atividade alelopática do ácido linoleico (70) (Figura 11) na inibição da fotossíntese da alga Chlorella pyrenoidosa. O parâmetro FV/FM foi utilizado como indicador da inibição do FSII, e após o tratamento com 70 em concentrações de 60 μg L-1 a 120 μg L-1, FV/FM foi reduzido de 20,5% a 34,1%, demonstrando um decréscimo no rendimento quântico máximo do FSII. Ye et al. 97 reportaram o uso do JIP-test como ferramenta de análise da atividade alelopática da macroalga Gracilaria lemaneiformis no controle da microalga Chaetoceros curvisetus. A inibição do FSII foi identificada pela redução dos parâmetros FV/FM, RC/CS0, RC/CSM, ABS/CS0 e ψ0, indicando que a G. lemaneiformis reduz o número de RCs ativos, danificando a cadeia de transportadora de elétrons e comprometendo o funcionamento do complexo de evolução de oxigênio de C. curvisetus. Outro estudo de alelopatia empregando macro e microalgas foi realizado por Ma et al. ,98 onde foi avaliado o uso do extrato diclorometano:metanol (3:1, v/v) de Prorocentrum donghaiense na inibição da fotossíntese de Sargassum fusiformis. Os resultados obtidos no JIP-test demonstraram uma redução dos parâmetros VJ, M0, ϕPo, ϕ0, ϕEo e PI, e aumento de DI0/RC, indicando danos aos aceptores de elétrons, a inativação dos RCs e bloqueio do transporte de elétrons. A fluorescência da Chl a também tem sido empregada na avaliação das interações alelopáticas existentes entre as macroalgas Ulva linza e Gracilaria lemaneiformis. Neste estudo, os resultados obtidos demonstram que a alga U. linza afeta o crescimento e a fotossíntese de G. lemaneiformis, sendo a eficiência fotossintética reduzida em 27,2%, 39,2%, e 84,7% nas concentrações de 1,25 g L-1, 3,75 g L-1 e 6,25 g L-1, respectivamente.99 Laue et al. 100 reportaram os efeitos dos xenobióticos ácido tânico (71), ácido gálico (72) e gramina (73) (Figura 12) nas taxas de crescimento, volume celular, rendimento quântico máximo do FSII (ΦFSIImáx = FV/FM) das algas Desmodesmus armatus e M. aeruginosa. Os resultados demonstraram que os xenobióticos reduziram o parâmetro ΦFSIImáx depois de 2 dias de tratamento, tendo efeitos mais significativos na alga M. aeruginosa com a presença dos polifenóis que em D. armatus.
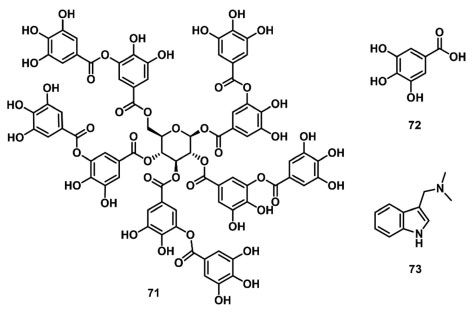 Figura 12. Compostos xenobióticos com atividade inibitória do fluxo de elétrons no FSII
CONCLUSÕES Essa revisão apresenta os principais estudos sobre o emprego de extratos e metabólitos secundários obtidos a partir de plantas e microorganismos, em estudos envolvendo a técnica de fluorescência da Chl a na compreensão dos eventos relacionados ao transporte de elétrons do FSII. Diversas classes de metabólitos secundários identificados e/ou isolados de extratos de plantas, fungos e em óleos essenciais demonstram bioatividade como aleloquímicos inibidores da fotossíntese, tais como os alcaloides, cumarinas, depisideos, flavonoides, acetogeninas, terpenoides, bis-nor-sesquiterpenos, derivados do ácido fenilpropanoico e ácidos fenólicos. Dentre os metabólitos já estudados empregando a fluorescência da Chl a, é possível destacar a atividade aleloquímica de cumarinas e alcaloides, os quais reduziram parâmetros relacionados à índice de desempenho e transferência de elétrons em 50% a 60% e 40% a 57%, respectivamente. A pesquisa em produtos naturais na busca de inibidores da fotossíntese representa uma importante área de pesquisa no desenvolvimento de novas tecnologias para uma agricultura ambientalmente sustentável, uma vez que esses compostos são uma alternativa interessante para a substituição dos herbicidas comerciais devido à sua baixa toxicidade ao ambiente e seres humanos.
AGRADECIMENTOS Os autores agradecem o apoio da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brasil (CAPES) - código de financiamento 001.
REFERÊNCIAS 1. Chen, M.; Annu. Rev. Biochem. 2014, 83, 317. [Crossref] 2. Mohammed, G. H.; Binder, W. D.; Gillies, S. L.; Scandinavian Journal of Forest Research 1995, 10, 383. [Crossref] 3. Murchie, E. H.; Lawson, T.; J. Exp. Bot. 2013, 64, 3983. [Crossref] 4. Dayan, F. E.; Zaccaro, M. L. M.; Pestic. Biochem. Physiol. 2012, 102, 189. [Crossref] 5. Stirbet, A.; Lazár, D.; Kromdijk, J.; Govindjee, G.; Photosynthetica 2018, 56, 86. [Crossref] 6. Küpper, H.; Benedikty, Z.; Morina, F.; Andresen, E.; Mishra, A.; Trtílek, M.; Plant Physiol. 2019, 179, 369. [Crossref] 7. Kareya, M. S.; Mariam, I.; Nesamma, A. A.; Jutur, P. P.; Mater. Sci. Energy Technol. 2020, 3, 420. [Crossref] 8. Bao, H.; Burnap, R. L.; Front. Plant Sci. 2016, 7, 578. [Crossref] 9. Kramer, M.; Rodriguez-Heredia, M.; Saccon, F.; Mosebach, L.; Twachtmann, M.; Krieger-Liszkay, A.; Duffy, C.; Knell, R. J.; Finazzi, G.; Hanke, G. T.; eLife 2021, 10, e56088. [Crossref] 10. Minges, A.; Groth, G. Em Advances in Botanical Research; Callow, J. A. , ed.; Elsevier: London, 2020. 11. Mandal, R.; Dutta, G.; Sensors International 2020, 1, 100058. [Crossref] 12. Kummerová, M.; Krulová, J.; Zezulka, Š.; Tříska, J.; Chemosphere 2006, 65, 489. [Crossref] 13. Zhu, J.; Patzoldt, W. L.; Radwan, O.; Tranel, P. J.; Clough, S. J.; Plant Genome 2009, 2, 191. [Crossref] 14. Guo, Y.; Liu, W.; Wang, H.; Wang, X.; Qiang, S.; Kalaji, H. M.; Strasser, R. J.; Chen, S.; J. Agric. Food Chem. 2021, 69, 7313. [Crossref] 15. van Bezouw, R. F. H. M.; Keurentjes, J. J. B.; Harbinson, J.; Aarts, M. G. M.; The Plant Journal 2019, 97, 112. [Crossref] 16. Hassannejad, S.; Ghafarbi, S. P.; Lotfi, R.; Environmental and Sustainability Indicators 2020, 6, 100026. [Crossref] 17. King-Díaz, B.; Soares, M. S.; da Silva, M. F. G. F.; Lotina-Hennsen, B.; Veiga, T. A. M.; Am. J. Plant Sci. 2014, 05, 2528. [Crossref] 18. Strasserf, R. J.; Srivastava, A.; Govindjee; Photochem. Photobiol. 1995, 61, 32. [Crossref] 19. Oukarroum, A.; Strasser, R. J.; S. Afr. J. Bot. 2004, 70, 277. [Crossref] 20. Tsimilli-Michael, M.; Eggenberg, P.; Biro, B.; Köves-Pechy, K.; Vörös, I.; Strasser, R. J.; Applied Soil Ecology 2000, 15, 169. [Crossref] 21. Schansker, G.; Strasser, R. J.; Photosynth. Res. 2005, 84, 145. [Crossref] 22. Kalaji, H. M.; Schansker, G.; Brestic, M.; Bussotti, F.; Calatayud, A.; Ferroni, L.; Goltsev, V.; Guidi, L.; Jajoo, A.; Li, P.; Losciale, P.; Mishra, V. K.; Misra, A. N.; Nebauer, S. G.; Pancaldi, S.; Penella, C.; Pollastrini, M.; Suresh, K.; Tambussi, E.; Yanniccari, M.; Zivcak, M.; Cetner, M. D.; Samborska, I. A.; Stirbet, A.; Olsovska, K.; Kunderlikova, K.; Shelonzek, H.; Rusinowski, S.; Bąba, W.; Photosynth. Res. 2017, 132, 13. [Crossref] 23. van Rooijen, R.; Aarts, M. G. M.; Harbinson, J.; Plant Physiol. 2015, 167, 1412. [Crossref] 24. Tsimilli-Michael, M.; Photosynthetica 2020, 58, 275. [Crossref] 25. Bussotti, F.; Desotgiu, R.; Pollastrini, M.; Cascio, C.; Scandinavian Journal of Forest Research 2010, 25, 43. [Crossref] 26. Strasser, R. J.; Tsimilli-Michael, M.; Srivastava, A. Em Advances in Photosynthesis and Respiration; Govindjee; Papageorgiou, G. C. , eds.; Springer: Dordrecht, 2004. 27. Bednarikova, M.; Folgar-Camean, Y.; Kucerova, Z.; Lazar, D.; Špundova, M.; Hajek, J.; Bartak, M.; Photosynthetica 2020, 58, 646. [Crossref] 28. de Souza, C. C. B.; Borella, J.; Leal, J. F. L.; Tornisielo, V. L.; Pimpinato, R. F.; Monquero, P. A.; de Pinho, C. F.; Bull. Environ. Contam. Toxicol. 2020, 104, 114. [Crossref] 29. Morales-Flores, F.; Aguilar, M. I.; King-Díaz, B.; Lotina-Hennsen, B.; J. Photochem. Photobiol. , B 2013, 125, 42. [Crossref] 30. Teng, K.; Tan, P.; Guan, J.; Dong, D.; Liu, L.; Guo, Y.; Guo, W.; Yuesen, Y.; Fan, X.; Wu, J.; Environ. Exp. Bot. 2021, 191, 104607. [Crossref] 31. Strasser, R. J.; Tsimilli-Michael, M.; Dangre, D.; Rai, M. Em Advanced Techniques in Soil Microbiology; Varma, A.; Oelmüller, R. , eds.; Springer: Heidelberg, 2007. 32. Macías-Rubalcava, M. L.; García-Méndez, M. C.; King-Díaz, B.; Macías-Ruvalcaba, N. A.; J. Photochem. Photobiol. , B 2017, 166, 35. [Crossref] 33. Varejão, J. O. S.; Barbosa, L. C. A.; Ramos, G. A.; Varejão, E. V. V.; King-Díaz, B.; Lotina-Hennsen, B.; J. Photochem. Photobiol. , B 2015, 145, 11. [Crossref] 34. Vinyard, D. J.; Ananyev, G. M.; Charles Dismukes, G.; Annu. Rev. Biochem. 2013, 82, 577. [Crossref] 35. Vass, I.; Biochimica et Biophysica Acta (BBA) - Bioenergetics 2012, 1817, 209. [Crossref] 36. Andreiadis, E. S.; Chavarot-Kerlidou, M.; Fontecave, M.; Artero, V.; Photochem. Photobiol. 2011, 87, 946. [Crossref] 37. Strasser, R. J.; Tsimilli-Michael, M.; Qiang, S.; Goltsev, V.; Biochimica et Biophysica Acta (BBA) - Bioenergetics 2010, 1797, 1313. [Crossref] 38. Ripoll, J.; Bertin, N.; Bidel, L. P. R.; Urban, L.; Front. Plant Sci. 2016, 7, 1679. [Crossref] 39. Souza, J. M.; Fazolo, B. R.; Lacerda, J. W. F.; Moura, M. S.; Santos, A. C. R.; Vasconcelos, L. G.; Sousa Junior, P. T.; Dall'Oglio, E. L.; Ali, A.; Sampaio, O. M.; Vieira, L. C. C.; Photochem. Photobiol. 2020, 96, 1233. [Crossref] 40. Mendes, M. C. S.; Fazolo, B. R.; de Souza, J. M.; de Vasconcelos, L. G.; de Sousa, P. T.; Dall'Oglio, E. L.; Soares, M. A.; Sampaio, O. M.; Vieira, L. C. C.; Photochem. Photobiol. Sci. 2019, 18, 1350. [Crossref] 41. Tsimilli-Michael, M.; Strasser, R. J. Em Mycorrhiza; Varma, A. , ed.; Springer: Heidelberg, 2008. 42. Pádua, G. M. S.; de Souza, J. M.; Sales, M. C. M.; de Vasconcelos, L. G.; Dall'Óglio, E. L.; Faraggi, T. M.; Sampaio, O. M.; Vieira, L.; Chem. Biodiversity 2021, 18, e2100226. [Crossref] 43. Leal, W. S. Em Comprehensive Natural Products III; Liu, H.; Begley, T. , eds.; Elsevier: London, 2020. 44. Zarbin, P. H. G.; Rodrigues, M. A. C. M.; Lima, E. R.; Quim. Nova 2009, 32, 722. [Crossref] 45. Singh, A. A.; Rajeswari, G.; Nirmal, L. A.; Jacob, S.; Rev. Anal. Chem. 2021, 40, 293. [Crossref] 46. Xu, D.; Gao, Z.; Zhang, X.; Fan, X.; Wang, Y.; Li, D.; Wang, W.; Zhuang, Z.; Ye, N.; PLoS One 2012, 7, e33648. [Crossref] 47. Peng, X.; Not. Bot. Horti Agrobot. Cluj-Napoca 2018, 47, 194. [Crossref] 48. Liang, G. T.; Zhang, S. Y.; Guo, J.; Yang, R.; Li, H.; Fang, X. C.; Zhang, G. C.; Photosynthetica 2018, 56, 505. [Crossref] 49. Yang, X. F.; Lei, K.; Kong, C. H.; Xu, X. H.; Pestic. Biochem. Physiol. 2017, 143, 224. [Crossref] 50. Cheng, F.; Cheng, Z.; Front. Plant Sci. 2015, 6, 1020. [Crossref] 51. Radhakrishnan, R.; Alqarawi, A. A.; Abd_Allah, E. F.; Ecotoxicol. Environ. Saf. 2018, 158, 131. [Crossref] 52. Zhu, W.; Liu, J.; Ye, J.; Li, G.; Sci. Hortic. 2017, 215, 49. [Crossref] 53. Zhang, Z.; Liu, Y.; Yuan, L.; Weber, E.; van Kleunen, M.; Ecology Letters 2021, 24, 348. [Crossref] 54. Zimdahl, R.; Fundamentals of Weed Science, 5th ed.; Elsevier: London, 2018. 55. Long, M.; Peltekis, A.; González-Fernández, C.; Hégaret, H.; Bailleul, B.; Harmful Algae 2021, 103, 101997. [Crossref] 56. Nimbal, C. I.; Yerkes, C. N.; Weston, L. A.; Weller, S. C.; Pestic. Biochem. Physiol. 1996, 54, 73. [Crossref] 57. Gonzalez, V. M.; Kazimir, J.; Nimbal, C.; Weston, L. A.; Cheniae, G. M.; J. Agric. Food Chem. 1997, 45, 1415. [Crossref] 58. Rimando, A. M.; Dayan, F. E.; Czarnota, M. A.; Weston, L. A.; Duke, S. O.; J. Nat. Prod. 1998, 61, 927. [Crossref] 59. Endo, T.; Takahagi, T.; Kinoshita, Y.; Yamamoto, Y.; Sato, F.; Biosci. , Biotechnol. , Biochem. 1998, 62, 2023. [Crossref] 60. Gonzalez-Bernardo, E.; Aguilar, M. I.; Delgado, G.; King-Diaz, B.; Lotina-Hennsen, B.; Physiol. Plant. 2003, 119, 598. [Crossref] 61. Achnine, L.; Pereda-Miranda, R.; Iglesias-Prieto, R.; Moreno-Sánchez, R.; Lotina-Hennsen, B.; Physiol. Plant. 1999, 106, 246. [Crossref] 62. Achnine, L.; Mata, R.; Iglesias-Prieto, R.; Lotina-Hennsen, B.; J. Agric. Food Chem. 1998, 46, 5313. [Crossref] 63. Hernández-Terrones, M. G.; Aguilar, M. I.; King-Diaz, B.; Lotina-Hennsen, B.; Pestic. Biochem. Physiol. 2003, 77, 12. [Crossref] 64. Chàvez, D.; Mata, R.; Iglesias-Prieto, R.; Lotina-Hennsen, B.; Physiol. Plant. 2001, 111, 262. [Crossref] 65. Schrader, K. K.; Dayan, F. E.; Allen, S. N.; de Regt, M. Q.; Tucker, C. S.; Paul Junior, R. N.; Int. J. Plant Sci. 2000, 161, 265. [Crossref] 66. Yang, X.; Deng, S.; de Philippis, R.; Chen, L.; Hu, C.; Zhang, W.; Plant Physiol. Biochem. 2012, 51, 153. [Crossref] 67. Lan, Y.; Chen, Q.; Gou, T.; Sun, K.; Zhang, J.; Sun, D.; Duan, S.; Water 2020, 12, 3256. [Crossref] 68. Yuan, R.; Li, Y.; Li, J.; Ji, S.; Wang, S.; Kong, F.; Sci. Total Environ. 2020, 712, 136332. [Crossref] 69. Waybright, T. J.; Terlizzi, D. E.; Ferrier, M. D.; J. Appl. Phycol. 2009, 21, 333. [Crossref] 70. Wang, X.; Szeto, Y. T.; Jiang, C.; Wang, X.; Tao, Y.; Tu, J.; Chen, J.; Bull. Environ. Contam. Toxicol. 2018, 100, 690. [Crossref] 71. Wu, A. P.; Li, Z. L.; He, F. F.; Wang, Y. H.; Dong, M.; PLoS One 2015, 10, e0132967. [Crossref] 72. Pouresmaeil, M.; Nojadeh, M. S.; Movafeghi, A.; Maggi, F.; Ind. Crops Prod. 2020, 155, 112785. [Crossref] 73. Gao, Y. N.; Ge, F. J.; Zhang, L. P.; He, Y.; Lu, Z. Y.; Zhang, Y. Y.; Liu, B. Y.; Zhou, Q. H.; Wu, Z. B.; Chemosphere 2017, 174, 732. [Crossref] 74. Jiao, X.; Bi, X.; Gao, W.; Acta Ecologica Sinica 2015, 35, 3006. [Crossref] 75. Burger, M. C. M.; de Oliveira, G. S.; Menezes, A. C. S.; Vieira, P. C.; da Silva, M. F. G. F.; Veiga, T. A. M.; Quim. Nova 2012, 35, 1395. [Crossref] 76. Wang, C. M.; Chen, H. T.; Li, T. C.; Weng, J. H.; Jhan, Y. L.; Lin, S. X.; Chou, C. H.; J. Chem. Ecol. 2014, 40, 90. [Crossref] 77. Menezes-de-Oliveira, D.; Aguilar, M. I.; King-Díaz, B.; Vieira-Filho, S. A.; Pains-Duarte, L.; Silva, G. D. F.; Lotina-Hennsen, B.; Molecules 2011, 16, 9939. [Crossref] 78. King-Díaz, B.; dos Santos, F. J. L.; Rubinger, M. M. M.; Piló-Veloso, D.; Lotina-Hennsen, B.; Zeitschrift für Naturforschung C 2006, 61, 227. [Crossref] 79. King-Díaz, B.; Pérez-Reyes, A.; dos Santos, F. J. L.; Ferreira-Alves, D. L.; Piló-Veloso, D.; Carvajal, S. U.; Lotina-Hennsen, B.; Pestic. Biochem. Physiol. 2006, 84, 109. [Crossref] 80. Morales-Flores, F.; Aguilar, M. I.; King-Díaz, B.; de Santiago-Gómez, J. R.; Lotina-Hennsen, B.; Photosynth. Res. 2007, 91, 71. [Crossref] 81. Sánchez-Muñoz, B. A.; Aguilar, M. I.; King-Díaz, B.; Rivero, J. F.; Lotina-Hennsen, B.; Molecules 2012, 17, 1437. [Crossref] 82. Lopes, L. G.; Tavares, G. L.; Thomaz, L. D.; Sabino, J. R.; Borges, K. B.; Vieira, P. C.; Veiga, T. A. M.; Borges, W. S.; Chem. Biodiversity 2016, 13, 284. [Crossref] 83. Sampaio, O. M.; da Silva, M. F. G. F.; Veiga, T. A. M.; King-Díaz, B.; Lotina-Hennsen, B.; Quim. Nova 2012, 35, 2115. [Crossref] 84. Veiga, T. A. M.; González-Vázquez, R.; Oiano Neto, J.; da Silva, M. F. G. F.; King-Díaz, B.; Lotina-Hennsen, B.; Arch. Biochem. Biophys. 2007, 465, 38. [Crossref] 85. Sampaio, O. M.; Vieira, L. C. C.; Bellete, B. S.; King-Diaz, B.; Lotina-Hennsen, B.; da Silva, M. F. G. F.; Veiga, T. A. M.; Molecules 2018, 23, 2693. [Crossref] 86. Veiga, T. A. M.; King-Díaz, B.; Marques, A. S. F.; Sampaio, O. M.; Vieira, P. C.; da Silva, M. F. G. F.; Lotina-Hennsen, B.; J. Photochem. Photobiol. , B 2013, 120, 36. [Crossref] 87. Sampaio, O. M.; Lima, M. M. C.; Veiga, T. A. M.; King-Díaz, B.; da Silva, M. F. G. F.; Lotina-Hennsen, B.; Pestic. Biochem. Physiol. 2016, 134, 55. [Crossref] 88. Neag, M. A.; Mocan, A.; Echeverría, J.; Pop, R. M.; Bocsan, C. I.; Crişan, G.; Buzoianu, A. D.; Front. Pharmacol. 2018, 9, 557. [Crossref] 89. Liu, L.; Zhang, S.; Dai, W.; Bi, X.; Zhang, D.; Water Sci. Technol. 2019, 80, 1155. [Crossref] 90. King-Díaz, B.; Granados-Pineda, J.; Bah, M.; Rivero-Cruz, J. F.; Lotina-Hennsen, B.; J. Photochem. Photobiol. , B 2015, 151, 213. [Crossref] 91. Carvalho, A. C.; Lira, J. C. S.; Pereira, T. M.; Silva, S. C.; Simote-Silva, S. Y.; Oliveira, F. K. D.; King-Diaz, B.; Lotina-Hennsen, B.; Veiga, T. A. M.; Nat. Prod. Res. 2019, 33, 557. [Crossref] 92. Severino, V. G. P.; Simão, J. L. S.; Junqueira, J. G. M.; de Carvalho, A. C.; King‐Díaz, B.; Lotina‐Hennsen, B.; Terezan, A. P.; Veiga, T. A. M.; Chem. Biodiversity 2020, 17, e2000484. [Crossref] 93. Moura, M. S.; Lacerda, J. W. F.; Siqueira, K. A.; Bellete, B. S.; Sousa, P. T.; Dall'Óglio, E. L.; Soares, M. A.; Vieira, L. C. C.; Sampaio, O. M.; J. Environ. Sci. Health, Part B 2020, 55, 470. [Crossref] 94. de Medeiros, L. S.; Sampaio, O. M.; da Silva, M. F. G. F.; Rodrigues Filho, E.; Veiga, T. A. M.; J. Braz. Chem. Soc. 2012, 23, 1551. [Crossref] 95. Chen, S.; Yin, C.; Dai, X.; Qiang, S.; Xu, X.; Environ. Exp. Bot. 2008, 62, 279. [Crossref] 96. Qian, H.; Xu, J.; Lu, T.; Zhang, Q.; Qu, Q.; Yang, Z.; Pan, X.; Sci. Total Environ. 2018, 625, 1415. [Crossref] 97. Ye, C.; Zhang, M.; Yang, Y.; Chin. J. Oceanol. Limnol. 2013, 31, 1174. [Crossref] 98. Ma, Z.; Wang, C.; Qin, W.; Wang, M.; Chen, B.; Jia, Y.; Qin, Z.; Dai, C.; Yu, H.; Li, G.; Li, R.; Thring, R. W.; Zhao, M.; Mar. Environ. Res. 2021, 170, 105453. [Crossref] 99. Gao, Z.; Xu, D.; Meng, C.; Zhang, X.; Wang, Y.; Li, D.; Zou, J.; Zhuang, Z.; Ye, N.; Aquat. Ecol. 2014, 48, 53. [Crossref] 100. Laue, P.; Bährs, H.; Chakrabarti, S.; Steinberg, C. E. W.; Chemosphere 2014, 104, 212. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access