Artigo
|
|
| Síntese, caracterização, atividade antimicrobiana de nanopartículas de ferrita de cobre e sua incorporação em cimento de ionômero de vidro Synthesis, characterization, antimicrobial activity of copper ferrite nanoparticles and their incorporation in glass ionomer cement |
|
Thays M. RibeiroI; Luciena dos S. FerreiraII; Isabela A. P. FariasIII,*; Fábio C. SampaioI; Jocianelle M. F. F. NunesI
I. Departamento de Clínica e Odontologia Social, Universidade Federal da Paraíba, 58051-900 João Pessoa - PB, Brasil Recebido em: 19/05/2023 *e-mail: isabelaapassos@yahoo.com.br Pure cubic copper ferrite (c-CuFe2O4), cerium-doped cubic copper ferrite (c-CuCeFe2O4) and pure tetragonal copper ferrite (t-CuFe2O4) nanoparticles were synthesized from the proteic sol-gel method, and characterized by X-ray diffraction, Rietveld method, FT-IR spectroscopy, and field emission scanning electron microscope. The antibacterial activity of the particles was tested in vitro against pathogenic Gram-positive, Gram-negative bacteria. Thus, it has been observed that the nanoparticles are capable of inhibiting the growth of such microorganisms. The nanoparticles were incorporated into glass ionomer cement, followed by Vickers microhardness evaluation. It is concluded that the cubic copper ferrite showed the best antimicrobial result, being the most suitable for market studies (industrial and biomedical). INTRODUÇÃO O desenvolvimento de novos materiais com propriedades aprimoradas é um desafio para os cientistas de materiais que buscam atender às recentes demandas biotecnológicas. As propriedades especiais requeridas para aplicações biomédicas de nanopartículas magnéticas são o controle preciso do tamanho de partícula, dispersão, propriedades antibacterianas e biocompatibilidade.1 Aplicações de nanopartículas magnéticas estão relacionadas com as propriedades ópticas, tamanho, forma, aspectos da superfície, entre outros, os quais irão determinar a sua função.2 A European Comission3 definiu as nanopartículas (NPs) como materiais com dimensão de 1-100 nm. Por apresentarem tamanho nanométrico e terem aplicação tanto tecnológica quanto biomédica, as nanopartículas têm relevante papel na interação com entidades microscópicas de interesse.4,5 Um avanço no desenvolvimento de materiais aconteceu com a articulação experimental entre as ciências física, química, de materiais, de saúde e as engenharias. Dentre esses materiais, as nanopartículas de ferritas podem ser incluídas. Dentre a classificação cristalográfica das ferritas, aquelas que apresentam arranjo cristalino do tipo espinélio podem apresentar potencial antimicrobiano contra bactérias e fungos resistentes.1 Há estudo atual que investiga a atuação dessas nanopartículas em agentes patogênicos.6 As nanopartículas de ferrita de zinco e cobalto apresentaram-se como material candidato para fins industriais e biomédicos.7,8 Enquanto a matriz de ferrita de cobre dopada com íons cério (Ce3+) apresentou aumento do potencial antimicrobiano com o aumento das concentrações do íon de terras raras.9 Em relação à síntese, surgiu uma variação do método sol-gel convencional, o método sol-gel protéico, que utiliza precursores poliméricos de origem orgânica, tais como a gelatina de origem animal para a produção de nanopartículas metálicas. O método sol-gel protéico para síntese das ferritas apresenta vantagens, tais como boa homogeneidade, controle de espessura e estrutura, além de baixo custo.10,11 Assim, a partir da demanda pelo desenvolvimento de novos materiais e produtos para aplicação biomédica, e pensando em métodos de prevenção de doenças bucais, busca-se o controle do biofilme bacteriano em avaliações laboratoriais de agentes antimicrobianos com modelos de biofilme para determinar o potencial desses agentes.12 A escolha das ferritas foi realizada analisando algumas das suas características e/ou propriedades, além de tratar-se de um dos materiais mais importantes na nanotecnologia na atualidade. Assim, o objetivo desse trabalho foi sintetizar, caracterizar e avaliar a atividade antimicrobiana de nanopartícula de ferrita de cobre diante da possibilidade de desenvolvimento de biomateriais que pudessem ser incorporados em materiais na área da saúde, com resultados promissores. Para isso, preparou-se a nanopartícula de ferrita de cobre (CuFe2O4), sendo ela nas simetrias cúbica (c-CuFe2O4), cúbica dopada com cério (c-CuCeFe2O4) e tetragonal pura (t-CuFe2O4). Avaliou-se in vitro a atividade antimicrobiana frente ao Streptococcus mutans e Escherichia coli, e verificouse a dureza superficial de cimento ionomérico modificado pela incorporação da ferrita.
PARTE EXPERIMENTAL Síntese das ferritas A síntese das ferritas do tipo espinélio (MFe2O4, M = Co, Ni e Cu) foi feita pelo método sol-gel protéico com uso de gelatina de origem animal como agente polimerizante (no Laboratório de Materiais Cerâmicos do Departamento de Engenharia de Materiais da Universidade Federal da Paraíba (UFPB)). O processo de síntese para cada ferrita consistiu, inicialmente, (i) na dissolução de 2 g de gelatina comercial (Dr. Oetker, Brasil) em 50 mL de água destilada aquecida à temperatura compreendida na faixa de 60-70 ºC sob constante agitação por aproximadamente 10 min; (ii) acrescentou-se o nitrato de ferro (Fe(NO3)3.9H2O, 99%, Merck) na solução precursora, sob agitação constante por 20 min para total dissolução; (iii) em seguida, acrescentou-se o nitrato de cobre (Cu(NO3)2.6H2O, 99%, Merck) e o nitrato de cério (Ce(NO3)3.6H2O, 99%, Merck) com elevação da temperatura para 90 ºC, sob agitação constante até a formação do gel; (iv) após a formação do gel, a solução foi para a secagem em forno mufla à temperatura de 300 ºC por 2 h com uma taxa de aquecimento de 2 ºC min-1. Finalizado o processo de secagem, (v) o pó precursor de cada uma das ferritas foi macerado para a etapa de calcinação, a qual foi feita a 800 °C para a ferrita de cobre tetragonal e a 500 ºC para ferrita de cobre cúbica pura e a dopada com cério, durante 4 h a uma taxa de 10 ºC min-1. As massas dos nitratos fonte de cátions trivalentes e divalentes levou em consideração a estequiometria de cada composição.10,13,14,15,16 Caracterização das ferritas de cobre As amostras calcinadas foram caracterizadas por difração de raios-X (DRX, D2PHASER, Bruker) usando radiação Cu-Kα (λ = 1,5418 Å). Os dados de DRX foram obtidos dentro do intervalo de 10-80° (2θ) com passo de 0,02º e uma taxa de varredura de 5º min-1. Análise quantitativa de fase, dos parâmetros de rede, tamanho de cristalito e ocupância dos sítios catiônicos das amostras foram obtidos a partir do refinamento de Rietveld aplicado aos padrões de difração. Os espectros de FT-IR foram obtidos utilizando um espectrômetro Shimadzu IRAffinity-1 na região de 4000 a 400 cm-1. A morfologia das amostras foi obtida por microscopia eletrônica de varredura de emissão de campo (FESEM, Carl Zeiss, modelo Supra 35-VP). Avaliação de atividade antimicrobiana A atividade antimicrobiana da ferrita de cobre em forma de pó foi testada sobre cepas padronizadas (INCQS e ATCC) previamente cultivadas. As cepas bacterianas testadas foram Streptococcus mutans INCQS 00446 e Escherichia coli ATCC 25922 fornecidas pela Fiocruz, Brasil. As bactérias foram estocadas em glicerol a 10% e mantidas a temperatura de -4 ºC até o momento da realização dos testes microbiológicos, quando foram mantidas à temperatura ambiente. Para a realização dos experimentos, realizou-se o cultivo das cepas bacterianas, em condições ideais, por 24 h em estufa a 37 ºC. Os microrganismos foram padronizados na 0,5 da escala de McFarland. Poços de BHI ágar na placa de Petri foram preenchidos com 100 µL de uma dispersão coloidal contendo 10 mg 10 mL-1 do espécime com água deionizada estéril (1 mg mL-1 de ferrita de cobre). Outros poços, foram preenchidos com 100 µL de digluconato de clorexidina a 0,12% (controle positivo) e 100 µL de solução salina a 0,9% (controle negativo).17 Assim, após 24 h de incubação foi medido o diâmetro do halo de inibição com auxílio de um paquímetro. A concentração inibitória mínima (CIM) foi conduzida segundo a técnica de difusão em ágar. Três poços foram preenchidos com 10 µL de uma diluição seriada correspondendo a 5, 4, 3, 2, 1, 0,5, 0,25, 0,20 e 0,15% para S. mutans e 1, 0,5, 0,25, 0,20, 0,15 e 0,10% para E. coli a partir da solução de estoque contendo 10 mg 1000 µL-1 do espécime com água deionizada estéril e colocado no BHI ágar. O quarto poço foi preenchido com 10 µL do controle positivo. As placas foram incubadas por 24 h em condições específicas para cada inóculo e após o período de incubação foi medido o diâmetro do halo de inibição com auxílio de um paquímetro. Incorporação de ferrita de cobre em cimento de ionômero de vidro e avaliação da microdureza As amostras foram compostas pelo cimento de ionômero de vidro (CIV) Ionofil Plus® convencional, como grupo controle. O cimento com ferrita de cobre (cúbica, dopada com cério e tetragonal) foi preparado pela incorporação do pó de ferrita nas concentrações de 2 e 5% ao pó do CIV. Dois corpos de prova de cada grupo foram confeccionados, sendo G0: cimento de ionômero de vidro sem incorporação de ferrita; G1: cimento de ionômero de vidro com incorporação de ferrita de cobre cúbica; G2: cimento de ionômero de vidro com incorporação de ferrita de cobre dopada com cério; G3: cimento de ionômero de vidro com incorporação de ferrita de cobre tetragonal. Os materiais foram manipulados de acordo com as instruções do fabricante em ambiente com temperatura e umidade controladas. Para confecção dos corpos de prova, foi utilizada uma matriz de polipropileno com cavidade central de 8 mm de diâmetro por 2 mm de espessura. O material foi transferido para uma placa de vidro adaptada utilizando fita crepe e coberta com uma fina camada de vaselina. Após a inserção do material na superfície, foi colocada uma tira matriz de poliéster para planificar a superfície. Antes da manipulação dos CIV, os mesmos foram pesados em balança analítica para padronização do proporcionamento pó resultando em 175 mg e o líquido foi padronizado uma média de 50 µL em cada gota. Os corpos de prova de CIV foram mantidos na matriz de polipropileno por 30 min. Após a retirada dos corpos de prova da matriz, os excessos foram removidos com lâmina de bisturi e, posteriormente, mantidos em recipiente úmido por 24 h a temperatura ambiente. As medidas de dureza iniciais foram realizadas após 24 h, contadas a partir da obtenção dos corpos de prova, em microdurômetro HMV2 (Shimadzu, Japão). A medida de dureza Vickers foi realizada nas superfícies de topo, em três pontos equidistantes, utilizando carga de 10 g por 15 s. Em seguida, para cada superfície, foi feita uma média das três endentações, que foi transformada automaticamente em número de dureza Vickers (VHN), utilizando a seguinte fórmula (Equação 1):18  Análise estatística Os dados foram conduzidos para banco de dados informatizados e analisados pela estatística descritiva (média, desvio-padrão, mediana) e inferencial, com aplicação de teste t de Student. O nível de significância adotado foi de 5%.
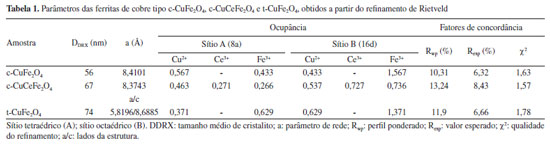
RESULTADOS E DISCUSSÃO Os padrões de DRX das amostras calcinadas (Figura 1) foram indexados ao espinélio da ferrita de cobre cúbica (Fm-3m (227), JCPDS 77 0010), sendo c-CuFe2O4 a ferrita de cobre pura (Figura 1a) e c-CuCeFe2O4 a ferrita de cobre dopada com cério (Figura 1b), e indexado ao espinélio da ferrita de cobre tetragonal (I41/amd (141), JCPDS 34 0425), amostra t-CuFe2O4 (Figura 1c).
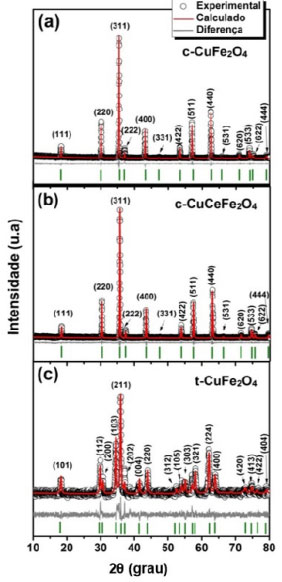 Figura 1. Padrão de DRX refinado da ferrita de cobre: (a) cúbica pura (c-CuFe2O4), (b) cúbica dopada com cério (c-CuCeFe2O4) e (c) tetragonal pura (t-CuFe2O4)
Não há picos adicionais relacionados a fases secundárias em nenhuma das amostras, garantindo pureza de fase dentro do limite de detecção de DRX. Além disso, a formação de fase pura para a ferrita de cobre dopada com cério (c-CuCeFe2O4) indica que os íons Ce3+ foram completamente inseridos na estrutura do espinélio cúbico de CuFe2O4 substituindo parcialmente os íons Fe3+ nos sítios octaédricos (sítios B). A análise quantitativa obtida a partir do refinamento de Rietveld é mostrada na Tabela 1. O tamanho médio de cristalito das mesmas foi de 56, 67 e 74 nm para c-CuFe2O4, c-CuCeFe2O4 e t-CuFe2O4, respectivamente. Para ferritas do tipo espinélio, a fórmula geral é dada por
Os espectros de infravermelho (FT-IR) característicos das amostras, registrados em temperatura ambiente na faixa de 4000 a 400 cm-1, são mostrados na Figura 2. A faixa de absorção em torno de 3436 e 1631 cm-1 é devido às vibrações de alongamento das moléculas de H2O e grupos O-H, respectivamente. A banda 2351 cm-1 corresponde a vibração do grupo nitrato residual usado na síntese. Ferritas do tipo espinélio exibem duas bandas ativas dentro da faixa de infravermelho, a banda de alta frequência (600-550 cm-1) e a banda de baixa frequência (450-340 cm-1), ambas associadas ao estiramento das ligações entre os íons metálicos e o oxigênio nos sítios tetraédrico e octaédrico, respectivamente. As bandas de absorção observadas em torno de 590 cm-1 dentro da faixa de 600-550 cm-1 são atribuídas aos complexos tetraédricos que representam a banda de alta frequência e indicam a formação da estrutura espinélio para todas as amostras.
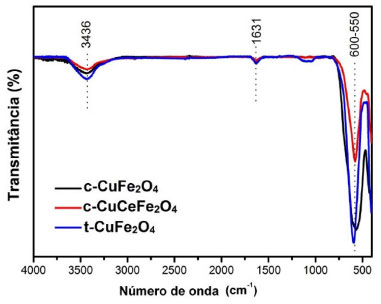 Figura 2. Espectros FT-IR da ferrita de cobre cúbica pura (c-CuFe2O4), cúbica dopada com cério (c-CuCeFe2O4) e tetragonal pura (t-CuFe2O4)
Há formação do espinélio, nesse caso, de ferrita de cobre, porque as bandas de absorção são características do sítio octaédrico e tetraédrico, ou seja, equivalentes aos espécimes utilizados no estudo.20,21 Na Figura 3, pode-se observar a configuração do espinélio de ferrita de cobre (CuFe2O4). As ferritas do tipo espinélio geralmente possuem íon metálico divalente ou podem ser uma associação de dois ou mais íons metálicos no caso das ferritas mistas. Observa-se que os íons metálicos são distribuídos no retículo cristalino em sítios tetraédricos e octaédricos cujos vértices são ocupados por átomos de oxigênio formando um arranjo que pode ser do tipo cúbico ou do tipo tetragonal.
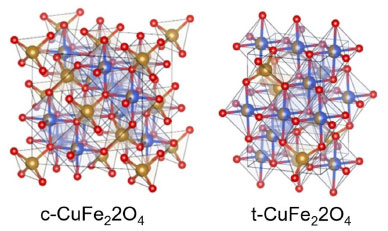 Figura 3. Configuração de um espinélio da ferrita de cobre cúbica pura (c-CuFe2O4) e tetragonal pura (t-CuFe2O4)
A análise morfológica das amostras (Figura 4) revelou partículas significativamente aglomeradas para todas as amostras. As amostras de simetria cúbica, c-CuFe2O4 (Figura 4a) e c-CuCeFe2O4 (Figura 4c) apresentaram partículas de morfologia esféricas, enquanto a amostra de simetria tetragonal, t-CuFe2O4 (Figura 4e), apresentou morfologia de partículas arredondadas e irregulares. A diferença na morfologia das amostras pode estar relacionada à simetria das mesmas, uma vez que a ferrita de cobre sofre transição de fase, da fase cúbica para tetragonal, de acordo com a temperatura de calcinação devido ao efeito Jahn-Teller, o qual está relacionado ao ambiente de oxigênio do íon de cobre que pode sofrer distorção, remoção da degenerescência orbital dos estados de elétrons e redução da energia total do sistema.22,23 Além disso, foi possível obter a distribuição de tamanho de partícula das amostras a partir das imagens de FESEM. A distribuição do tamanho de partículas foi do tipo lognormal para todas as amostras. O tamanho médio de partícula foi de 61 nm (c-CuFe2O4), 70 nm (c-CuCeFe2O4) e 83 nm (t-CuFe2O4) estando em boa concordância com os tamanhos de cristalito obtidos pelo refinamento do padrão de DRX e são consideradas nanopartículas (NPs < 100 nm).3,5
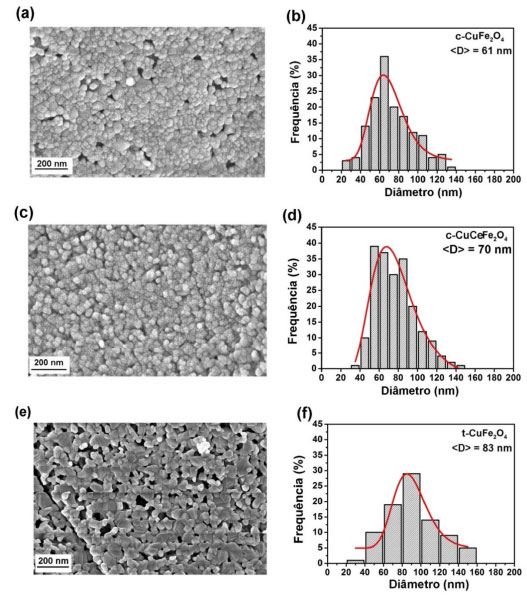 Figura 4. (a, c, e) Imagem de FESEM e (b, d, f) distribuição de tamanho de partícula da ferrita de cobre CuFe2O4
Para o teste de difusão em ágar, observou-se a formação de halo de inibição nas duas cepas testadas, S. mutans e E. coli. Como pode ser observado na Tabela 2, para S. mutans, a média dos halos com ferrita de cobre cúbica e ferrita de cobre dopada com cério foi de 32,26 e 20,13 mm, respectivamente, com diferença estatisticamente significativa em relação ao controle positivo (p < 0,001).
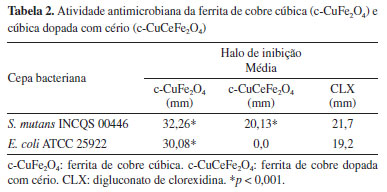
Já no teste de difusão realizado com a ferrita tetragonal (t-CuFe2O4), tanto para S. mutans quanto para E. coli, não houve formação de halo de inibição. O mecanismo exato do comportamento antimicrobiano das nanopartículas (NPs) de ferrita de cobre sintetizadas não é claro e requer mais estudos. Entretanto, algumas sugestões podem ser derivadas dos resultados obtidos neste estudo. Como já citado, a relação da ação antimicrobiana da ferrita de cobre cúbica pode estar relacionada com três fatores: o tamanho da partícula, área de superfície, a simetria da estrutura cristalina (cúbica ou tetragonal) e/ou às vacâncias de oxigênio presentes em cada amostra.1,22,23 A atividade antimicrobiana da ferrita de cobre cúbica pode ter sido favorecida pelo seu menor tamanho de nanopartículas, somado ao fato do cobre ter uma forte afinidade com biomoléculas.1,24 O comprometimento do efeito antimicrobiano da ferrita dopada com cério pode ser compreendido pela tendência do íon terras raras em formar aglomerados em ambiente úmido/dispersão coloidal, com reflexo direto na redução da área de superfície25 e limitado contato com íon Cu2+.26 Entretanto, os halos de inibição das ferritas de cobre cúbica pura e com cério foram superiores aos observados em estudo prévio.24 No resultado do teste de concentração inibitória mínima (CIM) por difusão frente a S. mutans, a ferrita de cobre cúbica dopada com cério (c-CuCeFe2O4) demonstrou melhor atividade, levando em consideração o tamanho do halo, na concentração de 0,5%. Já a ferrita de cobre cúbica sem dopagem (c-CuFe2O4) teve seu melhor desempenho da concentração de 4% e a ferrita de cobre tetragonal (t-CuFe2O4) na concentração de 0,15% (Figura 5a).
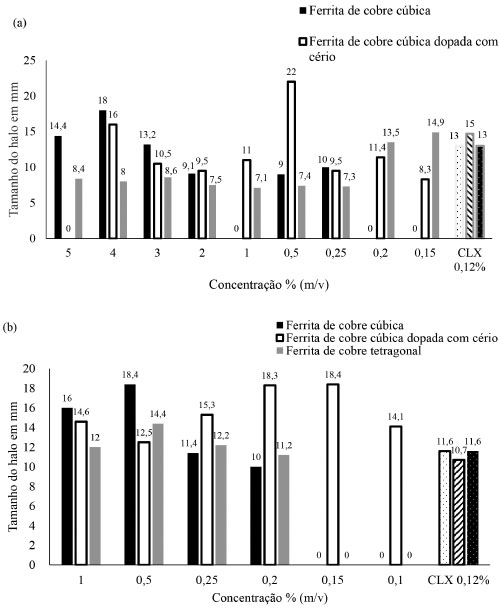 Figura 5. Distribuição do tamanho do halo por concentração da ferrita de cobre frente a S. mutans (a) e E. coli (b) (concentração inibitória mínima por teste de difusão)
No resultado do teste de concentração inibitória mínima (CIM) por difusão frente a E. coli, a ferrita de cobre cúbica dopada com cério (c-CuCeFe2O4) demonstrou melhor atividade, levando em consideração o tamanho do halo, frente a S. mutans, na concentração de 0,5%. A ferrita de cobre cúbica sem dopagem (c-CuFe2O4) também teve seu melhor desempenho da concentração de 0,5% e a ferrita de cobre tetragonal (t-CuFe2O4) na concentração de 0,15%, demonstrando que em menores concentrações há um melhor desempenho da partícula quando frente a E. coli (Figura 5b). No presente estudo, bactérias Gram-postivas e Gram-negativas foram susceptíveis à nanopartícula de ferrita, corroborando resultados de estudos prévios.24,27,28 A diferença nas rotas de síntese das ferritas: método sol-gel com ácido cítrico,24 coprecipitação27 e combustão,28 bem como falta de padronização das cepas bacterianas podem justificar diferentes efeitos observados nas bactérias Gram-positivas e Gram-negativas entre os estudos. Alguns pesquisadores2,29,30,31 afirmam que o mecanismo antibacteriano das NPs pode ser dividido em três tipos: o primeiro mecanismo seria as NPs interagindo com a parede e membrana celular do peptidoglicano e causando lise celular; o segundo mecanismo seria a interação das NPs com proteínas bacterianas e interrompendo a síntese de proteínas; e o terceiro mecanismo seria a interação das NPs com o DNA bacteriano (citoplasmático) e prevenindo a replicação do mesmo. Apesar da significativa atividade antibacteriana das NPs, ainda existem limitações para aplicação, que incluem concentrações antibacterianas inconsistentes contra microbiofilme, toxicidade e efeitos potencialmente indesejáveis no corpo humano. À medida que o tamanho da partícula diminui, a relação c-CuFe2O4/t-CuFe2O4 aumenta, levando a um aumento no valor líquido de magnetização de saturação. Além disso, a formação de vacâncias de oxigênio e Cu2+ na rede cristalina da ferrita e estabilização da ferrita cúbica de cobre cúbica em condições normais32 podem explicar o efeito biocida superior a fase cúbica quando comparada à fase tetragonal de CuFe2O4. Estudo prévio26 sugeriu um mecanismo de ação como alvo à membrana celular, com redução de Cu2+, pois o Cu+ tem forte afinidade de ligação e capacidade de redução de próteinas na membrana celular. Assim, com a produção de espécies reativas de oxigênio, ocorre quebra do DNA e desnaturação de proteínas funcionais. A atividade biocida do material pode ser potencializada pela produção de diferentes espécies altamente oxidantes.33 Testes de microdureza Diante da análise da ferrita, surge a perspectiva de agregar valor ao cimento ionomérico pela incorporação das nanopartículas, entretanto, a incorporação da ferrita de cobre reduziu a eficiência mecânica do material restaurador, reduzindo a dureza do material, prejudicou também a estética, já que o material apresentou coloração escurecida após sua manipulação. Por meio do parâmetro de dureza Vickers, observou-se que aumentando a concentração da ferrita, maiores efeitos sobre as propriedades físicas da mistura foram encontrados, porém sem diferença estatisticamente significante, como pode ser visto na Tabela 3. O grupo controle foi o material com os maiores valores de dureza, apresentando diferença estatisticamente significante entre os grupos que apresentaram modificação por ferrita (p = 0,008).
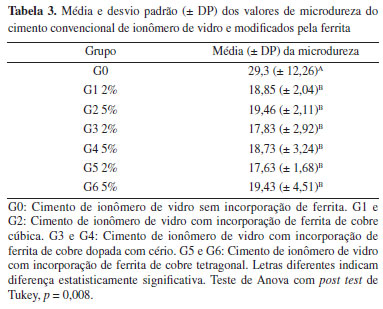
Sugere-se, em contrapartida, que o aumento da concentração de algum tipo de agente antimicrobiano pode provocar uma diminuição na reação entre as partículas de vidro e o líquido do cimento de ionômero de vidro (CIV), aumentando tanto o número de partículas não reagidas quanto a absorção de água, o que pode diminuir a resistência do CIV à compressão.34
CONCLUSÕES A análise morfológica das amostras demonstrou que a ferrita de simetria cúbica e a cúbica dopada com cério apresentaram partículas de morfologia esféricas, enquanto a ferrita de simetria tetragonal apresentou morfologia de partículas esféricas levemente distorcidas. A ferrita de cobre apresentou potencial bacteriostático e bactericida frente ao Streptococcus mutans e a Escherichia coli em crescimento planctônico, sendo mais efetiva contra S. mutans. Observou-se que a ferrita de cobre de simetria cúbica sem dopagem apresentou melhores resultados que as demais amostras, o que pode estar relacionado a possíveis vacâncias de oxigênio, ou ao menor tamanho de partículas, sua simetria e consequentemente maior área superficial de contato. No que diz respeito a dopagem com cério na ferrita de cobre cúbica, esta não resulta na melhoria da qualidade da amostra no que diz respeito a atividade antimicrobiana, nem a dispensação de elevada energia de calcinação na formação da ferrita de cobre tetragonal se mostra efetiva. Logo, a ferrita de cobre cúbica pura seria a mais adequada para estudo de mercado. Os resultados deste estudo in vitro demonstraram que incorporação da ferrita de cobre ao CIV reduziu a resistência mecânica do material restaurador, além do prejuízo estético, levando a uma repercussão clínica negativa. Logo, não há necessidade de estudos adicionais para avaliar os efeitos clínicos e eficácia da mistura de ferrita com o cimento de ionômero de vidro. Sugere-se, como perspectivas futuras do produto, que a incorporação da ferrita possa ser realizada para testes antimicrobianos em outros materiais quando não ocorra necessidades estéticas ou de resistência mecânica.
AGRADECIMENTOS Os autores agradecem ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo apoio financeiro.
REFERÊNCIAS 1. Samavati, A.; Ismail, A. F.; Particuology 2017, 30, 158. [Crossref] 2. Chen, G.; Qiu, H.; Prasad, P. N.; Chen, X.; Chem. Rev. 2014, 114, 5161. [Crossref] 3. European Comission, http://ec.europa.eu/environment/chemicals/nanotech/#definition, acessado em Outubro 2023. 4. Gharibshahian, M.; Nourbakhsh, M. S.; Mirzaee, O.; J. Sol-Gel Sci. Technol. 2018, 85, 684. [Crossref] 5. Saafan, A.; Zaazou, M. H.; Sallam, M. K.; Mosallam, O.; El Danaf, H. A.; Open Access Macedonian Journal of Medical Sciences 2018, 6, 1289. [Link] acessado em Outubro 2023 6. Iqbal, S.; Alam, M. F.; Atif, M.; Amin, N.; Alimgeer, K. S.; Ali, A.; Ahmad, A.; Hanif, A.; Farooq, W. A.; Results Phys. 2019, 15, 102529. [Crossref] 7. Ashour, A.; El-Batal, A. I.; Maksoud, M. A.; El-Sayyad, G. S.; Labib, S.; Abdeltwab, E.; El-Okr, M.; Particuology 2018, 2, 141. [Crossref] 8. Kazemi, M.; Ghobadi, M.; Mirzaie, A.; Nanotechnol. Rev. 2018, 7, 43. [Crossref] 9. Elayakumar, K.; Manikandan, A.; Dinesh, A.; Thanrasu, K.; Raja, K. K.; Kumar, R. T.; Slimani, Y.; Jaganathan, S. K.; Baykal, A.; J. Magn. Magn. Mater. 2019, 478, 140. [Crossref] 10. Lima, C. G.; Silva, R. M.; Aquino, F. D. M.; Raveau, B.; Caignaert, V.; Cesario, M. R.; Macedo, D. A.; Mater. Chem. Phys. 2017, 187, 177. [Crossref] 11. Mahdikhah, V.; Ataie, A.; Babaei, A.; Sheibani, S.; Ow-Yang, C. W.; Abkenar, S. K.; J. Phys. Chem. Solids 2019, 134, 286. [Crossref] 12. Pratten, J.; Wills, K.; Barnett, P.; Wilson, M.; J. Appl. Microbiol. 1998, 84, 1149. [Crossref] 13. Hiratsuka, R. S.; Santilli, C. V.; Pulcinelli, S. H.; Quim. Nova 1995, 18, 171. [Link] acessado em Outubro 2023 14. Menezes, A. S.; Remédios, C. M. R.; Sasaki, J. M.; da Silva, L. R. D.; Góes, J. C.; Jardim, P. M.; Miranda, M. A. R.; J. Non-Cryst. Solids 2007, 353, 1091. [Crossref] 15. Yonezawa, T.; Kamoshita, K.; Tanaka, M.; Kinoshita, M.; Jpn. J. Appl. Phys. 2008, 47, 1389. [Crossref] 16. Levy, D.; Zayat, M.; The Sol-Gel Handbook, 1st ed.; Wiley-VCH: Weinheim, 2015. 17. CLSI, https://clsi.org/standards/products/microbiology/documents/m02/, acessado em Outubro 2023. 18. Baloch, F. A.; Mirza, A. J.; Baloch, D.; International Journal of Health Sciences 2010, 4, 149. [Link] acessado em Outubro 2023 19. Köferstein, R.; Walther, T.; Hesse, D.; Ebbinghaus, S. G.; J. Solid State Chem. 2014, 213, 57. [Crossref] 20. Ditta, A.; Khan, M. A.; Junaid, M.; Khalil, R. A.; Warsi, M. F.; Phys. B. 2017, 507, 27. [Crossref] 21. Gupta, N.; Jain, P.; Rana, R.; Shrivastava, S.; Mater. Today: Proc. 2014, 4, 342. [Crossref] 22. Ponhan, W.; Maensiri, S.; Solid State Sci. 2009, 11, 479. [Crossref] 23. Balagurov, A. M.; Bobrikov, I. A.; Maschenko, M. S.; Sangaa, D.; Simkin, V. G.; Crystallogr. Rep. 2013, 58, 710. [Crossref] 24. Dabagh, S.; Haris, S. A.; Ertas, Y. N.; J. Cluster Sci. 2023, 34, 2067. [Crossref] 25. Farias, I. A. P.; Santos, C. C. L.; Xavier, A. L.; Batista, T. M.; Nascimento, Y. M.; Nunes, J. M. F. F.; Silva, P. M. F.; Menezes-Júnior, R. A.; Ferreira, J. M.; Lima, E. O.; Tavares, J. F.; Sobral, M. V.; Keyson, D.; Sampaio, F. C.; Arabian J. Chem. 2021, 14, 102888. [Crossref] 26. Gu, Y.; Xiao, F.; Luo, L.; Zhou, X.; Zhou, X.; Li, J.; Li, Z.; Nanomaterials 2019, 10, 18. [Crossref] 27. Mandal, S.; Natarajan, S.; Tamilselvi, A.; Mayadevi, S.; J. Environ. Chem. Eng. 2016, 4, 2706. [Crossref] 28. Gomes, G. A.; Costa, G. L.; Figueiredo, A. B. S.; J. Mater. Res. Technol. 2018, 7, 381. [Crossref] 29. Cao, W.; Zhang, Y.; Wang, X.; Chen, Y.; Li, Q.; Xing, X.; Xiao, Y.; Peng, X.; Ye, Z.; J. Mater. Sci.: Mater. Med. 2017, 28, 103. [Crossref] 30. Moreira, D. M.; Oei, J.; Rawls, H. R.; Wagner, J.; Chu, L.; Li, Y.; Zhang, W.; Whang, K.; The Angle Orthodontist 2015, 85, 175. [Crossref] 31. Song, W.; Ge, S.; Molecules 2019, 24, 1033. [Crossref] 32. Saikova, S.; Pavlikov, A.; Karpov, D.; Samoilo, A.; Kirik, S.; Volochaev, M.; Trofimova, T.; Velikanov, D.; Kuklin, A.; Materials 2023, 16, 2318. [Crossref] 33. Oliveira, M. C.; Assis, M.; Simões, L. G. P.; Minozzi, D. T.; Ribeiro, R. A. P.; Andrés, J.; Longo, E.; ACS Appl. Mater. Interfaces 2023, 15, 6548. [Crossref] 34. Prabhakar, A. R.; Prahlad, D.; Kumar, S. R.; Pediatric Dentistry 2013, 35, 411. [Link] acessado em Outubro 2023 |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access






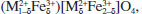 , em que δ é o grau de inversão que define a fração de íons divalentes (M2+) e íons trivalentes (Fe3+) nos sítios tetraédricos (A) e octaédricos [B]. A partir dos resultados de refinamento de Rietveld (Tabela 1) entende-se que todas as ferritas de cobre obtidas são do tipo espinélio misto, uma vez que os íons Cu2+ ocupam tanto os sítios tetraédricos quanto os sítios octaédricos. Os parâmetros de rede das amostras calcinadas estão de acordo com os relatados em trabalhos anteriores.6,9,19 De acordo com os fatores de concordância do refinamento Rietveld (Tabela 1), observa-se que os valores de χ2 = Rwp /Rexp indicam boa concordância entre os dados experimentais e calculados.
, em que δ é o grau de inversão que define a fração de íons divalentes (M2+) e íons trivalentes (Fe3+) nos sítios tetraédricos (A) e octaédricos [B]. A partir dos resultados de refinamento de Rietveld (Tabela 1) entende-se que todas as ferritas de cobre obtidas são do tipo espinélio misto, uma vez que os íons Cu2+ ocupam tanto os sítios tetraédricos quanto os sítios octaédricos. Os parâmetros de rede das amostras calcinadas estão de acordo com os relatados em trabalhos anteriores.6,9,19 De acordo com os fatores de concordância do refinamento Rietveld (Tabela 1), observa-se que os valores de χ2 = Rwp /Rexp indicam boa concordância entre os dados experimentais e calculados.