Artigo
|
|
| Alcaloides sesquiterpênicos isolados de Maytenus distichophylla (Celastraceae) Sesquiterpenes alkaloids from Maytenus distichophylla (Celastraceae) |
|
Pedro Thiago Ramalho de FigueiredoI; Marcelo Cavalcante DuarteII; Laísa Vilar CordeiroI; Renata Priscila Barros de MenezesI; Edeltrudes de Oliveira LimaI; Marcus Tullius ScottiI; Josean Fechine TavaresI; Vicente Carlos de Oliveira CostaI; Marcelo Sobral da SilvaI,*
I. Centro de Ciências da Saúde, Universidade Federal da Paraíba, 58051-900 João Pessoa - PB, Brasil Recebido em: 21/09/2022 *e-mail: marcelosobral.ufpb@gmail.com The phytochemical study of the roots of Maytenus distichophylla Mart. ex Reissek (Celastraceae), resulted in the isolation of the seven sesquiterpenes pyridine alkaloids euojaponine F (1), euojaponine K (2), ebinifoline W-I (3), wilforine (4), maiteine (5), euojaponine A (6) and ebinifoline E-II (7). The structures of compounds were established using spectroscopic techniques such as 1D and 2D NMR. All compounds were subjected to an in silico study through of a predictive model and then submitted to in vitro testing against S. epidermidis, P. aeruginosa, C. parapsilosis and C. albicans for evaluation of their antimicrobial activity. The compounds tested showed bacterial and fungal growth inhibition with MIC values 1024 and 256 µg mL-1, respectively. INTRODUÇÃO O gênero Maytenus (sinônimo Monteverdia) é considerado o maior em representatividade dentro da família Celastraceae, com aproximadamente 123 espécies distribuídas geograficamente em regiões de climas tropicais e subtropicais do mundo.1,2 No continente americano este gênero está presente desde do extremo sul da Argentina, precisamente na terra do fogo, até o sul dos Estados Unidos.3 No Brasil, espécies do gênero Maytenus podem ser encontradas nos seis biomas brasileiros (Amazônia, Caatinga, Cerrado, Mata Atlântica, Pampa, Pantanal), sendo relatadas 49 espécies, das quais 36 são consideradas endêmicas.4,5 As raízes de espécies de Maytenus apresentam grande importância para a medicina popular, com destaque para o tratamento dos distúrbios do trato gastrointestinal, como diarreias e úlceras pépticas.6,7 Maytenus apresenta uma grande diversidade de metabólitos secundários. Dentre eles, incluem-se os alcaloides piridínicos sesquiterpênicos. Tais compostos são estruturas macrocíclicas, formadas pela esterificação de um sesquiterpeno polioxigenado do tipo dihidro-β-agarofurano com diferentes ácidos dicarboxílicos nicotínicos (ácido evonínico, ácido wilfordico, ácido edulínico e ácido cassínico). Destacam-se por possuírem atividades leishmanicida, antitumoral, inseticida, imunossupressora, anti-HIV e anti-inflamatória, além de serem considerados marcadores químicos das raízes das espécies de Maytenus.8,9 Maytenus distichophylla (sinônimo Monteverdia distichophylla) é conhecida popularmente como "pau-colher", "casca-amarela", "pau-doce". É uma árvore de porte médio, arbustiva, chegando a até 12 metros de altura. Considerada uma espécie endêmica do Brasil, M. distichophylla apresenta boa adaptação às regiões da caatinga, principalmente à região do semiárido nordestino e do bioma da mata atlântica. Essa espécie é encontrada com mais frequência em alguns estados do litoral brasileiro, como no Nordeste (Alagoas, Bahia, Paraíba, Pernambuco, Rio Grande do Norte e Sergipe) e Sudeste (Espirito Santo), embora também seja identificada em algumas cidades do estado de Minas Gerais.10,11 Das raízes de M. distichophylla, já foi relatado o isolamento de triterpenos dos tipos friedelano, oleanano, além de quionanametideos.12 Observa-se, assim, que Maytenus representa um dos gêneros mais utilizados na medicina popular. Com importantes propriedades farmacológicas, apresentando uma riqueza de classes de metabólitos secundários, onde se destacam os alcaloides piridínicos sesquiterpênicos que são encontrados nas raízes de exemplares desse gênero. Entretanto, não são encontrados relatos de isolamento de alcaloides piridínicos sesquiterpênicos em M. distichophylla, tornando-se relevante a investigação da presença desses constituintes químicos na espécie, de forma a contribuir para o enriquecimento do conhecimento científico sobre o gênero. Nesse sentido, este artigo relata os primeiros alcaloides piridínicos sesquiterpênicos isolados das raízes de M. distichophylla, bem como, o estudo in silico e in vitro de extratos, fases e substâncias isoladas.
PARTE EXPERIMENTAL Procedimentos experimentais gerais Para análise e desenvolvimento de metodologias analíticas dos extratos e frações de M. distichophylla foi utilizada a cromatografia líquida de alta eficiência (CLAE) analítica, com auxílio do equipamento Shimadzu Prominence, detector DAD SPD-M20A e colunas de fase reversa C18 (250 mm × 4,6 mm preenchida com partículas de 10 μm). O fluxo empregado para as análises em escala analítica foi de 0,6 mL min-1, o volume de injeção foi de 20 µL e as amostras preparadas na concentração de 1 mg min-1. Os isolamentos em CLAE, na escala semi-preparativa, ocorreram no equipamento Shimadzu, detector DAD SPD-M10A VP. A coluna utilizada no procedimento foi uma ACE-5 C18 (250 mm × 21,2 mm e partículas de 5 µm). O fluxo da fase móvel foi de 8,0 mL min-1, com volume de injeção da amostra de 100 µL, as quais foram preparadas em concentrações de até 100 mg min-1, variando de acordo com suas características das frações. Para ambos os procedimentos, foram utilizados como fase móvel MeOH grau de pureza HPLC (Tedia®) (solvente B) e água ultrapura (purificada em sistema Milli-Q®) (solvente A), puros ou em misturas binárias. Os espectros de ressonância magnética nuclear (RMN), uni e bidimensionais, foram registrados nos espectrômetros da Varian System operando a 500 MHz (RMN 1H) e 125 MHz (RMN 13C) e no aparelho da Bruker Ascend operando a 400 MHz (RMN 1H) e 100 MHz (RMN 13C) do Laboratório Multiusuário de Caracterização e Análise (LMCA) da UFPB. O solvente empregado para a dissolução das amostras foi o clorofórmio deuterado (CDCl3) e metanol deuterado (CD3OD), cujos picos característicos do solvente em RMN 1H (7,24 ppm), 13C (77,00 ppm) e 1H (3,33 ppm), 13C (49,00 ppm), que respectivamente serviram como padrões internos durante a obtenção dos espectros. Material vegetal As raízes de M. distichophylla foram obtidas no município de Maturéia, PB e identificadas pela Profa. Dra. Maria de Fátima Agra, do setor de botânica do Centro de Biotecnologia. Uma exsicata encontra-se depositada no herbário Prof. Lauro Pires Xavier do Centro de Ciências Exatas e da Natureza (CCEN) da Universidade Federal da Paraíba (UFPB) sob número AGRA 7448. Esta espécie está registrada na plataforma do Sistema Nacional de Gestão do Patrimônio Genético e do Conhecimento Tradicional Associado (SisGen) sob código AF001C4. Extração e isolamento O material botânico coletado foi desidratado em estufa com ar circulante utilizando temperatura média de 45 °C durante 72 h. Após a secagem o material foi submetido a um processo de trituração em moinho mecânico, onde foram obtidos 3,620 kg do pó das raízes de M. distichophylla. Em seguida, este pó foi submetido à maceração com etanol (EtOH) a 95% em recipiente de aço inoxidável por 72 h. A solução hidroetanólica foi concentrada em evaporador rotativo obtendo-se 622,97 g das raízes. Previamente, foram solubilizados 50 g do extrato etanólico bruto em hexano (Hex) para o procedimento de retirada dos compostos mais apolares com agitação mecânica realizada pelo aparelho da Ethik Tecnology (Modelo M110-VER-4K3) durante 60 min. Após a evaporação do solvente foram obtidas 322 mg do extrato Hex. O resíduo não solúvel em Hex, foi solubilizado em H2O:MeOH (7:3) e esta solução hidrometanólica foi submetida a um processo de partição líquido-líquido com os solventes Hex (100%), Hex:AcOEt (8:2), DCM (100%), AcOEt (100%) e n-BuOH (100%). As soluções obtidas foram tratadas com sulfato de sódio anidro (NaSO4) e submetidas à filtração sob pressão reduzida. Após este processo, as soluções foram concentradas em evaporador rotativo a 45 °C e obtidas as seguintes fases: Hex (FH) (1,2 g), Hex:AcOEt (FHA) (8:2) (0,22 g), DCM (FDCM) (0,56 g), AcOEt (FA) (39,8 g) e n-BuOH (FB) (6,0 g). Sendo assim, prontas para a realização dos procedimentos cromatográficos. FHA foi submetida a uma análise exploratória em CLAE-DAD na escala analítica para a visualização do seu perfil cromatográfico. Em seguida, FHA foi purificada por CLAE-DAD semi-preparativa utilizando um gradiente de concentração de 10 a 100% de B em 60 min a 220 nm, obtendo os compostos 3 (1,3 mg, tr 53,8 min), 5 (2,0 mg, tr 43,2 min) e 7 (0,8 mg, tr 56,4 min). FDCM (220 g) foi submetida a um processo cromatográfico utilizando como fase estacionária um cartucho C-18 em sistema a vácuo com auxílio de um manifold e como fase móvel um gradiente de H2O:MeOH obtendo 5 frações. A fração 4 obtida em MeOH:H2O (8:2) foi analisada por cromatografia em camada delgada analítica (CCDA) e selecionada para também ser previamente analisada por CLAE-DAD na escala analítica e em seguida foi purificada por CLAE-DAD preparativa utilizando um gradiente de concentração de 60 a 100% de B em 60 min a 220 nm para a obtenção de 1 (7,5 mg, tr 36,4 min), 2 (1,2 mg, tr 29,3 min), 4 (1,0 mg, tr 35,5 min) e 6 (1,5 mg, tr 40,2 min). Banco de dados A partir do ChEMBL database13,14 foram selecionados quatro conjuntos de estruturas químicas com atividade conhecida para os microrganismos Candida albicans, Candida parapsilosis, Pseudomonas aeruginosa e Staphylococcus epidermides para a construção de modelos preditivos. Os compostos foram classificados a partir da pMIC50 (-log MIC50) em mol L-1, ressaltando que a MIC50 representa a concentração mínima necessária para uma inibição de 50% dos microrganismos estudados. Para todas as estruturas foram utilizados códigos SMILES como dados de entrada para o Marvin 14.9.1.0, 2014, ChemAxon (http://www.chemaxon.com).15 Usou-se ainda o software Standardizer JChem 14.9.1.0, 2014, ChemAxon (http://www.chemaxon.com),16 o qual converte as diversas estruturas químicas em representações canônicas personalizadas. Esta padronização é de suma importância para criar bibliotecas de compostos consistentes, além de obter as estruturas em formas canônicas, adicionar hidrogênios, aromatizar, gerar o 3D e salvar os compostos em formato SDF. Descritores Volsurf+ v.1.0.7 Foram utilizados descritores moleculares para prever propriedades biológicas e físico-químicas das moléculas dos dois bancos de dados. O cálculo dos descritores é gerado quando as moléculas são transformadas em uma representação molecular que permite o tratamento matemático. O software Volsurf+ v.1.0.717 tem a capacidade de calcular 128 descritores moleculares, utilizando campos de interação molecular (MIFs) através de sondas de N1 (amido nitrogênio-hidrogênio doador de ligação de hidrogênio), O (aceptor de ligação de hidrogênio), OH (água) e DRY (sonda hidrofóbica) e também cálculo de descritores não derivados de MIFs. Modelo de predição O software Knime 3.5 (Knime 3.5.3 the Konstanz Information Miner Copyright, 2003-2017, www.knime.org)18 foi utilizado para realizar as análises e gerar o modelo in silico. Os bancos de moléculas com os descritores calculados foram importados do software Dragon, e para cada um, os dados foram divididos utilizando uma ferramenta Partitioning com a opção de "Amostra estratificada", separando em Treino e Teste, representando 80 e 20% de todos os compostos, respectivamente, onde foram selecionados aleatoriamente, mas mantendo a proporção de substâncias ativas e inativas, em ambos os bancos de dados. Para a validação interna fez-se uso da validação cruzada, onde foram separados 10 grupos estratificados, selecionados aleatoriamente, mas distribuídos de acordo com a variável da atividade em todos os grupos de validação. Com os descritores selecionados, o modelo foi gerado usando o conjunto de treinamento utilizando o Random Forest (RF) que é um algoritmo para construção de árvores de decisão,19 empregado no WEKA.20 Os parâmetros selecionados para RF para todos os modelos gerados foram de 100 o número total de árvores para construir e de 1 semente (seed) na geração de números aleatórios para o modelo. As performances dos testes internos e externos dos modelos foram analisadas quanto a sensibilidade (taxa de verdadeiros positivos, ou seja, a taxa ativa), especificidade (verdadeira taxa de negativos, ou seja, a taxa de inativos) e precisão (previsibilidade geral). Além disso, a sensibilidade e especificidade da curva receiver operating characteristic (ROC), foi utilizada para descrever o verdadeiro desempenho do modelo, com mais clareza do que precisão. O modelo foi analisado também pelo coeficiente de Matthews, uma maneira de avaliar de modo global o modelo a partir dos resultados obtidos da matriz de confusão. O MCC é, em essência, um coeficiente de correlação entre as classificações binárias observadas e preditivas. Dele resulta um valor entre -1 e +1, onde um coeficiente de +1 representa uma previsão perfeita, o 0 nada mais que uma previsão aleatória e o -1 indica total desacordo entre previsão e observação.21,22 O coeficiente de correlação de Matthews pode ser calculado a partir da Equação 1: 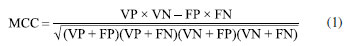 onde VP é o valor de verdadeiros positivos, VN o valor de verdadeiros negativos, FP o valor de falsos positivos e FN de falsos negativos. Foi utilizado ainda o domínio de aplicabilidade baseado nas distâncias euclidianas afim de sinalizar compostos no conjunto teste para os quais as previsões podem ser não confiáveis. São utilizadas medições de similaridade para definir o domínio de aplicabilidade do modelo com base nas distâncias euclidianas entre todos os compostos de treinamento, teste e da triagem virtual. A distância de um composto teste ao seu vizinho mais próximo no conjunto de treinamento é comparada com o limite de domínio de aplicabilidade predefinido, se a similaridade estiver além desse limite, a previsão é considerada não confiável.23 Determinação da concentração inibitória mínima (CIM) Para a determinação da CIM, foram utilizadas como drogas controle gentamicina e anfotericina B obtidas da Merck/Sigma-Aldrich. As substâncias isoladas e as drogas controle foram solubilizadas com dimetilsulfoxido (DMSO) a 5% e em Tween-80 a 2% até obter a concentração inicial de 1024 µg mL-1. Nesse estudo foram utilizadas as cepas de espécies bacterianas Staphylococcus epidermidis ATCC-12228, Pseudomonas aeruginosa ATCC-9027 e cepas fúngicas de Candida parapsilosis ATCC-22019, Candida albicans ATCC-9002, Candida albicans LM-22. Todos os microrganismos utilizados pertencem à Micoteca do Laboratório de Micologia da Universidade Federal da Paraíba, Brasil. Para a preparação do inóculo, colônias obtidas de culturas de cepas bacterianas em meio BHI e fungos em meio ASD, foram suspensas em solução salina 0,9% estéril e ajustadas de acordo com a escala padrão de McFarland para obter 106 UFC mL-1 para fungos e 108 UFC mL-1 para bactérias. Para a determinação da CIM de cada composto, foram realizadas microdiluições em série em placas de 96 poços.24 Paralelamente, foram realizados os controles: viabilidade das cepas, esterilidade do meio de cultura e controle positivo da atividade, utilizandose gentamicina para inibir bactérias e anfotericina B para inibir leveduras. As placas preparadas foram incubadas a 35 ± 2 °C por 24-48 h para os ensaios. A CIM para cada produto foi definida como a menor concentração capaz de inibir visualmente o crescimento microbiano.
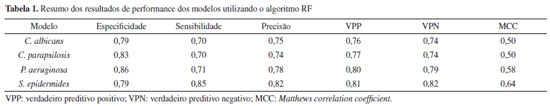
RESULTADOS E DISCUSSÃO O estudo químico das fases Hex:AcOEt (8:2) e diclorometano das raízes de M distichophylla levou ao isolamento de sete alcaloides piridínicos sesquiterpênicos. Suas estruturas químicas foram determinadas com base na análise de dados espectroscópicos de RMN uni e bidimensionais e em comparação com dados da literatura. O composto 1 foi isolado na forma de pó amorfo branco, em que no espectro de RMN de 1H revelou a presença de sinais para 5 grupos acila (δH 2,15, 2,17, 2,13, 1,42, 2,33) e de um grupo benzoila (orto) 7,86 (dd, J 8,4, 1,3 Hz, 1H), (meta) 7,47 (dd, J 8,4, 1,3 Hz, 1H) e (para) 7,61 (t, J 7,5 Hz, 1H). Também foram visualizados a presença de dois grupos metilas δH 1,59 (s, 3H) e 1,66 (s, 3H), cinco hidrogênios oximetínicos δH 5,93 (d, J 3,9 Hz, 1H), 5,21 (dd, J 3,9, 2,6 Hz, 1H), 4,97 (d, J 2,6 Hz, 1H), 6,99 (s, 1H), 5,54 (dd, J 5,8, 3,9 Hz, 1H) e 5,44 (d, J 2,3 Hz, 1H), quatro hidrogênios oximetilênicos δH 5,43 (d, J 13,4 Hz, 1H), 4,68 (d, J 13,4 Hz, 1H), 3,94 (d, J 12,0 Hz, 1H) 5,83 (d, J 12,0 Hz, 1H) e a presença de sinais característicos de um grupo piridínico 2,3 dissubstituído do tipo wilfordato δH 8,47 (dd, J 8, 2 Hz, 1H), 7,45 (dd, J 5, 8 Hz, 1H), 8,73 (dd, J 5, 2 Hz, 1H), 4,02 (ddd, J 13,0, 10,3, 5,7 Hz, 1H), 2,88 (dt, J 13,0, 5,7 Hz, 1H), 1,91 (m, 1H), 2,28 (m, 1H), 2,43 (m, 1H), 1,17 (d, J 7,1 Hz, 1H) (Tabela 1S, material suplementar). No espectro de 13C foram observados duas carbonilas de ésteres (δC 176,4, 168,4) e dois sinais δC 164,9, 126,1 de carbonos quartenários da unidade piridínica, bem como, a presença de três carbonos quartenários oxigenados (δC 71,3, 53,7 e 95,0) e um carbono quaternário alifático δC 53,7 de uma unidade sesquiterpênica (Tabela 2). Através das correlações de HMBC de H-1 com C-9, C-8, C-11 e 1-OBz, de H-11 com C-9, C-8 e C-11OAc e de H-8 com C-9, C-1, C-11 e C-8OAc foi possível definir as posições dos grupos benzoila e acila. A ligação da porção piridínica com a sesquiterpênica foi confirmada através das correlações de HMBC de H-15 com C-12', juntamente com a correlação de H-3 com C-11'. Com essas informações foi possível confirmar que o composto 1 trata-se do alcaloide piridínico sesquiterpênico euojaponina F.25 O composto 2 foi isolado na forma de um pó amorfo branco, apresentou sinais semelhantes ao composto 1. Em 2 foram observados apenas a presença de quatro hidrogênios metílicos de grupos acetil δH 2,16 (s, 1H), 2,11 (s, 1H), 1,40 (s, 1H), 2,29 (s, 1H). Diferentemente do composto 1, no espectro de RMN de 1H de 2 foi observado a presença do deslocamento químico 4,02 (dd, J 3,7, 2,4 Hz, 1H) característico hidrogênio oximetínico próximo a uma hidroxila podendo inferir que na posição C2 temos a ausência de um grupo acila, porém com a presença do grupo hidroxila. Esta informação foi confirmada através das correlações do HMBC de H-3 com C-2, C-1, C-10, C-12 e C-11'. Dessa forma, com os dados de RMN de 1H e 13C e com os dados da literatura foi possível identificar 2 como sendo a euojaponina K.26 O composto 3 foi isolado na forma de um pó amorfo branco, apresentando sinais semelhantes ao composto 1. O composto 3 apresentou deslocamentos químicos de apenas quatro grupos acila δH 2,18 (s, 3H), 2,12 (s, 3H), 1,34 (s, 3H), 2,20 (s, 3H) e a presença de sinais para dois grupos benzoíla δH 7,76 (d, J 7,6 Hz, 2H), 7,29 (t, J 8 Hz, 2H), 7,48 (t, J 7,6 Hz, 1H), 8.06 (d, J 7,6 Hz, 2H), 7,49 (t, J 7,8 Hz, 2H), 7,61 (t, J 7,5 Hz, 1H), bem como, sinais característicos de uma piridina 2,3 dissubstituída do tipo wilfordato (Tabelas 1S e 2S, material suplementar). Em comparação com dados da literatura, esse padrão de deslocamentos químicos confirma que uma das unidades benzoíla está presente em C2. Com base nos dados de RMN 1H e 13C e em comparação com os dados da literatura foi possível concluir que 3 trata-se da ebinifolina W-I.25 O composto 4 foi isolado na forma de um pó amorfo branco, apresentando sinais semelhantes com o composto 1. Através dos dados de RMN de 1H e 13C foi observado a presença de cinco grupos acila e um benzoíla. O composto 4 diferencia-se de 1 pela posição do seu grupo benzoíla. A presença do sinal em dH 1,92 (s, 3H) indica a ausência de um grupo bezoíla na posição 1. Com base nessas informações e com os dados da literatura foi possível concluir que 4 trata-se da wilforina.27 O composto 5 foi isolado na forma de um pó amorfo branco, apresentando sinais semelhantes com o composto 1. Em que no espectro de RMN de 1H revelou a presença de 5 sinais para grupos acila δH 2,13 (s, 3H), 2,19 (s, 3H), 2,10 (s, 3H), 1,37 (s, 3H), 2,32 (s, 3H) e a presença de um grupo benzoíla δH 7,78 (dd, J 8,4, 1,3 Hz, 2H), 7,37 (t, J 7,4 Hz, 2H), 7,51 (t, J 7,4 Hz, 1H) (Tabelas 1S e 2S). Também foram visualizadas a presença de uma piridina 2,3 dissubstituída δH 8,06 (dd, J 7,8, 1,8 Hz, 1H), 7,25 (dd, J 7,8, 4,9 Hz, 1H), 8,68 (dd, J 4,9, 1,8 Hz, 1H), 4,63 (m, 1H), 2,58 (dd, J 7,1, 1,1 Hz, 1H), 1,38 (d, J 7,1 Hz, 1H), 1,19 (d, J 7,1 Hz, 1H), porém, neste espectro foi observado um padrão de substituição diferente do composto 1 no qual a presença dos sinais de metilas dupletos δH 1,38 (d, J 7,1 Hz, 1H), 1,19 (d, J 7,1 Hz, 1H) indica que esta piridina é do tipo evoninato. Com essas informações de RMN de 1H e 13C e em comparação com dados da literatura foi possível identificar 5 como sendo a maiteína.28 O composto 6 foi isolado na forma de um pó amorfo branco, com sinais de RMN de 1H e 13C semelhantes com 5, apresentando 4 grupos acila δH 2,14 (s, 3H), 2,08 (s, 3H), 1,37 (s, 3H), 2,21 (s, 3H) e 1 grupo benzoíla δH 7,79 (dd, J 8,3, 1,2 Hz, 2H), 7,36 (t, J 7,7 Hz, 2H), 7,51 (t, J 7,4 Hz, 1H). Este diferencia-se de 5 pela ausência de um sinal de um grupo acila. A presença δH 5,46 (d, J 2,8 Hz, 1H) sugere que na posição 5 encontra-se uma hidroxila. Essas informações foram confirmadas ao analisar os espectros de RMN de HMBC por meio das correlações entre H-1 com C-9, C-8, C-11 e 1-OBz, de H-11 com C-9, C-8 e de H-8 com C-9, C-1, C-11 e C-8OAc. Com esses dados e em comparação com a literatura foi possível identificar 6 como sendo euojaponina A.28 O composto 7 foi isolado na forma de um pó amorfo branco, com sinais semelhantes com composto 5. O composto 7 diferencia-se de 5 por apresentar de quatro grupos acila e dois benzoíla. A posição do OBz em C5 foi confirmada através das correlações de HMBC de H-5 com C-10, 5OBz(C=O) e C-13. Com base nesses dados e em comparação com a literatura foi possível identificar 7 como sendo a ebinifolina E-II25 (Tabelas 1S e 2S). Análise dos modelos preditivos antimicrobianos Na análise de performance dos modelos gerados, foi observado que os modelos preditivos contra os microrganismos C. albicans, C. tropicalis, C. parapsilosis, P. aeruginosa e S. epidermides obtiveram bons resultados de desempenho, com precisão superior a 70%. As boas performances também foram observadas na análise de curva ROC, com valores superiores a 0,82. Desta forma é possível afirmar que os modelos possuem boas taxas de precisão, performance e robustez, além de uma boa capacidade de predição (Tabela 1 e Figura 2).
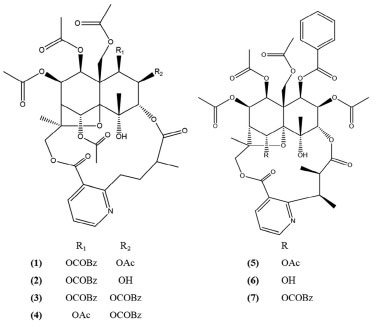 Figura 1. Alcaloides piridínicos sesquiterpênicos isolados de M. distichophylla
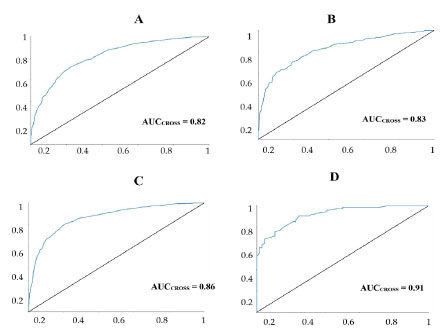 Figura 2. Curva ROC, verdadeiros positivos versus falsos positivos, gerado para os modelos de RF selecionados para validação cruzada; (A) C. albicans, (B) C. parapsilosis (C) P. aeruginosa e (D) S. Epidermides. AUC = valor da área sob a curva
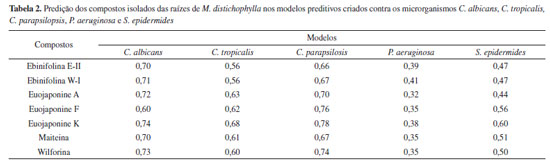
As moléculas foram preditas como ativas contra os microorganismos C. albicans, C. tropicalis e C. parapsilopsis com potencial atividade variando entre 54 a 79%. Já para a bactéria P. aeruginosa, as moléculas foram preditas como inativas. Para o modelo de S. epidermides algumas moléculas foram inativas e outras ativas. Os resultados das predições podem ser observados na Tabela 2. Dada as boas performances dos modelos gerados, foi realizada, então, a triagem das sete moléculas isoladas neste estudo, a fim de avaliar o perfil antimicrobiano dessas substâncias.
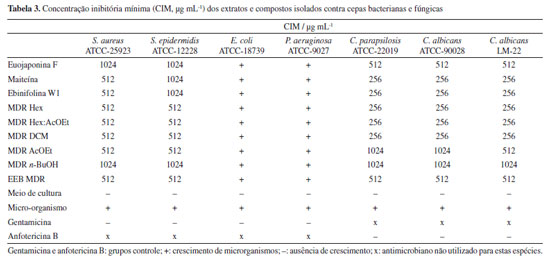
Avaliação da atividade antimicrobiana Na Tabela 3 estão registrados os resultados da avaliação da atividade antimicrobiana das substâncias isoladas e fases orgânicas de M. distichophylla. Todas as amostras foram capazes de inibir o crescimento microbiano das cepas S. epidermidis ATCC-12228, C. parapsilosis ATCC-22019, C. albicans ATCC-90028 e C. albicans LM-22 nas concentrações entre 1024-256 µg mL-1. As substâncias maiteína (5), ebinifolina W1 (3) e as fases MDR (Maytenus distichophylla raiz) Hex, MDR Hex:AcOEt e MDR DCM apresentaram as maiores atividades contra as cepas C. albicans ATCC-90028, LM-22 e C. parapsilosis ATCC-22019, inibindo o crescimento das leveduras na concentração de 256 µg mL-1. Para as cepas bacterianas a inibição ficou entre 1024-512 µg mL-1, entretanto, nenhuma das substâncias e fases foram capazes de inibir o crescimento microbiano da cepa de P. aeruginosa.29
CONCLUSÕES A investigação fitoquímica das fases Hex:AcOEt (8:2) e DCM das raízes de M. distichophylla levou ao isolamento de sete alcaloides piridínicos sesquiterpênicos: euojaponine F (1), euojaponine K (2), ebinifolina W-I (3), wilforina (4), maiteína (5), euojaponina A (6) e ebinifolina E-II (7), todos relatados pela primeira vez em M. distichophylla. Todas as amostras foram capazes de inibir o crescimento microbiano corroborando com os resultados do estudo computacional, porém as MICs de 256/512 µg mL-1 foram consideradas como uma fraca atividade frente as cepas avaliadas. MATERIAL SUPLEMENTAR O material suplementar desse trabalho está disponível em http://quimicanova.sbq.org.br/, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS Os autores agradecem à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) (código de financiamento 001) e ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo suporte financeiro e bolsas de pesquisa, ao Laboratório Multiusuário de Caracterização e Análise (LMCA-UFPB), ao Laboratório de Micologia da UFPB e ao Laboratório de Quimioinformática da UFPB.
REFERÊNCIAS 1. Huang, Y. Y.; Chen, L.; Ma, G. X.; Xu, X. D.; Jia, X. G.; Deng, F. S.; Li, X. J.; Yuan, J. Q.; Molecules 2021, 26, 4563. [Crossref] 2. Cessa, R. M. A.; Silva, P. S. R.; Barbosa, T.; Oliveira, M. L.; Brazilian Journal of Development 2021, 7, 103001. [Crossref] 3. Biral, L.; Simmons, M. P.; Smidt, E. C.; Tembrock, L. R.; Bolson, M.; Archer, R. H.; Lombardi, J. A.; Syst. Bot. 2017, 42, 680. [Crossref] 4. Zappi, D. C.; Filardi, F. L. R.; Leitman, P.; Souza, V. C.; Walter, B. M. T.; Pirani, J. R.; Morim, M. P.; Queiroz, L. P.; Cavalcanti, T. B.; Mansano, V. F.; Forzza, R. C.; Rodriguesia 2015, 66, 1085. [Crossref] 5. Biral, L.; Smidt, E. C.; Bolson, M.; Lombardi, J. A.; Phytotaxa 2015, 231, 53. [Crossref] 6. Maldonado, C. S.; Araya, B. F.; Sánchez, V. S.; Bernal, J. S.; Fuentes, L. A.; Díaz, A. A.; Hansen, M. E. Z.; Electron. J. Biotechnol. 2022, 56, 47. [Crossref] 7. Veloso, C. C.; Soares, G. L.; Perez, A. C.; Rodrigues, V. G.; Silva, F. C.; Rev. Bras. Farmacogn. 2017, 27, 533. [Crossref] 8. Din, A. U.; Siddiqui, B. S.; J. Braz. Chem. Soc. 2022, 33, 1386. [Crossref] 9. Callies, O.; Núñez, M. J.; Perestelo, N. R.; Reyes, C. P.; Romero, D. T.; Jiménez, I. A.; Bazzocchi, I. L.; Phytochemistry 2017, 142, 21. [Crossref] 10. Camargo, K. C.; Aguilar, M. G.; Moraes, A. R. A.; Castro, R. G.; Szczerbowski, D.; Miguel, E. L. M.; Oliveira, L. R.; Sousa, G. F.; Vidal, D. M.; Duarte, L. P.; Molecules 2022, 27, 959. [Crossref] 11. Duarte, M. C.; Tavares, J. F.; Madeiro, S. A. L.; Costa, V. C. O.; Barbosa, J. M. B.; Agra, M. F.; Braz, R.; Silva, M. S.; J. Braz. Chem. Soc. 2013, 24, 1697. [Crossref] 12. Morales, S. A.; Aguilar, M. G. D.; Pereira, R. C.; Duarte, L. P.; Sousa, G. F.; Oliveira, D. M. D.; Evangelista, F. C. B.; Sabino, A. P.; Viana, R. O.; Alves, V. S.; Vieira-Filho, S. A.; Quim. Nova 2020, 43, 1066. [Crossref] 13. Willighagen, E. L.; Waagmeester, A.; Spjuth, O.; Ansell, P.; Williams, A. J.; Tkachenko, V.; Hastings, J.; Chen, B.; Wild, D. J.; J. Cheminf. 2013, 5, 23. [Crossref] 14. Mendez, D.; Gaulton, A.; Bento, A. P.; Chambers, J.; De Veij, M.; Félix, E.; Magariños, M. P.; Mosquera, J. F.; Mutowo, P.; Nowotka, M.; Gordillon-Maranon, M.; Hunter, F.; Junco, F.; Mugumbate, G.; Rodriguez-Lopez, M.; Atkinson, F.; Bosc, N.; Radoux, C. J.; Segura-Cabrera, A.; Hersey, A.; Leach, A. R.; Nucleic Acids Res. 2019, 47, D930. [Crossref] 15. ChemAxon; Marvin; https://www.chemaxon.com, acessado em Outubro 2023. 16. ChemAxon; Standardizer; https://www.chemaxon.com, acessado em Outubro 2023. 17. Cruciani, G.; Pastor, M.; Guba, W.; Eur. J. Pharm. Sci. 2000, 11, S29. [Crossref] 18. Berthold, M. R.; Cebron, N.; Dill, F.; Gabriel, T. R.; Kötter, T.; Meinl, T.; Ohl, P.; Thiel, K.; Wiswedel, B.; ACM SIGKDD Explorations Newsletter 2009, 11, 26. [Crossref] 19. Salzberg, S.; Quinlan, R.; Machine Learning 1994, 16, 235. [Crossref] 20. Bouckaert, R. R.; Frank, E.; Hall, M. A.; Holmes, G.; Pfahringer, B.; Reutemann, P.; Witten, I. H.; Journal of Machine Learning Research 2010, 11, 2533. [Link] acessado em Setembro 2023 21. Chicco, D.; Jurman, G.; BMC Genomics 2020, 21, 6. [Crossref] 22. Matthews, B. W.; Biochim. Biophys. Acta, Protein Struct. 1975, 405, 442. [Crossref] 23. Weaver, S.; Gleeson, M. P.; J. Mol. Graphics Modell. 2008, 26, 1315. [Crossref] 24. CLSI; M07 Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically, 11th ed.; Clinical and Laboratory Standards Institute, Wayne, 2018. [Link] acessado em Setembro 2023 25. Itokawa, H.; Shirota, O.; Morita, H.; Takeyaa, K.; Iitakab, Y.; J. Chem. Soc., Perkin Trans. 1 1993, 11, 1247. [Crossref] 26. Han, B. H.; Ryu, J. H.; Han, Y. N.; Park, M. K.; Park, J. H.; Naoki, H.; J. Nat. Prod. 1990, 53, 909. [Crossref] 27. Monache, F. D.; Bettolo, G. M.; Bernays, E. A.; J. Appl. Entomol. 1984, 97, 406. [Crossref] 28. Han, B. H.; Park, M. K.; Ryu, J. H.; Park, J. H.; Naoki, H.; Phytochemistry 1990, 29, 2303. [Crossref] 29. Peixoto, I. N.; Souza, H. D. S.; Lira, B. F.; Silva, D. F.; Lima, D. O.; Barbosa-Filho, J. M.; Athayde-Filho, P. F.; J. Braz. Chem. Soc. 2016, 27, 1807. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access