Artigo
|
|
| Nanopartículas de zeína/PVA incorporadas com eugenol e óleo essencial do cravo-daíndia: otimização da síntese e validação analítica para quantificação do eugenol Zein/PVA nanoparticles loaded with eugenol and clove essential oil: optimization of synthesis and analytical validation for eugenol quantification |
|
Vanessa A. VelozI; Luise R. dos SantosI; Juliano G. AmaralII; Laryana B. GarciaII; Rosilene A. OliveiraI; Rodrigo Luis S. R. SantosI,*
I. Departamento de Química, Universidade Estadual de Santa Cruz, 45654-165 Ilhéus - BA, Brasil Recebido em: 25/03/2023 *e-mail: rrsantos@uesc.br Nanoparticles of zein (NPZ) stabilized with surfactant polyvinyl alcohol (PVA), and nanoparticles of zein/PVA loaded with eugenol (NPZ-Eug) and the essential oil extracted from the clove (Syzygium aromaticum) (NPZ-OC) were produced by nanoprecipitation method. The extraction method of essential oil of the clove was carried out by the hydrodistillation technique, obtaining a content of 81.5% (m/m) of eugenol. The nanoparticle preparation method was optimized using a one-factor-at-a-time design of experiments, where different levels of variables (zein concentration, PVA concentration, and eugenol concentration) were explored. The best condition of synthesis was obtained with 0.3% (m/v) zein, 0.6% (m/v) PVA and 1.5 mg L-1 eugenol or essential oil of the clove, reaching NPs with acceptable propriety for stable nanoparticulate systems: size particles (NPZ = 113, NPZ-Eug = 229 and NPZ-OC = 279 nm), polydispersity index (PDI < 0.26), and zeta potential (≈ -30 mV). Loaded NPs showed encapsulation efficiency and drug-loading of 52 and 20% (NPZ-Eug), and 62, 27% (NPZ-OC), respectively. The quantification method of eugenol was validated by analytical parameters. Finally, all NPs produced exhibited good colloidal stability, confirming the effectiveness of PVA as a stabilizing agent, which had not been previously reported for these systems. The results obtained provide promising prospects for further investigations into its potential application as a bioinsecticide agent. INTRODUÇÃO O óleo essencial do cravo-da-índia, extraído dos botões florais secos da espécie Syzygium aromaticum (L.) Merr. & L. M. Perry, família Myrtaceae, é constituído por uma mistura de compostos voláteis, geralmente eugenol, β-cariofileno, α-humuleno, acetato de eugenila e óxido de cariofileno, sendo o eugenol a substância com maior concentração.1 Nessa espécie, o eugenol pode ser encontrado em grandes porcentagens em óleos essenciais extraídos das folhas (94-82%), pedúnculos (90%) e botões florais secos (88-78%).1-3 Sendo que, a produção e acúmulo das mistura de compostos voláteis depende de vários fatores externos de estresse biótico e abiótico na planta.4 O eugenol apresenta várias atividades quimiopreventivas, como por exemplo, propriedade antibacteriana contra patógenos Gram-positivo (Bacillus subtilis; Staphylococcus aureus; Bacillus cereus) e Gram-negativo (Escherichia coli; Salmonella typhi; Pseudomonas aeruginosa),5 antifúngica,6 antioxidante,7 larvicida,8,9 herbicida,10 e repelente.11-14 Adicionalmente, a aplicação do eugenol como pesticidas botânicos na agricultura pode ser uma alternativa promissora.15-17 Pesticidas botânicos são produtos formulados com compostos de origem natural, como óleos essenciais com atuação inseticida, fungicida, nematicida ou bactericida.12,14,18 Se comparados com os pesticidas sintéticos, os botânicos apresentam baixa toxicidade nos organismos, não contaminam o solo, os recursos hídricos, e costumam apresentar baixa residência às pragas, além de apresentarem baixo custo de produção.17-19 Atualmente, já existem pesticidas botânicos comercializados no Brasil, sendo o principal o óleo de nim (Azadirachta indica) conhecido como Azamax®.17,19 Além desse, outros pesticidas botânicos também são comercializados em outros países, como por exemplo, aqueles baseados em óleo essencial de alho (Allium sativum L.), limoneno e linalool (Citrus sinensis L.), óleo essencial de timol (Thymus vulgaris), óleo essencial de mastruz (Chenopodium ambrosioides) e até mesmo o óleo essencial do cravo-da-índia (S. aromaticum).13,19,20 No entanto, devido às características físico-químicas dos óleos essenciais, como alta volatilização, baixa solubilidade em água e degradação fotoquímica de alguns dos seus componentes, a direta aplicação em ambientes abertos torna-se bastante limitada.21 Desta forma, o uso da nanotecnologia molecular, ou seja, o nanoencapsulamento de compostos voláteis, é uma estratégia promissora para viabilizar a aplicação dos óleos essenciais em ambientes abertos. O nanoencapsulamento de uma substância ativa pode ser obtido através da sua dissolução ou adsorção em uma matriz nanoparticulada, a qual isola a substância do meio reacional e sua liberação ocorre de forma gradual ou sob resposta a mudanças físico-químicas, como pH, temperatura, pressão, entre outras,22,23 promovendo assim uma maior estabilidade físico-química à substância ativa encapsulada.24 Geralmente, sistemas poliméricos nanoparticulados são constituídos por matriz polimérica, substância ativa que se pretende encapsular, e um surfactante que tem a função de promover maior estabilidade ao sistema nanoparticulado obtido.22,25 A zeína é uma proteína vegetal extraída do endosperma do grão de milho. Estruturalmente, é constituída basicamente por aminoácidos apolares com características de formar diferentes tipos de estruturas como fibras, filmes, compósitos e sistemas nanoestruturados.26,27 Devido ao seu caráter apolar, a zeína é uma barreira eficaz contra a umidade, e possui alta resistência térmica e a agentes oxidantes,27,28 tornando-a uma matriz polimérica atraente para a produção de nanopartículas visando uma potencial aplicação agrícola.29-31 As nanopartículas de zeína podem ser utilizadas como substratos para o encapsulamento de diferentes componentes botânicos, seja com óleos essenciais, como óleo de citronela (geraniol e R-citronelal),32 óleo de nim (A. indica),33 óleo de cravo (S. aromaticum),34 ou com substâncias isoladas, como carvacrol,35 terpinen-4-ol,36 eugenol,34 ou misturas de geraniol e eugenol, e de geraniol e cinamaldeido.37 Esses sistemas coloidais têm apresentado bons resultados perante o preparo e a estabilidade coloidal. O surfactante PVA é um polímero sintético não-iônico, solúvel em água e muito utilizado para promover a estabilidade coloidal de diferentes sistemas nanoestruturados, como nanopartículas poliméricas (NPs),38,39 nanofibras,40 filmes 41 e nanocompósitos.42 Na produção de nanopartículas visando uma aplicação farmacêutica, o PVA é amplamente empregado em NPs de ácido polilático (PLA) para sistemas de liberação controlada de drogas,25 porém o seu uso no encapsulamento de óleos essenciais ainda é pouco explorado.43,44 No entanto, é possível encontrar relatos de produções com resultados bastante satisfatórios, como as NPs de PLA/PVA encapsuladas com extrato de folhas de oliveira (Olea europea), com tamanho de 246 nm, PDI de 0,21 e potencial zeta de -27 mV.43 A quantificação da substância ativa encapsulada nas NPs é um parâmetro importante e que deve ser avaliado, uma vez que, a partir dessa informação são obtidos os valores de eficiência de encapsulamento (%EE) e drug loading (%DL) do sistema nanoparticulado, os quais irão influenciar diretamente a aplicabilidade das NPs produzidas.17,45 Neste contexto, o presente artigo tem como principal objetivo desenvolver novos sistemas nanoestruturados baseados em NPs de zeína incorporadas com óleo essencial extraído do botão floral do cravo-da-índia (S. aromaticum) (OC) e também com o eugenol (Eug), e estabilizadas com o surfactante PVA, visando uma potencial aplicação como pesticidas botânicos. Além disso, o método analítico para a quantificação do eugenol incorporado nas NPs foi também desenvolvido e devidadamente validado de acordo com as normas de agências regulatórias: Agência Nacional de Vigilância Sanitária (ANVISA) e Instituto Nacional de Metrologia, Normalização e Qualidade Industrial (INMETRO). Neste trabalho, o óleo essencial do cravo-da-índia (OC), assim como o eugenol (Eug) foram incorporados em nanopartículas poliméricas (NPs) de zeína utilizando o álcool polivinílico (PVA) como agente surfactante.
PARTE EXPERIMENTAL Materiais e reagentes Zeína (20 kDa), álcool polivinílico (PVA) hidrolizado 99% (89 98 kDa) e eugenol (99%) foram obtidos da Sigma-Aldrich. O cravo-da-índia, botões florais da espécie S. aromaticum, foram adquiridos já secos em feiras livres localizados na região de Valença (BA, Brasil) (13° 22' 50" S e 39° 4' 56" W) em fevereiro/2020. Os solventes empregados foram de grau analítico. Extração do óleo essencial do cravo-da-índia O material vegetal (60,02 g) foi submetido ao processo de extração por meio da técnica de hidrodestilação com o adaptador de Clevenger por 240 h.1,46 Em seguida, foi feita a separação líquido-líquido do hidrolato com éter etílico (Synth) e a fase orgânica tratada com Na2SO4 anidro (Synth). Depois, concentrada levando a obtenção do óleo essencial do cravo-da-índia (OC). O teor do óleo essencial foi expresso em percentual a partir da razão entre a massa de óleo obtida e 100 g massa de material vegetal seco (% m/m).47 Análise do óleo essencial do cravo-da-índia Análise cromatográfica A composição química quantitativa foi avaliada através da cromatografia a gás acoplada ao detector de ionização de chama (CG DIC) usando o cromatógrafo gasoso (Shimadzu QP2010) equipado com coluna capilar de sílica fundida VF5 ms (30 m × 0,25 mm) com fase estacionária 5% fenil - 95% dimetilpolisiloxano (0,25 μm de espessura de filme), utilizando hélio 6.0 como gás arraste e fluxo de 1,0 mL min-1 (10 psi). As temperaturas do injetor e detector foram de 250 e 280 °C, respectivamente. Foi injetado 1,0 μL de solução em CHCl3 (Vetec) a 10% no modo split (1:20). A temperatura da coluna teve início a 140 oC, permanecendo nessa temperatura por 3 min, seguida de acréscimo de 8 oC min-1 até 280 oC; sendo mantida nessa temperatura por 5 min perfazendo o tempo de 10 min. A identificação dos componentes majoritários presentes no OC foi realizada em um CG-MS (Varian Saturno 2000), usando as mesmas condições da análise CG-DIC. Sendo a temperatura da linha de transferência 250 °C, manifold 50 ºC e trap 150 °C por 40 min. O modo de operação foi de impacto elétrico de 70 eV a uma velocidade de varredura de 1 s-1 dentro de uma faixa de 40 a 450 Da e uma taxa de amostragem de 1,2 scan s-1, com analisador do tipo íon trap. Nas mesmas condições da análise foram injetados padrões de hidrocarbonetos alcanos C8-C26 (Sigma) usados para o cálculo do Índice Kovats. O padrão de fragmentação dos compostos foi comparado com aqueles presentes na base de dados fornecidos pelo equipamento (NIST 08) e com os dados da literatura (Tabela 1S, material suplementar).48 Determinação do teor do eugenol no OC usando UV-visível O teor de eugenol no OC foi determinado utilizando a técnica de espectroscopia de absorção eletrônica molecular na região do UV Vis. Foi preparado uma curva analítica de padronização externa em etanol 85% (v/v) (Synth) (faixa de concentração do eugenol = 15 57 μg mL 1; y = 0,017x + 0,0265; R2 = 0,996). Os espectros eletrônicos foram registrados em um espectrofotômetro NOVA 1600 UV na faixa de 200-800 nm, e o valor da absorbância (λ = 280 nm) foi utilizado para a construção da curva analitica. Preparação das NPs de zeína vazias e incorporadas com eugenol e óleo de cravo As NPs de zeína vazias (NPZ), também chamadas NPs controle, foram produzidas utilizando o método de nanoprecipitação já descrito na literatura com algumas modificações.34 Inicialmente, uma suspensão de zeína 1% (m/v) foi preparada com etanol 85% (v/v) e deixada sob agitação magnética à temperatura ambiente. Em seguida, essa suspensão foi aquecida por 15 min (75 °C). Após resfriar, a suspensão foi submetida à filtração utilizando filtros de seringa Millex® (0,45 μm) para a remoção de material particulado. Na sequência, 1 mL desta solução de zeína foi rapidamente misturada, sob agitação magnética (IKAMAG® RT 10 power, com 60% da velocidade de agitação máxima), em 9 mL de uma solução de álcool polivinílico (PVA) 0,5% (m/v), preparada previamente com água destilada e pH ajustado (4,0) com HCl (1,0 mol L-1). A suspensão nanopartículada (NPZ) foi formada imediatamente, e permaneceu sob agitação por 2 h em temperatura ambiente. Por fim, as NPZ foram transferidas para tubos e o volume final ajustado para 10 mL com água. Para a produção das NPs incorporadas com o eugenol (NPZ Eug) e com o óleo essencial de cravo (NPZ-OC), o mesmo procedimento descrito acima foi empregado, com a diferença de que o OC e o Eug foram misturados previamente à solução de zeína. Na Figura 1 é apresentado um esquema representativo para a produção dos três sistemas nanoparticulados.
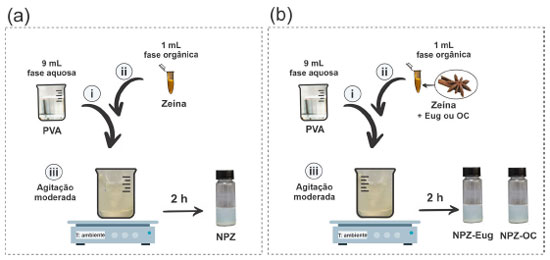 Figura 1. Esquema representativo do preparo das NPs de zeína vazias (NPZ) (a): (i) adicão da fase aquosa (solução de álcool polivínilico, PVA) no béquer; (ii) adição da fase orgânica (solução etanólica de zeína) à fase aquosa; (iii) agitação moderada em temperatura ambiente. Esquema representativo do preparo das NPs incorporadas (NPZ-OC e NPZ-Eug) (b): mesmo procedimento das NPZ, alterando apenas a etapa da fase orgânica (ii) em que o eugenol (Eug) ou óleo essencial de cravo-da-índia (OC) é adicionado
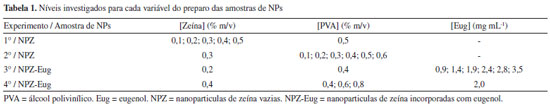
Otimização univariada do preparo das NPs A otimização do preparo das NPs foi investigada utilizando métodos univariados, ou seja, as variáveis foram avaliadas individualmente, fixando-se um dos parâmetros e variando-se o outro em diferentes níveis (Tabela 1).49 Estudos explanatórios foram realizados previamente para investigar o melhor tempo de agitação das NPZ (1, 2, 3 e 4 h) e também o volume adicionado da fase orgânica (0,8; 1,0; 1,2 e 1,4 mL de solução de zeína) à fase aquosa (solução contendo o surfactante PVA). Posteriormente, o efeito das concentrações de reagentes (zeína, PVA e Eug) foi avaliado individualmente. O raio hidrodinâmico (Z-average), índice de polidispersão (PDI) e potencial zeta foram utilizados como respostas para a otimização.
Determinação do tamanho da partícula, índice de polidispersão e potencial zeta As NPs obtidas foram caracterizadas por espalhamento dinâmico de luz (DLS) e espalhamento eletroforético de luz (ELS) utilizando um equipamento Zetasizer Nano-ZS Zen 3600 (Malvern Instruments Ltd., UK). As amostras de NPs foram diluídas por um fator de diluição de 200× com água deionizada e filtradas com filtros de seringa Millex (45 μm). Na sequência, as leituras das amostras foram registradas em triplicata para a obtenção da distribuição do tamanho das partículas (calculadas por intensidade do espalhamento da luz), raio hidrodinâmico (Z-average), índice de polidispersão (PDI), e potencial zeta. Determinação do eugenol incorporado, e cálculo da eficiência de encapsulamento e drug loading O eugenol incorporado nas NPs (NPZ-Eug e NPZ-OC) foi determinado indiretamente utilizando um método espectrofotométrico de absorção molecular na região do UV-Vis (λ = 280 nm), o qual foi analiticamente validado neste trabalho (descrito logo abaixo). Resumidamente, as amostras de NPZ-Eug e NPZ-OC foram ultracentrifugadas utilizando filtros Amicon® (Ultra-4, 30 kDa), as NPs retidas no filtro foram lavadas com água, e o eugenol residual (livre) presente no sobrenadante foi quantificado.32,34,50 O Eug residual foi quantificado a partir da equação da reta da curva analítica de padronização externa (faixa de concentração 15 57 μg mL-1, equação y = 0,015x + 0,0442, R2 = 0,990). A eficiência de encapsulamento (%EE), Equação 1, e o drug loading (%DL), Equação 2, foram calculadas a partir da massa de Eug residual, mEug(livre), determinada experimentalmente, e da massa de Eug, mEug(total), massa de OC, mOC(total), e massa de zeína, mzeína, todas utilizadas no preparo das NPs.51 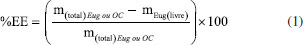  Validação do método analítico para a determinação do eugenol O método analítico utilizado para a determinação do eugenol foi devidamente validado seguindo as normas de agências regulatórias ANVISA e INMETRO.52,53 Os parâmetros analíticos avaliados foram seletividade, linearidade, exatidão, precisão, limite de detecção (LOD) e limite de quantificação (LOQ). Seletividade A solução estoque de eugenol (6000 μg mL-1) foi preparada em etanol 85% (v/v) e diluída em diferentes concentrações (15 a 57 μg mL-1). A curva de padronização externa foi preparada em água (pH 4,0), enquanto que a curva de adição de padrão foi preparada utilizando o próprio sobrenadante das NPZ-Eug também em água. A seletividade do método foi avaliada através da comparação do coeficiente angular das duas curvas de calibração.52,53 O tratamento estatístico foi realizado aplicando o teste F (Fisher-Snedecor) que avalia a homogeneidade da variância e, o teste t (Student) que faz comparação entre médias.54 Linearidade A linearidade das curvas de calibração foi avaliada a partir do coeficiente de variação (R2) pelo método dos mínimos quadrados. A homogeneidade dos dados foi confirmada visualmente por meio dos gráficos de resíduos, e também do gráfico de valores experimentais versus preditos.52-54 Exatidão A exatidão foi obtida por meio de ensaios de fortificação e recuperação do Eug nas NPZ-Eug e nas NPZ-OC em três faixas de concentração do Eug: baixa (25 μg mL-1), média (30 μg mL-1) e alta (35 μg mL-1) em triplicada.54 A taxa de recuperação (%REC) foi calculada de acordo com a Equação 3 e apresentada em forma de média da %REC e desvio padrão, onde: C1 é a concentração do analito na amostra fortificada, C2 é a concentração do analito na amostra, e C3 é a concentração do analito adicionado à amostra fortificada.52-54 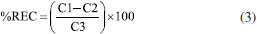 Precisão A precisão intermediária foi avaliada em três faixas de concentração do Eug: baixa (15-20 μg mL-1), media (30-40 μg mL-1) e alta (50-60 μg mL-1). Todos os pontos foram preparados em água (pH 4,0), e o espectro eletrônico foi registrado em três dias diferentes. Os resultados estão apresentados em forma de desvio-padrão relativo (DPR%), utilizando a Equação 4. Onde, 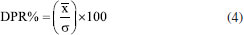 A repetibilidade foi avaliada utilizando-se três réplicas independentes de diferentes pontos da curva analítica de padronização externa (baixa, média e alta concentração). Os espectros eletrônicos (n = 9) foram registrados no mesmo dia. Limite de detecção (LOD) e limite de quantificação (LOQ) Os parâmetros LOD e LOQ foram avaliados a partir do registro de réplicas independentes das NPZ preparadas na mesma condição das NPs encapsuladas. Os valores do LOD e LOQ foram calculados a partir das Equações 5 e 6, respectivamente.52,53 Onde, σ é o desvio padrão, e S é o coeficiente angular (slope) da curva de padronização externa. 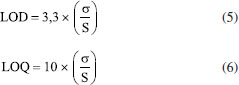
RESULTADOS E DISCUSSÃO Óleo essencial do cravo-da-índia A extração do OC foi realizada em 240 min, com teor de 7,9% (m/m). O rendimento da extração deste óleo pode variar entre 2,2 e 12,0% (m/m).3,55-57 Isto ocorre devido aos estresses bióticos e abióticos que influenciam na produção e acúmulo dos metabólicos secundários. A partir das análises cromatográficas (Figura 1S, material suplementar) e espectrômetria de massas (Figura 2S, material suplementar) foi possível identificar três compostos no OC (eugenol, β-cariofileno e acetato de eugenila), sendo o eugenol, o componente majoritário. O eugenol foi aquele que apresentou o pico (6,2 min) com maior área do cromatograma (88,4%), seguido pelos picos do β-cariofileno (0,6%) em 7,3 min, e acetato de eugenila (11,0%) em 8,6 min. O teor de eugenol no OC também foi quantificado por espectrometria de absorção molecular no comprimento de onda de 280 nm (Figura 3S, material suplementar). A curva externa em EtOH 85% é apresentada na Figura 4S, material suplementar, e os resultados corroboram com os dados da análise cromatográfica do CG-DIC (Figura 1S, material suplementar), sendo o eugenol a substância majoritaria no OC (81,5% m/m). Esses resultados também foram similares aos encontrados na literatura com a mesma parte vegetal da S. aromaticum.1,58 Preparação e análise do tamanho das NPs de zeína Nanopartículas são suspensões coloidais, ou seja, partículas dispersas em uma mistura de soluto e solvente,59 podendo ser facilmente identificadas visualmente devido à formação de uma suspensão de coloração opalescente, típica de suspensões coloidais. Na Figura 2 é possível observar também o efeito Tyndall das amostras de NPZ, confirmando assim a natureza nanoparticulada da amostra. O efeito Tyndall é um fenômeno que acontece quando a incidência de um feixe de luz sobre a amostra promove um típico espalhamento difuso da luz devido a presença de partículas dispersas no solvente. Este espalhamento só ocorre quando existe a propagação do feixe da luz em amostras particuladas (suspensão) ou soluções coloidais.60
 Figura 2. Efeito Tyndall na amostra de NPs de zeína vazia (NPZ)
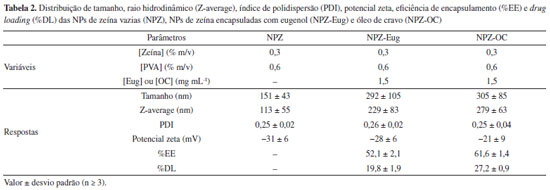
A distribuição de tamanho das partículas e a distribuição do potencial zeta dessa amostra de NPZ também foram analisadas utilizando um equipamento Zetasizer®. A distribuição de tamanho indicou uma única curva gaussiana com raio hidrodinâmico (Z-average) de ~ 280 nm e PDI ≈ 0,3. Estes resultados ficaram bastante próximos às NPZ já reportadas na literatura, porém estabilizadas com os surfactantes Pluronic F-68 (141 nm)34 e lectina (216 nm).35 Para o PDI, deseja-se valores menores que 0,2, pois quanto menor este índice, maior é a homogeneidade da distribuição de tamanho das partículas.61 Já para a distribuição de potencial dessa amostra, o valor obtido (-39 mV) está adequado para sistemas nanoparticulados, e similares aos reportados com Pluronic F-68 (31 mV)34 e lecitina (-22 mV).35 Uma vez que o PVA é um surfactante não-iônico, o sinal negativo do potencial zeta das NPZ é atribuído aos aminoácidos aniônicos presentes na superfície das NPs.29 Valores de potencial zeta acima de 30 mV (em módulo) sugerem boa repulsão eletrostática entre as NPs, e portanto pode ser um indicativo de boa estabilidade coloidal.60,62 Os bons resultados explanatórios aqui obtidos com as NPZ estabilizadas com o surfactante PVA, até então nunca reportados na literatura, motivaram uma investigação sistematizada da síntese dessas NPs objetivando a produção de partículas com menores tamanho (< 200 nm), baixo PDI (< 0,2) e elevados valores de valores de potencial zeta (> |30| mV), garantindo assim uma maior estabilidade para o sistema coloidal.28,39,60 Otimização univariada do preparo das NPZ e NPs incorporadas O tempo de agitação das NPZ foi o primeiro parâmetro a ser investigado, e os resultados indicaram que as amostras que permaneceram menos tempo sob agitação (1 e 2 h) foram aquelas que apresentaram os menores tamanho de partículas e com maiores valores de potencial zeta (em módulo) (dados não apresentados). Desta forma, o tempo de 2 h foi o escolhido para dar continuidade na otimização dos próximos parâmetros. Assim que as duas fases (orgânica e aquosa) são misturadas ocorre rapidamente a formação das nanopartículas. No entanto, a suspensão deve permanecer sob agitação por um tempo adequado para que parte do solvente orgânico utilizado seja evaporado da suspensão coloidal. Para as suspensões coloidais de NPZ, é relatado na literatura que as partículas de zeína são formadas com um tempo de 0,16 s quando misturadas sob forte agitação.63 O volume da fase orgânica adicionada à fase aquosa foi o segundo parâmetro investigado. Neste caso, foi observado um pequeno aumento no tamanho no valor do PDI em função do aumento do volume da fase orgânica. Curiosamente, a amostra de NPZ preparada com 0,8 mL de fase orgânica apresentou elevados valores de PDI (> 0,5), e duas curvas gaussiana de distribuição de tamanho (Figura 5S, material suplementar), sugerindo a formação de NPs com baixa homogeidade de tamanho. Apesar das demais amostras preparadas apresentarem uma única curva de distribuição de tamanho (dados não apresentados), optamos por escolher o volume 1,0 mL para preparar os próximos ensaios, uma vez que foi esse que apresentou o menor valor de PDI. Efeito da concentração da zeína O efeito da concentração de zeína sob as diferentes respostas das NPZ está apresentado na Figura 3. É possível observar que com o aumento da concentração de zeína, o valor de PDI sofreu grandes oscilações sem apresentar uma tendência definida. Por outro lado, o Z-average aumentou significativamente de 100 para 250 nm com o aumento da concentração de zeína, enquanto que o potencial zeta diminuiu de -35 mV para -20 mV. A diminuição do valor em módulo do potencial zeta sugere uma dimuinição da repulsão eletrostática das NPs com o aumento da concentração de zeína, indicando que a concentração do surfactante para este sistema não está adequada para evitar a formação de aglomerados nanoparticulados.
 Figura 3. Efeitos das respostas Z-average (nm), índice de polidispersão (PDI) e potencial zeta (mV) em função da concentração da zeína nas NPZ preparadas com 0,5% (m/v) de PVA
Apesar dos valores de PDI obtidos para algumas dessas amostras estarem relativamente elevados (PDI > 0,3) é relatado na literatura o mesmo para NPs formadas com matrizes de origem natural.32 Sendo assim, a condição de 0,2% (m/v) de zeína foi a escolhida como melhor condição para esses conjuntos de variáveis investigadas, considerando também que ela apresentou um valor de PDI < 0,2. Efeito da concentração do PVA A partir dos resultados obtidos com a variação da concentração de PVA (Figura 6S, material suplementar) foi possível observar que os melhores resultados (menor Z-average, menor PDI e maior potencial zeta) foram aqueles obtidos com as maiores concentrações do surfactante, [PVA] > 0,4% (m/v). Esse comportamento já era esperado, uma vez que a presença de surfactante favorece a estabilidade do sistema coloidal. Isto acontece porque o surfactante tem a função de controlar as forças presentes na superfície das NPZ, como por exemplo, cargas, força iônica, pH e efeitos repulsivos. Para que haja esse equilíbrio de forças eletrostáticas é preciso que as cargas superficiais das NPZ sejam contrabalanceadas com a presença do surfactante.60 Como o PVA é um surfactante não-iônico, a estabilidade atuará por meio de efeito estéricos na superfície das NPs.64 Assim, o equilíbrio dos efeitos repulsivos está diretamente atrelado ao parâmetro do potencial zeta, o qual apresenta o potencial elétrico efetivo das NPs. Sendo assim, a condição de 0,4% (m/v) de PVA foi considerada a mais adequada para o preparo das NPZ nessas condições empregadas. Efeito da concentração do eugenol Na Figura 4 é apresentado o efeito da concentração de eugenol na preparação das NPs incorporadas (NPZ-Eug). Para esse parâmetro, utilizou-se as condições da otimização das NPZ (vazias) descritas anteriormente, [zeína] = 0,2% (m/v) e [PVA] = 0,4% (m/v). A partir dos resultados foi possível observar que, com o aumento da concentração do eugenol, os valores de Z-average e PDI não sofreram grandes variações se considerarmos o desvio-padrão das medidas. Além disso, ao comparar com os resultados para as NPs vazias (NPZ) os tamanhos e PDI foram similares.
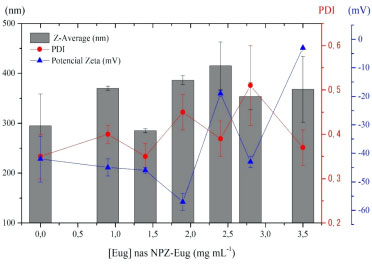 Figura 4. Efeitos das respostas Z-average (nm), índice de polidispersão (PDI) e potencial zeta (mV) em função da concentração do eugenol nas NPZ-Eug preparadas com 0,2% (m/v) de zeína e 0,4% (m/v) de PVA
No entanto, com o aumento da concentração de eugenol para 2,0 mg mL-1, o valor do potencial zeta apresentou uma redução, em módulo, de -42 mV para -3 mV. Essa variação pode ser um indicativo da baixa estabilidade coloidal das NPs encapsuladas (NPZ-Eug), sugerindo que a razão entre as concentrações do sistema (matriz, surfactante e substância ativa) não está em equilíbrio de cargas para gerar um sistema coloidal estável. Sendo assim, considerando esses resultados, concentrações de eugenol inferiores a 2,0 mg mL-1 são as mais indicadas para a preparação de NPs nessas condições. Considerando a significativa redução do potencial zeta com o aumento da concentração de eugenol, conforme descrito anteriormente, resolvemos investigar se o aumento da concentração da zeína para 0,4% (m/v) poderia proporcionar melhores resultados para o sistema incorporado. Neste caso, investigamos também diferentes concentrações do surfactante PVA (0,4%; 0,6%; 0,8% m/v), dados apresentados na Figura 7S, material suplementar. As NPZ Eug produzidas com os melhores resultados (150 nm e -30 mV) foram aquelas preparadas com a condição de [PVA] = 0,8% (m/v). O melhor resultado foi obtido com uma razão de [PVA]/[zeína] = 2, o qual também corresponde ao melhor resultado obtido para as NPZ variando o PVA na condição anterior (Figura 6S, material suplementar), sugerindo por fim, que a razão de surfatante/matriz tem um papel importante na produção de NPs estáveis. Vale salientar que esse fato, do uso do PVA apresentar uma melhora significativa na obtenção de tamanhos nas NPs, não é isolado. Vehapi et al.44 sintetizaram NPs de quitosana estabilizadas com PVA e encapsuladas com óleos essenciais de orégano (Origanum vulgare) e oliva. Como resultado, foi observada uma tendência na redução do tamanho das NPs à medida que a concentração do PVA aumentou. Esses resultados evidenciam que a presença do PVA favorece o aumento da estabilidade do sistema coloidal. No entanto, vale a pena ressaltar que elevadas concentrações de PVA podem influenciar nas propriedades farmacêuticas de sistemas coloidais65 e causar efeitos colaterais no organismo.66 Análises das NPs de zeína otimizadas, e cálculo da eficiência de encapsulamento e drug loading Uma vez definido as melhores condições dos parâmetros de síntese das NPs, novas amostras de NPs de zeína vazias (NPZ) e NPs incorporadas com o eugenol (NPZ-Eug) foram preparadas com a finalidade de validar a otimização univariada empregada. Adicionalmente, amostras de NPs encapsuladas com o óleo-de-cravo (NPZ-OC) também foram preparadas nas mesmas condições das NPZ-Eug otimizadas (Tabela 2).
A amostra de NPZ otimizada apresentou valores de tamanhos, PDI e potencial zeta apropriados para sistemas nanoparticulados. Na Figura 8S, material suplementar, é apresentado como exemplo, típicas distribuições de tamanho e potencial zeta para a amostra de NPZ. Os resultados aqui obtidos (Tabela 2) são similares aos reportados na literatura para NPs de zeína estabilizadas com os surfactantes Pluronic F-68, lecitina e tetradecil trimetil amônio (TTA), os quais apresentaram tamanhos na faixa de 100 e 300 nm.34-37 No entanto, para as NPs incorporadas (NPZ-Eug e NPZ-OC), os valores médios do tamanho das NPs foram significativamente maiores, se comparados com as NPs vazias (NPZ). Geralmente, a incorporação de principios ativos em NPs poliméricas promove o aumento do diâmetro das partículas.67 Curiosamente, o valor de potencial zeta das NPZ-OC (-21 mV) foi um pouco menor em módulo se comparado com as das NPZ-Eug (-31 mV). Essa redução do potencial zeta pode estar relacionada à presença dos diferentes compostos químicos, pois além do eugenol, o óleo de cravo é constituído por β-cariofileno e acetato de eugenila.1,58 Por fim, os baixos valores de PDI (~ 0,25) para os três sistemas de NPs indicam ausência de agregados particulares nas amostras. Vale salientar também que os três sistemas nanoparticulados produzidos (NPZ, NPZ-Eug e NPZ-OC) de fato apresentaram boa estabilidade coloidal, pois nenhuma sedimentação significativa foi observada ao longo dos 210 dias de monitoramento visual para as NPs que foram armazenadas sob refrigeração (Figura 9S, material suplementar). Diferentemente dos primeiros experimentos explanatórios das NPZ, que foram produzidas com concentração de 0,4% (m/v) para zeína e PVA, e que após 56 dias armazenadas em temperatura ambiente apresentaram a sedimentação de todo o material particulado (Figura 10S, material suplementar). Sugere-se então que essas amostras de NPs sejam armazenadas sob refrigeração, uma vez que baixas temperaturas favorecem a estabilidade do sistema coloidal. Estudos de monitoramento de NPZ estabilizadas com Pluronic F-68 foram realizados em diferentes temperaturas (4 e 20 °C), e os resultados confirmaram essa hipótese levantada, pois as amostras armazenadas em temperatura ambiente apresentaram a precipitação das NPs após 60 dias.50 A quantificação do eugenol presente nas NPs incorporadas foi realizada a partir do método indireto, onde a quantificação do princípio ativo foi realizada com o sobrenadante após as NPs terem sido purificadas por ultracentrifugação com auxílio de filtros Amicon®. O método analítico de quantificação do eugenol foi realizado por espectrofotometria UV-Vis (λ = 280 nm) utilizando uma curva analítica de padronização externa (Tabela 2S, material suplementar) e, consequentemente, a eficiência de encapsulamento (%EE) e o drug loading (%DL) puderam ser calculados a partir das Equações 1 e 2.51 Os resultados estão resumidos na Tabela 2. Os valores de %EE obtidos para as NPZ-Eug (n = 5) e NPZ OC (n = 5) foram de 52,1 ± 2,1% e 61,6 ± 1,4%, respectivamente. No entanto, maiores valores %EE é reportado na literatura para outros sistemas de de NPs de zeína/óleo essencial, tais como timol (91,8%),50 carvacrol (88,5%),50 óleo de alho (99,8%),34 óleo de citronela (geraniol e R-citronelal) (94,4%)32 e mistura de geraniol e eugenol (99%).37 Uma possível explicação para os elevados valores de %EE frequentemente relatados na literatura é a ausência da etapa de ultracentrifugação das NPs, a qual tem o propósito de remover a substância ativa livre da matriz nanopartícula. Outros parâmetros que também influenciam a eficiência de encapsulação (%EE) estão relacionados à concentração da matriz, do surfactante e da substância ativa, bem como à solubilidade desses reagentes e à quantidade de solvente presente na suspensão coloidal.38,39,45 O %DL indica a quantidade do princípio ativo carregado nas NPs por unidade de massa. Entretanto, a maioria dos sistemas nanoparticulados tem %DL relativamente baixo (< 10%).28,38,39 A obtenção de NPs com elevados valores de %DL acaba se tornando um grande desafio por conta das grandes variáveis que se deve investigar. Os valores de %DL obtidos para as NPZ-Eug e NPZ-OC foram 19,8 ± 1,9 e 27,2 ± 0,9%, respectivamente. Uma hipótese para os satisfatórios valores obtidos pode ser devido ao sinergismo obtido do princípio ativo, surfactante (PVA) e matriz proteica (zeína) durante o processo da obtenção das NPs. A técnica de nanoprecipitação está fundamentada no encapsulamento da substância ativa durante a formação das NPs e tem como característica o uso da matriz um polímero ou macromolécula, favorencedo a obtenção de %DL próximos a 30%.68 Validação do método analítico para a quantificação do eugenol das NPs A quantificação do eugenol incorporado às NPs pode ser realizada por diversas técnicas instrumentais, como cromatografia líquida,34,69 e espectroscopia eletrônica de absorção molecular na região do UV Vis.70,71 Independentemente da técnica empregada é necessário que o método analítico utilizado seja devidamente validado de acordo com as normas estabelecidadas pelas agências reguladoras.52,53,72 No presente trabalho, os parâmetros de desempenho analítico descritos a seguir foram avaliados através de um método espectrofotométrico. Seletividade A seletividade avalia à extensão que um método pode determinar o analito em uma mistura sem interferências.53 Para essa análise potenciais interferentes são adicionados à amostra e somente depois o analito de interesse é quantificado. Outra forma de avaliar este parâmetro é através da análise do paralelismo das curvas analíticas de padronização, ou seja, comparando estatisticamente os coeficientes angulares das equações das retas de duas curvas analíticas de padronização: adição de padrão e padronização externa.54,73 As duas curvas analíticas estão apresentadas na Figura 5. Entre as curvas foi observado o comportamento paralelo, isto ocorreu uma vez que os coeficientes angulares das equações das duas curvas são semelhantes. Para confirmar o paralelismo entre as curvas analíticas foi realizado um teste F (Fisher-Snedecor) e teste t (Student), os quais avaliam a homogeneidade da variância, e fazem comparação entre as médias, respectivamente (Tabela 2S, material suplementar).74 Desta forma, confirmamos que o método desenvolvido é seletivo, e portanto a amostra não possui interferentes químicos, os quais poderiam dificultar a quantificação do eugenol.51,54,71
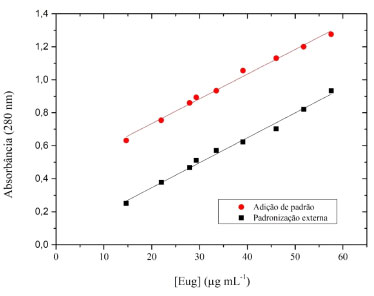 Figura 5. Validação do método analítico: curva de padronização externa (y = 0,015x + 0,0442, R2 = 0,990) e curva de adição de padrão (y = 0,015x + 0,0434, R2 = 0,991), ambas preparadas em água com pH ajustado para 4,0
Linearidade A linearidade em um método analíco indica se as respostas da curva analítica são diretamente proporcionais à concentração do analito na amostra, dentro de uma certa faixa de aplicação.52,72 A equação da reta da curva analítica de padronização mostrou ser estatisticamente significativa e com valor de coeficiente de correlação adequado (R2 > 0,99).75 A faixa de trabalho utilizada para a quantificação do eugenol (15-57 μg mL-1) mostrou ser linear, uma vez que a analíse gráfica dos resíduos da equação da reta de padronização externa (Figura 11Sa, material suplementar) indicou homogeinidade dos dados. Por fim, a porcentagem de resposta à curva analítica está dentro da faixa de 90-110% (Figura 11Sb, material suplementar) confirmando que o modelo é linear e adequado para ser utilizado na faixa de trabalho investigada (Figura 11Sb).54 Exatidão e Precisão A exatidão e a precisão têm como finalidade estimar até que ponto os erros sistemáticos afetam um método analítico.54 A exatidão representa o grau de concordância entre os resultados individuais encontrados no ensaio e um valor de referência aceito como verdadeiro.74 Assim, através de ensaios de recuperação foi possível avaliar que o método analítico utilizado é exato para os dois sistemas nanoparticulados (NPZ-Eug e NPZ-OC), uma vez que a porcentagem de recuperção (%REC) para as três faixas de concentração de eugenol apresentaram valores dentro do intervalo de 80-110% (Tabela 3S, material suplementar), atendendo as normas do INMETRO.53 A precisão do método analítico representa a dispersão de resultados entre ensaios independentes e repetidos de uma mesma amostra.54,74 Nessa pesquisa foram realizados ensaios de repetibilidade e precisão intermediária para avaliação deste parâmetro. Para a repetibilidade foram realizadas medidas sucessivas da mesma amostra, nas mesmas condições (mesmo analista, mesmo instrumento, mesmo local) e em diferentes níveis de concentração (baixa, média e alta). Para a precisão intermediária a mesma amostra foi analisada no mesmo laboratório e em dias diferentes.52,53 Assim, os resultados obtidos (Tabela 3S, material suplementar) apresentaram valores de desvio padrão relativo pequenos e aceitáveis (%DPR < 5), confirmando que o método é preciso.52 Limite de detecção (LOD) e limite de quantificação (LOQ) O limite de detecção (LOD) e o limite de quantificação (LOQ) foram obtidos por meio dos parâmetros da curva analítica (coeficientes angular e linear). O LOD representa a menor concentração do analito que pode ser detectada, porém que não pode ser quantificada com precisão. Enquanto que o LOQ representa a menor quantidade do analito que pode ser quantificada com aceitável precisão e exatidão nas condições experimentais estabelecidas.34,54 Os baixos valores encontrados para o LOD (2,2 μg mL-1) e o LOQ (6,7 μg mL-1) indicam que a técnica de espectroscopia UV-Vis é adequada para a detectação e quantificação do eugenol nas amostras de nanoparticuladas analisadas.
CONCLUSÃO Neste trabalho apresentamos o preparo de NPs de zeína carregadas com eugenol (NPZ-Eug) e óleo essencial do cravo-da-índia (NPZ-OC) utilizando o método da nanopreciptação. As variáveis do preparo das NPs de zeína vazias (NPZ) foram otimizadas utilizando um planejamento univariável, e um novo método analítico para a quantificação do eugenol incorporado às NPs foi devidamente validado. O surfactante PVA utilizado na formulação dos três sistemas nanoparticulados (NPZ, NPZ-Eug e NPZ-OC), até então nunca reportados na literatura para NPZ, garantiu a estabilidade coloidal dos sistemas nanoparticulados. Por meio da otimização foi possível obter amostras de NPs com distribuição de tamanho inferior a 300 nm (Z-average), valores de potencial zeta (~ -30 mV) adequados para sistemas nanoparticulados estáveis, e concluir que a razão da concentração surfactante (PVA) e matriz (zeína) tem um papel importante na estabilidade das NPs. As NPs incorporadas (NPZ Eug e NPZ-OC) apresentaram valores satisfatórios de eficiência de encapsulamento (EE > 50%) e drug loading (DL ≈ 30%). A quantificação do eugenol incorporado nas NPZ-Eug e NPZ-OC foi realizada por técnica espectrofotométrica UV-Vis, e a validação do método analítico empregado demonstrou ser simples, preciso e exato, atendendo as exigências das agências reguladoras, e assegurando a confiabilidade dos resultados. Por fim, os promissores resultados aqui obtidos abrem perspectivas para novos estudos visando a aplicação desses sistemas nanoparticulados como potencial agente bioinseticida.
MATERIAL SUPLEMENTAR O material suplementar está disponível em http://quimicanova.sbq.org.br em formato pdf, com acesso gratuito.
AGRADECIMENTOS V. A. V. agradece à CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior) pela bolsa de mestrado. L. R. S. agradece à FAPESB (Fundação de Amparo à Pesquisa do Estado da Bahia) pela bolsa de Iniciação Científica. R. L. S. R. S. agradece o apoio financeiro concedido pela UESC através do projeto de pesquisa cadastrado na PROPP (Pró-Reitoria de Pesquisa e Pós-Gradução) sob o número 073.11160.2022.0002001-32. Os autores agradecem ao Prof. Dr. Luiz Carlos Salay (UESC) por disponibilizar seu laboratório e infraestrutura para a realização dos experimentos, e também aos revisores anônimos da revista Química Nova pelos valiosos comentários sobre o manuscrito.
REFERÊNCIAS 1. de Oliveira, R. A.; Reis, T. V.; do Sacramento, C. K.; Duarte, L. P.; de Oliveira, F. F.; Rev. Bras. Farmacogn. 2009, 19, 771. [Crossref] 2. Raina, V. K.; Srivastava, S. K.; Aggarwal, K. K.; Syamasundar, K. V.; Kumar, S.; Flavour Fragrance J. 2001, 16, 334. [Crossref] 3. Selles, S. M. A.; Kouidri, M.; Belhamiti, B. T.; Amrane, A. A.; Journal of Food Measurement and Characterization 2020, 14, 2352. [Crossref] 4. Gobbo Neto, L.; Lopes, N. P.; Quim. Nova 2007, 30, 374. [Crossref] 5. Ribes, S.; Ruiz-Rico, M.; Pérez-Esteve, E.; Fuentes, A.; Barat, J. M.; LWT--Food Sci. Technol. 2019, 113, 108326. [Crossref] 6. Garg, A.; Singh, S.; Colloids Surf., B 2011, 87, 280. [Crossref] 7. Yogalakshmi, B.; Viswanathan, P.; Anuradha, C. V.; Toxicology 2010, 268, 204. [Crossref] 8. Barbosa, J. D.; Silva, V. B.; Alves, P. B.; Gumina, G.; Santos, R. L.; Sousa, D. P.; Cavalcanti, S. C.; Pest. Manage. Sci. 2012, 68, 1478. [Crossref] 9. da Silva, B. C.; Melo, D. R.; Franco, C. T.; Maturano, R.; Fabri, R. L.; Daemon, E.; J. Med. Entomol. 2020, 57, 181. [Crossref] 10. Ahuja, N.; Singh, H. P.; Batish, D. R.; Kohli, R. K.; Pestic. Biochem. Physiol. 2014, 118, 64. [Crossref] 11. Muratore, F.; Martini, R. E.; Barbosa, S. E.; Food Packag. Shelf Life 2018, 15, 159. [Crossref] 12. Agrawal, S.; Rathore, P.; Int. J. Curr. Microbiol. Appl. Sci. 2014, 3, 43. [Link] acessado em Novembro 2023 13. Miresmailli, S.; Isman, M. B.; Trends Plant Sci. 2014, 19, 29. [Crossref] 14. Isman, M. B.; Miresmailli, S.; MacHial, C.; Phytochem. Rev. 2011, 10, 197. [Crossref] 15. Prasad, R.; Kumar, V.; Prasad, K. S.; Afr. J. Biotechnol. 2014, 13, 705. [Crossref] 16. Gahukar, R. T.; Das, R. K.; Nanotechnol. Environ. Eng. 2020, 5, 1. [Crossref] 17. de Oliveira, J.; Campos, E.; Fraceto, L.; J. Agric. Food Chem. 2018, 66, 8898. [Crossref] 18. Isman, M. B.; Pest. Manage. Sci. 2015, 71, 1587. [Crossref] 19. Campos, E. V. R.; Proença, P. L. F.; Oliveira, J. L.; Bakshi, M.; Abhilash, P. C.; Fraceto, L. F.; Ecol. Indic. 2019, 105, 483. [Crossref] 20. Pascoli, M.; Jacques, M. T.; Agarrayua, D. A.; Avila, D. S.; Lima, R.; Fraceto, L. F.; Sci. Total Environ. 2019, 677, 57. [Crossref] 21. Baker, B. P.; Grant, J. A.; Integrated Pest Management Program, 2018. [Link] acessado em Novembro 2023 22. Reis, C. P.; Neufeld, R. J.; Ribeiro, A. J.; Veiga, F.; Nanomedicine 2006, 2, 8. [Crossref] 23. Pavela, R.; Benelli, G.; Trends Plant Sci. 2016, 21, 1000. [Crossref] 24. Pan, K.; Luo, Y.; Gan, Y.; Baek, S. J.; Zhong, Q.; Soft Matter 2014, 10, 6820. [Crossref] 25. Mora-Huertas, C. E.; Fessi, H.; Elaissari, A.; Int. J. Pharm. 2010, 385, 113. [Crossref] 26. Díaz-Gómez, J. L.; Ortíz-Martínez, M.; Aguilar, O.; García-Lara, S.; Castorena-Torres, F.; Molecules 2018, 23, 312. [Crossref] 27. Paliwal, R.; Palakurthi, S.; J. Controlled Release 2014, 189, 108. [Crossref] 28. Nunes, R.; Baião, A.; Monteiro, D.; das Neves, J.; Sarmento, B.; Drug Delivery Transl. Res. 2020, 10, 826. [Crossref] 29. Cheng, C. J.; Jones, O. G.; Food Hydrocolloids 2017, 69, 28. [Crossref] 30. Sun, C.; Dai, L.; He, X.; Liu, F.; Yuan, F.; Gao, Y.; Food Hydrocolloids 2016, 58, 11. [Crossref] 31. Wang, Y.; Padua, G. W.; Langmuir 2010, 26, 12897. [Crossref] 32. de Oliveira, J.; Campos, E.; Pereira, A.; Pasquoto, T.; Lima, R.; Grillo, R.; de Andrade, D.; dos Santos, F.; Fraceto, L.; J. Agric. Food Chem. 2018, 66, 1330. [Crossref] 33. Pascoli, M.; de Lima, R.; Fraceto, L. F.; Front. Chem. 2018, 6, 1. [Crossref] 34. Luis, A. I. S.; Campos, E. V. R.; de Oliveira, J. L.; Guilger-Casagrande, M.; de Lima, R.; Castanha, R. F.; de Castro, V. L. S. S.; Fraceto, L. F.; ACS Omega 2020, 5, 15557. [Crossref] 35. Shinde, P.; Agraval, H.; Srivastav, A. K.; Yadav, U. C. S.; Kumar, U.; Int. J. Pharm. 2020, 588, 119795. [Crossref] 36. Marinia, V. G.; Martellia, S. M.; Zornioa, C. F.; Caonb, T.; Simões, C. M. O.; Mickea, G. A.; de Oliveira, M. A. L.; Machadoa, V. G.; Sold, V.; Quim. Nova 2014, 37, 839. [Crossref] 37. de Oliveira, J.; Campos, E.; Germano-Costa, T.; Lima, R.; Vechia, J.; Soares, S.; de Andrade, D.; Gonçalves, K.; do Nascimento, J.; Polanczyk, R.; Fraceto, L.; Pest. Manage. Sci. 2019, 75, 1855. [Crossref] 38. de Menezes, T. I.; Costa, R. O.; Sanches, R. N. F.; Silva, D. O.; Santos, R. L. S. R.; Colloid Polym. Sci. 2019, 297, 1465. [Crossref] 39. Costa, R. O.; Coutinho, J. P.; Santos, R. L. S. R.; J. Appl. Polym. Sci. 2022, 139, 1. [Crossref] 40. Coelho, D.; Veleirinho, B.; Mazzarino, L.; Alberti, T.; Buzanello, E.; Oliveira, R. E.; Yunes, R. A.; Moraes, M.; Steindel, M.; Maraschin, M.; Colloids Surf., B 2021, 198, 111390. [Crossref] 41. Faria, F.; Vercelheze, A. E.; Mali, S.; Quim. Nova 2012, 35, 487. [Crossref] 42. Soliman, T. S.; Vshivkov, S. A.; Elkalashy, S. I.; Opt. Mater. 2020, 107, 110037. [Crossref] 43. Kesente, M.; Kavetsou, E.; Roussaki, M.; Blidi, S.; Loupassaki, S.; Chanioti, S.; Siamandoura, P.; Stamatogianni, C.; Philippou, E.; Papaspyrides, C.; Vouyiouka, S.; Detsi, A.; Bioengineering 2017, 4, 1. [Crossref] 44. Vehapi, M.; Yilmaz, A.; Özçimen, D.; J. Nat. Fibers 2021, 18, 1359. [Crossref] 45. Jyothi, N. V. N.; Prasanna, P. M.; Sakarkar, S. N.; Prabha, K. S.; Ramaiah, P. S.; Srawan, G. Y.; J. Microencapsulation 2010, 27, 187. [Crossref] 46. Santos, A. V.; de Oliveira, R. A.; Albuquerque, G. R.; Revista Brasileira de Medicina Veterinária 2012, 34, 111. [Link] acessado em Novembro 2023 47. Barbosa-Filho, J. M.; Cunha, R. M.; Dias, C. S.; Athayde-Filho, P. F.; Silva, M. S.; da Cunha, E. V. L.; Machado, M. I. L.; Craveiro, A. A.; Medeiros, I. A.; Rev. Bras. Farmacogn. 2008, 18, 37. [Crossref] 48. Adams, R. P.; Identification of Essential Oil Components by Gas Chromatography/Mass Spectrometry, 4th ed.; Allured Publishing Corporation: Illinois, 2007. 49. Montgomery, D. C.; Design and Analysis of Experiments, 8th ed.; John Wiley & Sons: Arizona, 2017. 50. da Rosa, C. G.; Maciel, M. V. O. B.; de Carvalho, S. M.; de Melo, A. P. Z.; Jummes, B.; da Silva, T.; Martelli, S. M.; Villetti, M. A.; Bertoldi, F. C.; Barreto, P. L. M.; Colloids Surf., A 2015, 481, 337. [Crossref] 51. Tadini, M. C.; Pinheiro, A. M. F.; Carrão, D. B.; Aguillera Forte, A. L. S.; Nikolaou, S.; de Oliveira, A. R. M.; Berretta, A. A.; Marquele-Oliveira, F.; J. Pharm. Biomed. Anal. 2017, 145, 576. [Crossref] 52. Agência Nacional de Vigilância Sanitária (ANVISA); Resolução da Diretoria Colegiada (RDC) No. 166, de 24 de julho de 2017, Dispõe sobre a Validação de Métodos Analíticos e dá Outras Providências; Diário Oficial da União (DOU), Brasília, No. 141, de 25/07/2017. [Link] acessado em Novembro 2023 53. Instituto Nacional de Metrologia, Qualidade e Tecnologia (INMETRO); DOQ-CGCRE-008 - Orientação sobre Validação de Métodos, 2020. [Link] acessado em Novembro 2023 54. Ribani, M.; Bottoli, C. B. G.; Collins, C. H.; Jardim, I. C. S. F.; Melo, L. F. C.; Quim. Nova 2004, 27, 771. [Crossref] 55. Dibazar, S. P.; Fateh, S.; Daneshmandi, S.; J. Food Drug Anal. 2014, 22, 448. [Crossref] 56. Rodríguez, O.; Sánchez, R.; Verde, M.; Núñes, M.; Ríos, R.; Chávez, A.; Journal of Oral Research 2014, 3, 218. [Link] acessado em Novembro 2023 57. Sokamte, T. A.; Jazet, D. P. M.; Tatsadjieu, N. L.; J. Microbiol. Res. 2016, 6, 1. [Link] acessado em Novembro 2023 58. Nassar, M. I.; Gaara, A. H.; El-Ghorab, A. H.; Farrag, A. R. H.; Shen, H.; Huq, E.; Mabry, T. J.; Rev. Latinoam. Quim. 2007, 35, 47. [Link] acessado em Novembro 2023 59. Swarbrick, J.; Encyclopedia of Pharmaceutical Technology, 3rd ed.; Iforma Healthcare: New York, 2002. 60. Toma, H. E.; Nanotecnologia Molecular: Materiais e Dispositivos, 1ª ed.; Editora Blucher: São Paulo, 2016. 61. Agustinisari, I.; Mulia, K.; Nasikin, M.; Appl. Sci. 2020, 10, 3205. [Crossref] 62. Kumar, B.; Jalodia, K.; Kumar, P.; Gautam, H. K.; J. Drug Delivery Sci. Technol. 2017, 41, 260. [Crossref] 63. Li, F.; Chen, Y.; Liu, S.; Qi, J.; Wang, W.; Wang, C.; Zhong, R.; Chen, Z.; Li, X.; Guan, Y.; Kong, W.; Zhang, Y.; Int. J. Nanomed. 2017, 12, 8197. [Crossref] 64. Fernandes, D. M.; Hechenleitner, A. A. W.; Lima, S. M.; Andrade, L. H. C.; Caires, A. R. L.; Pineda, E. A. G.; Mater. Chem. Phys. 2011, 128, 371. [Crossref] 65. Sahoo, S. K.; Panyam, J.; Prabha, S.; Labhasetwar, V.; J. Controlled Release 2002, 82, 105. [Crossref] 66. Muppalaneni, S.; Omidian, H.; J. Dev. Drugs 2013, 02, 1. [Crossref] 67. Crucho, C. I. C.; Barros, M. T.; Mater. Sci. Eng., C 2017, 80, 771. [Crossref] 68. Liu, Y.; Yang, G.; Jin, S.; Xu, L.; Zhao, C. X.; ChemPlusChem 2020, 85, 2143. [Crossref] 69. Pramod, K.; Ilyas, U. K.; Kamal, Y. T.; Ahmad, S.; Ansari, S. H.; Ali, J.; J. Anal. Sci. Technol. 2013, 4, 16. [Crossref] 70. Silva, J. T. P.; da Silva, A. C.; Geiss, J. M. T.; de Araújo, P. H. H.; Becker, D.; Bracht, L.; Leimann, F. V.; Bona, E.; Guerra, G. P.; Gonçalves, O. H.; Food Chem. 2017, 230, 336. [Crossref] 71. Buzanello, R. A. S.; Ferro, A. C.; Bona, E.; Cardozo-Filho, L.; de Araújo, P. H. H.; Leimann, F. V.; Gonçalves, O. H.; Food Chem. 2015, 172, 99. [Crossref] 72. International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use (ICH); Validation of Analytical Procedures: Text and Methodology Q2 (R1); ICH: London, 2005. [Link] acessado em Novembro 2023 73. Araujo, P.; J. Chromatogr. B: Anal. Technol. Biomed. Life Sci. 2009, 877, 2224. [Crossref] 74. Thompson, M.; Ellison, S. L. R.; Wood, R.; Pure Appl. Chem. 2002, 74, 4. [Crossref] 75. Chui, Q. S. H.; Zucchini, R. R.; Lichtig, J.; Quim. Nova 2001, 24, 374. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access






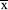 é a média das absorbâncias de cada ponto nos dias diferentes e σ é o desvio-padrão.
é a média das absorbâncias de cada ponto nos dias diferentes e σ é o desvio-padrão.