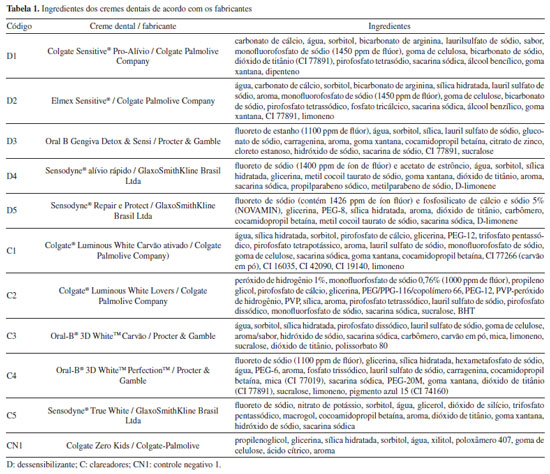
Artigo
|
|
| Ecotoxicidade de cremes dentais dessensibilizantes e clareadores em indicadores aquático e terrestre Ecotoxicity of desensitizing and whitening toothpastes in aquatic and terrestrial indicators |
|
Maria Thais S. de MacêdoI; Gabrieli Duarte FariasI; Alexandre Almeida-JúniorII; Andressa F. B. de OliveiraIII; I. Curso de Odontologia, Universidade Federal da Paraíba, 58051-900 João Pessoa - PB, Brasil Recebido: 01/04/2024 *e-mail: isabela.passos@academico.ufpb.br The aim of this study was to evaluate the ecotoxicity of desensitizing and whitening toothpastes against aquatic and terrestrial bioindicators. This is an in vivo ecotoxicity study. Ten different toothpastes were selected. Toothpaste without detergent and fluoride was negative control 1. Sea salt solution, mineral water and distilled-deionized water were second negative control. Toothpaste slurries were prepared at a ratio of 1:2, 1:3, 1:10 and 1:30 (w/w). The immobility/mortality test was carried out on Artemia salina L. The root growth test was carried out to obtain the percentage of relative growth and inhibition on Allium cepa L. pH of the slurries were determined. The ANOVA (analysis of variance) and Tukey's test was performed (p < 0.05). There was mortality in all Artemia nauplii exposed to desensitizing and whitening toothpastes. A significant reduction in the length of the roots of the bulbs exposed to all the slurries was observed. The percentage of inhibition was greater than 50%. Desensitizing and whitening toothpastes showed significant ecotoxicity against A. salina and A. cepa, with potential negative environmental impact of toothpastes on aquatic and terrestrial ecosystems. INTRODUÇÃO Os cremes dentais apresentam formulações complexas com vários ingredientes1 para prevenção e tratamento de condições dentárias e gengivais. Dentre essas condições, destacam-se a hipersensibilidade dentinária e escurecimento do dente, alterações frequentes na clínica odontológica,2,3 com cremes dentais específicos para o seu tratamento de acordo com ingredientes ativos.2,4 Os cremes dentais dessensibilizantes possuem dentre os ingredientes ativos, os compostos de potássio, fosfosilicato de cálcio de sódio, compostos de estrôncio, arginina, fluoreto estanhoso, fluoreto estanhoso, copolímeros, hidroxiapatita, fluoreto de sódio, monofluorfosfato de sódio e sal inorgânico.5,6 A eficácia do creme dental clareador é baseada nos ingredientes incorporados na sua composição base: abrasivos, agentes químicos peróxidos (peróxido de cálcio, percarbonato de sódio e peróxido de magnésio) e/ou enzimas.3 Além disso, globalmente, creme dental contém os seguintes ingredientes: carbonato de cálcio, fosfatos de cálcio, xilitol, sais de zinco, sílica hidratada, lauril sulfato de sódio e fluoreto de sódio, entre outros.1,7 Apesar dos benefícios, esses compostos químicos e seus metabólitos são poluentes emergentes por serem introduzidos direta e indiretamente no ambiente aquático ou terrestre.8 Somado a isso, a presença de microplásticos é uma realidade nos cremes dentais com potencial de contaminação emergente do ecossistema aquático.9-12 A variedade de ingredientes encontrados nos cremes dentais destaca a necessidade de tratamento dos efluentes brutos de cosméticos para evitar danos ao meio ambiente. Essa preocupação é particularmente relevante no Brasil, pois de acordo com o Sistema Nacional de Informações sobre Saneamento Básico,13 mais de 93 milhões de brasileiros, correspondendo a 44% da população, não têm acesso à coleta de esgoto. Isso significa que apenas 56,0% da população brasileira possui rede de esgoto, e destes, apenas 52,2% dos esgotos são tratados. Esses números evidenciam um problema socioambiental que precisa ser abordado com urgência. Aliado a isso, o tamanho do mercado de cremes dentais é estimado em US$ 34,48 bilhões em 2024 e US$ 50,78 bilhões até 2029, sendo a América do Sul o mercado de crescimento mais rápido.14 Este estudo foi realizado para investigar a toxicidade de cremes dentais dessensibilizantes e clareadores em um ambiente marinho e terrestre. Um invertebrado aquático foi escolhido como organismo modelo para estudar a toxicidade aquática e uma planta foi selecionada para a toxicidade terrestre. No ambiente aquático, a Artemia salina L. é microcrustáceo do zooplâncton recomendado pela EPA United States Enviromental Protection Agency para teste de ecotoxicidade aguda.15 No ambiente terrestre, o Allium cepa L. é uma das mais usadas espécies de planta em teste de ecotoxicidade para ambiente terrestre.16-18 O conhecimento da existência de uma situação de estresse ambiental é um pré-requisito para subsidiar ações para a sua solução ou melhoria. Com base nisso, métodos eficazes para avaliação de saúde ambiental foi desenvolvido.18 Assim, o objetivo deste estudo foi avaliar a ecotoxicidade de cremes dentais dessensibilizantes e clareadores frente a bioindicadores aquático e terrestre. As hipóteses nulas testadas foram: (i) não há diferença estatisticamente significativa entre cremes dentais dessensibilizantes, clareadores e o controle negativo no teste de mortalidade/imobilidade de A. salina; e (ii) não há diferença estatisticamente significativa entre cremes dentais dessensibilizantes, clareadores e o controle negativo na média de crescimento radicular de A. cepa.
PARTE EXPERIMENTAL Trata-se de um estudo de ecotoxicidade laboratorial in vivo em bioindicadores (organismos alternativos ao estudo tradicional em animais). Onze diferentes cremes dentais foram selecionados de acordo com a indicação: dessensibilizantes (D; n = 5) e clareadores (C; n = 5). Além destes, um creme dental infantil com composição sem detergente e flúor foi selecionado aleatoriamente como controle negativo 1 (CN1). O segundo controle negativo (CN2) foi solução de sal marinho (25 g L–1), para teste com A. salina; água mineral, para teste com A. cepa; e água destilada-deionizada para teste de pH dos cremes dentais. Os ingredientes dos cremes dentais estão descritos na Tabela 1. Os slurries de cremes dentais foram preparados nas proporções de 1:2, 1:3, 1:10 e 1:30 (creme dental/diluente), em peso, com o auxílio do agitador vórtex.
Teste de toxicidade em Artemia salina O teste de imobilidade/mortalidade em A. salina foi conduzido conforme descrito previamente19 com cistos de A. salina estocados a 4 °C. Um grama dos cistos foi dispensado em aquário (metade transparente e metade escuro) contendo solução de sal marinho (25 g L–1 de água destilada (NutriSelect® Basic, Merck KGaA, Brasil), sob iluminação artificial e aeração constante, temperatura de 28 °C durante 48 h de incubação para a eclosão dos cistos. Os náuplios foram distribuídos em tubos de ensaio (10 organismos para cada tubo) contendo 5 mL de slurries de creme dental em solução de sal marinho nas quatro concentrações previamente preparadas, e colocados em temperatura constante de 28 °C por 24 h. Após o período de exposição, os náuplios vivos foram contados, utilizando uma lupa. Náuplios foram considerados mortos quando não houve movimentação (mudança da posição do baricentro e apêndice) por 10 s de observação. O teste foi considerado válido diante da mortalidade de grupo controle negativo (apenas solução de sal marinho) inferior a 10%. Teste realizado em conjuntos de cinco repetições (n = 5) para cada concentração de creme dental. Teste de toxicidade em Allium cepa O teste de toxicidade aguda com bulbos de A. cepa foi conduzido conforme descrito previamente.16,18 Bulbos com diâmetro entre 15 e 20 mm livre de alterações na superfície foram tratados com remoção das cascas externas soltas e raspagem da base para expor as raízes, com cuidado para manter o anel radicular intacto. Para germinação prévia das raízes, os bulbos foram colocados em contato com água mineral em recipientes plásticos descartáveis, a temperatura ambiente constante (20 °C), protegidos contra a luz direta do sol, durante 24 h claro/escuro, total de 48 h. Para teste de inibição do crescimento radicular, cinco bulbos com brotamento (raízes com 1-2 cm) foram distribuídos aleatoriamente em cada recipiente contendo slurries dos onze cremes dentais na concentração de 1:30 (g/g) por período de 72 h. O controle negativo foi representado por cinco bulbos em água mineral. No final do tratamento, as duas raízes mais compridas de cada bulbo foram mensuradas com paquímetro, obtendo-se a média do comprimento. Com esse dado, o índice de crescimento relativo (ICR) e o percentual da inibição do crescimento foi calculado para cada uma das concentrações por comparação com a média do comprimento das raízes do controle negativo (água mineral) representativa de 100%. O teste foi conduzido em cinco replicatas. Determinação do pH O pH dos slurries de creme dental foi mensurado com pHmetro (modelo 91-02 Orion Research Corp. Cambridge, EUA) acoplado em um potenciômetro (modelo 290 A+, Orion Research Corp., Cambridge, EUA). Inicialmente, foi conduzida a calibração com soluções de pH 4 e pH 7. Cada slurry foi testado em triplicata e água destilada-deionizada foi usado como controle negativo. Análise estatística Os dados foram analisados estatisticamente usando pacote estatístico SPSS para Windows, versão 21.0 para Windows.20 O teste Shapiro-Wilk e teste Levene foram usados para determinar normalidade e homogeneidade das variâncias, respectivamente. Os dados demonstraram igualdade de variância e distribuição Gaussiana, nenhuma transformação de dados foi necessária. Teste ANOVA (análise de variância) e pós-teste de Tukey foram aplicados para média de organismos mortos/imóveis de A. salina, bem como para diferença entre médias do crescimento dos bulbos de A. cepa. As hipóteses foram testadas a nível de significância de 5%.
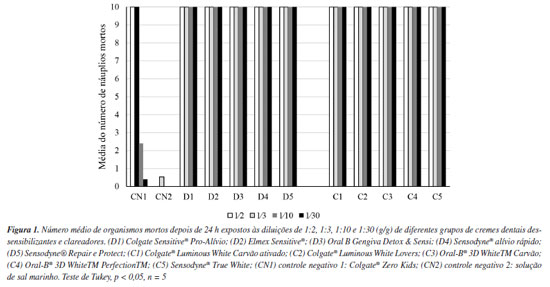
RESULTADOS E DISCUSSÃO Apesar dos cremes dentais de diferentes composições e indicações serem usados diariamente em todo o mundo, pouco se sabe o efeito ambiental desses produtos lançados nos efluentes. Assim, mostrou-se que os cremes dentais dessensibilizantes e clareadores influenciaram na viabilidade de bioindicadores da vida aquática e terrestre, o que levou a rejeitar a hipótese nula. Os slurries de 1:2 e 1:3 foram testados inicialmente no presente estudo por representarem padrões de proporção mais comumente usados para preparar cremes dentais em estudos in vitro21,22 por simular a situação clínica da escovação dental com a diluição do creme dental pela saliva na cavidade oral e expectoração no esgoto doméstico. Entretanto, diante da mortalidade dos náuplios, optou-se por aumentar aleatoriamente a diluição dos slurries (1:10 e 1:30). Na Figura 1, verificaram-se mortalidade de todos os náuplios submetidos aos cremes dentais dessensibilizantes e clareadores, frente a média de mortalidade de 0,53 no grupo controle (apenas solução de sal marinho), com diferença estatisticamente significativa (p < 0,001). Entretanto, na formulação Colgate® Zero Kids, a média de mortalidade foi de 2,40 náuplios na concentração 1:10 (g/g) e 0,40, no slurry de 1:30 (g/g). Este último não apresentou diferença estatisticamente significativa em relação ao controle com solução de sal marinho (p < 0,05).
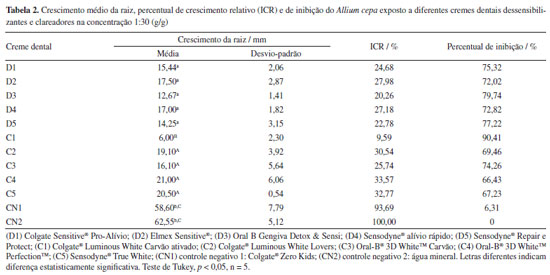
A mortalidade dos náuplios de A. salina expostos a todas as concentrações dos cremes dentais testes apresentaram valores superior às relatadas em estudos anteriores com gel de testosterona e estradiol23 e nanoplásticos.24 A Tabela 2 apresentou o crescimento médio da raiz, percentual de crescimento relativo e de inibição do A. cepa exposto aos cremes dentais dessensibilizantes e clareadores. A média ± desvio-padrão do crescimento radicular nos cremes dentais variou de 6,00 ± 2,30 a 20,50 ± 0,54 mm para C1 e C5, respectivamente. Constatou-se redução estatisticamente do comprimento das raízes dos bulbos expostos a todas as variantes de cremes dentais, quando comparados aos controles negativos (p < 0,05). O percentual de inibição foi superior a 50%. O creme dental controle (Colgate® Zero Kids) apresentou percentual de inibição do crescimento radicular de 6,31%.
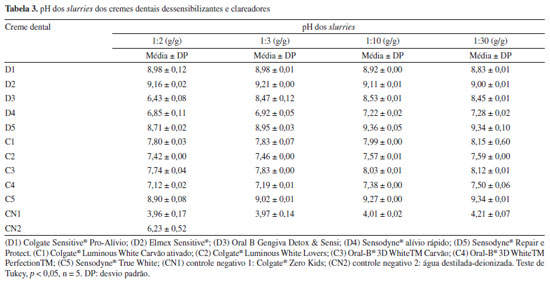
Em acréscimo, ao longo do período de exposição, conforme as condições experimentais, não foram notadas alterações macroscópicas na morfologia geral das raízes, sugerindo a ausência de mudanças visíveis em sua aparência. O crescimento das raízes de A. cepa foi frequentemente utilizado como bioindicador de toxicidade em estudos anteriores, demonstrando resultados similares aos encontrados no presente estudo, como no caso da exposição à fumaça de ponta de cigarro17 e do anticonvulsivante carbamazepina 75 mg mL–1.18 Por outro lado, a inibição do crescimento das raízes foi menos acentuada quando comparada a um estudo anterior25 relacionado aos contaminantes BTEX (benzeno, tolueno, etilbenzeno e xileno). Diante dos achados, buscou-se avaliar o pH dos slurries como possível efeito na viabilidade dos bioindicadores, considerando a presença de agentes reguladores de acidez nos cremes dentais, a exemplo do fosfato tricálcico e pirofosfato tetrasódio (Tabela 1). Na Tabela 3, pode-se verificar variação do pH dos slurries de 6,43 ± 0,08 (D3, [1:2]) a 9,36 ± 0,05 (D5, [1:10]), com exceção do creme dental do grupo controle. Os dados de pH revelaram que os slurries de creme dental estavam dentro da faixa de pH de 6 a 9, considerada adequada para a eclosão e sobrevivência dos náuplios. Em adição, o pH do meio aquático superior a 10,5 não favorece o desenvolvimento do microcrustáceo.26 O pH de 4,21 ± 0,07 do slurry do creme dental controle na concentração 1:30 não influenciou na mortalidade dos naúplios e nem no crescimento radicular quando comparados ao controle negativo (p > 0,05), e pode ser explicado pela presença de ácido cítrico na sua composição (Tabela 1). Em relação, estudo prévio16 observou ausência de comprometimento do crescimento radicular do A. cepa em pH entre 3,5 e 11,0.
O slurry com fluoreto de estanho (D3) foi o único com alteração relevante no pH após diluição (6,43-8,45) quando comparada aos menos diluídos e outros slurries com outras formas de flúor na composição (fluoreto de sódio e monofluorfosfato de sódio). O fluoreto de estanho é um composto de flúor polivalente contendo cátion metálico que tem papel na desmineralização e remineralização de lesões de cárie dentária. Sn2+ preveniu a remineralização na copresença de fluoreto, mas apenas em valores de pH elevados. Por outro lado, o Sn2+ é reativo e pode perder flúor e oxidar para estânico [estanho(IV)].27 Em adição, os ingredientes presentes nas águas residuais da indústria cosmética são tóxicos e não biodegradáveis, a exemplo dos desreguladores endócrinos (metilparabeno e propilparabeno, presentes no creme dental D4, Tabela 1),28 microplásticos e surfactantes.29 Os surfactantes presentes nos cremes dentais do presente estudo foram cocoamidopropil betaína, metil cocoil taurato de sódio e lauril sufato de sódio (Tabela 1). Eles podem ter influenciado a sobrevivência da A. salina e o crescimento radicular do A. cepa. Especialmente o lauril sufato de sódio e cocoamidopropil betaína, em estudo recente,7 foram responsáveis pela diminuição da atividade locomotora e inibição da expressão de genes relacionados a odontogênese em organismo aquático (peixe-zebra). Por outro lado, há relatos da presença de microplásticos (não foi objeto de avaliação deste estudo) nos cremes dentais em diferentes classes de tamanho, distribuição e formas poliméricas,9 o que pode justificar o efeito deletério na sobrevida da A. salina exposta ao creme dental controle. Os microplásticos são poluentes emergentes com efeito prejudicial em A. salina por indução de estresse oxidativo, apoptose, acúmulo físico no intestino, alteração do comportamento e na capacidade de nadar.10-12 Sugere-se estudos futuros para avaliar microplásticos presentes em cremes dentais dessensibilizantes e clareadores, bem como infantis. Nesse contexto, é importante notar as limitações desse estudo. O estudo laboratorial não capturou a complexidade do ambiente aquático e terrestre, e não há dados sobre a real concentração final do creme dental nos ecossistemas aquático e terrestre. A ausência de controle positivo do presente estudo também foi verificada em trabalhos prévios,23-25 sem comprometimento da qualidade do estudo, pois o percentual de crescimento relativo e de inibição do Allium cepa foi obtido pela representatividade de 100% de crescimento do controle negativo.16,18 O teste de A. salina foi considerado válido com base na taxa de mortalidade calculada no grupo controle negativo. Apesar de algumas soluções poderem representar controle positivo como ciclofosfamida,17 solução de alumínio18 e metilmetanosulfona,23 nenhuma se aplicava ao presente estudo. Os efluentes com concentrações tóxicas desses cremes dentais em cursos d’água e no solo, sem prévio tratamento, pode comprometer a sobrevivência de espécies do ecossistema. Isso ressalta a urgência e estimula a promoção de estratégias para o tratamento adequado dos efluentes, bem como incentiva e fomenta o desenvolvimento de técnicas de tratamento dos efluentes previamente ao descarte. Além disso, são necessários estudos futuros do impacto crônico dos resíduos de creme dental a nível molecular na sobrevivência de organismos aquáticos e terrestres.
CONCLUSÃO Os cremes dentais dessensibilizantes e clareadores apresentaram ecotoxicidade significativa em A. salina e A. cepa, com potencial de impacto ambiental negativo dos cremes dentais em ecossistemas aquáticos e terrestres.
AGRADECIMENTOS Os autores agradecem ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo apoio financeiro.
REFERÊNCIAS 1. Unterbrink, P.; zur Wiesche, E. S.; Meyer, F.; Fandrich, P.; Amaechi, B. T.; Enax, J.; Dent. J. 2024, 12, 64. [Crossref] 2. Liu, X.-X.; Tenenbaum, H. C.; Wilder, R. S.; Quock, R.; Hewlett, E. R.; Ren, Y.-F.; BMC Oral Health 2020, 20, 220. [Crossref] 3. Vladislavic, N. Z.; Tadin, A.; Gavic, L.; Jerkovic, D.; Franic, I.; Verzak, Z.; Clinical Oral Investigations 2022, 26, 739. [Crossref] 4. Casado, B. G. S.; Moraes, S. L. D.; Souza, G. F. M.; Guerra, C. M. F.; Souto-Maior, J. R.; Lemos, C. A. A.; Vasconcelos, B. C. E.; Pellizzer, E. P.; Int. J. Dent. 2018, 2018, 7868531. [Crossref] 5. Martins, C. C.; Firmino, R. T.; Riva, J. J.; Ge, L.; Carrasco-Labra, A.; Brignardello-Petersen, R.; Colunga-Lozano, L. E.; Granville-Garcia, A. F.; Costa, F. O.; Yepes-Nuñez, J. J.; Zhang, Y.; Schünemann, H. J.; J. Dent. Res. 2020, 99, 514. [Crossref] 6. Martins, C. C.; Riva, J. J.; Firmino, R. T.; Schüneman, H. J.; J. Appl. Oral Sci. 2022, 30, e20210410. [Crossref] 7. Karaman, G. E.; Ünal, İ.; Beler, M.; Üstündağ, F. D.; Cansız, D.; Üstündağ, Ü. V.; Emekli-Alturfan, E.; Akyüz, S.; Drug Chem. Toxicol. 2024, 47, 15. [Crossref] 8. Reyes, N. J. D. G.; Geronimo, F. K. F.; Yano, K. A. V.; Guerra, H. B.; Kim, L.-H.; Water 2021, 13, 1159. [Crossref] 9. Madhumitha, C. T.; Karmegam, N.; Biruntha, M.; Arun, A.; Al Kheraif, A. A.; Kim, W.; Kumar, P.; Chemosphere 2022, 296, 133976. [Crossref] 10. Athulya, P. A.; Sunil, Z.; Manzo, S.; Chandrasekaran, N.; J. Environ. Manage. 2023, 348, 119367. [Crossref] 11. Contino, M.; Ferruggia, G.; Indelicato, S.; Pecoraro, R.; Scalisi, E. M.; Salvaggio, A.; Brundo, M. V.; Animals 2023, 13, 3152. [Crossref] 12. Kanimozhi, S.; Seenivasan, R.; Mukherjee, A.; Chandrasekaran, N.; Environ. Sci. Pollut. Res. 2024, 31, 13207. [Crossref] 13. Sistema Nacional de Informações sobre Saneamento, https://www.gov.br/cidades/pt-br/acesso-a-informacao/acoes-e-programas/saneamento/snis, acessado em outubro 2024. 14. Mordor Intelligence, Tamanho do Mercado de Pasta de Dente e Análise de Participação - Tendências e Previsões de Crescimento (2024 - 2029), https://www.mordorintelligence.com/pt/industry-reports/global-toothpaste-market, acessado em outubro 2024. 15. United States Environmental Protection Agency (US EPA); Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms, 5th ed.; US EPA: Washington, 2002. [Link] acessado em outubro 2024. 16. Fiskesjö, G.; Hereditas 1985, 102, 99. [Crossref] 17. Montalvão, M. F.; Sampaio, L. L. G.; Gomes, H. H. F.; Malafaia, G.; Environ. Sci. Pollut. Res. 2019, 26, 2013. [Crossref] 18. García-Medina, S.; Galar-Martínez, M.; Gómez-Oliván, L. M.; Torres-Bezaury, R. M. C.; Islas-Flores, H.; Gasca-Pérez, E.; Chemosphere 2020, 253, 126675. [Crossref] 19. Meyer, B. N.; Ferrigni, N. R.; Putnam, J. E.; Jacobsen, L. B.; Nichols, D. E.; McLaughlin, J. L.; Planta Med. 1982, 45, 31. [Crossref] 20. IBM SPSS Statistics for Windows, versão 21.0; IBM Corp., Armonk, NY, USA, 2012. 21. Sakae, L. O.; Kairalla, C. A.; Viana, Í. E. L.; Carvalho, T. S.; Niemeyer, S. H.; Hara, A. T.; Scaramucci, T.; J. Dent. 2024, 143, 104901. [Crossref] 22. Chalkidis, J.; Barke, S.; Rohland, B.; Schmidt, A.; Kanzow, P.; Wiegand, A.; Sci. Rep. 2023, 13, 10884. [Crossref] 23. Viega, B. L.; Rocha, A. M.; Düsman, E.; Environ. Sci. Pollut. Res. 2020, 27, 6659. [Crossref] 24. Kamalakannan, M.; Rajendran, D.; Thomas, J.; Chandrasekaran, N.; NanoscaleAdv. 2024, 6, 3119. [Crossref] 25. Caetano, M. O.; Kieling, A. G.; Raimondi, R. L.; Gomes, L. P.; Schneider, I. A. H.; Environ. Sci. Pollut. Res. Int. 2018, 25, 12849. [Crossref] 26. Lewan, L.; Andersson, M.; Morales-Gomez, P.; ATLA, Altern. Lab. Anim. 1992, 20, 297. [Crossref] 27. Lippert, F.; Caries Res. 2016, 50, 378. [Crossref] 28. Bila, D. M.; Dezotti, M.; Quim. Nova 2007, 30, 651. [Crossref] 29. Lima, J. P. P.; Melo, E. D.; Aguiar, A.; Process Saf. Environ. Prot. 2022, 168, 601. [Crossref]
Editor Convidado responsável pelo artigo: Marco T. Grassi |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access