Artigo
|
|
| Glicosídeos esteroidais de Solanum jabrense Agra & M.Nee Steroidal glycosides from Solanum jabrense Agra & M.Nee |
|
Anauara Lima e SilvaI; Thiago A. M. BritoI; Maria de Fátima AgraII; Marcelo S. da SilvaI; Josean F. TavaresI,* I. Programa de Pós-Graduação em Produtos Bioativos Naturais e Sintéticos, Centro de Ciências da Saúde, Universidade Federal da Paraíba, 58397-000 João Pessoa - PB, Brasil Recebido: 07/02/2025 *e-mail: josean@ltf.ufpb.br Solanum jabrense is an endemic species of Brazil, which occurs in high-altitude swamps in the Northeast, associated with rocky environments, exclusively in the states of Ceará, Paraíba, Pernambuco and Bahia. In previous studies, its pharmacological potential was demonstrated given the presence of flavonoids and steroid glycosides. In this work, three steroidal glycosides were isolated from the aerial part of S. jabrense, foliumin A and (22S,23R,25R)-3β,23-dihydroxyspirost-5-en-26-one 3-O-{α-L-rhamnopyranosyl-(1→2)-[α-L-rhamnopyranosyl-(1→4)]-β-D glucopyranoside}, a rare and a new saponin, respectively, in addition to an already known alkaloid, solamargine, all being the first record for the species. All structures were elucidated by spectroscopic data analysis (1D, 2D nuclear magnetic resonance (NMR) and high-resolution mass spectrometry (HRMS)) combined with polarimeter and infrared. INTRODUÇÃO O gênero Solanum L. é um dos mais relevantes do mundo, com espécies amplamente utilizadas na alimentação humana diária, destacando-se o tomate (S. lycopersicum), a batata (S. tuberosum) e a berinjela (S. melongena), além de ser um dos mais diversos e com grande número de representantes dentro da família Solanaceae, incluindo, atualmente, cerca de 1.245 espécies aceitas, que ocorrem em uma variedade de hábitats, desde florestas tropicais até ambientes áridos.1,2 As espécies desse grupo, conhecidas popularmente como "Jurubebas", destacam-se do ponto de vista etnobotânico, já que são utilizadas para diversos fins em diferentes regiões do mundo. Muitas delas são reconhecidas na medicina tradicional por suas propriedades antitumoral,3 anti-inflamatórias,4 antimicrobianas,5,6 antifúngicas,7,8 antioxidantes,9 antidiabética,10,11 leishmanicida,12 entre outras, as quais estão frequentemente associadas à presença de compostos bioativos, como alcaloides, saponinas e flavonoides.13,14 Dentre as espécies de Solanum, destaca-se S. jabrense, uma espécie endêmica do Brasil, com ocorrência restrita à Caatinga e Mata Atlântica, encontrada principalmente em ambientes rochosos e regiões de altitude de estados do Nordeste brasileiro.15,16 Embora seu potencial medicinal ainda seja pouco explorado, estudos relatam sua ação espasmolítica17 e moluscicidal.18 Compreender sua composição química pode auxiliar no entendimento de suas interações ecológicas, distribuição geográfica e principalmente de suas propriedades biológicas, sendo fundamental para embasar ações de conservação e estimular o aproveitamento sustentável de seus recursos, contribuindo também para a valorização e a preservação da biodiversidade regional e nacional. A partir do estudo fitoquímico do extrato hidroalcoólico das partes aéreas de S. jabrense, foi possível isolar e identificar uma rara e uma nova saponina, além de um alcaloide já conhecido, sendo este o primeiro registro dessas estruturas na espécie.
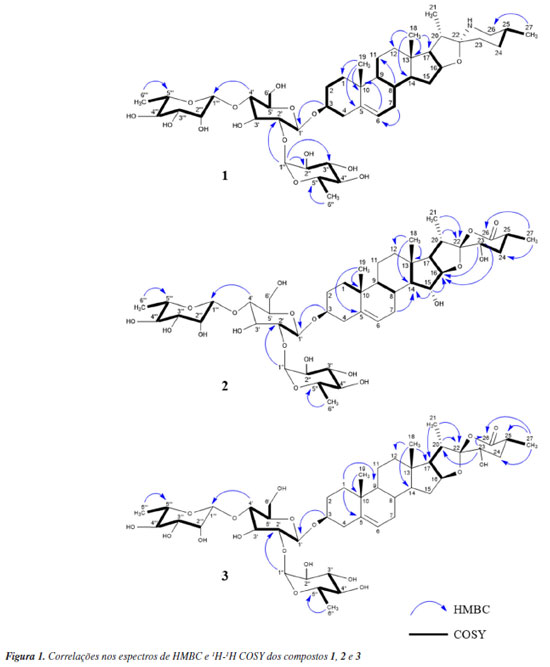
RESULTADOS E DISCUSSÃO Do extrato hidroalcoólico das partes aéreas de S. jabrense foram isolados três glicosídeos esteroidais, compostos 1, 2 e 3 (Figura 1). As estruturas foram elucidadas com base na análise de dados de infravermelho (IV), rotação óptica (RO), ressonância magnética nuclear (RMN) e espectrometria de massas de alta resolução (EMAR), além da comparação com dados disponíveis na literatura.
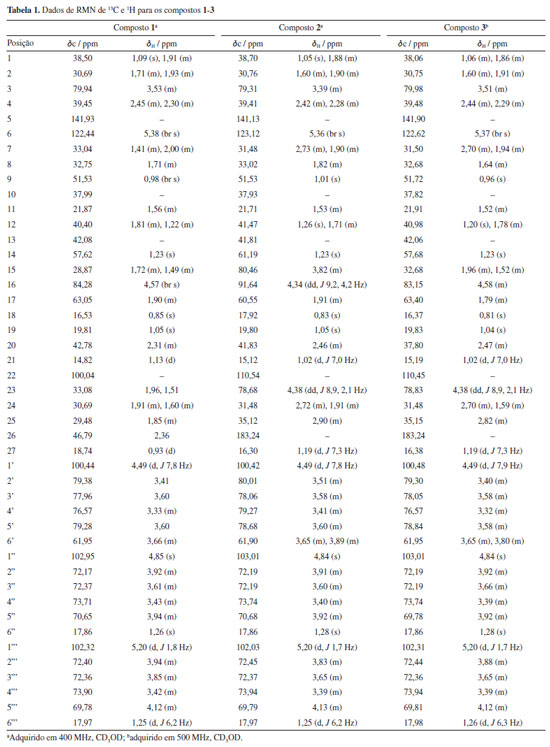
O composto 1 foi isolado como um pó branco, [a]D21 -58,071 (c 0,1, CH3OH). Sua fórmula molecular foi determinada como C45H73NO15 por EMAR, com m/z 868,5053 [M + H]+ (calcd. para 868,5021, Δ = 3,7 ppm). O espectro de IV (ATR-FTIR, do inglês attenuated total reflectance - Fourier transform infrared spectroscopy) mostrou bandas de absorção em 3371 cm-1 referente a presença dos grupos OH, e 1651 cm-1 referente a absorção de dobramento N-H de amina secundária. A análise detalhada dos espectros de RMN de 1H e 13C do composto 1 permitiram identificar sinais característicos do alcaloide esteroidal do tipo espirosolano ligado a uma cadeia glicosilada. O espetro de RMN de 1H exibiu sinais de um hidrogênio olefínico δH 5,38 (1H, sl), três sinais de hidrogênios anoméricos 5,20 (1H, d), 4,85 (1H, s), 4,49 (1H, d), e quatro sinais de metilas, sendo duas singletos 1,05 (3H, s), 0,85 (3H, s) e duas dubletos 1,13 (3H, d), 0,93 (3H, d). No espectro de RMN de 13C foram observados 45 sinais ressonantes, sendo quatro carbonos não hidrogenados, δC 42,08 (C-13), 37,99 (C-10), incluindo um ligado a átomo de oxigênio e nitrogênio, 100,04 (C-22), e um sp2 em 141,93 (C-5). Nove carbonos metínicos, incluindo dois oxigenados 79,94 (C-3) e 84,28 (C-16), 122,44 (C-6), 32,75 (C-8), 51,53 (C-9), 57,62 (C-14), 63,05 (C-17), 42,78 (C-20), 29,48 (C-25), dez metilênicos 46,79 (C-26), 30,69 (C-24), 33,08 (C-23), 28,87 (C-15), 40,40 (C-12), 21,87 (C-11), 33,04 (C-7), 39,45 (C-4), 30,69 (C-2), 38,50 (C-1), e quatro metílicos 18,74 (C-27), 14,82 (C-21), 16,53 (C-18), 19,81 (C-19), foram encontrados, considerando a presença de uma função éter. A estrutura da aglicona foi confirmada por correlações chave nos espectros de RMN de 1H-1H COSY (do inglês, correlation spectroscopy) e HMBC (do inglês, heteronuclear multiple bond correlation) (Figura 1). A posição das metilas Me-18, Me-19, Me-21 e Me-27 foram confirmadas por correlações no espectro de RMN de HMBC (Figura 1). A estrutura da aglicona foi consistente com a mesma apresentada pelo composto (3β,22α,25R)-espirosol-5-en-3-ol conhecido como solasodina.19 O trissacarídeo ligado em C-3 da aglicona composto por duas L-ramnose, 4,85 (1H, d, C-1''), 3,92 (1H, m, C-2''), 3,61 (1H, m, C-3''), 3,43 (1H, m, C-4''), 3,94 (1H, m, C-5''), 1,26 (3H, s, C-6''), 5,20 (1H, d, C-1'''), 3,94 (1H, m, C-2'''), 3,85 (1H, m, C-3'''), 3,42 (1H, m, C-4'''), 4,12 (1H, m, C-5'''), 1,25 (3H, d, C-6''') e uma D-glicose, 4,49 (1H, d, C-1'), 3,41(1H, m, C-2'), 3,60 (1H, m, C-3'), 3,33 (1H, m, C-4'), 3,60 (1H, m, C-5'), 3,66 (2H, m, C-6'), foi identificado como O-6-desoxi-α-L-ramnopiranosil-(1→2)-O-[6-desoxi-α-L-ramnopiranosil-(1→4)]-β-D-glucopiranosídeo, uma chacotriose20 (Tabela 1). A conectividade dos açúcares foi confirmada pelas correlações no espectro de HMBC δH 4,49 (H-1') / δC 79,94 (C-3), δH 4,85 (H-1'') / δC 79,38 (C-2') e δH 5,20 (H-1''') / δC 76,57 (C-4') (Figura 1). Todos os dados obtidos e analisados foram condizentes para identificação de 1 em (3β,22α,25R)-espirosol-5-en-3-il O-6-desoxi-α-L-ramnopiranosil-(1→2)-O-[6-desoxi-α-L-ramnopiranosil-(1→4)]-β-D-glucopiranosídeo ou solamargina.20 Os dados de RMN de 1H e 13C estão dispostos na Tabela 1 e os espectros disponíveis no Material Suplementar (Figuras 1S-9S).
O composto 2 foi obtido como um sólido incolor, [a]D21 -86,557 (c 0,1, CH3OH). A EMAR mostrou um íon molecular protonado com m/z 915,4584 [M + H]+ (calcd. para 915,4466, Δ = 1,8 ppm) e sua fórmula molecular determinada como C45H70O19. O espectro de IV (ATR-FTIR) mostrou duas bandas de absorção em 1757 cm-1 e uma banda intensa em 3392 cm-1 referentes a presença de C=O (éster) e grupos OH, respectivamente. Os sinais no espectro de RMN de 1H e 13C mostraram que a estrutura do composto 2 é formada por uma aglicona e um trisscarídeo ligado em C-3, similar quando comparado aos dados do composto 1. Entretanto, a estrutura da aglicona 2 apresentou deslocamentos semelhantes a aglicona de foliumin.21 Assim como em foliumin, no espectro de RMN de 13C o composto isolado demonstrou a presença de uma insaturação devido aos sinais referentes aos carbonos olefínicos δC 123,12 (C-6) e 141,13 (C-5), e a observação de um hidrogênio olefínico δH 5,36 (H-6) no espectro de RMN de 1H. A estrutura da aglicona foi confirmada por correlações chave nos espectros de RMN de 1H-1H COSY e HMBC (Figura 1). Diferente de foliumin, que é um Δ5-espirosteno dissubstituído, onde só foram observados dois sinais relativos a carbonos anoméricos, aqui temos três sinais relativos a carbonos anoméricos, δC 100,42 (C-1'), 103,01 (C-1''), 102,03 (C-1''') indicando que o composto é Δ5-espirosteno substituído com um trissacarídeo. Esqueletos espirostenos são comuns em espécies de Solanum e muitas dessas estruturas, glicosiladas na posição C-3 já foram isoladas.22 A posição da dupla ligação foi confirmada por correlações no espectro de HMBC de δH 1,05 (H-19) / δC 141,13 (C-5), δH 1,05 (H-19) / δC 37,93 (C-10), além da comparação com dados da literatura. Já a conectividade dos açúcares foi confirmada pelas correlações no espectro de HMBC δH 4,49 (H-1') / δC 79,31 (C-3), δH 4,84 (H-1'') / δC 80,01 (C-2') e δH 5,20 (H-1''') / δC 79,27 (C-4'). O espectro de RMN de 1H também exibiu quatro sinais relativos a duas metilas singletos δH 1,05 (3H, s), 0,83 (3H, s) e duas metilas dubletos 1,19 (3H, d), 1,01 (3H, d) assim como em solamargina,23 condizentes com a biossíntese dessas estruturas. A principal diferença entre 1 e 2 está no carbono não oxigenado δC 110,54 (C-22) que nesta estrutura não mais está ligado a um nitrogênio e a um oxigênio e sim a dois oxigênios, deixando de ser então um alcaloide esteroidal e passando a ser uma saponina esteroidal. Também foi possível observar no espectro de RMN de 13C a presença de um outro carbono não oxigenado conectado a um grupo carbonila δC 183,24 (C-26), e duas hidroxilas, evidentes pelos sinais de dois carbonos ligados a oxigênio, 78,68 (C-23) e 80,46 (C-15), além dos dois hidrogênios hidroximetínicos δH 3,82 (H-15, 1H, m) e 4,38 (H-23, 1H, dd) no espectro de RMN de 1H. A posição desses grupos foi confirmada pelas correlações no espectro de HMBC δH 1,19 (H-27) / δC 183,24 (C-26), δH 1,01 (H-21) / δC 110,54 (C-22), δH 4,38 (H-23) / δC 91,64 (C-16) e δH 3,82 (H-15) / δC 91,64 (C-16). O trissacarídeo ligado na posição C-3 da aglicona também apresentou deslocamentos referentes a duas L-ramnose e uma D-glicose, assim como em solamargina.23 Todos os dados obtidos foram condizentes para identificação dessa estrutura como (22S,23R,25R)-3β,15α,23-tri-hidroxispirosina-5-en-26-ona 3-O-{α-L-ramnopiranosil-(1→2)-[α-L-ramnopiranosil-(1→4)]-β-D-glicopiranosídeo} ou foliumin A.24 Apenas um registro desse composto foi encontrado na literatura podendo este então ser considerado raro, entretanto, não foi possível encontrar dados do seu completo assinalamento, disponíveis agora neste trabalho. Dados de RMN de 1H e 13C foram apresentados na Tabela 1 e no Material Suplementar (Figuras 10S-18S). O composto 3, um sólido incolor, [a]D21 -113,414 (c 0.1, CH3OH), teve sua fórmula molecular determinada como C45H70NaO18 por EMAR, com m/z 921,4479 [M + Na]+ (calcd. para 921,4422, Δ = 2,6 ppm). O espectro de IV (ATR-FTIR) mostrou uma banda de absorção em 1757 e 3371 cm-1 relativas à presença de C=O (éster) e grupos OH, respectivamente. O espectro de RMN de 1H exibiu três sinais relativos a hidrogênios anoméricos de açúcares δH 5,20 (1H, d), 4,84 (1H, d), 4,49 (1H, d), duas metilas singletos 1,04 (3H, s), 0,81 (3H, s) e duas metilas dubletos 1,19 (3H, d), 1,02 (3H, d). No espectro de RMN de 13C, sinais relativos de C-1 a C-13 e C-19 a C-27 mostraram deslocamentos químicos similares a estrutura de 2, mas sinais relativos a δC 32,68 (C-15), 83,15 (C-16) e 63,40 (C-17) foram similares a solamargina23 sugerindo que a aglicona de 3 é um derivado 15-desidroxilado de 2. Entretanto, sinais relativos ao trisscarídeo no espectro de RMN de 13C do composto 3 foram iguais a solamargina e ao composto 2, uma 3-O-β-chacotriose. A estrutura da aglicona e seus trissacarídeos foram confirmadas por correlações chave nos espectros de RMN de 1H-1H COSY e HMBC (Figura 1). Após uma ampla revisão da literatura não foi encontrado nenhum relato do isolamento desse composto anteriormente, sendo um novo Δ5-espirosteno, substituído com um trissacarídeo, identificado como (22S,23R,25R)-3β,23-diidroxiespirost-5-en-26-ona 3-O-{α-L-ramnopiranosil-(1→2)-[α-L-ramnopiranosil-(1→4)]-β-D-glicopiranosídeo}. Dados de RMN de 1H e 13C também estão dispostos na Tabela 1 e os espectros no Material Suplementar (Figuras 19S-27S).
CONCLUSÕES O estudo fitoquímico do extrato hidroalcoólico das folhas de S. jabrense levou ao isolamento e identificação de uma saponina e um alcaloide esteroidal previamente conhecidos, solamargine (1) e foliumin A (2), juntamente com a nova saponina (22S,23R,25R)-3β,23-diidroxiespirost-5-en-26-ona 3-O-{α-L-ramnopiranosil-(1→2)-[α-L-ramnopiranosil-(1→4)]-β-D-glicopiranosídeo}. Este é o primeiro registro da substância 3 e a primeira vez que as estruturas aqui apresentadas estão sendo documentadas para a espécie.
PARTE EXPERIMENTAL Métodos espectroscópicos e espectrométricos Os espectros de ressonância magnética nuclear de 1H e 13C uni e bidimensionais foram obtidos em espectrômetros Bruker® Ascend, operando a 400 MHz (1H) e 100 MHz (13C), e 500 MHz (1H) e 125 MHz (13C). As amostras para as análises foram solubilizadas em solvente deuterado (CD3OD) e referenciadas pelo sinal do solvente (dH 3,30 ppm e δC 49 ppm). Os espectros de massas das substâncias foram obtidos por injeção direta em modo de ionização positivo pela técnica de ionização por eletrospray (ESI), utilizando um espectrômetro de massas de alta resolução Bruker, micrOTOF II. As rotações específicas das substâncias foram realizadas no polarímetro JASCO, modelo polarimeter, série P-200, com a temperatura do ambiente estabelecida em 21,68 ºC. Os espectros de infravermelho foram adquiridos em espectrofotômetro de infravermelho com transformada de Fourier com refletância total atenuada (ATR-FTIR), IRSpirit-X, Shimadzu. Para as aquisições 1 mg de cada amostra foi solubilizada em 200 µL de metanol grau CLAE (cromatografia líquida de alta eficiência). Procedimentos experimentais gerais As análises de cromatografia líquida de alta eficiência com detector de arranjo de diodos (CLAE-DAD) em escala analítica foram realizadas em um cromatógrafo líquido Shimadzu (Prominence) equipado com módulo de bombeamento de solvente binário LC-20AT, autoinjetor SIL-20A, um sistema de degaseificação DGU-20A, detector SPD-M20A diode array e CBM-20A como unidade controladora. A coluna utilizada foi Kromasil, Bohus, Sweden C18 (250 mm × 4,6 mm diâmetro interno, preenchido com partículas 5 µm), com pré-coluna SecurityGuard Gemini® C18 (4 mm × 3 mm diâmetro interno, preenchido com partículas 5 µm). As análises de CLAE preparativa foram realizadas em um sistema da Shimadzu equipado com módulo de bombeamento de solvente binário LC-6AD, injetor Rheodyne, detector SPD-M10A diode array e SCL-10A. A fase estacionária consistiu em coluna preparada com octadesilsilano (ACE C18 250 mm × 21,2 mm e 5 μm de tamanho de partícula) e a fase móvel, acetonitrila (solvente A) e água ultrapura acidificada com ácido fórmico 0,1% grau CLAE (solvente B). Os espectros de EMAR foram obtidos utilizando um sistema de cromatografia líquida de alta eficiência Shimadzu® (Kyoto, Japão), acoplado a um micrOTOF II (Bruker Daltonics, Billerica, MA, EUA), equipado com uma fonte de ionização por electrospray (ESI). O sistema CLAE era constituído por uma unidade de bomba de solvente (LC-20AD), um degaseificador on-line (DGU-20A5), um controlador de sistema (CBM-20A) e um detector de arranjo de diodos (DAD) (SPD-M20A) operando de 190 a 800 nm. As injeções foram realizadas utilizando um amostrador automático (SIL-20A) e sistema de eluição constituído por água ultrapura com 0,1% de ácido fórmico (solvente A) e acetonitrila (solvente B). Uma solução de formiato de sódio (NaCOOH) foi utilizada como calibrante (10 mM) e os parâmetros de análise foram: tensão capilar de 4,5 kV, ESI em modo positivo, deslocamento final da placa a 500 V, pressão do nebulizador a 4,0 bar, fluxo de gás seco (N2) de 8 mL min-1 e temperatura de 200 ºC. Os espectros foram registados em uma faixa de massa de m/z 50-1500. Material vegetal O material botânico (partes aéreas) foi coletado na cidade de Maturéia, Paraíba, Brasil, e identificados pela Profa. Dra. Maria de Fátima Agra. Parte do material foi destinado a produção de uma exsicata que foi depositada no Herbário Lauro Pires Xavier (JPB 42267), localizado na Universidade Federal da Paraíba (UFPB), e o acesso ao patrimônio genético registrado no Sistema Nacional de Gestão do Patrimônio Genético e do Conhecimento Tradicional Associado (SisGen) sob o No. A2B19D6. O material fresco coletado foi seco em estufa (cerca de 45 ºC) por 5 dias, e pulverizado para obtenção do pó (465 g). Extração e obtenção do extrato bruto e da fração rica em alcaloides Aproximadamente 500 g do pó da planta seca foram extraídos com 80% de CH3OH (80:20, CH3OH:H2O v/v) em banho ultrassônico por 1 h à temperatura ambiente (~ 25 ºC). Esse procedimento de extração foi repetido por duas vezes. O sobrenadante, líquido extrativo (4 L), foi concentrado em evaporador rotativo sob vácuo a cerca de 40 ºC, e assim obtido o extrato bruto seco (108 g). Para obtenção do precipitado, fração rica em alcaloides, 30 g do extrato bruto hidroalcoólico foi solubilizado em água ultrapura deionizada e alcalinizado com hidróxido de amônio, até atingir o pH 9, aproximadamente. Essa mistura foi submetida a refrigeração em geladeira, onde permaneceu por 24 h. Após esse período, obteve-se um precipitado que foi separado por filtração sob vácuo. O precipitado foi ressuspendido em água ultrapura deionizada, neutralizado com ácido acético, e refrigerado por 24 h. Esse processo foi repetido por três vezes e por fim centrifugado. Isolamento dos constituintes químicos A fração rica em alcaloides (precipitado, 2,40 g) foi submetida a fracionamento em coluna de Sephadex LH-20 (Sigma-Aldrich, Merck) e metanol 100% (CH3OH) como eluente, obtendo-se 21 frações que foram analisadas por CLAE-DAD em escala analítica e reunidas quando conveniente. Das frações 4-5 analisadas e reunidas foi obtido o composto codificado como 1 (37,1 mg). O extrato bruto concentrado (35 g) foi suspenso em H2O (1 L) e particionado sucessivamente com os solventes hexano (n-hex), clorofórmio (CHCl3), acetato de etila (EtOAc) e n-butanol (n-but). A fase n-butanol (3,96 g) foi submetida à cromatografia em coluna, utilizando sílica gel como fase estacionária (0,063-0,200 mm, 60 F254, Merck), e hexano (n-hex/EtOAc 10:0 a 0:10), acetato de etila (EtOAc/CH3OH 9:1 a 3:6) e metanol (CH3OH/EtOAc 3:6 a 10:0) como fase móvel, obtendo-se 35 frações e estas foram analisadas por CLAE-DAD analítico. As frações 11 (102,1 mg) e 12 (720,2 mg) obtidas da fase n-butanol foram submetidas à cromatografia por exclusão, utilizando coluna de Sephadex LH-20 (Sigma-Aldrich, Merck) e metanol 100% (CH3OH) como eluente, obtendo-se 14 e 16 frações, respectivamente. A fração 7 (92,9 mg) obtida do fracionamento da fração 12 foi analisada por CLAE-DAD analítico e submetida a análises de CLAE-DAD preparativa obtendo-se assim a substância codificada como 2 (6,5 mg). A fração 2 obtida do fracionamento da fração 11 em Sephadex foi analisada por CLAE-DAD em escala analítica e observada a presença da substância codificada como 3 (7,73 mg). Solamargina (1)23 Pó branco; [a]D21 -58,071 (c 0.1, CH3OH); IV (ATR-FTIR) νmáx / cm-1 3371, 1651, 2938, 1045; EMAR modo positivo m/z 868,5053 [M + H]+ (calcd. para 868,5021, Δ = 3,7 ppm); 1H RMN (400 MHz, CD3OD) δH 1,09 (1H, s, C-1), 1,91 (1H, m, C-1), 1,71 (1H, m, C-2), 1,93 (1H, m, C-2), 3,53 (1H, m, C-3), 2,45 (1H, m, C-4), 2,30 (1H, m, C-4), 5,38 (1H, br s, C-6), 1,41 (1H, m, C-7), 2,00 (1H, m, C-7), 1,71 (1H, m, C-8), 0,98 (1H, br s, C-9), 1,56 (1H, m, C-11), 1,81 (1H, m, C-12), 1,22 (1H, m, C-12), 1,23 (1H, s, C-14), 1,72 (1H, m, C-15), 1,49 (1H, m, C-15), 4,57 (1H, br s, C-16), 1,90 (1H, m, C-17), 0,85 (3H, s, C-18), 1,05 (3H, s, C-19), 2,31 (1H, m, C-20), 1,13 (3H, s, C-21), 1,96 (1H, m, C-23), 1,51 (1H, m, C-23), 1,91 (1H, m, C-24), 1,60 (1H, m, C-24), 1,85 (1H, m, C-25), 2,36 (1H, m, C-26), 0,93 (3H, d, C-27), glucose 4,49 (1H, d, C-1'), 3,41 (1H, m, C-2'), 3,60 (1H, m, C-3'), 3,33 (1H, m, C-4'), 3,60 (1H, m, C-5'), 3,66 (2H, m, C-6'), ramnose 4,85 (1H, d, C-1''), 3,92 (1H, m, C-2''), 3,61 (1H, m, C-3''), 3,43 (1H, m, C-4''), 3,94 (1H, m, C-5''), 1,26 (3H, s, C-6''), ramnose 5,20 (1H, d, C-1'''), 3,94 (1H, m, C-2'''), 3,85 (1H, m, C-3'''), 3,42 (1H, m, C-4'''), 4,12 (1H, m, C-5'''), 1,25 (3H, d, C-6'''); 13C RMN (400 MHz, CD3OD) δC 38,50 (C-1), 30,69 (C-2), 79,94 (C-3), 39,45 (C-4), 141,93 (C-5), 122,44 (C-6), 33,04 (C-7), 32,75 (C-8), 51,53 (C-9), 37,99 (C-10), 21,87 (C-11), 40,40 (C-12), 42,08 (C-13), 57,62 (C-14), 28,87 (C-15), 84,28 (C-16), 63,05 (C-17), 16,53 (C-18), 19,81 (C-19), 42,78 (C-20), 14,82 (C-21), 100,04 (C-22), 33,08 (C-23), 30,69 (C-24), 29,48 (C-25), 46,79 (C-26), 18,75 (C-27), 100,44 (C-1'), 79,38 (C-2'), 77,96 (C-3'), 76,57 (C-4'), 79,28 (C-5'), 61,95 (C-6'), 102,95 (C-1''), 72,17 (C-2''), 72,37 (C-3"), 73,71 (C-4"), 70,65 (C-5"), 17,86 (C-6''), 102,32 (C-1'''), 72,40 (C-2'''), 72,36 (C-3'''), 73,90 (C-4'''), 69,78 (C-5'''), 17,97 (C-6'''). (22S,23R,25R)-3β,15α,23-Triidroxiespirost-5-en-26-ona 3-O-{α-L-ramnopiranosil-(1→2)-[α-L-ramnopiranosil-(1→4)]-β-D-glicopiranosídeo} (2)24 Sólido incolor; [a]D21 -86,557 (c 0,1, CH3OH); IV (ATR-FTIR) νmáx / cm-1 3392, 1757, 2932, 1042; EMAR modo positivo m/z 915,4584 [M + H]+ (calcd. C45H71O19); 1H RMN (400 MHz, CD3OD) δH 1,05 (1H, s, C-1) ,1,88 (1H, m, C-1), 1,60 (1H, m, C-2), 1,90 (1H, m, C-2), 3,39 (1H, m, C-3), 2,42 (1H, m, C-4), 2,28 (1H, m, C-4), 5,36 (1H, br s, C-6), 2,73 (1H, m, C-7), 1,90 (1H, m, C-7), 1,82 (1H, m, C-8), 1,01 (1H, d, C-9), 1,53 (2H, m, C-11), 1,26 (1H, s, C-12), 1,71 (1H, m, C-12), 1,23 (1H, s, C-14), 3,82 (1H, m, C-15), 4,34 (1H, dd, C-16), 1,91 (1H, m, C-17), 0,83 (3H, s, C-18), 1,05 (3H, s, C-19), 2,46 (1H, m, C-20), 1,02 (3H, d, C-21), 4,38 (1H, dd, C-23), 2,72 (1H, m, C-24), 1,91 (1H, m, C-24), 2,90 (1H, m, C-25), 1,19 (3H, d, C-27), glucose 4,49 (1H, d, C-1'), 3,51 (1H, m, C-2'), 3,58 (1H, m, C-3'), 3,41 (1H, m, C-4'), 3,60 (1H, m, C-5'), 3,65 (1H, m, C-6'), 3,89 (1H, m, C-6'), ramnose 4,84 (1H, d, C-1''), 3,91 (1H, m, C-2''), 3,60 (1H, m, C-3''), 3,40 (1H, m, C-4''), 3,92 (1H, m, C-5''), 1,28 (3H, s, C-6''), ramnose 5,20 (1H, d, C-1'''), 3,83(1H, m, C-2'''), 3,65 (1H, m, C-3'''), 3,39 (1H, m, C-4'''), 4,13(1H, m, C-5'''), 1,25 (3H, d, C-6'''); 13C RMN (400 MHz, CD3OD) δC 38,70 (C-1), 30,76 (C-2), 79,31 (C-3), 39,41 (C-4), 141,13 (C-5), 123,12 (C-6), 31,48 (C-7), 33,02 (C-8), 51,53 (C-9), 37,93 (C-10), 21,71 (C-11), 41,47 (C-12), 41,81 (C-13), 61,19 (C-14), 80,46 (C-15), 91,64 (C-16), 60,55 (C-17), 17,92 (C-18), 19,80 (C-19), 41,83 (C-20), 15,12 (C-21), 110,54 (C-22), 78,68 (C-23), 31,48 (C-24), 35,12 (C-25), 183,24 (C-26), 16,30 (C-27), 100,42 (C-1'), 80,01 (C-2'), 78,06 (C-3'), 79,27 (C-4'), 78,68 (C-5'), 61,90 (C-6'), 103,01 (C-1''), 72,19 (C-2''), 72,19 (C-3''), 73,74 (C-4''), 70,68 (C-5''), 17,86 (C-6''), 102,03 (C-1'''), 72,45 (C-2'''), 72,37 (C-3'''), 73,94 (C-4'''), 69,79 (C-5'''), 17,97 (C-6'''). (22S,23R,25R)-3β,23-Diidroxiespirost-5-en-26-ona 3-O-{α-L-ramnopiranosil-(1→2)-[α-L-ramnopiranosil-(1→4)]-β-D-glicopiranosídeo} (3) Sólido incolor; [a]D21 -113,414 (c 0,1, CH3OH); IV (ATR-FTIR) νmáx / cm-1 3371, 1757, 1378, 1453, 2932, 1033; EMAR modo positivo m/z 921,4479 [M + Na]+ (calcd. para 921,4422, Δ = 2,6 ppm); 1H RMN (400 MHz, CD3OD) δH 1,06 (1H, m, C-1), 1,86 (1H, m, C-1), 1,60 (1H, m, C-2), 1,91 (1H, m, C-2), 3,51 (1H, m, C-3), 2,44 (1H, m, C-4), 2,29 (1H, m, C-4), 5,37 (1H, br s, C-6), 2,70 (1H, m, C-7), 1,94 (1H, m, C-7), 1,64 (1H, m, C-8), 0,96 (1H, d, C-9), 1,52 (1H, m, C-11), 1,20 (1H, s, C-12), 1,78 (1H, m, C-12), 1,23 (1H, s, C-14), 1,96 (1H, m, C-15), 1,52 (1H, m, C-15), 4,58 (1H, m, C-16), 1,79 (1H, m, C-17), 0,81 (3H, s, C-18), 1,04 (3H, s, C-19), 2,47 (1H, s, C-20), 1,02 (3H, d, C-21), 4,38 (1H, dd, C-23), 2,70 (1H, m, C-24), 1,59 (1H, m, C-24), 2,82 (1H, m, C-25), 1,19 (3H, d, C-27), glucose 4,49 (1H, d, C-1'), 3,40 (1H, m, C-2'), 3,58 (1H, m, C-3'), 3,32 (1H, m, C-4'), 3,58 (1H, m, C-5'), 3,65 (1H, m, C-6'), 3,80 (1H, m, C-6'), ramnose 4,84 (1H, m, C-1''), 3,92 (1H, m, C-2''), 3,66 (1H, m, C-3''), 3,39 (1H, m, C-4''), 3,92 (1H, m, C-5''), 1,28 (3H, s, C-6''), ramnose 5,20 (1H, d, C-1'''), 3,88 (1H, m, C-2"'), 3,65 (1H, m, C-3'''), 3,39 (1H, m, C-4'''), 4,12 (1H, m, C-5'''), 1,26 (3H, d, C-6'''); 13C RMN (400 MHz, CD3OD) δC 38,06 (C-1), 30,75 (C-2), 79,98 (C-3), 39,48 (C-4), 141,90 (C-5), 122,62 (C-6), 31,50 (C-7), 32,68 (C-8), 51,72 (C-9), 37,82 (C-10), 21,91 (C-11), 40,98 (C-12), 42,06 (C-13), 57,68 (C-14), 32,68 (C-15), 83,15 (C-16), 63,40 (C-17), 16,37 (C-19), 19,83 (C-19), 37,80 (C-20), 15,19 (C-21), 110,45 (C-22), 78,83 (C-23), 31,48 (C-24), 35,15 (C-25), 183,24 (C-26), 16,38 (C-27), 100,48 (C-1'), 79,30 (C-2'), 78,05 (C-3'), 76,57 (C-4'), 78,84 (C-5'), 61,95 (C-6'), 103,01 (C-1''), 72,19 (C-2"), 72,19 (C-3''), 73,74 (C-4"), 69,78 (C-5"), 17,86 (C-6"), 102,31 (C-1"'), 72,44 (C-2'''), 72,36 (C-3'''), 73,94 (C-4'''), 69,81 (C-5'''), 17,98 (C-6''').
MATERIAL SUPLEMENTAR O material suplementar desse trabalho (espectros 1D e 2D de ressonância magnética nuclear (RMN), infravermelho (ATR-FTIR) e de espectrometria de massas de alta resolução (EMAR) para os compostos 1-3) está disponível em http://quimicanova.sbq.org.br/, na forma de arquivo PDF, com acesso livre.
DECLARAÇÃO DE DISPONIBILIDADE DE DADOS Dados deste estudo estão disponíveis em https://drive.google.com/drive/folders/1qSIJ5dYaAwz1ymbS9vmAkEjjuptjoNmM?usp=drive_link.
AGRADECIMENTOS Agradecemos ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelas bolsas concedidas ao Prof. Josean F. Tavares, Marcelo S. da Silva e ao aluno Thiago A. M. Brito. Projeto INCT-RENNOFITO 465536/2014-0 e Projeto Universal 403382/2023-8, e a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela bolsa de doutorado (código 001) concedida à aluna Anauara Lima e Silva.
REFERÊNCIAS 1. Hilgenhof, R.; Gagnon, E.; Knapp, S.; Aubriot, X.; Tepe, E. J.; Bohs, L.; Giacomin, L. L.; Gouvêa, Y. F.; Martine, C. T.; Orejuela, A.; Orozco, C. I.; Peralta, I. E.; Särkinen, T.; Taxon 2023, 72, 811. [Crossref] 2. Panda, T.; Mishra, N.; Rahimuddin, S.; Pradhan, B. K.; Apollo, M.; Mohanty, R. B.; Majalah Obat Tradisional 2024, 29, 344. [Crossref] 3. Manoharan, R.; Nair, C. S.; Eissa, N.; Cheng, H.; Ge, P.; Ren, M.; Jaleel, A.; Drug Des., Dev. Ther. 2024, 18, 3063. [Crossref] 4. Liu, Y.; Ma, G. Q.; Wu, J. T.; Zhang, Y. Q.; Xu, Z. P.; Naseem, A.; Kuang, H. X.; Yang, B. Y.; Nat. Prod. Res. 2024, 1. [Crossref] 5. Wanyonyi, A. W.; Chhabra, S. C.; Mkoji, G.; Njue, W.; Tarus, P. K.; Fitoterapia 2003, 74, 298. [Crossref] 6. Zhou, Y.; Deng, Z. S.; Cheng, F.; Dong, W. J.; Guo, Z. Y.; Wang, J. Z.; Zou, K.; Chem. Nat. Compd. 2016, 52, 920. [Crossref] 7. Pinto, F. D. C. L.; Uchoa, D. E. D. A.; Silveira, E. R.; Pessoa, O. D. L.; Braz-Filho, R.; Silva, F. M.; Theodoro, P. N. E. T.; Espíndola, L. S.; Quim. Nova 2011, 34, 284. [Crossref] 8. Sitapha, O.; Elisée, K. K.; Mathieu, K. A. K.; Desire, A. F. H.; Francis, Y. A.; Joseph, D. A. A.; Eur. J. Med. Plants 2024, 35, 26. [Crossref] 9. Silva, L. D. O.; Rosado, C. P.; Samary, M.; Cruz, M. A. D. A. S.; Montenegro, J.; Silva, G. R. P.; Nunes, J. C.; Int. J. Food Sci. Technol. 2024, 59, 6267. [Crossref] 10. Kadima, J. N.; Kasali, F. M.; Bavhure, B.; Mahano, A. O.; Bwironde, F. M.; Int. J. Pharm. Pharm. Res. 2016, 5, 196. [Link] acessado em maio 2025 11. Silva, E. L.; Almeida-Lafetá, R. C.; Borges, R. M.; Staerk, D.; Fitoterapia 2017, 118, 42. [Crossref] 12. Núñez-Mojica, G.; Rivas-Galindo, V. M.; Garza-González, E.; Miranda, L. D.; Romo-Pérez, A.; Pagniez, F.; Picot, C.; Le Pape, P.; Bazin, M. A.; Marchand, P.; Camacho-Corona, M. D. R.; Med. Chem. Res. 2021, 30, 152. [Crossref] 13. Kaunda, J. S.; Zhang, Y. J.; Nat. Prod. Bioprospect. 2019, 9, 77. [Crossref] 14. Winkiel, M. J.; Chowański, S.; Słocińska, M.; Front. Pharmacol. 2022, 13, 979451. [Crossref] 15. Agra, M. F.; Nee, M.; Brittonia 1997, 49, 350. [Crossref] 16. Flora e Funga do Brasil, Solanum, https://floradobrasil.jbrj.gov.br/FB14716, acessado em junho 2025. 17. Cavalcante, F. A.; da Silva, J. L. V.; Medeiros, A. F. D.; Sousa, F. C.; J. Med. Plants Res. 2013, 7, 772. [Crossref] 18. Silva, T. M. S.; Câmara, C. A.; Agra, M. F.; Carvalho, M. G.; Frana, M. T.; Brandoline, S. V. P. B.; Paschoal, L. S.; Braz-Filho, R.; Fitoterapia 2006, 77, 449. [Crossref] 19. Puri, R.; Wong, T. C.; Puri, R. K.; Magn. Reson. Chem. 1993, 31, 278. [Crossref] 20. El‐Hawary, S. S.; Mohammed, R.; AbouZid, S. F.; Bakeer, W.; Ebel, R.; Sayed, A. M.; Rateb, M. E.; J. Appl. Microbiol. 2016, 120, 900. [Crossref] 21. Ferreira, F.; Vazquez, A.; Moyna, P.; Kenne, L.; Phytochemistry 1994, 36, 1473. [Crossref] 22. Xiang, M. L.; Hu, B. Y.; Qi, Z. H.; Wang, X. N.; Xie, T. Z.; Wang, Z. J.; Ma, D. Y.; Zheng, Q.; Luo, X. D.; Nat. Prod. Bioprospect. 2022, 12, 23. [Crossref] 23. Cornelius, M. T.; Carvalho, M. G. D.; Silva, T.; Alves, C. C.; Siston, A. P.; Alves, K. Z.; Sant'Anna, C. M. R.; Neto, M. B.; Eberlin, M. N.; Braz-Filho, R.; J. Braz. Chem. Soc. 2010, 21, 2211. [Crossref] 24. Vázquez, A.; Ferreira, F.; Moyna, P.; Kenne, L.; Phytochem. Anal. 1999, 10, 194. [Crossref]
Editor Convidado responsável pelo artigo: Lucas S. Abreu |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access