Revisão
|
|
| Organismos marinhos como fonte de novos fármacos: 15 anos e uma pandemia depois Marine natural product as a source of new drugs: 15 years and one pandemic later |
|
Mateus F. BritoI; Thayssa S. F. FagundesII,III; Paula C. JimenezIV; Alessandra L. ValverdeI,* I. Instituto de Química, Universidade Federal Fluminense, 24020-150 Niterói - RJ, Brasil Recebido: 24/11/2024 *e-mail: alessandravalverde@id.uff.br Marine natural products have proven to be a source of inspiration for the pharmaceutical industry in the production of innovative and highly effective drugs. Building upon a 2009 publication, this article presents a review that encompasses the advancements of commercially available drugs and those in clinical trial phases, providing an overview of the progress and developments observed in these marine-derived drug candidates over the past years. By examining the progress since the initial review, this article aims to provide insights into the current status and potential applications of marine natural products as therapeutic agents. Of the eleven active principles in different phases of clinical trials in 2009, only three have progressed to approval. Derivatives of dolastatins stand out using antibody-drugs conjugate (ADC) technology, which has led to the approval of six other drugs originating from marine-derived molecules. Despite the challenges encountered until the approval of these drugs, many marine-derived molecules are still under clinical study, and researchers and healthcare professionals believe that much remains to be discovered. INTRODUÇÃO Com o passar do tempo, fica cada vez mais evidente o grande potencial bioativo que os produtos naturais apresentam, mediante a crescente publicação de artigos nessa área. Dentre esses trabalhos, encontra-se uma gama de artigos de revisão que aborda, como tema, o protagonismo dos produtos naturais com atividades biológicas utilizados como fármacos para o tratamento de diversas enfermidades, sendo essa, tradicionalmente, uma das principais aplicações desde a antiguidade.1-3 Segundo Cragg e Newman,4 na Mesopotâmia, cerca de 2600 a.C., foram gravados em uma tabuleta de argila os primeiros usos de produtos naturais, como foi o caso óleo extraído de algumas espécies da mirra (Commiphora sp.) que eram utilizados no tratamento de tosses, resfriados e inflamações. Embora o ecossistema terrestre seja vasto e amplamente estudado por esta perspectiva, o ecossistema marinho pode ser considerado como uma fonte promissora de produtos naturais bioativos.5 Ao estudar o ecossistema marinho, é necessário ter em mente que se trata de um ambiente onde a competição é muito elevada, seja por espaço, atividade predatória ou outras características oriundas da ecologia química, além de considerar a variabilidade das condições abióticas que ali incidem, como salinidade, pH, pressão e radiação. Tais aspectos proporcionam aos organismos que ali habitam a produção de moléculas bioativas potentes, e dotadas de características químicas e farmacológicas distintas daquelas tipicamente obtidas de organismos do meio terrestre. Contexto e objetivos da revisão de 2009 Em 2009, o trabalho publicado por Costa-Lotufo et al.6 relatava os desafios que os pesquisadores precisavam transpor na área de produtos naturais marinhos e a alta toxicidade das substâncias bioativas como uma adversidade destacada. Isso devido ao fato dos metabólitos secundários que são produzidos pelos organismos marinhos poderem desempenhar funções de proteção química contra atividade predatória ou contra patógenos, apresentando um potencial inimaginável. Entretanto, como uma espada de dois gumes, essa elevada toxicidade torna-se um empecilho ao testar essas substâncias em células humanas. Unindo-se esse fator com o longo tempo consumido durante a pesquisa e o desenvolvimento de um novo fármaco, algo em torno de 15 anos, é possível explicar a baixa quantidade de fármacos disponíveis no mercado que se originam desse tipo de matriz. Além disso, outros fatores que tornam essa linha de pesquisa ainda mais desafiadora são o baixo rendimento, possibilidade de simbiose, pouca matriz disponível e a alta complexidade molecular. Contudo, apesar dos inúmeros desafios, o uso de produtos naturais marinhos como potenciais fármacos já era uma realidade. Dessa maneira, a revisão feita por Costa-Lotufo et al.6 em 2009 tinha o objetivo de destacar os fármacos já aprovados de origem marinha e relatar as atípicas substâncias químicas oriundas do mar que estavam em testes clínicos naquele momento. Cenário atual e objetivos desta revisão A revisão elaborada por Carroll et al.,7 descreve 1417 novas substâncias que foram isoladas de organismos marinhos, provenientes do report de 384 artigos científicos no decorrer do ano de 2022. Também foi efetuada uma comparação entre as matrizes que deram origem às substâncias isoladas entre os anos de 2018 e 2022. Os autores destacaram um aumento significativo de novas substâncias isoladas a partir de fungos, chegando a ultrapassar a faixa de 500 unidades em 2022. As bactérias, esponjas e cnidários também seguem como matrizes de interesse para obtenção de novas substâncias, ultrapassando 200 novas moléculas por ano. Considerando-se que os mares e oceanos ocupam 2/3 da superfície terrestre, esse ecossistema, de fato, é possuidor de uma vasta biodiversidade, apresentando um gigantesco potencial biotecnológico na área de produtos naturais.6 Em virtude desses fatores, o objetivo deste trabalho é averiguar como se deu o avanço das substâncias que estavam em testes clínicos no ano de 2009, além de compilar informações sobre novos fármacos aprovados e descrever as substâncias em fase de testes clínicos atualmente.
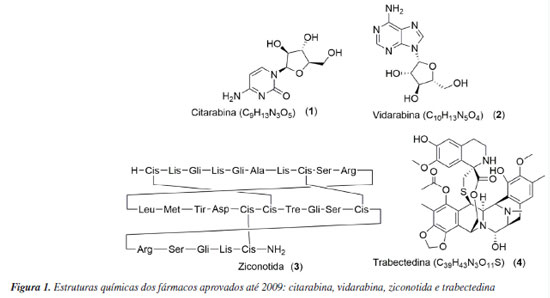
BREVE RESGATE DOS FÁRMACOS JÁ APROVADOS ATÉ 2009 Costa-Lotufo et al.6 trouxeram um levantamento dos fármacos de origem marinha até 2009. Naquele momento, existiam apenas 4 fármacos aprovados pelos órgãos reguladores, sendo eles: citarabina (Ara C, 1), vidarabina (Ara A, 2), ziconotida (3) e trabectedina (4), representados na Figura 1.
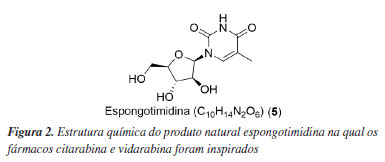
Ara C foi o primeiro fármaco de origem marinha a ser aprovado pelo FDA (Food and Drug Administration). Tal fato histórico aconteceu em 1969, que culminou na comercialização do Cytosar-U® para o tratamento da leucemia.8 De forma semelhante, a Ara A foi aprovada pelo FDA, no ano de 1976 com a finalidade de combater o vírus da Herpes simplex.9 Tanto a citarabina (1) quanto a vidarabina (2) são derivados sintéticos do nucleosídeo espongotimidina (5) (Figura 2), isolados da esponja marinha Tectitethya crypta (Cryptotethya crypta).6
O fármaco ziconotida (3), também conhecido com o nome comercial de Prialt®, é uma toxina peptídica com propriedades analgésicas que foi isolada do molusco Conus magnus na década de 80. Foi aprovado em 2004 pelo FDA e é usado no tratamento de dores crônicas.10 Trabectedina (4), princípio ativo do Yondelis®, foi isolada do tunicado marinho, Ecteinascidia turbinata. O fármaco possui indicação no tratamento de sarcoma de tecido mole, após falha das antraciclinas, e para o câncer de ovário, quando administrada com a doxorrubicina.11 No ano de 2007, passou a ser comercializado na Europa em condições específicas devido a informações limitadas a respeito do princípio ativo.12 Em 2015, foi completamente aceito pela EMA (European Medicines Agency) e pelo FDA.13,14
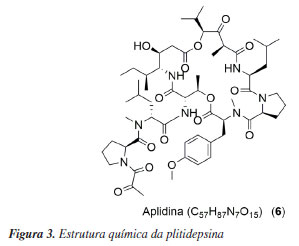
PRINCÍPIOS ATIVOS APRESENTADOS NA REVISÃO DE 2009 QUE CONTINUARAM A SER INVESTIGADOS ATÉ A APROVAÇÃO No levantamento realizado até a publicação em 2009, para a revisão de Costa-Lotufo et al.,6 11 principíos ativos e 1 extrato tinham sido avaliados e estavam em fase de testes clínicos. Os autores também descreveram o mecanismo de ação, estrutura e classe das substâncias. Em um artigo de revisão mais recente, Jimenez et al.15 reportaram os avanços científicos e o potencial de inovação tecnológica associados ao desenvolvimento de um novo medicamento a partir de recursos marinhos. Contudo, essa revisão tinha como o escopo principal o uso de produtos naturais marinhos no tratamento do câncer. O presente trabalho visa à atualização do panorama de 2009 e também será exposto o status atual das substâncias, além de novos estudos em andamento ou já concluídos. Também são abordados os fármacos de origem marinha que já estão disponiveis no mercado, independente da atividade biológica. Plitidepsina Aplidin®, cujo princípio ativo é a plitidepsina (6) (Figura 3), é um fármaco desenvolvido pela PharmaMar que foi aprovado em dezembro de 2018 na Austrália, para o tratamento do mieloma múltiplo. Após o estudo inicial, fase I dos testes clínicos, foi recomendado em 1998, para o tratamento de tumores sólidos,16 demonstrando a jornada da produção até a aprovação de um fármaco. Outros novos estudos de testes clínicos foram concluídos e englobou a fase II para mielofibrose, câncer de próstata, leucemia e liposarcoma. Já na fase III, estudo recente que ocorreu em 2023, envolve o uso da plitidepsina no tratamento da doença causada pelo coronavírus (COVID-19) (NCT04784559).17
Derivados de dolastatinas Dolastatina 10 (7) e dolastatina 15 (8) (Figura 4) são peptídeos que foram isolados inicialmente do molusco Dolabella auricularia. Entretanto, em estudos posteriores,18 verificou-se que, na realidade, as cianobactérias Symploca hydnoides e Lyngbya majuscula são as responsáveis pela síntese da dolastatina 10, uma vez que elas fazem parte da alimentação do molusco.
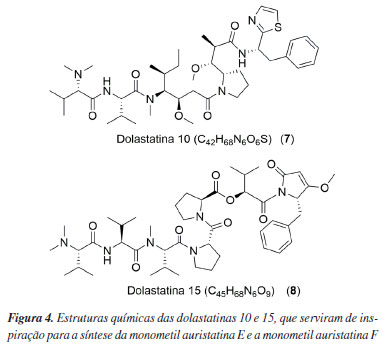
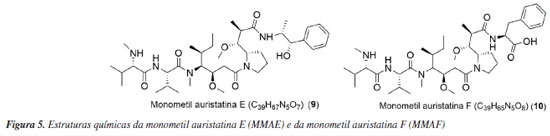
Inicialmente, a dolastatina 10 foi testada isoladamente para atividade antitumoral, pois o mecanismo de ação dessa substância envolve a indução do bloqueio da polimerização da tubulina, impedindo a multiplicação celular.19 Com os resultados obtidos, a dolastatina 10 chegou a alcançar a fase II dos testes clínicos em pacientes que apresentavam sarcoma de tecido mole. Porém, devido aos efeitos adversos, sendo a neuropatia periférica a causa mais comum, os testes foram descontinuados.20 Mesmo com esse resultado, os olhos dos cientistas permanecem sempre atentos a oportunidades que possibilitem transformações e inovações para o nosso mundo. Tal fato é aplicado à monometil auristatina E (MMAE ou vedotina, 9) e a monometil auristatina F (MMAF, 10) (Figura 5). Ambos são derivados sintéticos da dolastatina 10 (7), a qual possui papel fundamental na elaboração dos fármacos já aprovados Adcetris® (11), PolivyTM (12), PADCEVTM (13), TIVDAK® (14) e AidixiTM (15), que utilizam a tecnologia antibody-drugs conjugate (ADC). A substância MMAE apresenta maior capacidade de ultrapassar a membrana celular se comparado ao MMAF devido à ausência do ácido carboxílico no carbono terminal. Em contrapartida, a MMAE é mais tóxica, além de apresentar maior tendência de agregação.21
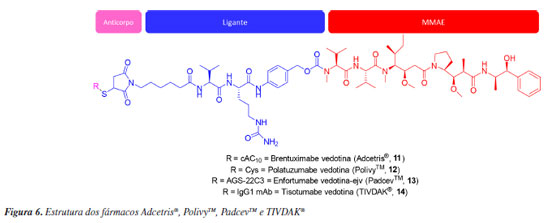
Fármacos imunoconjugados ou, do inglês, antibody-drugs conjugate (ADC), são estruturas projetadas com o propósito de transportar pequenas moléculas citotóxicas a células tumorais. Medicamentos que apresentam essa tecnologia são compostos por três partes: um anticorpo, um ligante e um princípio ativo. O anticorpo presente nos ADCs reconhece antígenos específicos expressos, tipicamente em maiores proporções, na membrana de células tumorais. A partir desse reconhecimento, o antígeno presente na célula tumoral transporta o ADC para o interior celular, onde o agente citotóxico é clivado. Após esse processo, o princípio ativo é liberado para exercer sua ação na célula tumoral. Essa é uma forma de aumentar a seletividade do fármaco à célula tumoral, direcionando a entrega do agente citotóxico. Como característica geral, é necessário selecionar com sabedoria todos os componentes do ADC para que o fármaco seja eficaz e os parâmetros de segurança sejam próximos da idealidade.22 Os quatro fármacos em questão (11-14) possuem apenas o anticorpo como diferença estrutural (Figura 6), mas devido a especificidade do anticorpo em reconhecer o antígeno, cada ADC é utilizado para o tratamento de um tipo ou de um pequeno grupo de cânceres que compartilhem a mesma característica, revelado na expressão do antígeno na membrana celular.
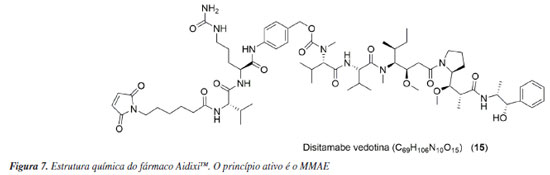
Adcetris® (11) Produzido pela companhia Seagen em parceria com a Takeda, a brentuximabe vedotina (11), princípio ativo do Adcetris®, age na proteina CD30, sendo aplicado com a finalidade de tratar pacientes com linfoma de Hodgkin e linfoma anaplásico de grandes células.23 Em 2011, foi aprovada antecipadamente pelo mesmo órgão pois o fármaco atingiu a eficácia de 86% no tratamento do linfoma anasplásico e de 75% no tratamento do linfoma de Hodgkin enquanto ainda estava em fase II dos testes clínicos.24 No momento da escrita desse artigo, Adcetris® possui 8 aprovações de indicações pelo FDA.25 PolivyTM (12) Aprovado de forma condicional pelo FDA em 2019 devido à elevada taxa de resposta do fármaco, PolivyTM é um medicamento produzido pela Genentech, do grupo Roche.26 Outros testes clínicos ainda estão em andamento e necessitam ser reportados ao FDA a fim de se verificar os benefícios e efeitos colaterais.27 Polatuzumabe vedotina (12), que é o princípio ativo do PolivyTM, provoca a morte celular por apoptose através da atuação na proteina CD76b. O uso é indicado para pacientes com linfoma difuso de grandes células B recidivado ou refratário.28 PADCEVTM (13) Usado no tratamento do câncer urotelial metástico, o PADCEVTM, cujo princípio ativo é o enfortumabe vedotina-ejv, foi desenvolvido pela empresa Seagen em parceria com a Astellas Pharma. O fármaco está em desenvolvimento e a sua segurança e eficiência ainda não foram determinadas por completo. Mesmo com essas limitações, o fármaco foi aprovado pelo FDA em 2019.29,30 Um dos efeitos colaterais do fármaco é a toxicidade cutânea, na qual 45% dos pacientes apresentaram esse sintoma durante a fase I dos testes clínicos. Porém, estudos realizados por Hirotsu et al.31 demonstram que tal efeito pode ser suprimido com o uso de corticoides, caso verifique-se imediatamente as erupções cutâneas oriundas da toxicidade, permitindo o uso contínuo do PADCEVTM. O mecanismo de ação envolve a ligação do MMAE à proteína de adesão nectina-4 na superfície celular. Posteriormente, ocorre a clivagem do complexo MMAE-proteína no interior celular. A MMAE livre desregula os microtúbulos, induzindo a interrupção do ciclo celular.32 TIVDAKTM (14) Tisotumabe vedotina-tftv (14) é um fármaco que pode ser prescrito para o tratamento do câncer cervical e foi sintetizada para atingir o fator tissular (TF). O TF é altamente expressado por tumores sólidos, destacando-se os cânceres de ovário, próstata, bexiga, esôfago, endométrio e pulmão.33,34 É produzido pela empresa Seagen em colaboração com Genmab e foi aprovado pelo FDA em setembro de 2021.35,36 AidixiTM (15) Disitamabe vedotina (Figura 7) é um fármaco que foi aprovado na China em 2021 que usa o MMAE como associado à tecnologia ADC para o tratamento do câncer gástrico e também do câncer urotelial. É conhecido comercialmente como AidixiTM e é produzido pela Remegen Biosciences.37 Os alvos do fármacos são os microtúbulos e o HER2. Além disso, a substância está na fase III dos testes clínicos para o câncer de mama.38 Também cabe ressaltar que o disitamabe vedotina possui uma pequena diferença estrutural no ligante, que é representado pela ligação dupla no anel dicetônico pirrolidínico.
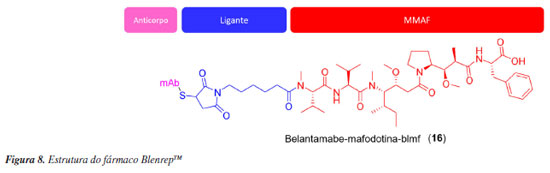
BlenrepTM (16) Belantamabe-mafodotina-blmf (16) (Figura 8), que é o princípio ativo do BlenrepTM, é um fármaco produzido pela GSK usado no tratamento do mieloma múltiplo, onde os pacientes já tiveram no mínimo 4 tratamentos prévios, incluindo um anticorpo monoclonal anti-CD38, um inibidor de proteassoma e um agente imunomodulador.39 Foi aprovado pelo FDA em 2020 de forma antecipada, devido à taxa de resposta do fármaco uma vez que o seu mecanismo de ação é diferente dos tratamentos disponíveis.40 O mecanismo de ação envolve o MMAF, que é um inibidor dos microtúbulos e a conjugação do antígeno IgG1 com a proteína BCMA, que expressa linfócitos B normais e células de mieloma múltiplo. Um dos efeitos colaterais do fármaco mais relatado é a toxidade ocular, como a ceratopatia, alterações na acuidade visual (visão turva e olho seco).41 Contudo, em fevereiro de 2023, o FDA retirou a licença para a fabricação do fármaco nos Estados Unidos.42,43
Ainda há outros fármacos imunoconjugados que estão em diferentes fases dos testes clínicos, salientando a inovação e a estratégia promissora, que se desenvolveu muito após 2012, além do sucesso dos ADCs já aprovados. Esses exemplos de ADCs, em testes clínicos, que utilizam o MMAE, MMAF ou outra variante da auristatina (17-19) podem ser consultados no Material Suplementar (Figuras 1S-3S). Derivados da eribulina Mesilato de eribulina (20) O medicamento Halaven® é uma substância artificial da classe dos macrolídeos, desenvolvida com base na halichondrina B (21) (Figura 9), originalmente encontrada na esponja marinha Halichondria okadai. Estudos15 sobre a relação entre a estrutura e a atividade biológica revelaram que a parte crucial para a ação citotóxica está na porção cíclica da substância. Assim, simplificou-se a estrutura da halichondrina B para uma molécula menor, mantendo sua eficácia. A síntese total do mesilato de eribulina é reconhecida como uma das mais complexas já realizadas.
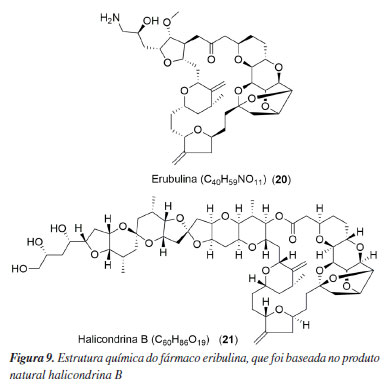
Em 2009, o mesilato de eribulina (20) estava na fase III no tratamento do câncer de mama. Além desse estudo, outras doenças estavam sendo pesquisadas através do uso da eribulina. Estudos de tumores de tecido urotelial e sólidos alcançaram a fase I. Já em tumores de bexiga, uretra, trompa de falópio, ovário, próstata, peritônio, sarcoma, cabeça e pescoço, pulmão e pâncreas galgaram a fase II dos testes clínicos. Estudos concluídos após 2009 englobam a fase III no tratamento do câncer de pulmão e mama e a fase IV frente ao câncer de mama. Ainda há 27 novos estudos em andamento que abrangem sarcomas, tumores de mama, bexiga, uretra e Peau d'Orange.44 Em 2010, esse princípio ativo foi aprovado pelo FDA com o nome comercial de Halaven® para o tratamento do câncer de mama nos Estados Unidos.45 MORAb-202 Além do Halaven®, outro fármaco que é baseado na eribulina (20) e que está em processo de testes clínicos é o MORAb-202. Também relatado como farletuzumabe ecteribulina, a substância pertence à classe dos fármacos imunoconjugados e é capaz de tratar tumores sólidos, agindo nos microtúbulos.46 Atualmente está recrutando pacientes com tumores sólidos para a fase II dos testes clínicos (NCT04300556).47 Em um outro estudo recente48 é relatada a segurança e a eficácia no uso do MORAb-202 em pacientes com a condição de câncer de ovário resistente a platina, sendo essa avaliação uma expansão da fase I dos testes clínicos. A estrutura química dessa substância não está disponível na literatura.
PRINCÍPIOS ATIVOS APRESENTADOS NA REVISÃO DE 2009, QUE SEGUEM EM ESTUDO VISANDO A APROVAÇÃO Nesse tópico serão descritas outras três substâncias (Figura 10) que foram relatadas no artigo de 2009 que não foram aprovadas pelos orgãos reguladores para serem comercializadas. Apesar da não aprovação, essas substâncias seguem sendo avaliadas, sendo componentes dos testes clínicos.
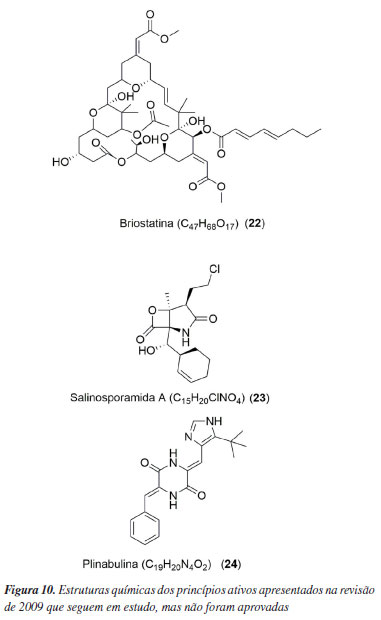
Briostatina A substância briostatina (22) é uma lactona macrocíclica isolada do briozoário Bugula neritina, reconhecida por sua capacidade de modular as proteínas Quinase C (PKC). Inicialmente, a obtenção da briostatina era feita por meio do cultivo do briozoário.49 No entanto, atualmente, já se tornou viável realizar a síntese total dessa substância.50 Um total de 43 estudos foram concluídos explorando o uso da briostatina, seja de forma pura ou em combinação com outras substâncias, para tratar diversas doenças. O tratamento do Alzheimer foi o estudo mais recente utilizando a briostatina pura, sendo realizado em 2020 (NCT04538066).51 Todos os testes realizados estavam nas fases I e II dos testes clínicos. Salinosporamida A Marizomib, também reconhecida como NPI-0052 ou salinosporamida A (23), substância isolada da bactéria marinha Salinispora tropica, atua como um inibidor de proteassoma no tratamento de células neoplásicas.52,53 Satoh et al.54 concluíram a síntese integral da salinosporamida A, a partir do ácido pent-4-enoico. O procedimento sintético demandou 14 etapas, resultando em um rendimento total de 19%. Há um estudo em fase III dos ensaios clínicos, que serão realizados em pacientes diagnosticados com glioblastoma (NCT03345095).55 Plinabulina NPI-2358 ou plinabulina (24) é uma substância sintética derivada da fenilahistina (25) (Figura 11), a qual foi isolada do fungo Aspergillus ustus, pertencente à classe das dicetopiperazinas. Ela é identificada como um poderoso agente de desregulação vascular, agindo contra a despolimerização da tubulina, o que constitui seu mecanismo de ação.56,57 Em 2009, a plinabulina estava em fase II dos ensaios clínicos, sendo administrada a pacientes com câncer de pulmão. Em 2021, a fase III dos testes clínicos foi concluída para esse tipo de câncer de pulmão (NCT02504489)58 e também em estudos empregando a substância vs. terapia quimioterápica induzida com docetaxel em pacientes com tumores sólidos (NCT03102606).59 Ainda há outro teste em fase III em andamento que é semelhante ao anteriormente citado, mas usa-se pegfilgrastim no lugar do docetaxel (NCT03294577).60
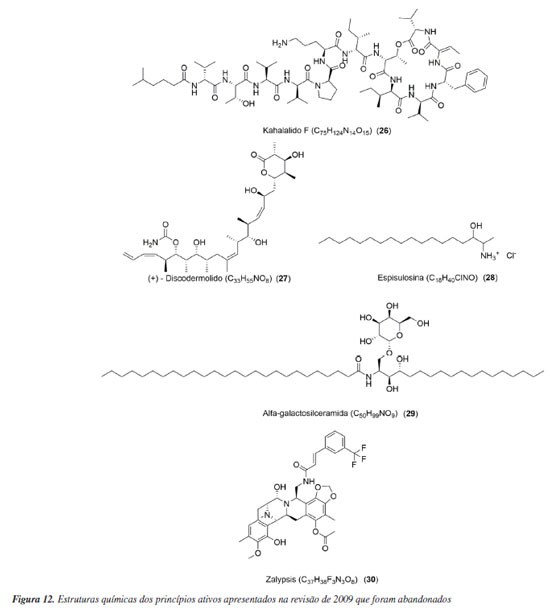
PRINCÍPIOS ATIVOS APRESENTADOS NA REVISÃO DE 2009 QUE FORAM ABANDONADOS Nessa subdivisão serão relatados os status de cinco substâncias (Figura 12) e um extrato, que, até 2009, eram considerados como promissores, mas foram descontinuados.
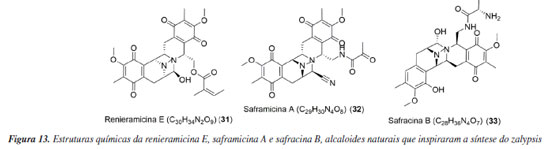
Kahalalido F Kahalalido F (KF, 26) é um depsipeptídeo obtido da alga Bryopsis pennata e do molusco Elysia rufescens. Em 2009, estava na fase II dos testes clínicos sem passar por modificações estruturais. Atualmente, a fase II foi finalizada. Os testes foram conduzidos na Espanha, onde o KF foi administrado semanalmente, na dose de 650 μg m-2, por infusão de 1 hora, em pacientes com NSCLC, um tipo de câncer de pulmão. Os resultados desses testes foram publicados no site do órgão responsável pelos testes clínicos na União Europeia em fevereiro de 2008, com a versão final do documento revisada em 31 de julho de 2016 (2004-001253-29).61 Gao e Hamann62 detalharam minuciosamente o processo dos testes clínicos nas fases I e II desta substância. Além do estudo mencionado, o KF também foi avaliado até a fase II para tratar a psoríase. Em junho de 2009, a PharmaMar, responsável pelo desenvolvimento do kahalalido F, estabeleceu uma parceria com a Farmacêutica Medimetriks para explorar o uso deste princípio ativo em áreas além da oncologia e neurologia.63 Considerando o foco da Medimetriks, acredita-se que o uso primário desta substância seja na dermatologia. Um estudo conduzido por Shah et al.64 sugere que o KF pode ser aplicado em concentrações terapêuticas na pele, combinado com intensificadores químicos lipofílicos e hidrofílicos. Discodermolido A substância (+) ‐ discodermolido (27) foi isolada da esponja caribenha Discodermia dissoluta. Ela tem a capacidade de estabilizar os microtúbulos, afetando a fase G2 do ciclo celular. Isso faz com que as células não funcionem corretamente e acabem morrendo por apoptose. Inicialmente, o discodermolido mostrou grande potencial em testes realizados em laboratório e teve efeitos positivos quando combinado com outros medicamentos. No entanto, quando foi testado na primeira fase dos estudos clínicos em pacientes com tumores sólidos, não avançou para as próximas fases devido a efeitos prejudiciais nos pulmões, chamados de pneumotoxicidade.65,66 Espisulosina Espisulosina (28) foi extraída do molusco marinho Spisula polynyma e, em 1999, estava na fase inicial dos testes clínicos em pacientes com tumores sólidos. Essa substância ficou conhecida por desencadear a morte das células cancerosas por diferentes meios, como apoptose, necrose e autofagia. No entanto, mesmo com o aumento da quantidade da substância na dose, a espisulosina demonstrou ter eficácia limitada contra tumores. O estudo visava determinar a maior dose tolerável. O problema foi a combinação entre a baixa estabilidade química do medicamento e seus efeitos tóxicos no sistema nervoso e no fígado durante a administração. Esses aspectos resultaram na interrupção do desenvolvimento do fármaco.67 KRN7000 A alfa-galactosilceramida (29), conhecida também como KRN7000, foi extraída da bactéria Bacteroides fragilis e é considerada um ligante natural do CD1d. Esse ligante ativa as células iNKT no organismo.68 Essa substância avançou para a fase II dos testes clínicos, sendo testada em pacientes com diagnósticos de câncer de cabeça e pescoço, hepatite B e C. No entanto, não há atualmente estudos clínicos em andamento para esta substância. Atualmente, a alfa-galactosilceramida está sendo usada como um modelo sintético de antígeno em estudos de imunoterapia. O objetivo principal é fortalecer o sistema imunológico para ajudar o corpo a combater infecções ou até mesmo o câncer de forma mais eficaz e independente.69 Zalypsis O PM00104 (30), princípio ativo do zalypsis, é um alcaloide sintético inspirado em uma série de substâncias marinhas como as renieramicina E (31), saframicina A (32) e safracina B (33), todas obtidas de esponjas (Figura 13). Esse medicamento age induzindo a apoptose, ou seja, a morte programada das células. Ele se liga ao ácido desoxirribonucleico (DNA) de forma covalente, inibindo as fases iniciais da transcrição e causando danos na dupla hélice do DNA.70 Devido à sua versatilidade, o zalypsis avançou para a fase II dos testes clínicos. No entanto, os estudos foram interrompidos.71
Neovastat O AE-941, também conhecido como neovastat, é um extrato obtido da cartilagem de tubarão, usado para tratar pacientes com câncer de pulmão, mieloma e carcinoma renal. O neovastat chegou à fase III dos testes clínicos, conforme relatado por Gingras et al.72 Embora tenha avançado para a fase III, é importante notar que, por ser um extrato e não uma substância única, desencoraja-se sua comercialização. Isso se deve ao fato de que a exploração desse extrato pode ameaçar toda a população de tubarões, dos quais o extrato é obtido.73
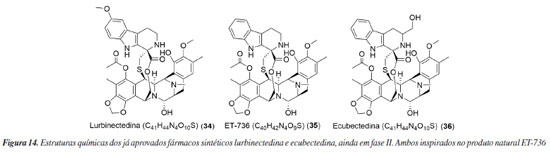
NOVOS FÁRMACOS OU PRINCÍPIOS ATIVOS QUE FORAM APROVADOS APÓS 2009 Lurbinectedina e ecubectedina O ZepzelcaTM ou lurbinectedina (34) (Figura 14) é uma versão artificial semelhante à substância ET-736 (35), isolada do organismo marinho Ecteinacidia turbinata. Na lurbinectedina, um átomo de hidrogênio foi substituído por um ligante metóxi.74,75 Produzida pela empresa PharmaMar, esse fármaco é recomendado para tratar câncer de pulmão de pequenas células. Sua aprovação pelo FDA em 2020 foi baseada na eficácia do tratamento, medindo a rapidez e a duração da resposta ao medicamento.76,77 Esse medicamento tem a capacidade de se ligar ao DNA, causando danos em sua estrutura, levando à morte das células cancerosas. Além de sua atividade de combate ao câncer, o medicamento também está associado à redução de macrófagos associados ao tumor, o que pode ter um efeito direto no ambiente onde o tumor se desenvolve.78 Apesar de já ter sido aceito pelo FDA, outro estudo, em fase III, está sendo conduzido e visa o tratamento do leiomiossarcoma (NCT06088290),79 além do estudo no tratamento do câncer de ovário já concluído (NCT02421588).80
Ecubectedina (36) (Figura 14), também conhecida como PM14, é um alcaloide sintético que participa do mesmo programa de desenvolvimento de química medicinal da lurbinectedina pela PharmaMar. Atualmente, está na fase II dos testes clínicos, sendo testada em pacientes que possuem tumores sólidos (NCT05146440).81 O mecanismo de ação desse fármaco engloba a inibição da síntese de ácido ribonucleico (RNA) e a transcrição ativa de genes codificadores de proteínas.82 Lovaza, Vascepa e Epanova Apesar de não ser discutido no artigo de 2009, Lovaza® foi o primeiro fármaco da classe do ômega-3 que foi aceito pelo FDA, em 2004.83 Produzida pela GSK, a composição do medicamento é uma combinação de ésteres etílicos de ácidos graxos ômega-3, principalmente ácido eicosapentaenoico (EPA, 37) e ácido docosahexaenoico (DHA, 38) (Figura 15), indicado como complemento à dieta para reduzir os níveis de triglicerídeos em pacientes adultos com doença grave (≥ 500 mg dL-1) hipertrigliceridemia.84,85
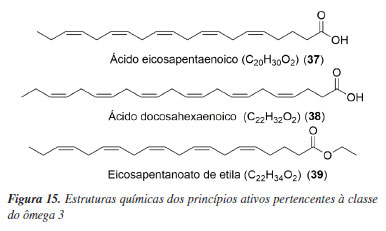
Vascepa® é um medicamento produzido pela empresa Amarin Pharma, aprovado pelo FDA em 2012.86 Este medicamento é usado em duas situações diferentes: primeiro, para reduzir o risco de ataque cardíaco, derrame e problemas cardíacos graves que precisam de hospitalização, quando tomado junto com estatinas. Em segundo lugar, é utilizado juntamente com uma dieta com baixo teor de colesterol e gorduras para diminuir os níveis de triglicerídeos.87 A substância ativa neste medicamento é o eicosapentanoato de etila (39) (Figura 15), que faz parte da classe dos ácidos graxos ômega-3, geralmente encontrados em peixes ou óleos de peixe, junto com seu ácido correspondente.88 Estudos89 feitos com o ácido eicosapentaenoico (EPA, 37) mostram que seu mecanismo de ação acontece por meio da síntese e inibição de quebra de proteínas, levando a uma redução nos níveis de triglicerídeos por meio do processo de beta oxidação. Epanova® é um medicamento composto por uma mistura complexa de ácidos graxos poli-insaturados, onde os principais componentes são o ácido eicosapentaenoico (EPA, 37) e o ácido docosahexaenoico (DHA, 38). A cada 1 grama do medicamento, pelo menos 850 miligramas são representados pela combinação desses ácidos graxos. Especificamente, a composição da mistura é aproximadamente 550 miligramas de EPA e 200 miligramas de DHA.90 Similar ao Vascepa®, o Epanova® foi aprovado pelo FDA em 2014, principalmente para tratar pacientes com níveis elevados de triglicerídeos, ajudando a diminuir o risco de doenças cardíacas.91 Este medicamento é fabricado pela empresa AstraZeneca e o mecanismo de ação descrito na bula do medicamento envolve o aumento da queima de gordura e a redução da produção de gordura no fígado.92 Contudo, ao consultar o status atual do medicamento, verificou-se que o fármaco não é mais comercializado.93
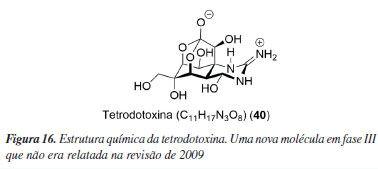
NOVAS MOLÉCULAS QUE NÃO FORAM CITADAS NA REVISÃO DE 2009 E ESTÃO EM TESTES CLÍNICOS Também serão relatadas outras novas substâncias que não foram citadas no trabalho anterior, mas que, atualmente, estão sendo estudadas, compondo as mais variadas fases dos testes clínicos. Fase III Tetrodotoxina Tetrodotoxina (40) (Figura 16) é uma neurotoxina pertencente à classe dos alcaloides e é comumente encontrada em animais marinhos. A substância é conhecida por causar dormência perional em consumidores de baiacu e é capaz de bloquear os canais de sódio.94 Tal atividade biológica foi explorada pela indústria farmacêutica WEX, de forma que a empresa vem desenvolvendo o fármaco HalneuronTM,95 testado no tratamento de dor crônica (NCT00725114).96
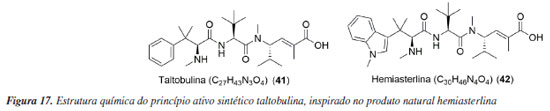
Fase II Taltobulina (STRO-002) A empresa Sutro Biopharma está desenvolvendo o Luvelta® (STRO-002, luveltamab tazevibulin, 41), fármaco imunoconugado o qual tem como o princípio ativo a taltobulina (HTI-286), um derivado sintético do produto natural hemiasterlina (42) (Figura 17), obtido de esponja marinha Hemiasterella vasiformis var. minor.97,98 O medicamento está em fase II dos testes clínicos e está sendo testado para tratar mulheres que apresentam quadro de câncer nos ovários que expressam o receptor FOLR1 (NCT05870748).99 O candidato a fármaco também está em fase I para o tratamento do câncer endometrial (NCT03748186).100,101
Fase I Griffithsina Griffithsina (43) (Figura 18) é uma proteína com uma sequência de 121 aminoácidos que foi isolada de algas vermelhas. Ela possui relevante atividade antiviral com amplo espectro e baixa toxidade para o hospedeiro, seja in vitro ou in vivo.102 Na base de dados dos testes clínicos, verifica-se que a substância possui quatro estudos finalizados e um em andamento. Os testes, todos em fase I, são relacionados com a prevenção e o tratamento da COVID-19 e infecções provocadas pelo vírus da imunodeficiência humana (HIV).43
CONSIDERAÇÕES E PERSPECTIVAS Grandes progressos na pesquisa de medicamentos de origem marinha foram alcançados na última década. Desde a revisão anterior, publicada em 2009, outros 12 fármacos foram aprovados pelas principais agências mundiais de saúde para serem utilizados, principalmente, no tratamento de doenças oncológicas e em complicações relacionadas a níveis elevados de triglicerídeos. Dos fármacos aprovados após 2009, apenas dois já estavam em estudos clínicos anteriormente e seis são derivados das dolastatinas, já conhecidas naquele ano, produzidos a partir da promissora tecnologia dos fármacos imunoconjugados (antibody drugs conjugate, ADC). Essa tecnologia permitiu um grande sucesso no desenvolvimento de medicamentos relacionados ao tratamento de doenças oncológicas e levou a um grande aumento no número de substâncias que, atualmente, avançam nas diferentes fases dos testes clínicos. O conhecimento obtido a partir da literatura foi compilado aqui para evidenciar os avanços obtidos nos últimos anos, fornecendo atualizações sobre fármacos e candidatos a fármacos de origem marinha. Portanto, esperamos que essa revisão inspire outros grupos de pesquisa a desenvolver investigações com a matriz de origem marinha, que, apesar de recente, demonstra ter um grande potencial para o desenvolvimento de novos fármacos.
MATERIAL SUPLEMENTAR O material suplementar desse trabalho (ADCs que estão em testes clínicos, que utilizam o MMAE, MMAF ou outra variante da auristatina) está disponível em http://quimicanova.sbq.org.br/, na forma de arquivo PDF, com acesso livre.
DECLARAÇÃO DE DISPONIBILIDADE DE DADOS Todos os dados estão disponíveis no texto..
AGRADECIMENTOS Somos eternamente gratos à Profa. Dra. Rosângela de Almeida Epifanio (in memoriam) por sua dedicação à pesquisa em produtos naturais marinhos brasileiros. Agradecemoa à Profa. Letícia Costa-Lotufo que nos inspirou com sua revisão de 2009 nessa mesma revista. Os autores agradecem a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Programa de Assistência Estudantil/Universidade Federal Fluminense (PROAES/UFF) e à Fundação Carlos Chagas Filho de Amparo à Pesquisa do Estado do Rio de Janeiro (FAPERJ, CNE E-26/200.515/2023).
REFERÊNCIAS 1. Newman, D. J.; Cragg, G. M.; J. Nat. Prod. 2020, 83, 770. [Crossref] 2. Newman, D. J.; Natl. Sci. Rev. 2022, 9, nwac206. [Crossref] 3. Dias, D. A.; Urban, S.; Roessner, U.; Metabolites 2012, 2, 303. [Crossref] 4. Cragg, G. M.; Newman, D. J.; Pure Appl. Chem. 2005, 77, 7. [Crossref] 5. Jiménez, C.; ACS Med. Chem. Lett. 2018, 9, 959. [Crossref] 6. Costa-Lotufo, L. V.; Wilke, D. V.; Jimenez, P. C.; Epifanio, R. A.; Quim. Nova 2009, 32, 703. [Crossref] 7. Carroll, A. R.; Copp, B. R.; Grkovic, T.; Keyzers, R. A.; Prinsep, M. R.; Nat. Prod. Rep. 2024, 41, 162. [Crossref] 8. US Food and Drug Administration (US FDA), FDA-Approved Drugs, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=016793, acessado em junho 2025. 9. US Food and Drug Administration (US FDA), FDA-Approved Drugs, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=050486, acessado em junho 2025. 10. US Food and Drug Administration (US FDA), FDA-Approved Drugs, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=021060, acessado em junho 2025. 11. All the Power of Sea, https://allthepowerofthesea.com/sections, acessado em junho 2025. 12. European Medicines Agency (EMA), Yondelis, https://www.ema.europa.eu/en/medicines/human/EPAR/yondelis, acessado em junho 2025. 13. European Medicines Agency (EMA), Yondelis, https://www.ema.europa.eu/en/documents/overview/yondelis-epar-summary-public_en.pdf, acessado em junho 2025. 14. US Food and Drug Administration (US FDA), FDA-Approved Drugs, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=207953, acessado em junho 2025. 15. Jimenez, P. C.; Wilke, D. V.; Costa-Lotufo, L. V.; Clinics 2018, 73, e482s. [Crossref] 16. Alonso-Álvarez, S.; Pardal, E.; Sánchez-Nieto, D.; Navarro, M.; Caballero, M.; Mateos M. V.; Martín, A.; Drug Des., Dev. Ther. 2017, 11, 253. [Crossref] 17. ClinicalTrials.gov, https://clinicaltrials.gov/study/NCT04784559, acessado em junho 2025. 18. Stuart, K. A.; Welsh, K.; Walker, M. C.; Edrada-Ebel, R.; Expert Opin. Drug Discovery 2020, 15, 499. [Crossref] 19. Newman, D.; Cragg, G. Em Marine Biomedicine; Baker, B. J., ed.; Taylor & Francis Group: Boca Raton, 2015, cap. 14. 20. Gao, G.; Wang, Y.; Hua, H.; Li, D.; Tang, C.; Mar. Drugs 2021, 19, 363. [Crossref] 21. Baah, S.; Laws, M.; Rahman, K. M.; Molecules 2021, 26, 2943. [Crossref] 22. Kumar, A.; White, J.; Christie, R. J.; Dimasi, N.; Gao, C. Em Annual Reports in Medicinal Chemistry; Goodnow, R. A., ed.; Elsevier: Amsterdam, 2017, cap. 12. 23. Takeda Pharmaceutical Company Limited, www.takeda.com/4ab5c9/siteassets/pt-pt/home/media/prs/_2017-01-25_infarmed-aprova-adcetris-brentuximab-vedotina.pdf, acessado em junho 2025. 24. Zhao, P.; Zhang, Y.; Li, W.; Jeanty, C.; Xiang, G.; Dong, Y.; Acta Pharm. Sin. B 2020, 10, 1589. [Crossref] 25. Pfizer, U.S. FDA Approves Pfizer's ADCETRIS® Combination Regimen for the Treatment of Relapsed/Refractory Diffuse Large B-Cell Lymphoma, https://www.pfizer.com/news/press-release/press-release-detail/us-fda-approves-pfizers-adcetrisr-combination-regimen, acessado em junho 2025. 26. US Food and Drug Administration (US FDA), FDA-Approved Drugs, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=761121, acessado em junho 2025. 27. Genentech, Polivy, https://www.gene.com/medical-professionals/medicines/polivy, acessado em junho 2025. 28. Genentech, Polivy, https://www.gene.com/download/pdf/polivy_prescribing.pdf, acessado em junho 2025. 29. Pfizer, Our Pipeline: Potential Breakthroughs in the Making, https://www.pfizer.com/science/drug-product-pipeline, acessado em junho 2025. 30. US Food and Drug Administration (US FDA), FDA-Approved Drugs, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=761137, acessado em junho 2025. 31. Hirotsu, K. E.; Rana, J.; Wang, J. Y.; Raghavan, S. S.; Rieger, K. E.; Srinivas, S.; Fan, A. C.; Kwong, B. Y.; Novoa, R. A.; Zaba, L. C.; J. Am. Acad. Dermatol. 2021, 85, 1610. [Crossref] 32. Challita-Eid, P. M.; Satpayev, D.; Yang, P.; An, Z.; Morrison, K.; Shostak, Y.; Raitano, A.; Nadell, R.; Liu, W.; Lortie, D. R.; Capo, L.; Verlinsky, A.; Leavitt, M.; Malik, F.; Aviña, H.; Guevara, C. I.; Dinh, N.; Karki, S.; Anand, B. S.; Pereira, D. S.; Joseph, I. B. J.; Doñate, F.; Morrison, K.; Stover, D. R.; Cancer Res. 2016, 76, 3003. [Crossref] 33. van den Berg, Y. W.; Osanto, S.; Reitsma, P. H.; Versteeg, H. H.; Blood 2012, 119, 924. [Crossref] 34. Cocco, E.; Varughese, J.; Buza, N.; Bellone, S.; Glasgow, M.; Bellone, M.; Todeschini, P.; Carrara, L.; Silasi, D. A.; Azodi, M.; Schwartz, P. E.; Rutherford, T. J.; Pecorelli, S.; Lockwood, C. J.; Santin, A. D.; BMC Cancer 2011, 11, 263. [Crossref] 35. US Food and Drug Administration (US FDA), FDA Grants Accelerated Approval to Tisotumab Vedotin-tftv for Recurrent or Metastatic Cervical Cancer, https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-tisotumab-vedotin-tftv-recurrent-or-metastatic-cervical-cancer, acessado em junho 2025. 36. Tivdak, Full Prescribing Information, https://docs.tivdak.com/Tivdak_Large_Print_Tabbed_PI.pdf, acessado em junho 2025. 37. ADC Review, Chinese Regulator Conditionally Approves Disitamab Vedotin in Advanced or Metastatic Gastric Cancer, https://www.adcreview.com/clinical-trials-update/chinese-regulator-conditionally-approves-disitamab-vedotin-in-advanced-or-metastatic-gastric-cancer, acessado em junho 2025. 38. Remegen, Disitamab Vedotin, https://www.remegen.com/index.php?v=show&cid=94&id=150, acessado em junho 2025. 39. European Medicines Agency (EMA), Sumary of Products Characteristics: BLENREP, https://www.ema.europa.eu/en/documents/product-information/blenrep-epar-product-information_pt.pdf, acessado em junho 2025. 40. US Food and Drug Administration (US FDA), FDA Granted Accelerated Approval to Belantamab Mafodotin-blmf for Multiple Myeloma, https://www.fda.gov/drugs/resources-information-approved-drugs/fda-granted-accelerated-approval-belantamab-mafodotin-blmf-multiple-myeloma, acessado em junho 2025. 41. Lonial, S.; Lee, H. C.; Badros, A.; Trudel, S.; Nooka, A. K.; Chari, A.; Abdallah, A. O.; Callander, N.; Lendvai, N.; Sborov, D.; Suvannasankha, A.; Weisel, K.; Karlin, L.; Libby, E.; Arnulf, B.; Facon, T.; Hulin, C.; Kortüm, K. M.; Rodríguez-Otero, P.; Usmani, S. Z.; Hari, P.; Baz, R.; Quach, H.; Moreau, P.; Voorhees, P. M.; Gupta, I.; Hoos, A.; Zhi, E.; Baron, J.; Piontek, T.; Lewis, E.; Jewell, R. C.; Dettman, E. J.; Popat, R.; Esposti, S. D.; Opalinska, J.; Richardson, P.; Cohen, A. D.; Lancet Oncol. 2020, 21, 207. [Crossref] 42. GSK, https://www.blenrephcp.com, acessado em junho 2025. 43. GSK, GSK Provides an Update on Blenrep (belantamab mafodotin- blmf) US Marketing Authorisation, https://www.gsk.com/en-gb/media/press-releases/gsk-provides-update-on-blenrep-us-marketing-authorisation, acessado em junho 2025. 44. ClinicalTrials. gov, https://www.clinicaltrials.gov, acessado em junho 2025. 45. Eisai, U.S. FDA Approves Eisai's HalavenTM (Eribulin Mesylate) Injection for Treatment of Metastatic Breast Cancer, https://www.eisai.com/news/news201064.html, acessado em junho 2025. 46. Cheng, X.; Li, J.; Tanaka, K.; Majumder, U.; Milinichik, A. Z.; Verdi, A. C.; Maddage, C. J.; Rybinski, K. A.; Fernando, S.; Fernando, D.; Kuc, M.; Furuuchi, K.; Fang, F.; Uenaka, T.; Grasso, L.; Albone, E. F.; Mol. Cancer Ther. 2018, 17, 2665. [Crossref] 47. ClinicalTrials.gov, https://clinicaltrials.gov/study/NCT04300556, acessado em junho 2025. 48. Eisai, Eisai Presents New Findings for Antibody Drug Conjugate Farletuzumab Ecteribulin at 2022 ASCO Annual Meeting, https://www.eisai.com/news/2022/news202245.html, acessado em junho 2025. 49. Farrow, B.; Thomas, R. P.; Wang, X. F.; Evers, B. M.; Int. J. Gastrointest. Cancer 2002, 32, 63. [Crossref] 50. Wender, P. A.; Hardman, C. T.; Ho, S.; Jeffreys, M. S.; Maclaren, J. K.; Quiroz, R. V.; Ryckbosch, S. M.; Shimizu, A. J.; Sloane, J. L.; Stevens, M. C.; Science 2017, 358, 218. [Crossref] 51. ClinicalTrials.gov, https://www.clinicaltrials.gov/study/NCT04538066, acessado em junho 2025. 52. Raninga, P. V.; Lee, A.; Sinha, D.; Dong, L. F.; Datta, K. K.; Lu, X.; Croft, P. K.; Dutt, M.; Hill, M.; Pouliot, N.; Gowda, H.; Kalimutho, M.; Neuzil, J.; Khanna, K. K.; Theranostics 2020, 10, 5259. [Crossref] 53. Macherla, V. R.; Mitchell, S. S.; Manam, R. R.; Reed, K. A.; Chao, T. H.; Nicholson, B.; Deyanat-Yazdi, G.; Mai, B.; Jensen, P. R.; Fenical, W. F.; Neuteboom, S. T. C.; Lam, K. S.; Palladino, M. A.; Potts, B. C. M.; J. Med. Chem. 2005, 48, 3684. [Crossref] 54. Satoh, N.; Yokoshima, S.; Fukuyama, T.; Org. Lett. 2011, 13, 3028. [Crossref] 55. ClinicalTrials.gov, https://clinicaltrials.gov/study/NCT03345095, acessado em junho 2025. 56. La Sala, G.; Olieric, N.; Sharma, A.; Viti, F.; Perez, F. A. B.; Huang, L.; Tonra, J. R.; Lloyd, G. K.; Decherchi, S.; Díaz, J. F.; Steinmetz, M. O.; Cavalli, A.; Chem 2019, 5, 2969. [Crossref] 57. Ganesher, A.; Chaturvedi, P.; Karkara, B. B.; Chatterjee, I.; Datta, D.; Panda, G.; J. Mol. Struct. 2021, 1229, 129830. [Crossref] 58. ClinicalTrials. gov, https://clinicaltrials.gov/study/NCT02504489, acessado em junho 2025. 59. ClinicalTrials.gov, https://clinicaltrials.gov/study/NCT03102606, acessado em junho 2025. 60. ClinicalTrials.gov, https://clinicaltrials.gov/study/NCT03294577, acessado em junho 2025. 61. EU Clinical Trials Register, https://www.clinicaltrialsregister.eu/ctr-search/trial/2004-001253-29/results, acessado em junho 2025. 62. Gao, J.; Hamann, M. T.; Chem. Rev. 2011, 111, 3208. [Crossref] 63. Krogan, K., Spain's Zeltia Signs Psoriasis Deal with Medimetriks, https://pharmatimes.com/news/spains_zeltia_signs_psoriasis_deal_with_medimetriks_984716/, acessado em junho 2025. 64. Shah, P. P.; Desai, P. R.; Patlolla, R.; Klevans, L.; Singh, M.; J. Pharm. Pharmacol. 2014, 66, 760. [Crossref] 65. Fan, Y.; Schreiber, E. M.; Day, B. W.; J. Nat. Prod. 2009, 72, 1748. [Crossref] 66. Valderrama, K.; Castellanos, L.; Zea, S.; J. Sep. Sci. 2010, 33, 2316. [Crossref] 67. Massard, C.; Salazar, R.; Armand, J. P.; Majem, M.; Deutsch, E.; García, M.; Oaknin, A.; Fernández-García, E. M.; Soto, A.; Soria, J. C.; Invest. New Drugs 2012, 30, 2318. [Crossref] 68. Carr, R. M.; J. Lipid Res. 2019, 60, 1805. [Crossref] 69. Lehmann, N.; Paret, C.; El Malki, K.; Russo, A.; Neu, M. A.; Wingerter, A.; Seidmann, L.; Foersch, S.; Ziegler, N.; Roth, L.; Backes, N.; Sandhoff, R.; Faber, J.; Front. Immunol. 2020, 11, 1819. [Crossref] 70. Petek, B. J.; Jones, R. L.; Molecules 2014, 19, 12328. [Crossref] 71. Jones, R. L.; Ferrari, S.; Blay, J. Y.; Navid, F.; Lardelli, P.; Alfaro, V.; Siguero, M.; Soman, N.; Chawla, S. P.; Invest. New Drugs 2014, 32, 171. [Crossref] 72. Gingras, D.; Boivin, D.; Deckers, C.; Gendron, S.; Barthomeuf, C.; Béliveau, R.; Anti-Cancer Drugs 2003, 14, 91. [Crossref] 73. Lu, C.; Lee, J. J.; Komaki, R.; Herbst, R. S.; Feng, L.; Evans, W. K.; Choy, H.; Desjardins, P.; Esparaz, B. T.; Truong, M. T.; Saxman, S.; Kelaghan, J.; Bleyer, A.; Fisch, M. J.; J. Natl. Cancer Inst. 2010, 102, 859. [Crossref] 74. PharmaMar, Zepzelca, https://pharmamar.com/en/products/zepzelca/, acessado em junho 2025. 75. Immedica Pharma, Zepzelca® (Lurbinectedin) Approved by the Ministry of Health in Oman for the Treatment of Metastatic Small Cell Lung Cancer, https://www.immedica.com/en/press/zepzelcar-lurbinectedin-approved-ministry-health-oman-treatment-metastatic-small-cell-lung, acessado em junho 2025. 76. US Food and Drug Administration (US FDA), FDA Grants Accelerated Approval to Lurbinectedin for Metastatic Small Cell Lung Cancer, https://www.fda.gov/drugs/drug-approvals-and-databases/fda-grants-accelerated-approval-lurbinectedin-metastatic-small-cell-lung-cancer, acessado em junho 2025. 77. Zepzelca, https://www.zepzelcapro.com/faqs/, acessado em junho 2025. 78. Markham, A.; Drugs 2020, 80, 1345. [Crossref] 79. ClinicalTrials.gov, https://clinicaltrials.gov/study/NCT06088290, acessado em junho 2025. 80. ClinicalTrials.gov, https://clinicaltrials.gov/study/NCT02421588, acessado em junho 2025. 81. ClinicalTrials.gov, https://clinicaltrials.gov/study/NCT05146440, acessado em junho 2025. 82. PharmaMar, Pipiline, https://pharmamar.com/en/science/oncology-pipeline/, acessado em junho 2025. 83. US Food and Drug Administration (US FDA), FDA-Approved Drugs, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=021654, acessado em junho 2025. 84. GlaxoSmithKline, Lovaza, https://www.accessdata.fda.gov/drugsatfda_docs/label/2014/021654s041lbl.pdf, acessado em junho 2025. 85. DailyMed, Lovaza, https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=c1920576-1b04-4b20-bb00-061f09032574#LINK_85663 a88-f671-4780-8633-0b12ebe3a055, acessado em junho 2025. 86. US Food and Drug Administration (US FDA), FDA-Approved Drugs, https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=202057, acessado em junho 2025. 87. Vascepa, https://www.vascepa.com/, acessado em junho 2025. 88. Li, Y.; Zhao, L.; Huang, X.; Zhang, L.; Li, J.; Zhang, J.; J. Sep. Sci. 2019, 42, 3697. [Crossref] 89. Fan, C.; Wen, L.; Cao, X.; J. Chromatogr. A 2020, 1618, 460872. [Crossref] 90. Shimada, H.; Nilsson, C.; Noda, Y.; Kim, H.; Lundström, T.; Yajima, T.; J. Atheroscler. Thromb. 2017, 24, 980. [Crossref] 91. Jing, S.; Zhang, Z.; Chen, X.; Miao, R.; Nilsson, C.; Lin, Y.; Clin. Pharmacol. Drug Dev. 2020, 9, 985. [Crossref] 92. AstraZeneca Pharmaceuticals, Epaniova, https://www.accessdata.fda.gov/drugsatfda_docs/label/2014/205060s000lbl.pdf, acessado em junho 2025. 93. AstraZeneca, Update on Phase III STRENGTH Trial for Epanova in Mixed Dyslipidaemia, https://www.astrazeneca.com/media-centre/press-releases/2020/update-on-phase-iii-strength-trial-for-epanova-in-mixed-dyslipidaemia-13012020.html#modal-historic-confirmation, acessado em junho 2025. 94. Kotipoyina, H. R.; Kong, E. L.; Warrington, S. J.; Tetrodotoxin Toxicity; StatPearls Publishing: Treasure Island, 2023. 95. Wexpharma, Halneuron, https://wexpharma.com/technology/about-halneuron/, acessado em junho 2025. 96. ClinicalTrials.gov, https://clinicaltrials.gov/study/NCT00725114, acessado em junho 2025. 97. Vashist, Y. K.; Tiffon, C.; Schneider, M.; Stoupis, C.; Wagner, M.; Baer, H. U.; Redaelli, C. A. Em Chirurgisches Forum 2005; Rothmund, M.; Jauch, K. W.; Bauer, H., eds.; Springer: Berlin, 2005. 98. Talpir, R.; Benayahu, Y.; Kashman, Y.; Pannell, L.; Schleyer, M.; Tetrahedron Lett. 1994, 35, 4453. [Crossref] 99. ClinicalTrials.gov, https://clinicaltrials.gov/study/NCT05870748, acessado em junho 2025. 100. Sutro Biopharma, Pipeline, https://www.sutrobio.com/pipeline/, acessado em junho 2025. 101. ClinicalTrials.gov, https://clinicaltrials.gov/study/NCT03748186, acessado em junho 2025. 102. Lee, C.; Mar. Drugs 2019, 17, 567. [Crossref]
Editor responsável pelo artigo: Jorge M. David |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access