Educação
|
|
| Dicromatometria em microescala: motivação para diminuir os impactos ambientais no ensino da química analítica Microscale dichrometry: the motivation for lowering the environmental impacts in analytical chemistry teaching |
|
Gabriel N. F. NettoI; Flávia F. de C. MarquesI I. Departamento de Química Analítica, Instituto de Química, Universidade Federal Fluminense, 24020-141 Niterói - RJ, Brasil Recebido: 07/12/2024 *e-mail: cbduyck@id.uff.br The introduction of the concepts of Green Analytical Chemistry in the teaching of Chemistry has been growing, in view of the formation of students more attentive to sustainable development. However, many experimental classes still employ reagents of high toxicity, which generate class I residues, as is the case of dichrometry, a titulometric method. Using the determination of iron in a dietary supplement and in a steel sponge as motivating examples, this paper presents microtitration as a greener alternative for classroom use. The method is compared to the classical approach, highlighting differences in chemical exposure and waste volume, emphasizing the environmental benefits of microtitration. The experiment allowed students to develop critical thinking about traditional methods and became familiar with the manipulation of microvolumes and microscale reasoning. Their evaluations of the proposed practice were recorded and discussed, for a possible replacement of the classical method. INTRODUÇÃO A química verde (QV) tem passado por transformações significativas desde a proposição dos 12 princípios norteadores em 1998, por Anastas e Warner.1 Originalmente definida como o "desenho de produtos e processos que minimizam o uso e a geração de substâncias perigosas", a QV evoluiu para uma abordagem multidisciplinar, assumindo também uma responsabilidade social voltada para a proteção da vida.2,3 Nesse contexto de preservação, a química analítica verde (QAV) visa modificar ou criar métodos sustentáveis para identificação e quantificação de substâncias, privilegiando métodos diretos, com baixo ou nenhum consumo de energia e de substâncias de alto risco, que gerem menos resíduos e que empreguem sistemas automatizados e miniaturizados, segundo os 12 princípios da QAV.4 No entanto, pesquisas apontaram para a escassez de experimentos de QAV ou de modificações de métodos poluentes ainda empregados no ensino da química analítica.5 Portanto, as adaptações dos cursos devem vir de uma comunidade atenta quanto à sustentabilidade de suas práticas e de estudantes que saibam comparar métodos e fazer escolhas mais alinhadas com os preceitos da QV.6 Por outro lado, tais mudanças necessitam de conhecimentos socioeconômicos e culturais sobre a problemática de sustentabilidade por parte dos estudantes, dentro de um conhecimento geral robusto, como apontado por Lipscher.7 No entanto, muitos estudantes iniciam disciplinas com dificuldades na linguagem química, tornando as modificações curriculares que incluam a QAV mais desafiadoras. No Brasil, a aplicação da QV em métodos educacionais e em aulas laboratoriais está em expansão. Contudo, a adaptação dos métodos tradicionais para incorporar os princípios da QV ainda é uma questão secundária.8-11 Nesse sentido, a miniaturização de experimentos em sala de aula permite a introdução da QAV nos projetos pedagógicos dos cursos, a redução ou eliminação de reagentes e/ou produtos de elevada toxicidade que gerem riscos à saúde e ao meio ambiente, além de gerar volumes reduzidos de resíduos. Em diversos países, existem cursos de graduação sobre sistemas microfluídicos do tipo "LabOnChip", devido às crescentes aplicações, principalmente na indústria farmacêutica. No entanto, os alunos precisam de conhecimentos multi-disciplinares prévios para sua construção e aplicação, que não são usuais nos currículos de graduação em Química.12,13 Por outro lado, o uso de suportes como fios ou papel melhoram o transporte e a mistura de soluções em microescala e foram propostos por autores para miniaturização de técnicas clássicas de titulação que usam bureta e Erlenmeyer.14,15 Dentre os dispositivos existentes, aqueles baseados no transporte difusivo sob papel (μ-PAD, do inglês microfluidic paper-based analytical devices) foram os mais empregados.16-18 Eles são baseados na distância percorrida pela solução titulada sob a solução titulante, onde há modificação da cor do indicador. Esse método necessita de técnicas adicionais de medição, incluindo a detecção por imagem (código RGB, do inglês red, green and blue, em aplicativos de celular) e micro-régua, além da construção de curvas analíticas de calibração (distância vs. concentração do titulado). Desta forma, microtitulações de ácidos (HCl e CH3COOH) e NaOH, cloreto por argentometria e ácido ascórbico por iodometria já foram propostas e executadas por estudantes, que precisaram desenvolver habilidade para a deposição de volumes da ordem de microlitros. Outros dispositivos se baseiam na relação entre a concentração e a vazão, envolvendo conceitos teóricos mais complexos e a construção de um dispositivo microfluídico, que foi aplicado para a microtitulação de ácidos (HCl, CH3COOH e CH2(COOH)2) por NaOH.19 De forma mais simples, um indicador fluorescente foi proposto para titulações redox comuns, como permanganometria, cerimetria e dicromatometria, que foram realizadas em microescala usando uma microbureta e soluções padrão micromolares.20 Essa abordagem teve a vantagem de discutir os conceitos de QAV em um curso comum de laboratório analítico sobre métodos titrimétricos, o que não implicou em habilidades adicionais dos alunos. Visando contribuir nesta área, este trabalho teve como objetivo miniaturizar um experimento de dicromatometria em sala de aula, para minimizar os impactos ambientais ocasionados pela aplicação do método clássico. Para tal, a titulação em microescala e seus conceitos teóricos foram ensinados em uma aula experimental de química analítica quantitativa para alunos de graduação de Engenharia Química, Química Industrial e Farmácia, com o intuito de concientizar os alunos sobre a necessidade de adaptação de métodos que usam dicromato de potássio, que é altamente tóxico, segundo os princípios da QAV.
PARTE EXPERIMENTAL Contextualização O experimento de microtitulação foi desenvolvido por um estudante de graduação no quadro do Projeto de Monitoria em Química da Universidade Federal Fluminense. Esse projeto permite aos alunos bolsistas (monitores) desenvolverem aplicações em todas as áreas da Química. De forma geral, os projetos de monitoria experimental do curso de Química Analítica podem propor adaptações ou modificações de uma metodologia existente no currículo de uma disciplina. Cada monitor desenvolve e aplica sua proposta de aula a uma turma, sob supervisão de um professor orientador. As aulas em laboratório de química analítica na maioria das Universidades do Brasil são divididas entre as análises qualitativas e quantitativas. As técnicas de titulação volumétrica empregadas na análise quantitativa são ensinadas após a disciplina de análise qualitativa e a maioria dos alunos não é familiarizada com os princípios da QAV. Assim, os objetivos de aprendizagem foram estabelecidos considerando essas observações, visando:
O íon dicromato e sua reação com o íon Fe2+ Antes do experimento no laboratório, é reforçado aos alunos que a titulação dos íons Fe2+ com os íons dicromato se baseia na reação do titulante e do analito com estequiometria conhecida, sendo possível empregar quantidades e concentrações em escala reduzida. Em seguida, os conceitos de QAV foram introduzidos, focando na toxicidade do dicromato e no procedimento de microescala empregando placas de toque de porcelana e micropipetas, o que permite reduzir a exposição e a quantidade de resíduos gerados. O dicromato de potássio, K2Cr2O7(s), é um sal de toxicidade máxima (letal) se ingerido ou inalado, segundo sua Ficha de Dados de Segurança do Sistema Globalmente Harmonizado (FDS-GHS), e apresenta toxicidade aguda no diamante de Hommel, além de provocar danos severos ao meio ambiente. Essas especificações estão resumidas na Figura 1.

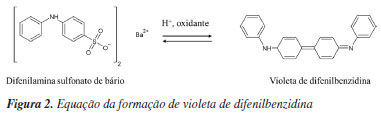
Esse reagente é um oxidante forte ainda muito usado na determinação da demanda química de oxigênio, DQO, que avalia a concentração de espécies orgânicas e inorgânicas oxidáveis como um parâmetro de qualidade da água.21 O K2Cr2O7 também pode ser usado como um padrão primário em técnicas volumétricas de oxirredução, pois apresenta alta pureza, estabilidade e baixo custo. A metodologia clássica de titulação do cátion ferroso, Fe2+, pelo dicromato, Cr2O72-, é uma prática antiga, investigada desde o século XIX.22 A titulação é feita em meio de ácido sulfúrico 33% (m m-1) no qual o par Cr2O72-/Cr3+ tem potencial padrão (Eº) igual a +1,33 V.23 O indicador usado é o difenilamina sulfonato de bário a 0,2% (m v-1), que apresenta Eº = +0,76 V, próximo do par Fe3+/Fe2+ (Eº = +0,77 V). Sua reação com o íon dicromato acontece após a oxidação do íon Fe2+, devido à formação de um intermediário reacional, enquanto o indicador, incolor, é oxidado formando um composto de coloração violeta de difenilbenzidina no ponto final da titulação (Figura 2).
Outra prática do currículo clássico propõe a determinação de ferro em palha de aço, o que necessita de uma etapa de decomposição com HCl e HNO3 e da redução do íon Fe3+ a Fe2+ pela adição de cloreto estanoso, SnCl2 (Eº = +0,15 V). No entanto, o excesso de SnCl2 pode reagir com o íon dicromato e interferir na determinação do ponto final. Portanto, uma solução concentrada de sulfato mercúrico, HgSO4, é adicionada para oxidar o excesso de SnCl2 e formar cloreto mercuroso, Hg2Cl2(s). No entanto, essa solução apresenta também toxicidade aguda pelo GHS. As Equações 1 e 2 de semirreação e a Equação 3 simplificada da reação do íon dicromato com o íon Fe2+ em meio ácido são dadas a seguir. 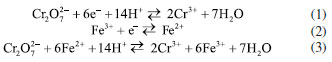 Em um experimento de titulação, a reação deve ser rápida e completa, para minimizar erros e obter resultados exatos. Essas condições devem também ser observadas na microtitulação. Nesse caso, a constante K1 da reação é calculada em sala de aula segundo a Equação 4 e os alunos podem verificar seu valor elevado (5,2 × 1046).  onde 6 é o número de elétrons trocados (n = 6), ΔEº é a diferença de potencial padrão da reação (+0,46 V), R é a constante universal dos gases perfeitos (8,3145 J K-1 mol-1), ℱ é o Faraday (96500 C) e T é a temperatura (298,15 K). Os experimentos foram feitos com uma solução padrão de K2Cr2O7 (Vetec, Brasil) na concentração de 0,00104 mol L-1 em meio de ácido sulfúrico 1:3 (v v-1), o que corresponde a uma concentração do titulante 100 vezes mais baixa do que aquela empregada na metodologia clássica. Aplicação da dicromatometria em microescala O experimento de microtitulação foi aplicado a uma turma mista de 13 estudantes dos cursos de Química, Engenharia Química e Farmácia, durante a aula de 3 horas de Química Analítica Quantitativa Experimental, entre o quarto e quinto período da faculdade. Ao mesmo tempo, outra turma com mesmo número de alunos, executou o experimento clássico de dicromatometria proposto na matriz curricular. Em um primeiro momento, os alunos que fizeram o experimento de microtitulação formaram 5 grupos de duas ou três pessoas e os alunos foram familiarizados com o uso de micropipetas de volumes de 50 e de 5 µL, usando um béquer com água e uma balança analítica com erro de 0,0001 g. Cada aluno avaliou a sua própria habilidade a partir de repetições de pesagem, sendo considerada adequada uma massa repetida com desvios padrões relativos inferiores a 5% (50 µL) ou 10% (5 µL). Autores destacam que o uso de amostras e exemplos do cotidiano facilita a compreensão da linguagem química e dos processos envolvidos.24 Desta forma, optou-se usar como amostra o suplemento alimentar Vitafer® contendo 40 mg de ferro (EMS, Brasil), de acordo com informações do fabricante. O uso desse suplemento tem como vantagens a facilidade de extração do ferro e o baixo custo, além de despertar o engajamento dos alunos, por ser um suplemento comum. O preparo de amostra feito pelos alunos começou pela trituração de 2 comprimidos do suplemento, usando gral e pistilo e transferência do sólido para um béquer, seguido da adição de 10 mL de HCl (6 mol L-1) e agitação durante 5 min. Em seguida, a solução foi filtrada com funil e filtro de celulose (4-12 µm, Unifil, Brasil) para um balão volumétrico de 100,0 mL e o papel filtro foi lavado com água destilada. Por fim, a solução foi avolumada com água destilada e identificada como "solução A". O experimento de microtitulação foi feito em uma placa de toque de porcelana com 12 cavidades (4 × 3), após numeração das cavidades em ordem crescente da esquerda para a direita e de cima para baixo (n: 1 até 12) conforme mostra a Figura 3.
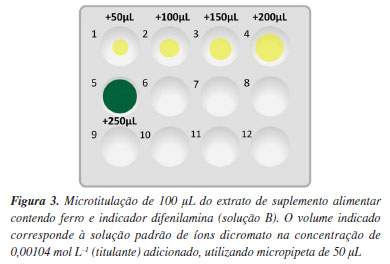
Uma alíquota de 10 mL da solução A foi transferida para um béquer, e 3 gotas de difenilamina foram adicionadas como indicador do ponto final da reação, constituindo assim a "solução B". Em cada cavidade da placa de toque, os alunos transferiram 100 µL da solução B contendo íons Fe2+, e foram adicionando incrementos de (n × 50 µL) da solução de dicromato a 0,00104 mol L-1, a partir da primeira cavidade, até observarem a virada do indicador (Figura 3). Desta forma, o volume do titulante no ponto final é a soma dos volumes da solução de íons dicromato transferidos com a micropipeta. A placa de toque foi lavada e todos os rejeitos foram guardados para comparação do volume gerado com a técnica clássica. Em seguida, uma segunda titulação foi feita, adicionando a mesma quantidade da solução B (100 µL) e incrementos de 5 µL da solução padrão de íons dicromato a partir do volume anterior à virada do indicador (Figura 3). Assim, o volume do ponto final pôde ser determinado com uma precisão de três algarismos significativos. Um exemplo é dado na Figura 4.
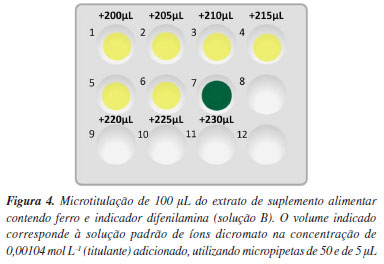
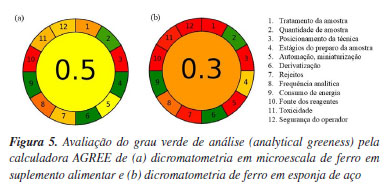
As vantagens do uso da microescala podem ser visualizadas empregando a calculadora AGREE.25 A Figura 5 mostra os resultados obtidos com a microtitulação e com o método clássico, onde a diminuição dos impactos ambientais fica evidente com o uso da microescala. Os parâmetros usados para a microtitulação consistiram em um tratamento externo de 0,2 g amostra com menos de 3 etapas, a determinação miniaturizada e não-automatizada de um analito em triplicata durante uma hora, sem derivatização, usando 3 mL de solução tóxica (dicromato) e gerando um resíduo de 10 mL por titulação. Os parâmetros usados para o método clássico diferiram no número de etapas (6), na não-miniaturização, nos volumes aproximados de solução de dicromato (30 mL) e de rejeito (130 mL por titulação), considerando a adição de mercúrico que é bioacumulativo e persistente no meio ambiente.
Avaliação da aprendizagem Os alunos avaliaram a aula em dois tempos. Logo após o término da aula, os alunos responderam às duas primeiras questões de um formulário eletrônico desenvolvido pelo monitor e disponibilizado via Google Classroom, conforme a Tabela 1.
O uso de formulários é comum em projetos de Monitoria, como devolutiva sobre a aula ministrada pelo monitor aos alunos participantes, sob supervisão do professor orientador. Com isso, pôde-se observar o desenvolvimento de habilidades como o uso de micropipetas e o entendimento do aluno sobre a diminuição da quantidade de rejeito tóxico gerado, seguindo os princípios da QAV. Em seguida, cada aluno elaborou um relatório sobre a prática, no qual usou os microvolumes encontrados pelo seu grupo para calcular a massa de ferro determinada no comprimido do suplemento alimentar e a porcentagem de concordância com o rótulo. Finalmente, os alunos responderam às questões 3 e 4 do formulário. Desta forma, foi possível avaliar os conhecimentos adquiridos pelos alunos sobre a teoria da dicromatometria e sua aplicação à microtitulação.
RESULTADOS E DISCUSSÃO Formulários eletrônicos As respostas obtidas a partir da Tabela 1 estão apresentadas na Figura 6.
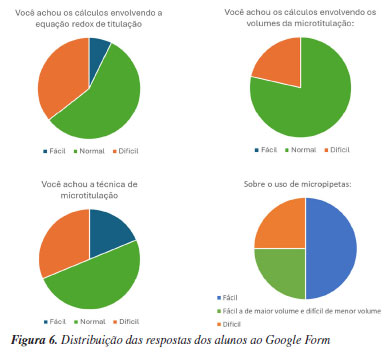
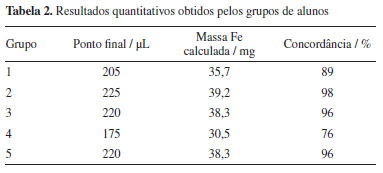
Em geral, a maioria dos alunos (68,8%) não sentiu dificuldade adicional na técnica de microtitulação em relação aos métodos clássicos de titulação de oxirredução. Por outro lado, muitos alunos comentaram sobre os benefícios da técnica e da lógica associada à QAV, que permite menor exposição aos reagentes de elevada toxicidade e geração de um menor volume de rejeitos. Ademais, o experimento proporcionou, para muitos alunos, a familiarização com o uso de micropipetas e essa etapa foi considerada normal ou fácil (75%) pela maioria. As dificuldades comentadas foram relativas à necessidade de atenção e ao aspecto repetitivo do uso das micropipetas. Desta forma, o uso de micro-volumes não teve um impacto importante na compreensão dos cálculos, pois 78,6% dos alunos acharam esses cálculos "normal", e 64,2% não apresentaram dificuldade com as equações envolvidas. Resultados quantitativos Os alunos elaboraram relatórios individuais a partir dos dados obtidos pelos seus respectivos grupos. A massa de ferro por comprimido (mg) foi calculada segundo a Equação 5 e a Equação 6 foi usada para calcular a concordância entre a massa obtida experimentalmente e a esperada, conforme rótulo (40 mg):  onde VCr2O72- é o volume do dicromato, VFe2+ é o volume da solução de íons Fe2+ (100 µL da solução B), e MFe é a massa atômica do ferro (55,845 u). A Tabela 2 apresenta os resultados por grupo, que foram satisfatórios, especialmente considerando que os alunos estavam tendo seu primeiro contato com a técnica de microtitulação, com exceção do grupo 4, que apresentou um resultado mais discrepante.
Desta forma, o experimento, que foi desenvolvido por um monitor de graduação sob a supervisão de seu professor e demorou cerca de 2 h e 30 min, gerou resultados quantitativos e exatos. Esse experimento estimulou o desenvolvimento e/ou adaptação de metodologias mais alinhadas com os preceitos da QAV em projetos de monitoria, no quadro das aulas de laboratório do curso de Química Analítica Quantitativa. Rejeitos da técnica Como parte do experimento, foi solicitado que cada grupo de alunos registrasse o volume total da solução de íons dicromato utilizada. O volume médio dos grupos foi em torno de 3 mL, o que totalizou 15 mL de K2Cr2O7 na concentração de 0,00104 mol L-1 para a turma. Adicionalmente, cada grupo recolheu seus rejeitos, totalizando cerca de 200 mL, com as lavagens. No mesmo dia da aula relatada, em outro laboratório, o experimento com a metodologia clássica foi realizado, e os rejeitos foram também separados. Ao final dos experimentos, os alunos compararam os volumes de rejeitos produzidos e puderam perceber a diferença não só de volume, mas também de cor, sendo o da prática de microtitulação, incolor, conforme mostra a Figura 7.

Ademais, a solução de K2Cr2O7 restante pôde ser facilmente tratada com uma solução de tiossulfato de sódio (Na2S2O3) na concentração de 0,1 mol L-1, de forma a reduzir o íon dicromato ao cátion Cr3+, que apresenta uma toxicidade muito mais baixa. O fato de ter uma solução mais diluída de íons dicromato facilita seu tratamento, pois o laboratório acumula a solução de tiossulfato, devido a outra prática de titulação redox (iodometria). Em resumo, para facilitar o entendimento, a Tabela 3 mostra uma comparação entre a dicomatometria clássica e a dicromatometria em microescala proposta neste trabalho.
CONCLUSÕES O experimento de microtitulação para determinação de ferro em suplemento alimentar por dicromatometria desenvolvido neste trabalho mostrou-se eficaz na introdução aos conceitos da Química Analítica Verde para alunos dos cursos de graduação em Química, Engenharia Química e Farmácia. Realizado em aula prática, o experimento reduziu a exposição dos alunos ao dicromato de potássio e eliminou o uso de HgSO4, também muito tóxico, ao substituir a amostra de palha de aço por comprimidos de sulfato ferroso. O treinamento prévio no uso de micropipetas e o emprego de placas de toque facilitaram a observação do ponto final e a compreensão dos mecanismos de microtitulação. Os resultados obtidos pelos alunos foram concordantes com as especificações dos rótulos dos suplementos. Através de questionários, os alunos indicaram que a microtitulação não apresentou dificuldades adicionais em comparação aos métodos clássicos, mas destacaram a redução significativa do volume e da toxicidade dos resíduos. Enfim, espera-se que este trabalho promova um maior engajamento e interesse de professores e alunos em técnicas analíticas mais sustentáveis.
DECLARAÇÃO DE DISPONIBILIDADE DE DADOS Os autores afirmam que todos os dados estão disponíveis no texto.
AGRADECIMENTOS Os autores agradecem o Programa de Monitoria da Universidade Federal Fluminense (UFF) pela bolsa e o Departamento de Química Analítica da UFF e a UFF, pela infraestrutura, os materiais e reagentes disponibilizados. Flávia F. C. Marques agradece também a Fundação de Amparo à Pesquisa do Estado do Rio de Janeiro (FAPERJ) pelo apoio financeiro (processo - 26/200.523/2023).
REFERÊNCIAS 1. Anastas, P. T.; Warner, J. C.; Green Chemistry: Theory and Practice; Oxford University Press: Oxford, 1998. 2. USEPA, Green Chemistry, https://www.epa.gov/greenchemistry, acessado em julho 2025. 3. Collins, T. J.; J. Cleaner Prod. 2017, 140, 93. [Crossref] 4. de la Guardia, M.; Garrigues, S.; Handbook of Green Analytical Chemistry, 1st ed.; Wiley: New York, 2012. 5. Kurowska-Susdorf, A.; Zwierżdżyński, M.; Bevanda, A. M.; Talić, S.; Ivanković, A.; Płotka-Wasylka, J.; TrAC, Trends Anal. Chem. 2019, 111, 185. [Crossref] 6. Płotka-Wasylka, J.; Kurowska-Susdorf, A.; Sajid, M.; de la Guardia, M.; Namieśnik, J.; Tobiszewski, M.; ChemSusChem 2018, 11, 2845. [Crossref] 7. Lipscher, J.; Chimia 2023, 77, 659. [Crossref] 8. Soares, M. H. F. B.; Mesquita, N. A. S.; Rezende, D. B.; Quim. Nova 2017, 40, 656. [Crossref] 9. Brandão, J. B.; Bouzon, J. D.; dos Santos, T. C.; Pereira, V.; Chrispino, Á.; Amazônia - Revista de Educação em Ciências e Matemáticas 2018, 14, 59. [Crossref] 10. de Almeida, Q. A. R.; Silva, B. B.; Silva, G. A. L.; Gomes, S. S.; Gomes, T. N. C.; Amazônia - Revista de Educação em Ciências e Matemáticas 2019, 15, 178. [Crossref] 11. Ventapane, A. L. S.; dos Santos, P. M. L.; Quim. Nova Esc. 2021, 43, 201. [Crossref] 12. Fung, F. M.; Widyantoro, C.; Li, S. F. Y.; Anal. Chem. 2024, 96, 6863. [Crossref] 13. Delgado, P.; Luna, C. A.; Dissanayaka, A.; Oshinowo, O.; Waggoner, J. J.; Schley, S.; Fernandez T.; Myers, D. R.; Lab Chip 2024, 24, 2176. [Crossref] 14. Cai, L.; Ouyang, Z.; Huang, X.; Xu, C.; J. Chem. Educ. 2020, 97, 1566. [Crossref] 15. Huang, J.; Cai, L.; J. Chem. Educ. 2022, 99, 3607. [Crossref] 16. Cai, L.; Ouyang, Z.; Song, J.; Yang, L.; ACS Omega 2020, 5, 18935. [Crossref] 17. Dias, L. G. A.; Duarte L. C.; Pinheiro, K. M. P.; Moreira, N. S.; Coltro, W. K. T.; Talanta Open 2023, 7, 100216. [Crossref] 18. Lin, X.; Jin, X.; Xu, C.; Lai, H.; Lin, M.; Ren, N.; Cai, L.; J. Chem. Educ. 2023, 100, 1997. [Crossref] 19. Greener, J.; Tumarkin, E.; Debono, M.; Dicks, A. P.; Kumacheva, E.; Lab Chip 2012, 12, 696. [Crossref] 20. Das, K. R.; Antony, M. J.; J. Chem. Educ. 2022, 99, 892. [Crossref] 21. ASTM D1252-06: Standard Test Method for Chemical Oxygen Demand (Dichromate Oxygen Demand) of Water; ASTM Iinternational, Pennsylvania, 2020. [Crossref] 22. Rao, G. G.; Sastri, T. P.; Fresenius' Z. Anal. Chem. 1956, 152, 270. [Crossref] 23. Skoog, D.; West, D.; Holler, J.; Crouch, S.; Fundamentos de Química Analítica, 1ª ed.; Cengage, 2005. 24. Hamer, M.; Hamer, M.; Vago, M. J.; Denis, M. F. L.; J. Chem. Educ. 2024, 101, 205. [Crossref] 25. Pena-Pereira, F.; Wojnowski, W.; Tobiszewski, M.; Anal. Chem. 2020, 92, 10076. [Crossref]
Editor Associado responsável pelo artigo: Nyuara A. S. Mesquita |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access







