Artigo
|
|
| Análise quimiossistemática da família Myristicaceae: a via mista (acetato/chiquimato) Chemosystematic analysis of the Myristicaceae family: the mixed pathway (acetate/shikimate) |
|
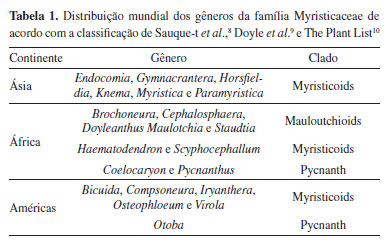
Raquel M. de S. N. SampaioI,* I. Laboratório de Ciências Químicas, Centro de Ciência e Tecnologia, Universidade Estadual do Norte Fluminense Darcy Ribeiro, Avenida Alberto Lamego 2000, 28013-602 Campos dos Goytacazes - RJ, Brasil Recebido: 28/02/2025 *e-mail: rmsn17@pq.uenf.br The Myristicaceae family, belonging to the order Magnoliales, comprises of 21 genera and 1144 species distributed in the Americas, Africa and Asia. The phenolic chemical constituents of this taxon stand out, mainly in Myristica fragrans, which is known worldwide for its nutmeg spice. This study aimed to analyze and explore the chemical information obtained from micromolecules derived from the mixed pathway, contributing to the chemosystematics and chemometrics of the family. The methodology employed for the analysis of evolutionary parameters was that of Prof. Gottlieb. A bibliographical survey of the special metabolites of each genus was carried out, using Scifinder as a database, 3392 works published between 1945 and 2025. An occurrence number (ON) of 355 special metabolites from the mixed pathway was identified, distributed in only six genera: Horsfieldia (ON = 68), Iryanthera (ON = 120), Knema (ON = 76), Myristica (ON = 22), Pycnanthus (ON = 12) and Virola (ON = 57); bioproducers of arylflavans, aurones, chalcones, diarylpropanoids, dihydroflavonol, stilbenes, flavones, flavones, flavonones, isoflavonoids, and proanthocyanidins. These metabolic categories are mostly unprotected from phenolic protection. Chemometric analysis revealed that the genera can be grouped according to their chemical characteristics, showing a high degree of similarity within the taxa. INTRODUÇÃO Do ponto de vista morfológico, a família Myristicaceae da ordem das Magnoliales é considerada uma das mais primitivas do grupo das Angiospermas.1,2 Encontra-se entre as dez famílias de árvores mais diversas e importantes das florestas tropicais úmidas de terras baixas, facilmente identificáveis pelo aroma característico das folhas, pela cor vermelha da seiva e dos seus frutos, os quais possuem sementes envoltas por um arilo vermelho, rico em lipídios fenólicos, que servem como alimento para animais.3-5 As espécies desse táxon são árvores ou arbustos perenes que podem crescer até 40 m de altura.6,7 A família é composta por 21 gêneros e 1144 espécies subdivididas em três clados, Mauloutchioids, Myristicoids e Pycnanth, distribuídos em florestas de planícies das regiões tropicais e subtropicais dos continentes africano, americano e asiático, como resumido na Tabela 1.8-10
As espécies do gênero Myristica são conhecidas na Ásia, África e América do Sul, destacando-se pelas suas especiarias, como a nozmoscada, e seus óleos essenciais para produção de cosméticos.11 Por outro lado, Pycnanthus e Virola são conhecidas pelo potencial medicinal, utilizadas nas formas de chás, para tratar problemas gastrointestinais, cataplasmas e decocções para feridas e dermatites, além de serem exploradas devido à madeira.12-15 No Brasil, a família Myristicaceae é representada por seis gêneros, Compsoneura, Iryanthera, Myristica, Osteophloeum, Otoba e Virola, 65 espécies, com 12 endêmicas.16,17 Os principais e mais explorados gêneros desse táxon são Iryanthera, conhecido popularmente como "ucuubarana e ucuuba-punã" e Virola, conhecido como "ucuuba", ambos endêmicos e distribuídos por todo território nacional, principalmente na região amazônica. Porém, Virola é o gênero mais abundante nos biomas brasileiros e possui grande valor comercial devido à exploração de sua madeira.1,18 Desde o final da década de 1970, a família Myristicaceae tem sido objeto de diversos estudos químicos, ganhando notoriedade, principalmente, a partir das pesquisas conduzidas pelo professor Otto Gottlieb e seus colaboradores em 1979. O interesse em investigar essa família surgiu, em parte, pelo uso da casca, folhas e resinas de Virola para limpar feridas, tratar dermatites e para o preparo de rapé alucinógeno, o que despertou o interesse do professor Otto em relação à Myristicaceae. Assim, Gottlieb e sua equipe identificaram e caracterizaram diversas micromoléculas em gêneros como Compsoneura, Dialyanthera (atualmente conhecido como Otoba), Iryanthera e Virola. O trabalho levou à descoberta de uma nova classe de compostos químicos - as neolignanas - derivadas da via do chiquimato, tornando Gottlieb reconhecido internacionalmente.19-21 Investigar o perfil dos metabólitos especiais permite classificar e identificar espécies de acordo com as diferenças e semelhanças de suas composições bioquímicas, este estudo é conhecido como quimiossistemático ou quimiotaxonômico.22 O estudo quimiossistemático da família Myristicaceae parte do pressuposto desafio de contribuir para a compreensão desse táxon abundante nos biomas brasileiros. Apesar do vasto conhecimento químico disponível sobre suas espécies, esses dados ainda não foram utilizados como ferramenta em estudos quimiotaxonômicos. Assim, a abordagem quimiossistemática pretende contribuir para a compreensão das relações entre os gêneros dessa família. Em suma, este trabalho tem como objetivo analisar, explorar e contribuir com informações químicas sobre a família Myristicaceae, por meio da identificação do número de ocorrência de cada metabólito especial oriundo da via mista; pelos índices químicos particulares de oxidação e especialização do esqueleto molecular; índices químicos modulares, a partir dos parâmetros de avanço evolutivo de proteção por O-glicosilação, O-metilação e proteção total, além do parâmetro de avanço evolutivo de desproteção. Também foram analisados os índices de diversificação dos esqueletos moleculares dos metabólitos de cada gênero que bioproduz micromoléculas oriundas da via mista, além da razão flavona/flavonol. Após obtenção desses parâmetros quimiossistemáticos, foi possível correlacionar os clados e gêneros bioprodutores de metabólitos da via mista através de ferramentas quimiométricas. Destaca-se que há poucos estudos quimiotaxonômicos a despeito da família Myristicaceae, o que despertou interesse para elaboração deste trabalho.
PARTE EXPERIMENTAL A metodologia aplicada neste trabalho foi desenvolvida pelo professor Otto Gottlieb23,24 e seu grupo de pesquisa, recentemente revisada por nosso grupo de pesquisa Sousa25 e Batista.26 Inicialmente, realizou-se um levantamento bibliográfico a respeito de cada gênero da família Myristicaceae, utilizando o Chemical Abstracts para acessar as principais obras de referência disponibilizadas no indexador Scifinder, abrangendo o período de 1945 até 2022, empregando como palavras-chaves os nomes de cada gênero da família Myristicaceae: Bicuida, Brochoneura, Cephalosphaera, Coelocaryon, Compsoneura, Doyleanthus, Endocomia, Gymnacrantera, Haematodendron, Horsfieldia, Iryanthera, Knema, Maulotchia, Myristica, Osteophloeum, Otoba, Paramyristica, Pycnanthus, Scyphocephallum, Staudtia e Virola. Após análise criteriosa dos artigos publicados que realizaram estudos fitoquímicos dos gêneros da Myristicaceae, organizou-se as informações na primeira planilha eletrônica (Excel, Microsoft Corporation, versão 365) de dados gerais da família, visando delinear o perfil químico dos gêneros. Essa tabela foi estruturada em colunas identificadas por ano de publicação dos artigos, gêneros, espécies, nomes dos metabólitos especiais identificados, CAS, estrutura molecular, classe, tipo de extrato utilizado para o isolamento dos metabólitos especiais, parte da planta que foi isolada a micromolécula, a região geográfica que foi coletada o vegetal e as referências conforme mostra o exemplo da planilha na Tabela 2.
Depois do preenchimento dos dados da primeira planilha, filtrou-se as informações químicas principais de cada gênero da família e desenvolveu-se a segunda planilha eletrônica, a qual foi inserida informações dos metabólitos especiais oriundos da via mista de acordo com cada gênero, a estruturação dessa planilha é representada na Tabela 3.
É importante ressaltar que todas as micromoléculas identificadas na via mista tiveram suas estruturas analisadas individualmente pelos autores deste estudo, considerando a quantidade de grupos de proteção presentes no anel aromático, como a glicosilação (G) e a metilação (M), bem como o total de proteção do metabólito (Pt) e também o quanto este está desprotegido (D). Logo, foi possível calcular, por meio de planilhas eletrônicas, seus respectivos índices, como veremos no subtítulo "Índices químicos modulares". Em relação aos índices químicos particulares, estes também foram estudados de forma individual pelos autores, foi contabilizado manualmente os números de ligações carbono-heteroátomo (x), carbono-hidrogênio (h), a quantidade de átomos de carbono do esqueleto molecular (n), quantas ligações carbono-carbono foram quebradas (q) e formadas (f) em relação à micromolécula precursora, números de sistemas cíclicos formados envolvendo heteroátomos com relação ao mesmo precursor (c) e número de unidades carbônicas adicionais em relação ao mesmo precursor (u). Já os níveis de oxidação (O) e especialização (E) do esqueleto molecular, utilizou-se fórmulas matemáticas (Equações 1 e 2) conforme descrito no subtítulo "Índices químicos particulares", as quais foram lançadas no Excel para obtenção dos resultados. Por meio da segunda planilha, representada pela Tabela 3, também se determinou o número de ocorrência (NO) de cada micromolécula, o número de tipos estruturais (NT), cujo produto NO × NT resulta no índice de diversificação (ID) dos esqueletos moleculares das micromoléculas oriundas da rota biossintética mista ocorrentes na família Myristicaceae. Índices químicos particulares Os índices químicos particulares foram determinados através do nível de oxidação (O) e especialização do esqueleto (E) de cada micromolécula pertencente às categorias químicas identificadas na via mista da família Myristicaceae, de acordo com as Equações 1 e 2, pré-definidas por Gottlieb et al.24 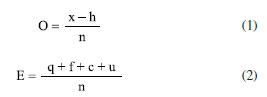 onde: x: número de ligações C-heteroátomo; h: número de ligações C-H; n: número de átomos de carbono do esqueleto molecular; q: número de ligações C-C quebradas em relação ao precursor; f: número de ligações C-C formadas em relação ao mesmo precursor; u: número de unidades carbônicas adicionais em relação ao mesmo precursor. Em seguida, obteve-se os parâmetros de avanço evolutivo de oxidação (AEO) e de especialização do esqueleto (AEE) de cada gênero, a partir de metabólitos especiais oriundos da rota biossintética mista ocorrentes em Myristicaceae conforme Equações 3 e 4. 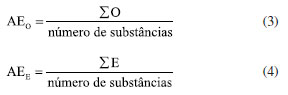 Índices químicos modulares Esses índices estão relacionados à presença de proteção e desproteção das hidroxilas ligadas ao anel aromático, os quais foram avaliados para cada uma das micromoléculas decorrentes da via mista, identificadas neste trabalho por meio de índices matemáticos chamados de índice de proteção por metilação (IM), índice de proteção por glicosilação (IG), índice de proteção total (IPt) e índice de desproteção (ID) conforme propõe Emerenciano27 e Gottlieb et al.24 nas Equações 5-8.  Após, também, por meio de planilhas eletrônicas, calculou-se os parâmetros de avanços evolutivos de glicosilação (AEG), metilação (AEM), proteção total (AEPt) e de desproteção (AED) de cada gênero que possui micromoléculas da via mista da família Myristicaceae, empregando as Equações 9-12. 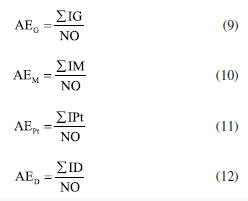 Por meio desse levantamento obteve-se a dimensão do quanto a via mista apresenta proteção fenólica e qual tipo dessa proteção da família Myristicaceae. Vale ressaltar que todas as Equações supracitadas dos índices químicos modulares e particulares foram lançadas em planilhas eletrônicas para obtenção dos resultados. Relação de ocorrência entre flavona e flavonol Verificou-se a relação percentual entre a bioprodução de flavona (fo) e flavonol (fl) nos gêneros de Myristicaceae que apresentaram metabólitos especiais oriundos da via mista. Essa relação é um importante parâmetro no estabelecimento da correlação entre morfologia e diversidade química (Equação 13). 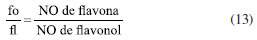 A análise estatística multivariada foi realizada por meio da principal análise de componentes (PCA) e análise de agrupamento hierárquico (HCA). Para análise de similaridade química, foi construída uma matriz de dados binária baseada na presença ou ausência de tipos e/ou subtipos de flavonoides. Os dados foram submetidos ao coeficiente de Jaccard e o agrupamento foi realizado pelo método de grupos de pares não ponderados com média aritmética (UPGMA). Todo o procedimento estatístico foi realizado no software R®, versão 4.0.2 (R Core Team, 2020), desenvolvido na Nova Zelândia. Destaca-se que não foram encontrados trabalhos publicados que abordassem o estudo quimiossistemático de toda a família Myristicaceae. Além disso, no levantamento bibliográfico realizado no Scifinder, abrangendo o período de 1945 a 2022, não foram identificados metabólitos especiais oriundos da via mista para os gêneros: Bicuida, Brochoneura, Cephalosphaera, Coelocaryon, Compsoneura, Doyleanthus, Endocomia, Gymnacrantera, Haematodendron, Maulotchia, Osteophloeum, Otoba, Paramyristica, Scyphocephallum e Staudtia, porém, no final do ano de 2022 foi publicado um trabalho intitulado "Antibacterial activity of flavonoids and triterpenoids isolated from the stem bark and sap of Staudtia kamerunensis Warb. (Myristicaceae)", o qual identificou metabólitos oriundos da via mista no gênero Staudtia, dados que ainda não foram incluídos nas análises dos parâmetros quimiossistemáticos.
RESULTADOS E DISCUSSÃO Avaliou-se, por meio do Chemical Abstracts, um total de 3392 trabalhos publicados acerca dos gêneros da família Myristicaceae, mas somente 426 estavam relacionados a análises fitoquímicas. Este estudo abrangeu os gêneros e as respectivas espécies da família Myristicaceae em todo território mundial. Esse táxon faz parte das principais famílias de árvores de grande porte, possuem preferência por ambientes com sombreamento, altas umidade e temperatura, características de florestas tropicais úmidas, sendo predominantes no Hemisfério Sul conforme a Tabela 1, especialmente nas áreas próximas à linha do Equador,28 porém, este estudo não irá comparar as composições químicas destas espécies de acordo com a localização geográfica das mesmas, deixando para uma próxima oportunidade. Dentre os 21 gêneros desse táxon, identificou-se que não havia estudos químicos divulgados na base de dados que foi utilizada como padrão, Scifinder, até o período final deste levantamento, para os seguintes gêneros: Bicuida, Compsoneura, Doyleanthus, Endocomia, Haematodendron, Maulotchia e Paramyristica, respectivamente. Os 426 artigos que apresentaram informações químicas foram criteriosamente avaliados, resultando na identificação de 2409 metabólitos especiais que foram isolados e caracterizados dentro da família Myristicaceae. Constatou-se o número de ocorrência de metabólitos especiais, oriundos da via do chiquimato (NO = 1132), via do acetato, (NO = 875), via mista (NO = 355) e outros tipos de micromoléculas (NO = 46) como alcalóides, polímeros, açúcares, fenóis dentre outros, as quais não foram alvo deste estudo quimiossistemático. Todavia, este trabalho, visa discutir somente o perfil químico dos metabólitos especiais oriundos da via mista, contribuindo e ampliando o conhecimento interdisciplinar entre a Química e a Biologia, além de avaliar a similaridade química entre os clados e gêneros dessa família por meio de parâmetros quimiossistemáticos e ferramentas quimiométricas. Número de ocorrência e tipos de categorias metabólicas identificadas na via mista da família Myristicaceae Antes da obtenção dos dados quimiossistemáticos subsequentes, foi necessário analisar de forma individual todas as 355 micromoléculas decorrentes da via mista da família Myristicaceae, por meio de uma ficha catalográfica, que se encontra no Material Suplementar. Inicialmente, a análise dos metabólitos especiais oriundos da via mista da família Myristicaceae resultou na identificação de uma grande diversidade estrutural de micromoléculas químicas presentes em 6 gêneros: Horsfieldia (número de espécies (E) = 10; NO = 68), Iryanthera (E = 11; NO = 120), Knema (E = 9; NO = 76), Myristica (E = 5; NO = 22) e Virola (E = 12; NO = 57), os quais são do clado Myristicoids; e o gênero Pycnanthus (E = 1; NO = 12), que é o clado Pycnanth. Por meio de estudos quimiotaxonômicos, dentre os gêneros estudados neste trabalho que bioproduzem micromoléculas da via mista, o Iryanthera possui maior ocorrência, enquanto Pycnanthus e Myristica apresentaram baixo número de ocorrência quando comparados aos demais gêneros Horsfieldia, Knema e Virola. A relação entre o número de ocorrência e a bioprodução de cada categoria metabólica decorrente da via mista pode ser observado na Figura 1.
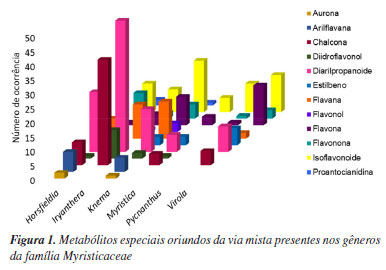
Os metabólitos especiais ocorrentes na via mista foram distribuídos em 12 categorias distintas: aurona, arilflavana, chalconas, diarilpropanóides, diidroflavonol, estilbenos, flavana, flavona, flavonol, flavonona, isoflavonoide e proantocianidina, respectivamente. Notou-se a ocorrência de aurona somente nos gêneros Horsfieldia e Knema, enquanto de chalconas foi observada em Horsfieldia, Iryanthera, Myristica e Virola. Apenas Pycnanthus não possuiu chalconas e nem diarilpropanoides. Vale ressaltar que as auronas, chalconas e diarilpropanóides são considerados marcadores de primitividade, mas não são comuns em todos os gêneros bioprodutores de micromoléculas da via mista, sendo pouco distribuídos na família Myristicaceae, revelando que há diferenças evolutivas entre os gêneros que possuem essa rota biossintética. O gênero Iryanthera é o que possui maior bioprodução de chalconas e diarilpronanóides, característica de angiospermas basais, indicando que determinadas rotas biossintéticas desse gênero foram preservadas, portanto, este gênero manteve características bioquímicas antigas ao longo da evolução. Essas características provavelmente foram mantidas devido a localização dessas espécies, que encontram-se, preferencialmente, na parte dossel superior das florestas, áreas de pouca competição de luz solar e de difícil acesso, portanto, o ambiente dessas espécies está mais preservado, não precisando criar meios de sobrevivência, rotas biossintéticas, muito diferente do que já são acostumadas.29-31 Verificou-se a ocorrência de isoflavonóides e flavona, metabólitos mais evoluídos32 nos seis gêneros dessa via, principalmente, nos gêneros Knema e Virola. As espécies do gênero Knema são nativas de regiões sub-tropicais da Ásia e ilhas do Pacífico, vivem nos sub-bosques das florestas tropicais úmidas, cujo habitat tem menor incidência de luz, ocorrendo competição entre as espécies e consequentemente ao crescimento lento das mesmas. Os sub-bosques também são as regiões preferidas de fungos e bactérias, então, esse vegetal acaba se especializando mais na defesa química.33 Por outro lado, o gênero Virola é encontrado nas florestas tropicais da América do Sul, especialmente na região amazônica e atingem o dossel superior das florestas. Essas espécies crescem rápido para procurar luz, então, se preocupam mais em crescer do que em se defender como ocorre com Knema, porém, as árvores do gênero Virola são muito conhecidas por sua madeira de qualidade, o que as torna alvo de exploração madeireira, representando uma ameaça para a biodiversidade da região. Provavelmente, esse fato fez com que esse gênero começasse a criar mecanismos bioquímicos para sua sobrevivência na floresta.34,35 Esse estudo quimiossistemático revelou que os gêneros Knema e Virola possuem metabólitos da via mista mais especializados, mais evoluídos que os demais gêneros dessa família, mesmo a família apresentando um quantitativo baixo de flavonol que também indica avanço evolutivo. Assim, o número de ocorrência das categorias metabólicas da via mista está disposto na Figura 2.
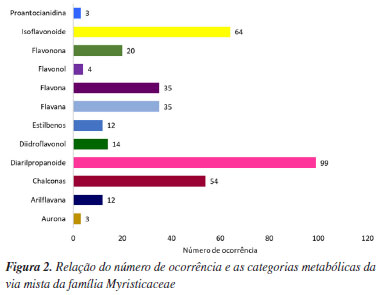
Observa-se a presença preponderante de diarilpropanóides (NO = 99), seguido de isoflavonoides (NO = 64) e chalconas (NO = 54), enquanto o número de ocorrência de flavana e flavona foi de 35. A menor abundância das micromoléculas da via mista está nas categorias da aurona e proantocianidina (NO = 3), flavonol (NO = 4), arilflavana e estilbenos (NO = 12), diidroflavonol (NO = 14) e flavonona (NO = 20), revelando baixa ocorrência de metabólitos mais especializados. Relação flavona/flavonol Um dos principais parâmetros que relacionam as características químicas e morfológicas em um táxon é a relação entre os números de ocorrências de flavona (fo) e flavonol (fl). Essa razão fo/fl pode ser correlacionada aos índices de Sporne (IS) e herbacidade (IH) em um táxon. Em Myristicaceae a razão fo/fl foi de 8,75, o índice de Sporne é de 34, e o de herbacidade é de 12,5. De acordo com Geraldo e Kaplan,36 a maioria dos táxons arbóreos e arbustos que possuem IH ≤ 50, IS ≤ 55 e fo/fl < 1, são morfologicamente mais primitivos. Isso indica que a família Myristicaceae é uma das famílias mais primitivas de angiospermas (IS = 34) e ainda revela que é extremamente lenhosa, tendo o predomínio de árvores sobre arbustos, pois seu índice de Sporne é 12,5, portanto, menor que 25. Em contrapartida, a razão fo/fl em Myristicaceae é maior que 1 (8,75), indicativo que a família produz mais flavona que flavonol, o que é uma tendência em famílias mais evoluídas contradizendo o que demonstra os índices de Sporne e herbacidade da família. Esse resultado também contraria a teoria de que é raro, em táxons extremamente lenhosos, a razão fo/fl ser maior que 1, geralmente, essa razão é inferior a 1, o que corrobora com relatos anteriores na literatura, os quais destacam a complexidade e a dificuldade em se estabelecer relações morfológicas consistentes dentro da família Myristicaceae.36 Ao analisar os gêneros de Myristicaceae que bioproduzem flavonas e flavonóis, destaca-se apenas Iryanthera (NOflavona = 4 e NOflavonol = 1) cuja razão fo/fl é de 4, e Knema (NOflavona = 10 e NOflavonol = 3) com a razão fo/fl de 3,33, portanto, nesse requisito, os gêneros seguem a mesma linha geral da família. Não foram identificados a presença de flavonóis para os demais gêneros analisados Horsfieldia, Myristica, Virola e Pycnanthus. Em geral, os flavonoides são importantes marcadores quimiossistemáticos. Famílias da mesma ordem Magnoliales, geralmente, apresentam elevadas ocorrências de micromoléculas oriundas da via mista, indicando que estão aprimorando sua biossíntese, que continuam evoluindo, o que não é amplamente observado em Myristicaceae, pois há baixa ocorrência de micromoléculas da via mista (chiquimato/acetato) e alta ocorrência de metabólitos da via do chiquimato. Sem embargo, o metabólito especial mais abundante da via mista é o diarilpropanóide, considerado um marcador quimiotaxonômico de primitividade das plantas. Índice de diversificação molecular e categorias metabólicas Os seis gêneros aqui estudados apresentaram boa variabilidade estrutural, apresentando um índice de diversificação total de 3043 como demonstrado na Tabela 4.
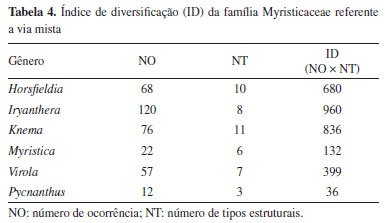
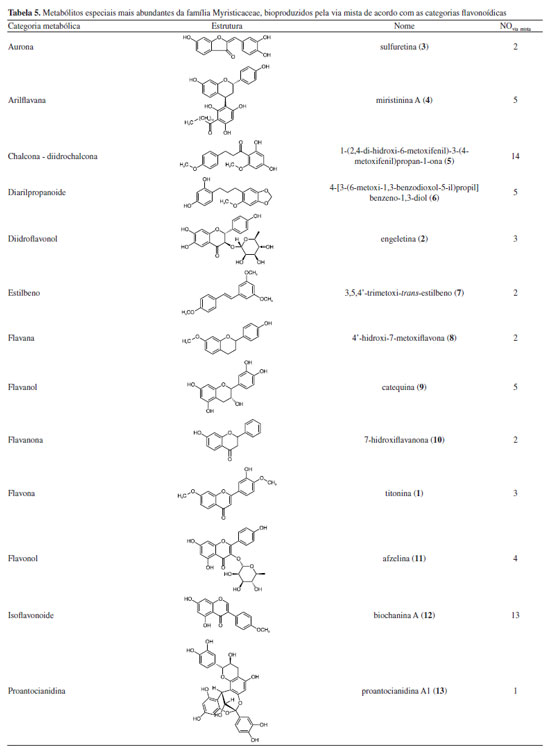
O gênero Iryanthera revelou maior índice de diversificação do esqueleto apesar de apresentar menor número de categorias estruturais quando comparado ao Knema, isso poderia indicar que Iryanthera é mais evoluída que Knema, porém Iryanthera é superabundante em metabólitos que sinalizam a primitividade das espécies como chalcona e diarilpropanoide, enquanto Knema apresenta metabólitos mais especializados. Isso pode indicar uma provável estagnação quanto à diversificação dos esqueletos micromoleculares de Iryanthera. É notória a baixa ocorrência de metabólitos especiais da via mista e a baixa diversidade molecular do gênero Myristica nesta via. As principais categorias metabólicas bem como os metabólitos mais abundantes bioproduzidos pela via mista em Myristicaceae são demonstrados na Tabela 5. É importante destacar que não foi considerada a estereoquímica das estruturas químicas apresentadas na Tabela 5.
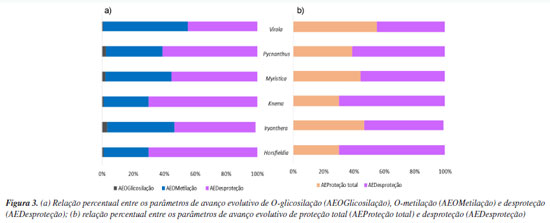
As micromoléculas oriundas da via mista presentes em Myristicaceae apresentaram uma ampla diversificação estrutural conforme ilustrados na Tabela 3. O metabólito mais abundante é 2',4'-diidroxi-4,6'-dimetoxidiidrochalcona (5) da categoria das chalconas, característica de primitividade das espécies e a proantocianidina A1 (13) é a menos ocorrente. Por outro lado, a categoria molecular mais abundante é diarilpropanoide, tendo o metabólito 1,3-benzenediol,4-[3-(6-methoxy-1,3-benzodioxol-5-yl)propyl] (6) como mais abundante. Adicionalmente, as micromoléculas que apresentaram proteção fenólica contra oxidação por O-metilação foram as 5, 6, 7, 8 e 1, já as com proteção contra oxidação por O-glicosilação foram apenas nos metabólitos 2 e 11, no entanto, a família é caracterizada, majoritariamente, por apresentar suas hidroxilas desprotegidas da ação oxidativa. A proteção fenólica dos flavonoides de Myristicaceae corresponde aos parâmetros de avanço evolutivo de proteção contra o estresse oxidativo e desproteção do anel aromático, ficando suscetível à oxidação, também chamados de índices químicos moduladores. Parâmetros de avanço evolutivo Os metabólitos oriundos da rota biossintética mista da família Myristicaceae são majoritariamente desprotegidos da ação oxidativa, mas quando apresentaram proteção fenólica contra oxidação, ocorreu preferencialmente pelo grupos O-metilação e/ou O-glicosilação, conforme ilustrado na Figura 3.
Os metabólitos especiais dos gêneros Horsfieldia e Knema são os mais desprotegidos, ambos com 69,82% de desproteção, enquanto em Virola, os metabólitos são mais protegidos (55,32%). A proteção por O-metilação dessas micromoléculas é mais abundante no gênero Virola (55,32%), seguido por Iryanthera (52,97%), Myristica (42,58%), Pycnanthus (36,11%), Horsfieldia (28,99%) e Knema (28,99%). A proteção por O-glicosilação é mais abundante em Iryanthera (3,21%), percebendo uma preferência pelo mecanismo de proteção por O-metilação nos metabólitos. Uma das características de angiospermas basais é a ausência de proteção fenólica, mas, embora a maioria das hidroxilas dos flavonoides dessa via sejam desprotegidas, notou-se um aperfeiçoamento em um mecanismo de proteção fenólica, alcançando mais de 40% de proteção total. Similaridade química dos gêneros da família Myristicaceae A partir dos parâmetros quimiossistemáticos da família Myristicaceae, especificamente, dos metabólitos especiais da via mista dos gêneros Horsfieldia, Iryanthera, Knema, Myristica e Virola (clado Myristicoids), e, Pycnanthus (clado Pycnanthus), foi possível analisar a similaridade entre esses gêneros e seus respectivos clados por meio da análise quimiométrica como ilustrado na Figura 4.
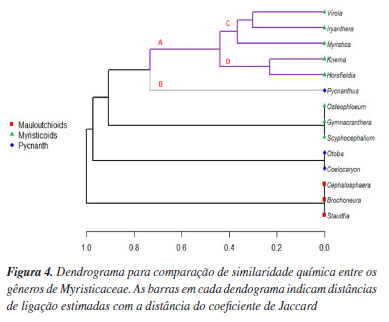
Os clados que biossintetizam metabólitos oriundos da via mista são separados em dois grupos, A e B. O grupo A, corresponde aos gêneros do clado Myristicoids e o grupo B ao gênero do clado Pycnanth. O grupo A se dividiu em grupos C e D. No grupo C, observou-se maior correlação entre os gêneros Virola e Iryanthera, ambos são bioprodutores de chalcona, diarilpropanóide, flavana, flavona, flavonona e isoflavonona, majoritariamente, desprotegidos de proteção fenólica. Ainda no grupo C, o gênero Myristica, está mais próximo de Iryanthera, provavelmente, por ambos bioproduzirem diidroflavonol, além de biossintetizarem chalcona, diarilpropanóide, flavona e isoflavonoide, predominantemente, desprotegidos de proteção fenólica. O grupo D revelou alta similaridade entre os gêneros Knema e Horsfieldia, únicos biprodutores de aurona e arylflavana, adicionalmente, bioproduzem diarilpropanóide, diidroflavonol, flavana, flavona, flavonona e isoflavonoide, principalmente, com suas hidroxilas fenólicas desprotegidas. Assim, os seis gêneros identificados como bioprodutores de metabólitos especiais oriundos da via mista, apresentaram menos de 50% de proteção fenólica por O-metilação e menos de 8% de proteção por O-glicosilação.
CONCLUSÕES Foram identificados um número de ocorrência de 355 metabólitos especiais oriundos da via mista na família Myristicaceae. Houve registro de espécies (E) e número de ocorrência (NO) nos gêneros Horsfieldia (H) (EH: 10; NOH: 20), Iryanthera (I) (EI: 11; NOI: 120), Knema (K) (EK: 9; NOK: 76), Myristica (M) (EM: 5; NOM: 55), Pycnanthus (P) (EP: 1; NOP: 12) e Virola (V) (EV: 12; NOV: 52). Observou-se a presença de categorias moleculares como arilflavana (NO = 12), aurona (NO = 3), chalconas (NO = 54), diarilpropanoides (NO = 99), diidroflavonol (NO = 14), estilbenos (NO = 12), flavana (NO = 35), flavona (NO = 35), flavonona (NO = 20), flavonol (NO = 4), isoflavonoide (NO = 64) e proantocianidina (NO = 3), respectivamente. Dentre as categorias moleculares bioproduzidas pela via mista, destacam-se os diarilpropanóides como provável marcador quimiotaxonômico. Os seis gêneros da família Myristicaceae mencionados anteriormente, bioprodutores de metabólitos especiais da via mista, apresentaram, em sua maioria, grupos fenólicos desprotegidos, com exceção do gênero Virola. Foram identificados parâmetros de avanço evolutivo relacionados à proteção por grupos de O-metilação e O-glicosilação nesses mesmos gêneros. A análise quimiossistemática da família Myristicaceae desempenha um papel fundamental na compreensão da diversidade biológica, classificatória e funcional das espécies que a compõem. Por meio da identificação de metabólitos especiais como diarilpropanóides, chalconas, isoflavonoides, flavonas, flavonol foi possível estabelecer relações evolutivas entre os gêneros e espécies dessa família, revelando rotas biosssintéticas que se mantiveram preservadas como as do gênero Iryanthera, que prevalece a bioprodução de metabólitos como chalconas e diarilpropanoides, considerados marcadores químicos de angiospermas basais, mas também revelou rotas metabólicas que tiveram que sofrer algumas adaptações como as dos gêneros Knema e Virola, bioprodutores de isoflavonoides, flavonol e flavona, metabólitos mais especializados. Esse trabalho também fornece subsídios para o campo da conservação ambiental, a diversidade química pode indicar regiões e espécies que são prioritárias para conservação. Também pode contribuir para prospecção de compostos bioativos com potencial terapêutico, uma vez que gêneros como Myristica e Virola apresentam metabólitos, como os flavanoides e diarilpropanoides, com atividades farmacológicas comprovadas. A análise quimiométrica dos parâmetros quimiossistemáticos revelou adequada separação dos clados, Myristicoids (Horsfieldia, Iryanthera, Knema, Myristica e Virola) e Pycnanth (Pycnanthus), bem como dos seus respectivos gêneros conforme suas características químicas. Esses resultados evidenciam uma alta similaridade dentro do táxon, demonstrando que método utilizado é eficaz, satisfatório e coerente com os dados químicos analisados. Assim, não se pode afirmar que novos metabólitos oriundos dessa rota não tenham sido descobertos nos demais gêneros supracitados. Mas vale ressaltar que os dados analisados até o momento representam um panorama abrangente das informações químicas disponíveis a respeito da família Myristicaceae. Este trabalho contribui significativamente para a quimiossistemática da família Myristicaceae, bem como para análise quimiométrica desse táxon. Os metabólitos especiais oriundos de rota metabólica mista forneceram insights sobre a evolução química da família e auxiliam na correlação entre seus clados e gêneros, corroborando com a taxonomia e filogenia da família Myristicaceae.
MATERIAL SUPLEMENTAR O material suplementar desse trabalho está disponível em http://quimicanova.sbq.org.br/, como arquivo em PDF e de livre acesso.
DECLARAÇÃO DE DISPONIBILIDADE DE DADOS Além dos dados apresentados no texto e no Material Suplementar, também disponibilizamos o endereço URL do conjunto de dados que apresentam os índices químicos particulares e moduladores, e o número de ocorrência dos metabólitos especiais oriundos da via mista da família Myristicaceae: https://docs.google.com/spreadsheets/d/15ucWncyQv_K_PWwTbFUjnSqq2t3exRex/edit?usp= sharing&ouid=118220023232179798125&rtpof=true&sd=true Em caso de dúvidas, entrar em contato com o autor de correspondência.
AGRADECIMENTOS Agradecemos ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e a Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela bolsa de doutorado (código 001).
REFERÊNCIAS 1. Quintanilha, L. G.; Lobão, A. Q.; Rodriguésia 2017, 68, 85. [Crossref] 2. Chase, M. W.; Christenhusz, M. J. M.; Fay, M. F.; Byng, J. W.; Judd, W. S.; Soltis, D. E.; Mabberley, D. J.; Sennikov, A. N.; Soltis, P. S.; Stevens, P. F.; Bot. J. Linn. Soc. 2016, 181, 1. [Crossref] 3. Massoni, J.; Forest, F.; Sauquet, H.; Mol. Phylogenet. Evol. 2014, 70, 84. [Crossref] 4. Taylor, C. M.; Álvarez, W. D.; Biota Colombiana 2000, 1, 106. [Link] acessado em julho 2025 5. Santamaría-Aguilar, D.; Aguilar, R.; Lagomarsino, L. P.; PhytoKeys 2019, 134, 1. [Crossref] 6. Martins-da-Silva, R. C. V.; Silva, A. S. L.; Fernandes, M. M.; Margalho, L. F.; Noções Morfológicas e Taxonômicas para Identificação Botânica, 1ª ed.; Embrapa: Brasília, 2014. 7. Salihu, A. S.; Salleh, W. M. N. H. W.; Vietnam J. Chem. 2023, 61, 397. [Crossref] 8. Sauquet, H.; Doyle, J. A.; Scharaschkin, T.; Borsch, T.; Hilu, K. W.; Chatrou, L. W.; Thomas, A. L.; Bot. J. Linn. Soc. 2003, 142, 125. [Crossref] 9. Doyle, J. A.; Sauquet, H.; Scharaschkin, T.; Le Thomas, A.; Int. J. Plant Sci. 2004, 165, S55. [Crossref] 10. The Plant List, Myristicaceae, http://www.theplantlist.org/1.1/browse/A/Myristicaceae/, acessado em julho 2025 11. Longuefosse, J. L.; Nossin, E.; J.Ethnopharmacol. 1996, 53, 117. [Crossref] 12. Hiruma-Lima, C. A.; Batista, L. M.; de Almeida, A. B. A.; Magri, L. P.; dos Santos, L. C.; Vilegas, W.; Brito, A. R. M. S.; J. Ethnopharmacol. 2009, 122, 406. [Crossref] 13. Abrantes, M.; Mil-Homens, T.; Duarte, N.; Lopes, D.; Cravo, P.; Madureira, M. C.; Ferreira, M.-J. U.; Planta Med. 2008, 74, 1408. [Crossref] 14. Bascope, M.; Sterner, O.; Rev. Boliv. Quim. 2006, 23, 44. [Link] acessado em julho 2025 15. Carvalho, J. C. T.; Ferreira, L. P.; Santos, L. S.; Corrêa, M. J. C.; Campos, L. M. O.; Bastos, J. K.; Sarti, S. J.; J. Ethnopharmacol. 1999, 64, 173. [Crossref] 16. Kato, M. J.: A Distribuição de Lignoides e Policetídeos nos Frutos de Virola elongata (Benth) Warb. (Myristicaceae); Tese de Doutorado, Universidade de São Paulo, São Paulo, Brasil, 1989. [Link] acessado em julho 2025 17. Flora e Funga do Brasil, Myristicaceae R. Br., https://shre.ink/kVGe, acessado em julho 2025. 18. Sauquet, H.; Le Thomas, A.; Int. J. Plant Sci. 2003, 164, 613. [Crossref] 19. Gottlieb, O. R.; J. Ethnopharmacol. 1979, 1, 309. [Crossref] 20. Lopes, N. P.; Yoshida, M.; Kato, M. J.; Rev. Bras. Cienc. Farm. 2004, 40, 53. [Crossref] 21. Valderrama, J. C. M.; Phytochemistry 2000, 55, 505. [Crossref] 22. Mali, S.; Yadav, R.; Gauttam, V.; Sawale, J.; Toxicol. Int. 2023, 30, 121. [Crossref] 23. Gottlieb, O. R.; Micromolecular Evolution, Systematics and Ecology: An Essay into a Novel Botanical Discipline; Springer: Berlin, 1982. 24. Gottlieb, O. R.; Kaplan, M. A. C.; Borin, M. R. M. B.; Biodiversidade: um Enfoque Químico-Biológico; Editora UFRJ: Rio de Janeiro, 1996. 25. Sousa, A. L.: Análise Quimiossistemática da Família Moraceae; Tese de Doutorado, Universidade Estadual do Norte Fluminense Darcy Ribeiro, Campos dos Goytacazes, Brasil, 2016. [Link] acessado em julho 2025 26. Batista, L. C.: Quimiosistemática, Fitoquimica e Potencial Atividades Biológicas da Espécie Medicinal Virola bicuhyba Warb; Tese de Doutorado, Universidade Estadual do Norte Fluminense Darcy Ribeiro, Campos dos Goytacazes, Brasil, 2019. [Link] acessado em julho 2025 27. Emerenciano, V. P.; Ferreira, Z. S.; Kaplan, M. A. C.; Gottlieb, O. R.; Phytochemistry 1987, 26, 3103. [Crossref] 28. Adrianzén, U. M.; Revista Del Instituto de Investigaciones Tropicales 2010, 5, 29. [Link] acessado em julho 2025 29. da Silva, J. A. C.; da Silva, M. F.; Acta Amazonica 2008, 38, 207. [Crossref] 30. Conserva, L. M.; Yoshida, M.; Gottlieb, O. R.; Phytochemistry 1990, 29, 3986. [Crossref] 31. Wink, M.; Phytochemistry 2003, 64, 3. [Crossref] 32. Yonekura-Sakakibara, K.; Higashi, Y.; Nakabayashi, R.; Front. Plant Sci. 2019, 10, 943. [Crossref] 33. Giap, T. H.; Duc, P. M.; The, N. V.; Popova, M.; Bankova, V.; Hue, C. T.; Oanh, V. T. K.; Hang, N. T. M.; Van, H. N.; Le, T. N.; Nat. Prod. Res. 2021, 35, 455. [Crossref] 34. Maestri, M. P.: Análises e Contribuições para o Manejo Florestal Comunitário do Projeto de Desenvolvimento Sustentável Virola Jatobá, Anapu, Pará; Tese de Doutorado, Universidade Federal Rural da Amazônia, Belém, Brasil, 2021. [Link] acessado em julho 2025 35. Santamaría-Aguilar, D.; Lagomarsino, L. P.; PhytoKeys 2022, 197, 81. [Crossref] 36. Geraldo, L. G.; Kaplan, M. A. C.; Bot. J. Linn. Soc. 2001, 135, 61. [Crossref]
Editor Convidado responsável pelo artigo: Antonio E. M. Crotti |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access