Artigo
|
|
| Análise de pedras preciosas apreendidas pela Polícia Civil do Espírito Santo por espectroscopia raman portátil Analysis of seized precious stones by the Civil Police of Espírito Santo by portable raman spectroscopy |
|
Thaynara V. NatividadeI,II; Jandira M. O. B. BrandãoII,III,IV; Alan R. PereiraII,IV; Nayara A. dos SantosI,II,IV; I. Instituto Federal de Educação, Ciência e Tecnologia do Espírito Santo, 29106-010 Vila Velha - ES, Brasil Recebido: 26/05/2025 *e-mail: wanderson.romao@ifes.edu.br The identification of gemstones requires increasingly precise analytical methods due to advances in synthesis and treatment techniques, which heighten the risk of fraud. Portable Raman spectroscopy stands out as a non-destructive and efficient tool for these analyses, providing detailed structural information. This study aimed to apply portable Raman spectroscopy to the characterization of gemstones seized by the Civil Police of Espírito Santo (PCES) and contribute to the creation of a spectral database. Eleven seized samples and seven authentic gemstones from the Federal Institute of Espírito Santo (IFES) were analyzed using a portable Raman spectrometer, along with refractive index and absolute density measurements. The results revealed discrepancies between the presumed classification and the actual composition: the supposed blue emeralds were identified as apatites, while the alleged topazes exhibited spectral characteristics of authentic amethysts. Multivariate statistical analysis (principal component analysis, PCA) and hierarchical analysis demonstrated distinct groupings, aiding in sample differentiation. The study confirms the potential of portable Raman spectroscopy, combined with chemometrics, for gemstone identification, reinforcing forensic investigations and improving gem authentication protocols. INTRODUÇÃO A formação das pedras preciosas envolve processos físicos e químicos complexos, influenciados por diversos fatores ambientais como profundidade, temperatura e pressão. A composição química do ambiente, o tempo de cristalização, a presença de fluidos, pressões, calor e a ação de esforços tectônicos desempenham um papel crucial na determinação de propriedades únicas, como: cor, dureza, clivagem e brilho de cada gema.1 Segundo o Instituto Brasileiro de Gemas e Metais Preciosos (IBGM),2 as gemas podem ser classificadas como: naturais (formadas na natureza sem a interferência do homem), artificiais (criadas pelo homem, sem equivalentes na natureza), sintéticas (fabricadas pelo homem, com propriedades correspondentes às das gemas naturais) e imitações (fabricadas para replicar a aparência das gemas naturais ou sintéticas). Além disso, as gemas naturais podem ter origem inorgânica, como minerais e rochas, ou orgânica, provenientes de animais ou vegetais.2 O valor das pedras preciosas vai depender de sua cor, tamanho, qualidade e raridade. Essas características são determinadas principalmente pela presença dos elementos químicos na sua composição, e também pela estrutura cristalina. Inclusões sólidas presentes nas gemas são importantes indicadores da natureza e determinação da origem de uma pedra preciosa.3 Embora o Brasil ocupe uma posição de destaque mundial na exploração de ouro e pedras preciosas, questões relacionadas à violência, atividades criminosas, falsificação e negligência com os direitos humanos começaram a ser evidenciadas, principalmente devido à operação de muitas minas ilegais que não atendem aos protocolos de segurança.4,5 Outros problemas incluem o contrabando de pedras preciosas, que resulta em consequências econômicas negativas para os países envolvidos, e a falsificação de gemas de qualidade inferior por meio de tratamentos artificiais que melhoram sua aparência e valor de mercado. Essa prática envolve a aplicação de substâncias químicas para alterar a cor, clareza e outras características, muitas vezes resultando na comercialização dessas pedras como se fossem autênticas e de alta qualidade, iludindo compradores e consumidores finais.6 Devido às inúmeras formas de fraude, é fundamental desenvolver metodologias mais rigorosas de caracterização, uma vez que a autenticidade e qualidade das gemas são essenciais para o mercado de jóias e pedras preciosas. No contexto das Ciências Forenses, a caracterização dos materiais requer técnicas analíticas, cujos resultados contribuem para estabelecer uma correlação entre elementos traço e a origem das cores, além de fornecer subsídios acerca da gênese, identificar possíveis fontes e determinar a autenticidade ou não das gemas.7 Durante décadas, a identificação da maioria das gemas era feita com uso de refratômetros, polariscópios, microscópios e espectroscópios.8 Com o progresso na síntese e tratamento de gemas, surgiu a necessidade de instrumentos analíticos mais sofisticados. Tecnologias como espectrômetros de infravermelho, ultravioleta-visível, fluorescência de raios X por dispersão de energia (EDXRF) e instrumentos Raman foram aprimorados, e novos dispositivos adaptados, para atender às demandas analíticas de laboratórios gemológicos.9,10 A espectroscopia Raman destaca-se na avaliação e identificação destes materiais por ser uma técnica não destrutiva e dispensar a etapa de preparo de amostra, sendo amplamente utilizada na gemologia para obter informações detalhadas sobre a composição química, a estrutura cristalina, as inclusões e a autenticidade de pedras preciosas.11,12 Essa técnica espectroscópica baseia-se na interação da luz com a matéria, possibilitando a identificação e caracterização de compostos químicos presentes nos materiais analisados.13 A técnica permite analisar gemas brutas ou lapidadas, cravadas ou soltas, além de identificar tratamentos e inclusões internas.14 A eficácia dessa técnica analítica para identificação de gemas e minerais tem sido demonstrada em diversos estudos utilizando instrumentos de bancada e dispositivos portáteis, para detecção in situ.15-18 A portabilidade dos espectrômetros Raman permite a análise não destrutiva de pedras preciosas e artefatos de forma rápida, diretamente em campo, sem a necessidade de remoção das peças ou transporte para laboratórios, representando uma grande vantagem para aplicações em gemologia, patrimônio cultural e Ciências Forenses.19 Apesar da alta especificidade química da espectroscopia Raman, diferenças entre espectros de variadas classes podem ser sutis e difíceis de identificar visualmente. O uso de métodos quimiométricos, supervisionados ou não supervisionados, amplia a interpretação dos dados espectrais, potencializando a capacidade de análise de amostras complexas de forma rápida e eficiente, fornecendo respostas analíticas mais robustas e confiáveis.20-22 Métodos não supervisionados, como a análise de componentes principais, do inglês principal component analysis (PCA) e a análise de cluster hierárquico, do inglês hierarquical cluster analysis (HCA), são utilizados sem a necessidade de informações prévias sobre as amostras, permitindo uma análise exploratória dos espectros para identificar padrões, similaridades ou agrupamentos nos dados.23 Embora a espectroscopia Raman e a instrumentação portátil já sejam amplamente empregadas na análise de gemas, grande parte dos estudos concentra-se apenas na interpretação visual e qualitativa dos espectros obtidos. Observa-se uma escassez de pesquisas que integrem métodos quimiométricos ao tratamento dos dados espectrais, permitindo a identificação de padrões para diferenciação de materiais. Diante disso, o objetivo deste estudo foi investigar como a combinação da espectroscopia Raman portátil e quimiometria pode contribuir para a identificação de falsificações em gemas, considerando aspectos tecnológicos e computacionais envolvidos na análise com foco no desenvolvimento de protocolos analíticos mais eficientes, seguros e acessíveis para aplicação em contextos comerciais e forenses, complementando as metodologias tradicionais já estabelecidas.
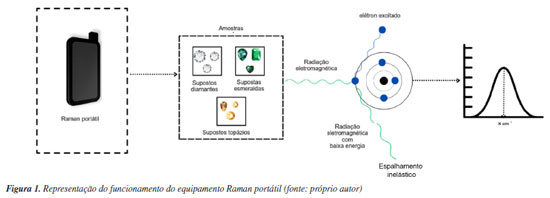
PARTE EXPERIMENTAL Esta pesquisa é um estudo de natureza descritiva24 voltado para a discussão sobre a aplicação de um equipamento Raman portátil na avaliação, identificação e autenticação de gemas e pedras preciosas em associação a análises tradicionais já consolidadas na gemologia, como a medição de densidade e o índice de refração. Materiais e equipamentos As amostras consistiram em dois grupos: (a) 11 (onze) gemas questionadas selecionadas a partir de um conjunto apreendido pela Polícia Civil do Espírito Santo (PCES), denominadas Apreensão-PCES (Ap-PCES), sendo elas: 4 (quatro) supostos topázios (Figura 1S), 2 (duas) supostas ametistas (Figura 2S), 4 (quatro) supostas esmeraldas azuis (Figura 3S) e 1 (uma) suposta esmeralda verde (Figura 4S); e (b) 7 (sete) gemas padrão autênticas pertencentes ao Acervo do Instituto Federal do Espírito Santo (IFES) campus Vila Velha, denominadas Acervo-IFES (Ac-IFES), sendo elas: 4 (quatro) topázios (Figura 5S), 2 (duas) ametistas (Figura 6S), e 1 (uma) esmeralda verde (Figura 7S). Essas figuras estão disponíveis no Material Suplementar. O conjunto de amostras questionadas foi inicialmente caracterizado utilizando refratômetro gemológico, para determinação dos índices de refração, e balança hidrostática, para determinação das densidades absolutas. Posteriormente, todas as amostras foram analisadas, sem qualquer tratamento prévio, utilizando um espectrômetro Raman portátil (CloudMinds AI Raman spectrometer XI MR), equipado com tampa de detecção de sólido/pó, distância entre o centro da lente do laser e o ponto focal do laser de ∼10 mm (0,4 polegadas), comprimento de onda do laser de 785 ± 0,5 nm e tempo de integração de 0,01 s. A análise multivariada não supervisionada, para reconhecimento de padrões nos dados, foi realizada utilizando-se os métodos PCA e HCA. O processamento dos dados foi realizado utilizando os softwares OriginPro 8.5 (OriginLab Corporation, Estados Unidos, 2009) e Orange Data Mining Tool (ODMT) (GitHub, Inc., Eslovênia, 2004). Gráficos de dispersão foram gerados para analisar a distribuição dos dados, e identificar potenciais correlações entre as variáveis estudadas, juntamente com um gráfico dendrograma para analisar a relação entre as diferentes variáveis e os grupamentos entre as amostras. Raman portátil No campo da gemologia, a espectroscopia Raman é um recurso de baixo custo que possibilita a identificação da maior parte dos minerais, principalmente as gemas ou pedras preciosas, utilizando uma série conjunta de frequências das vibrações moleculares.25 Uma de suas principais vantagens é “não precisar que a amostra seja preparada e não ser destrutiva, assim as gemas podem ser analisadas na condição bruta, lapidada, cravadas em jóias ou soltas. Além disso, possibilita determinar o tratamento a ser aplicado nas gemas e auxilia na identificação de inclusões em seu interior”.26 Por não ser destrutiva, ou seja, não danificar a amostra durante a análise, a técnica permite que a integridade da amostra seja mantida, possibilitando que ela seja utilizada para outros fins sem que suas propriedades físicas e químicas sejam alteradas.27 A espectroscopia Raman é uma técnica que envolve espalhamento inelástico, como pode ser observado na Figura 1. Esse processo baseia-se nas mudanças que ocorrem após a colisão entre o fóton e a molécula ou átomo da substância analisada. A técnica analítica é especialmente indicada para a caracterização qualitativa de pedras preciosas, oferecendo informações detalhadas sobre sua estrutura cristalina e composição química.28 Nesse sentido, a radiação eletromagnética (RE) incide sobre uma molécula, transferindo energia para o elétron e provocando seu salto quântico. Como resultado, a RE, que foi direcionada à molécula, perde sua energia, gerando um espectro que posteriormente será tratado por métodos quimiométricos. A dispersão Raman está diretamente associada aos modos vibracionais de uma substância. Como as vibrações dependem da massa dos átomos, das forças de ligação e das simetrias entre eles, o espectro Raman de uma substância funciona como uma impressão digital única, possibilitando sua identificação inequívoca.
O Raman portátil envolve o uso de instrumentos compactos que podem ser facilmente transportados para o local de análise, tornando-a uma ferramenta valiosa em diversas aplicações, como análise de materiais em campo, controle de qualidade e monitoramento ambiental.29 Quimiometria Os métodos de análise multivariada aplicados no tratamento dos dados espectrais, obtidos por espectroscopia Raman portátil, reduzem a complexidade do conjunto de dados e facilitam a interpretação dos resultados. A análise multivariada permite explorar relações entre um grande número de variáveis medidas em diferentes amostras, possibilitando a identificação de padrões, tendências e agrupamentos relevantes.30 Os dados de espectros Raman, organizados em matrizes, com números de onda (cm-1) nas colunas e valores de intensidades de cada amostra nas linhas, são analisados por algoritmos que desenvolvem modelos estatísticos. Esses modelos identificam padrões, minimizam ruídos/interferentes e distinguem dados relevantes, permitindo respostas qualitativas ou quantitativas.31 Entre os métodos empregados, destaca-se a PCA, utilizada para reduzir a dimensão do conjunto de dados original sem perda significativa de informação. Por meio desse método, as variáveis originais são transformadas linearmente em um novo conjunto de componentes não correlacionados, denominados componentes principais (PC), ordenados segundo a quantidade de variância explicada.32-34 Adicionalmente, a HCA tem a finalidade de agrupar as amostras de acordo com a similaridade de suas características espectrais. Esse método organiza os dados em clusters com alta homogeneidade interna e maior heterogeneidade entre os grupos, sendo representada graficamente por um dendrograma. A formação dos clusters baseia-se na proximidade entre as amostras no espaço multivariado, medida por métricas de distância apropriadas, sendo adotada neste trabalho a distância Euclidiana, que é geralmente empregada.35 Refratômetro gemológico e balança hidrostática Na gemologia, a precisão na análise de propriedades físicas das gemas é fundamental para sua identificação e classificação. Entre os instrumentos mais utilizados, destacam-se o refratômetro gemológico (RG) e a balança hidrostática (BH), cada um contribuindo para a caracterização das pedras preciosas. O princípio de funcionamento do refratômetro baseia-se na mudança na velocidade da luz ao passar de um meio para outro, resultando em um desvio de seu caminho.36 Quando a luz atravessa a gema e passa pelo prisma, ocorre sua refração e o ângulo de desvio é medido. O índice de refração é então calculado a partir desse ângulo, permitindo comparação com valores conhecidos para diferentes gemas.37 Uma das principais vantagens do RG é sua capacidade de fornecer resultados rápidos e precisos, além da análise não ser destrutiva, preservando a integridade da amostra durante o procedimento.36 A balança hidrostática é um instrumento utilizado para determinar a densidade absoluta de gemas. Essa propriedade é definida como a razão entre a massa de um material e o volume que ele ocupa. O equipamento opera com base no princípio de Arquimedes, que afirma que um corpo imerso em um fluido sofre uma força de empuxo igual ao peso do fluido deslocado.38 A BH também é altamente precisa e permite a análise de gemas em diversas condições, como em sua forma bruta e lapidada. Além disso, essa técnica é não destrutiva e pode ser aplicada a uma ampla gama de materiais, ampliando seu uso na gemologia.36 O uso conjunto do refratômetro gemológico e da balança hidrostática oferece uma abordagem abrangente para a análise de gemas. Apesar de detectores de maior resolução, mais rápidos e precisos terem sido desenvolvidos, essas técnicas ainda são ferramentas importantes na análise diária de gemas.
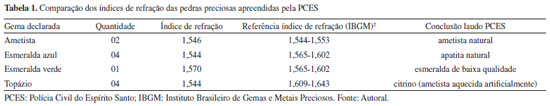
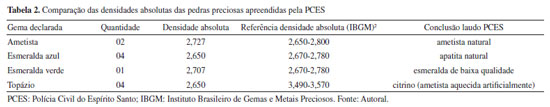
RESULTADOS E DISCUSSÃO O índice de refração e a densidade absoluta são propriedades características das gemas, e seus valores podem ser comparados com valores tabelados encontrados na literatura.2 A Tabela 1 apresenta os valores do índice de refração das gemas apreendidas pela PCES, a comparação com os respectivos valores de referência e a conclusão indicada no laudo emitido pela Perícia Oficial da PCES. A Tabela 2 mostra a mesma comparação para os valores de densidade absoluta encontrados para as gemas apreendidas.
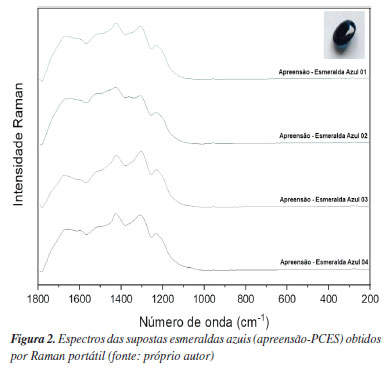
Os índices de refração e a densidade absoluta foram usados para determinar o tipo das gemas analisadas. Os resultados foram então comparados com as referências bibliográficas com os seguintes valores: para as sete amostras de ametista, o índice de refração (IR) medido foi de 1,546, dentro do intervalo reportado na literatura (1,544-1,553). A densidade absoluta média foi de 2,727, também dentro do intervalo esperado, que varia entre 2,650-2,800. Portanto, as gemas foram confirmadas como ametistas naturais. As amostras de esmeraldas azuis apresentaram um IR de 1,544, que não corresponde ao intervalo de referência de 1,565-1,602 para esmeraldas. A densidade absoluta encontrada foi de 2,650, também fora do intervalo de referência de 2,670 a 2,780 para esmeraldas, confirmando que essas gemas são, na verdade, apatitas naturais. Das amostras de esmeraldas verdes, o IR medido foi de 1,570, que está dentro intervalo da referência bibliográfica (1,565-1,602), e a densidade absoluta média foi de 2,707, dentro do intervalo de 2,670-2,780. As pedras foram confirmadas como esmeraldas verdes, porém de baixa qualidade. Para as amostras de topázio, o IR encontrado foi de 1,544, valor que não se enquadra ao intervalo de 1,609-1,643 esperado para o topázio, mas sim para a ametista. A densidade absoluta encontrada foi de 2,650, valor que não corresponde ao intervalo de 3,490-3,570 esperado para topázios, mas que, novamente, enquadra-se no intervalo de uma ametista. A análise concluiu que essas amostras são, na verdade, citrinos, resultantes do aquecimento artificial da ametista. Embora os resultados apresentados sejam relevantes, são insuficientes para uma identificação conclusiva, sendo imprescindível o uso de técnicas mais precisas como a espectroscopia Raman portátil. Raman portátil Nas análises com uso de Raman portátil das supostas gemas apreendidas (Ap-PCES), os espectros adquiridos das supostas esmeraldas azuis, Figura 2, juntamente com o IR (1,544) e a densidade absoluta (2,650), indicam que o material, na verdade, é uma apatita natural, que é significativamente mais barata do que a esmeralda azul. As principais bandas observadas no espectro Raman revelaram as seguintes informações: vibração de estiramento assimétrico de [PO4]3- na região 1079,2 cm-1; e bandas assinalando uma possível substituição por carbonato na frequência de 1370,0 cm-1.39,40
Os topázios pertencentes ao acervo do IFES apresentam distintos perfis espectrais quando comparados aos supostos topázios apreendidos (Figura 3). As principais bandas obtidas do topázio do Ac-IFES são: 332,8 cm-1, correspondendo às vibrações de flexão dos tetraedros SiO4 e modos externos, incluindo Al3+ e liberações dos tetraedros SiO4; 563,4 cm-1, relacionada às traduções de Al3+, levando a vibrações de alongamento Al-O e Al-F no octaedro AlO4F2; 855,8 cm-1, associada às vibrações de alongamento dos tetraedros SiO4 e também a duas vibrações de alongamento significativas: Al-O e Si-O; 982,8 cm-1, referente às vibrações de alongamento antissimétricas do tetraedro SiO4.41 Além disso, os valores de IR (1,544) e a densidade absoluta (2,650) não são relacionáveis aos valores teóricos descritos na literatura para este mineral.
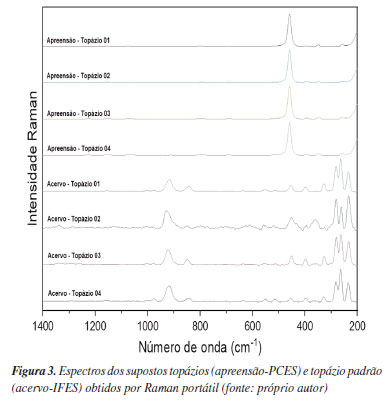
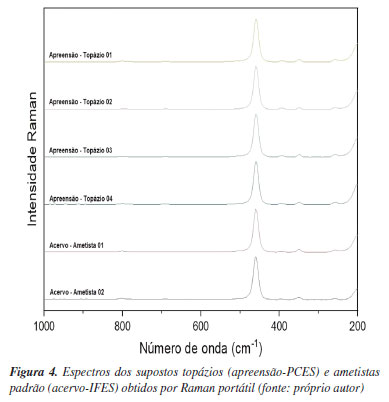
No entanto, quando os espectros Raman dos supostos topázios apreendidos (Ap-PCES) são comparados às ametistas autênticas (Ac-IFES), Figura 4, há uma evidente semelhança espectral, sendo ambas variedades de quartzo com a fórmula química SiO2 (dióxido de silício). As bandas espectrais mais relevantes obtidas do espectro do suposto topázio (Ap-PCES) e da ametista do Ac-IFES são: 205,79 cm-1, relacionada à flexão de Si-O-Si;42 263,12 cm-1, associada à vibração do tetraedro Si-O; 355,79 cm-1, relacionada à vibração de flexão de Si-O; e 465,58 cm-1, associada à vibração de flexão de Si-O.43 Vale destacar que os valores supracitados para os supostos topázios - IR (1,544) e densidade absoluta (2,650) - estão de acordo com os valores descritos na literatura.
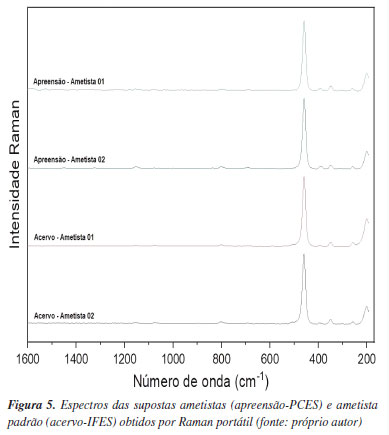
Na Figura 5, o espectro da ametista apreendida (Ap-PCES) e da ametista do Ac-IFES são semelhantes, o que corrobora fortemente a indicação de que a amostra seja realmente uma ametista natural. Os valores de IR (1,546) e a densidade absoluta (2,727) asseveram tal indicação. As bandas características das ametistas apreendidas são: 264,79 cm-1, referente à vibração do tetraedro silício-oxigênio; 355,42 cm-1, associado à vibração de flexão de Si-O; e 464,13 cm-1, também relacionado à vibração de flexão de Si-O.43
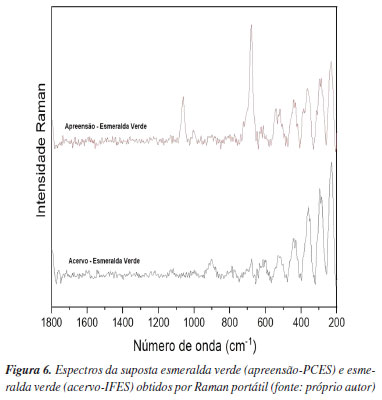
A partir do espectro Raman da esmeralda verde pertencente ao Ac-IFES e Ap-PCES, Figura 6, é possível inferir que a suposta esmeralda apreendida é autêntica, porém com qualidade inferior, e isso pode ser relacionado a, por exemplo, tratamento com preenchimento polimérico. A esmeralda verde é uma variedade de berilo; sua cor verde intensa é devida à presença de pequenas quantidades de íons de cromo Cr3+ substituindo o alumínio na estrutura cristalina do berilo. Os íons de cromo absorvem certas cores do espectro visível, deixando apenas o verde visível aos olhos humanos. As bandas características mais relevantes obtidas do espectro da esmeralda verde apreendida são: 236,9 cm-1, associada a modos vibracionais envolvendo átomos de berílio e oxigênio; 447,9 cm-1, relacionada a modos vibracionais dos tetraedros de SiO4; 686,12 cm-1, referentes à vibração das ligações Si-O; e 1300,3 cm-1, associada às vibrações moleculares típicas dos berilos.44-46 Além disso, os valores de densidade absoluta (2,707) e IR (1,570) guardam correspondência com dados da literatura.
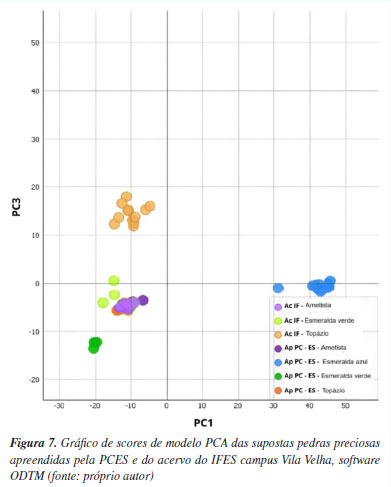
Quimiometria A construção de uma análise de componentes principais com os dados de Raman portátil das amostras permitiu a projeção das amostras em um espaço dimensional menor, o espaço das componentes principais, mantendo-se a informação (variância) do conjunto de dados. Para a construção do modelo PCA no software ODTM, foram selecionadas dez componentes principais (PC) com base na variância explicada de 98% (Figuras 8S e 9S).47 Os três primeiros PCs foram responsáveis por 87% da variância total dos espectros Raman estudados, sendo suficiente para discriminar as amostras. O gráfico de dispersão com os scores do modelo PCA mostra os grupametos intrínsecos aos dados devido a semelhanças químicas entre as amostras.48 Apesar da contribuição de variância do PC2, a melhor capacidade de discriminação entre as amostras foi encontrada no PC1 e PC3. Na Figura 7, nota-se a formação de grupos definidos, nos quadrantes positivos de PC1 (esmeralda azul Ap-PCES) e PC3 (topázio Ac-IFES), e quadrante negativo de PC1 (esmeralda verde Ap-PCES), e o agrupamento de gemas autênticas de ametistas do Ac-IFES, supostas ametistas Ap-PCES, e supostos topázios Ap-PCES, conforme evidenciado nas Figuras 3 a 5.
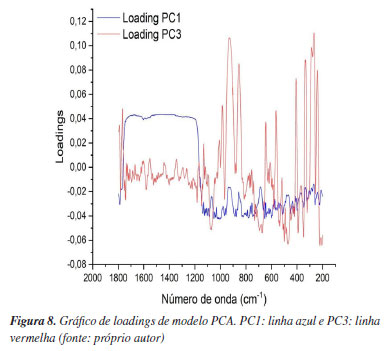
A partir da análise PCA foi possível a interpretação das relações mais importantes entre as amostras e entre as variáveis, como pode ser observado no gráfico de loadings, Figura 8. Na PC1, a região de maior loading está entre 1800 e 1200 cm-1 (região onde são encontradas bandas apenas nas amostras de esmeralda azul). Na PC2, a região entre 1000 a 800 cm-1 apresenta maiores loadings, em função das amostras do acervo do IFES, que apresentam bandas nessa região.
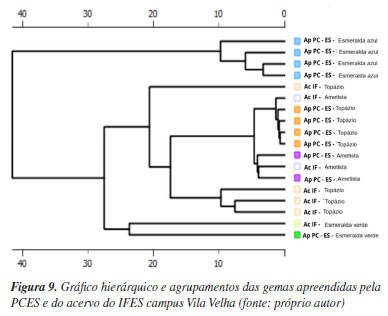
O dendrograma adquirido a partir da análise hierárquica de cluster, Figura 9, mostra a similaridade entre as amostras com base na distância entre os pontos. Podemos ver no HCA que os grupos vistos no gráfico de scores são os mesmos, aqui sendo representados por uma métrica de distância Euclidiana, permitindo visualizar de forma clara e organizada a estrutura hierárquica dos elementos estudados.49
Algumas gemas, especialmente aquelas com impurezas ou tratamentos químicos, podem gerar um forte sinal de fluorescência que pode mascarar ou dificultar a obtenção de um espectro Raman claro. A presença de inclusões pode também gerar espectros adicionais.25 Essas limitações podem ser mitigadas com ajustes experimentais, como a escolha do comprimento de onda do laser, otimização das condições de medição e o uso de técnicas complementares.50,51 Estudos anteriores52 já demonstraram a eficácia de equipamentos portáteis em ambientes arqueológicos, forenses e geológicos, indicando a utilidade dos espectrômetros Raman portáteis em aplicações reais e ao ar livre. A tecnologia portátil tem grande potencial, mesmo com algumas limitações, que não invalidam o uso dos aparelhos, mas sim mostram que algumas melhorias técnicas são necessárias. Observa-se que a maioria das análises rotineiras de gemas demanda técnicas complementares para verificar a precisão, devido às dificuldades em comparar espectros Raman com um banco de dados conhecido. Diante disso, este trabalho mostra potencial para criação de uma biblioteca a partir da aquisição espectral de uma grande variedade de gemas, para posterior classificação gemológica.
CONCLUSÕES Neste trabalho, a técnica de espectroscopia Raman portátil foi aplicada para identificação da autenticidade de supostas gemas apreendidas ao se relacionar as principais bandas detectadas à literatura; somada às análises clássicas de densidade absoluta e índice de refração. Além disso, a comparação com perfis espectrais de gemas autênticas (Ac-IFES) contribuiu para a classificação do material apreendido, possibilitando comparações diretas e validação dos resultados obtidos pela espectroscopia Raman portátil. Destaca-se a importância da associação dos dados espectroscópicos aos métodos quimiométricos PCA e HCA, que possibilita identificar padrões de forma multivariada e projetar os dados para análises gráficas. Isso permite, por exemplo, a distinção clara das gemas apreendidas como esmeralda azul no quadrante positivo de PC1 e do topázio (Ac-IFES) no quadrante positivo de PC3, além do agrupamento de ametistas (Ac-IFES), supostas ametistas (Ap-PCES) e supostos topázios (Ap-PCES). Esses resultados, somados aos demais, asseveram a aplicabilidade da técnica Raman portátil associada à quimiometria para estudo da autenticidade de supostas gemas.
MATERIAL SUPLEMENTAR Imagens das amostras utilizadas neste trabalho (Figuras 1S a 7S) e gráficos referentes à construção do modelo quimiométrico (Figuras 8S e 9S) estão disponíveis em http://quimicanova.sbq.org.br, na forma de arquivo PDF, com acesso livre.
DECLARAÇÃO DE DISPONIBILIDADE DE DADOS Todos os dados estão disponíveis no texto e no Material Suplementar.
AGRADECIMENTOS Este trabalho foi realizado em parceria entre Instituto Federal do Espírito Santo (IFES), Universidade Federal do Espírito Santo (UFES) e Polícia Civil do Estado do Espírito Santo (PCES), por meio do Acordo de Cooperação No. 23068.022157/2020-69. Os autores agradecem à Coordenação de Aperfeiçoamento de Nível Superior (CAPES, 23038.007083/2014-40), Fundação de Apoio à Pesquisa do Espírito Santo (FAPES) (CNPq/FAPES No. 23/2018 - PRONEM (596/2018 e 597/2018); FAPES/CNPq/Decit-SCTIEMS/SESA No. 09/2020 - PPSUS (165/2021); FAPES No. 03/2021 - UNIVERSAL (492/2021); FAPES No. 15/2022 - PROFIX 2022 (714/2022) e FAPES No. 12/2024 - PROFIX 2024 (503/2025); FAPES No. 019/2022 - Núcleos Capixabas de Excelência em Pesquisa (991/2022 P; 2022-5KMF0); e edital FAPES No. 21/2022 - Apoio à Infraestrutura de Pesquisa (1069/2022 P: 2022-98VRN)), ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq, 310057/2020-5, INCT-Forense e CNPq 03/2023 - PICTI) pelo apoio financeiro. Agradecemos também à Prof. Dra. Daniela Teixeira Carvalho de Newman, do Departamento de Gemologia da UFES. Reconhecemos ainda o valoroso trabalho dos orientadores e colaboradores do Laboratório de Petroleômica e Forense - LabPetro/UFES e do INCT-Forense, pelo apoio contínuo às atividades de pesquisa e discussões construtivas que contribuem para as investigações na área de química forense.
CONTRIBUIÇÕES DO AUTOR Thaynara V. Natividade foi responsável por investigação, curadoria de dados, redação de rascunho original; Jandira M. O. B. Brandão por conceituação, metodologia, visualização, redação (revisão e edição); Alan R. Pereira por análise formal; Nayara A. dos Santos por administração de projetos, supervisão, visualização, redação (revisão e edição); Marcia H. C. Nascimento por análise formal; Carlos R. P. Campos por validação; Paulo R. Filgueiras por validação; Hildegardo S. França por validação; Wanderson Romão por conceituação, aquisição de financiamento, metodologia, recursos, validação.
REFERÊNCIAS 1. Carneiro, C. D.; Gonçalves, P. W.; Lopes, O. R.; Terrae Didática 2009, 5, 50. [Crossref] 2. Instituto Brasileiro de Gemas e Metais Preciosos (IBGM), Manual Técnico de Gemas, 4ª ed.; IBGM: Brasília, 2009. [Link] acessado em setembro 2025 3. Kiefert, L.; Karampelas, S.; Spectrochim. Acta, Part A 2011, 80, 1194. [Crossref] 4. Verstegen, J. A.; Rorato, A. C.; Environ. Res. Lett. 2023, 18, 101003. [Crossref] 5. Rorato, A. C.; Câmara, G.; Escada, M. I. S.; Picoli, M. C. A.; Moreira, T.; Verstegen, J. A.; Environ. Res. Lett. 2020, 15, 1040a3. [Crossref] 6. Naylor, T.; Crime, Law and Social Change 2010, 53, 131. [Crossref] 7. Doty, K. C.; Muro, C. K.; Bueno, J.; Halámková, L.; Lednev, I. K.; J. Raman Spectrosc. 2016, 47, 39. [Crossref] 8. Breeding, C. M.; Shen, A. H.; Eaton-Magaña, S.; Rossman, G. R.; Shigley, J. E.; Gilbertson, A.; Gems Gemol. 2010, 46, 241. [Crossref] 9. Hänni, H. A.; Journal of the Gemmological Association of Hong Kong 2009, 30, 14. [Link] acessado em setembro 2025 10. Hainschwang T.; In Color 2010, 13, 34. [Link] acessado em setembro 2025 11. Bersani, D.; Lottici, P. P.; Anal. Bioanal. Chem. 2010, 397, 2631. [Crossref] 12. Hope, G. A.; Woods, R.; Munce, C. G.; Miner. Eng. 2001, 14, 1565. [Crossref] 13. Machado, D. V.; Schnellrath, J.; Queiroz, J. P. C.; Anuário do Instituto de Geociências 2020, 43, 415. [Crossref] 14. Barone, G.; Mazzoleni, P.; Raneri, S.; Jelicka, J.; Vandenabeele, P.; Lottici, P. P.; Lamagna, G.; Manenti, A. M.; Bersani, D.; Appl. Spectrosc. 2016, 70, 1420. [Crossref] 15. Kiefert, L.; Epelboym, M.; Kan-Nyunt, H.; Paralusz, S. Em Infrared and Raman Spectroscopy in Forensic Science; Chalmers, J. M.; Edwards, H. G. M.; Hargreaves, M. D., eds.; John Wiley & Sons Ltd.: New Jersey, 2012, cap. 8b. 16. Curtis, N. J.; Gascooke, J. R.; Johnston, M. R.; Pring, A.; Minerals 2019, 9, 299. [Crossref] 17. Eaton-Magaña, S.; Breeding, C. M.; Palke, A. C.; Homkrajae, A.; Sun, Z.; McElhenny, G. R.; Minerals 2021, 11, 177. [Crossref] 18. Kelly, J. F.; Blake, T. A.; Bernacki, B. F.; Timothy, J. J.; Int. J. Spectrosc. 2012, 2012, 938407. [Crossref] 19. Culka, A.; Jehlička, J.; J. Raman Spectrosc. 2019, 50, 262. [Crossref] 20. Liu, T.; Lili, K.; Lin, L.; Xu, H.; Zhou, Z.; Huang, M.; Laser Phys. 2022, 32, 045702. [Crossref] 21. Caggiani, M. C.; Colomban, P.; Physical Sciences Reviews 2018, 3, 20180007. [Crossref] 22. Almeida, M. R.: Espectroscopia Raman e Quimiometria como Ferramentas Analíticas para Química Forense e Paleontologia; Tese de Doutorado, Universidade Estadual de Campinas, Campinas, Brasil, 2015. [Link] acessado em setembro 2025 23. Ralbovsky, N. M.; Lednev, I. K.; Spectrochim. Acta, Part A 2019, 219, 463. [Crossref] 24. Marconi, M. A.; Lakatos, E. M.; Metodologia do Trabalho Científico, 8ª ed.; Atlas: São Paulo, 2018. 25. Bersani, D.; Azzi, G.; Lambruschi, E.; Barone, G.; Mazzoleni, P.; Raneri, S.; Longobardo, U.; Lottici, P. P.; J. Raman Spectrosc. 2014, 45, 1293. [Crossref] 26. D'Azevêdo, R. G. B.; XXII Jornada de Iniciação Científica - JIC; CETEM, Rio de Janeiro, Brasil, 2014. [Link] acessado em setembro 2025 27. Edwards, H. G. M.; Munshi, T.; Anal. Bioanal. Chem. 2005, 382, 1398. [Crossref] 28. Smith, E.; Dent, G.; Modern Raman Spectroscopy: A Practical Approach, 2nd ed.; John Wiley & Sons Ltd.: New Jersey, 2019. 29. Vandenabeele, P.; Practical Raman Spectroscopy: An Introduction, 1st ed.; John Wiley & Sons Ltd.: New Jersey, 2013. 30. Kumar, N.; Bansal, A.; Sarma, G. S.; Rawal, R. K; Talanta 2014, 123, 186. [Crossref] 31. Qi, Y.; Hu, D.; Jiang, Y.; Wu, Z.; Zheng, M.; Chen, E. X.; Liang, Y.; Sadi, M. A.; Zhang, K.; Chen, Y. P.; Adv. Opt. Mater. 2023, 11, 1. [Crossref] 32. Gorshkova, K. O.; Rossinskaya, E. R.; Kirillova, N. P.; Fogel, A. A.; Kochemirovskaia, S. V.; Kochemirovsky, V. A.; Sci. Justice 2020, 60, 451. [Crossref] 33. Navas, N.; Romero-Pastor, J.; Manzano, E.; Cardell, C.; J. Raman Spectrosc. 2010, 41, 1486. [Crossref] 34. Camacho, J.; Picó, J.; Ferrer, A.; Lab. Autom. Inf. Manage. 2010, 100, 48. [Crossref] 35. Beebe, K. R.; Pell, R. J.; Seasholtz, M. B.; Chemometrics: A Practical Guide, 1st ed.; John Wiley & Sons Ltd.: New Jersey, 1998. 36. Moore, T. P. Em Gems: Their Sources, Descriptions and Identification; O'Donoghue, M., ed.; Butterworth-Heinemann: Oxford, 2006. 37. Gao, S.: The Gemological Collection of Abraham Gottlob Werner; Dissertação, Technische Universität Bergakademie Freiberg, TU Bergakademie Freiberg, 2021. [Link] acessado em setembro 2025 38. Sinkankas, J.; Gems Gemol. 1986, 22, 156. [Crossref] 39. Yuan, P.; Xu, B.; Wang, Z.; Liu, D.; Crystals 2022, 12, 461. [Crossref] 40. Tardif, D.; Silva, C. B. S.; Costa, F. C.; Belotti, F. M.; Graça, L. M.; Frost, R. L.; Cipriano, R. A. S.; Mineralogia e Gemologia, 1ª ed.; CAUFES: Alegre, 2022, cap. 3. [Link] acessado em setembro 2025 41. Borovikova, E. Y.; Spivak, A. V.; Setkova, T. V.; Kvas, P. S.; Kuźmin, A. V. V.; Zakharchenko, E. S.; Balitsky, V. S.; Khasanov, S. S.; Lazarenko, V. A.; Dorovatovskii, P. V.; Korshunov, D. M.; Aksenov, S. M.; Spectrochim. Acta, Part A 2023, 288, 122137. [Crossref] 42. Karampelas, S.; Wörle, M.; Hunger, K.; Hanspeter, L.; J. Raman Spectrosc. 2012, 43, 1833. [Crossref] 43. Liu, K.; Guo, Y.; Crystals 2022, 12, 1735. [Crossref] 44. Ázaro, A. S.; Mendes, J. C.; Schnellrath, J.; Anais do 46º Congresso Brasileiro de Geologia, Santos, Brasil, 2012. [Link] acessado em setembro 2025 45. Guo, H.; Yu, X.; Zheng, Y.; Sun, Z.; Ng, M.; Gems Gemol. 2020, 56, 336. [Crossref] 46. Huang, Z.; Li, G.; Weng, L.; Zhang, M.; Crystals 2023, 13, 233. [Crossref] 47. Ferreira, M. M. C.; Quim. Nova 2022, 45, 1251. [Crossref] 48. Martins, M. E. G.; Revista Ciência Elementar 2014, 2, 214. [Crossref] 49. Moita Neto, J. M.; Moita, G. C.; Quim. Nova 1998, 21, 467. [Crossref] 50. Workman Junior, J.; Spectroscopy 2024. [Link] acessado em setembro 2025 51. Boteju, W. I. W. Y.; Gunarathna, M. K. A. S.; Fonseka, T. L. M. D.; Peiris, H. N. S.; Silva, L. A. R.; Jayathilaka, N. N. S. S.; Jayasekara, L. A. G. D.; Perera, P. N.; Jayaweera, H. H. E.; Gunewardene, M. S.; Jayawardhana, S.; Sri Lankan Journal of Physics 2022, 23, 1. [Crossref] 52. Jehlička, J.; Culka, A.; Vandenabeele, P.; Edwards, H. G. M.; Spectrochim. Acta, Part A 2011, 80, 36. [Crossref]
Editor Associado responsável pelo artigo: Eduardo M. Richter |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access