Revisão
|
|
| 1T-MoS2: uma breve revisão das propriedades e aplicações deste polimorfo metálico do dissulfeto de molibdênio 1T-MoS2: a brief review of the properties and applications of this metallic polymorph of the molybdenum disuldife |
|
Felipe Moreira PintoI; Felipe de Almeida La PortaII; Fernando WypychII,* I. Departamento de Engenharia, Universidade Federal de Lavras, Caixa Postal 3037, 37200-900 Lavras - MG, Brasil Recebido: 13/05/2024 *e-mail: fernandowypych@utfpr.edu.br Due to its excellent physicochemical properties, molybdenum disulfide (MoS2) has emerged as one of the most promising two-dimensional materials, comparable to graphene. This material can occur in three polymorphic/polytypic structures (1T, 2H and 3R) but this article will only focus on the polymorph 1T-MoS2 and its distorted variants 1T', 1T" and T"'. Thus, our objective is to summarize recent advances in understanding the properties of this metallic polytype. Due to their sui generis structures, anisotropic properties, and possibilities of being delaminated and exfoliated and their layers manipulated and reassembled in the most diverse ways, they offer a world of opportunities for future applications, it is enough to have a fertile imagination for important contributions to emerge, even in research centers that have instrumental limitations and specialized personnel. INTRODUÇÃO Dentre os cerca de 5600 materiais com estruturas lamelares conhecidos, somente dois deles têm sido mais intensivamente investigados nos últimos anos a saber, o dissulfeto de molibdênio (MoS2) e o grafeno, a monolamela do grafite. Um dos grandes diferenciais do MoS2 em relação ao grafeno é sua capacidade de apresentar uma banda proibida direta para sua monolamela, o que confere ao material propriedades ópticas únicas e potencial para aplicações em dispositivos eletrônicos e fotônicos. Particularmente, o MoS2 é um importante membro da família dos dicalcogenetos de metais de transição (transition metal dichalcogenides, TMDC). Apesar de existirem compostos sub-estequiométricos, sua fórmula química ideal é representada por MX2 (onde M representa um cátion tetravalente do metal de transição e X, um ânion divalente da família dos calcogênios ou seja, S2-, Se2- ou Te2-).1 Existem três polimorfos/politipos cristalinos do MoS2: 1T (com grupo espacial P-3m1), 2H (com grupo espacial P63/mmc) e 3R (com grupo espacial R3m), além das distorções dos octaedros da fase 1T que são geralmente denominadas de 1T' (distorção zig-zag ou dimerização), 1T" (distorção cadeia de diamante ou tetramerização) e 1T''' (distorção em triângulos ou trimerização),2 embora existam certas controvérsias sobre as estruturas dos últimos três no que se refere a seu grau de distorção estrutural. Na Figura 1a, são ilustradas as estruturas destes três polimorfos/politipos do MoS2.
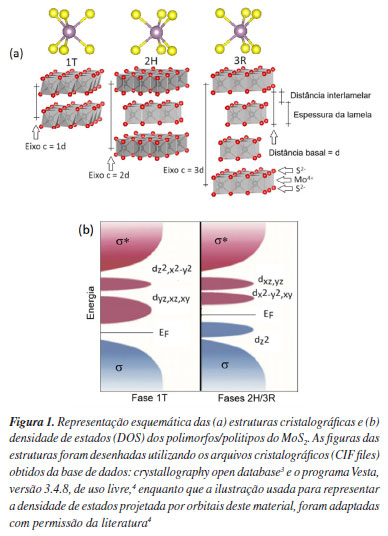
A fase 2H, que foi descrita pela primeira vez em 1923 por Dickinson e Pauling,5 é abundante na natureza na forma do mineral molibdenita e, além disso, pode ser considerada como sendo a fase mais barata dos TMDC. Da mesma forma, a fase 3R foi descrita por Bell e Herfert em 1957,6 sendo também observada na natureza, mas neste caso como um contaminante da fase 2H. Por outro lado, a fase 1T-MoS2 que é alvo desta revisão, foi sintetizada pela primeira vez em 1992 através da oxidação da fase KMoS2 (atualmente denominada de 1T"'),7 tem despertado um grande interesse da comunidade científica devido as suas propriedades metálicas e potenciais aplicações em diversas tecnologias emergentes. A evolução das publicações envolvendo diferentes politipos/polimorfos do MoS2 entre os anos de 1964 e 2014 foi reportada recentemente.8 Especificamente, na fase 1T é conhecido que os cátions Mo4+ estão em geral alocados no centro de um octaedro distorcido (D3d) tendo ânions S2- nos vértices, sendo as unidades ligadas umas às outras pelas arestas, formando lamelas bidimensionais, que são empilhadas ao longo da direção basal. Por outro lado, nas estruturas dos politipos 2H e 3R, os cátions Mo4+ estão no centro de um prisma trigonal regular (D3h) com ânions S2- nos vértices, sendo as unidades ligadas pelas arestas e empilhadas na direção basal de duas maneiras distintas, ou seja, caracterizando os diferentes politipos. Além disso, na fase 2H, a segunda lamela é deslocada em relação à primeira, sendo que a primeira é eclipsada pela terceira (Figura 1a). As diferenças estruturais entre os polimorfos/politipos do MoS2 exercem um impacto significativo nas propriedades do material. Nesse sentido, os pesquisadores investigaram a estrutura eletrônica desses materiais por meio de cálculos teóricos9,10 com o objetivo específico de aprimorar a compreensão dessas alterações. A densidade de estados (density of states, DOS) projetada para os polimorfos/politipos do MoS2 é apresentada na Figura 1b. Os resultados das DOS são fortemente influenciados pelo número de orbitais d. Devido à configuração D3d, observam-se dois conjuntos de orbitais d degenerados (dz2,x2y2 e dxy,xz,yz) na banda de condução da fase 1T. Por outro lado, na fase 2H/3H, que possui configuração D3h, há três grupos de orbitais d devido a sua simetria. Consequentemente, nota-se uma maior contribuição do orbital dz2 na banda de valência, enquanto que os orbitais dx2y2,xy e dxz,yz estão na banda de condução desses sistemas, conforme ilustrado na Figura 1b. Como a estrutura eletrônica do MoS2 é dependente da geometria de coordenação do Mo4+ e elétrons nos orbitais d, as propriedades das diferentes fases podem ser descritas como: 2H-MoS2 é um semicondutor diamagnético com um bandgap de aproximadamente 1,29 eV, a fase 3R possuindo a mesma lamela da fase 2H, possui propriedades físicas e químicas semelhantes, enquanto a fase 1T e suas variantes distorcidas, possuem propriedades metálicas e uma condutividade eletrônica aproximadamente 107 maior que a da fase 2H.1 No MoS2, as ligações Mo-S são predominantemente covalentes, delineando a forma dos clusters observados nas estruturas 1T, 2H e 3R, respectivamente. Por outro lado, as lamelas com três átomos de espessura (S-Mo-S) são empilhadas e mantidas por ligações de van der Waals, conferindo ao material sua morfologia bidimensional e suas propriedades anisotrópicas. Na nomenclatura de Ramsdel, as letras referem-se ao sistema cristalino dos compostos (T: trigonal, H: hexagonal e R: romboédrico), enquanto os números correspondentes (1, 2 e 3) representam o número de lamelas na cela unitária ao longo do empilhamento, conhecido como direção basal (Figura 1). Assim, o objetivo do presente manuscrito é mostrar os avanços recentes envolvendo especificamente a fase 1T-MoS2 (e suas fases distorcidas) destacando suas características distintivas em relação às outras fases e explorando seu potencial em diversas aplicações.10 Iniciamos este trabalho com uma revisão atualizada das estruturas cristalinas das fases 1T-MoS2, baseado em diversos estudos teóricos e experimentais. Em seguida, sintetizamos e discutimos seu potencial em áreas como eletrônica, catálise, sensores, ambiental, dispositivos optoeletrônicos, nanocompósitos poliméricos e medicina, utilizando uma abordagem moderna que considera a relação entre estrutura, propriedade e composição. Finalmente, os exemplos e resultados apresentados indicam claramente a promissora viabilidade da fase 1T-MoS2 para essas aplicações alvo. Estrutura cristalina da fase 1T-MoS2 e suas variantes distorcidas 1T', 1T" e 1T"' Embora a fase 1T seja metaestável e possa se decompor na fase 2H desordenada em temperaturas próximas de 95 ºC,7 ou sob irradiação com micro-ondas,11 ainda existe a possibilidade de estabilizar essa fase por meio de dopagem,12 ou pela introdução de vacâncias de enxofre.13 Além disso, as fases denominadas 1T', 1T" e 1T"', que correspondem a pequenas distorções da fase regular 1T após esfoliação, foram primeiramente descritas quando KMoS2 foi oxidado por vários oxidantes.7 A fase 1T-MoS2 tem sido objeto de crescente interesse nos últimos anos devido às suas propriedades atrativas e enorme potencial tecnológico, como descrito na literatura científica recente.1,10 As Figuras 2a e 2c mostram as diferentes estruturas descritas para as variantes da fase metálica do MoS2 na rede real e suas respectivas representações esquemáticas obtidas dos padrões de difração de elétrons em área selecionada (selected area electron diffraction, SAED) (Figuras 2b e 2d). Os padrões de SAED são uma projeção da rede recíproca, com reflexões da rede aparecendo como pontos de difração nítidos. As pequenas distorções estruturais que originam as diferentes variantes da fase 1T-MoS2 não foram indicadas na Figura 2, pela falta de consenso na literatura, porém propostas recentes têm tentado compilar e explicar essas distorções, utilizando-se cálculos teóricos à nível DFT (density functional theory).2
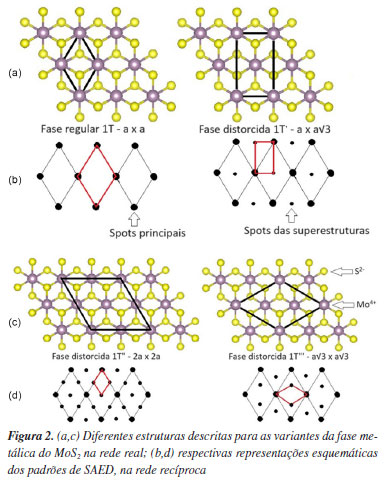
Na verdade, a maioria dessas fases, apesar de serem descritas em artigos recentes como "novas", já foram anteriormente identificadas. Por exemplo, a fase denominada de 1T foi descrita com a superestrutura do tipo a√3 × a√3,14 que corresponde, na realidade, à fase 1T"' descrita em 201815 (Figura 2). Além disso, a superestrutura do tipo a × a√3 descrita por Fang et al. ,15 como sendo relativa à fase 1T', já foi descrita anteriormente e corresponde a fase parcialmente intercalada com íons potássio hidratados.14 Essa estrutura também pode ser descrita como tendo a superestrutura do tipo 2a × 2a, quando da superposição de três domínios cristalinos do tipo a × a√3, com rotações de 60 e 120º (geminação ou triplicação). Ambas as fases, no entanto, foram amplamente estudadas por difração de elétrons em área selecionada (SAED) e microscopia de tunelamento (scanning tunneling microscopy, STM).16,17 Observa-se uma confusão frequente na literatura no que se refere as fases polimórficas/politípicas do MoS2, onde estudos experimentais envolvendo compostos de intercalação descritos na literatura sendo atribuídos as fases não intercaladas. Um caso típico é descrito no artigo de Lu et al. ,18 que estudaram as propriedades do LiMoS2, onde o molibdênio ocorre no estado de oxidação 3+. No entanto, todo o trabalho descreve a fase como sendo do 1T"-MoS2, sem que nenhum processo de oxidação tenha sido descrito para a eventual obtenção da fase contendo somente Mo4+. As pequenas distorções estruturais que originam as diferentes variantes da fase 1T-MoS2 não foram indicadas na Figura 2, devido à falta de consenso na literatura. Essa falta de atenção a esses aspectos, em especial a ausência de técnicas de caracterização rigorosas para determinar a composição química das fases analisadas e identificar o politipo presente nos experimentos, é uma lacuna comum até mesmo em revistas de alto impacto.19 Isso resulta em inconsistências e na dificuldade frequente de reproduzir os dados publicados, o que, por sua vez, pode limitar significativamente a aplicabilidade desses materiais lamelares em dispositivos comerciais. Strachan et al.20 deixam claro essas preocupações no que se refere as dificuldades de reproduzir alguns dados da literatura, principalmente por falta de caracterizações adequadas. Recentemente, a estrutura do 1T-MoS2 foi revisada e os parâmetros de rede foram determinados como sendo a = b = 3,190(3) Å e c = 5,945(6) Å.11 Essencialmente podemos notar que esses valores são bem próximos daqueles publicados anteriormente (a = b = 5,597 Å; a = b = 3,23 Å e c = 5,994 Å), mas a revisão não aponta a superestrutura que ocorre no 1T-MoS2, devido a trimerização dos cátions Mo4+ que ocorre nesta rede cristalina.7 A fase descrita em 1992 na verdade se trata da fase 1T"'. O Material Suplementar (mostra os difratogramas de raios X simulados das fases 1T (Figura 1S), 2H (Figura 2S) e 3R (Figura 3S), obtidos a partir dos arquivos CIF de cada uma das estruturas, com auxílio do programa Mercury, versão 4.2.0,21 de uso livre (λ = 1,5418 Å, passo de 0,02º e largura a meia altura de 0,2º). Observe-se que os difratogramas são muito semelhantes, especialmente no que se refere as posições dos picos basais já que os parâmetros de rede basais são muito próximos. Diferenciações entre as estruturas somente são observadas a partir de 30º (em 2θ), onde picos de difração com índices de Miller do tipo 10l são observados. As superestruturas indicadas na Figura 2, se existentes, seriam observadas por picos de difração de baixa intensidade. A Tabela 1 apresenta um resumo das propriedades físico-químicas adicionais relacionas à fase 1T-MoS2.22-27

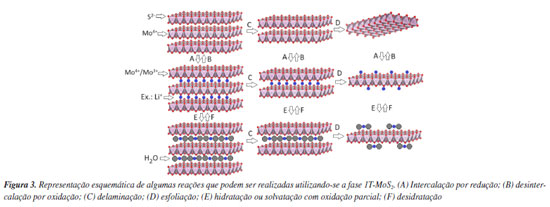
Devido a semelhança e pequenas distorções da estrutura regular 1T, em geral, a diferenciação das fases de maior interesse na área de materiais bidimensionais de TMDC (2H e 1T e variantes 1T', 1T" e 1T"') é difícil de ser realizada apenas por difração de raios X (DRX). Nesse contexto, a espectroscopia Raman emerge como a técnica analítica instrumental mais utilizada, não apenas para diferenciar as fases, mas também para identificar o número de lamelas empilhadas ao longo do plano basal.28-31 Sendo assim, a fase 2H apresenta bandas ativas no Raman em torno de 400 e 380 cm-1, as quais são atribuídas aos modos vibracionais E12g e A1g, respectivamente. Por outro lado, as bandas ativas no Raman na fase 1T (não se sabe se a regular ou distorcida), são observadas em 400, 380, 330, 280, 220 e 150 cm-1, respectivamente.32 Outra forma de diferenciar as diferentes distorções da fase metálica do MoS2 é através do emprego da técnica SAED, na qual um feixe de elétrons incide sobre a fase de um monocristal lamelar e a rede recíproca é registrada na forma de um padrão de difração. As diferentes fases registradas por SAED podem ser visualizadas esquematicamente na Figura 2b. Além disso, é importante destacar que outras técnicas relatadas como adequadas para diferenciar as fases 2H e 1T incluem a espectroscopia eletrônica na região do ultravioleta-visível (UV-Vis) e através das bandas de fotoluminescência.33 Muitos estudos recentes utilizam as palavras-chave quentes da literatura como, por exemplo, "single layers" ou "monolayers", para descrever materiais lamelares. No entanto, é crucial distinguir que uma monocamada é uma camada única de átomos formando uma estrutura bidimensional contínua, enquanto que uma monolamela é a unidade de repetição da construção do composto lamelar, sendo o caso específico do grafeno no cristal da grafita. Uma camada ou um filme se forma quando partículas lamelares são depositadas num substrato plano e orientadas ao longo do plano do substrato. Nessas condições de orientação dos cristais lamelares seja por spin coating, evaporação de dispersões aquosas pingadas sobre o substrato ou até por prensagem, nos difratogramas de raios X são observados predominantemente picos de difração basais (00l). A comprovação da existência de monolamelas individuais é desafiadora devido à sua natureza intrínseca que as torna altamente instáveis e propensas à agregação e distorção. Particularmente, monolamelas individuais só existem em dispersões aquosas bem diluídas, onde as interações com o solvente e controle do ponto isoelétrico minimizam a agregação, ou em deposições sobre substratos atomicamente planos que oferecem um suporte físico para as monolamelas, para evitar reempilhamentos desordenados de monolamelas (isto é, formação de estruturas turbostráticas). Mesmo com o uso de técnicas avançadas de caracterização, como a microscopia eletrônica de transmissão de alta resolução e microscopia de força atômica, podem não ser suficientes para confirmar a presença de monolamelas individuais.34,35 Nesse contexto, o termo "monolamela" do MoS2 foi provavelmente usado pela primeira vez no trabalho de Pollack et al. ,36 em 1983. Posteriormente, em 1986, no trabalho de Joensen et al. ,37 monolamelas foram descritas após esfoliação do LiMoS2 em água, obtido a partir da intercalação de 2H-MoS2 com n-butillitio. No trabalho de Yang et al.38 em 1991, os estudos de DRX, espalhamento Raman e SAED sugeriram que a geometria do molibdênio nas lamelas é octaédrica distorcida em vez da geometria trigonal prismática, como ocorre na fase 2H-MoS2. Além disso, os autores explicaram que após reempilhamento das lamelas, a fase obtida é metaestável e que, após aquecimento ou envelhecimento, ela se transforma na fase 2H distorcida. A Figura 3 mostra uma representação esquemática de algumas reações que podem ser realizadas utilizando-se a fase 1T-MoS2 ((A) intercalação por redução (ex.: MoS2 + e- + Li+ → LiMoS2); (B) desintercalação por oxidação (ex.: LiMoS2 → MoS2 + e- + Li+); (C) delaminação; (D) esfoliação; (E) hidratação ou solvatação com oxidação parcial (LiMoS2 + H2O → Li1-x(H2O)yMoS2 + x Li+ + x/2 H2 + x OH-); (F) desidratação (Li1-x(H2O)yMoS2 → LixMoS2 + y H2O)).
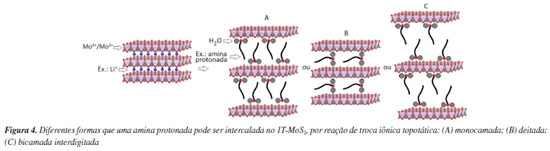
Observa-se que a reação de intercalação/desintercalação se trata de um processo redox com fluxo de elétrons e cátions, o que a torna análoga aos princípios de uma bateria. Devido ao seu baixo raio iônico e alta mobilidade entre as lamelas, o íon lítio é preferencialmente utilizado porque permite processos de carga/descarga mais rápidos e com baixa distorção do eletrodo. É importante notar que as reações redox são processadas em estado sólido para evitar a hidratação do íon, o que poderia resultar na expansão e consequente rompimento do eletrodo. Após as reações, lamelas individuais obtidas por esfoliação ou um pequeno número de lamelas empilhadas obtidas por delaminação podem ser novamente empilhadas, resultando em partículas com desordem turbostrática, ou seja, as lamelas são empilhadas ao acaso. Lamelas individuais (ou cristais lamelares) podem ter suas superfícies laterais ou basais funcionalizadas, bem como, cátions intercalados e superficiais podem ser trocados por outros cátions de diferentes tamanhos, cargas e composições químicas, o que altera as características hidrofílicas/hidrofóbicas das partículas obtidas. A Figura 4 apresenta um exemplo no qual íons lítio foram trocados topotaticamente por uma amina protonada, CH3(CH2)n-NH3+, em solução aquosa. Uma reação topotática é um processo químico em que uma substância hóspede é intercalada na estrutura de um material hospedeiro sólido, resultando em mudanças na composição química e rearranjos atômicos, porém preservando a estrutura geral do material hospedeiro, mesmo com a quebra e formação de ligações químicas.39,40 Essa reação, que pode ser reversível ou não, possibilita a exploração de novos fenômenos físico-químicos, além de suas aplicações práticas.
Normalmente, nesse tipo de reação, ocorre apenas uma alteração no espaçamento basal (expansão ou contração dependendo do tamanho da espécie hóspede) e, em alguns casos, podem ocorrer transições interpolitípicas e alterações das propriedades do material hospedeiro lamelar. Dependendo da concentração de amina e água, observa-se que a amina protonada pode adquirir a conformação na forma de uma monocamada (Figura 4A), deitada (Figura 4B) ou bicamada interdigitada (Figura 4C). A compreensão dos fatores que governam a intercalação e a conformação das espécies hóspedes é crucial para o design de novos materiais funcionais. Portanto, é crucial reconhecer que essas alterações estruturais impactam significativamente nas propriedades e funcionalidades destes materiais lamelares, como sua condutividade elétrica, capacidade de adsorção, atividade catalítica e em baterias de íons lítio, as quais serão melhor descritas a seguir.
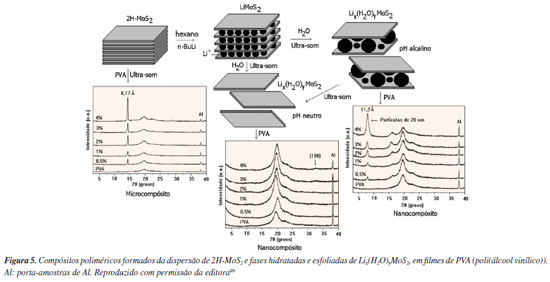
APLICAÇÕES DA FASE 1T-MoS2 Supercondutores De acordo com o conhecimento dos autores, a supercondutividade em TMDC foi descoberta em 1972 para o sistema 2H-NbSe2.41 Desde então, vários membros desta classe de materiais avançados foram extensivamente investigados para essa aplicação. Entre eles, as variantes das fases metálicas do MoS2 apresentam propriedades interessantes para exibir supercondutividade em duas dimensões. Desse modo, a monolamela da fase 1T' obtida a partir da oxidação da fase LiMoS2, apresenta supercondutividade com "onset" da transição supercondutora em 4,6 K.42 A supercondutividade de poucas lamelas da fase 1T-MoS2 (~12 unidades empilhadas) foi determinada como próxima a 0,9 K quando amostras foram obtidas a partir da fase 2H, utilizando-se engenharia de fase assistida por plasma de micro-ondas. De acordo com Sharma et al. ,43 a observação da supercondutividade em duas dimensões torna a fase 1T-MoS2 uma opção viável para hospedar circuitos quânticos híbridos monolíticos do tipo bidimensionais. Além disso, existe um consenso na literatura de que a supercondutividade observada em poucas lamelas da fase 1T-MoS2 é provavelmente devido a mudanças nos mínimos da banda de condução global para os vales K/K'.44,45 Fang et al.15 sintetizaram monocristais de MoS2 na fase 1T e caracterizaram sua estrutura cristalina por meio de DRX de monocristal. Além disso, foi observada uma transição supercondutora nos cristais de 1T-MoS2 a uma temperatura crítica de aproximadamente 4 K. Peng et al.46 investigaram o processo de exfoliação direta do cristal 1T', resultando na obtenção de empilhamento de poucas lamelas de 1T'-MoS2 com alta pureza. Esse método contorna os desafios tradicionais associados à transformação incompleta de 2H para 1T', representando um avanço significativo na obtenção de materiais de alta qualidade. Além disso, o estudo revela a supercondutividade intrínseca do 1T'-MoS2, mesmo em escalas atômicas, com uma temperatura de transição de 4,6 K. O estudo também aborda a interação entre a supercondutividade 2D e a interação spin-órbita, observando um aumento significativo no campo crítico superior em relação ao limite de Pauli em empilhamento de poucas lamelas. Esses resultados sugerem uma forte interação entre esses fenômenos, abrindo caminho para uma compreensão mais profunda dos estados topológicos em materiais 2D metastáveis. Utilizando poucas lamelas empilhadas de 1T'-MoS2, obtidas a partir da remoção de íons de lítio de cristais de LiMoS2, Guo et al.42 observaram supercondutividade com uma temperatura crítica de transição de 4,6 K. Este material apresentou uma estrutura de uma monolamela baseada em octaedros compartilhados nas bordas. Por fim, Costanzo et al.26 examinaram a relação entre a espessura do filme de MoS2 e a temperatura crítica de transição supercondutora. A capacidade de controlar a fase e a espessura desses materiais, juntamente com a compreensão dos mecanismos subjacentes à supercondutividade, abre caminho para o desenvolvimento de dispositivos quânticos inovadores e aplicações em áreas como computação quântica e spintrônica.15,26,42,43,46 Supercapacitores Supercapacitores eletroquímicos representam uma classe de dispositivos de armazenamento de energia altamente eficientes, sendo capazes de converter energia de forma rápida e eficaz através da formação de duplas camadas elétricas e/ou reações redox na superfície.47-49 Nesse contexto, o MoS2 possui características únicas destacadas anteriormente que o tornam um material ideal para supercapacitores. Por exemplo, sua ampla área superficial específica, espaçamento interplanar basal de cerca de 6,2 Å, alta capacitância teórica de até 1504 F g-1 e sua capacidade de apresentar vários estados de oxidação, variando de 2+ a 6+, destacam seu enorme potencial como material de eletrodo para supercapacitores.47,48 Portanto, a partir desta perspectiva, o MoS2 esfoliado quimicamente na forma de nanopartículas lamelares, contendo alta concentração do politipo 1T, foi intercalado com diferentes cátions monovalentes e as suas propriedades de capacitor foram avaliadas. Resultados em vários eletrólitos demonstraram que valores de capacitância entre 400 e 700 F cm-3 podem ser obtidos para o MoS2 intercalado, além de suportar altas tensões de operação (3,5 V) em solução não aquosa, resultando em uma eficiência superior a 95% e estabilidade acima de 5000 ciclos de operação. Esse desempenho eletroquímico favorável pode ser explicado pela hidrofilicidade e alta condutividade elétrica, habilidade de ser intercalado com diferentes cátions, além das propriedades de poder ser delaminado e esfoliado.50 Além disso, estudos da aplicação da fase 1T-MoS2 na forma de nanotubos mostraram uma excelente capacitância específica de 328 F g-1, com excelente retenção de capacitância de ~98,4% após 5000 ciclos a uma densidade de corrente de 3 A g-1. Notavelmente, uma alta capacitância específica de 250 F g-1 a 1 A g-1 também foi observada em uma célula simétrica de dois eletrodos, sugerindo seu grande potencial para supercapacitores de nova geração.51 No trabalho desenvolvido por Joseph et al. ,52 utilizou-se uma metodologia para criar alta densidade de defeitos nas bordas das partículas o que, de acordo com os autores, produz um efeito de melhora das propriedades do material. Os estudos eletroquímicos demostraram que o eletrodo preparado exibe uma capacitância específica máxima de 379 F g-1 e 68,9 F g-1 a 1 A g-1 de densidade de corrente em três e dois sistemas de eletrodos, respectivamente. O supercapacitor simétrico exibiu um excelente desempenho celular com uma densidade de energia de 21,3 Wh kg-1, a uma densidade de potência de 750 W kg-1 e uma retenção de capacitância de 92% após 3000 ciclos. Um sistema envolvendo multicamadas de três tipos de estruturas lamelares incluindo 2H-MoS2, MoS2-CTAB (CTAB, cetyltrimethylammonium bromide) e 1T-MoS2 foram obtidas por síntese hidrotérmica. Os supercapacitores flexíveis de estado sólido exibiram uma alta capacitância de 310 mF cm-2 a 1 mA cm-1, excelente flexibilidade e excelente estabilidade de ciclo, com a retenção de capacitância acima de 97,3 e 84,1% após 10.000 e 30.000 ciclos, respectivamente.53 Após esfoliação eletroquímica e modificação química das superfícies basais com iodobenzeno, observou-se um significativo aprimoramento no desempenho do supercapacitor. Essa abordagem resultou em melhorias na densidade de carga e nas propriedades eletrônicas do dispositivo, promovendo um transporte rápido de carga e uma alta capacidade de armazenamento de energia. Particularmente, a capacitância específica medida foi de 501 F g-1 a uma densidade de corrente de 1 A g-1, com retenção de capacitância de ~76,32% após 2000 ciclos, que é 2,6 vezes maior que a fase 1T-MoS2 sem modificação química.54 A constante busca por novas estratégias de síntese e modificação deve continuar a impulsionar o desenvolvimento desses dispositivos, abrindo caminho para aplicações cada vez mais avançadas e sustentáveis no campo do armazenamento de energia. Catalisadores A fase 1T-MoS2 foi descrita como catalisador em fase heterogênea na hidrogenação de nitroaromáticos, utilizando água como solvente "verde" e também em uma síntese sequencial one-pot de bases de Schiff a partir de nitroaromáticos e aldeídos. Este catalisador demonstrou excelente reciclabilidade, mantendo sua atividade catalítica mesmo após seis ciclos sucessivos, além de tempos de reação curtos. Além disso, quando se utilizou água como solvente, tanto a conversão quanto a seletividade superaram 99 e 97%, respectivamente, enquanto que o uso de tolueno como solvente resultou em valores ainda mais altos, superiores a 99% para ambos parâmetros.55 A síntese eletroquímica de amônia através da reação de redução de nitrogênio (N2) tem emergido como uma abordagem promissora para a produção desse importante composto químico em comparação com o processo convencional de Haber-Bosch, utilizando industrialmente. A busca por catalisadores eficientes e seletivos tem sido um foco de intensa pesquisa, visando superar os desafios cinéticos associados à ativação da molécula N2. Neste contexto, a incorporação de materiais bidimensionais, como 1T-MoS2, tem sido explorada como uma estratégia promissora para desenvolver catalisadores de alta performance na síntese eletroquímica de amônia. No trabalho desenvolvido por Zhao et al. ,56 estudos por DFT demonstraram que V e Ti ancorados na estrutura do 1T-MoS2 são candidatos potenciais para a obtenção de catalisadores de átomos únicos, para a fixação de N2 e obtenção de amônia. No que se refere a redução eletroquímica de CO2, visando a obtenção de hidrocarbonetos de alto valor agregado e a mitigação do impacto ambiental do CO2, os resultados mostraram que a incorporação de metais de transição à fase 1T-MoS2 pode enriquecer as variedades dos produtos obtidos. Entre os catalisadores avaliados, aqueles contendo rutênio e platina demonstraram potenciais aceitáveis de -0,56 e -0,73 V, respectivamente, para a redução de CO2 para metano e metanol. Além disso, catalisadores contendo rênio e zinco foram considerados catalisadores promissores para a geração de metanol, exibindo potenciais de -0,13 e -0,22 V, respectivamente.57 A hidrogenação em fase heterogênea seletiva do anidrido maleico para produzir anidrido succínico foi estudada, revelando uma excepcional atividade e seletividade (ambas de 100%), comparável aos catalisadores comerciais a base de metais nobres. A taxa de reação específica aumenta de forma linear com a concentração de 1T-MoS2, confirmando a excelente atividade intrínseca do catalisador. Além disso, os sítios de Mo ricos em elétrons nas bordas de Mo oxidado do 1T-MoS2 formam sítios ativos do tipo (HO-Mo-S-Mo-S-Mo-OH), que confinam o modo de adsorção de anidrido malêico devido ao efeito estérico e promovem a ativação de H2 devido aos elétrons itinerantes de Mo4+ na fase 1T-MoS2.58 No contexto da fotocatálise de moléculas de interesse ambiental, em particular, o aumento significativo na atividade fotocatalítica da fase 1T-MoS2 foi investigada na estrutura heteroepitaxial de 1T-MoS2 e SnO2, obtida usando o método de síntese hidrotérmico convencional.59 Servindo como substrato para o crescimento da fase desejada de 1T-MoS2, o SnO2 de menor granulação favorece um crescimento epitaxial mais efetivo do 1T-MoS2. Como resultado, misturas de 1T-MoS2/SnO2 foram preparadas com diferentes tamanhos de partículas de SnO2 para degradação fotocatalítica do corante azul de metileno. Particularmente, observou-se que a fase SnO2 pura não apresentou atividade fotocatalítica significativa sob irradiação com luz visível para degradação da molécula de corante azul de metileno, provavelmente devido ao seu grande bandgap (~3,7 eV). Em paralelo, cerca de 10% do azul de metileno foi degradado em uma hora utilizando-se MoS2 puro preparado pelo método hidrotérmico. No entanto, o emprego de misturas de 1T-MoS2/SnO2 revelou um efeito sinérgico, possibilitando a degradação de cerca de 80% da solução de azul de metileno.59 A fase 1T-MoS2 foi sintetizada a partir da fase amorfa e quando dopada com níquel e submetida a pressão de 15 bar se apresentou como um excelente catalisador com tripla função, evolução de hidrogênio, evolução de oxigênio e redução de oxigênio, demonstrando a diversidade de reações que a fase condutora do MoS2 pode conduzir.60 Geração de hidrogênio No momento, o material utilizado na reação de evolução de hidrogênio (hydrogen evolution reaction, HER: 2H+ + 2e− → H2) é baseado em platina depositada sobre carbono, sendo, portanto, um metal nobre de alto custo e de produção limitada. Na busca de alternativas de processar a reação tanto em meio ácido quando básico, de menor custo, de alta hidrofilicidade, alta resistência química e de fácil escalonamento, a fase condutora do MoS2 se apresenta como uma boa opção.1 Ao contrário da fase 2H, a qual possui somente sítios catalíticos ativos nas ligações insaturadas nas bordas dos cristais, a fase 1T possui sítios catalíticos ativos não somente nas bordas, mas também nas superfícies das lamelas, especialmente se vacâncias estruturais forem geradas por métodos químicos ou físicos.33 No caso da fase 1T, muitos estudos estão em curso no sentido de melhorar a sua atividade catalítica, aumentar a sua estabilidade térmica e melhorar os métodos de síntese de forma que maiores quantidades de material possam ser obtidas. Uma revisão recente aborda várias vantagens, desvantagens e gargalos a serem resolvidos para uma aplicação da fase 1T-MoS2 como catalisador para a produção de hidrogênio.61 Outros trabalhos mostraram o desempenho positivo na geração de hidrogênio utilizando a fase 1T, na forma lamelar ou na forma de nanoesferas.62,63 Além das reações de geração de hidrogênio, outras aplicações como catalisadores como hidrodessulfurização e hidrogenação de hidrocarbonetos, além de outros foram também investigadas com a fase 1T.64 Estudos recentes realizados por Peng et al.65 exploraram o potencial de dopagens com estruturas mono/bimetálicos na fase 1T-MoS2 (TiTi@1T-MoS2, VTi@1T-MoS2, NiTi@1T-MoS2, CuTi@1T-MoS2, PdTi@1T-MoS2) como eletrocatalisadores para reações de evolução de hidrogênio, utilizando a DFT com spin polarizado. Os resultados indicaram que essas dopagens possibilitaram a obtenção de eletrocatalisadores altamente estáveis e eficientes nas reações de HER através do controle sistemático da composição e estrutura eletrônica. Observou-se que os átomos de Ti isolados ancorados no plano basal da fase 1T-MoS2 atuaram como centro ativo para adsorção de H* em vez do S proximal, exibindo excelente estabilidade estrutural e atividade catalítica. Surpreendentemente, esses catalisadores superaram até mesmo os catalisadores comerciais baseados em platina. Esses materiais, entretanto, carecem de experimentos para validar os cálculos realizados por DFT. Essas descobertas destacam o potencial dos eletrocatalisadores baseados em 1T-MoS2 dopados com átomos mono/bimetálicos como alternativas promissoras e sustentáveis para a HER. Sensores A utilização da fase 1T-MoS2 na fabricação de sensores ultrassensíveis foi recentemente descrita por Dai et al.66 Nesse trabalho utilizou-se um método eletroquímico para detectar mercúrio, em um eletrodo contendo a fase 1T esfoliada. Após a modificação e otimização dos eletrodos, curvas de trabalho para ambos os materiais foram obtidas, obtendo-se limites de detecção para eletrodos de carbono vítreo contendo 1T-MoS2 de 1,54 × 10-19 mol L-1, sendo seis ordens de magnitude menor do que o de 2H-MoS2 (1,46 × 10-13 mol L-1). Além disso, o método de detecção eletroquímica também exibiu seletividade superior a outros dez íons selecionados devido à alta afinidade entre Hg e S. A estabilidade e reprodutibilidade do novo método também foi impressionante, e as taxas de recuperação usando amostras reais foram todas na faixa de 99,8-101,2% devido à excelente sensibilidade. No trabalho de Tegegne et al. ,67 a fase 1T-MoS2 foi sintetizada pelo método hidrotermal e decorada com nanopartículas de prata. Os resultados mostraram que o material resultante 1T-MoS2/Ag alcançou um fator de incremento recorde na intensificação de espalhamento por meio de superfície (SERS, surface-enhanced Raman spectroscopy ou surface-enhanced Raman scattering) de 1,78 × 107, um baixo limite de detecção de 10-12 mol L-1 e boa reprodutibilidade na detecção de rodamina 6G em comparação com os outros substratos. Além disso, o substrato SERS é capaz de detectar pesticidas tiram e tiabendazol em suco e casca de maçã. O limite de detecção do tiram e do tiabendazol caiu para 0,15 e 10 ppb, respectivamente. Dessa forma, a detecção multicomponente de uma mistura de tiram e do tiabendazol foi analisada com sucesso. Er et al.68 avaliaram o uso do 1T-MoS2 como sensor para SERS. Ao utilizar uma rota eficiente de exfoliação química com ligas metálicas NaK, derivados de MoS2 exfoliados e funcionalizados covalentemente foram obtidos com uma alta proporção da fase metálica (1T), de até 94,5%. Como resultado, o MoS2 exfoliado apresentou uma significativa atividade SERS em relação à rodamina 6G (R6G) e violeta cristalina, com baixos limites de detecção. Essa abordagem demonstra a versatilidade de funcionalização covalente do MoS2 sem depender de defeitos de borda ou planos basais da estrutura, preservando assim a alta proporção da fase 1T. Er e Erk69 avaliaram ainda 1T-MoS2 decorado com nanoestruturas de ouro de diferentes formas para a detecção de doxorrubicina (DOX). O sensor mostrou uma resposta linear em relação à concentração de DOX, com um limite de detecção de 2,5 nano molar. Além disso, foi eficaz na determinação rápida e sensível de DOX em amostras de soro humano. Dai et al.66 desenvolveram um método eletroquímico para detecção de íons de mercúrio usando lamelas metálicas de 1T-MoS2. Alcançou-se uma sensibilidade significativamente maior e limites de detecção (limits of detection, LODs) drasticamente reduzidos devido à resistência de transferência de carga dramaticamente reduzida das lamelas de 1T-MoS2 em comparação com as de semicondutor 2H-MoS2. Surpreendentemente, os LODs dos eletrodos de carbono vítreo modificados com 1T-MoS2 foram calculados em 1,54 × 10−19 mol L-1, seis ordens de magnitude mais baixos do que os de 2H-MoS2 (1,46 × 10−13 mol L-1). Além disso, o método de detecção eletroquímica baseado em 1T-MoS2 também exibiu uma seletividade superior para outros dez íons selecionados devido à alta afinidade entre Hg e S. A estabilidade e reprodutibilidade do novo método foram impressionantes, e as taxas de recuperação usando amostras reais de água contaminada estavam todas na faixa de 99,8-101,2%, devido à sensibilidade excepcional. Baterias Estudos eletroquímicos de intercalação da fase 1T-MoS2 se iniciaram logo após a descoberta dessa fase em 1992,7 primeiramente conduzidos em solução aquosa, onde 4 picos no ciclovoltamograma foram observados com a intercalação de íons potássio, sendo o processo totalmente reversível.70 Além disso, a condutividade eletrônica e o maior espaçamento entre lamelas no 1T-MoS2 facilita a intercalação e difusão de cátions e fluxo de elétrons, processos essenciais para o armazenamento e liberação de energia em baterias.71 Mais recentemente a fase foi investigada como eletrodo de baterias utilizando soluções de NaPF6 em etileno glicol e dimetil carbonato como eletrólito e a fase 1T-MoS2 diretamente depositada no eletrodo de metal. O voltamograma cíclico indicou um processo de redução irreversível após o primeiro ciclo e os ciclos reversíveis demonstram uma capacidade de 597, 384, 326, 297, 228, 159, 106, e 56 mAh g-1 em densidades de corrente de 0,08, 0,2, 0,5, 1,0, 2,0, 5,0, 10, e 20 A g-1, respectivamente, indicando esse material com grande potencial para aplicação em eletrodos de baterias de sódio.72 Poucas lamelas de 1T-MoS2 (entre 1 e 2) foram obtidas e investigadas como anodos de baterias de sódio. O material apresentou uma alta capacidade reversível de 450 mAh g-1 a 50 mA g-1 e excelente estabilidade de ciclagem com uma alta taxa de retenção de capacidade de 94% após 200 ciclos a 1 A g-1, que é muito superior à da contraparte da fase 2H-MoS2. Experimentos foram complementados por estudos por DFT que mostram que, além da condutividade eletrônica significativamente aumentada, o 1T-MoS2 também possui muito mais afinidade pelo de sódio e mobilidade mais rápida dos íons Na+ entre as lamelas, em comparação com a fase 2H.73 No estudo da fase 1T como eletrodo de baterias de lítio, o eletrodo de trabalho foi preparado misturando o material com negro de acetileno, fluoreto de poli(vinilideno) e n-metilpirrolidona. A mistura foi depositada sobre eletrodo de cobre. O eletrodo sólido foi preparado com 75% de Li2S e 25% de P2S5 (em percentagem molar) e as medidas de voltametria cíclica conduzidas a 0,2 mV s-1. Observou-se uma estabilidade de ciclagem muito boa com capacidade de 406 mAh g-1 após 50 ciclos a uma densidade de corrente de 0,2 coulombs.74 No trabalho desenvolvido por Zhang et al. ,75 a metaestabilidade do 1T-MoS2 foi contornada através da intercalação de Ni2+ em sua estrutura. A configuração eletrônica original dos orbitais 4d do Mo é alterada através da injeção de elétrons pelo Ni, que desencadeia a transição de fase da fase 2H para 1T, melhorando assim a condutividade elétrica e acelerando a cinética redox do material. Consequentemente, a fase o 1T-Ni-MoS2 exibe capacidade superior (266,8 mAh g-1 a 10 A g-1) e excelente vida útil do ciclo (358,7 mAh g-1 a 1 A g-1) após 350 ciclos, demonstrando excelentes propriedades eletroquímicas e com grandes perspectivas para aplicação em dispositivos de armazenamento de energia. Fotodetectores Fotodetectores, dispositivos optoeletrônicos que convertem luz em sinais elétricos, são componentes essenciais em diversas tecnologias modernas. Particularmente, o 1T-MoS2, com sua alta fotossensibilidade, ampla faixa de resposta espectral, flexibilidade e compatibilidade com processos de fabricação em larga escala, surge como um material promissor para revolucionar o desempenho desses dispositivos.76-79 Wang et al.77 propuseram um fotodetector ultrarrápido baseado em MoS2, com um canal que consiste em uma camada de partículas lamelares de 2H-MoS2 sensibilizante sobre 1T@2H-MoS2. A camada de 1T@2H-MoS2 tem uma espessura de vários nanômetros e é uma mistura de 1T-MoS2 metálico e 2H-MoS2 semicondutor, conferindo propriedades metálicas ao fotodetector. Em comparação com o fotodetector de camada de 2H-MoS2, foi observado um aumento drástico na fotoresposta do fotodetector empilhando verticalmente camadas de 2H-MoS2/1T@2H-MoS2. A maior densidade de portadores e maior mobilidade da camada de 1T@2H-MoS2 explicam o melhor desempenho modulado por polarização. Jetani e Rahmani76 depositaram um filme de MoS2 (camada) com fase 1T dominante, via uma rota hidrotérmica em solução alcalina. A predominância da fase 1T, confirmada por análises de Raman e DRX, aumenta a disponibilidade de sites ativos no filme. Imagens de microscopia eletrônica revelou a formação de longos nanofios de MoS2 no topo de microesferas em forma de novelo. Cada microesfera é composta de nanopartículas lamelares encaracoladas. O fotosensor fabricado com este material apresentou uma resposta de 26% à luz incidente 450 nm, demonstrando alta estabilidade. Os resultados obtidos mostraram o efeito da fase 1T-MoS2 e da estrutura de nanofios na melhoria do desempenho de fotodetectores e apresentaram um método simples para a síntese de filmes de MoS2 com morfologia de nanofios. Um método simples de deposição química em fase vapor para preparar estruturas heterofásicas verticais 1H/1T' de MoS2 foi recentemente descrito.77 O dispositivo integrado baseado na estrutura 1H/1T' de MoS2 exibe um comportamento retificador típico e uma responsividade relevante mesmo com uma corrente escura baixa. Esses resultados sugerem que as estruturas 1H/1T' de MoS2 podem ser candidatas promissoras para futuros retificadores e fotodetectores. Remediação ambiental O trabalho realizado por Li et al. ,79 demonstrou a síntese da fase 1T-MoS2 por um processo solvotérmico simples em dois estágios, utilizando-se etanol e água como solventes e o material foi aplicado na remoção de Cr6+, um cátion extremamente tóxico aos organismos vivos e ao meio ambiente. O material apresentou uma capacidade de sorção de 200,3 mg g-1, mantendo sua capacidade mesmo após ter sido utilizado em 5 ciclos de adsorção/dessorção. O estudo do mecanismo de adsorção do Cr6+ revelou que a adsorção de cromo foi atribuída ao Mo4+ com ligações insaturadas como sítio ativo e acoplado à reação redox durante o processo de remoção. No trabalho de Cheng et al. ,80 1T-MoS2 com vacâncias de enxofre e na forma de nanoflores foi depositado sobre uma matriz de carbono e o material utilizado para remover o antibiótico tetraciclina de soluções aquosas, revelando uma capacidade máxima de adsorção de 124,4 mg g-1. Mais notavelmente, o aerogel à base de MoS2/C apresentou excelente desempenho fototérmico, o que poderia elevar sinergicamente a temperatura local. A transpiração induzida pela evaporação solar foi capaz de acelerar a adsorção de tetraciclina, devido ao comportamento endotérmico do processo de adsorção de tetraciclina. O aerogel à base de MoS2/C atingiu uma excelente taxa de evaporação de água de 2,54 kg m-2 por hora sob uma iluminação solar, que é 11 vezes maior que a da água pura. O protótipo de purificação solar baseado em aerogel à base de MoS2/C poderia efetivamente remover tetraciclina e gerar água doce. A produção de água doce foi de cerca de 33,6 kg m-2, e as tetraciclinas foram completamente removidas na água condensada, em dias ensolarados. Omar et al.81 testaram a influência das fases do MoS2, bem como a concentração de 1T, no desempenho de adsorção dos corantes orgânicos azul de metileno, rodamina e alaranjado de metila. Os resultados revelaram que as nanopartículas de MoS2 ricas em 1T apresentam desempenho de adsorção superior em comparação com outras fases 2H e 3R. O modelo de Langmuir fornece o melhor ajuste aos dados experimentais com uma capacidade máxima de adsorção de 787 mg g−1. A capacidade obtida é significativamente maior do que a de todos os relatórios anteriores para materiais de MoS2 semelhantes. Estudos computacionais das fases 2H e 1T/2H-MoS2 mostraram que os defeitos estruturais presentes nas fronteiras de grãos 1T/2H aumentam a ligação de grupos hidroxila e carboxila à superfície do MoS2, o que, por sua vez, aumenta as propriedades de adsorção da fase 1T/2H-MoS2. Zhang et al.82 desenvolveram um método simples para sintetizar nanopartículas de MoS2 de alta pureza de fase e ricas em defeitos atômicos induzidos pela luz solar (S-ADR-MoS2). A irradiação solar levou à formação de vacâncias atômicas (com diâmetros entre aproximadamente 0,4 e 0,9 nm; enxofre e molibdênio foram co-deletados) nas nanopartículas do 1T-MoS2, atacando ·OH e ·O2-. Consequentemente, o S-ADR-MoS2 (1T-MoS2 rico em defeitos atômicos induzidos pela luz solar) apresentou alta seletividade e afinidade para metais tóxicos, e 1 g de S-ADR-MoS2 sob 1 e 4 iluminações solares capturou 638 mg e 902 mg de Pb2+, respectivamente, o que é melhor do que o desempenho da maioria dos nanomateriais à base de grafeno e enxofre funcionalizados.83,84 Demonstrou-se que a captura iônica de características ricas em defeitos por meio de interações de Lewis macio-macio e atrações eletrostáticas foi o mecanismo dominante para a capacidade aprimorada de remoção de Pb2+ sob irradiação solar. Além disso, a membrana empilhada em camadas de S-ADR-MoS2 alcançou altos fluxos de água (181-345 L m−2 h−1 bar−1) e alto desempenho de separação para Pb2+ (84,5-99,6%), resultando em uma concentração de Pb2+ na água tratada abaixo dos limites da Agência de Proteção Ambiental dos EUA82 para água potável. O S-ADR-MoS2 também foi capaz de capturar eficientemente outros metais tóxicos, como Al3+ e Cd2+, exibindo alto potencial para o tratamento de água potável contaminada. Luo et al.85 investigaram teórica e experimentalmente o comportamento de adsorção de metais pesados (Pb2+ e Cu2+) em diferentes fases de MoS2 (fase metálica (1T) e fase semicondutora (2H)). Os resultados computacionais indicaram que tanto Pb2+ quanto Cu2+ formaram complexos mais estáveis em 1T-MoS2 em comparação com 2H-MoS2 devido à menor energia de adsorção (Ead). Isso sugere que Pb2+ e Cu2+ foram preferencialmente adsorvidos em 1T-MoS2. Com base nesses resultados, nanopartículas de MoS2 bidimensionais (2D) com fases 1T e 2H idênticas foram sintetizadas via reação hidrotérmica. Como previsto, 1T-MoS2 apresentou excelentes capacidades de adsorção de Pb2+ e Cu2+, 147,09 e 82,13 mg g-1 a 298 K, respectivamente, em comparação com 2H-MoS2 (ou seja, 64,16 e 50,74 mg g-1 a 298 K). Além disso, o 1T-MoS2 mostrou outras propriedades superiores, como (i) cinética de adsorção ultrarrápida e (ii) grande atividade anti-interferência em relação a outros cátions existentes, em comparação com 2H-MoS2. Análises extensivas de complexos de adsorção MoS2-Pb e -Cu ilustraram que os sítios S ativos eram indispensáveis para a adsorção de metais pesados. No geral, pela primeira vez, foram fornecidas evidências de que 1T-MoS2 é mais funcional na remoção de metais pesados em comparação com 2H-MoS2, o que pode orientar e ampliar as aplicações de adsorventes à base de MoS2 na remediação ambiental. Compostos de intercalação Vários compostos de intercalação, sem qualquer aplicação específica já foram amplamente descritos, desde os primórdios do processo de intercalação da fase 2H-MoS2 com n-butilítio,36,86-88 seguido de processos de delaminação/esfoliação e reações de troca iônica diversos,15,38,70,86,89-92 além de estudos mais recentes.93 É importante citar que quando a reação da fase 2H-MoS2 é processada com n-butillítio, esse último é sensível ao ar. Da mesma forma, a fase 1T-LiMoS2 (2H-MoS2 + n-BuLi → 1T-LiMoS2 + 0,5 n-octano) é pirofórica e somente pode ser manipulada em atmosfera inerte. Após o processo de hidratação e oxidação parcial (1T-LiMoS2 + H2O → 1T-Li1-x(H2O)yMoS2 + x Li+ x/2 H2 + x OH-), a fase obtida pode ser manipulada ao ar, porém, mesmo assim, apresenta certa instabilidade após meses de exposição ao ar.87,89,91 A fase 1T-MoS2 obtida pela oxidação total da fase 1T-Li1-x(H2O)y MoS2 (1T-Li1-x(H2O)yMoS2 + oxidante → 1T-MoS2 + 1-x Li+) possui certa estabilidade ao ar, porém, para evitar a contaminação com seu produto de decomposição (2H-MoS2 desordenado), é conveniente mantê-la em atmosfera inerte, principalmente se encontrada na forma delaminada ou esfoliada, as quais são mais sensíveis à decomposição. No que se refere à estabilidade térmica, a fase 1T-MoS2 que tem coloração dourada, se converte à fase 2H-MoS2 desordenada de coloração cinza, a uma temperatura próxima de 95 ºC.7 Attanayake et al.94 intercalaram cátions metálicos na região intercalar do MoS2 na fase 1T, visando melhorar a eficiência do material em HER. A intercalação provavelmente diminui a sobretensão para a HER, em parte, aumentando a área superficial das amostras intercaladas. Além disso, cálculos de DFT sugerem que a intercalação de um cátion metálico de banda sp ou d na fase 1T do MoS2 resulta em uma mudança de ΔGH (energia livre de Gibbs), em relação ao ΔGH associado ao material sem intercalante, que pode estar relacionada a uma atividade aprimorada para a HER. Esses resultados fornecem insights valiosos para o desenvolvimento de catalisadores mais eficientes para a produção de hidrogênio. Como já discutido na sub-seção "Baterias", a intercalação da fase 1T-MoS2 é altamente vantajosa para sua aplicação em supercapacitores.95,96 Os nanocanais fornecidos pelo espaço interlamelar dos eletrodos de MoS2 são de grande importância para alcançar uma alta capacitância, permitindo uma rápida intercalação dos cátions. Além disso, o MoS2 do tipo 1T metálico é mais favorável como material de eletrodo para supercapacitores, pois é mais condutivo, beneficiando o transporte de elétrons para supercapacitores de alta potência, e possui alta hidrofilicidade e um espaço interlamelar maior, facilitando a intercalação de vários íons.90,96 Essas características fazem com que os supercapacitores baseados em 1T-MoS2 alcancem taxas ultra-rápidas e uma capacitância extraordinariamente alta.50 Nanocompósitos poliméricos Imediatamente após o processo de intercalação da fase com n-BuLi, descrita nos anos 70 e 80, despertou-se o interesse para a utilização das lamelas individuais (ou monolamelas) na preparação de nanocompósitos poliméricos, sendo através da dispersão das lamelas no polímero ou através da intercalação das macromoléculas entre as lamelas do 1T-Li1-x(H2O)yMoS2.93,97-100 Nanocompósito polimérico é definido como tendo uma matriz polimérica no qual são dispersas partículas (no presente caso 1T-MoS2 ou seus compostos de intercalação), tendo pelo menos uma das dimensões (no presente caso a dimensão ao longo do empilhamento das lamelas) menores que 100 nm. A ideia principal no caso dos nanocompósitos poliméricos contendo os cristais do 1T-MoS2 ou seus compostos de intercalação delaminados ou esfoliados, é o efeito sinérgico que pode ser observado quando as propriedades dos polímeros são combinadas com as propriedades das nanopartículas, surgindo novas propriedades ou reforçando as propriedades da matriz polimérica. Esse efeito sinérgico surge quando existe uma boa dispersão do material inorgânico na matriz polimérica, um teor ideal e uma boa interação do polímero com a superfície das partículas da fase dispersa. Um exemplo didático relatado na literatura mostra o processo de formação de compósitos de PVA (poli(álcool vinílico)) com 2H-MoS2 e diferentes fases intercaladas com lítio hidratado (Figura 5).99 Os materiais obtidos na forma de filmes obtidos por evaporação das soluções/dispersões (casting úmido) apresentaram coloração escura, ao contrário do polímero puro, que formava filmes transparentes.
Ao adicionar várias proporções de 2H-MoS2 no PVA (caracterizado por DRX por picos de difração característico em 6,17 Å (lado esquerdo da Figura 5), além de um halo amorfo centrado na região de 20 graus (em 2θ)). Após hidratação e dispersão no PVA, um nanocompósito é obtido e picos característicos de 11,2 Å são observados e atribuídos à Lix(H2O)yMoS2 (lado direito da Figura 5). Essa intercalação também induz uma transição de fase de 2H para 1T no MoS2. No entanto, após esfoliação e dispersão, nenhum pico de difração é observado além do halo amorfo (parte central da Figura 5), indicando a presença de monolamelas ou poucas lamelares empilhadas de tal forma que domínios cristalinos ao longo da direção basal não são suficientemente grandes para difratar picos do tipo 00l, caracterizando um nanocompósito.99 De modo geral, algumas propriedades dos polímeros a serem afetadas pela dispersão das fases 1T são: aumento da condutividade elétrica, aumento da estabilidade térmica, aumento da transição vítrea em polímeros amorfos, aumento do índice de cristalinidade para polímeros semi-cristalinos, melhora das propriedades mecânicas, melhora das propriedades tribológicas (aumento de lubricidade), atribuição de propriedade anti-chama, diminuição do teor de cinzas e fumaça durante combustão parcial, diminuição da permeação de gases, seletividade na permeação de gases em membranas poliméricas, alteração das propriedades óticas, entre outros. Estudos de intercalação químicos ou eletroquímicos também foram publicados no início da década de 90, mostrando a formação de fases intermediárias com a estabilização de estruturas com teores variáveis de cátions alcalinos e moléculas de água de hidratação.101,102 Células solares O crescente interesse em fontes de energia renovável tem impulsionado a pesquisa em materiais avançados para aplicações em células solares.103-106 A fase 1T-MoS2 apresenta potencial para ser empregada em células solares, especialmente em células solares sensibilizadas por pontos quânticos (quantum dot-sensitized solar cells, QDSSCs). Estas células, similares em estrutura e mecanismos de trabalho às células solares sensibilizadas por corante, têm recebido grande atenção como uma das células solares de terceira geração devido às propriedades físicas intrigantes dos QDs e seu processo de fabricação de baixo custo e simples, além da alta eficiência teórica de conversão de energia (até 44%). A possibilidade de interface entre a fase 1T-MoS2 e os QDs poderia ser explorada para melhorar a eficiência de conversão de energia dessas células solares, superando os desafios atuais de desempenho enfrentados pelas QDSSCs.103 Como parte integrante dos dispositivos de conversão de energia solar, a fase 1T-MoS2 tem duas aplicações distintas: como contra eletrodo103 e na formação de uma junção tipo-II heteroestrutura com p-Si para operação fotovoltaica.104 A presença do MoS2 cria um campo elétrico embutido próximo à interface com o p-Si, promovendo a separação eficaz de portadores fotogerados. Esta heteroestrutura alcança uma impressionante eficiência de conversão de energia de 5,23%, a mais alta entre todas as células solares baseadas em monolamelas de dicalcogenetos de metais de transição.104 Esses resultados promovem o potencial da integração de materiais 2D, como o MoS2, com eletrônicos de silício comerciais, oferecendo perspectivas promissoras para o desenvolvimento de dispositivos fotovoltaicos altamente eficientes e economicamente viáveis. A fase 1T-MoS2 na forma de favo de mel foi fabricado como um eficiente contra-eletrodo para células solares sensibilizadas por pontos quânticos via método hidrotermal, usando um template. Experimentos eletroquímicos demostraram que a resistência de transferência de carga de interface do 1T-MoS2 é de apenas 0,66 Ω com 3% de template. A eficiência de conversão de energia do dispositivo atingiu 6,03%, sendo que o desempenho foi atribuído principalmente à vantagem morfológica única e excelente condutividade, atividade catalítica e hidrofilicidade do 1T-MoS2. O 1T-MoS2 esférico em formato de favo de mel aumenta a área superficial específica e fornece ricos sítios catalíticos ativos e canais de transporte de eletrólitos, o que também aumenta a estabilidade do 1T-MoS2.105 Outras nanoestruturas com diferentes formatos, como nanoflores, também têm sido estudadas para aplicação em células solares.103 O estudo demonstrou que as DSSCs com o 1T-MoS2 como contra eletrodo apresentaram uma excelente eficiência de conversão de energia de 7,08%, que é três vezes maior do que a eficiência (1,72%) obtida com MoS2 na fase 2H. Esses resultados indicam um novo e promissor caminho para o uso de MoS2 na fase 1T como material de eletrodo em DSSCs, abrindo possibilidades para melhorias significativas na eficiência de conversão de energia desses dispositivos. Aplicações biomédicas A crescente exploração do 1T-MoS2 na área médica destaca seu potencial promissor além das aplicações convencionais.107-110 Sua notável biocompatibilidade in vitro tem aberto portas para uma série de aplicação biomédicas inovadoras. De acordo com Bharti et al. ,107 destacaram que as nanoestruturas de MoS2, fornecem muitas oportunidades para avanços em biosensoriamento, bioimagem, fotoproteção, sistemas de liberação de nanofármacos, detecção eletroquímica e terapia genética. Todos esses avanços são resultados dos esforços que têm sido feitos nos últimos anos para melhorar as propriedades físico-químicas do MoS2, através do refinamento de métodos de síntese, funcionalização de superfície e avaliação da biocompatibilidade, visando garantir seu uso seguro e eficaz em aplicações biomédicas.107-110 A maioria desses trabalhos tem sido experimentalmente desenvolvidos e respaldados por cálculos computacionais, especialmente utilizando-se DFT. Essa convergência entre experimentação e modelagem computacional tem impulsionado significativamente a pesquisa nesse campo, ampliando as possibilidades de aplicação do 1T-MoS2 na medicina e destacando seu papel promissor no avanço da saúde e da tecnologia biomédica. A preparação bem-sucedida de nanopartículas de ouro depositadas sobre a superfície da fase 1T-MoS2 (MoS2@AuNRs) e o subsequente uso em fototerapia foram exploradas na literatura.108 Em particular, a fototermoterapia e a terapia fotodinâmica do material MoS2@AuNRs foram confirmadas utilizando-se E. coli, pela contagem de placas de ágar. Para o efeito fotodinâmico, os materiais MoS2@AuNR mostraram-se capazes de gerar espécies reativas de oxigênio quando irradiados com luz visível. Mais importante, a combinação de terapia fototérmica e terapia fotodinâmica dos materiais MoS2@AuNR revelou maior atividade antibacteriana do que a terapia fototérmica ou fotodinâmica isolada, demonstrando que os materiais estudados, ativados por luz, exibiram um notável efeito sinérgico da terapia fototérmica e da terapia fotodinâmica, que fornece uma abordagem alternativa para combater infecções bacterianas. Heteroestruturas de van der Waals contendo nitreto de carbono (g-C3N4) e 1T-MoS2 foram produzidos e funcionalizados com polietilenoglicol (PEG), conforme descrito no estudo de Dai et al.110 Os resultados dos estudos in vitro revelaram que as espécies reativas de oxigênio geradas intracelularmente podem levar à morte celular. Esse processo ocorre por meio da indução de apoptose e/ou necrose celular através da mediação de ectrópio fosfatidilserina, despolarização mitocondrial e fragmentação do DNA cromossômico. Além disso, observou-se um aumento na expressão de proteínas relacionadas à apoptose e um desequilíbrio da homeostase redox intracelular. Esses resultados sugerem o potencial das heteroestruturas de g-C3N4/1T-MoS2 como agentes indutores de morte celular seletiva, abrindo caminho para aplicações em terapias anticâncer e outras abordagens biomédicas. Os resultados da exploração in vivo foram igualmente promissores, demonstrando uma significativa inibição no crescimento através da terapia fotodinâmica. Além disso, foi confirmada a excelente biocompatibilidade e biossegurança dos materiais avaliados, destacando ainda mais o potencial dessas terapias baseadas no 1T-MoS2 com estratégia para o tratamento de câncer e outras condições médicas.
CONCLUSÕES E PERPECTIVAS FUTURAS Embora os TMDC e seus compostos de intercalação tenham sido objeto de interesse desde a década de 1950, o verdadeiro ápice desses estudos ocorreu entre as décadas de 1970 a 1990.111 Este período foi marcado pelo surgimento do processo de esfoliação descritas em 1983,38 permitindo a obtenção das monolamelas, e pelo desenvolvimento de equipamentos que permitissem manipular e medir as propriedades das monolamelas do MoS2 em 2005.112 A fabricação do primeiro transistor baseado em uma monolamela deste material em 2011,113 além do surgimento de uma infinidade de possibilidade de aplicações industriais, levou a um ressurgimento significativo dos estudos a partir de 2012.8 Entre os estudos fundamentais e uma aplicação real em um dispositivo se passaram praticamente 60 anos, o que reforça a necessidade de que a pesquisa básica seja fortemente incentivada pelos órgãos de fomento. Sem o entendimento claro das estruturas e propriedades dos materiais, não se pode imaginar a alteração dessas propriedades para transformar em um produto que possa servir a sociedade. Apesar do gigantesco volume de estudos envolvendo as fases polimórficas/politípicas do MoS2, especialmente a fase condutora 1T-MoS2, novas rotas de síntese e propriedades continuam sendo descobertas diariamente,114 principalmente quando se trata de sua aplicação em heteroestruturas envolvendo outros compostos lamelares e mais recentemente no estudo das superestruturas de Moiré, com aplicações diretas na recém criada twistrônica.115-117 Basicamente tem se investido muito no estudo em 2 materiais lamelares ditos da moda (como o MoS2 e o grafeno), porém existe uma fila de praticamente 5600 materiais lamelares a serem estudados,118 o que precisa motivar a comunidade científica para transformar esses produtos em materiais de maior valor agregado como, por exemplo, os argilominerais da classe dos filossilicatos, hidróxidos duplos lamelares, entre outros. Como os recentes progressos nas técnicas de caracterização e fabricação de dispositivos cada vez menores e com as mais variadas funções, não é possível prever o que vai ocorrer num futuro próximo, mas certamente a classe de materiais lamelares ainda possui um enorme potencial para gerar produtos e processos inovadores que beneficiarão a sociedade como um todo. Essa perspectiva promissora reforça em larga medida a importância do investimento para fomentar a pesquisa básica e aplicada para o desenvolvimento de produtos e processos envolvendo essa fascinante e versátil classe de materiais lamelares.
MATERIAL SUPLEMENTAR O material suplementar desse trabalho está disponível em http://quimicanova.sbq.org.br/, na forma de arquivo PDF, com acesso livre.
AGRADECIMENTOS F. Wypych agradece a FINEP, Capes (código de financiamento 001) e CNPq pela bolsa produtividade em pesquisa (303776/2023-4).
REFERÊNCIAS 1. Pinto, F. M.; de Conti, M. C. M. D.; Pereira, W. S.; Sczancoski, J. C.; Medina, M.; Corradini, P. G.; de Brito, J. F.; Nogueira, A. E.; Góes, M. S.; Ferreira, O. P.; Mascaro, L. H.; Wypych, F.; La Porta, F. A.; Catalysts 2024, 14, 388. [Crossref] 2. Austeria, M. P.; Babu, P. V.; Heine, T.; Sampath, S.; Kim, D. H.; Appl. Surf. Sci. 2024, 652, 159303. [Crossref] 3. Gražulis, S.; Chateigner, D.; Downs, R. T.; Yokochi, A. T.; Quirós, M.; Lutterotti, L.; Manakova, E.; Butkus, J.; Moeck, P.; Le Bail, A.; J. Appl. Crystallogr. 2009, 42, 726 [Crossref]; Crystallography Open Database, https://www.crystallography.net/cod/browse.html, acessado em novembro 2024. 4. Momma, K.; Izumi, F.; J. Appl. Crystallogr. 2011, 44, 1272. [Crossref] 5. Dickinson, R. G.; Pauling, L.; J. Am. Chem. Soc. 1923, 45, 1466. [Crossref] 6. Bell, R. E.; Herfert, R. E.; J. Am. Chem. Soc. 1957, 79, 3351. [Crossref] 7. Wypych, F.; Schöllhorn, R.; J. Chem. Soc. , Chem. Commun. 1992, 1386. [Crossref] 8. Song, I.; Park, C.; Choi, H. C.; RSC Adv. 2015, 5, 7495. [Crossref] 9. Kuc, A.; Heine, T.; Chem. Soc. Rev. 2015, 44, 2603. [Crossref] 10. Krishnan, U.; Kaur, M.; Singh, K.; Kumar, M.; Kumar, A.; Superlattices Microstruct. 2019, 128, 274. [Crossref] 11. Xu, D.; Zhu, Y.; Liu, J.; Li, Y.; Peng, W.; Zhang, G.; Zhang, F.; Fan, X.; Nanotechnology 2016, 27, 385604. [Crossref] 12. Enyashin, A. N.; Yadgarov, L.; Houben, L.; Popov, I.; Weidenbach, M.; Tenne, R.; Bar-Sadan, M.; Seifert, G.; J. Phys. Chem. C 2011, 115, 24586. [Crossref] 13. Gan, X.; Lee, L. Y. S.; Wong, K. -y.; Lo, T. W.; Ho, K. H.; Lei, D. Y.; Zhao, H.; ACS Appl. Energy Mater. 2018, 1, 4754. [Crossref] 14. Wypych, F.; Weber, T.; Prins, R.; Chem. Mater. 1998, 10, 723. [Crossref] 15. Fang, Y.; Pan, J.; He, J.; Luo, R.; Wang, D.; Che, X.; Bu, K.; Zhao, W.; Liu, P.; Mu, G.; Zhang, H.; Lin, T.; Huang, F.; Angew. Chem. , Int. Ed. 2018, 57, 1232. [Crossref] 16. Wypych, F.; Weber, T.; Prins, R.; Surf. Sci. 1997, 380, L474. [Crossref] 17. Wypych, F.; Solenthaler, C.; Prins, R.; Weber, T.; J. Solid State Chem. 1999, 144, 430. [Crossref] 18. Lu, H.; Aramberri, H.; Lipatov, A.; Proksch, R.; Sinitskii, A.; Íñiguez, J.; Gruverman, A.; ACS Mater. Lett. 2023, 5, 3136. [Crossref] 19. Zhao, X.; Ning, S.; Fu, W.; Pennycook, S. J.; Loh, K. P.; Adv. Mater. 2018, 30, 1802397. [Crossref] 20. Strachan, J.; Masters, A. F.; Maschmeyer, T.; J. Mater. Chem. A 2021, 9, 9451. [Crossref] 21. Mercury, versão 4.2.0; CCDC, Cambridge, 2019. 22. Liu, Q.; Li, X.; He, Q.; Khalil, A.; Liu, D.; Xiang, T.; Wu, X.; Song, L.; Small 2015, 11, 5556. [Crossref] 23. Ge, Y.; Wan, W.; Ren, Y.; Liu, Y.; Phys. Rev. Res. 2020, 2, 013134. [Crossref] 24. Haynes, W. M.; CRC Handbook of Chemistry and Physics, 97th ed.; CRC Press: Boca Raton, 2016. 25. Kappera, R.; Voiry, D.; Yalcin, S. E.; Branch, B.; Gupta, G.; Mohite, A. D.; Chhowalla, M.; Nat. Mater. 2014, 13, 1128. [Crossref] 26. Costanzo, D.; Jo, S.; Berger, H.; Morpurgo, A. F.; Nat. Nanotechnol. 2016, 11, 339. [Crossref] 27. Kim, J. S.; Kim, J.; Zhao, J.; Kim, S.; Lee, J. H.; Jin, Y.; Choi, H.; Moon, B. H.; Bae, J. J.; Lee, Y. H.; Lim, S. C.; ACS Nano 2016, 10, 7500. [Crossref] 28. Li, H.; Zhang, Q.; Yap, C. C. R.; Tay, B. K.; Edwin, T. H. T.; Olivier, A.; Baillargeat, D.; Adv. Funct. Mater. 2012, 22, 1385. [Crossref] 29. Gontijo, R. N.; Zhang, T.; Fujisawa, K.; Elías, A. L.; Pimenta, M. A.; Righi, A.; Terrones, M.; Fantini, C.; 2D Mater. 2021, 8, 035042. [Crossref] 30. Lemos, J. S.; Blundo, E.; Polimeni, A.; Pimenta, M. A.; Righi, A.; Nanomaterials 2023, 13, 2722. [Crossref] 31. Lee, J. -U.; Kim, K.; Han, S.; Ryu, G. H.; Lee, Z.; Cheong, H.; ACS Nano 2016, 10, 1948. [Crossref] 32. Saha, D.; Kruse, P.; J. Electrochem. Soc. 2020, 167, 126517. [Crossref] 33. Jayabal, S.; Wu, J.; Chen, J.; Geng, D.; Meng, X.; Mater. Today Energy 2018, 10, 264. [Crossref] 34. Coleman, J. N.; Lotya, M.; O'Neill, A.; Bergin, S. D.; King, P. J.; Khan, U.; Young, K.; Gaucher, A.; De, S.; Smith, R. J.; Shvets, I. V.; Arora, S. K.; Stanton, G.; Kim, H. -Y.; Lee, K.; Kim, G. T.; Duesberg, G. S.; Hallam, T.; Boland, J. J.; Wang, J. J.; Donegan, J. F.; Grunlan, J. C.; Moriarty, G.; Shmeliov, A.; Nicholls, R. J.; Perkins, J. M.; Grieveson, E. M.; Theuwissen, K.; McComb, D. W.; Nellist, P. D.; Nicolosi, V.; Science 2011, 331, 568. [Crossref] 35. Nicolosi, V.; Chhowalla, M.; Kanatzidis, M. G.; Strano, M. S.; Coleman, J. N.; Science 2013, 340, 1226419. [Crossref] 36. Pollack, S. S.; Sanders, J. V.; Tischer, R. E.; Appl. Catal. 1983, 8, 383. [Crossref] 37. Joensen, P.; Frindt, R. F.; Morrison, S. R.; Mater. Res. Bull. 1986, 21, 457. [Crossref] 38. Yang, D.; Sandoval, S. J.; Divigalpitiya, W. M. R.; Irwin, J. C.; Frindt, R. F.; Phys. Rev. B 1991, 43, 12053. [Crossref] 39. Benavente, E.; Santa Ana, M. A.; Mendizábal, F.; González, G.; Coord. Chem. Rev. 2002, 224, 87. [Crossref] 40. Clearfield, A.; Chem. Mater. 1998, 10, 2801. [Crossref] 41. Frindt, R. F.; Phys. Rev. Lett. 1972, 28, 299. [Crossref] 42. Guo, C.; Pan, J.; Li, H.; Lin, T.; Liu, P.; Song, C.; Wang, D.; Mu, G.; Lai, X.; Zhang, H.; Zhou, W.; Chen, M.; Huang, F.; J. Mater. Chem. C 2017, 5, 10855. [Crossref] 43. Sharma, C. H.; Surendran, A. P.; Varma, S. S.; Thalakulam, M.; Commun. Phys. 2018, 1, 90. [Crossref] 44. Brumme, T.; Calandra, M.; Mauri, F.; Phys. Rev. B 2015, 91, 155436. [Crossref] 45. Piatti, E.; De Fazio, D.; Daghero, D.; Tamalampudi, S. R.; Yoon, D.; Ferrari, A. C.; Gonnelli, R. S.; Nano Lett. 2018, 18, 4821. [Crossref] 46. Peng, J.; Liu, Y.; Luo, X.; Wu, J.; Lin, Y.; Guo, Y.; Zhao, J.; Wu, X.; Wu, C.; Xie Y.; Adv. Mater. 2019, 31, 1900568. [Crossref] 47. Bello, I. T.; Oladipo, A. O.; Adedokun, O.; Dhlamini, S. M.; Mater. Today Commun. 2020, 25, 101664. [Crossref] 48. Wang, L.; Wu, J.; Wang, X.; Fu, S.; J. Alloys Compd. 2023, 959, 170548. [Crossref] 49. Lin, Z.; Goikolea, E.; Balducci, A.; Naoi, K.; Taberna, P. L.; Salanne, M.; Yushin, G.; Simon, P.; Mater. Today 2018, 21, 419. [Crossref] 50. Acerce, M.; Voiry, D.; Chhowalla, M.; Nat. Nanotechnol. 2015, 10, 313. [Crossref] 51. Yang, S.; Zhang, K.; Wang, C.; Zhang, Y.; Chen, S.; Wu, C.; Vasileff, A.; Qiao, S. -Z.; Song, L.; J. Mater. Chem. A 2017, 5, 23704. [Crossref] 52. Joseph, N.; Shafi, P. M.; Bose, A. C.; New J. Chem. 2018, 42, 12082. [Crossref] 53. Wang, X.; Ding, W.; Li, H.; Li, H.; Zhu, S.; Zhu, X.; Dai, J.; Sheng, Z.; Wang, H.; Zhu, X.; Sun, Y.; Dou, S. X.; J. Mater. Chem. A 2019, 7, 19152. [Crossref] 54. Naz, R.; Abbas, W.; Liu, Q.; Shafi, S.; Gull, S.; Khan, S.; Rasheed, T.; Song, G.; Gu, J.; J. Alloys Compd. 2023, 951, 169944. [Crossref] 55. Ramalingam, A.; Samaraj, E.; Venkateshwaran, S.; Senthilkumar, S. M.; Senadi, G. C.; New J. Chem. 2022, 46, 8720. [Crossref] 56. Zhao, P.; Wang, H.; Huang, Z.; Fan, B.; Liu, Y.; Yin, Z.; Wang, Y.; Zheng, X.; Deng, Y.; Fan, X.; Appl. Surf. Sci. 2023, 631, 157480. [Crossref] 57. Linghu, Y.; Tong, T.; Li, C.; Wu, C.; Appl. Surf. Sci. 2022, 590, 153001. [Crossref] 58. Zhao, Y.; Chang, K.; Gu, Q.; Yang, B.; Xu, J.; Zhang, Y.; Pan, C.; Wang, Z.; Lou, Y.; Zhu, Y.; ACS Catal. 2022, 12, 8986. [Crossref] 59. Shan, S.; Zhu, S.; Pan, Z.; Lu, Y.; Liu, Y.; Tao, Y.; Cryst. Res. Technol. 2021, 56, 2000091. [Crossref] 60. Choi, Y.; Ahn, T. -Y.; Kim, J. -Y.; Lee, E. H.; Yu, H. -R.; RSC Adv. 2023, 13, 18122. [Crossref] 61. Tang, J.; Huang, J.; Ding, D.; Zhang, S.; Deng, X.; Int. J. Hydrogen Energy 2022, 47, 39771. [Crossref] 62. Zhang, Y.; Wang, L.; Chen, Q.; Cao, J.; Zhang, C.; Front. Chem. 2022, 10, 1000406. [Crossref] 63. Wang, S.; Li, Y.; Hu, Y.; Zhou, X.; Zhang, M.; Jia, X.; Yang, Y.; Lin, B. -L.; Chen, G.; ACS Appl. Energy Mater. 2022, 5, 11705. [Crossref] 64. Palencia-Ruiz, S.; Uzio, D.; Legens, C.; Laurenti, D.; Afanasiev, P.; Appl. Catal. , A 2021, 626, 118355. [Crossref] 65. Peng, Q.; Qi, X.; Gong, X.; Chen, Y.; Materials 2021, 14, 4073. [Crossref] 66. Dai, J.; Yao, L.; Gao, X.; Bai, S.; Chen, X.; Li, L.; Song, J.; Yang, H.; Electrochim. Acta 2020, 355, 136800. [Crossref] 67. Tegegne, W. A.; Su, W. -N.; Tsai, M. -C.; Beyene, A. B.; Hwang, B. -J.; Appl. Mater. Today 2020, 21, 100871. [Crossref] 68. Er, E.; Hou, H. -L.; Criado, A.; Langer, J.; Möller, M.; Erk, N.; Liz-Marzán, L. M.; Prato, M.; Chem. Mater. 2019, 31, 5725. [Crossref] 69. Er, E.; Erk, N.; Microchim. Acta 2020, 187, 223. [Crossref] 70. Wypych, F.; Sollmann, K.; Schöllhorn, R.; Mater. Res. Bull. 1992, 27, 545. [Crossref] 71. Liu, Y.; Qu, B.; Li, S.; Lian, X.; Luo, Y.; Shen, X.; Xu, C.; Wang, J.; Pan, F.; Adv. Funct. Mater. 2024, 34, 2405586. [Crossref] 72. Lane, C.; Cao, D.; Li, H.; Jiao, Y.; Barbiellini, B.; Bansil, A.; Zhu, H.; Condens. Matter 2019, 4, 53. [Crossref] 73. Sun, D.; Huang, D.; Wang, H.; Xu, G. -L.; Zhang, X.; Zhang, R.; Tang, Y.; EI-Hady, D. A.; Alshitari, W.; AL-Bogami, A. S.; Amine, K.; Shao, M.; Nano Energy 2019, 61, 361. [Crossref] 74. Chong, P.; Zhou, Z.; Wang, K.; Zhai, W.; Li, Y.; Wang, J.; Wei, M.; Batteries 2023, 9, 26. [Crossref] 75. Zhang, Y.; Li, J.; Li, X.; Shan, L.; Zhao, W.; Wang, J.; Gao, Q.; Cai, Z.; Zhou, C.; Han, B.; Amine, K.; Sun, R.; Nano Lett. 2024, 24, 3331. [Crossref] 76. Jetani, G. H.; Rahmani, M. B.; Opt. Quantum Electron. 2024, 56, 533. [Crossref] 77. Wang, W.; Zeng, X.; Warner, J. H.; Guo, Z.; Hu, Y.; Zeng, Y.; Lu, J.; Jin, W.; Wang, S.; Lu, J.; Zeng, Y.; Xiao, Y.; ACS Appl. Mater. Interfaces 2020, 12, 33325. [Crossref] 78. Wang, Y.; Zhai, W.; Ren, Y.; Zhang, Q.; Yao, Y.; Li, S.; Yang, Q.; Zhou, X.; Li, Z.; Chi, B.; Liang, J.; He, Z.; Gu, L.; Zhang, H.; Adv. Mater. 2024, 36, 2307269. [Crossref] 79. Li, Z.; Fan, R.; Hu, Z.; Li, W.; Zhou, H.; Kang, S.; Zhang, Y.; Zhang, H.; Wang, G.; J. Hazard. Mater. 2020, 394, 122525. [Crossref] 80. Cheng, X.; Yang, L.; Sun, F.; Shi, Y.; Wang, Z.; Liu, C.; Yu, F.; Wang, X.; Zhang, Q.; Ceram. Int. 2023, 49, 37901. [Crossref] 81. Omar, A. M.; Metwalli, O. I.; Saber, M. R.; Khabiri, G.; Ali, M. E. M.; Hassen, A.; Khalil, M. M. H.; Maarouf, A. A.; Khalil, A. S. G.; RSC Adv. 2019, 9, 28345. [Crossref] 82. Zhang, L.; He, X.; Zhou, Q.; Hu, X.; Chem. Eng. J. 2020, 386, 123996. [Crossref] 83. Saha, D.; Barakat, S.; Van Bramer, S. E.; Nelson, K. A.; Hensley, D. K.; Chen, J.; ACS Appl. Mater. Interfaces 2016, 8, 34132. [Crossref] 84. Wang, J.; Zhang, W.; Yue, X.; Yang, Q.; Liu, F.; Wang, Y.; Zhang, D.; Li, Z.; Wang, J.; J. Mater. Chem. A 2016, 4, 3893. [Crossref] 85. Luo, J.; Fu, K.; Sun, M.; Yin, K.; Wang, D.; Liu, X.; Crittenden, J. C.; ACS Appl Mater. Interfaces 2019, 11, 38789. [Crossref] 86. Gee, M. A.; Frindt, R. F.; Joensen, P.; Morrison, S. R.; Mater. Res. Bull. 1986, 21, 543. [Crossref] 87. Py, M. A.; Haering, R. R.; Can. J. Phys. 1983, 61, 76. [Crossref] 88. Mattheiss, L. F.; Phys. Rev. B 1973, 8, 3719. [Crossref] 89. Divigalpitiya, W. M. R.; Frindt, R. F.; Morrison, S. R.; Science 1989, 246, 369. [Crossref] 90. Wypych, F.; Quim. Nova 2014, 37, 1220. [Crossref] 91. Wypych, F.; Quim. Nova 2002, 25, 83. [Crossref] 92. Wypych, F.; Schöllhorn, R.; Quim. Nova 1996, 19, 5. [Link] acessado em novembro 2024 93. Xie, W.; Xiao, C.; Sun, Y.; Fan, Y.; Zhao, B.; Zhang, D.; Fan, T.; Zhou, H.; Adv. Funct. Mater. 2023, 33, 2305734. [Crossref] 94. Attanayake, N. H.; Thenuwara, A. C.; Patra, A.; Aulin, Y. V.; Tran, T. M.; Chakraborty, H.; Borguet, E.; Klein, M. L.; Perdew, J. P.; Strongin, D. R.; ACS Energy Lett. 2018, 3, 7. [Crossref] 95. Shi, S.; Sun, Z.; Hu, Y. H.; J. Mater. Chem. A 2018, 6, 23932. [Crossref] 96. Lei, Z.; Zhan, J.; Tang, L.; Zhang, Y.; Wang, Y.; Adv. Energy Mater. 2018, 8, 1703482. [Crossref] 97. Wypych, F.; Seefeld, N.; Denicoló, I.; Quim. Nova 1997, 20, 356. [Crossref] 98. Wypych, F.; Adad, L. B.; Grothe, M. C.; Quim. Nova 1998, 21, 687. [Crossref] 99. Mancinelli, K. C. B.; Lisboa, F. S.; Soares, J. F.; Zawadzki, S. F.; Wypych, F.; Mater. Chem. Phys. 2013, 137, 764. [Crossref] 100. Wang, X.; Xing, W.; Feng, X.; Song, L.; Hu, Y.; Polym. Rev. 2017, 57, 440. [Crossref] 101. Wypych, F.; Tsunoda, M.; Quim. Nova 1993, 16, 543. [Link] acessado em novembro 2024 102. Wypych, F.; Tsunoda, M.; Quim. Nova 1994, 17, 9. [Link] acessado em novembro 2024 103. Wei, W.; Sun, K.; Hu, Y. H.; J. Mater. Chem. A 2016, 4, 12398. [Crossref] 104. Wirth-Lima, A. J.; Alves-Sousa, P. P.; Bezerra-Fraga, W.; Appl. Phys. A 2019, 125, 241. [Crossref] 105. Tian, Z.; Chen, Q.; Zhong, Q.; Chem. Eng. J. 2020, 396, 125374. [Crossref] 106. Raj, A.; Kumar, M.; Singh, D. V.; Anshul, A.; FlatChem 2024, 44, 100629. [Crossref] 107. Bharti, S.; Tripathi, S. K.; Singh, K.; Anal. Biochem. 2024, 685, 115404. [Crossref] 108. Yougbaré, S.; Mutalik, C.; Chung, P. -F.; Krisnawati, D. I.; Rinawati, F.; Irawan, H.; Kristanto, H.; Kuo, T. -R.; Nanomaterials 2021, 11, 3064. [Crossref] 109. Karunakaran, S.; Pandit, S.; Basu, B.; De, M.; J. Am. Chem. Soc. 2018, 140, 12634. [Crossref] 110. Dai, J.; Chen, J.; Song, J.; Ji, Y.; Qiu, Y.; Hong, Z.; Song, H.; Yang, L.; Zhu, Y.; Li, L.; Yang, H.; Hu, Z.; Chem. Eng. J. 2021, 421, 129773. [Crossref] 111. Lerf, A.; Dalton Trans. 2014, 43, 10276. [Crossref] 112. Novoselov, K. S.; Jiang, D.; Schedin, F.; Booth, T. J.; Khotkevich, V. V.; Morozov, S. V.; Geim, A. K.; Proc. Natl. Acad. Sci. U. S. A. 2005, 102, 10451. [Crossref] 113. Radisavljevic, B.; Radenovic, A.; Brivio, J.; Giacometti, V.; Kis, A.; Nat. Nanotechnol. 2011, 6, 147. [Crossref] 114. Dai, B.; Su, Y.; Guo, Y.; Wu, C.; Xie, Y.; Chem. Rev. 2024, 124, 420. [Crossref] 115. Carr, S.; Massatt, D.; Fang, S.; Cazeaux, P.; Luskin, M.; Kaxiras, E.; Phys. Rev. B 2017, 95, 075420. [Crossref] 116. Cao, Y.; Fatemi, V.; Fang, S.; Watanabe, K.; Taniguchi, T.; Kaxiras, E.; Jarillo-Herrero, P.; Nature 2018, 556, 43. [Crossref] 117. Jorio, A.; Nat. Mater. 2022, 21, 844. [Crossref] 118. Mounet, N.; Gibertini, M.; Schwaller, P.; Campi, D.; Merkys, A.; Marrazzo, T.; Sohier, T.; Castelli, I. E.; Cepellotti, A.; Pizzi, G.; Marzari, N.; Nat. Nanotechnol. 2018, 13, 246. [Crossref]
Editor Associado responsável pelo artigo: Marcela M. Oliveira |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access