Artigo
|
|
| Predicción de toxicidad acuática mediante QSAR Toolbox: un enfoque in silico para la evaluación de riesgos químicos en la fracturación hidráulica Prediction of aquatic toxicity using QSAR Toolbox: an in silico approach for chemical hazard assessment in hydraulic fracture |
|
Adolfo E. Ensuncho; Diana B. Ramírez* Chemistry Department, University of Córdoba, 230002 Montería, Colombia Recibido: 24/05/2024 In general, the effects of contaminants from the oil industry, related to the hydraulic fracturing technique and its consequences on ecosystems, were evaluated by alternative methods, such as the use of the QSAR methodology. This method implements the quantitative structure-activity relationship to determine the toxicity of chemicals and predict their endpoints in biological systems, such as the mean lethal concentration (LC50). To determine the toxicity of different groups of chemical compounds used in hydraulic fracturing, tests were carried out using three aquatic species: Pimephales promelas,Oncorhynchus mykiss and Oreochromis niloticus. The results show that QSAR toolbox can predict aquatic toxicity, using the log Kow hydrophobicity descriptor and through this it's observed that, in the three aquatic species, aldrin exhibits a high degree of toxicity compared to the other chemicals. In this sense, the QSAR models developed could be used to anticipate toxicity profiles and evaluate the chemical hazard of the studied substances. INTRODUCCIÓN El petróleo es de vital importancia para la economía mundial; sin embargo, el modelo extractivo de los combustibles fósiles contribuye de manera significativa al ambiente, aumentando la preocupación a nivel mundial, dado que su extracción por la técnica de fracturación hidráulica, se ha convertido en uno de los grandes problemas ambientales debido a que los ecosistemas podrían verse afectados de diversas maneras, ya que se ha demostrado que estas prácticas alteran el pH y la salinidad del agua, a causa de la liberación de sustancias químicas que representan un peligro potencial para los acuíferos superficiales y subterráneos aledaños a los pozos.1-3 Si bien, la divulgación obligatoria de los componentes químicos que contienen los fluidos de la estimulación hidráulica,4 ha favorecido nuestra comprensión sobre su potencial efecto, a menudo, faltan datos de toxicidad de muchas de las sustancias químicas usadas.2 Esto trae consigo, que no haya una evaluación del riesgo ambiental, del uso de esta técnica. Por tal razón, es preciso adelantar estudios tanto teóricos como experimentales que permitan la evaluación del riesgo de estos compuestos químicos usados en la estimulación hidráulica; especialmente, sobre organismos de agua dulce.5 Ahora bien, aunque se cuenta con información experimental de la toxicidad en humanos de las sustancias usadas en fracking,6 el conocimiento de la toxicidad de dichas sustancias en peces de agua dulce es prácticamente nulo, por lo que, se hace necesario llevar a cabo estudios en este campo, con el fin de facilitar la clasificación y la priorización de productos químicos potencialmente peligrosos en los sitios de fracturación hidráulica. Por tanto, es necesario predecir la toxicidad acuática de compuestos químicos asociados a la fracturación hidráulica, a través de relaciones cuantitativas estructura-actividad u otra técnica. El uso de herramientas computacionales para la solución de problemas complejos son ampliamente usados en varias disciplinas del saber, en este caso en particular, se usará la metodología QSAR que representan un modelo estadísticos predictivos derivados de la aplicación de herramientas estadísticas que correlacionan la actividad biológica y los efectos causados por las sustancias químicas, dentro estos efectos pueden predecir toxicidad, efectos terapéuticos y un sin números de resultados aplicados en las diferentes disciplinas. De igual forma, también se usa este modelo para la evaluación de riesgos, toma de decisiones regulatorias, descubrimiento de nuevos fármacos, entre otros.7 Los modelos QSAR, son muy bondadosos debido a que sus predicciones son confiables y con una alta precisión en sus resultados debido a la validación de estos. También podemos decir que son que son ágiles, con ahorros de tiempo y gastos económicos.5 Por lo anterior, en el presente trabajo se estudia el análisis de la estimación de toxicidad acuática de treinta y cuatro compuestos químicos presentes en los fluidos empleados en el proceso de fracturación hidráulica. Este análisis se realiza mediante la aplicación del modelado cuantitativo in silico, el cual se basa en un modelo matemático que relaciona la estructura molecular y la actividad, por medio del programa especializado de libre acceso QSAR Toolbox, para evaluar el potencial de riesgo que representan a la población de peces como Oncorhynchus mykiss, Pimephales promelas y Oreochromis niloticus, presentes en los cuerpos de aguas continentales. En tal sentido, se aborda la importancia de comprender este riesgo en ecosistemas acuáticos y el uso de herramientas computacionales como QSAR en este tipo de estudio.
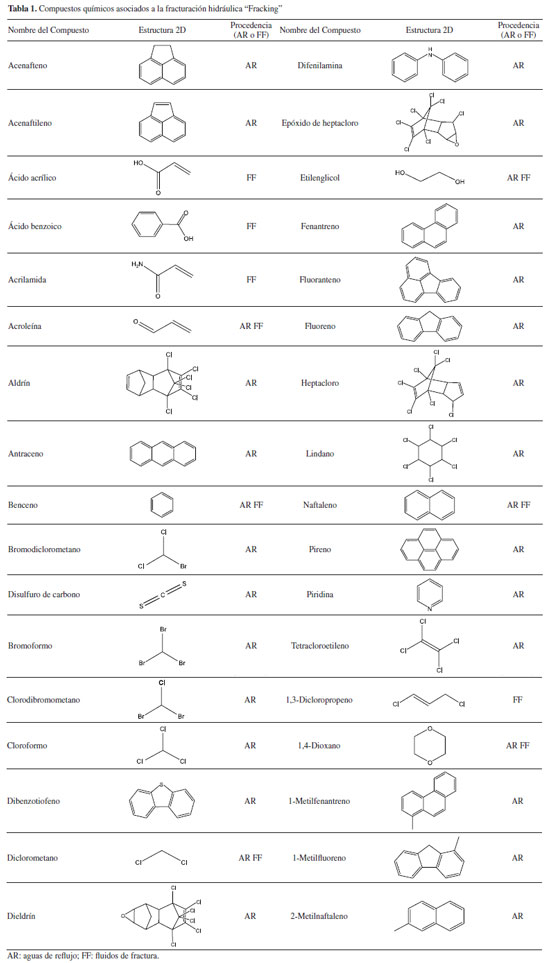
METODOLOGÍA Compuestos químicos relacionados con la técnica de fracturación hidráulica Las moléculas relacionadas con las técnicas de fracturación hidráulica consideradas en este trabajo para la predicción de su toxicidad acuática serán tomadas de la Agencia para la protección Ambiental de los Estados Unidos (EPA, por sus siglas en inglés), a partir de su informe; "Compilación de información fisicoquímica y toxicológica sobre productos químicos relacionados con la fracturación hidráulica"8 y se presentan en la Tabla 1. En el informe, la EPA ha identificado 1173 sustancias químicas asociadas con la fracturación hidráulica,9 de las cuales, aquí solamente se considerarán 34 moléculas. Dentro de este grupo de moléculas seleccionadas, se clasifica su procedencia como compuestos presentes las aguas de reflujo (ARs) y compuestos presentes en los fluidos de fractura (FFs).10
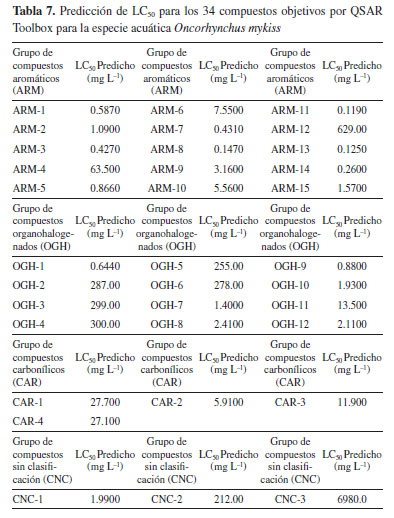
Flujo de trabajo en QSAR toolbox Las funcionalidades y los recursos necesarios para llevar a cabo la predicción de la toxicidad acuática de las tres especies de peces consideradas en este estudio, se encuentran disponibles en el paquete computacional QSAR Toolbox en su versión 4.5,11 divididos en seis módulos principales a saber: entrada, elaboración de perfiles, datos, definición de categoría, relleno de datos faltantes e informe.12 El modelado inicia con la etapa de entrada. Esta etapa permite la selección de las sustancias químicas objetivo y el criterio de valoración toxicológica de interés, en este caso LC50 (concentración letal media), para cada una de las tres especies acuáticas en estudio, partiendo de la mortalidad como efecto a un tiempo de exposición de noventa y seis horas (96 h). El segundo módulo es la elaboración de perfiles, en el cual se dispuso de un conocimiento químico de las sustancias estudiadas, es decir, su posible reactividad química y biológica para la identificación de análogos apropiados, a partir de perfiladores adecuados, sugeridos por el programa. Además, dependiendo del producto químico en cuanto a sus características estructurales, los perfiladores asignan a los productos químicos diferentes etiquetas; estas etiquetas pueden indicar afiliación a bases de datos específicas, así como alertas estructurales específicas de criterios de valoración de la toxicidad.12,13 El siguiente paso a seguir es la recopilación de datos. Seleccionando las bases de datos que sugiere el programa para estudios ecotoxicológicos, dando como resultado los datos experimentales para los compuestos análogos adquiridos en el perfilador.13 El sucesivo modulo fue el de definición de categorías, que nos ayudó a agrupar con las categorías definidas de los compuestos objetivos, mediante bases de datos del programa y dependiendo de cuál diera mejores resultados, se hizo la selección. Posteriormente de los resultados anteriores, se utilizó el módulo de cálculo de datos faltantes, para llenar los vacíos de datos de la sustancia química objetivo, implantando el modelado de análisis de tendencia,14 para la predicción cuantitativa del criterio de valoración de la toxicidad LC50 en las especies acuáticas estudiadas. A partir de lo anterior, el programa arrojaba un resultado, pero para algunas sustancias se les realizo una subcategorización para que el programa aceptara la predicción a partir de los criterios de aceptación QSAR y por últimos se generó un reporte con los resultados obtenidos.12,13
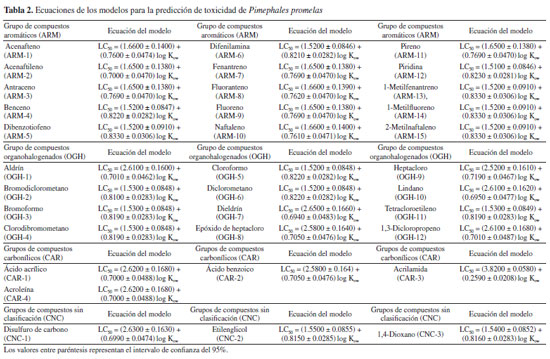
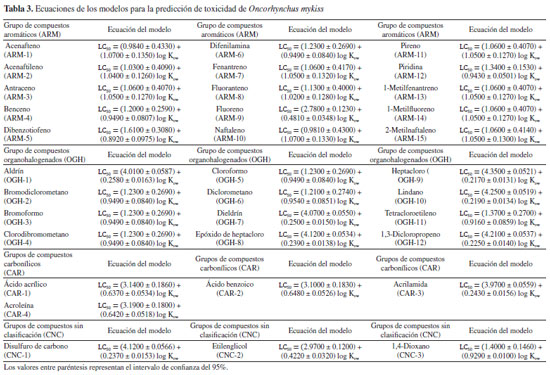
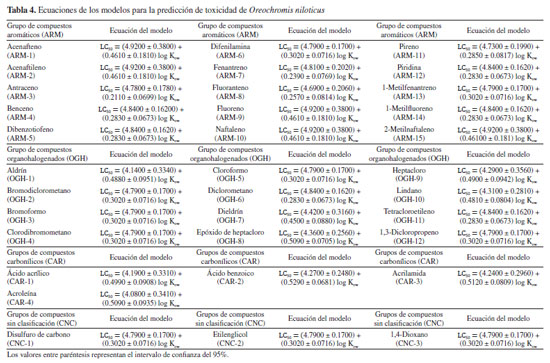
RESULTADOS Y DISCUSIONES Este estudio siguió el flujo de trabajo habitual de QSAR toolbox para la predicción de la toxicidad acuática LC50 en tres especies diferentes de peces O. mykiss,P. promelas y O. niloticus.12 Mediante la identificación de un número significativo de compuestos análogos, la definición de categorías y el completado de datos faltantes, fue posible obtener una predicción utilizando un modelo QSAR lineal por medios de un análisis de tendencia, el cual hace un uso eficaz de los datos disponibles para compuestos análogos, estimando los valores faltantes a partir de los resultados de sustancias químicas analizadas a sustancias químicas no analizadas.15 El modelo resultante, cuantificó las variaciones de los valores de LC50 en función del descriptor predeterminado, que en este caso fue el coeficiente de partición octanol-agua (log Kow) y al observar una correlación, dio lugar a un modelo lineal de regresión (Ecuación 1) donde se pudo observar la actividad de las sustancias objetivo para cada especie acuática analizada (Tablas 2, 3 y 4). Además, se aplicaron los criterios de aceptabilidad descritos por Yordanova et al.,12 para el análisis de tendencia, que implican lograr un coeficiente de determinación de la regresión lineal (R2) igual o superior a 0.7, junto con un número de análogos estructurales igual o superior a 10. 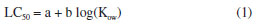 donde, a y b son los coeficientes de regresión.
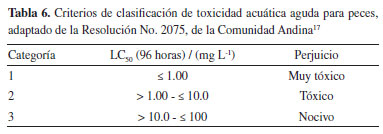
El log Kow, es un descriptor de hidrofobicidad, que evidencia un enfoque mecanicista, ya que simula la habilidad de una sustancia para penetrar las células mediante las membranas lipídicas, lo que refleja tanto su absorción como su toxicidad, convirtiéndolo en una herramienta ampliamente empleada en la modelización de la toxicidad.16 Según los resultados de las ecuaciones obtenidas, como se reflejan en las Tablas 2, 3 y 4, los coeficientes de regresión de log Kow muestran una tendencia positiva, por tanto, el LC50 aumenta con el aumento de log Kow; sugiriendo que las moléculas con menores valores presentan una mayor respuesta tóxica. Predicción de LC50 para Pimephales promelas por QSAR toolbox La Tabla 5 presenta los resultados de la estimación LC50 obtenidos de las sustancias objetivos estudiadas, mediante QSAR toolbox para la especie acuática P. promelas. Todos los resultados se derivan de una regresión lineal simple que describe los valores experimentales de los análogos resultantes para la respuesta de toxicidad en los compuestos estudiados. Estos resultados fueron la estimación de la respuesta de toxicidad de los compuestos frente a una exposición durante 96 h. Posteriormente, se compararon los resultados con los criterios de valoración toxicológica establecidos por la escala de clasificación de toxicidad acuática aguda, según lo dispuesto por la Comunidad Andina,17 detallados en la Tabla 6.
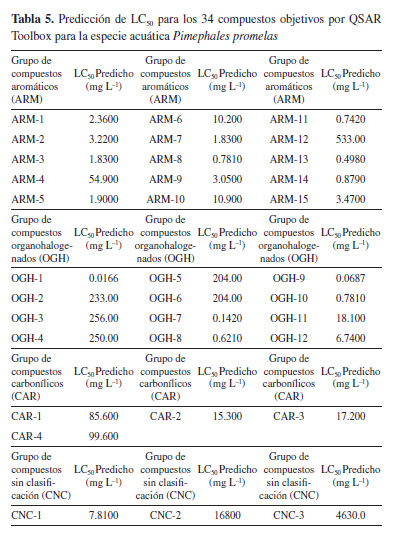
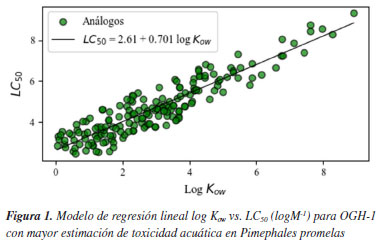
Por simplicidad, los compuestos objetivos se clasificaron en cuatro grupos, de acuerdo a sus cualidades estructurales. Es preciso resaltar que dentro de este grupo de moléculas estudiadas existen algunos compuestos que no pueden ser clasificados (CNC), ya que no presentan similitudes estructurales semejantes: compuestos aromáticos (ARM), compuestos organohalogenados (OGH), compuestos carbonílicos (CAR) y grupo de compuestos no categorizados (CNC). Considerando los resultados obtenidos de LC50 de la Tabla 5, al compararlos entre los grupos de moléculas formados, para la especie Pimephales promelas, podemos evidenciar que el conjunto de moléculas organohalogenadas (OGHs), presentan mayor grado de toxicidad, ya que exhibe resultados que están por debajo de 1.00 mg L-1 cómo lo observado en el modelo resultante de regresión lineal (Figura 1), en los compuestos, aldrín, dieldrín, epóxido de heptacloro, heptacloro y lindano, con una estimación de LC50 de 0.0166, 0.1420, 0.6210, 0.06787 y 0.7810 mg L-1 respectivamente. Indicando, según la clasificación de toxicidad para peces, presentes en la Tabla 6, que estos compuestos pueden ser muy tóxicos para este organismo acuático. Por otro lado, se observó que para el resto de moléculas OGHs las estructuras alifáticas con mayor número de cadenas abiertas insaturadas y menor cantidad de átomos de cloro presentan una menor respuesta toxica.
Estudios experimentales para la especie acuática Pimephales promelas, divulgados por Iyaniwura,18 indica que el aldrín y el heptacloro exhibieron valores de LC50 de 0.0330 y 0.0540 mg L-1 respectivamente, resultados muy cercanos a los obtenidos por este estudio, mostrando que estos resultados teóricos son de gran ayuda para determinar la toxicidad de sustancias químicas en especies acuáticas. Por otra parte, en el estudio de DeGraeve et al.,19 el naftaleno obtuvo un valor de LC50 de 7.9000 mg L-1, valor que no se aleja al obtenido por este estudio, ya que muestra según la escala de toxicidad acuática en peces, que esta sustancia es toxica para esta especie. El aldrín, dieldrín, heptacloro y el lindano, son compuestos organoclorados, los cuales son utilizados comercialmente como plaguicidas, además están categorizados como Contaminantes Orgánicos Persistentes (COP), debido a que presentan propiedades tóxicas, son resistentes a la degradación, se bioacumulan, son transportados a largas distancias, y se biomagnifican en los ecosistemas terrestres y acuáticos.20 En el grupo de compuestos aromáticos ARM, según los resultados predichos, se identificaron compuestos como el fluoranteno, pireno, 1-metilfenantreno y 1-metilfluoreno, con valores de 0.7810, 0.7420, 0.4980 y 0.8790 mg L-1 respectivamente, todos estos por debajo de 1.00 mg L-1. La mayoría de compuestos de este grupo ARM, son pertenecientes a la familia de los Hidrocarburos Aromáticos Policíclicos (PAHs, por sus siglas en ingles) y han sido clasificados como contaminantes de control prioritario por la Agencia de Protección Ambiental de los Estados Unidos, debido a que son venenosos, mutagénicos, genotóxicos y cancerígenos.21 Cuando los PAHs son vertidos en el medio acuático, plantean riesgos significativos tanto para el ambiente como para la salud humana. La degradación microbiana de estos compuestos se ve influenciada por factores como los nutrientes disponibles en la fase acuosa, la cantidad y tipo de microbios presentes en el entorno, así como la naturaleza y características moleculares de estos.21 En el caso de los grupos restantes CAR y CNC, el disulfuro de carbono, mostrando un valor de 7.8100 mg L-1, indicando ser toxico al estar por debajo del límite de 10.0 mg L-1 para esta especie. Predicción de LC50 para Oncorhynchus mykiss por QSAR toolbox Los resultados presentados en la Tabla 7, muestran las estimaciones de LC50 obtenidas mediante QSAR toolbox para evaluar la toxicidad de las moléculas estudiadas en la especie O. mykiss. Estos datos destacan que en el grupo de moléculas OGHs, más del 50% exhibieron niveles de LC50 superiores a 254.00 mg L-1, indicando una notable resistencia frente a la respuesta toxicológica. Sin embargo, se observó que, dentro de este grupo de moléculas, aquellas con estructuras cíclicas mostraron niveles de toxicidad significativamente altos, con valores que oscilan entre 2.4100 y 0.6440 mg L-1, lo que sugiere que podrían ser tóxicas o muy tóxicas en algunos casos. Esto resalta nuevamente el impacto tóxico del aldrín para diferentes especies acuáticas, que en este caso obtuvo un valor de LC50 de 0.6440 mg L-1.
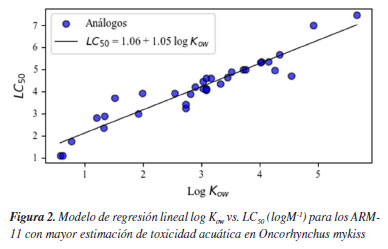
En el caso de los ARMs, la mayoría de los compuestos, a excepción de la piridina y el benceno, mostraron una alta estimación de toxicidad, calificándolos como tóxicos o incluso, en algunos casos, muy tóxicos para la vida de esta especie. Esto se evidencia en los valores de LC50 obtenidos para el fluoranteno, pireno y 1-metilfenantreno de 0.1470, 0.1190 y 0.1250 mg L-1, respectivamente, como muestra el modelo de regresión lineal resultante para el pireno (Figura 2), siendo este el compuesto más toxico en esta especie. Estos resultados, según la escala de toxicidad acuática en peces, son significativos, mostrando que estos compuestos pueden causar potencialmente una alta mortalidad en caso de contacto directo en su hábitat, ya que son muy tóxicos.
Por otro lado, la investigación de DeGraeve et al.,19 muestra que, según estudios experimentales para O. mykiss, el naftaleno obtuvo un resultado de LC50 de 1.6000 mg L-1, un valor que guarda similitud con el obtenido en esta investigación, debido a que, para ambos estudios según la escala de toxicidad acuática en peces, confirma que el naftaleno es de categoría 2, indicando que es una sustancia toxica para esta especie. Es notable que, estas tres moléculas también son catalogadas como compuestos PAHs, según Zambrano et al.,22 para estos compuestos, a medida que aumenta el número de anillos en la estructura química, el peso molecular y la complejidad de la estructura química, la estimación de letalidad también aumenta. Siendo esto una posible explicación de su alta respuesta toxica frente a esta especie. Para el resto de grupos de moléculas CAR y CNC, nuevamente presento mayor grado de toxicidad el disulfuro de carbono, con un valor por debajo de 1.00 mg L-1 siendo este compuesto muy tóxico para esta especie. Se ha observado que, cuando los peces entran en contacto con compuestos químicos altamente tóxicos, no se presentan efectos de manera inmediata, los síntomas más significativos de intoxicación suelen manifestarse a concentraciones más altas de toxinas. Pese a esto, las consecuencias para los peces expuestos a niveles elevados mostrarán un comportamiento errático, como nadar en la superficie y perder el equilibrio. Además, investigaciones como las llevadas a cabo por Black et al.,23 y Rodríguez et al.,1 han demostrado que el fracking puede contaminar los recursos hídricos, generando efectos tóxicos en los peces de agua dulce y en los ecosistemas acuáticos. Predicción de LC50 para Oreochromis niloticus por QSAR toolbox La especie acuática Oreochromis niloticus, comúnmente conocida como "tilapia del Nilo", habita en los ecosistemas de agua dulce de Colombia, fue introducido desde el río Nilo, así como de otros ríos del Oeste de África y Oriente Medio. Esta especie, se ha convertido en una especie altamente comercial, principalmente por su valor como fuente nutricional.24 En este estudio, se evaluaron los riesgos potenciales para su supervivencia, frente algunas sustancias implementadas en la fracturación hidráulica, mediante una estimación de toxicidad acuática. Mostrando que, los datos recopilados para los grupos de moléculas estudiadas revelaron que el 80% de los compuestos mostraron valores de LC50 inferiores a 0.10 mg L-1 (Tabla 8), lo que indica que la mayoría de estas sustancias son altamente tóxicas para la supervivencia de esta especie.
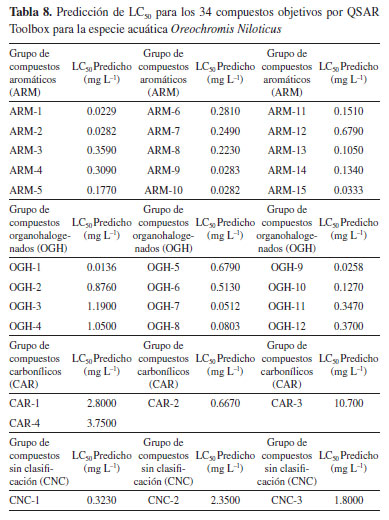
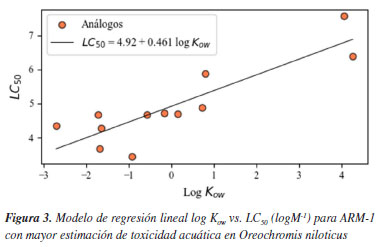
Se observó que, entre los grupos de moléculas, los que presentan una mayor respuesta toxica fueron los ARMs, debido a que estos compuestos presentaron valores de LC50 muy por debajo de 0.10 mg L-1, indicando alta toxicidad para la vida de este organismo acuático. Los valores que muestran una mayor toxicidad, para este grupo de moléculas son el acenafteno, acenaftileno, fluoreno, naftaleno, y el 2-metilnaftaleno, con valores entre 0.0229-0.0330 mg L-1, cómo lo observado en el modelo de regresión lineal resultante para el acenafteno (Figura 3). Se noto nuevamente que, dentro de este grupo de compuestos, las sustancias PAHs sobresalieron por su mayor respuesta tóxica hacia esta especie.
El naftaleno, debido a su bajo peso molecular, baja susceptibilidad a la fotooxidación y prolongada persistencia en el agua, es considerado el PAH más peligroso.25 Los PAHs penetran en el organismo de los peces a través de la absorción en las branquias, la piel y durante la ingesta de alimentos. Estos compuestos pueden desencadenar intoxicaciones agudas y crónicas, alterando la actividad antioxidante, debido a que se acumulan rápidamente en los organismos acuáticos, alcanzando concentraciones superiores a las presentes en el entorno circundante, lo que afecta las funciones vitales.25 Este estudio, se observó que dentro del grupo de compuestos OGHs, aquellas moléculas con un mayor número de átomos de cloro exhiben una mayor respuesta tóxica. Ejemplos de ello son el aldrín, dieldrín, epóxido de heptacloro y el heptacloro, con valores muy por debajo de 1.00 mg L-1, de acuerdo con los criterios de clasificación de toxicidad acuática de la Tabla 6, mostrando que estas sustancias son muy toxicas para esta especie, siendo el aldrín nuevamente el compuesto mayor respuesta tóxico, presentando un valor de 0.0136 mg L-1. Asimismo, para el resto de grupos de moléculas CAR y CNC, se observó que el ácido benzoico y el disulfuro de carbono presentaron mayor grado de toxicidad, con un valor por debajo de 1.00 mg L-1, indicando que estos compuestos son muy tóxicos para la vida acuática en esta especie.
CONCLUSIONES Los resultados obtenidos mediante QSAR toolbox se comparan con los criterios de valoración toxicológica establecidos por la Comunidad Andina, lo que permite una clasificación de la toxicidad de los compuestos en diferentes categorías. Los resultados indican que la especie acuática Oreochromis niloticus mostró la mayor respuesta tóxica entre las 34 sustancias objetivo estudiadas. Además, también se muestra que compuestos como aldrín, dieldrín y heptacloro, presentan valores muy tóxicos, lo que indica que son sustancias que pueden atentar contra las tres especies estudiadas. Este enfoque in silico es considerado importante para anticipar perfiles de toxicidad y evaluar el peligro químico de sustancias químicas, lo que puede ser útil para la toma de decisiones en materia ambiental y la protección de los ecosistemas acuáticos.
REFERENCIAS 1. Rodríguez, J.; Heo, J.; Kim, K. H.; Water 2020, 12, 796. [Crossref] 2. Elliott, E. G.; Ettinger, A. S.; Leaderer, B. P.; Bracken, M. B.; Deziel, N. C.; J. Exposure Sci. Environ. Epidemiol. 2017, 27, 90. [Crossref] 3. Desai, K.; Aminzadeh, F.; J. Sustainable Energy Eng. 2016, 4, 250. [Crossref] 4. FracFocus, https://fracfocus.org/, acceso en diciembre del 2024. 5. Soeder, D. J.; Fracking and the Environment: A Scientific Assessment of the Environmental Risks from Hydraulic Fracturing and Fossil Fuels; Springer Nature: Rapid City, SD, USA, 2020. 6. Yost, E. E.; Stanek, J.; DeWoskin, R. S.; Burgoon, L. D.; Environ. Sci. Technol. 2016, 50, 4788. [Crossref] 7. Ensuncho, A.; López, J.; Robles, J.; Herramienta Computacional para la Construcción de Modelos QSAR; Editorial Palomo: Montería, Colombia, 2017. 8. Yost, E. E.; Stanek, J.; DeWoskin, R. S.; Burgoon, L. D.; Environ. Sci. Technol. 2016, 50, 7732. [Crossref] 9. United States Environmental Protection Agency (EPA); Assessment of the Potential Impacts of Hydraulic Fracturing for Oil and Gas on Drinking Water Resources; EPA: Washington DC, 2015. [Link] acceso en diciembre del 2024 10. Gordalla, B. C.; Ewers, U.; Frimmel, F. H.; Environ. Earth Sci. 2013, 70, 3875. [Crossref] 11. Organización para la Cooperación y el Desarrollo Económicos (OCDE); QSAR Toolbox, V.4.5; Laboratory of Mathematical Chemestry (LMC), Bulgaria, 2021. 12. Yordanova, D.; Schultz, T. W.; Kuseva, C.; Tankova, K.; Ivanova, H.; Dermen, I.; Pavlov, T.; Temelkov, S.; Chapkanov, A.; Georgiev, M.; Gissi, A.; Sobanski, T.; Mekenyan, O. G.; Comput. Toxicol. 2019, 10, 89. [Crossref] 13. Mombelli, E.; Pandard, P.; Regul. Toxicol. Pharmacol. 2021, 122, 104893. [Crossref] 14. Raies, A. B.; Bajic, V. B.; WIREs Computational Molecular Science 2016, 6, 147. [Link] acceso en diciembre del 2024 15. Dimitrov, S. D.; Diderich, R.; Sobanski, T.; Pavlov, T. S.; Chankov, G. V.; Chapkanov, A. S.; Karakolev, Y. H.; Temelkov, S. G.; Vasilev, R. A.; Gerova, K. D.; Kuseva, C. D.; Todorova, N. D.; Mehmed, A. M.; Rasenberg, M.; Mekenyan, O. G.; SAR QSAR Environ. Res. 2016, 27, 203. [Crossref] 16. Gramatica, P.; Int. J. Quant. Struct.-Prop. Relat. 2020, 5, 61. [Crossref] 17. Comunidad Andina; Resolución No. 2075, del 15 de mayo de 2019; Manual Técnico Andino para el Registro y Control de Plaguicidas Químicos de Uso Agrícola, Secretaria General de la Comunidad Andina, p. 154. [Link] acceso en diciembre del 2024 18. Iyaniwura, T. T.; Rev. Environ. Health 1991, 9, 161. [Crossref] 19. DeGraeve, G. M.; Elder, R. G.; Woods, D. C.; Bergman, H. L.; Arch. Environ. Contam. Toxicol. 1982, 11, 487. [Crossref] 20. Kumar, J. A.; Krithiga, T.; Sathish, S.; Renita, A. A.; Prabu, D.; Lokesh, S.; Geetha, R.; Namasivayam, S. K. R.; Sillanpaa, M.; Sci. Total Environ. 2022, 831, 154808. [Crossref] 21. Vijayanand, M.; Ramakrishnan, A.; Subramanian, R.; Issac, P. K.; Nasr, M.; Khoo, K. S.; Rajagopal, R.; Greff, B.; Wan, N. I.; Jeon, B.-H.; Chang, S. W.; Ravindran, B.; Environ. Res. 2023, 227, 115716. [Crossref] 22. Zambrano, M.; Casanova, R.; Prada, J.; Arencibia, G.; Vidal, A.; Capetillo, N.; Gayana (Concepc.) 2012, 76, 1. [Crossref] 23. Black, K. J.; Boslett, A. J.; Hill, E. L.; Ma, L.; McCoy, S. J.; Annual Review of Resource Economics 2021, 13, 311. [Crossref] 24. El - Sayed, A. F. M.; Fitzsimmons, K.; Reviews in Aquaculture 2023, 15, 6. [Crossref] 25. Nayak, S.; Dash, S. N.; Pati, S. S.; Priyadarshini, P.; Patnaik, L.; Aquacult. Res. 2021, 52, 5739. [Crossref] |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access