Artigo
|
|
| Efeito da ativação mecânica de uma formulação de talco/caulim/alumina sobre o mecanismo e a cinética de formação de cordierita Effect of the mechanical activation of a talc/kaolin/alumina mixture on the mechanism and kinetics of cordierite formation |
|
Joao Batista Rodrigues NetoI; Dachamir HotzaII,*; Rodrigo MorenoIII
IUniversidade Federal de Santa Catarina, Campus Araranguá, 88900-000 Araranguá - SC, Brasil Recebido em 05/03/2013 *e-mail: dhotza@gmail.com In this study, the influence of mechanical activation by intensive ball milling of a stoichiometric mixture of talc, kaolin, and alumina on the mechanism and kinetics of cordierite (2MgO·2Al2O3·5SiO2) formation was evaluated. The raw materials were characterized by chemical analysis, X-ray diffraction (XRD), laser diffraction, and helium pycnometry. The kinetics and mechanism of cordierite formation were studied by XRD, differential thermal analysis, and dilatometry in order to describe the phase formation as a function of temperature (1000-1400 ºC), time of thermochemical treatment (0-4 h), and grinding time of the mixture (0-45 min). Finally, the optimal conditions of the thermochemical treatment that ensured the formation of cordierite were determined: milling time of 45 min and thermal treatment at 1280 ºC for 1 h. INTRODUÇAO A cordierita (2MgO·2Al2O3·5SiO2) é uma fase cerâmica do sistema MgO-Al2O3-SiO2, empregada em uma série de aplicaçoes, em temperaturas moderadas, que exigem materiais com baixo coeficiente de dilataçao térmica e elevada resistência ao choque térmico. Além disso, a cordierita se caracteriza por apresentar uma pequena constante dielétrica e elevada estabilidade química. Materiais a base de cordierita sao utilizados na produçao de componentes para suporte de catalisadores, filtros, placas para circuitos integrados, refratários de fornos e isolantes térmicos.1-5 O método mais comum para a síntese da fase cordierita envolve a reaçao no estado sólido, à alta temperatura, de misturas de componentes puros e/ou de minerais naturais. As substâncias puras mais comumente empregadas sao MgO, Al2O3, SiO2, MgCO3, Mg(OH)2. Vários trabalhos na literatura descrevem a obtençao de cordierita por meio da utilizaçao de minerais como talco e sepiolita como fontes de MgO; argilas, caulins, diatomitas, feldspatos, quartzo e cinzas volantes como fontes de Al2O3 e SiO2. 6-10 Aza e Monteros11 propuseram que a formaçao da cordierita (2MgO·2Al2O3·5SiO2) ocorre mediante duas etapas bem definidas. Primeiramente, a cordierita começa a formar-se a 1100 ºC por meio de uma reaçao no estado sólido, conforme Equaçao 1, entre mulita (3Al2O3·2SiO2), enstatita (MgO·SiO2) e cristobalita (SiO2). A reaçao apresenta um ápice em sua cinética a 1275 ºC.
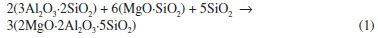
Em uma segunda etapa, à medida que a temperatura se eleva, a cordierita previamente formada reage, por um mecanismo de fusao diferencial, com a enstatita e a cristobalita, formando um líquido em torno de 1330 a 1355 ºC. Essa reaçao depende dos teores de óxidos de metais alcalinos contaminantes das matérias-primas. O líquido formado tem a composiçao do eutético cordierita-enstatita-sílica. Com o aumento da temperatura, o líquido começa a reagir com a mulita remanescente alterando sua composiçao para aquela típica da cordierita. A temperatura de máxima cinética desta reaçao de formaçao de cordierita é de ~1357 ºC. A cinética das reaçoes no estado sólido é dependente da distribuiçao de tamanho de partículas dos seus reagentes. Um dos problemas derivados da utilizaçao de matérias-primas naturais em reaçoes para formaçao de cordierita é a presença de partículas grosseiras que sao limitantes de sua reatividade. Vários estudos têm sido feitos no sentido de determinar o efeito de alguns processos de moagem de argilominerais, caulim e talco,7-9,12-15 sobre suas estruturas cristalinas e sua reatividade. Tais estudos concluem que os processos de moagem de alta energia, geralmente a seco, produzem efeitos físico-químicos intensos nos argilominerais, incluindo a completa amorfizaçao de sua estrutura cristalina lamelar e uma extrema reduçao de tamanho de suas partículas. Por consequência, a moagem aumenta substancialmente a reatividade dos pós cerâmicos por aumentar suas áreas superficiais específicas, além de reduzir as temperaturas necessárias à sua sinterizaçao. Para sintetizar a fase cordierita via reaçao no estado sólido usualmente sao empregados tratamentos térmicos entre 1250 e 1350 ºC. Outra opçao utilizada no sentido de aumentar a reatividade de formulaçoes para obtençao de cordierita é o emprego de alguns aditivos que reduzem sua temperatura de síntese. Entretanto, esses aditivos reduzem a temperatura de trabalho da cordierita produzida. O efeito combinado da moagem e dos aditivos torna possível um decréscimo da temperatura de síntese na ordem de 300 ºC. Em trabalhos anteriores,8,9 foram publicados resultados relativos à otimizaçao do comportamento reológico de suspensoes de caulim, talco e alumina para o posterior processamento coloidal de componentes de cordierita, densos ou porosos. Além disso, foi avaliada também a influência do processo de moagem de alta energia sobre o comportamento reológico de tais suspensoes, bem como as alteraçoes microestruturais produzidas, tanto do ponto de vista da porosidade quanto das fases formadas durante sinterizaçao. O objetivo deste trabalho é avaliar o efeito do processo de moagem intensiva de uma suspensao concentrada de talco, caulim e alumina, dando enfoque sobre a cinética e os mecanismos de formaçao de cordierita quando comparado aos resultados obtidos com as mesmas matérias-primas utilizadas in natura.
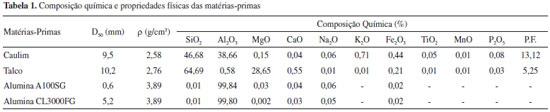
PARTE EXPERIMENTAL A cordierita é constituída por 13,8% de MgO, 34,9% de Al2O3 e 51,4% de SiO2, em massa. As matérias primas empregadas neste trabalho foram: caulim e talco (ambos fornecidos por Colorminas, Brasil) e alumina (uma mistura de 85% em massa de 1000SG, como alumina fina, e 15% em massa de CL3000FG, como alumina grosseira, ambas fornecidas por Alcoa, EUA). Para se obter uma formulaçao estequiométrica da fase cordierita os componentes foram misturados nas proporçoes em massa de 40,0% caulim, 43,8% talco e 16,2% alumina. As matérias-primas foram caracterizadas por meio de análise granulométrica (Mastersizer S, Malvern, Inglaterra) e de medidas de densidade em picnômetro de He (Accupyc 1330, Micromeritics, EUA). As análises químicas foram obtidas por meio de fluorescência de raios X (Philips PW 2400, Holanda). Algumas propriedades físicas e a composiçao química das matérias-primas sao apresentadas na Tabela 1.
Seguindo os critérios estabelecidos em um trabalho prévio,8 foram preparadas suspensoes aquosas com a formulaçao das matérias-primas. As condiçoes ótimas de dispersao foram estabelecidas para uma concentraçao de sólidos de 40% em volume, 1,5% (em relaçao aos sólidos) de defloculante de base poliacrílica (Dolapix PCN, Zschimmer-Schwarz, Alemanha) e para um valor de pH = 11, ajustado com soluçao de KOH (concentraçao 5 N). As suspensoes foram homogeneizadas em um agitador a hélice por 15 min e em seguida em um agitador de alto cisalhamento (Silverson L2R, Inglaterra) por 3 min. As suspensoes foram submetidas a moagens utilizando-se um moinho de bolas planetário de alta velocidade, com jarro de porcelana e bolas de alumina. Os tempos de moagem foram de 15, 30 e 45 min e ao final de cada ensaio o pH das suspensoes foi ajustado novamente para 11.9 Após cada moagem, os pós foram caracterizados por meio de análise granulométrica por difraçao laser (Mastersizer S. Malvern, Inglaterra). Para os ensaios de tratamentos térmicos para obtençao de cordierita foram preparados corpos de prova utilizando a suspensao sem moagem, como também cada uma das suspensoes de cada um dos testes de moagem (15, 30 e 45 min). Os corpos de prova foram conformados pelo processo de colagem de barbotina utilizando um molde de gesso cilíndrico (10 mm de diâmetro). Os tratamentos térmicos para síntese/sinterizaçao dos compactados foram realizados em temperaturas entre 1000 e 1400 ºC com tempos de tratamento de zero (quenching) a 4 h e com taxa de aquecimento de 30 ºC/min. Foram realizados ensaios dinâmicos de sinterizaçao, utilizando um dilatômetro diferencial (Setsys 16/18, Setaram, França), com uma taxa de aquecimento de 10 ºC/min até 1400 ºC. O processo de evoluçao das fases formadas durante o aquecimento da formulaçao foi estudado com auxílio da técnica de análise térmica diferencial (ATD, Netzsch STA 409, Alemanha). Os ensaios de análise térmica foram realizados nas mesmas condiçoes daquele de dilatometria. Ensaios de difratometria de raios X (D5000, Siemens, Alemanha) foram empregados para determinar as fases presentes na formulaçao e em amostras obtidas de cada um dos tratamentos térmicos realizados. Todas as amostras para os ensaios de difratometria foram preparadas via moagem em almofariz de ágata.
RESULTADOS E DISCUSSAO Análises de difratometria de raios X obtidas das formulaçoes in natura e daquela moída por 45 min em moinho de bolas planetário demonstraram que o processo de moagem nao produziu nenhuma alteraçao aparente sobre a estrutura cristalina dos minerais. Ambos os difratogramas confirmam a presença das fases argilominerais caulim e talco, além da alumina-α. Ressalta-se a presença do mineral acessório quartzo-α, que é típica em matérias primas de origem natural. A Figura 1 mostra o efeito do tempo de moagem sobre as distribuiçoes granulométricas da formulaçao moída em moinho planetário de alta energia. Pode-se observar que já nos primeiros 15 min a moagem foi muito efetiva, pois produziu uma grande reduçao do tamanho das partículas mais grosseiras dos componentes da formulaçao (entre 5 e 70 mm). A partir dos 45 min de moagem, nota-se que o aumento do tempo nao produziria ganhos significativos de reduçao de tamanho de partículas. A formulaçao antes da moagem apresentou uma distribuiçao com partículas com até 100 mm e um diâmetro médio de ~5,5 mm. Ao final dos 45 min de moagem, a formulaçao passou a ter partículas com diâmetros inferiores a 56 mm e com um diâmetro médio da ordem de 4 mm.
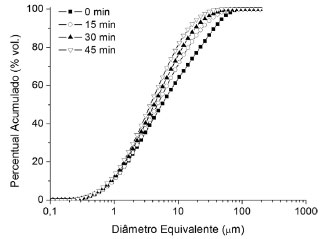 Figura 1. Distribuiçoes granulométricas acumuladas das formulaçoes para os diversos tempos de moagem e para a formulaçao sem moagem
Os resultados dos ensaios de ATD (sem moagem e com 45 min de moagem) e dilatometria (45 min de moagem) da formulaçao sao apresentados na Figura 2. Comparando as curvas de ATD, observa-se que as mesmas sao praticamente coincidentes até a temperatura de 1200 ºC. Ambas mostram um pico endotérmico amplo entre 200 e 300 ºC, referente à perda de água estrutural dos aluminossilicatos, um pico endotérmico intenso em torno de 550 ºC devido à desidroxilaçao do caulim e outro menos intenso a 885 ºC referente à desidroxilaçao do talco, que promove a formaçao de enstatita (MgO·SiO2). Observa-se um pico exotérmico intenso a 1000 ºC que indica a transformaçao da estrutura nao-cristalina da caulinita em pré-mulita. A partir de 1200 ºC pode-se observar que o processo de moagem produziu uma alteraçao importante nos resultados de ATD.
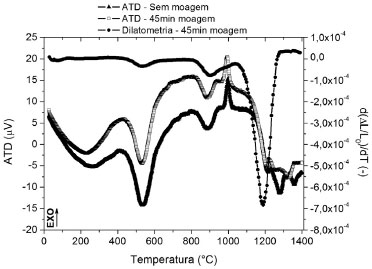 Figura 2. Resultados de ATD da formulaçao in natura e curvas de ATD e dilatometria após 45 min de moagem
Na Figura 3 mostra-se um detalhe dos resultados de ATD e dilatometria para temperaturas entre 1180 e 1380 ºC. Observando os resultados da formulaçao sem moagem, na Figura 3, constata-se a presença de 3 picos exotérmicos a 1230, 1305 e 1335 ºC. Segundo a literatura,11 pode-se afirmar que o primeiro pico é característico da formaçao da mulita e que os dois seguintes indicam a formaçao da cordierita. No caso da formulaçao moída, o pico referente à formaçao de mulita mostra-se mais intenso e antecipado de 3 ºC daquele obtido para a condiçao sem moagem. As alteraçoes mais pronunciadas ocorrem a partir desta transformaçao. O pico endotérmico a 1280 ºC observado na formulaçao sem moagem desaparece para o caso da formulaçao moída, indicando que o processo de formaçao de fase líquida após a cristalizaçao da mulita é substituído pelo início imediato da reaçao de formaçao de cordierita. No caso da formulaçao moída, nota-se um efeito exotérmico de 1275 a 1280 ºC, ou seja, pode-se afirmar que o processo de moagem antecipou o início da formaçao da cordierita em aproximadamente 30 ºC e que este acontece em um único evento.
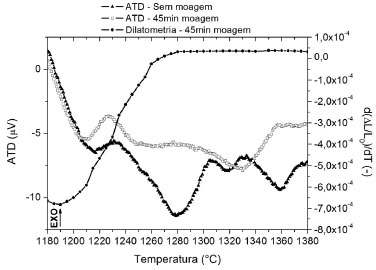 Figura 3. Detalhe da curva de ATD da formulaçao in natura e das curvas de ATD e dilatometria após 45 min de moagem
Os resultados de dilatometria da amostra moída por 45 min, Figuras 2 e 3, mostram-se muito coerentes com aqueles de sua análise térmica. Constata-se que todas as transformaçoes que envolvem perda de hidroxilas sao confirmadas pelas retraçoes dilatométricas observadas nos mesmos intervalos de temperatura obtidos na análise térmica. O início do pico endotérmico intenso mostrado nos resultados de ATD a 1100 ºC coincide com o início do processo de sinterizaçao apontado na dilatometria. Tal efeito é típico de sinterizaçao com fase líquida transiente. A Figura 3 mostra ainda que a maior taxa de sinterizaçao é observada a 1190 ºC e que a densificaçao é interrompida a 1280 ºC, justamente na temperatura em torno da máxima taxa de formaçao da cordierita. Na Figura 4 sao apresentados os resultados obtidos a partir dos ensaios de difratometria de raios X realizados nas amostras, da formulaçao in natura, tratadas termicamente. Nela estao colocadas as variaçoes de intensidade dos picos de difraçao tomados como característicos das diferentes fases obtidas em funçao das temperaturas de tratamento térmico realizados com corpos de prova da formulaçao que nao sofreram o processo de moagem. Ressalta-se que os picos selecionados para identificaçao das várias fases, por problemas de sobreposiçao dos mesmos em algumas fases, nao sao aqueles mais intensos de cada uma delas: cordierita-α (2MgO·2Al2O3·5SiO2), 3,00 Å; quartzo-α (SiO2), 4,25 Å; cristobalita (SiO2), 3,14 Å; safirina (4MgO·5Al2O3.2SiO2), 2,01 Å; espinélio (MgO·Al2O3), 2,44 Å; mulita (3Al2O3·2SiO2), 1,60 Å; alumina-α (Al2O3), 2,08 Å. Portanto, os resultados apresentados sao qualitativos, indicando a evoluçao das fases no material em funçao da temperatura. Nota-se que a 1250 ºC a amostra é composta basicamente por sílica (nas formas alotrópicas quartzo-α e cristobalita), safirina, espinélio, mulita, alumina nao-reagida e pouca cordierita. Confirmando os resultados de ATD, observa-se que a cordierita-α só aparece de forma majoritária para os tratamentos acima de 1300 ºC. Analisando os resultados de ATD (Figura 2) e de DRX pode-se concluir que as fases reagentes oriundas das matérias-primas para temperaturas superiores a 1230 ºC sao enstatita proveniente do talco, mulita cristalizada a partir da pré-mulita do caulim, sílica e alumina. Um dos mecanismos de formaçao de cordierita-α a baixa temperatura (1275 ºC) envolve a reaçao entre estas fases. Os resultados da Figura 4 mostram que estes reagentes nao reagem completamente já que se observa a presença de quartzo-α, cristobalita e alumina-α até 1400 ºC. Outro fato a se ressaltar é o de que existem reaçoes concorrentes à formaçao de cordierita-α, coerentes com o diagrama de equilíbrio MgO-Al2O3-SiO2, pois a safirina e o espinélio permanecem na composiçao do material em toda a gama de tratamentos. A partir dos resultados apresentados, pode-se propor que inicialmente (1250 ºC) a enstatita e a mulita reagem preferencialmente com a alumina-α extremamente fina (D50 = 0,6 mm) utilizada como matéria prima formando fases mais ricas em Al2O3 e MgO, como a safirina e o espinélio.
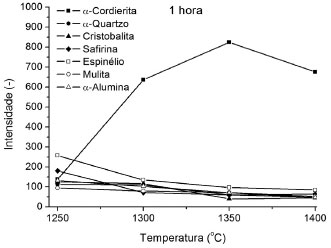 Figura 4. Intensidades dos picos de raios X das fases presentes nas amostras da formulaçao in natura tratadas por 1 h em funçao da temperatura de tratamento
A Equaçao 2 apresenta uma proposta da reaçao concorrente à formaçao de cordierita-α, em baixas temperaturas (até 1250 ºC), que aconteceria no caso da formulaçao em estudo. Nesta reaçao, a mulita proveniente do caulim, juntamente com a enstatita formada a partir do talco, reage preferencialmente com a alumina-α, formando como produtos de reaçao a safirina, o espinélio e a cristobalita (forma alotrópica da sílica estável a altas temperaturas).
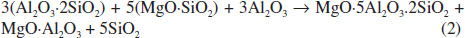
O fator preponderante que facilitaria a formaçao destas fases ricas em Al2O3 (safirina e espinélio) é a existência de partículas grosseiras de quartzo-α contaminando as matérias-primas (talco e caulim), como comprovam as análises granulométricas da Figura 1. Partículas grosseiras dificultam a formaçao de fases mais ricas em SiO2 como a cordierita-α e, como mostra a Figura 4, nota-se a presença significativa de sílica (quartzo-α e cristobalita) em todo o intervalo de temperaturas de tratamento da formulaçao sem moagem. Em temperaturas mais elevadas (1300 a 1350 ºC), a cordierita-α passa a ser a fase prioritária da reaçao comprovando os resultados de ATD (Figura 3). Nesse ponto, a reaçao da enstatita com mulita e sílica passa a ser a majoritária em detrimento da formaçao de safirina e espinélio. Pode-se notar na Figura 4 que o crescimento da intensidade do pico de cordierita-α está associado à diminuiçao das intensidades dos picos de safirina e espinélio, bem com o do quartzo-α e da cristobalita. A reduçao da intensidade do pico de cordierita-α a 1400 ºC pode vir a confirmar a formaçao de uma fase líquida eutética a 1355 ºC com a composiçao do eutético de enstatita-silica-cordierita, que quando formada consome uma parcela da cordierita-α anteriormente produzida. Observando os resultados de ATD para a formulaçao sem moagem (Figura 3), nota-se a presença de um pico endotérmico a 1360 ºC que deve estar associado à formaçao dessa fase líquida. A Figura 5 mostra os resultados obtidos a partir dos ensaios de difratometria de raios X realizados nas amostras tratadas termicamente para o caso da formulaçao moída por 45 min. Os resultados demonstram o efeito que o processo de moagem produziu sobre a cinética e o mecanismo de formaçao da cordierita-α. Comparando as Figuras 4 e 5 pode-se observar que a reduçao do tamanho das partículas mais grosseiras da formulaçao fez acelerar a cinética de formaçao de cordierita-α, pois, no caso da formulaçao moída, já se nota a presença da fase a 1200 ºC. Além disso, a cordierita-α já é a fase majoritária a 1280 ºC, enquanto que para o caso da formulaçao sem moagem isso só ocorria a 1300 ºC. Estes resultados estao de acordo com aqueles obtidos nos ensaios de análise térmica (Figura 3). Nota-se também que a intensidade máxima do pico de cordierita-α é atingida a 1280 ºC, enquanto que para a formulaçao in natura isso só ocorria a 1350 ºC. A partir de 1280 ºC, ao contrário do caso onde nao foi feita a moagem, a mulita, a enstatita, a sílica e a alumina-α reagentes sao consumidas para a formaçao preferencial de cordierita-α. O pequeno aumento de intensidade do pico de cordierita-α a 1350 ºC pode vir a confirmar plenamente o mecanismo de formaçao desta fase a alta temperatura proposto por Aza e Monteros.11 Diferentemente do caso da formulaçao sem moagem, o resultado de análise térmica da formulaçao moída (Figura 3) mostra um pico endotérmico a 1330 ºC, enquanto no primeiro caso este pico aparecia a 1360 ºC. Segundo a referida literatura, tal efeito (citado 1330 ºC) é devido à formaçao de uma fase líquida com a composiçao do eutético cordierita-enstatita-sílica. Segundo o mecanismo proposto, esta fase líquida reage com a mulita remanescente, a 1357 ºC, formando cordierita-µ. Como pode ser observado nos resultados de ATD, existe um pico exotérmico em torno de 1360 ºC que confirma a tese sugerida.
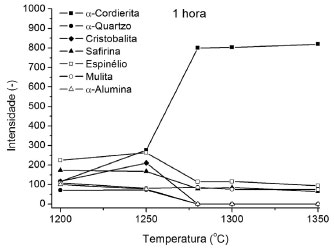 Figura 5. Intensidades dos picos de raios X das fases presentes nas amostras da formulaçao moída por 45 min, tratadas por 1 hora, em funçao da temperatura de tratamento
Resultados nao apresentados, relativos à influência do tempo na temperatura de tratamento sobre a evoluçao das fases formadas a 1280 ºC a partir da formulaçao moída por 45 min, demonstraram que para tempos de tratamento superiores a 1 h, nao sao observadas alteraçoes significativas na composiçao de fases presentes nas amostras. Os resultados observados para o caso do quenching (aquecimento a 1280 ºC, seguido de resfriamento rápido à temperatura ambiente) mostram já a presença de cordierita-α coexistindo com os produtos ricos em MgO e Al2O3 (safirina e espinélio) e com os reagentes (quartzo-α, alumina-α e mulita) da reaçao de formaçao de cordierita-α. O difratograma de raios X para a amostra de "quenching" a 1280 ºC mostra ainda que além dos reagentes citados anteriormente, nota-se a presença de enstatita na composiçao da amostra. Logo, durante a primeira hora de reaçao o espinélio, a safirina e a enstatita reagem com o quartzo-α e a alumina-α formando finalmente a cordierita-α. A Figura 6 apresenta os difratogramas de raios X de amostras da formulaçao moída tratadas termicamente, por 1 h, para temperaturas inferiores à máxima cinética de formaçao da cordierita (1000, 1200 e 1250 ºC). O difratograma da amostra tratada a 1000ºC ratifica os resultados de ATD (Figura 2), já que é observada a presença de enstatita na amostra na temperatura de pico de formaçao do composto. Além disso, nota-se que a amostra ainda apresenta quartzo-α e alumina-α e que já se inicia, nesta temperatura, a formaçao de mulita. Quanto ao mecanismo de reaçao proposto anteriormente (Equaçao 2), os dados da Figura 6 só vem a corroborar com o exposto. Mais uma vez, nota-se que, a 1200 ºC, a reaçao concorrente de formaçao de fases ricas em Al2O3 e MgO é a preferencial. Observa-se na Figura 5 que as fases majoritárias a 1200 ºC sao espinélio e safirina, além da cristobalita, que sao os produtos da reaçao proposta. Os resultados da Figura 6 confirmam que a reaçao prioritária nesses níveis de temperatura tem validade. O difratograma para 1200 ºC indica que as fases presentes sao: sílica (quartzo-α e cristobalita); alumina-α; mulita; safirina; espinélio; e uma pequena quantidade de cordierita-α. Esses resultados demonstram que o mecanismo da reaçao proposto segue uma sequência onde a enstatita formada a temperaturas mais baixas reage preferencialmente com a mulita formada a 1200 ºC e com a alumina produzindo safirina, espinélio e cristobalita. Nessa temperatura, observa-se uma reduçao significativa na intensidade dos picos de alumina-α que está sendo consumida na reaçao e desaparecem também os picos de enstatita que é também outro reagente. Outro indicativo importante da validade da reaçao proposta é o aparecimento do pico muito intenso de cristobalita. A Equaçao 2 evidencia que para cada mol formado de safirina e de espinélio formam-se 5 moles de SiO2. Por fim, como os resultados de distribuiçao de tamanha de partículas (Figura 1) propoem que a moagem produziu uma reduçao no tamanho das partículas de quartzo-α da formulaçao, pode-se observar que já a 1250 ºC a reaçao de formaçao da fase rica em SiO2, ou seja, cordierita-α (Equaçao 1) é mais representativa, apesar de se observar ainda teores significativos de safirina, espinélio, cristobalita e pequena quantidade de mulita.
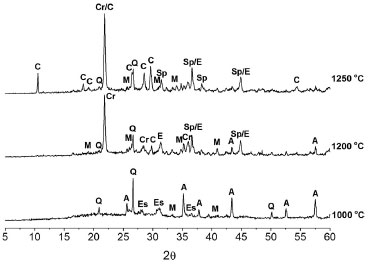 Figura 6. Difratogramas de raios X das amostras da formulaçao moída por 45 min, tratadas por uma hora, em funçao da temperatura de tratamento. A: α-alumina; C: α-cordierita; Cr: cristobalita; E: Espinélio; Es: enstatita; M: mulita; Q: α-quartzo; Sp: safirina
CONCLUSOES O processo de ativaçao mecânica de matérias primas utilizadas no trabalho, apesar de nao produzir modificaçoes na estrutura cristalina dos minerais, atuou de forma significativa na alteraçao da cinética e do mecanismo de formaçao da fase cordierita-α. A reduçao do tamanho das partículas dos reagentes produzida pela moagem de alta energia, principalmente do quartzo-α contaminante, antecipou a temperatura de início da formaçao de cordierita-α em até 30 ºC (de 1305 ºC para 1275 a 1280 ºC). Além disso, a temperatura de máxima taxa de produçao de cordierita-α foi reduzida em ~70 ºC (de 1350 ºC para 1280 ºC). O tempo de tratamento termoquímico demonstrou pouca influência sobre a cinética de formaçao das fases produzidas pela reaçao das matérias primas, e para tempos de tratamento superiores a 1 h, nao foram observadas alteraçoes substanciais na composiçao das fases presentes. O mecanismo de formaçao de cordierita-α quando se utiliza caulim, talco e alumina como reagentes depende, além da temperatura de tratamento, também da distribuiçao de tamanho de partículas das matérias primas empregadas. Quando as matérias-primas naturais (talco e caulim) foram empregadas in natura, a reaçao de obtençao de cordierita-α, por meio da reaçao entre enstatita, mulita e quartzo, é dificultada pela presença de partículas grosseiras de SiO2 como reagente. Neste caso, a reaçao só passa a ser majoritária a temperatura de tratamento da ordem de 1300 ºC. A opçao do emprego de alumina-α fina (D50 = 0,6 mm) na formulaçao dos reagentes possibilitou a proposta da hipótese de uma reaçao concorrente à formaçao de cordierita-α que se mostrou prioritária em tratamentos termoquímicos realizados a baixa temperatura (1200 a 1250 ºC). Nesta reaçao, a enstatita formada a partir do talco, a temperaturas da ordem de 885 ºC reage preferencialmente com a mulita proveniente do caulim (1200 ºC) e com a alumina produzindo fases ricas em Al2O3 (safirina e espinélio) e cristobalita. No caso da formulaçao que sofreu o processo de ativaçao mecânica, a reaçao de formaçao de cordierita-α já é significativa a 1250 ºC, impedindo que o mecanismo de formaçao caminhe na direçao da geraçao de fases ricas em Al2O3 (safirina e espinélio).
AGRADECIMENTOS O presente trabalho foi realizado com o apoio do Conselho Nacional de Desenvolvimento Científico e Tecnológico/Brasil (CNPq) e do Ministério da Educaçao e Ciência/Espanha (MEC, Projeto MAT2003-00836). Os autores agradecem a Empresa Colorminas Colorifício e Mineraçao pela doaçao das matérias primas utilizadas no trabalho.
REFERENCIAS 1. Lima, P. T.; Bertran, C. A.; Thim, G. P.; Quim. Nova. 1998, 21, 608. 2. Camerucci, M. A.; Urretavizcaya, G.; Cavalieri, A. L.; Mater. Res. 2000, 3, 124. 3. Silva, F. A.; Lira, H. L.; Cerâmica 2006, 52, 276. 4. Silva, R. A.; Viana, M. M.; Mohallem, N. D. S.; Cerâmica 2009, 55, 170. 5. Montedo, O. R. K.; Pereira, Y. S.; Floriano, F. J.; Filho, J. O.; Angioleto, E.; Bernardin, A. M.; Matéria 2011, 16, 583. 6. Acimovic, Z.; Pavlovic, L.; Trumbulovic, L., Andric, L.; Stamatovic, M.; Mater. Lett. 2003, 57, 2651. 7. Goren, R.; Gocmez, H.; Ozgur, C.; Ceram. Int. 2006, 32, 407. 8. Rodrigues Neto, J. B.; Moreno, R.; Appl. Clay Sci. 2007, 37, 157. 9. Rodrigues Neto, J. B.; Moreno, R.; Appl. Clay Sci. 2008, 38, 209. 10. Zhou, J.; Dong, Y.; Hampshire, S.; Meng, G.; Appl. Clay Sci. 2011, 52, 328. 11. Aza, S.; Monteros, J. E.; Boletín de la Sociedad Española de Cerámica y Vidrio 1972, 11, 315. 12. Aglietti, E. F.; Porto López, J. M.; Mater. Res. Bull. 1992, 27, 1205. 13. Aglietti, E. F.; Appl. Clay Sci. 1994, 9, 139. 14. Yalamaç, E.; Akkurt, S.; Ceram. Int. 2006, 32, 825. 15. Fotoohi, B.; Blackburn, S.; J. Eur. Ceram. Soc. 2012, 32, 2267. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access