Artigo
|
|
| Tratamentos térmico e químico para remoção de óxidos alcalinos de cinzas de capim elefante Thermal and chemical treatments for removal of alkali oxides of elephant grass ashes |
|
Erika Y. Nakanishi*,I; Ernesto Villar-CociñaII; Sérgio F. SantosI; Michelle S. RodriguesIII; Pedro S. PintoI; Holmer Savastano JuniorI
IDepartamento de Engenharia de Biossistemas, Faculdade de Zootecnia e Engenharia de Alimentos, Universidade de São Paulo, Pirassununga - SP, Brasil Recebido em 11/07/2013 *e-mail: tyou.eyuna@gmail.com Elephant grass ash (EGA) was produced at 700 ºC, with two different treatments: hot water (EGAhw) or acid solution (EGAas). The efficiency of the treatments at removing the potassium oxide was evaluated with the aim of using the EGA as a pozzolanic mineral addition for cement-based composites. Characterizations were carried out by X-ray fluorescence (XRF), X-ray diffraction (XRD), pozzolanic activity by electric conductivity and application of the kinetic-diffusive model. The analysis evidenced that the chemical treatment was more efficient for removing potassium oxide. The pozzolanic activity test and the kinetic parameters for the EGAas indicated that this ash is suitable for cement-based composites. INTRODUÇÃO O termo biomassa abrange todo o recurso renovável oriundo de matéria orgânica de origem animal ou vegetal, utilizada na produção de energia. De forma geral, as madeiras de florestas, as algas, os resíduos de processos agroindustriais e florestais, e os resíduos de humanos e de animais são considerados biomassa.1 A biomassa apresenta-se como importante fonte de energia limpa. Um dos motivos advém do próprio carbono liberado, considerado como "neutro". Ou seja, quando a biomassa passa pelo processo de combustão para produção de energia, o carbono liberado é provido do carbono atmosférico absorvido durante o processo fotossintético para o crescimento da planta, portanto, é considerado "neutro", pois não causa um aumento no balanço de carbono atmosférico.1-3 Diferentemente do carbono do combustível de origem fóssil que se encontra armazenado no subsolo, que ao utilizá-lo libera uma quantidade extra de carbono na atmosfera, ocasionando um aumento em sua concentração. No Brasil, dentre as biomassas disponíveis, a cana-de-açúcar é a mais usada para cogeração de energia limpa (etanol, por exemplo). Os seus resíduos, o bagaço e a palha, são queimados como principal matéria-prima em centrais de cogeração para a produção de energia elétrica.4 O capim-elefante (Pennisetum purpureum) também tem sido investigado como nova fonte de biomassa.2 O capim-elefante é uma espécie originaria da África, com taxas de crescimento elevado, a produção de 40 ton de matéria seca/ ha por ano.2 Com isso, o interesse no capim-elefante como uma fonte de energia de biomassa é devido à sua capacidade de acumular matéria seca e a alta percentagem de fibra semelhante à cana-de-açúcar.5 No entanto, a central de cogeração de energia produz também resíduos sólidos, as cinzas. Por esta razão, estas cinzas vêm sendo avaliadas e estudadas como adição mineral pozolânica, ou seja, como material de substituição parcial de cimento Portland em compósitos.4,6-8 Simulações realizadas por Fairbairn et al.9 demonstraram que a adição de minerais em compósitos à base de cimento podem resultar em benefícios ambientais. Portanto, a utilização de adição mineral como substituição parcial do cimento Portland se enquadra no conceito de mecanismos de desenvolvimento limpo que comtempla projetos de redução de emissões de CO2.9 Todavia, a presença de elevados teores de óxidos alcalinos (K2O e Na2O) nas cinzas pode gerar produtos de hidratação indesejáveis em uma matriz cimentícia e podem reagir com certos agregados, ou seja, na presença de umidade é um processo químico onde alguns constituintes mineralógicos do agregado reagem com hidróxidos alcalinos, que resulta na propagação de fissuras e um consequente dano à matriz de cimento Portland.10 A norma ASTM C618 (2012)11 preconiza o teor máximo de álcalis disponíveis em Na2Oeq de 1,5%. O objetivo deste estudo é avaliar o potencial das cinzas de capim-elefante como material pozolânico para compósitos à base de cimento após o tratamento térmico ou químico para remoção dos óxidos alcalinos, tais como K2O e Na2O.
PARTE EXPERIMENTAL Material O capim elefante (Pennisetum purpureum), cultivar Napier, foi coletado no campus da Universidade de São Paulo, Pirassununga, Brasil. Devido ao elevado teor de umidade, de aproximadamente 70%, o processo de secagem se fez necessário. A secagem do material foi em estufa de 60 ºC durante 72 horas e, em seguida, esse material foi picado. A produção de cinza de capim elefante (CCE) foi obtida em forno mufla, com taxa de aquecimento de 10 ºC min-1 para atingir dois patamares (400 ºC e 700 ºC). A primeira etapa de aquecimento atingiu a temperatura de 400 ºC por 20 min (com o objetivo de homogeneizar a queima) e a segunda etapa atingiu a temperatura de 700 ºC, permanecendo por 60 min.12 O tratamento a 700 ºC foi com o objetivo de obter óxido de silício em fase amorfa, que facilita a reação com o hidróxido de cálcio. Após esse tempo o forno foi desligado e aguardou-se o resfriamento. Tratamentos térmico e químico na cinza Foram testados dois tratamentos, térmico e químico, na cinza para remoção dos óxidos alcalinos. O tratamento térmico consiste em lavar a cinza com água quente (CCEag).13 Para tanto, foi usado uma relação de 0,6 g de cinza/mL de água a 70 ºC durante 30 min, sob agitação. Este processo possui como princípio da dissolução dos óxidos alcalinos em temperaturas elevadas. O tratamento químico consiste em passar as cinzas por um processo de limpeza com ácido clorídrico (HCl) 3,3% v/v (CCEhc).14 Para isso foi usada uma relação de 50,5 g de cinza/500 mL de solução ácida, mantida sob agitação a 90 ºC durante 1 h. O HCl promove a remoção das impurezas metálicas. Caracterizações das cinzas Caracterizações químicas das cinzas foram realizadas por fluorescência de raios-X (FRX) em espectrômetro de raios X Axios Advanced. A perda ao fogo (PF) foi efetuada a 1050 ºC por 1 h de acordo com a norma ASTM C114 (2003).15 A perda ao fogo exprime a perda de massa da cinza após aquecimento. Ou seja, a perda ao fogo está relacionada com a quantidade de matéria-orgânica residual existente no material após a queima do capim elefante, tais como os elementos voláteis, como o carbono. As caracterizações mineralógicas foram realizadas pela técnica de difração de raios X (XRD), a fim de identificar as fases cristalina e amorfa das cinzas. Padrões de difração de raios-X foram analisados usando o programa PANlytical X'Pert Pro com X' Celerator, assim como os dados foram comparados com os disponíveis no International Centre for Diffraction Data e na Panalytical Inorganic Crystal Structure Database. A atividade pozolânica foi determinada por meio da medida de condutividade elétrica em uma solução saturada de hidróxido de cálcio (Ca(OH)2).16 Foram misturados 5,25 g de cinza de capim elefante em uma solução saturada de Ca(OH)2 e água deionizada. Imediatamente após a cinza ser adicionada na solução, iniciou-se a coleta de condutividade elétrica, por 72 h, por meio do condutivímetro, modelo DM-32, da Digimed. Determinação dos parâmetros do modelo cinético-difusivo O modelo cinético-difusivo7,16 é usado para descrever a atividade pozolânica em um sistema CH/pozolana, segundo o modelo abaixo:
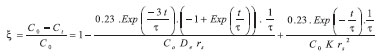
sendo De o coeficiente efetivo de difusão, K a constante de velocidade da reação, Co a condutividade inicial da solução e τ uma constante de tempo (intervalo de tempo no qual o raio do núcleo de uma pozolana diminui a 37% do seu raio inicial (rs)). A magnitude adimensional ξ = (Co - Ct)/Co que representa a perda relativa de condutividade a ser determinada neste trabalho. Ct representa a perda absoluta de condutividade com o tempo em um sistema CH/pozolana.
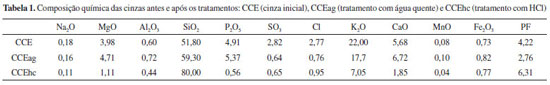
RESULTADOS E DISCUSSÃO A Tabela 1 mostra os principais elementos (expresso em óxidos) presentes nas cinzas de capim elefante antes e após o tratamento. Os principais óxidos presentes foram a sílica (SiO2) e o óxido de potássio (K2O). Os óxidos Al2O3, SO3, P2O5 e Fe2O3 também foram identificados, porém, em menor quantidade. Ao se comparar a composição química das cinzas tratadas (CCEag e CCEhc) com a cinza de capim elefante antes dos tratamentos, como apresentadas na Tabela 1, pode-se observar aumento no teor de sílica de 7,5% e 28,2% em relação ao teor inicial, respectivamente para as cinzas CCEag e CCEhc. Com isso, apenas a cinza CCEhc atingiu teores de SiO2 próximos de cinzas que são amplamente estudadas, tais como cinzas de casca de arroz (82%), de bagaço de cana-de-açúcar (78%)17 e de folha de bambu (80%).16
Todavia, ambas as cinzas CCEag e CCEhc apresentaram uma soma de teores dos óxidos de silício (SiO2), de alumínio (Al2O3) e de ferro (Fe2O3) acima de 50% como indicativo preconizado pela norma ASTM C-618 (2012) para serem consideradas materiais pozolânicos.11 Além disso, ambas as cinzas tratadas também atenderam o máximo teor de óxido de enxofre (SO3) permitido de 5%. Em relação à extração do potássio, observa-se que na cinza CCEag o teor de óxido de potássio foi reduzido em 19,54%, enquanto o teor na cinza CCEhc foi reduzido em 67,95%, como mostrado na Figura 1. Contudo, o teor máximo de álcalis disponíveis ainda se encontra acima do estabelecido pela norma ASTM C-618 (2012), que é 1,5%12 em ambas as cinzas. Sendo assim, para compósitos cimentícios sem agregados existe a possibilidade de usar as cinzas tratadas como adições minerais. Mehta18 relatou a utilização de cinza da casca de arroz com teor de 5% de K2O.
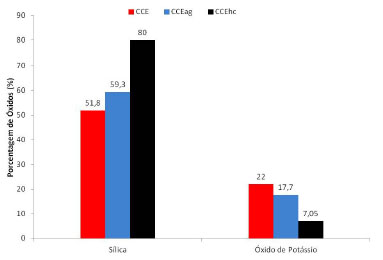 Figura 1. Efeito dos tratamentos nas cinzas com relação à sílica e ao óxido de potássio. CCE é a cinza de referência, CCEag e CCEhc são respectivamente as cinzas tratadas com água quente e ácido clorídrico
As composições mineralógicas das cinzas são mostradas na Figura 2. Observa-se nos difratogramas das cinzas CCE, CCEag e CCEhc uma indicação da presença de fase amorfa entre os ângulos de Bragg (2θ) entre 20 º e 40 º. Contudo, foram identificadas fases cristalinas, tais como a cristobalita, quartzo e magnesita. Vale ressaltar que na cinza CCEag há mais fases cristalinas do que nas cinzas tratadas com ácido clorídrico (CCEhc), tais como nitrato de amônio, fosfato de magnésio e potássio, e, óxido de cálcio.
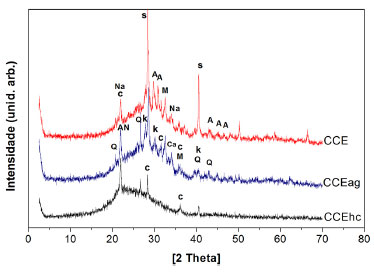 Figura 2. Difração de raios X das cinzas: CCE (cinza inicial), CCEag (cinza tratada com água quente) e CCEhc, (cinza tratada com ácido clorídrico). S= Silvita (KCl); C= Cristobalita (SiO3); A= Arcanita (K2SO4); M= Magnesita (MgCO3); Na= Magnésio Fosfato de Sódio (NaMgPO4); Q= Quartzo (SiO2); AN= Nitrato de amônio (NH4NO3); Ca= Óxido de cálcio (CaO4); K= Potássio Fosfato de Magnésio (KMgPO4)
Avaliação da atividade pozolânica no sistema CH/CCEEhc O ensaio de atividade pozolânica não foi realizado na cinza CCEag, pois a leitura registrou uma alta condutividade elétrica. Uma explicação é a quantidade elevada de íons presente na composição da cinza liberados no sistema hidróxido de cálcio e água deionizada. Vale ressaltar que a cinza CCEag apresentou uma maior quantidade de fases cristalinas solúveis em água em relação à cinza tratada com ácido clorídrico (CCEhc), como indicado nos difratogramas. Como consequência, a cinza CCEag libera muitos íons no sistema com hidróxido de cálcio e água deionizada, o que impossibilita a medida de condutividade elétrica para avaliar a atividade pozolânica e determinar os parâmetros do modelo cinético-difusivo da mesma. As curvas de condutividade elétrica e de perda relativa de condutividade (ξ) versus tempo da cinza CCEhc foram apresentadas no gráfico da Figura 3. Nota-se que os valores de condutividade elétrica no sistema CH/cinza CCEhc diminui com o tempo. Atribui-se este comportamento à reação pozolânica entre a sílica amorfa e os íons Ca2+ liberados pelo CH para formação de gel de CSH (silicato de cálcio hidratado).16
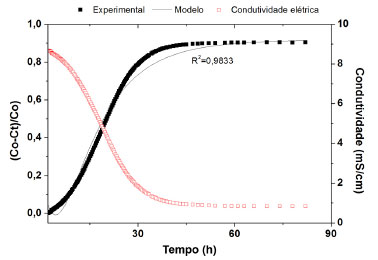 Figura 3. Variação de condutividade elétrica do sistema cinza CCEhc, hidróxido de cálcio e água deionizada, e perda relativa de condutividade em função do tempo de reação
A estabilização da condutividade elétrica em um patamar abaixo do valor inicial é um indicativo de que os íons de Ca2+ foram consumidos parcialmente na reação com a cinza.16 Provavelmente, a cinza CCEhc possui outros elementos químicos, provenientes de fases cristalinas solúveis, que reagem com Ca2+ além da sílica amorfa. Modelo cinético-difusivo Conforme a Figura 3, a curva com linha contínua representa o comportamento previsto pelo modelo. O coeficiente de correlação (r), o coeficiente de múltipla determinação (R²) e soma dos quadrados dos resíduos (RSS) foram, respectivamente, 0,9833; 0,9812 e 0,26, indicando que o modelo cinético-difusivo contempla os principais mecanismos de reação entre a cinza CCEhc e o hidróxido de cálcio em um sistema aquoso. Além disso, o ajustamento do modelo com a curva experimental permitiu determinar importantes parâmetros: τ = 16,9 ± 0,2 h; De = (6,37 ± 0,32) 10-3 mm2 h-1; K = (9,70 ± 0,25) 10-2 h-1, baseando-se no modelo cinético-difusivo. De acordo com os valores de parâmetros do modelo cinético-difusivo é possível concluir que a CCEhc calcinada a 700 ºC apresenta alta reatividade na ordem de 10-2/h, equivalente à ordem de magnitude registrada para as cinzas de bagaço de cana-de-açúcar, palha de cana-de-açúcar e casca de arroz calcinados a 800 ºC mencionadas na literatura.8,19 Esse resultado sugere que a cinza de capim elefante tratada com ácido clorídrico pode ser utilizada como adição mineral em compósitos cimentícios sem agregados.
CONCLUSÃO As principais conclusões deste trabalho são listadas abaixo:
AGRADECIMENTOS Os autores agradecem à FAPESP (processos nº 2009/17293-5, 2010/16524-0 e 2011/16842-5) e ao CNPq (p. 306386/2013-5 e p. 401704/2013-0) pelo apoio financeiro.
REFERÊNCIAS 1. Saidur, R.; Abdekaziz, E. A.; Demirbas, A.; Hossain M. S.; Mekhilef, S.; Renew. Sust. Energ. Rev. 2011, 15, 2262. 2. Strezov, V.; Evans, T. J.; Hayman, C.; Bioresour. Technol. 2008, 99, 8394. 3. Abbasi, T.; Abbasi, S.; Renew. Sust. Energ Rev. 2010, 14, 919. 4. Frías, M.; Villar-Cociña, E.; Savastano Jr., H.; Cem. Concr. Compos. 2011, 33, 490. 5. Quesada, D. M.; Boddey, R. M.; Massena Reis, V.; Urquiaga, S.; Boletim técnico, Marta Maria, Seropédica, 2004. 6. Martirena Hernández, J. F.; Middendorf, B.; Gehrke, M.; Budelmann, H. Cem. Concr. Res. 1988, 28, 1525. 7. Villar-Cociña, E.; Frías, M. R.; Morales, E. V. ACI Mater. J. 2008, 105, 258. 8. Morales, E. V.; Villar-Cociña, E.; Frías M.; Santos, S. F.; Savastano Jr., H.; Cem. Concr. Compos. 2009, 31, 28. 9. Fairbairn, E. M. R.; Americano, B. B.; Cordeiro, G. C.; Paula, T. P.; Toledo Filho, R. D.; Silvoso, M. M.; J. Environ. Manag. 2010, 9, 1864. 10. Jackson, P. J.; Em Lea's Chemistry of Cement and Concrete; Hewlett, P. C.; ed.; Butterworth-Heinemann: London, 1990, cap. 1. 11. A. C. 618, Standard Specification for Coal Fly Ash and Raw or Calcined Natural Pozzolan for Use in Concrete. 12. Rodrigues, M. S.; Tese de Doutorado, Universidade Estadual de Campinas, Brasil, 2012. 13. Saturino, D. M.; Carvalho, G. G.; Brandão, H. S.. M.; Lutkenhaus, M. G.; Nogueira, M. M. N.; Suzuki, R. Y.; Cardoso, M.; Rocha, S. D. R.; Congreso Iberoamericano de Investigación em celulosa y papel, Puerto Iguazú, Argentina, 2000. 14. Lima, S. P. B. de.; Vasconcelos, R. P.; Paiva, O. A.; Cordeiro, G. C.; Chaves, M. R. M.; Toledo Filho, R. D.; Fairbairn, E. M. R.; Quim. Nova. 2011, 34, 71. 15. A. C 114-03, Standard Test Method for Chemical Analysis of Hydraulic Cement, Philadelphia, 2003. 16. Villar-Cociña, E.; Morales, E. V.; Santos, S. F.; Savastano Jr., H.; Frías, M.; Cem. Concr. Compos. 2011, 33, 68. 17. Cordeiro, G. C.; Toledo Filho, R. D.; Tavares, L. M.; Fairbairn, E. M. R.; Constr. Build Mater. 2012, 29, 641. 18. Mehta, P. K.; Proceedings of the International Symposium on Advances in concrete technology, Atenas, Grécia, 1992, 407. 19. Villar-Cociña, E.; Valencia-Morales, E.; González-Rodríguez, R.; Hernández-Ruíz, J.; Cem. Concr. Res. 2003, 33, 517. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access