Artigo
|
|
| Avaliação da atividade antimicrobiana de soluções de flumequina submetidas aos processos eletroquímico e foto-eletroquímico Evaluation of residual antimicrobial activity of flumequine solutions subjected to electrochemical and photo-electrochemical processes |
|
Caio Rodrigues-Silva; Milena G. Maniero; José Roberto Guimaraes*
Departamento de Saneamento e Ambiente, Faculdade de Engenharia Civil, Arquitetura e Urbanismo, Universidade Estadual de Campinas, Avenida Albert Einstein, 951, 13083-852 Campinas - SP, Brasil Recebido em 22/08/2013 *e-mail: jorober@fec.unicamp.br Flumequine degradation by electrochemical and photo-electrochemical processes was evaluated in this study. The antimicrobial activity of the solutions subjected to the electrochemical processes was monitored during the assays. The experiments were carried out using DSAr (dimensionally stable anode) electrode. The influence of current density was investigated for the 7.5 to 45 mA cm-2 range. The photo-electrochemical process was more efficient for degrading flumequine (85%) and reducing solution antimicrobial activity. For both processes, the residual antimicrobial activity decreased as flumequine degradation increased. The reaction intermediate m/z 244 (5-methyl-1-oxo-6,7-dihydro-1H,5H-pyrido[3,2,1-ij]quinoline-2-carboxylic acid) was identified. INTRODUÇÃO A presença de poluentes orgânicos emergentes em águas superficiais, esgoto municipal e, inclusive, em água potável clorada destinada ao abastecimento público tem sido relatada pela comunidade científica.1-3 Poluentes emergentes são definidos como compostos que não são usualmente monitorados ou que ainda não possuem legislação regulatória específica, mas que apresentam potencial risco à saúde humana e ao meio ambiente.4 Dentre os principais riscos da presença de poluentes emergentes no ambiente destaca-se a preocupação com o desenvolvimento de bactérias resistentes. Bactérias expostas a resíduos de agentes antimicrobianos podem sofrer modificações em sua carga genética, elevando a resistência das mesmas em relação ao antimicrobiano as quais foram expostas.5 Esses compostos oferecem, inclusive, riscos para espécies não-alvo, por sua toxicidade, pela possibilidade de bioacumulação e por possíveis efeitos ecotoxicológicos ainda pouco conhecidos. Resíduos de fluoroquinolonas já foram detectados em efluentes hospitalares (44 µg L-1).5 A flumequina, que pertence à classe das fluoroquinolonas, tem sido utilizada na medicina veterinária para combater principalmente bactérias Gram-negativas, como por exemplo E. coli. Poucos são os trabalhos de monitoramento ambiental e estudos de degradação desse composto. Os processos oxidativos avançados (POA) têm sido reportados como métodos alternativos para a degradação de poluentes emergentes, dentre eles a flumequina.6-10 Os POA podem ser definidos como processos baseados na formação do radical hidroxila (•OH), o qual possui um elevado potencial de redução (E = 2,8 V).11 Os POA eletroquímico (POAE) e fotoeletroquímico (POAFE) são eficientes na degradação de compostos orgânicos recalcitrantes,12-15 e já foram empregados na degradação de outras quinolonas, como ofloxacina e enrofloxacina.12,14 No entanto, não são encontrados dados sobre a degradação de flumequina pelos referidos processos. Jara et al.14 avaliaram a degradação da ofloxacina (25 mg L-1) pelo processo fotoeletroquímico (Ti/Pt, DSA®, 40 mmol L-1 de Na2SO4 como eletrólito suporte) e comprovaram que, ao aplicar uma densidade de corrente elétrica de 200 A m-2, 60% da fluoroquinolona foi degradada após 100 min de ensaio. Guinea et al.12 avaliaram a degradação da enrofloxacina (158 mg L-1) em solução aquosa, empregando como anodo Pt ou diamante dopado com boro BDD ("boron-doped diamond") e uma densidade de corrente de 33 mA cm-2. Aproximadamente 23% e 37% da fluoroquinolona foi degradada em 60 min utilizando-se eletrodos de Pt e BDD, respectivamente, atingindo 90% e 97% em 360 min. Dos processos eletroquímicos, aqueles que empregam oxidação anódica são os mais comumente usados para a remoção de compostos orgânicos em baixas concentrações. Durante o processo, pode ocorrer a troca direta de elétrons entre o composto orgânico e a superfície do eletrodo e, também, a troca indireta, pela intermediação de espécies eletroativas oxidantes formadas no anodo.13 Pinhedo et al.16 e Fukunaga et al.17 destacaram a eficiência dos eletrodos metálicos de Ti revestidos com óxidos nobres, conhecidos como DSA® (Dimensionally Stable Anode), para a degradação de ácidos húmicos e formaldeído, respectivamente. Os principais objetivos do presente trabalho são a avaliação da degradação da flumequina, o monitoramento da atividade antimicrobiana das soluções submetidas aos processos eletroquímico e fotoeletroquímico e a identificação dos produtos de degradação.
MATERIAL E MÉTODOS Reagentes e soluções Flumequina (99%) foi adquirida da empresa Sigma-Aldrich, metanol (grau HPLC) e BaCl2.2H2O (99%) da J. T. Baker, ácido oxálico (99.5%) da Merck, H3PO4 (85%) e KH2PO4 (98%) da Nuclear e KOH (85%) da Ecibra. H2SO4 concentrado, NaOH (97%) e K2SO4 foram adquiridos da Synth. Caldo de cultura Mueller-Hinton e Mueller-Hinton/Agar foram obtidos da Himidia. A água ultrapura utilizada no estudo foi obtida por um sistema Millipore (Milli-Q Academic water purification system). As soluções aquosas de flumequina (500 µg L-1) utilizadas nos ensaios foram preparadas a partir da diluição da solução estoque (250 mg L-1) em água ultrapura (Milli-Q). Sistema experimental Os ensaios de degradação foram realizados em um reator fotoeletroquímico similar ao descrito por Pinhedo et al.16 O sistema experimental utilizado para a degradação da flumequina era constituído de um reator de vidro (capacidade de 1,2 L) e de uma bomba peristáltica para manter a solução em constante recirculação e agitação. O anodo possuía a composição de óxidos na proporção 70TiO2/30RuO2 (DSA®, comercial de titânio revestido) com área de 200 cm2, fornecido por De Nora do Brasil. Uma tela de TiO2 na forma metálica (catodo) foi fixada no interior do cilindro do anodo, mantendo-se um espaçamento de 3,0 mm. Por fim, um tubo de quartzo foi inserido concentricamente ao catodo, para servir de suporte para a lâmpada utilizada nos experimentos (UV-C germicida de 11 W e 80 W). Na Figura 1 é apresentado o esquema do sistema fotoeletroquímico.
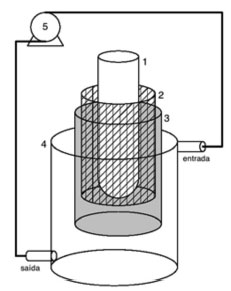 Figura 1. Sistema operacional do reator foto-eletroquímico: 1 - tubo de quartzo; 2 - catodo; 3 - anodo; 4 - reservatório; 5 - bomba peristáltica
A degradação da flumequina foi avaliada em diferentes tempos de reação (0 a 60 min). As densidades da corrente foram 7,5, 15, 22,5, 30, 37,5 e 45 mA cm-2. Como eletrólito suporte foi utilizado K2SO4 em duas concentrações diferentes, 25 e 50 mmol L-1. Método analítico O método analítico utilizado para determinação da flumequina consistiu na concentração do analito por extração em fase sólida (EFS) e quantificação por cromatografia líquida de alta eficiência (HPLC), com detecção por UV. Para a EFS, foi utilizado o cartucho C18 (500 mg/6 mL) da Varian, o qual foi condicionado com 6 mL de metanol e 6 mL de água ultrapura. Após a percolação da solução (1000 mL) pelo cartucho, a flumequina e os produtos de degradação foram eluídos com 4 mL de metanol. Foi realizada a extração em fase sólida para permitir a quantificação de baixas concentrações da flumequina pela técnica analítica empregada, ou seja, a cromatografia líquida de alta eficiência. Destaca-se que é importante desenvolver trabalhos utilizando-se baixos teores iniciais do fármaco de interesse, aproximando-se daqueles encontrados em matrizes aquosas reais.5 O cromatógrafo a líquido de alta eficiência utilizado no desenvolvimento deste trabalho é composto por um sistema de bombeamento unitário modelo Waters 510 (Waters, EUA), injetor modelo 7725 (Rheodyne, EUA), amostrador de 20 µL e detector UV modelo 486 (Waters, EUA). A quantificação foi realizada em 236 nm. Para a aquisição dos dados foi utilizado um integrador modelo 746 (Waters, EUA). A coluna analítica utilizada para a separação foi a XBridgeTM RP18 da Waters (250 mm x 4,6 mm DI, 5 µm). A fase móvel era constituída por metanol e 0,01 mol L-1 ácido oxálico (60:40, v/v). A vazão foi de 1 mL min-1. Atividade antimicrobiana O monitoramento da atividade antimicrobiana foi realizado utilizando-se a bactéria E. coli K12 (ATCC 23716) como organismo-teste, conforme metodologia descrita por da Silva et al.8 e Rodrigues-Silva et al.9-10 Esses ensaios são baseados na avaliação da inibição do crescimento da cultura das bactérias por meio do monitoramento da turbidez da suspensão microbiana. A concentração de flumequina necessária para inibir o crescimento de 50% das bactérias E. coli (CE50) foi avaliada e utilizada como um parâmetro de controle. A cultura de E. coli foi exposta a concentrações de flumequina variando entre 21,7 µg L-1 e 1,25 mg L-1. O valor de CE50 assumido para a flumequina foi de 14,65 x 10-5 g L-1, baseado na média de 10 ensaios realizados em duplicata e em 10 diferentes dias. Os resultados dos ensaios de atividade antimicrobiana foram comparados aos das curvas de dose resposta para o padrão da flumequina (controle) e para a solução inicial não degradada (t = 0 min) e foram avaliados usando o software Graph-Pad Prism 5.0. As atividades antimicrobianas residuais das soluções submetidas aos processos eletroquímico e fotoeletroquímico foram avaliadas em três condições diferentes: aplicando 15, 30 e 45 mA cm-2 de densidade de corrente e utilizando 25 mmol L-1 de eletrólito suporte (K2SO4). Identificação de intermediários Os intermediários de degradação formados foram avaliados utilizando-se espectrometria de massas, massas em tandem (MS/MS) e pela avaliação do perfil isotópico dos intermediários propostos. As estruturas dos possíveis produtos formados foram propostas baseadas nos espectros de massas, composição elementar do fármaco e mecanismos de reações apresentados na literatura especializada.9-10,18-20 A estrutura e composição química dos intermediários propostos foram obtidas utilizando o software ChemDoodle v.4.1.1. Os produtos de degradação formados foram avaliados após a submissão de soluções aquosas de flumequina (10 mg L-1) aos processos de degradação. Essa maior concentração do fármaco foi utilizada para intensificar o sinal dos produtos de degradação e para evitar a perda dos analitos na etapa de EFS. Foi utilizado um espectrômetro de massas UHPLC-MS/MS Waters UPLC Acquity - TQD Quattro Micro API. A condição típica de operação foi: fluxo de gás no cone (100 L h-1), fluxo do gás de dessolvatação (800 L h-1), polaridade (ES+), energia do capilar (3.000 V), energia do cone (25 V), energia do cone de extração (3 V), temperatura de dessolvatação (300 ºC) e energia de ionização (0,5 V). O espectro foi adquirido entre m/z 100 e 600.
RESULTADOS Influência da fotólise A degradação de flumequina (500 µg L-1) pelos processos de fotólise e de fotocatálise heterogênea com TiO2 imobilizado foi avaliada isoladamente para a melhor compreensão da contribuição desses processos nos ensaios nos quais foram aplicados os processos eletroquímico e foto-eletroquímico. Para o processo de fotólise, utilizando uma lâmpada UV254nm com 11 W de potência atingiu-se a degradação máxima da flumequina em solução aquosa de 26,2%, em 60 min de ensaio; em 15 min de iluminação, 3,3% do fármaco foi degradado. Ao aumentar a potência da lâmpada em aproximadamente 7 vezes (UV254nm com 80 W), a eficiência do processo de fotólise foi de 10,3% após 15 min e aumentou para 38% após 60 min de ensaio. A fotocatálise heterogênea foi avaliada utilizando o TiO2 imobilizado na forma de um eletrodo. Quando empregado apenas o eletrodo (anodo-70TiO/30RuO ou catodo-Ti na forma metálica), não foi observada uma degradação do fármaco superior à obtida pela fotólise, independentemente da potência da lâmpada utilizada. Utilizando a lâmpada de menor potência, em 60 min de contato, 24,4% do fármaco foi degradado e, com a lâmpada de 80 W, atingiu-se 38,1% de degradação nesse mesmo período de ensaio. Influência da concentração de eletrólito suporte A influência da concentração do eletrólito suporte durante os ensaios com processos eletroquímico e fotoeletroquímico foi avaliada utilizando-se duas concentrações de sulfato de potássio: 25 e 50 mmol L-1. Conforme apresentado na Figura 2, para o processo eletroquímico (15 mA cm-2), quando utilizada a menor concentração de eletrólito suporte (25 mmol L-1), a degradação máxima da flumequina foi de 19,4% em 60 min de reação. Dobrando-se a concentração do K2SO4, atingiu-se 26,1% de degradação.
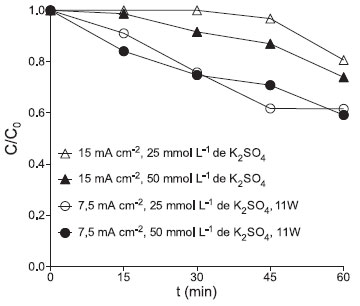 Figura 2. Degradação de flumequina pelo processo eletroquímico e foto-eletroquímico utilizando duas concentrações de eletrólito suporte (25 e 50 mmol L-1)
Com relação ao processo foto-eletroquímico, quando aplicada uma densidade de corrente de 7,5 mA cm-2, a degradação máxima atingida foi de aproximadamente 40%, independentemente da concentração do eletrólito suporte. É importante destacar que, devido ao baixo incremento na eficiência de degradação obtido com a utilização da maior concentração de eletrólito suporte, optou-se em dar continuidade aos experimentos de degradação utilizando a menor concentração do sulfato de potássio, ou seja, 25 mmol L-1. Degradação da flumequina pelos processos eletroquímico e fotoeletroquímico Para o processo POAE, utilizando-se 25 mmol L-1 de K2SO4 como eletrólito suporte, foi observado que a elevação gradual da densidade de corrente de 15 até 45 mA cm-2 promoveu um aumento na degradação de flumequina. Nos primeiros 15 min de ensaio, a degradação máxima atingida foi de 43,3% quando empregada densidade de corrente de 45 mA cm-2. Em 60 min, 19,4%, 49,3%, 68,2%, 74,9% e 82,9% do fármaco foi degradado quando aplicados 15, 22,5, 30, 37,5 e 45 mA cm-2, respectivamente. O emprego da radiação UV254nm (11 W) (processo POAFE) resultou no aumento da eficiência da degradação da flumequina quando comparado ao processo POAE, para densidades de corrente de até 22,5 mA cm-2. Após 45 min de ensaio, quando empregada densidade de corrente de 15 mA cm-2, as degradações atingidas pelo processo POAE e POAFE foram de 3,2% e 50,3%, respectivamente, conforme apresentado nas Figuras 3A e 3B. A combinação do processo eletroquímico com a fotólise resultou em efeito sinérgico na eficiência de degradação apenas quando empregada a densidade de corrente de 15 mA cm-2.
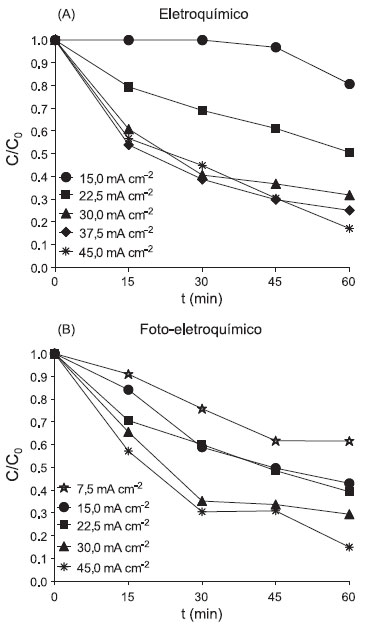 Figura 3. Degradação de flumequina pelos processos (A) eletroquímico e (B) foto-eletroquímico (25 mmol L-1 de K2SO4, UV254nm, 11 W, densidade de corrente variando entre 7,5 e 45 mA cm-2)
Subsequentes aumentos na densidade da corrente (30 a 45 mA cm-2) não promoveram significativo ganho de eficiência em relação ao processo POAE isoladamente. Em 60 min de ensaio, o processo POAFE promoveu a degradação máxima de 85% da flumequina, quando aplicada uma densidade de corrente de 45 mA cm-2. Comparando-se os resultados obtidos pelos processos POAE e POAFE com trabalho prévio,10 no qual foi empregado reagente de Fenton, observou-se uma maior degradação da flumequina pelos processos eletroquímicos. Quando utilizado 0,5 mmol L-1 de Fe(II) e 2,0 mmol L-1 de H2O2, aproximadamente 40% da flumequina foi degradada em 30 min.10 Nesse mesmo tempo de ensaio, utilizando a maior densidade de corrente avaliada (45 mA cm-2), os processos eletroquímico e fotoeletroquímico foram capazes de degradar 55,1% e 69,4%, respectivamente. Salienta-se ainda que, para o processo Fenton, não foi verificado um aumento da degradação ao longo do tempo de ensaio,10 o qual foi observado para os experimentos utilizando o eletrodo DSA. Intermediários formados A avaliação dos intermediários da degradação da flumequina já foi previamente discutida e analisada para os processos oxidativos avançados, tais como UV/H2O2, fotocatálise, reagente de Fenton e foto-Fenton.9-10,18,19 Entretanto, não há relatos de investigações da degradação da flumequina e da avaliação dos intermediários formados durante a aplicação dos processos eletroquímico e foto-eletroquímico. Nas Figuras 4 e 5 são apresentados os espectros de massa obtidos para as soluções submetidas a esses processos.
 Figura 4. Espectros de massa das soluções submetidas ao processo eletroquímico (30 mA cm-2). (A) t = 0 min, (B) t = 15 min, (C) t = 30 min, (D) t = 45 min e (E) t = 60 min
 Figura 5. Espectros de massa das soluções submetidas ao processo foto-eletroquímico (UV254nm, 11W e 30 mA cm-2). (A) t = 0 min, (B) t = 15 min, (C) t = 30 min, (D) t = 45 min e (E) t = 60 min
De acordo com Albini e Monti,20 a perda do flúor é uma das principais rotas de degradação das quinolonas quando submetidas à radiação UV. Inclusive, o aumento da concentração de fluoreto em soluções de flumequina submetidas aos POA foi reportado por Klamerth et al.21 e por Sirtori et al.19 Dessa forma, é possível propor que o radical hidroxila gerado nesses processos possa ter promovido a formação do produto m/z 244 (5-metil-1-oxo-6,7-dihidro-1H,5H-pirido[3,2,1-ij]quinolina-2-ácido carboxílico), pelo processo de perda do flúor da molécula da flumequina, conforme apresentado na Figura 6. A identificação do produto de degradação com m/z 244 corrobora com os estudos de Rodrigues-Silva et al.9-10
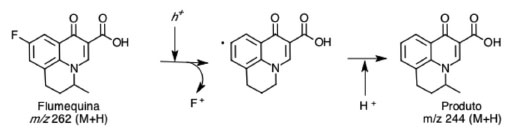 Figura 6. Produto de degradação da flumequina
A identificação dos demais produtos da degradação, apresentados nos espectros de massa das Figuras 4 e 5, é complexa, tendo em vista a possibilidade de formação de adutos entre os fragmentos e o K+, devido ao excesso de K2SO4 em relação à concentração de flumequina. Adutos são íons formados pela combinação direta entre a molécula ionizada e outro íon que não seja um próton (H+), e não se fragmentam quando empregada energia de ionização normalmente utilizada em análise de massa em tandem.22 Os produtos formados com m/z 245, 217, 213, 197 e 175, presentes com um sinal intenso nos espectros de massa das Figuras 4 e 5, não puderam ser identificados e propostos, pois não foi possível fragmentar esses analitos por análises de MS/MS. Presume-se que esse fato tenha ocorrido, provavelmente, por esses intermediários serem adutos dos intermediários de degradação formados durante a aplicação dos processos eletroquímicos. Remoção da atividade antimicrobiana A atividade antimicrobiana da flumequina está relacionada com a formação de ligações de hidrogênio entre os grupos aceptores (-COOH, -C=O e -F) com o DNA-girase, resultando na inibição da duplicação da bactéria.23 Caso ocorram alterações nos sítios ativos onde se formam as ligações de hidrogênio, espera-se que a atividade antimicrobiana do intermediário formado diminua. Porém, as reações entre os radicas hidroxila e as quinolonas não são totalmente identificáveis, uma vez que o radical hidroxila não é seletivo, podendo entrar em contato com qualquer região da molécula alvo. É imprescindível a utilização de ensaios biológicos capazes de avaliar a atividade antimicrobiana residual da solução, ou seja, do composto original e de seus intermediários de reação. Do ponto de vista ambiental essa avaliação é importante e permite verificar possíveis efeitos sinérgicos e antagônicos. Foram realizados ensaios em branco com o eletrólito suporte e não foi observada inibição do crescimento da cultura de bactérias E. coli. Em nenhuma das condições avaliadas no processo eletroquímico (densidade de corrente de 15, 30 e 45 mA cm-2) foi observada a total degradação do fármaco e a total remoção da atividade antimicrobiana. Observou-se uma redução gradativa da atividade antimicrobiana com o aumento do tempo de reação e da densidade de corrente. Após 45 min de reação, a atividade antimicrobiana da solução reduziu 44,7, 75,8 e 83,6% quando aplicadas densidades de corrente de 15, 30 e 45 mA cm-2, respectivamente. A máxima redução da atividade antimicrobiana observada para o processo POAE foi de 92,7% em 60 min, quando empregada densidade de corrente de 45 mA cm-2 (Figura 7).
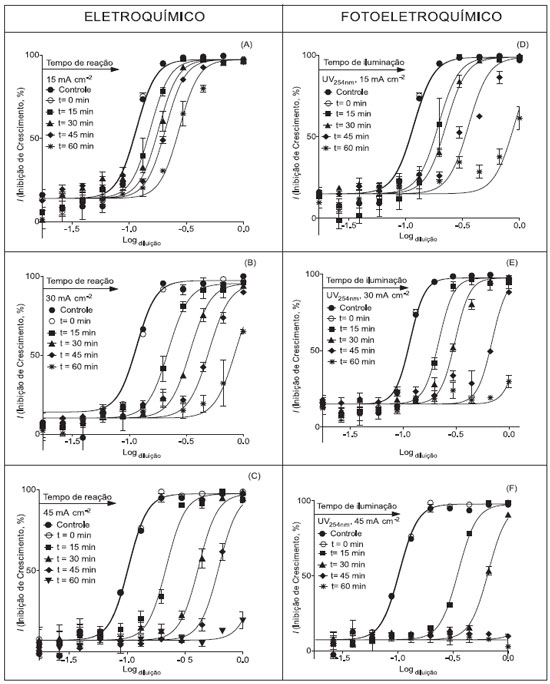 Figura 7. Atividade antimicrobiana das soluções de flumequina submetidas aos processos eletroquímico (A) 15 mA cm-2, (B) 30 mA cm-2 e (C) 45 mA cm-2, e foto-eletroquímico (D) 15 mA cm-2, (E) 30 mA cm-2 e (F) 45 mA cm-2
No processo fotoeletroquímico, diferentemente do ocorrido no processo eletroquímico, foi observada a total remoção da atividade antimicrobiana das soluções; no entanto, essa total remoção foi observada somente quando aplicada densidade de corrente de 45 mA cm-2 (Figura 7). Nessas condições, a atividade antimicrobiana foi reduzida em aproximadamente 95% e 100% após 45 e 60 min de ensaio, respectivamente. O produto de degradação identificado neste trabalho (m/z 244) provavelmente apresenta atividade antimicrobiana inferior à da flumequina. Quando a molécula de flumequina perde o flúor ligante no C-6, a afinidade com o DNA-girase diminui,23 ou seja, a atividade antimicrobiana do composto é reduzida. Poucos são os trabalhos relativos à avaliação quantitativa da atividade antimicrobiana de soluções de flumequina submetidas a processos oxidativos avançados, ou seja, que envolvem a geração dos radicais hidroxila.9,10 Os resultados de remoção da atividade antimicrobiana obtidos nesse trabalho corroboram com os trabalhos publicados por da Silva et al.8 e Rodrigues-Silva et al.,9,10 ou seja, foi verificada uma diminuição da atividade antimicrobiana com o aumento da eficiência de degradação. Da Silva e colaboradores constataram a total remoção da atividade antimicrobiana de soluções de flumequina (500 µg L-1) submetidas ao processo UV/H2O2 (CH2O2 inicial = 1 mmol L-1 e 45 min de ensaio).8 Rodrigues-Silva et al.10 não observaram atividade antimicrobiana residual em soluções de flumequina submetidas ao processo foto-Fenton (CH2O2-inicial = 10 mmol L-1, CFe(II)-inicial = 0,25 mmol L-1, Cflumequina-inicial = 500 µg L-1) após 15 min de ensaio. Rodrigues-Silva et al.9 também reportaram a remoção da atividade antimicrobiana de soluções de flumequina (500 µg L-1) submetidas ao processo fotocatálise com TiO2 em suspensão. Observaram que, após 15 min de ensaio, aumentando a concentração do catalisador (entre 0,16 e 0,94 mmol L-1), a atividade antimicrobiana da solução foi decaindo gradativamente. A total remoção da atividade antimicrobiana foi observada após 30 min de ensaio quando utilizado 0,31 mmol L-1 de TiO2.
CONCLUSÕES Os processos POAE e POAFE atingiram eficiências de degradação máximas similares de 83% e 85%, respectivamente, após 60 min de ensaio, quando empregada densidade de corrente de 45 mA cm-2 e 25 mmol L-1 de K2SO4 como eletrólito suporte. O aumento da densidade de corrente aplicada promoveu um aumento na degradação de flumequina. O processo POAFE foi mais eficaz do que o processo POAE para a remoção da atividade antimicrobiana. A máxima redução da atividade antimicrobiana foi observada em 60 min de ensaio quando aplicada a maior densidade de corrente avaliada nesse trabalho: 45 mA cm-2. A utilização de K2SO4 como eletrólito suporte dificultou a identificação dos produtos de degradação, devido à formação de adutos. O intermediário com m/z 244 foi identificado, o qual foi formado a partir da perda do flúor da molécula da flumequina.
AGRADECIMENTOS À CAPES pelas bolsas concedidas a C. Rodrigues-Silva e M.G. Maniero (PNPD0233080) e à Fapesp pelo apoio financeiro (2008/06470-0).
REFERÊNCIAS 1. Tamtam, F.; Mercier, F.; Le Bot, B.; Eurin, J.; Dinh, Q. T.; Clément, M.; Chevreuil, M.; Sci. Total Environ. 2008, 393, 84. 2. Dorival-García, N.; Zafra-Gómez, A.; Cantarero, S.; Navalón, A.; Vílchez, J. L.; Microchem. J. 2013, 106, 323. 3. Yiruhan; Wang, Q-J.; Mo, C-H.; Li, Y-W.; Gao, P.; Tai, Y-P.; Zhang, Y.; Ruan, Z-L.; Xu, J-W.; Environ. Pollut. 2010, 158, 2350. 4. La Farré, M.; Pérez, S.; Kantiani, L.; Barceló, D.; Trends Anal. Chem. 2008, 27, 991. 5. Reyes, C.; Fernández, J.; Freer, J.; Mondaca, M. A.; Zaror, C.; Malato, S.; Mansilla, H. D.; J. Photochem. Photobiol., A 2006, 184, 141. 6. Palominos, R.; Freer, J.; Mondaca, M. A.; Mansilla, H. D.; J. Photochem. Photobiol., A 2008, 193, 139. 7. Klamerth, N.; Rizzo, L.; Malato, S.; Maldonado, M. I.; Agüera, A.; Fernández-Alba, A. R.; Water Res. 2010, 44, 545. 8. Da Silva, C. R.; Maniero, M. G.; Rath, S.; Guimarães, J. R.; J. Adv. Oxid. Technol. 2011, 14, 106. 9. Rodrigues-Silva, C.; Maniero, M. G.; Rath, S.; Guimarães, J. R.; Chem. Eng. J. 2013, 224, 46. 10. Rodrigues-Silva, C.; Maniero, M. G.; Rath, S.; Guimarães, J. R.; Sci. Total Environ. 2013, 445-446, 337. 11. Legrini, O.; Oliveros, E.; Braun, A. M.; Chem. Rev. 1993, 93, 671. 12. Guinea, E.; Garrido, J. A.; Rodríguez, R. M.; Cabot, P.; Arias, C.; Centellas, F.; Brillas, E.; Electrochim. Acta 2010, 55, 2101. 13. Bertazzoli, R.; Pelegrini, R.; Quim. Nova 2002, 25, 447. 14. Jara, C. C.; Fino, D.; Specchia, V.; Saracco, G.; Spinelli P.; Appl. Catal., B 2007, 70, 479. 15. Dirany, A.; Sirés, I.; Oturan, N.; Oturan, M. A.; Chemosphere 2010, 81, 594. 16. Pinhedo, L.; Pelegrini, R.; Bertazzoli, R.; Motheo, A. J.; Appl. Catal., B 2005, 57, 75. 17. Fukunaga, M. T.; Guimarães, J. R.; Bertazzoli, R.; Chem. Eng. J. 2008, 136, 236. 18. Sirtori, C.; Zapata, A.; Malato, S.; Gernjak, W.; Fernández-Alba, A. R.; Agüera, A; Photochem. Photobiol. Sci. 2009, 8, 644. 19. Sirtori, C.; Zapata, A.; Gernjak, W.; Malato, A.; Agüera, A.; Chemosphere 2012, 88, 627. 20. Albini, A.; Monti, S.; Chem. Soc. Rev. 2003, 32, 238. 21. Klamerth, N.; Rizzo, L.; Malato, S., Maldonado, M. I.; Agüera, A.; Fernández-Alba, A. R.; Water Res. 2010, 44, 545. 22. Hoffmann, E.; Stroobant, V.; Mass Spectrometry Principles and Applications, 3th ed., Wiley: England, 2007. 23. Shen, L. L.; Mitscher, L. A.; Sharma, P. N.; O'Donnell, T. J.; Chu, D. W. T.; Cooper, C. S.; Rosen, T.; Pernet, A. G.; Biochemistry 1989, 28, 3886. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





