Artigo
|
|
| Influência de parâmetros de processo na obtenção de sílica a partir de cinza da casca de arroz pela ação de Fusarium oxysporum Influence of process parameters on obtention of silica from rice husk ash by action of Fusarium oxysporum |
|
Tatiana G. Pineda-VásquezI; Mabel T. Born e SilvaII; Carlos H. L. SoaresII; Dachamir HotzaI,*
IDepartamento de Engenharia Química e Engenharia de Alimentos, Universidade Federal de Santa Catarina, 88040-970 Florianópolis - SC, Brasil Recebido em 18/10/2013 *e-mail: dhotza@gmail.com In this work, an experimental design was used to analyze the influence of process parameters on the production of extracellular enzymes such as β-glucosidase and peroxidase, and their possible effect on the obtention of soluble and nanostructured silica from rice husk ash by the action of the fungus Fusarium oxysporum. Specifically, pH, fermentation time and glucose concentration in the culture medium were varied. Statistical analysis indicated that the silica synthesis in the aqueous medium was strongly dependent on pH and time. Although the glucose concentration does not exert a direct influence on the biosynthesis of silica, it is an important parameter in the production of extracellular enzymes. To prevent enzyme inhibition and provide higher dissolution of silica, it is recommended to work at a pH close to neutral with a glucose concentration of 3 g L-1 for at least 144 h. INTRODUÇÃO A cinza da casca de arroz (CCA) é um resíduo do beneficiamento industrial do arroz que contém entre 54 e 96% (em massa) de SiO2,1 o que a torna uma matéria-prima valorizada para a produção de sílica, sob diversas formas.2 A CCA, natural ou tratada química e/ou termicamente, tem aplicações como isolante térmico,3 pozolana em cimento e concreto,4-6 carga em polímeros,7-9 precursor para síntese de carbeto de silício,10 zeólita11 e cordierita,12 suporte de catalisadores,13,14 matéria-prima para cerâmica e vidro,15,16 adsorvente de metais pesados17 e gases tóxicos,18 entre outras. Para se aumentar o valor agregado da CCA, diversos processos químicos,15-19 térmicos,20-22 ou uma combinação de ambos23-25 têm sido relatados, de modo a aumentar a superfície específica das partículas de sílica e diminuir a quantidade de impurezas, que incluem elementos alcalinos e alcalino-terrosos. No entanto, esses tratamentos empregam combustíveis fósseis para gerar calor, além de ácidos ou bases como insumos em operações de lixiviação. Assim, há produção de novos resíduos sólidos, efluentes líquidos e emissões gasosas em grandes quantidades, além de consumo energético significativo. Tais aspectos limitam a aplicação em maior escala desses tratamentos, tanto do ponto de vista econômico quanto ambiental. Recentemente, cientistas começaram a estudar a biotransformação de micro e nanomateriais usando bactérias, fungos e algas, capazes de sintetizar substâncias como parte do seu metabolismo.26-29 A formação de sílica micro e nanoestrutura a partir da biodegradação da cinza da casca de arroz pela ação de fungos é uma alternativa promissora,30,31 já que parte de um resíduo, tem um baixo custo de insumos e pode ocorrer à temperatura ambiente. Os fungos filamentosos têm se destacado nesses processos de biotransformação por sua capacidade de degradação do material lignocelulósico, por meio de produção de enzimas extracelulares não específicas. Basicamente, as enzimas responsáveis pela degradação da cinza da casca de arroz são as enzimas oxidativas (oxidoredutases) e hidrolíticas (hidrolases).27 Neste trabalho foi usado um planejamento experimental para analisar a influência de parâmetros de processo na produção extracelular de enzimas como a β-glicosidase e peroxidase e seus possíveis envolvimentos na produção de sílica solúvel e nanoestruturada para a síntese da sílica com o uso do fungo Fusarium oxysporum. Particularmente, foram analisados pH, tempo de fermentação e concentração de glicose no meio de cultura.
PARTE EXPERIMENTAL A cinza da casca de arroz foi fornecida pela Indústria e Comércio de Arroz Fumacense (Morro da Fumaça, SC, Brasil) com diâmetro médio de ~600 µm. A CCA não sofreu nenhum processamento prévio antes de ser submetida ao processo de biotransformação. Foram utilizados Azul de Comasie Brilliant Blue G-250 e p-nitrofenil-β-D-glicopiranosídeo (PNPG) para a dosagem da concentração de proteínas totais e atividade enzimática, respectivamente, ambos da Sigma-Aldrich; o-dianisidina e peróxido de hidrogênio da Merck; ácido fosfórico (H3PO4), ácido clorídrico (HCl), hidróxido de sódio (NaOH) da Vetec; extrato de malte e glicose anidra da Hymedia. O microrganismo empregado foi o Fusarium oxysporum, fornecido pelo Centro de Estudios e Investigaciones en Biotecnologia (CIBIOT) da Universidad Pontificia Bolivariana (UPB), Medellin, Colômbia. O fungo foi mantido em meio de cultura sólido com extrato de malte e glicose em placas com incubação a 25 ± 1 ºC.30 O meio de cultura foi preparado em frascos erlenmeyer, contendo 15 g L-1 de extrato de malte, 20 g L-1 de cinza da casca de arroz. O pH foi ajustado empregando-se NaOH 0,1 mol L-1 e/ou HCl 0,1 mol L-1. Diferentes concentrações de glicose foram testadas (3, 9,5 e 16 g L-1). Posteriormente, os frascos foram esterilizados em autoclave a 120 ºC, durante 20 min.31 Cada frasco foi inoculado com ~0,5 g (base úmida) de F. oxysporum, em câmara estéril e mantido sob agitação a 200 rpm e a 28 ºC, durante os diferentes tempos estabelecidos no planejamento experimental (48, 144 e 240 h). Foi realizado um planejamento fatorial 23 ampliado (planejamento composto central), fizeram-se testes aleatoriamente para garantir a validade estadística dos resultados, realizando oito pontos do cubo, seis repetições nos pontos centrais do cubo e seis axiais (α = 1), conforme Tabela 1. Os fatores estudados foram: pH, tempo de contato entre o fungo e a cinza da casca de arroz (t) e concentração de glicose (GC) Quando o ponto central é adicionado, estima-se o efeito das interações e a curvatura da superfície de resposta.32
Os dados foram analisados estatisticamente usando o programa Statistica 6.0® e as superfícies e modelos encontrados foram feitos utilizando-se o mesmo programa, usou-se análise de variância ANOVA para indicar que fatores eram significativos ao nível de 5% e determinou-se o modelo empírico adequado para descrever o comportamento de cada variável de resposta em função dos fatores estudados. Para este estudo somente aqueles valores dos coeficientes que foram significativos ao nível de 5%, (p<0,05) foram apresentados. Na Tabela 2 encontram-se os fatores e os níveis selecionados nesta pesquisa, os valores dos níveis foram selecionados baseados em pesquisas anteriores.30 As variáveis de resposta analisadas foram a produção de proteína total (PT), atividades enzimáticas de peroxidases (POD) e β-glicosidases, solubilização da sílica (SiO2) e o diâmetro médio das partículas da CCA (DCCA).
A concentração de proteína total foi dosada usando o método de Bradford.33 A enzima β-glicosidase foi avaliada segundo o método de Tan e colaboradores.34 A determinação da atividade da peroxidase foi feita a partir do método de Vinterhalter & James, baseado na oxidação da O-dianisidina e monitorada a 460 nm.34 A quantificação da sílica solúvel foi feita pelo método colorimétrico em espectrofotômetro UV-Visível (Pró-Análise V-1200) em comprimento de onda de 660 nm. A distribuição de tamanho de partícula em suspensões aquosas foi determinada por meio de difração a laser (Mastersizer 2000, Malvern). Finalmente, foi realizada a análise por microscopia eletrônica de varredura (JEOL JSM-6390LV). A análise química da CCA, antes e após o bioprocesso, foi realizada por espectrometria de fluorescência de raios X e espectrometria de absorção atômica no Laboratório de Desenvolvimento e Caracterização de Materiais (LDCM), em Criciúma.
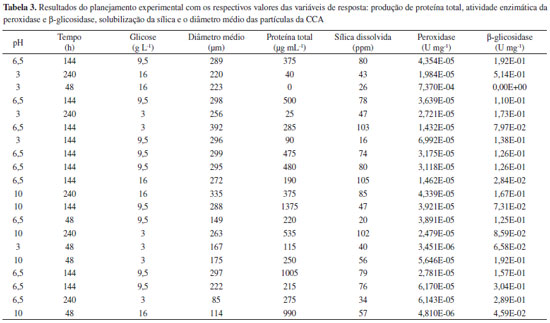
RESULTADOS E DISCUSSÃO A partir do planejamento fatorial foram determinados quais fatores têm efeitos relevantes na resposta e também a avaliação das interações entre eles. Na Tabela 3 são apresentados os resultados obtidos do planejamento experimental. Os fatores estudados neste processo foram selecionados com base no fato bem conhecido de que processos enzimáticos empregados na síntese de materiais metálicos e de diferentes óxidos exigem condições especificas de pH, concentração de nutrientes/substratos, tempo de contato, temperatura, entre outros. Adicionalmente, experimentos preliminares demonstraram que tais fatores influenciam o processo em estudo.30 Essas condições estão diretamente relacionadas não somente à solubilização da sílica no meio aquoso, como também à produção de enzimas extracelulares responsáveis pela hidrólise e redução de diferentes compostos.
A análise de variância ao nível de 5% indicou que estatisticamente o pH da solução foi o fator que mais influenciou na produção de proteínas extracelulares, tanto na resposta linear (p = 0,001) quanto quadrática (p = 0,008), A Equação 1 representa o modelo empírico obtido pela análise do planejamento experimental, sendo os coeficientes em negrito estatisticamente significativos ao nível de 95% de confiança (R2 = 0,747 e ajuste = 0,518). Alguns trabalhos publicados demonstraram que a produção de proteínas extracelulares pode acompanhar a produção de biomassa em fungos filamentosos em função do tempo.35 Nas condições do bioprocesso, para valores maiores de pH, na presença de 20 g L-1 de CCA, o F. oxysporum produz maiores concentrações de proteína, como apresentado na Figura 1. Por outro lado, o tempo de contato e a concentração de glicose, para as condições estudadas, não apresentaram significância estatística ao nível de 5% (p>0,05). Embora as interações tenham sido pouco consideráveis, essas não podem ser descartadas. Estudos anteriores indicam que a síntese de nanopartículas de sílica ocorre mediante processos enzimáticos, e esses dependem do tempo e das condições do meio.27,31
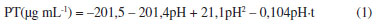
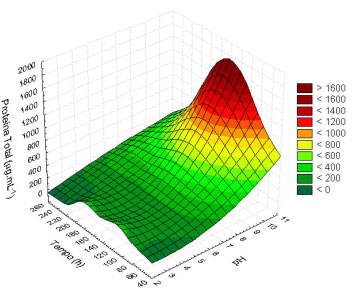 Figura 1. Modelo de superfície de resposta para produção de proteína total
As peroxidases (POD) constituem um grupo de enzimas oxi-redutases que catalisam a redução do peróxido de hidrogênio e a concomitante oxidação de uma variedade de substratos orgânicos e inorgânicos.36,37 A atividade destas enzimas produzidas por microrganismos, em especial fungos, tem sido relacionada com uma grande variedade de processos de interesse biotenológico tais como degradação de poluentes e polímeros vegetais como lignina, entre outros.37 Para a faixa testada, estatisticamente os fatores mencionados não tiveram efeito significativo na produção de POD, embora a análise estatística tenha indicado que existe uma forte interação entre os fatores ao nível de 5%, (p<0,05). Foi observado, conforme a Figura 2, que a produção desta enzima é considerável nas primeiras 90 h da fermentação, no intervalo de pH de 3,0-4,0. A Equação 2 representa o modelo empírico obtido pela análise do planejamento experimental (R2 = 0,752 e ajuste = 0,529). Os parâmetros apresentados são estatisticamente significativos ao nível de 95% de confiança.
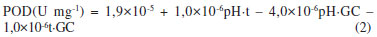
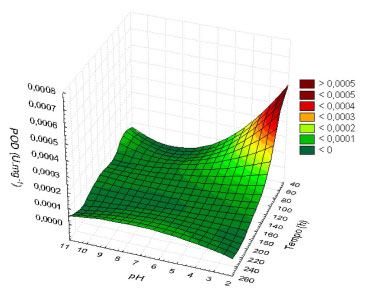 Figura 2. Modelo de superfície de resposta para produção de peroxidase
A análise de variância ao nível de 5% indicou que estatisticamente o tempo de contato entre o fungo e a CCA, em solução, foi o fator que mais influenciou a produção de β-glicosidase (p = 0,015), considerando-se o efeito linear. A Equação 3 representa o modelo empírico da produção da β-glicosidase, sendo o coeficiente em negrito estatisticamente significativo ao nível de 95% de confiança, (R2 = 0,673 e ajuste = 0,38).
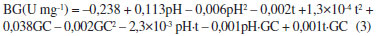
A produção deste tipo de enzima foi maior para concentrações de glicose entre 3 e 9,5 g L-1 para pH 6,5. No entanto, para tempos de reação maiores, quando os nutrientes tornam-se escassos, a produção dessa enzima também foi estimulada. Provavelmente, F. oxysporum secreta este grupo de enzimas para catalisar reações de hidrolise nas quais os carboidratos de mais alta massa molecular presentes no meio de cultura são transformados em glicose, para fornecer energia e manter o metabolismo micelial.38 As β-glicosidases são enzimas envolvidas no metabolismo primário do fungo, tornando-se assim importante monitorar a sua produção ao longo do tempo, visando avaliar o comportamento metabólico do mesmo. Por outro lado, a secreção da β-glicosidase foi altamente dependente do meio de cultivo e do pH.36,39 Para valores de pH ácidos e próximos ao neutro a atividade enzimática exibiu valores elevados para o caso dessa enzima, conforme mostra a Figura 3.
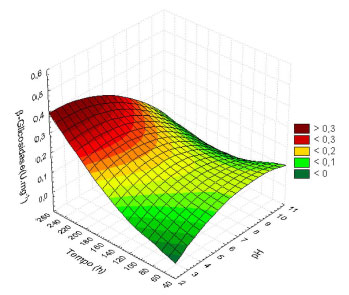 Figura 3. Modelo de superfície de resposta para a produção de β-glicosidase
A análise estatística indicou que as variáveis selecionadas, pH, tempo de duração da fermentação e a concentração de glicose tiveram efeito significativo ao nível de 5% (p<0,05) na disponibilização de sílica no meio aquoso. Não obstante, existem limites para os valores do pH, pois a produção de enzimas extracelulares responsáveis pela biotransformação da sílica pode ser inibida. Estudos com diatomáceas estabelecem que a solubilização da sílica através de enzimas denominadas silafinas, por processos de hidrólises e condensação a pH próximos ao neutro, permitem a obtenção de partículas de sílica mais estáveis em meio aquoso.40 O modelo de superfície de resposta é apresentado na Figura 4 e indica que a maior concentração de sílica dissolvida pode ser obtida a pH superior ao neutro, e com tempos de contato entre o fungo e a CCA na faixa de 80-200 h, apresentando um máximo de 125 ppm a pH 11,0; t = 233 h e GC = 3 g L-1, embora a maior concentração sugerida pelo modelo matemático seja no pH 11,6. Valores próximos ao neutro apresentaram concentrações de sílica solúvel consideráveis e diminuiram a contaminação da CCA com íons de Na presentes no hidróxido usado para ajustar o pH. Com relação ao tempo do bioprocesso, provavelmente a solubilização e biotransformação da sílica ocorreram como resultado de processos metabólicos denominados de metabolismo secundário, os quais são operantes quando se tem algum tipo de estresse, por exemplo, aquele provocado por alterações de pH. Por outro lado, os resultados parecem indicar que o estresse pela deficiência de glicose não é um fator condicionante para a dissolução da sílica. Estudos relacionados com a dissolução da sílica usando Fusarium oxysporum indicam que o processo ocorre através de processos enzimáticos.27,30,31 Apesar de a peroxidase e a β-glicosidase estarem envolvidas no processo, o planejamento experimental sugere que estas enzimas não são diretamente responsáveis pela dissolução da sílica. Particularmente no caso da peroxidase, os valores de pH e tempo para os quais foi observada a maior dissolução da sílica não coincidem com as faixas de pH e tempo correspondentes à máxima atividade da peroxidase (pH entre 3,0 e 4,0, tempo de 90 h).
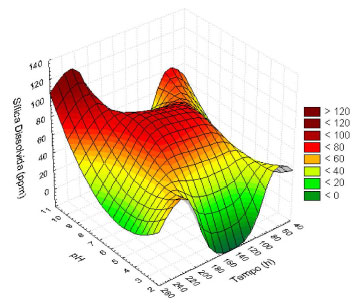 Figura 4. Modelo de superfície de resposta para a dissolução da sílica
O modelo estatístico de segunda ordem na Equação 4 foi o que apresentou menor erro (R2 = 0,751 e ajuste = 0,527) para a descrição da solubilização da sílica em função dos fatores selecionados e dos níveis tratados. Na Equação 4, são apresentados os parâmetros estatisticamente significativos ao nível de 95% de confiança (p< 0,05).
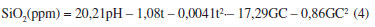
A estrutura típica da CCA foi lamelar e porosa (Figura 5A), quando submetida ao bioprocesso (pH = 6,5; t = 240 h, GC = 3 g L-1). Observou-se uma diminuição de tamanho considerável (~600 para ~80 µm), no mesmo aumento (500×, Figura 5B). Por outro lado, as partículas de sílica solubilizadas apresentaram tamanhos menores que 5 µm (Figura 5C).
 Figura 5. Micrografias da cinza da casca de arroz: (A) antes e (B) depois do tratamento com Fusarium oxysporum a 28 ºC (pH = 6,5, t = 240 h, GC = 3 g L-1); (C) sílica solubilizada
A análise de variância (ANOVA) ao nível de 5% indicou que o tempo de fermentação apresentou significância estatística, tanto no efeito linear (p = 0,021) quanto no quadrático (p = 0,007), no diâmetro médio das partículas da CCA. Tempos de permanência maiores e pH próximo ao neutro (pH: 7,0) promoveram a diminuição do tamanho de partícula da CCA (Figura 6), que foi acompanhado pela solubilização da sílica.
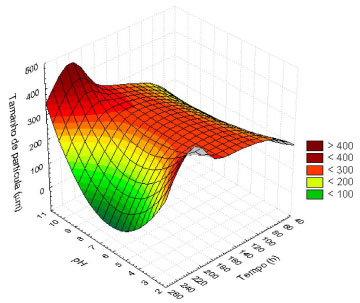 Figura 6. Modelo de superfície de resposta para o tamanho de partícula da CCA
A análise química por FRX foi realizada para amostras submetidas a diferentes níveis de pH, a uma concentração fixa de glicose (3 g L-1), para um tempo de bioprocesso de 240 h. Na Tabela 4 são apresentados os valores dos diferentes elementos presentes na CCA, antes e após solubilização e biotransformação por F. oxysporum, na forma de óxidos.
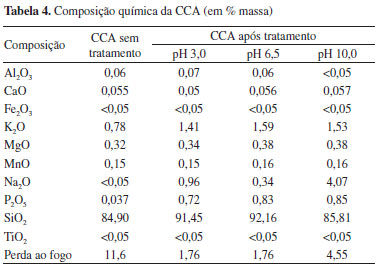
Estes resultados indicam que a concentração da sílica na CCA antes do bioprocesso é de ~85% e aumenta para ~92% nos processos com pH próximo ao neutro e pH 3,0. Nos processos convencionais,41 valores de pH >10 são usados para a solubilização da sílica na presença do F. oxysporum. Nesse caso, a concentração máxima de SiO2 obtida foi de ~86%. Possivelmente, a alcalinidade inibiu a atividade de algumas enzimas e o metabolismo do fungo responsável pelo processo de hidrólise e condensação da SiO2, dando como resultado uma baixa concentração deste óxido.
CONCLUSÕES A análise estatística indicou que a síntese da sílica em meio aquoso é fortemente dependente do pH e do tempo. Embora a concentração de glicose não exerça influência direta na biotransformação da sílica, é um parâmetro importante na produção de enzimas extracelulares, de um modo geral. O modelo estatístico de segunda ordem foi o que apresentou menor erro e melhor ajuste para a descrição da solubilização da sílica. Para impedir a inibição enzimática e garantir maior dissolução de sílica com tamanhos nano e micrométricos, é recomendável trabalhar a pH próximos ao neutro, concentração de glicose baixa 3 g L-1 e por um período de tempo maior que 144 h.
AGRADECIMENTOS O presente trabalho foi realizado com o apoio do Conselho Nacional de Desenvolvimento Científico e Tecnológico/Brasil (CNPq) e do Centro de Estudios e Investigaciones en Biotecnologia (CIBIOT) da Universidad Pontificia Bolivariana (UPB), Medellin, Colômbia.
REFERÊNCIAS 1. Fuad, M.Y.A.; Ismail, Z.; Ishak, Z.A.M.; Omar, A.K.M.; Plastics Additives; Pritchard, G., ed.; Springer: New York, 1998. 2. Foletto, E. L.; Hoffmann, R.; Hoffmann, R. S.; Portugal Jr., U. L.; Jahn, S. L.; Quim. Nova. 2005, 28, 1055. 3. Gonçalves, M.R.F.; Bergmann, C.P.; Constr. Build. Mater. 2007, 21, 2059. 4. Anwar, M.; Miyagawa, T.;Gaweesh, M.; Waste Manage. Res. 2000, 1, 671. 5. Safiuddin, M.;West, J.S.;Soudki, K.A.; Cem. Concr. Compos. 2010, 32, 708. 6. Khan, R.; Jabbar, A.; Ahmad, I.; Khan, W.; Khan, A.N.; Mirza, J.; Constr. Build. Mater. 2012, 30, 360. 7. Fuad, M.Y.A.; Yaakob, I.; Ishak, Z.A.M.; Omar, A.K.M.; Polym. Test. 1993, 12, 107. 8. Ismail, H.; Nasaruddin, M.N.; Ishiaku,U.S.; Polym. Test. 1999, 18, 287. 9. Ayswarya, E.P.; Francis, K.F.V.; Renju, V.S.; Thachil, E.T.; Mater. Des. 2012, 41, 1. 10. Krishnarao, R.V.; Godkhindi, M.M.; Ceram. Int. 1992, 18, 35. 11. Wang, H.P.; Lin, K.S.; Huang, Y.J.; Li, M.C.; Tsaur, L.K.; J. Hazard. Mater. 1998, 58, 147. 12. Naskar, M.K.; Chatterjee, M.; J. Eur. Ceram. Soc. 2004, 24, 3499. 13. Chang, F.W.; Kuo, W.Y.; Lee, K.C.; Appl. Catal., A 2003, 246, 253. 14. Adam, F.; Ahmed, A.E.; Chem. Eng. J. 2008, 145, 328. 15. Sutas, J.; Mana, A.; Pitak, L.; Procedia Eng. 2012, 32, 1061. 16. Kaewkhao, J.; Limsuwan, P.; Procedia Eng. 2012, 32, 670. 17. Lakshmi, U.R.; Srivastava, V.C.; Mall, I.D.; Lataye, D.H.; J. Environ. Manage. 2009, 90, 710. 18. Dahlan, I.; Lee, K.T.; Kamaruddin, A.H.; Mohamed, A.R.; J. Hazard. Mater. 2009, 166, 1556. 19. Liou, T.H.; Yang, C.C.; Mater. Sci. Eng. B. 2011, 176, 521. 20. Ibrahim, D.M.; El-Hemally, S.A.; Abo-El-Enein, S.A.; Hanafi, S.; Helmy, M.; Thermochim. Acta 1980, 37, 347. 21. Della, V.P.; Kühn, I.; Hotza, D.; Mater. Lett. 2002, 57, 818. 22. Martínez, J. D.; Pineda, Tatiana G.; Junkes, J. A.; Hotza, D.; Quim. Nova. 2009, 32, 1110. 23. Della, V. P.; Hotza, D.; Junkes, J. A.; Oliveira, A. P. N.; Quim. Nova. 2006, 29, 1175. 24. Liu, Y.; Guo, Y.; Zhu, Y.; An, D.; Gao, W.; Wang, Z.; Ma, Y.; Wang, Z.; J. Hazard. Mater. 2011, 186, 1314. 25. Liou, T.H.; Yang, C.C.; Mater. Sci. Eng. B. 2011, 176, 521. 26. Kamida, H. M.; Durrant, R.T.; Monteiro, R.; Armas E.D.; Quim. Nova 2005, 28, 629. 27. Bansal, V.; Ahmad, A.; Sastry, M.; J. Am. Chem. Soc. 2006, 128, 14059. 28. Bansal, V.; Asad, S.; Bhargava, S.; Ahmad, A.; Sastry, M.; Langmuir 2007, 23, 4993. 29. Bansal, V.; Bharde, A; Ramanathan, R; Bhargava, S.; Adv. Colloid Interface Sci. 2012, 179-182, 150. 30. Pineda, T.; Hotza, D.; Soares, C.H.L; Casas, A.; Ramírez, M.; Matéria 2012, 17, 946. 31. Pineda, T.; Soares, C.H.L.; Hotza, D.; Casas, A.E.; Ramírez, M.E.; Torres, M.M.; Mater. Sci. Forum 2012, 727-728, 1153. 32. Montgomery, D. C.; Design and Analysis of Experiments. 4th ed., Wiley: New York, 1996. 33. Bradford, M.M.; Anal. Biochem. 1976, 72, 248. 34. Esposito, L.; Innocentini-Meia, L.H.; Ferraz, A; Canhosc, V P; Durán, N.; J. Biotechnol. 1993, 29, 219. 35. Djajakirana, G.; Joergensen, R.G.; Meyer, B.; Biol. Fertil. Soils 1996, 22, 299. 36. Ikehata, K.; Buchanan, I.D.; Smith, D.W.; J. Environ. Eng. Sci. 2004, 3, 1. 37. Aguiar, M.M.; Tese de Doutorado, Universidade de São Paulo, Piracicaba, Brasil, 2008. 38. Philippoussis, A.; Zervakis, G.; Diamantopoulou, P. World J. Microbiol. Biotechnol. 2001, 17, 191. 39. Sternberg, D.; Appl. Environ. Microbiol. 1976, 31, 648. 40. Cheryl, W.; Huang, J.; Kaplan, D.; Trends Biotechnol. 2004, 22, 11. 41. Kalapathy, U.; Proctor, A.; Shultz, J.; Bioresour. Technol. 2000, 73, 257. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access