Artigo
|
|
| Caracterização físico-química do óleo essencial da Siparuna guianensis Aublet Physical and chemical characterization of essential oil of Siparuna guianensis Aublet |
|
Augustus Caeser Franke PortellaI,*; Marilda MunaroII; Sergio Donizete AscêncioIII; Chrystian de Assis SiqueiraI; Talita Pereira de Souza FerreiraI; Raimundo Wagner de Souza AguiarI
IDepartamento de Ciências Exatas e Tecnológicas, Universidade Federal do Tocantins, 77404-970 Gurupi - TO, Brasil Recebido em 18/12/2013 *e-mail: portella@uft.edu.br Thermal and spectroscopic analyses of essential oil extracted from Siparuna guianensis Aublet, an aromatic plant belonging to medicinal ethnobotany family Siparunaceae, were carried out. The plant is known throughout the North and Northeast of Brazil by the name negramina and has wide application as a natural insect repellent. Thermogravimetric analyses were correlated with the Arrhenius Equation to provide kinetic parameters of evaporation, including activation energy and frequency factor. Differential scanning calorimetric analysis showed the presence of an exothermic oxidation peak, probably as a result of transformations and decomposition of the solid structure before melting. INTRODUÇÃO Siparuna guianenis Aublet pertencente à família Siparunaceae é uma espécie neotrópica utilizada para indicações etnobotânicas e para conservação de biomas. No Brasil, localiza-se, principalmente, no Cerrado, onde estas plantas são nativas e abundantes. No entanto, as suas reservas encontram-se ameaçadas por não estarem legalmente protegidas.1 É possível que, num futuro próximo, esta e outras espécies não possam ser encontradas e tampouco estudadas, especialmente por suas características popularmente tidas como terapêuticas. Óleos essenciais de folhas frescas e secas de S. guianensis são extraídos para diversos fins, sendo que sua composição pode mudar conforme a região e as estações do ano.1 De uma forma geral, os óleos essenciais são comercialmente importantes devido à presença de terpenóides, alcalóides e compostos fenólicos em grandes quantidades e aos seus usos em indústrias de condimentos, perfumes, drogas e outros. Conforme Croteau (2002)2 e seus colaboradores, existem em torno de 55 mil terpenóides já isolados fazendo parte tanto do metabolismo primário quanto do secundário deste gênero de planta com, aproximadamente, 12 mil alcalóides e 8 mil compostos fenólicos já reconhecidos.2 A principal reação de decomposição dos extratos vegetais está relacionada com a oxidação dos seus compostos quando os mesmos são processados inadequadamente. Em geral, a presença de luz, oxigênio, calor e umidade dificultam a conservação dos óleos essenciais, sendo que, para manter sua qualidade, um armazenamento apropriado é de fundamental importância.3 Altas temperaturas promovem a oxidação dos óleos, o que, consequentemente, seguem para uma oxi-polimerização e uma decomposição termo-oxidativa.4 A estabilidade destes óleos torna-se um fator importante a ser considerado, pois suas propriedades são utilizadas para a produção de alimentos, aromatizantes, dentre outras. A oxidação é uma reação exotérmica que pode ser medida por análise térmica.5 Os métodos termoanalíticos são empregados para o controle da qualidade dos óleos vegetais, os quais podem fornecer informações relevantes a respeito de sua estabilidade quando em aquecimento.6 Assim, Dyszel (1990, 1993),7 utilizando uma das técnicas térmicas, caracterizou os óleos extraídos de nozes, macadâmia e de amendoins quanto a sua oxidação. Kasprzycka-Guttman (1991),7 utilizaram temperaturas de 70 a 140 ºC para identificar calores específicos de alguns óleos comestíveis e óleos terapêuticos para determinar a sua estabilidade oxidativa. Kaisersberger (1989)7 analisou com a calorimetria diferencial de varredura, DSC, os processos de fusão, cristalização e oxidação de óleos. Kovalski (1991)5 e Litwnienko e Kasprzycka-Guttman (1991)7, verificaram que a insaturação dos óleos provoca a redução na estabilidade oxidativa dos mesmos, ocasionando a decomposição térmica e inviabilizando sua utilização.7 As técnicas de análises térmicas também foram utilizadas para identificar qualitativamente e quantitativamente os processos de decomposição térmica, as taxas de vaporização, curvas de pressão de vapor, entalpia de vaporização da transição líquido-gás, a energia de ativação das reações de decomposição, dentre outros parâmetros físicos e químicos de diferentes preparações analgésicas a partir de óleos essenciais.8 Cinética de eventos termoquímicos do óleo essencial da S. guianensis As técnicas termogravimétrica, TG, e de DSC, vêm sendo realizadas sob controle sistemático de alguns parâmetros, tais como: a taxa de aquecimento, a atmosfera, o ganho ou a perda de massa, a temperatura e o fluxo de calor, sendo exo ou endotérmico. Estes controles foram estabelecidos para a identificação e a investigação de processos, se existentes, como a isomerização, oxidação, desidrogenação, vaporização, polimerização e degradação térmica, conforme as características dos picos, a faixa de temperatura e a ocorrência ou ausência da perda de massa pela amostra.8 A cinética de um evento térmico de natureza química com a ocorrência de liberação de um produto gasoso pode ser modelada pela lei das velocidades, representada pela Equação 1.9
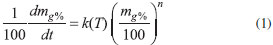
onde: mg%, é a massa percentual do vapor produzido pelo óleo essencial; n, é a ordem da reação; e, k(T), a constante de velocidade da reação, cuja dependência com a temperatura T é dada pela Equação de Arrhenius, representada na Equação 2.9

Esta equação é válida para uma faixa limitada de temperatura dentro da qual a reação ocorre, sendo: A, uma constante chamada fator pré-exponencial; Ea, a energia de ativação da reação; T, a temperatura termodinâmica; e, R = 8,31447 × 10-3 kJ/(mol K), a constante do gás. A lei de velocidade (Equação 1) está escrita em termos da massa do vapor produzido pelo óleo essencial, no entanto, neste caso, a massa mg% monitorada pela TG deve ser a da amostra. A lei de velocidade pode ser reescrita em termos da massa da amostra, m%, conforme apresentado pela Equação 3.
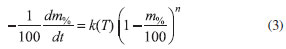
Assim, considerando-se, consecutivamente a Equação de Arrhenius (Equação 2), tem-se a Equação 4.
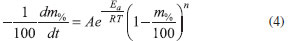
Para as reações com cinética de ordem zero, por exemplo, a Equação 4, pode ser reescrita como apresentado na Equação 5.
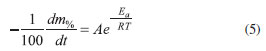
O logaritmo neperiano dessa expressão está formulado na Equação 6.
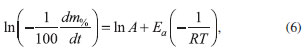
Esta, define o gráfico de Arrhenius, cujas variáveis Assim, este trabalho foi conduzido no sentido de investigar as propriedades térmicas do óleo essencial da S. guianensis usando TG/DSC. Os dados foram obtidos para calcular a Ea e o fator que modelam a cinética do evento térmico a partir da equação de Arrhenius. Também, no intuito de obter informações a respeito da estrutura química do óleo essencial trabalhado, a amostra foi adicionalmente analisada por meio da espectroscopia no infravermelho com transformada de Fourier (FTIR) acoplado ao equipamento.
PARTE EXPERIMENTAL A obtenção e a análise físico-química do óleo essencial da S. guianensis Aublet foram efetuadas por diversas técnicas analíticas e estão apresentadas na sequência. Extração do óleo A coleta das folhas e galhos foi realizada em um fragmento de Cerrado no município de Formoso do Araguaia, no norte do Brasil, latitude: 11º47'48" S e longitude: 49º31'44" W, nos meses de fevereiro e março, ou seja, de alta intensidade de chuvas. Exsicatas do material botânico foram depositadas na Universidade Federal do Tocantins (registro 10.298). As amostras foram analisadas por microscopia eletrônica de varredura, SEM, em equipamento VEGA/TESCAN, após metalização com ouro por deposição em equipamento de vaporização catódica. Depois, foram moídas, pesadas em balança analítica (25,0 ± 5,0) g e secas em um ambiente climatizado a uma temperatura de 24 ºC, durante 5 dias. Subsequentemente, o material foi colocado em um balão volumétrico com 500 mL de água destilada, para a extração do óleo essencial pelo método de destilação a vapor em aparelho Tipo Clevenger. O rendimento resultante foi expresso com base na massa do material seco.10 Todas as experiências foram realizadas em triplicata e os desvios-padrão médios foram calculados. Análise química do óleo essencial por cromatografia gasosa acoplada à espectrometria de massas, GC/MS e GC/FID Foi executada em um equipamento marca Varian, modelo 3900, com uma programação de temperatura do forno de 60 a 220 ºC, taxa de aquecimento de 4 ºC min -1 e de 220 a 260 ºC, com razão de aquecimento de 1 ºC min -1. A análise quantitativa dos compostos foi realizada em um cromatógrafo gasoso, CG 2010, com detector de ionização de chama (GC/FID), contendo coluna cromatográfica RTX-5MS-Reslek (30 m × 0,25 mm × 0,25 µm), gás de arraste hélio, pressão da coluna a 59 kPa, temperaturas do injetor de 240 ºC, do forno, de 50 ºC a 290 ºC, a uma taxa de aquecimento de 4 ºC/min, e do detector de 260 ºC. A injeção foi efetuada no modo split 1:10. A identificação dos compostos foi baseada na comparação dos índices de retenção na mesma coluna (pelo método de Van Den Dool, para padrões de n-alcanos C7 a C30)11 e respectivo espectro de massa. Os resultados foram investigados complementarmente em estudos de casos citados na literatura.1,11 TG/DSC com FTIR acoplado As curvas do óleo essencial foram obtidas a partir do processo de análise térmica TG/DSC, com cerca de (20,00 ± 0,10) mg de amostra, em equipamento marca Netzsch, modelo STA 449 Jupiter F3, entre 25 e 400 ºC, com taxa de aquecimento de 10 ºC/min, em atmosfera de N2 (fluxo de 50 ml/minuto) e de O2, e em cadinho de alumina, aberto. Os gases volatilizados foram analisados qualitativamente em espectrômetro FTIR acoplado no equipamento, de marca Bruker Tensor 27, resolução de 4 cm-1, em célula de gás com 36 varreduras por medida, a cada 30 s e seus espectros registrados no intervalo de 600 a 3.800 cm-1.
RESULTADOS E DISCUSSÃO Análise micrográfica da folha da S. guianensis Seções transversais e paradérmicas da região mediana de folhas adultas de S. guianensis mostraram a presença de epiderme unisseriada, coberta por uma fina camada de cutícula com tricomas glandulares do tipo capitado (C) e peltado (D) em ambas as faces, e de tricomas não glandulares (E) (tectores), unisseriados, multicelulares, não ramificados, predominantes na epiderme abaxial (Figura 1a), e os seus ductos secretores, os quais são formados pelas cavidades alongadas resultantes da junção de várias células secretoras, epitaliais, sendo revestidos de células adjacentes (Figura 1b).12
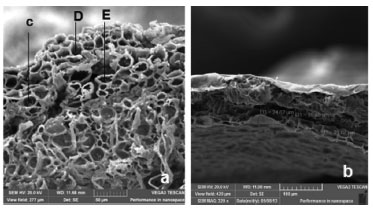 Figura 1. Imagens micrográficas, por SEM, correspondentes a: a) células secretoras das folhas da S. guianensis localizadas no mesófilo (500x); e b) sob ampliação de 329x, um dos ductos secretores com suas dimensões aproximadas
Na micrografia da Figura 2, está apresentado, em destaque, uma imagem de um dos tricomas glandulares da folha, que são pelos epidérmicos modificados e que consistem de uma região basal, um pedúnculo e uma cabeça. A sua importância está na possibilidade da produção de óleo essencial e na síntese dos monoterpenos, terpenos, gomas e taninos, principalmente, durante a florada de algumas espécies de plantas.12
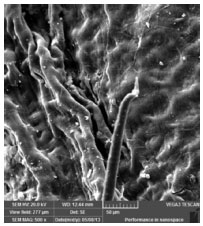 Figura 2. Micrografia, por SEM, com ampliação de 500x, na qual está destacada a presença de um dos tricomas glandulares da folha de S. guianensis
Extração do óleo essencial O tempo para a extração do óleo essencial das folhas de S. guianensis pelo processo de hidrodestilação está mostrado na Figura 3, em função de seu rendimento percentual. O valor máximo encontrado foi de (1,75 ± 0,10)%, a partir de 90 minutos, corroborando com os resultados da literatura.1
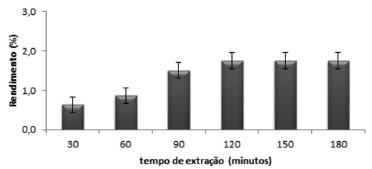 Figura 3. Histograma do rendimento do óleo essencial da S. guianensis pelo tempo de extração, em processo de hidrodestilação
Caracterização química por GC/MS e GC/FID Na Tabela 1, estão listados os componentes químicos gerais, em porcentagem em massa, obtidos pela análise cromatográfica GC/MS do óleo essencial da folha da S. guianensis. Destacaram-se os sesquiterpenos oxigenados com 75,07% (em massa) e, destes, o β-mirceno, com 67,30%, seguidos pelos monoterpenos oxigenados em 8,37%, em massa, representado, basicamente, pelo 2-undecadona. O restante, em percentual em massa (15,83%), não foi identificado quanto à sua constituição química.
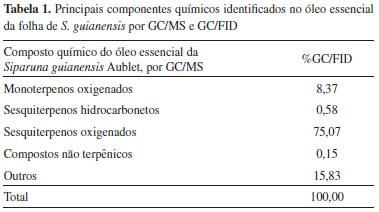
A composição química final, principalmente, com relação aos sesquiterpenos e dos compostos não terpênicos, está de acordo com o encontrado na literatura, para o mesmo material, porém, para locais de colheita diferentes, mas mesma época do ano.1 A variação da composição resultante é função da fenologia da espécie e das variações meteorológicas.1 TG/DSC A curva TG do óleo essencial S. guianensis (Figura 4), em atmosfera de N2, mostrou decomposição gradativa acentuada entre 100 ºC e 225 ºC com uma perda de massa equivalente a 54,21% do total da amostra. A partir desta temperatura, a perda de massa foi de 6,97%, até próximo de 400 ºC.
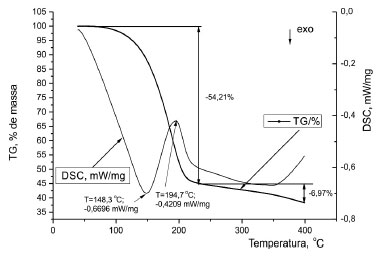 Figura 4. Curvas TG/DSC da amostra de óleo essencial da S. guianensis
A curva de DSC do óleo essencial mostrou evento exotérmico a 148,3 ºC, possivelmente, pela oxidação parcial da amostra, pela dificuldade de se extrair todo o O2 presente no sistema, seguido de um pico endotérmico, com ápice de pico a 194,7 ºC, atribuído à sua volatilização ou decomposição. Em atmosfera de O2 o resultado obtido indicou, apenas, a oxidação completa do óleo com evento exotérmico. Cálculo da energia de ativação A partir dos dados obtidos da TG foi realizado um ajuste (fitting) polinomial por regressão linear com um polinômio de grau 8, dado por: m%8(T) = 1,82×104 + 1,02×103T + 2,46×101T2 + 3,37×10-1T3 + 2,85×10-3T4 + 1,53×10-5T5 + 5,07×10-8T6 + 9,51×10-11T7 + 7,72×10-14T8, como mostrado na Figura 5. Este polinômio foi utilizado sobretudo para obtenção do "fitting" da DTG, bem como para a determinação dos intervalos de temperatura de ocorrência dos eventos de perda de massa obtidos na TG/DTG.
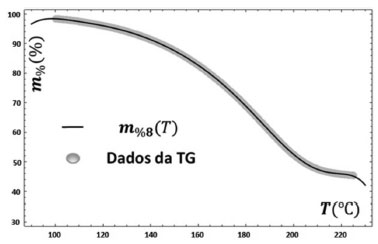 Figura 5. Ajuste matemático ou "fitting" com polinômio de grau 8, de um trecho da curva TG, regressão linear a partir de um polinômio de grau 8 no intervalo de temperatura de 90-230 ºC, faixa de temperatura que contém a primeira fase de perda de 54,3% de massa
A partir desse fitting, obteve-se a taxa percentual de perda de massa da amostra necessária para o cálculo da curva de Arrhenius, mostrada na Figura 6.
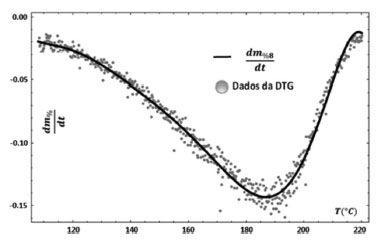 Figura 6. Ajuste ou "fitting" dos dados da DTG a partir do polinômio m%8 (T)
No intuito de se determinar a ordem da reação envolvida na técnica TG, construíram-se gráficos da constante de velocidade k versus T a partir da Equação 2, reapresentada com valores progressivos da constante n, para ordens de 0 a 5, na Equação 7 e Figura 7.
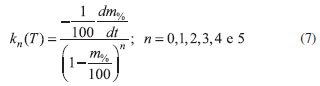
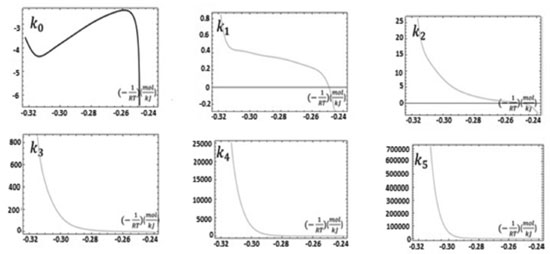 Figura 7. Gráficos da constante de velocidade, calculadas a partir da Equação (7), para ordens de reação, n, de 0 a 5
Se a equação de Arrhenius apresentada na Equação (2) for reescrita em função de

que consiste numa função crescente, uma vez que tanto o fator pré-exponencial , quanto a energia de ativação são necessariamente positivos. Na Figura 5, observa-se que o único gráfico com um trecho ascendente é aquele correspondente a ordem zero, que é, portanto, o valor tomado para a ordem da reação ocorrida no evento térmico trabalhado. A curva de Arrhenius, considerando ordem zero, fica sendo dada conforme a Figura 8.
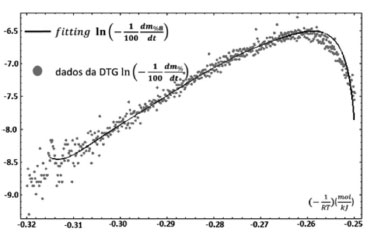 Figura 8. Curva de Arrhenius (ordem zero) a partir dos dados da DTG e do "fitting" polinomial
A tendência linear dos dados pode ser observada num trecho reduzido da curva da Figura 6, que foi escolhido em função do valor de correlação obtido da regressão linear, neste mesmo intervalo. No gráfico da Figura 9, está mostrado o resultado da regressão linear equivalente.
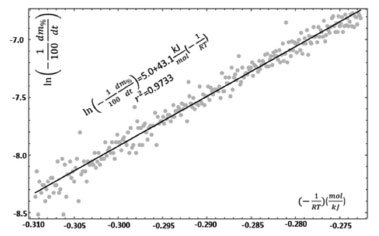 Figura 9. Regressão linear obtida da curva de Arrhenius dos dados da DTG
O valor calculado da Ea da reação ocorrida no evento térmico considerado está apresentado na Tabela 2. A partir destes resultados pode-se reproduzir a cinética do evento térmico no trecho descendente da DTG, como mostrado na Figura 10.

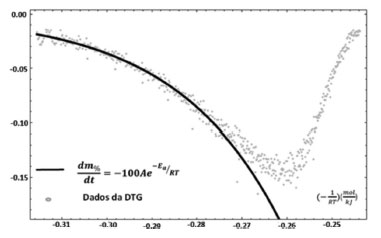 Figura 10. Ajuste dos dados ou "fitting" da análise térmica do óleo essencial da S. guianensis, resultantes dos parâmetros obtidos na regressão linear tendo como base a equação de Arrhenius
Infravermelho com transformada de Fourier Na Figura 11, estão mostrados os espectros FTIR (2-D) da parte volátil do óleo essencial extraído a 190 ºC das folhas da espécie S. guianensis e 3-D, em absorbância, e em função do número de onda e da temperatura de sua extração. As ligações C-H do esqueleto hidrocarbônico foram observadas em 2.924, 2.855 e 1.458 cm-1; e uma banda larga entre 3.600 - 3.200 cm-1 que corresponde a absorção dos grupos hidroxilas e hidroperóxidos. As bandas de absorção da ligação C-H das duplas ligações presentes nos ácidos graxos insaturados foram observadas em 3.009, 1.600, 990 a 800 cm-1. A absorção do grupo carboxila de ésteres está apresentada em 1.746 cm-1 e das ligações éteres, C-O-C, entre 1.163 e 1.099 cm-1. As posições relativas das bandas foram consistentes com as encontradas na literatura.13
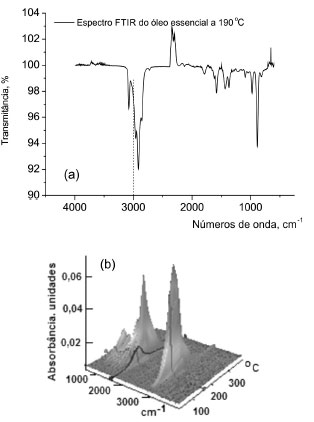 Figura 11. Espectro em transmitância por FTIR do óleo essencial extraído a partir das folhas da S. guianensis, a 190 ºC, e sua imagem 3-D, progressiva com a taxa de aquecimento, sendo apresentados nos eixos: Y, a absorbância; no X, o número de onda; e no Z, a temperatura equivalente à sua volatilização térmica
O óleo estudado apresentou uma taxa de absorção progressiva com o aumento da temperatura de queima até cerca de 200 ºC, conforme pode ser observado na Figura 11, em 3-D, e, esta foi atribuída como resultante de sua volatilização ou decomposição, em acordo com a literatura.13 Para Craveiro et al.13 os compostos monoterpênicos (cujo percentual na mistura corresponde a cerca de 9%, em peso) têm significativa absorbância nas regiões de 3.000 cm-1, 2.800 a 1.650 cm-1, entre 1.000 e 950 cm-1 e entre 900 e 850 cm-1, corroborando com os dados do espectro apresentado na Figura 11.
CONCLUSÃO Neste trabalho, foi realizada a caracterização físico-química de uma amostra do óleo essencial da S. guianensis Aublet. De acordo com os resultados, sugeriu-se um tempo ótimo para a extração do óleo essencial a partir das suas folhas e galhos, da forma como extraído, de 90 minutos, com um rendimento médio de (1,75 ± 0,10)%. A composição química da amostra analisada por GC/MS consistiu em mais de 80% (em massa) de monoterpenos e sesquiterpenos oxigenados. A caracterização física realizada a partir das análises TG/DSC permitiu verificar o seu desempenho térmico de oxidação parcial com evento exotérmico em pico a 148,3 ºC, possivelmente pela sua composição oxigenada, e pico endotérmico a 194,7 ºC, este último atribuído à volatilização ou decomposição progressiva do óleo essencial, na ausência de oxigênio na atmosfera. A Ea para o processo oxidativo foi de 43,1 kJ/mol. A perda de massa equivalente até a temperatura de 225 ºC foi de 54,21%, e com perda de massa posterior até 400 ºC de 6,97%.
AGRADECIMENTOS Ao Professor Luiz Gustavo de Lima Guimarães da Universidade Federal de São João Del Rei e aos professores do curso de Química Ambiental da Universidade Federal do Tocantins, Profs. Douglas Henrique Pereira e Paulo Victor Brandão Leal, pelos valorosos esclarecimentos.
REFERÊNCIAS 1. Valentini, C. M. A.; Rodriguez-Ortiz, C. E.; Coelho, M. F. B.; Rev. Bras. Plantas Med. 2010, 12, 96; Valentini, C. M. A.; Silva, L. E.; Maciel, E. N.; Franceschini, E.; Sousa Jr., P. T.; Dall´Oglio, E. L.; Coelho, M. F. B.; Quim. Nova 2010, 33, 1506. 2. Perini, V. B. M.; Castro, H. G.; Santos, G. R.; Chagas Júnior, A. F.; Cardoso, D. P.; Aguiar, W. S.; Soares, A. A.; J. Biotechnol. Biodiversity 2013, 4, 70; Pandey, A. K.; Palni, U. T.; Tripathi, N. N.; J. Food Sci. Technol. 2013, 93, 1680; Ootani, M. A.; Aguiar, R. W.; Ramos, A. A. C.; Brito, D. R.; Silva, J. B. da; Cajazeira, J. P.; J. Biotechnol. Biodiversity 2013, 4, 162; Croteau, R.; Kutchan, T. M.; Lewis, N. G.; Natural products (secondary metabolites). In Buchanan B.; Gruissem, W.; Joneas, R., eds.; Biochemistry and Molecular Biology of Plants; American Society of Plant Biologists: Rockville, MD, 2000. 3. Simões, C. M. O.; Schenkel, E. P.; Gosmann, G.; Mello, J. C. P.; Mentz, L. A.; Petrovick, P. R.; Farmacognosia: da planta ao medicamento, 5ª ed., Editora da UFSC: Porto Alegre, 2004. 4. Queiroga Neto, V.; Bora, P. S.; Diniz, Z. N.; Cavalheiro, J. M. O.; Queiroga, K. F.; Ciênc. Agrotec. 2009, 33, 1601. 5. Kowalski, B.; Thermochim. Acta 1991, 49, 184. 6. Santos, J. C. O.; Santos, I. M. G.; Conceição, M. M.; Porto, S. L.; Trinidade, M. F. S.; Souza, A. G.; Prasad, S.; Fernandes Júnior, V. J.; Araújo, A. S.; J. Therm. Anal. Calorim. 2004, 75, 419. 7. Dyszel, S. M.; Thermochim. Acta 1990, 166, 291; Dyszel, S. M.; Thermochim. Acta 1993, 226, 265; Kasprzycka-Guttman, T.; Odzeniak, D.; Thermochim. Acta 1991, 191, 41; Kaisersberger, E.; Thermochim. Acta 1989, 151, 83; Litwinienko, G.; Kasprzycka-Guttman, T.; Thermochim. Acta 1998, 319, 185. 8. Turek, C.; Stintzing, F. C.; Comprehensive Reviews in Food Science and Food Safety 2013, 12, 40. 9. Wendlant, W. W.; Collins, L. W. Anal. Chim. Acta. 1974, 71, 411; Long, G. T.; Vyazovkin, S.; Gamble, N.; Wight, C. A.; J. Pharm. Sci. 2002, 91, 800; Fernandes, N. S.; Carvalho Filho, M. A. S.; Mendes, R. A.; Ionashiro, M.; J. Braz Chem Soc. 1999, 10, 459; Leroy, V.; Cancellieri, D.; Leoni, E.; Thermochim. Acta. 2006, 451, 131; Nudelman, N. E. S.; Estabilidad de medicamentos, El Ateneo: Buenos Aires, 1975; Rodrigues, P. O.; Cardoso, T. F. M.; Silva, M. A. S.; Matos, J. R.; Acta Farm. Bonaerense 2005, 24, 383; Aulton, M. E.; Delineamento de formas farmacêuticas, 2ª ed., ARTMED: Porto Alegre, 2005; Höhne, G. W. H.; Hemminger, W. F.; Flammersheim, H. J.; Differencial Scanning Calorimetry, 2nd ed., Springer: New York, 2003; Miyazawa, M.; Pavan, M. A.; Oliveira, E. L.; Ionashiro, M.; Silva, A. K.; Braz. Arch. Biol. Techn. 2000, 43, 475; Giron, D.; J. Therm. Anal. Calorim. 2002, 68, 335; Vecchio, S.; Catalani, A.; Rossi, V.; Tomasseti, M.; Thermochim. Acta 2004, 420, 99; Lacerda, L. G.; Almeida, R. R.; Demiate, I. M.; Carvalho Filho, M. A. S.; Vasconcelos, E. C.; Woiciechowski, A. L.; Bannach, G.; Schnitzler, E.; Soccol, C. R.; Braz. Arch. Biol Techn. 2009, 52,143. 10. Radünz, L. L.; Melo, E. C.; Berbert, P. A.; Barbosa, L. C. A.; Rocha, R. P.; Grandi, A. M.; Revista Brasileira de Armazenamento 2002, 27, 9. 11. Silverstein, R. M.; Webster, F. X.; Kiemle, D. J.; Identificação espectrométrica de compostos orgânicos, Livros técnicos e científicos S.A.: Rio de Janeiro, 2007; Lopes, W. A,; Fascio, M.; Quim. Nova 2004, 27, 670; Negri, G.; Santi, D.; Tabach, R.; Brazilian Journal of Pharmacognosy 2012, 22, 1024; Mc Lafferty, F. W.; Stauffer, D. B.; The Wiley/NBS registry of mass spectral data, John Wiley Sons: New York, vol I-II, 1989; Adams, R. P.; Identification of essential oil components by gas cromatography/mass spectroscopy, Allured Pub.: Carol Stream, 1995; Van Den Dool, H.; Kratz, D. J.; J. Chromatogr. 1963, 11, 463. 12. Combrick, S.; Du Plooy, G. W.; McCridle, R. I.; Botha, B. M.; Ann. Bot. 2007, 99, 111; Fahn, A. Secretory tissues in plants, Academic Press: London, 1979; Lucas, P. W.; Turner, I. M.; Dominy, N. J.; Yamashita, N.; Ann. Bot. 2000, 86, 913. 13. Adhvaryu, A.; Perez, J. M.; Singh, I. D.; Energy Fuels 1998, 12, 1369; Chen, D.; Liu, Y.; Hartman, D. R.; American Laboratory 1999, 31, 15; Craveiro, A. A.; Alencar, J. W.; Quim. Nova 1988, 11, 398. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access






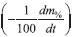 versus
versus 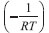 resultam numa reta ascendente de coeficiente angular igual à Ea, em kJ/mol, no caso, a constante do gás deve estar apresentada em kJ/(mol K).
resultam numa reta ascendente de coeficiente angular igual à Ea, em kJ/mol, no caso, a constante do gás deve estar apresentada em kJ/(mol K).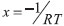 , tem-se na Equação 8,
, tem-se na Equação 8,