Revisão
|
|
| Bionanocompósitos preparados por incorporação de nanocristais de celulose em polímeros biodegradáveis por meio de evaporação de solvente, automontagem ou eletrofiação BIO-BASED NANOCOMPOSITES OBTAINED BY INCORPORATION OF CELLULOSE NANOCRYSTALS INTO BIODEGRADABLE POLYMERS THROUGH CASTING, LAYER-BY-LAYER OR ELECTROSPINNING METHODS |
|
Fabiano Vargas PereiraI,*; Everton Luiz de PaulaI; Joao Paulo de MesquitaII; Alessandra de Almeida LucasIII; Valdir ManoIV
IDepartamento de Química, Instituto de Ciências Exatas, Universidade Federal de Minas Gerais, Av. Antônio Carlos, 6627, 31270-901 Belo Horizonte - MG, Brasil Recebido em 18/09/2013 *e-mail: fabianovargas@yahoo.com This review reports the preparation and characterization of bionanocomposites based on biodegradable polymers reinforced with cellulose nanocrystals (CNC) described in the literature. The outstanding potential of cellulose nanocrystals as reinforcement fillers of biodegradable polymers is presented with an emphasis on the solution casting process, which is an appropriate method to investigate the physico-chemical effects of the incorporation of CNC into the polymeric matrices. Besides solution casting, other small scale methods such as electrospinning and layer-by-layer are also covered. INTRODUÇÃO As pesquisas para o desenvolvimento de materiais poliméricos biodegradáveis de fontes renováveis são crescentes, uma vez que a disponibilidade de biopolímeros é abundante na natureza e alguns possuem custo relativamente baixo. No entanto, de um modo geral, os biopolímeros obtidos de fontes naturais apresentam propriedades mecânicas muito inferiores em relação aos preparados a partir de materiais derivados do petróleo, necessitando, assim, de melhorias significativas nestas e em outras propriedades. Uma alternativa para o aperfeiçoamento dessas propriedades em polímeros biodegradáveis é o desenvolvimento de nanocompósitos com a utilização de nanopartículas de reforços (ou nanocargas) que sejam também de fonte renovável e biodegradáveis. Dentre as nanopartículas que apresentam essas características destacam-se os chamados nanowhiskers ou nanocristais à base de polissacarídeos, como os de quitina, amido ou celulose. Esses últimos são mais comumente chamados de nanocristais de celulose (NCCs) e têm merecido destaque especial na literatura, principalmente pelo fato de serem provenientes da fonte mais abundante e de mais baixo custo entre aquelas citadas. A celulose é o composto orgânico de maior abundância na crosta terrestre, sendo o principal componente da biomassa. Os materiais provenientes deste biopolímero vêm sendo utilizados pela sociedade há centenas de anos. Todavia a sociedade moderna demanda o desenvolvimento de novos materiais com alto desempenho, para aplicações tradicionais, num formato relativamente novo como as embalagens antibacterianas e biodegradáveis.1 Os NCCs são constituídos de domínios cristalinos de celulose que apresentam diferentes e interessantes propriedades mecânicas, óticas e térmicas quando comparados com as estruturas celulósicas de maior dimensão. Isso acontece porque, com a extração da celulose em escala nanométrica, a maioria dos defeitos associados à estrutura hierárquica de um organismo vegetal podem ser removidos, produzindo a base de construção para a preparação de uma nova geração de materiais, como os compósitos baseados em celulose. A potencialidade e consequentemente o interesse na utilização e desenvolvimento dessas nanopartículas é bem representado por alguns trabalhos de revisão publicados nos últimos anos em periódicos de alto fator de impacto.1-4 De fato, há uma grande expectativa com relação à utilização dessas nanoestruturas no desenvolvimento de materiais avançados relacionados a nanocompósitos, filmes finos e dispositvos óticos.5 Isso se justifica pelo fato de serem de fácil obtenção e por apresentarem excelentes propriedades mecânicas (apresentam módulo elástico próximo ao do Kevlar), aliada a uma baixa densidade (1,6 g cm-3), biodegradabilidade, biocompatibilidade e possibilidade de funcionalização química devido à presença de hidroxilas superficiais.6 Em função dessas propriedades, os NCCs têm despertado a atenção de indústrias de diferentes ramos como a de embalagens, agricultura, alimentícia, automobilística, aeronáutica, entre outras. Para essas destacam-se as aplicações que envolvem a utilização para embalagens flexíveis ou rígidas.7 Essas aplicações devem gerar num futuro próximo um grande interesse econômico nessas nanopartículas, que podem inclusive ser preparadas a partir de resíduos provenientes da agroindústria como bagaço de cana, casca de arroz e palha de milho.8 Nesse contexto o Brasil se destaca, pois é um dos maiores produtores agrícolas do mundo e contribui com grande parcela do total dos milhares de toneladas de biomassa lignocelulósicas que são produzidas de diferentes fontes. Além disso o Brasil também se destaca como um grande produtor e exportador de celulose, sendo parte dessa produção proveniente de plantações de eucalipto em áreas de reflorestamento. Assim sendo a pesquisa envolvendo o uso dos NCCs na preparação de nanocompósitos com polímeros biodegradáveis ajusta-se perfeitamente a um cenário onde é cada vez mais urgente a utilização sustentável de recursos naturais, abundantes no Brasil, de forma a desenvolver novos produtos provenientes de fontes renováveis e de baixo custo, agregando valor e gerando riquezas. A inserção de NCCs em polímeros biodegradáveis (obtidos de fonte natural ou sintética) tem sido mencionada na literatura como uma excelente alternativa para melhoria em algumas de suas propriedades como as mecânicas, de barreira e térmicas. Esses materiais compósitos podem ser preparados por metodologias adequadas à escala laboratorial, a partir de estratégias que podem envolver ou não reação química entre os nanocristais e os biopolímeros, ou por meio de técnicas aplicáveis à escala industrial (métodos de incorporação por fusão). Nesse artigo de revisão pretendemos demonstrar a influência da incorporação de NCCs nas diferentes propriedades de polímeros biodegradáveis, em compósitos preparados por métodos em escala de bancada, os quais têm sido os mais extensivamente investigados nos últimos anos, como no caso de filmes compósitos preparados por evaporação de solvente (casting) ou por métodos mais elaborados como electrospinning ou filmes finos automontados (layer-by-layer).
NANOCRISTAIS DE CELULOSE: DEFINIÇÃO, CARACTERÍSTICAS E PROPRIEDADES A descoberta dos NCCs tem sido atribuída a Ränby et al.,9-11 que publicaram o primeiro trabalho descrevendo a obtenção de suspensões coloidais de celulose por meio da hidrólise controlada com ácido sulfúrico. Anteriormente, Nickerson and Habrle12 tinham observado que a degradação de celulose com solução ácida em ebulição atingia um limite após um determinado tempo de reação. Ainda na década de 1950 Mukherjee et al.,13,14 utilizando microscopia eletrônica de transmissão (MET), observaram pela primeira vez que as partículas obtidas da suspensão hidrolisada após secagem eram compostas por agregados de estruturas em forma de agulha e que estas estruturas tinham a mesma estrutura cristalina das fibras da celulose original. Atualmente os NCC são obtidos por diferentes métodos, incluindo hidrólise enzimática,15 hidrólise assistida por ultrassom,16 dissolução em N, N-Dimetilacetamida (DMAc)/LiCl17 e líquidos iônicos.18 Porém, a metodologia mais utilizada é a hidrólise ácida. Durante a reação, as regiões amorfas, mais acessíveis, são mais rapidamente atacadas em comparação aos domínios cristalinos que permanecem intactos após o processo conduzido de forma controlada, como exemplificado na Figura 1.2
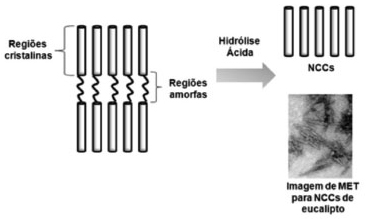 Figura 1. Esquema com as regiões amorfas (mais suscetíveis à hidrólise) e cristalinas de celulose
É importante mencionar que a literatura se refere ainda às microfibrilas, também chamadas de nanofibrilas de celulose (cellulose nanofibrills).19,20 Essas, diferentemente dos NCCs, constituem-se de partículas longas e flexíveis com comprimento na escala micrométrica (entre 5-20 µm) e dimensão lateral em torno de 10-100 nm, possuindo, concomitantemente, domínios amorfos alternados com domínios cristalinos. Essa revisão vai tratar somente de nanocompósitos formados pelos nanocristais de celulose. O procedimento típico para obtenção de nanocristais, ou nanowhiskers de celulose em dispersão aquosa consiste em submeter as fibras celulósicas à hidrólise ácida (H2SO4 ou HCl) sob condições controladas (tempo, temperatura). Posteriormente a suspensão é diluída e lavada com sucessivas centrifugações. Por fim é realizada uma diálise contra água destilada para remoção do ácido residual da dispersão. Além de ácido clorídrico e sulfúrico, os ácidos fosfórico2 e bromídrico21 também têm sido utilizados. A morfologia, as dimensões e as propriedades dos NCCs são fortemente dependentes das condições reacionais, como tempo, temperatura, concentração e tipo de ácido. Quando o ácido clorídrico é utilizado, tem-se um material com limitada dispersão em solução aquosa,22 uma vez que as partículas tendem a se agregar por meio da extensa possibilidade de ligações de hidrogênio. Por outro lado, quando é utilizado H2SO4, ocorre, além da hidrólise, a reação direta entre o ácido e os grupos hidroxila, formando grupos éster-sulfato negativamente carregados, conforme mostra a Figura 2. A presença dessas cargas na superfície dos nanocristais gera repulsão eletrostática entre as nanopartículas, o que facilita a dispersão em água. Por outro lado, a presença desses grupos na superfície dos NCCs diminui a estabilidade térmica das nanoestruturas.23,24 O uso combinado dos dois ácidos tem ocorrido com o objetivo de se obter materiais com boas propriedades térmicas e de dispersão em água.24-26
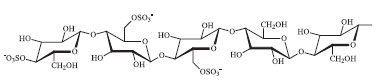 Figura 2. Grupos éster-sulfatos introduzidos nas cadeias de celulose durante preparação de NCCs com H2SO4
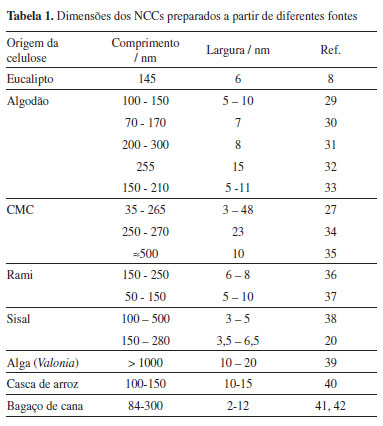
Uma vez que a hidrólise ocorre principalmente nas regiões amorfas e o grau de cristalinidade das fibras celulósicas varia com a origem da fibra precursora, este último fator é importante na definição da dimensão dos NCCs.27 Na Tabela 1 são indicados os valores de comprimento e espessura de nanocristais preparados com fibras de celulose de diferentes origens, incluindo as provenientes de rejeitos agrícolas como casca de arroz e resíduo da cana-de-açúcar.1,28 A Tabela 1 também indica que o tamanho dos NCCs depende fortemente das condições de hidrólise a que foi submetida a fonte de celulose, pois para uma mesma fonte, são descritos diferentes valores de comprimento e espessura dos nanocristais.
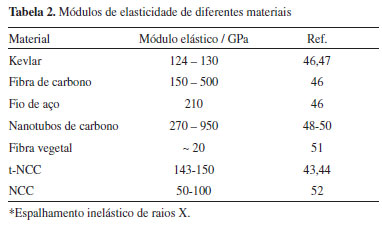
As propriedades mecânicas dos NCCs têm sido estimadas usando microscopia de força atômica (MFA)43 e espectroscopia de espalhamento Raman.44 Em 1997, Hamad e Eichhorn45 demonstraram que a deformação molecular da celulose podia ser acompanhada por espectroscopia de espalhamento Raman. Na prática, eles observaram que um pico característico da celulose, localizado em 1095 cm-1, deslocava-se para números de onda mais baixos quando uma tensão era aplicada no material. Em 2005, Sturcova et al.44 estimaram teoricamente o módulo elástico de NCCs obtidos de tunicato (um animal marinho que possui um manto de celulose), por meio do acompanhamento do deslocamento da banda localizada em 1095 cm-1, ao deformar um NCC de tunicato (t-NCC) incorporado em uma resina expoxi. Nesse trabalho, o valor do módulo elástico observado foi de 143 GPa. Como comparação, os valores de módulo para os NCCs obtidos de fontes vegetais variam de 50 a 100 GPa. Na Tabela 2 são mostrados os valores do módulo elástico estimados de fibra vegetal, de NCCs e de outros materiais para comparação, como nanotubos de carbono e Kevlar. Pode ser verificado que os valores de módulo dos NCCs são próximos aos do Kevlar, mas bem superiores (até 5 vezes) aos valores da fibra vegetal.
Devido a suas excelentes propriedades mecânicas, baixa densidade (1,6 g cm-3) e superfície reativa pela presença de grupos hidroxila (que facilitam o ancoramento de grupos químicos específicos que melhoram a compatibilidade entre carga e matriz) os NCCs se apresentam como materiais adequados para o desenvolvimento de novos materiais polímericos compósitos.1,53 É digno de nota que, em um cenário em que a produção de NCCs pode atingir importância econômica, algumas instalações de plantas piloto apropriadas para a produção de nanowhiskers de celulose em larga escala já foram instalados.54
BIONANOCOMPÓSITOS PREPARADOS COM NCCS Quando a matriz de um nanocompósito é um polímero biodegradável e o material de reforço é obtido de fonte renovável e biodegradável, como no caso dos NCCs, tem-se o que nos últimos anos tem sido relatado na literatura como bionanocompósitos.55 Pelas propriedades dos NCCs destacadas, o principal foco dos trabalhos envolvendo essas nanopartículas tem sido o desenvolvimento de nanocompósitos pela incorporação de NCCs às matrizes poliméricas. Entretanto, apesar dos NCCs terem sido obtidos já na década de 1950, somente em 1995 foi publicado o primeiro trabalho no qual NCCs obtidos de tunicatos foram utilizados como reforço em uma matriz polimérica (látex) utilizando o método de evaporação de solvente.56,57 Os bionanocompósitos representam uma classe relativamente nova de materiais que tem atraído grande atenção, principalmente devido à necessidade de desenvolvimento de materiais ecologicamente corretos.58 Eles são produzidos mediante a incorporação de NCCs em uma matriz biodegradável e dependendo da aplicação, em uma matriz também biocompatível.59 Dentre as matrizes biodegradáveis e de origem natural destacam-se alguns polissacarídeos (amido, alginato e quitosana) e algumas proteínas como colágeno e aquelas originadas da soja e da seda. No caso dos polímeros sintéticos biodegradáveis, os mais estudados são os polilactídeos - PLAs (também obtido por rota biotecnológica), a poli(ε-caprolactona) - PCL, o poli(ácido glicólico) - PGA, o poli(hidroxioctanoato) - PHO, o poli(hidroxibutirato) - PHB, e o seu copolímero poli(hidroxibutirato-co-hidroxivalerato) - PHBV. Como em todo material compósito, as propriedades dos bionanocompósitos dependem das propriedades individuais de cada componente (matriz e reforço), da composição (fração volumétrica dos constituintes), da morfologia de cada fase (arranjo espacial, dimensões, cristalinidade) e das propriedades da interface. Samir et al.6 destacaram a importância de três parâmetros na definição das propriedades mecânicas de compósitos com NCCs. O primeiro é a razão de aspecto (L/d) dos nanocristais, que, conforme mencionado, está relacionada ao material de origem e ao método de extração dos NCCs. Quanto maior essa razão maior é o efeito de reforço esperado. O segundo é o método de preparação dos nanocompósitos que pode ser por evaporação de solvente (água ou solventes orgânicos, dependendo da solubilidade do polímero) ou no estado fundido, em processos baseados em extrusão e injeção. O terceiro parâmetro é o resultado das interações entre matriz polímérica/nanopartículas e entre as nanopartículas. Em compósitos convencionais a priorização do primeiro tipo de interação é importante na busca de melhores propriedades mecânicas. No entanto, no caso dos NCCs, a perspectiva da formação de uma rede percolada está relacionada à capacidade de interação entre as nanopartículas por meio de interações por ligação de hidrogênio.60 Na preparação de bionanocompósitos com NCCs o método que tem sido mais utilizado e descrito na literatura é a obtenção de filmes por evaporação de solvente (solvent casting ou simplesmente casting, em inglês), por se tratar de estudos que visam basicamente investigar os efeitos físico-químicos que os NCCs podem incorporar às matrizes poliméricas em escala laboratorial. Por isso a maior parte dos estudos citados neste trabalho de revisão utiliza casting como método de processamento. Outros métodos como eletrofiação e preparação de filmes auto-montados (layer-by-layer) também serão abordados. A seguir são apresentadas a preparação e a caracterização de bionanocompósitos poliméricos reforçados com NCCs com os principais polímeros biodegradáveis já relatados na literatura. São destacadas a forma de incorporação das nanopartículas de celulose no biopolímero, a caracterização e o estudo das propriedades dos compósitos. Polilactideos - PLAs Os poliésteres alifáticos da família dos lactídeos (polilactídeos, PLAs) foram polimerizados pela primeira vez há 40 anos pela abertura do anel do 1,4-dioxano-2,5-diona (lactídeo). PLAs são termoplásticos de alto módulo de elasticidade, podendo ser facilmente processados por técnicas convencionais utilizadas na indústria de polímeros como moldagem por injeção, termoformagem e extrusão. A degradação é dependente do tempo, temperatura, massa molar e do meio de degradação. Para produzir os polilactídeos, milho ou fontes de açúcar são processados para a obtenção de D-glicose, que depois é fermentada para produzir ácido lático, o que é convertido térmica e catalicamente em um dímero cíclico, o lactídeo. O método de polimerização por abertura do anel do lactídeo é o método mais usado para a obtenção do polímero. A unidade repetitiva para os PLAs é mostrada na Figura 3.
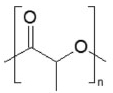 Figura 3. Representação da unidade repetitiva dos polilactídeos - PLAs
Em se tratando de propriedades mecânicas os polilactídeos são polímeros relativamente frágeis, apresentando resistência ao impacto em torno de 26 J m-1. Para melhorar suas propriedades mecânicas muitas estratégias têm sido desenvolvidas, como: variação da massa molar e do grau de cristalinidade, produção de copolímeros e blendas e também a adição de cargas de reforço como os nanocristais de celulose. De todos os nanocompósitos preparados e estudados com NCCs, a matriz de PLA é a que tem recebido o maior interesse.61-75 O principal fator para garantir propriedades desejáveis dos compósitos envolvendo os NCCs é a boa dispersão das nanopartículas na matriz polimérica. Existem diferentes alternativas para garantir uma boa dispersão, incluindo a utilização de algum agente dispersante, a modificação química da superfície dos nanocristais e, mais recentemente, tem sido realizada a polimerização na presença dos nanocristais. Lin e colaboradores76 realizaram a acetilação dos NCCs para melhorar sua dispersão na matriz de polilactídeo. Esses NCCs acetilados mostraram melhor dispersão em solventes orgânicos (diclorometano, acetona, tolueno, tetrahidrofurano e dimetilformamida). Ao serem incorporados na matriz de PLA, os nanocristais aumentaram em 60% a cristalinidade da matriz, alteraram suas propriedades mecânicas e também a Tg, a qual passou de 43,0 ºC, no caso da matriz de PLA pura, para 49,7 ºC no compósito. O aumento na temperatura de transição vítrea é importante para ampliar as possibilidades de aplicação do PLA. Trabalho similar foi desenvolvido por Petersson e colaboradores,77 os quais modificaram a superfície dos NCCs, absorvendo t-butanol e um surfactante, com o objetivo de melhorar a dispersão dos nanocristais no solvente orgânico e aumentar a compatibilidade da nanocarga com a matriz. Imagens obtidas por microscopia eletrônica de transmissão (MET) mostraram que tanto o t-butanol quanto o surfactante melhoraram a dispersão dos NCCs na matriz, o que resultou em aumento no módulo de armazenamento do polímero em altas temperaturas. Lin e colaboradores78 funcionalizaram NCCs com poli(ε-caprolactona) com o auxílio de radiação micro-ondas e utilizaram as nanocargas modificadas como reforço de PLA, melhorando sensivelmente as propriedades mecânicas do polímero. Os efeitos dos NCCs sobre a microestrutura e o comportamento térmico de fibras de PLA obtidas por eletrospining foram estudados por Liu e colaboradores.74 Eles obtiveram fibras com diâmetro de 300 nm e, por microscopia eletrônica de varredura (MEV), verificaram que os nanocristais não se encontravam na sua superfície. Foi observada também uma maior estabilidade térmica das fibras contendo nanocristais comparadas àquelas de PLA puro e, por difração de raios-X, ficou comprovada a baixa cristalinidade das fibras obtidas, atribuída, sobretudo, à rápida evaporação do solvente. Mais recentemente, de Paula e colaboradores79 estudaram a influência dos NCCs na degradação hidrolítica do poli(D,L-lactídeo), PDLLA, em meio de tampão fosfato. A presença dos nanocristais induziu a uma diminuição na velocidade de degradação da matriz PDLLA, proporcionalmente à quantidade de NCCs incorporados. Os autores atribuíram a queda na taxa de degradação a um efeito de barreira ocasionado pela alta cristalinidade dos nanocristais, dificultando assim a difusão de água por entre as cadeias poliméricas e tornando o polímero mais resistente à degradação em ambientes hidrolíticos. Visto que o tempo de degradação foi dependente da quantidade de nanocristais incorporados ao polímero, essa estratégia pode ser uma alternativa para controlar a velocidade da degradação de polilactídeos. Os efeitos nas propriedades de barreira do PLLA ocasionados por NCCs quimicamente modificados com um surfactante foram investigados por Fortunati e seus colaboradores.80 Compósitos contendo concentrações de 1 e 5% em massa de nanowhiskers foram preparados por meio da metodologia casting. Os resultados obtidos por MET revelaram a boa dispersão dos nanocristais na matriz devido à adição do surfactante na superfície dos NCCs. Com a perspectiva de aplicação em embalagens, foram avaliadas as propriedades de barreira dos compósitos que revelaram um decréscimo de 34% de permeabilidade ao vapor d'água. Além disso, estudos por calorimetria diferencial de varredura (DSC) e DRX revelaram o efeito de nucleação exercido pelos nanocristais nas matrizes de PLLA. Em um segundo estudo desenvolvido pelo mesmo autor e seus colaboradores81 foram caracterizados nanocompósitos preparados com o PLLA, nanopartículas de prata e nanocristais de celulose não modificados e modificados com um surfactante. Os compósitos produzidos por casting revelaram uma melhoria nas propriedades mecânicas da matriz quando foram dispersos os NCCs modificados. Esse efeito foi ainda mais pronunciado ao se combinar as nanopartículas de prata. Por MEV foi revelada a boa adesão interfacial entre a matriz e os nanowhiskers de celulose, o que explica o bom desempenho mecânico dos materiais. Além disso, a combinação de poli(L-lactídeo), NCCs e nanopartículas de prata apresenta possibilidade para produção de embalagens de alimentos devido a uma resposta antimicrobiana adequada. Uma fibra a base de PLA e NCCs foi produzida por electrospinning por Shi e colaboradores.82 Os autores verificaram que o diâmetro médio das fibras diminuía com o aumento da concentração dos nanocristais, possivelmente pela sua agregação durante o processo de preparação. A análise do comportamento mecânico revelou um aumento considerável nas propriedades mecânicas como o aumento do módulo de Young de 5,7 para 125,6 MPa e da tensão máxima de tração de 1,26 para 6,3 MPa. Além disso, os autores verificaram que a incorporação dos NCCs aumentou a estabilidade térmica e a velocidade de degradação in vitro dos nanocompósitos. Recentemente, nanocompósitos de PLA com NCCs foram preparados com vistas à sua utilização na área de engenharia de tecidos.83,84 Zhou e colaboradores83 prepararam suportes para crescimento celular (scaffolds) por meio da técnica de eletrofiação. O material eletrofiado foi formado por PLA graftizado com anidrido maleico e reforçado com NCCs. As propriedades mecânicas, morfológicas, térmicas e as propriedades de degradação in vitro bem como a citocompatibilidade foram investigados. Os suportes preparados apresentaram propriedades mecânicas apropriadas para a reparação de tecidos ósseos, mostraram-se não tóxicos e capazes de suportar a proliferação celular. Em outro trabalho divulgado recentemente,84 NCCs foram adequadamente dispersos em nanofibras eletrofiadas de PLA. Este material foi liofilizado para produzir um aerogel e, posteriormente, compactados a quente (hot pressing). A composição ótima de nanocristais para esses compósitos foi de 0.5-3%. Os compósitos finais obtidos exibiram características promissoras de integridade estrutural e porosidade, demonstrado características potenciais para uso como suportes em engenharia de tecidos. Quitosana Importantes propriedades da quitosana (QUI) incluem a biocompatibilidade, biodegradabilidade, propriedades anti-microbianas e versáteis propriedades físicas e químicas que possibilitam a preparação de materiais poliméricos de diferentes formas como fibras, filmes, géis, esponjas, pérolas ou mesmo nanopartículas. Todas essas características possibilitam a aplicação deste biopolímero em diferentes áreas biomédicas,85 tais como liberação de fármacos,86 engenharia de tecidos,87 cicatrização de feridas, entre outras.88 Além das aplicações biomédicas, filmes de quitosana também têm sido utilizados em embalagens de alimentos, principalmente devido à sua biodegradabilidade, propriedades anti-microbianas e não toxicidade.89,90 Todavia a inerente sensibilidade à água e as baixas propriedades mecânicas em comparação aos polímeros derivados do petróleo restrigem consideravelmente suas aplicações, principalmente em ambientes úmidos. Os NCCs apresentam-se como uma alternativa adequada para o desenvolvimento de nanocompósitos com a QUI principalmente para aplicações em embalagens e produtos biomédicos. As principais justificativas são as características semelhantes entre NCCs e quitosana, como biodegradabilidade, biocompatibilidade e hidrofilia, o que facilita o preparo e maximiza a compatibilidade entre carga e matriz no compósito. O primeiro nanocompósito quitosana/NCC foi preparado por Li et al.59 Os autores avaliaram o efeito da concentração de NCCs na estrutura, morfologia e propriedades desses bionanocompósitos. Os resultados indicaram boa miscibilidade com fortes interações entre os nanocristais e a matriz. Além disso, os nanocompósitos apresentaram uma menor afinidade por água e um aumento de aproximadamente 50% na resistência à tensão quando utilizada concentração de 20% em massa de NCCs. Os autores atribuíram os bons resultados obtidos principalmente às fortes interações entre os grupos sulfato na superfície dos NCCs e os grupos amino da quitosana. Mais recentemente, Azeredo et al.91 avaliaram o efeito da quantidade de NCCs e do plastificante glicerol nas propriedades mecânicas (resistência à tração, módulo elástico e deformação), temperatura de transição vítrea (Tg) e permeabilidade ao vapor d'água dos nanocompósitos de quitosana. Utilizando ferramentas de otimização os autores verificaram que, exceto para a deformação, todas as outras variáveis foram favorecidas em altas concentrações de NCCs e baixas concentrações de glicerol. Os autores estabeleceram um valor mínimo de 10% para a deformação e otimizaram o sistema para maximizar a resistência à tração, o módulo elástico, a temperatura de transição vítrea e para diminuir a permeabilidade ao vapor d'água. As concentrações ótimas de glicerol e NCCs nos filmes compósitos foram, respectivamente, 18 g/100 g e 15 g/100 g. Nessas condições os valores do módulo elástico e da resistência à tração foram semelhantes ao observado para outros polímeros sintéticos, porém o material apresentou baixa deformação e alta permeabilidade ao vapor d'água. Esta última característica é indesejável, por exemplo, para aplicação em embalagens para alimentos.90 Mais recentemente de Mesquita e colaboradores92 prepararam bionanocompósitos de quitosana covalentemente ligada a NCCs obtidos de polpa de eucalipto, previamente funcionalizados com uma função éster terminal. Foi verificado que os bionanocompósitos apresentaram menor capacidade de absorção de água devido ao aumento do caráter hidrofóbico dos NCCs funcionalizados e também devido à reticulação carga-matriz. As propriedades mecânicas dos nanocompósitos melhoraram significativamente em relação à matriz de QUI pura (aumento na resistência à tração de até 150% e no módulo elástico em até 160%). Em outro estudo, de Mesquita e colaboradores28 prepararam filmes finos automontados (layer-by-layer) de NCCs com QUI altamente desacetilada. Imagens obtidas por MEV mostraram que em cada camada os NCCs encontravam-se homogeneamente distribuídos e formando um empacotamento denso. Os resultados obtidos indicaram que a metodologia usada pode ser estendida para outros biopolímeros com potenciais aplicações, tanto no campo biomédico quanto na preparação de embalagens para alimentos.28 Já Spagnol e seus colaboradores93 desenvolveram um hidrogel à base de quitosana modificada com poli(ácido acrílico) e NCCs. As imagens obtidas por MEV revelaram que a morfologia do hidrogel modifica-se completamente na presença dos nanocristais. Foram ainda avaliadas as propriedades responsivas dos compósitos mediante a variação de pH e da concentração salina do meio em que foram adicionados. Os resultados revelaram um comportamento responsivo em relação aos dois parâmetros, apresentando assim potencial para aplicação em dispositivos de liberação controlada de fármacos. Poli(hidroxibutirato-co-hidroxivalerato) - PHBV e poli(hidroxibutirato) - PHB Ten et al.94 investigaram as propriedades de compósitos de PHBV e NCCs preparados por casting. Os autores aprofundaram as discussões sobre esses compósitos e verificaram que as nanopartículas de celulose atuam como agentes de nucleação eficazes devido ao decréscimo da temperatura de cristalização do PHBV determinada por DSC e também por meio da microscopia óptica. O módulo de armazenamento desse polímero aumentou com a adição dos nanocristais, especialmente em temperaturas acima da Tg. Mais recentemente esse mesmo grupo95 mostrou que na presença de 2,3% de NCCs na constituição do compósito a resistência à tração passou de 27 MPa para 36 MPa e o módulo elástico de 1,3 a 2,0 MPa. Nessa concentração o módulo de armazenamento aumentou de 1,8 GPa para cerca de 3,4 GPa a -10 ºC. Para as outras concentrações testadas não foram verificadas melhorias nas propriedades mecânicas uma vez que, por MET, constatou-se uma aglomeração dos nanocristais. Yu e colaboradores96 verificaram que os NCCs são bastante efetivos como agente de cristalização do PHBV, induzindo a um aumento na temperatura de fusão cristalina. A cinética de cristalização não-isotérmica mostrou que a taxa de cristalização total do PHBV nos nanocompósitos foi mais alta que a do PHBV puro. Por outro lado foi verificada uma diminuição na cristalinidade e no tamanho dos esferulitos de PHBV. Além disso medidas de ângulo de contato mostraram o aumento da hidrofilia dos nanocompósitos à base de PHBV. Yu et al.97 preparam nanocompósitos à base de PHBV e NCCs, sendo observadas melhorias nas propriedades mecânicas da matriz, como o aumento de 149% na tensão de ruptura e 250% no módulo de Young. Segundo os autores essas melhorias significativas foram atribuídas a interações por ligações de hidrogênio entre os nanocristais de celulose e a matriz de PHBV e evidenciadas por espectroscopia no infravermelho, além de propriedades de cristalização comprovadas pelo cálculo do índice de cristalinidade por DRX. Ten e colaboradores98 prepararam fibras de PHBV por eletrofiação reforçadas com NCCs e alinhadas unidirecionalmente utilizando um campo elétrico externo. Preparados nas concentrações em massa de 1,5, 2, 3, 4 e 5% de NCCs os resultados obtidos por MET revelaram o completo alinhamento das fibras com a aplicação do campo elétrico, além da influência dos nanocristais nesse alinhamento. Análise dinâmico-mecânica foi utilizada para calcular o grau de anisotropia dessas fibras, revelando que a concentração dos NCCs influencia diretamente nesse valor: quanto maior a concentração de NCCs, mais isotrópico é o material. Isso porque o aumento da quantidade dos nanocristais propicia o aumento das interações entre as nanopartículas e a matriz polimérica, facilitando o alinhamento. Em recente artigo Patrício et al.99 prepararam bionanocompósitos de poli(hidroxibutirato), PHB e NCCs utilizando baixas concentrações dos nanocristais (até 0,45%). Os NCCs foram previamente dispersos em poli(etileno glicol) de baixa massa molar (PEG 200) e posteriormente as nanopartículas de celulose foram dispersas na matriz de PHB. Os autores descreveram um resultado surpreendente, pois com baixas concentrações de NCCs juntamente com PEG, foi possível aumentar consideravelmente a elongação na ruptura do PHB (até 50 vezes comparado ao PHB puro). É importante salientar que o mesmo resultado não foi observado ao se utilizar apenas o PEG200, (que aumenta apenas 50% a elongação na ruptura do polímero). Este comportamento foi explicado devido à orientação das cadeias poliméricas promovida pela presença das nanopartículas em forma de bastão na mesma direção da força mecânica aplicada. Esses resultados indicam que as aplicações do PHB podem ser ampliadas, já que a principal limitação para aplicações desse biopolímero é sua natureza quebradiça, apresentando baixa elongação. Os resultados desse trabalho demonstram que a incorporação de NCCs pode promover mudanças drásticas e diferenciadas no comportamento mecânico de polímeros, o que depende basicamente das interações específicas entre polímero, NCCs e outros aditivos incorporados na formulação. Amido Entre os bionanocompósitos formados pela incorporação de NCCs, aqueles que envolvem o biopolímero amido estão entre os mais estudados devido à natureza do amido ser similar à da celulose, o que garante boa dispersão dos nanocristais e por isso considerável melhoria nas propriedades mecânicas do biopolímero. Os polímeros de amido são polissacarídeos, modificados quimicamente ou não, produzidos a partir de amido extraído de milho, batata, trigo ou mandioca. Podem ser utilizados na produção de embalagens e itens de descarte rápido além de blendas e compósitos com polímeros sintéticos,100 na confecção de filmes flexíveis101 e também biocompósitos preparados com NCCs. Nestes últimos, ressalta-se que a interface matriz/ nanorreforços determina algumas propriedades essenciais (mecânicas, térmicas e de permeabilidade). Angles e Dufresne102 relataram a preparação de um nanocompósito à base de amido de milho plastificado com glicerol e reforçado com NCCs. Os compósitos foram acondicionados em diferentes níveis de umidade e caracterizados por MEV, DSC, experimentos de absorção de água e espalhamento de raios-X de baixo ângulo (SAXS). Os autores atribuíram ao comportamento específico de cadeias de amilopectina, localizadas próximo da interface com a celulose, o fenômeno de transcristalização da amilopectina sobre a superfície dos nanocristais. Em 2002, o mesmo grupo de pesquisadores repetiu a preparação dos compósitos, substituindo o glicerol pelo sorbitol.103 Esse sistema apresentou apenas uma temperatura de transição vítrea e nenhuma evidência de transcristalização de amilopectina. Foi verificado também que a Tg da matriz de amilopectina plastificada aumenta com a adição de até 15% em massa de NCCs, e diminui em seguida. Um crescimento significativo na cristalinidade foi observado nos compósitos com aumento tanto da umidade quanto da concentração dos NCCs. Outro trabalho envolvendo a preparação de nanocompósitos com a inserção de NCCS de algodão e tendo como matriz polimérica o amido plastificado com glicerol foi reportado por Lu e colaboradores.104 As análises realizadas revelaram que as fortes interações entre os nanocristais e a matriz de amido plastificado desempenham um papel chave no reforço dos compósitos, sendo que os compósitos mantidos a 50% de umidade relativa tiveram aumento tanto na tensão de ruptura quanto no módulo de Young, passando respectivamente de 2,5 MPa para 7,8 MPa e de 36 MPa para 301 MPa. Além disso a incorporação dos NCCs conduziu a uma diminuição da solubilidade dos filmes de amido em água, resultado importante para as aplicações desse material na área de embalagens. Outro estudo envolvendo o amido reforçado com NCCs é o de Cao e colaboradores.105 Nesse estudo as nanopartículas foram obtidas a partir do linho e tinham comprimentos entre 100 e 500 nm e diâmetros que variavam entre 10 e 30 nm. Os compósitos foram preparados por casting e a análise das imagens obtidas por MET revelaram uma dispersão homogênea dos nanocristais. Essa boa adesão interfacial entre polímero e carga levou a um aumento na Tg da matriz e a uma maior resistência à absorção de água, além de um aumento significativo na resistência à tração (de 3,9 a 11,9 MPa) e no módulo de Young (de 31,9 a 498,2 MPa) com o aumento na concentração dos nanocristais entre 0 e 30% em massa. Savadekar e colaboradores106 prepararam compósitos de amido termoplástico e nanocristais caracterizando-os quanto as suas propriedades térmicas, mecânicas, de barreira e morfológicas. Os nanocompósitos apresentaram melhorias nas propriedades mecânicas como o aumento de 46% na tensão máxima de ruptura para o nanocompósito contendo apenas 0,4% de nanocristais em massa. Outro ponto importante observado é que os NCCs não exerceram influência no processo de fusão cristalina da matriz de amido e não diminuíram as taxas de permeabilidade ao vapor d'água e ao oxigênio. Dessa forma é possível prever que os NCCs agiram como uma rede que impediu a passagem e difusão dos gases pela matriz, já que, segundo análise de MEV, as nanopartículas apresentaram alta adesão interfacial como resultado da boa dispersão dos NCCs na matriz. Silva e colaboradores107 prepararam biocompósitos à base de amido de mandioca plastificados com sacarose e açúcar invertido e reforçados com NCCs. Os autores verificaram que a presença dos nanocristais induziu a melhorias nas propriedades de resistência à água (diminuindo a solubilidade e inchamento) e nas propriedades mecânicas, como o aumento no módulo elástico em torno de 400% e a resistência à tração superior a 90%, usando apenas entre 0,1 e 0,3% de NCCs. Com a melhoria nas referidas propriedades, os nanocompósitos apresentam a possibilidade de aplicação na área de produção de embalagens alimentícias. Chen e colaboradores108 reforçaram uma matriz de amido termoplástico com nanocristais obtidos de resíduos de casca de batatas. Preparados por meio da metodologia casting, os compósitos foram obtidos nas concentrações de NCCs de 0, 1 e 2% em massa. O resultado da incorporação foi um aumento de 19 e 39% no módulo de elasticidade para os compósitos contendo 1 e 2% dos nanocristais, respectivamente. Zainuddin e colaboradores109 reforçaram compósitos de amido de mandioca com fibras Kenaf (planta tropical similar ao bambu), branqueadas e não-branqueadas, além de nanocristais de celulose produzidos a partir dessas fibras. Preparados por meio de casting e utilizando glicerol e sorbitol como plastificantes, os resultados obtidos para as análises mecânicas e térmicas revelaram que os compósitos obtidos com os NCCs foram os que apresentaram melhores propriedades, com maior resistência à tração (8,2 MPa) para o compósito contendo 6% de NCCs. Isto sugere a existência de uma boa adesão interfacial entre a matriz e as nanopartículas, devido à maior razão de aspecto das nanopartículas comparada com as fibras convencionais. Poli(ε-caprolactona) A poli(ε-caprolactona), PCL, é um polímero hidrofóbico, com baixa temperatura de transição vítrea e tradicionalmente preparado a partir da polimerização por abertura do anel do monômero ε-caprolactona. Por ser um polímero bioabsorvível, seu uso é crescente na área médica e odontológica, sendo utilizado em suturas cirúrgicas, sistema para liberação controlada de fármacos, dispositivos ortopédicos e como suporte na engenharia de tecidos, entre outras aplicações.110 A unidade repetitiva da PCL é mostrada na Figura 4.
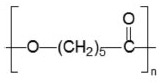 Figura 4. Representação da unidade repetitiva do polímero PCL
Utilizando nanocristais de celulose obtidos a partir de rami, Goffin e colaboradores69 modificaram quimicamente as superfícies desses NCCs enxertando cadeias de PCL por meio da abertura do anel ε-caprolactona em polimerização catalisada por octanoato de estanho [Sn(Oct)2]. Essas nanopartículas funcionalizadas com PCL foram então incorporadas mecanicamente a uma matriz de PCL em extrusora a 120 ºC para obtenção dos compósitos. Os resultados demonstraram que a modificação da superfície dos nanocristais melhorou a adesão interfacial entre as nanopartículas e a matriz. O material resultante apresentou significativa melhoria nas propriedades mecânicas tendo, por exemplo, um aumento de 300% no modulo elástico com a incorporação dos nanocristais. Labet e Thielemans111 também propuseram a modificação química de NCCs utilizando a PCL, porém utilizaram ácido cítrico como catalisador em substituição ao Sn(Oct)2. Foram obtidos quatro vezes mais sítios superficiais modificados com PCL em relação ao catalisador tradicional. Segundo os autores, como é virtualmente impossível remover todo o catalisador ao final da reação, a utilização do novo catalisador representa um avanço em termos de sustentabilidade do processo. Hassan e colaboradores112 incorporaram NCCs modificados com isocianato de n-octadecila em PCL e avaliaram o impacto das nanopartículas modificadas nas propriedades térmicas, mecânicas e de barreira da matriz, além do efeito na biodegrabilidade em solo. Em relação às propriedades térmicas, não foram evidenciadas mudanças nas temperaturas de transição vítrea (Tg) e fusão cristalina da matriz (Tm), enquanto que, para as propriedades mecânicas (tensão máxima, módulo), verificou-se um aumento considerável quando os nanocristais eram adicionados até 5% em massa. Além disso, foi evidenciada uma maior barreira ao vapor d'água para os compósitos. Submetidos ao processo de biodegradação em solo os compósitos apresentaram maior biodegradabilidade em relação à PCL pura, efeito causado pela presença da celulose na matriz, que é consumida rapidamente pelos microrganismos, o que leva a um aumento da porosidade e à perda da integridade da matriz de polímero. A matriz polimérica é assim dividida em partículas menores logo mais susceptível ao ataque por microrganismos do solo. Hidroxipropilmetilcelulose (HPMC) Recentemente, Bilbao et al.113 preparam filmes comestíveis de HPMC reforçados com três diferentes tipos de partículas de celulose: (i) nanofibrilas (NFC), (ii) nanofibrilas oxidadas (NFCt) e (iii) NCCs. Eles avaliaram as propriedades mecânicas, de barreira e de umidade, a capacidade de adsorção/dessorção de água e o seu coeficiente de difusão. Em geral a adição de NFC e NFCt afetou de forma negativa o desempenho dos filmes de HPMC. Por outro lado com os NCCs foi verificado um aumento de 22% na resistência à tração e de 55% no módulo de Young. A adição de NCCs também diminuiu a afinidade dos nanocompósitos por água sem alterar o coeficiente de difusão da molécula. Outra propriedade importante observada para os nanocompósitos à base de NCCs foi a manutenção da transparência, muito importante na aplicação do material em filmes comestíveis.113 Colágeno O primeiro trabalho dedicado ao desenvolvimento de nanocompósitos de colágeno com NCCs foi recentemente publicado por nosso grupo de pesquisa.8 Nesse trabalho a técnica de fabricação de filmes finos automontados (layer-by-layer) foi aplicada para combinar o principal componente de vegetais na forma de nanopartículas (NCCs), com colágeno, o principal componente de tecidos encontrado exclusivamente em animais. O crescimento do filme multicamadas colágeno/NCCs foi monitorado por medidas de UV-Vis e elipsometria, enquanto a morfologia do filme e a rugosidade foram caracterizadas por MEV e microscopia de força atômica (MFA). O crescimento do filme mostrou-se homogêneo com relação à massa de material depositado e à espessura. A espessura de cada camada dupla de material (colágeno e NCCs) foi de 8,6 nm e a massa de colágeno depositado em cada camada foi de 5 mg m-2. As forças de atração intermolecular do tipo ligações de hidrogênio entre os grupos amida do colágeno e os grupos hidroxila dos nanocristais desempenharam papel fundamental no crescimento do filme. A origem natural, a biocompatibilidade e as características observadas tornam esses filmes automontados materiais promissores para o desenvolvimento de matriz extracelular para aplicações na área biomédica.8 Proteína de soja Proteína isolada da soja tem sido usada para preparar diferentes materiais biodegradáveis, incluindo adesivos e plásticos.114 Porém sua aplicação é limitada devido à baixa flexibilidade e alta solubilidade em água. Por um lado, a flexibilidade pode ser facilmente controlada pela adição de plastificantes, como o glicerol. Por outro, a introdução de plastificantes diminui ainda mais a resistência à tração do polímero e, em alguns casos, aumenta ainda mais a sensibilidade à água.115 Em uma matriz de proteína de soja plastificada com glicerol, Wang et al.116 introduziram NCCs com o objetivo de atenuar as propriedades negativas do plastificante. A caracterização dos bionanocompósitos mostrou que os NCCs interagem fortemente com a matriz, gerando um ganho significativo na resistência à tração (40%) e no módulo elástico (201%), na presença de 30% de NCCs, com umidade relativa de 43%. Além disso, a capacidade de absorção de água diminui proporcionalmente com a concentração dos NCCs. Outra observação importante é o aumento significativo da temperatura de transição vítrea de -44,3 para 51,5ºC na presença de 15% de NCCs. Agarose Bionanocompósitos de agarose/NCCs foram primeiramente utilizados para estudo da dinâmica das nanopartículas dentro da matriz.117,118 Recentemente esses materiais foram uniaxialmente dispostos sob condições de umidade controlada e a orientação dos NCCs monitorada por espalhamento de raios-X. Os resultados mostraram que os NCCs têm uma orientação preferencial dentro da matriz e esta é influenciada pela tensão, deformação e umidade. Verificou-se também que o aumento da hidratação do gel, após a reorientação dos NCCs na matriz, evita um aumento crítico da tensão, melhorando a capacidade de deformação que é acompanhado por um moderado alinhamento das nanopartículas. Os estudos indicaram que uma secagem controlada do hidrogel é essencial para estabelecer interações entre a matriz e os nanocristais de celulose, o que permite uma transferência de tensão durante o alongamento e assim promove o seu alinhamento.119 Poli(hidroxioctanoato) - PHO PHO é um elastômero termoplástico amorfo obtido a partir de bactérias do gênero Pseudomonas oleovorans.120 Dubief et al.121 relataram a preparação de bionanocompósitos à base de PHO e nanowhiskers de amido e celulose (tunicato), utilizando o método de evaporação de solvente. Foram obtidos materiais com alto desempenho mecânico e altos valores de módulo de armazenamento, sendo esses resultados atribuídos principalmente à razão de aspecto das nanopartículas e às interações carga-matriz. Dufresne122 utilizou PHO amorfo e semi-cristalino para a preparação de nanocompósitos com os nanocristais de celulose. Os resultados demonstraram que os NCCs são bons agentes de reforço quando se utiliza uma matriz completamente amorfa. Por outro lado nas matrizes semicristalinas foram observadas alterações nas propriedades. Fenômenos interfaciais são os responsáveis pela melhoria das propriedades da matriz quando se utilizam nanorreforços. No caso do PHO semicristalino foi observado um fenômeno de transcristalização da matriz onde os NCCs estavam localizados, impedindo qualquer contato entre as cadeias da parte amorfa e os nanowhiskers de celulose. Alginato Alginatos são polissacarídeos extraídos de algas marrons, sendo uma família de copolímeros não ramificados de unidades de ácido β-D-manurônico (M) e ácido α-L-gulurônico (G).121,123 Atualmente filmes comestíveis preparados com purês de frutas têm recebido atenção, uma vez que o purê conjuga a presença de substâncias formadoras de filmes (como pectina e amido) com as propriedades nutricionais e sensoriais da fruta. Porém esses materiais necessitam de melhores propriedades mecânicas e de barreira a vapor d'água.124,125 Azeredo e colaboradores124 prepararam filmes comestíveis de alginato com purê de acerola plastificado com xarope de milho e estudaram a influência de NCCs de diferentes origens (algodão e coco) nas propriedades de barreira frente a vapor d'água e nas propriedades mecânicas. Foi verificado que, independentemente da origem dos NCCs, filmes modificados com os nanocristais de celulose mostraram aumento na resistência à tração, no módulo elástico e nas propriedades de barreira frente ao vapor d'água. Fibras de alginato apresentam aplicações em sistemas de liberação de fármacos, imobilização de enzimas e inclusive no tratamento de feridas, porém mostram pobre comportamento mecânico. Em um artigo recente, Urena-Benavides e colaboradores126 relataram aumento de 38% na tenacidade e de 123% no módulo de tração de fibras de alginato com a introdução de NCCs a 10% em massa. As imagens obtidas por MEV revelaram um alinhamento no crescimento das fibras ao serem adicionados os nanowhiskers de celulose. Os mesmos autores realizaram estudos de DRX e investigaram o alinhamento das nanopartículas de celulose nas fibras obtidas de nanocompósitos de alginato, fornecendo correlações com as melhorias nas propriedades mecânicas resultantes. Eles verificaram que as nanopartículas se orientam em espiral no interior da matriz em torno do eixo longitudinal, o que resultou em redução na tenacidade e aumento na tensão de ruptura e na dureza das fibras. Segundo os autores a explicação para esse incremento nas propriedades mecânicas se deve ao fato de que a organização das nanopartículas nos compósitos é semelhante à das fibras de celulose, o que é determinante para suas propriedades mecânicas.127 Lin et al.128 prepararam nanocompósitos de alginato, de morfologia esférica, com diferentes nanopartículas de polissacarídeos, incluindo NCCs, e avaliaram como sistema de liberação controlada para a teofilina. A presença dos NCCs, além de aumentar a estabilidade da estrutura da rede tridimensional das microesferas, aumentou a eficiência da encapsulação com promissores perfis de liberação sustentada do fármaco. De acordo com os autores esses resultados são decorrentes da boa dispersão dos NCCs nas microesferas, que restringe o movimento das cadeias do polímero, inibindo a difusão do fármaco e a dissolução e colapso das microesferas.128 Mais recentemente Abdollahi e seus colaboradores129 avaliaram a sensibilidade à água de compósitos à base de alginato e NCCs produzidos a partir de celulose microcristalina. Preparados por casting nas composições 0, 1, 3, 5 e 10% em massa dos nanocristais, os resultados revelaram que os NCCs aumentam consideravelmente a hidrofobicidade da matriz de alginato. Isso se refletiu nos testes de absorção de água e de permeabilidade ao vapor d'água em que, para o compósito contendo 10% de nanocristais, ocorreu um decréscimo de 40% e 17%, respectivamente. Xiloglucano Nas paredes das células vegetais encontram-se diversos polissacarídeos sendo o xiloglucano (XG) um de seus principais componentes em muitas espécies vegetais. A cadeia principal do XG é idêntica à da celulose, ou seja, uma cadeia linear de glicoses com ligações β-1,4, à qual se unem, na forma de ramificações laterais, unidades de xilose ou xilose-galactose. O xiloglucano liga-se às microfibrilas de celulose por meio de ligações de hidrogênio, proporcionando um espaçamento que impede a formação de feixes muito espessos dessas microfibrilas.130 Em 2008, Jean et al.131 prepararam um compósito "verde" com base em multicamadas (filmes layer-by-layer) de nanocristais de celulose/xiloglucano usando uma interação não eletrostática celulose/hemicelulose e apresentaram uma caracterização detalhada dos filmes finos por meio de experimentos de refletividade de nêutrons e medidas por microscopia de força atômica. Lopez e colaboradores132 realizaram um estudo para verificar as interações entre o xiloglucano e a celulose utilizando dois tipos de substratos celulósicos: a celulose microcristalina bacteriana e os NCCs. Foram consideradas diferentes características da estrutura primária de XG, tais como o comprimento da cadeia e a natureza das cadeias laterais, a fim de examinar a influência da estrutura primária na sua capacidade de interação. Os resultados revelaram uma baixa contribuição das interações eletrostásticas para os parâmetros estudados: coeficiente de adsorção e a constante de adsorção segundo o modelo de Langmuir. Além disso, os resultados foram mais pronunciados quando se aumentou a massa molar do XG utilizado.132 Lignina Recentemente Hambardzumyan et al.133 elaboraram um compósito à base de lignina e NCCs para aplicações óticas. Foram preparados sistemas com diferentes concentrações de nanopartículas de celulose que, em proporções adequadas, apresentaram excelentes propriedades óticas, elevada transmitância no espectro visível e ação bloqueadora da radiação ultravioleta. Fibras de lignina preparadas por electrospinning foram também reforçadas com nanocristais de celulose no trabalho de Ago e colaboradores.134 Foram reveladas interações de hidrogênio entre os nanocristais e a lignina nas fibras, o que proporcionou um efeito positivo na estabilidade térmica das fibras. Carragenano Os carragenanos compreendem um grupo de carboidratos extraídos de algas vermelhas, muito utilizados em alimentos e produtos médicos e farmacêuticos. Com boas propriedades formadoras de filmes e alta transparência, esses materiais apresentam pobres propriedades de barreira e mecânicas. Savadekar e colaboradores135 prepararam bionanocompósitos envolvendo esses carboidratos e NCCs cujas concentrações em massa variaram entre 0,1 e 1,0%. As análises obtidas por MEV revelaram a formação de uma rede de nanocristais no compósito cuja concentração era 0,4%, enquanto que, no compósito contendo 1% em massa de NCCs, evidenciou-se a aglomeração das nanopartículas. Com a adição e a boa dispersão dos nanocristais na matriz de carragenano foram evidenciadas melhorias nas propriedades mecânicas, como a resistência à tração, além da redução na permeabilidade ao vapor d'água e gás oxigênio. Xilana As xilanas compreendem o grupo das hemiceluloses mais importantes, apresentando cadeias menores do que as da celulose, com uma estrutura ramificada e com grau de polimerização entre 100 e 200. Espumas à base de xilana e NCCs foram preparadas recentemente por Köhnke e seus colaboradores.136 Nesse trabalho imagens obtidas por MEV revelaram que os nanocristais influenciam na morfologia dos poros durante o processo de solidificação. As propriedades mecânicas das espumas reforçadas com os NCCs mostraram-se superiores às espumas não reforçadas, tanto para os testes de deformação quanto para os de compressão. Fibroína de seda A seda produzida pelo bicho-da-seda Bombyx-mori é composta por dois tipos de proteínas: a primeira, chamada sericina, envolve as fibras, enquanto que a fibroína, o segundo tipo, é o filamento da seda, composto de regiões altamente organizadas com regiões cristalinas e semicristalinas, conferindo, assim, elasticidade a esse material. A utilização desse material se dá, sobretudo, no campo biomédico devido à alta compatibilidade com os diferentes tipos de células, alta permeabilidade para vapor d'água e oxigênio, biodegradabilidade e mínima reação inflamatória.137 Noishiki et al.138 prepararam nanocompósitos de fibroína de seda com NCCs de tunicato por meio do método de evaporação do solvente e observaram que a interação dos NCCs com as cadeias da seda induz a uma mudança conformacional do polímero (de fibroína de seda I para fibroína de seda II), mostrada pelo deslocamento da banda de absorção correspondente à amida I de 1654 para 1625 cm-1. Nesse trabalho foram obtidos filmes homogêneos e com melhorias significativas nas propriedades mecânicas, como, por exemplo, aumento de até 80% na deformação máxima e de 100% no módulo de Young.138 Recentemente nanocompósitos flexíveis e transparentes foram fabricados por meio da mistura de fibroína de seda com poli(etileno glicol) e NCCs obtidos da casca da amoreira. Os NCCs foram efetivamente dispersos na matriz proporcionando significativas melhoras nas propriedades mecânicas do material. O módulo elástico e a resistência à tração aumentaram proporcionalmente com a concentração dos NCCs até um máximo de 12%. Nesta concentração foram observados incrementos de 160 e 80%, respectivamente. Além disso as interações das nanocargas com a matriz foram fortes o suficiente para reduzir a mobilidade das cadeias poliméricas, causando um aumento na temperatura de transição alfa.139 Huang et al.140 prepararam nanofibras de fibroína de seda reforçada com NCCs utilizando eletrospinning. Foi verificado que o tamanho da fibra decresce de 250 nm no material puro para valores entre 77 a 160 nm no material reforçado com NCCs devido ao aumento da condutividade da solução eletrofiada. Eles verificaram também que a resistência à tração e o módulo de armazenamento aumentaram quase que linearmente com a concentração de NCCs (0 a 4%), passando de 12 para 38 MPa e de 320 para 1250 MPa, respectivamente.
CONSIDERAÇÕES FINAIS Nanocompósitos formados por polímeros biodegradáveis e NCCs tem sido preparados em diferentes formatos (filmes, cápsulas, esferas e fibras) por meio de diferentes técnicas aplicáveis à escala laboratorial como evaporação de solvente, filmes automontados e eletrofiação. Em muitos desses trabalhos, a incorporação das nanopartículas de celulose acarretou melhorias significativas em propriedades como de barreira, térmicas e mecânicas. Muitos estudos visando à preparação de nanocompósitos com efetiva transferência das excelentes propriedades mecâncias dos NCCs para polímeros biodegradáveis demonstram que a funcionalização e o ancoramento de moléculas e cadeias poliméricas na superfície dos NCCs têm sido, em geral, as melhores alternativas com o objetivo de incrementar a adesão interfacial e a compatibilidade entre as nanopartículas e os polímeros biodegradáveis. Dentre as potenciais aplicações dos materiais compósitos poliméricos à base de polímeros biodegradáveis e NCCs, destacam-se os usos em embalagens para alimentos e na área biomédica, bem como na engenharia de tecidos e na fabricação de dispositivos transportadores de fármacos. Apesar das grandes expectativas com relação ao uso em larga escala das nanopartículas obtidas de fonte renovável, destacamos que ainda existem dois grandes desafios a serem vencidos para a efetiva utilização dos NCCs em escala industrial nos próximos anos: diminuição dos custos do processo de extração das nanopartículas de celulose e sua adequada compatibilização às matrizes poliméricas de diferentes naturezas.
AGRADECIMENTOS Os autores agradecem à Capes (Nanobiotec - EDT Nº 04/2008) pelo auxílio financeiro.
REFERÊNCIAS 1. Moon, R. J.; Martini, A.; Nairn, J.; Simonsen, J.; Youngblood, J.; Chem. Soc. Rev. 2011, 40, 3941. 2. Habibi, Y.; Lucia, L. A.; Rojas, O. J.; Chem. Rev. 2010, 110, 3479. 3. Klemm, D.; Kramer, F.; Moritz, S.; Lindstrom, T.; Ankerfors, M.; Gray, D.; Dorris, A.; Angew. Chem. Int. Ed. 2011, 50, 5438. 4. Lin, N.; Huang, J.; Dufresne, A.; Nanoscale 2012, 4, 3274. 5. Eichhorn, S. J.; Soft Matter 2011, 7, 303. 6. Samir, M.; Alloin, F.; Dufresne, A.; Biomacromolecules 2005, 6, 612. 7. Silva, R.; Haraguchi, S. K.; Muniz, E. C.; Rubira, A. F.; Quim. Nova 2009, 32, 661. 8. de Mesquita, J. P.; Patricio, P. S.; Donnici, C. L.; Petri, D. F. S.; de Oliveira, L. C. A.; Pereira, F. V.; Soft Matter 2011, 7, 4405. 9. Ranby, B. G.; Acta Chem. Scand. 1949, 3, 649. 10. Ranby, B. G.; Ribi, E.; Experientia 1950, 6, 12. 11. Ranby, B. G.; Discuss. Faraday Soc. 1951, 11, 158. 12. Nickerson, R. F.; Habrle, J. A.; Ind. Eng. Chem. 1947, 39, 1507. 13. Mukherjee, S. M.; Sikorski, J.; Woods, H. J.; J. Text. Inst. 1952, 43, T196. 14. Mukherjee, S. M.; Woods, H. J.; Biochim. Biophys. Acta 1953, 10, 499. 15. Filson, P. B.; Dawson-Andoh, B. E.; Schwegler-Berry, D.; Green Chem. 2009, 11, 1808. 16. Filson, P. B.; Dawson-Andoh, B. E.; Bioresour. Technol. 2009, 100, 2259. 17. Oksman, K.; Mathew, A. P.; Bondeson, D.; Kvien, I.; Compos. Sci. Technol. 2006, 66, 2776. 18. Man, Z.; Muhammad, N.; Sarwono, A.; Bustam, M. A.; Kumar, M. V.; Rafiq, S.; J. Polym. Environ. 2011, 19, 726. 19. Siqueira, G.; Bras, J.; Dufresne, A.; Polymers 2010, 2, 728. 20. Siqueira, G.; Bras, J. Dufresne, A.; Biomacromolecules 2009, 10, 425. 21. Sadeghifar, H.; Filpponen, I.; Clarke, S.; Brougham, D.; Argyropoulos, D.; J. Mater. Sci. 2011, 46, 7344. 22. Araki, J.; Wada, M.; Kuga, S.; Okano, T.; Colloid Surface A 1998, 142, 75. 23. Roman, M.; Winter, W. T.; Biomacromolecules 2004, 5, 1671. 24. Teixeira, E. d. M.; Oliveira, C. R. d.; Mattoso, L. H. C.; Corrêa, A. C.; Paladin, P. D.; Polímeros 2010, 20, 264. 25. Araki, J.; Wada, M.; Kuga, S.; Okano, T.; Langmuir 2000, 16, 2413. 26. Araki, J.; Wada, M.; Kuga, S.; Okana, T.; J. Wood Sci. 1999, 45, 258. 27. Elazzouzi-Hafraoui, S.; Nishiyama, Y.; Putaux, J. L.; Heux, L.; Dubreuil, F.; Rochas, C.; Biomacromolecules 2008, 9, 57. 28. de Mesquita, J. P.; Donnici, C. L.; Pereira, F. V.; Biomacromolecules 2010, 11, 473. 29. Araki, J.; Wada, M.; Kuga, S.; Langmuir 2001, 17, 21. 30. Dong, X. M.; Kimura, T.; Revol, J. F.; Gray, D. G.; Langmuir 1996, 12, 2076. 31. Heux, L.; Chauve, G.; Bonini, C.; Langmuir 2000, 16, 8210. 32. De Souza Lima, M. M.; Wong, J. T.; Paillet, M.; Borsali, R.; Pecora, R.; Langmuir 2002, 19, 24. 33. Miller, A. F.; Donald, A. M.; Biomacromolecules 2003, 4, 510. 34. Capadona, J. R.; Shanmuganathan, K.; Triftschuh, S.; Seidel, S.; Rowan, S. J.; Weder, C., Biomacromolecules 2009, 10, 712. 35. Pranger, L.; Tannenbaum, R.; Macromolecules 2008, 41, 8682. 36. Habibi, Y.; Goffin, A. L.; Schiltz, N.; Duquesne, E.; Dubois, P.; Dufresne, A.; J. Mater. Chem. 2008, 18, 5002. 37. de Menezes, A. J.; Siqueira, G.; Curvelo, A. A. S.; Dufresne, A.; Polymer 2009, 50, 4552. 38. de Rodriguez, N. L. G.; Thielemans, W.; Dufresne, A.; Cellulose 2006, 13, 261. 39. Revol, J.-F; Carbohyd. Polym. 1982, 2, 123. 40. Johara, N.; Ahmada, I.; Dufresne, A; Ind. Crop. Prod. 2012, 37, 93. 41. de Teixeira, E. M.; Bondância, T. J.; Teodoro, K. B. R.; Corrêa, A. C.; Marconcini, J. M.; Mattoso, L. H. C.; Ind. Crop. Prod. 2011, 33, 63. 42. Bras, J.; Hassan, M. L.; Bruzesse, C.; Hassan, E. A.; El-Wakil, N. A.; Dufresne, A.; Ind. Crop. Prod. 2010, 32, 3. 43. Iwamoto, S.; Kai, W. H.; Isogai, A.; Iwata, T.; Biomacromolecules 2009, 10, 2571. 44. Sturcova, A.; Davies, G. R.; Eichhorn, S. J.; Biomacromolecules 2005, 6, 1055. 45. Hamad, W. Y.; Eichhorn, S.; J. Eng. Mat. Tech. 1997, 119, 309. 46. Callister, W.; Materials Science and Engineering: An Introduction. Wiley: 2006. 47. Kawabata, M. S; Kotani, T; Katsuma K; Niwa, M; Xiaoxin C; Resumos da 9th International Conference on Composite Materials, Itália, 1993. 48. Yu, M. F.; Lourie, O.; Dyer, M. J.; Moloni, K.; Kelly, T. F.; Ruoff, R. S.; Science 2000, 287, 637. 49. Salvetat, J. P.; Bhattacharyya, S.; Pipes, R. B.; J. Nanosci. Nanotechnol. 2006, 6, 1857. 50. Lavall, R. L.; de Sales, J. A.; Borges, R. S.; Calado, H. D. R.; Machado, J. C.; WindmöllerI, D.; Silva, G. G.; Lacerda, R. G.; Ladeira, L. O.; Quim. Nova 2010, 33, 133. 51. Spinacé, M. A. S.; Janeiro, L. G.; Bernardino, F. C.; Grossi, T. A.; Paoli, M.-A. D.; Pol. Sci. Technol. 2011, 21, 168. 52. Rusli, R.; Eichhorn, S. J.; Appl. Phys. Lett. 2008, 93, 033111. 53. Villanova, J. C. O.; Lima, T. H.; Patrício, P. S.; Pereira, F. V.; Ayres, E.; Quim. Nova 2012, 35, 124. 54. http://www.fpinnovations.ca/, acessada em Agosto 2013. 55. Tate, J. S.; Akinola, A. T.; Kabakov, D.; Journal Of Technology Studies 2009, 35, 25. 56. Favier, V.; Chanzy, H.; Cavaille, J. Y.; Macromolecules 1995, 28, 6365. 57. Favier, V.; Canova, G. R.; Cavaille, J. Y.; Chanzy, H.; Dufresne, A.; Gauthier, C.; Polym. Adv. Technol. 1995, 6, 351. 58. Petersson, L.; Oksman, K.; Compos. Sci. Technol. 2006, 66, 2187. 59. Li, Q.; Zhou, J. P.; Zhang, L. N.; J. Polym. Sci. Pol. Phys. 2009, 47, 1069. 60. Dufresne, A.; Molecules 2010, 15, 4111. 61. Blaker, J. J.; Lee, K. Y.; Mantalaris, A.; Bismarck, A.; Compos. Sci. Technol. 2010, 70, 1879. 62. Jonoobi, M.; Harun, J.; Mathew, A. P.; Oksman, K.; Compos. Sci. Technol. 2010, 70, 1742. 63. Liu, D. Y.; Yuan, X. W.; Bhattacharyya, D.; Easteal, A. J.; Express Polym. Lett. 2010, 4, 26. 64. Pandey, J. K.; Lee, C. S.; Ahn, S. H.; J. App. Polym. Sci. 2010, 115, 2493. 65. Qu, P.; Gao, Y. A.; Wu, G. F.; Zhang, L. P.; Bioresources 2010, 5, 1811. 66. Sanchez-Garcia, M.; Lagaron, J.; Cellulose 2010, 17, 987. 67. Tingaut, P.; Zimmermann, T.; Lopez-Suevos, F.; Biomacromolecules 2010, 11, 454. 68. Frone, A. N.; Berlioz, S.; Chailan, J. F.; Panaitescu, D. M.; Donescu, D.; Polym. Compos. 2011, 32, 976. 69. Goffin, A. L.; Raquez, J. M.; Duquesne, E.; Siqueira, G.; Habibi, Y.; Dufresne, A.; Dubois, P.; Biomacromolecules 2011, 12, 2456. 70. Lin, N.; Huang, J.; Chang, P. R.; Feng, J. W.; Yu, J. H.; Carbohyd. Polym. 2011, 83, 1834. 71. Tome, L. C.; Pinto, R. J. B.; Trovatti, E.; Freire, C. S. R.; Silvestre, A. J. D.; Neto, C. P.; Gandini, A.; Green Chem. 2011, 13, 419. 72. Fortunati, E.; Armentano, I.; Zhou, Q.; Iannoni, A.; Saino, E.; Visai, L.; Berglund, L. A.; Kenny, J. M.; Carbohyd. Polym. 2012, 87, 1596. 73. Hossain, K. M. Z.; Ahmed, I.; Parsons, A. J.; Scotchford, C. A.; Walker, G. S.; Thielemans, W.; Rudd, C. D.; J. Mater. Sci. 2012, 47, 2675. 74. Liu, D. Y.; Yuan, X. W.; Bhattacharyya, D.; J. Mater. Sci. 2012, 47, 3159. 75. Raquez, J. M.; Murena, Y.; Goffin, A. L.; Habibi, Y.; Ruelle, B.; DeBuyl, F.; Dubois, P.; Compos. Sci. Technol. 2012, 72, 544. 76. Lin, N.; Huang, J.; Chang, P. R.; Feng, J.; Yu, J.; Carbohyd. Polym. 2011, 83, 1834. 77. Petersson, L.; Kvien, I.; Oksman, K.; Compos. Sci. Technol. 2007, 67, 2535. 78. Lin, N.; Chen, G. J.; Huang, J.; Dufresne, A.; Chang, P. R.; J. App. Polym. Sci. 2009, 113, 3417. 79. de Paula, E. L.; Mano, V.; Pereira, F. V.; Polym. Degrad. Stab. 2011, 96, 1631. 80. Fortunati, E.; Peltzer, M.; Armentano, I.; Torre, L.; Jimenez, A.; Kenny, J. M.; Carbohyd. Polym. 2012, 90, 948. 81. Fortunati, E.; Armentano, I.; Zhou, Q.; Puglia, D.; Terenzi, A.; Berglund, L. A.; Kenny, J. M.; Polym. Degrad. Stab. 2012, 97, 2027. 82. Shi, Q. F.; Zhou, C. J.; Yue, Y. Y.; Guo, W. H.; Wu, Y. Q.; Wu, Q. L.; Carbohyd. Polym. 2012, 90, 301. 83. Zhou, C.; Shi, Q.; Guo, W.; Terrell, L.; Qureshi, A. T.; Hayes, D. J. Wu, Q.; ACS Appl. Mater. Interfaces 2013, 5, 3847. 84. Pirani, S.; Abushammala, H.M. N.; Hashaikeh, R. J. Appl. Polym. Sci.; 2013, DOI: 10.1002/APP.39576. 85. Hein, S.; Wang, K.; Stevens, W. F.; Kjems, J.; Mater. Sci. Technol. 2008, 24, 1053. 86. Kumar, M. N. V. R.; Muzzarelli, R. A. A.; Muzzarelli, C.; Sashiwa, H.; Domb, A. J.; Chem. Rev. 2004, 104, 6017. 87. Venkatesan, J.; Kim, S.-K.; Mar. Drugs 2010, 8, 2252. 88. Laranjeira, M. C. M.; Fávere, V. T.; Quim. Nova 2009, 32, 672. 89. Rhim, J.-W.; Hong, S.-I.; Park, H.-M.; Ng, P. K. W.; J. Agr. Food Chem. 2006, 54, 5814. 90. Dutta, P. K.; Tripathi, S.; Mehrotra, G. K.; Dutta, J.; Food Chem. 2009, 114, 1173. 91. Azeredo, H. M. C.; Mattoso, L. H. C.; Avena-Bustillos, R. J.; Filho, G. C.; Munford, M. L.; Wood, D.; McHugh, T. H.; J. Food Sci. 2010, 75, N1. 92. de Mesquita, J. P.; Donnici, C. L.; Teixeira, I. F.; Pereira, F. V.; Carbohyd. Polym. 2012, 90, 210. 93. Spagnol, C.; Rodrigues, F. H. A.; Pereira, A. G. B.; Fajardo, A. R.; Rubira, A. F.; Muniz, E. C.; Carbohyd. Polym. 2012, 87, 2038. 94. Ten, E.; Turtle, J.; Bahr, D.; Jiang, L.; Wolcott, M.; Polymer 2010, 51, 2652. 95. Ten, E.; Bahr, D. F.; Li, B.; Jiang, L.; Wolcott, M. P.; Ind. Eng. Chem. Res. 2012, 51, 2941. 96. Yu, H. Y.; Qin, Z. Y.; Zhou, Z.; Prog. Nat. Sci. -Mater. Int. 2011, 21, 478. 97. Yu, H. Y.; Qin, Z. Y.; Liu, Y.; Chen, L.; Liu, N.; Zhou, Z.; Carbohyd. Polym. 2012, 89, 971. 98. Ten, E.; Jiang, L.; Wolcott, M.; Carbohyd. Polym. 2013, 92, 206. 99. Patricio, P. S. O.; Pereira, F. V.; dos Santos, M. C.; de Souza, P. P.; Roa, J. P. B.; Orefice, R. L.; J. App. Polym. Sci. 2013, 127, 3613. 100. Ó, R. F.; Andrade, C. T.; Quim. Nova 2012, 35, 1146. 101. Marengo, V. A.; Vercelheze, A. E. S.; Mali, S.; Quim. Nova 2013, 36, 680. 102. Angles, M. N.; Dufresne, A.; Macromolecules 2000, 33, 8344. 103. Mathew, A. P.; Dufresne, A.; Biomacromolecules 2002, 3, 609. 104. Lu, Y. S.; Weng, L. H.; Cao, X. D.; Macromol. Biosci. 2005, 5, 1101. 105. Cao, X.; Chen, Y.; Chang, P. R.; Stumborg, M.; Huneault, M. A.; J. App. Polym. Sci. 2008, 109, 3804. 106. Savadekar, N.; Mhaske, S.; Carbohyd. Polym. 2012, 89, 146. 107. da Silva, J. B. A.; Pereira, F. V.; Druzian, J. I.; J. Food Sci. 2012, 77, N14. 108. Chen, D.; Lawton, D.; Thompson, M. R.; Liu, Q.; Carbohyd. Polym. 2012, 90, 709. 109. Zainuddin, S. Y. Z.; Ahmad, I.; Kargarzadeh, H.; Compos. Interface 2013, 20, 189. 110. Souza, P. M. S.; Lobo, F. A.; Rosa, A. H.; Fraceto, L. F.; Quim. Nova 2012, 35, 132. 111. Labet, M.; Thielemans, W.; Polym. Chem. 2012, 3, 679. 112. Hassan, M. L.; Bras, J.; Hassan, E. A.; Fadel, S. M.; Dufresne, A.; J. App. Polym. Sci. 2012, 125, E10. 113. Bilbao-Sainz, C.; Bras, J.; Williams, T.; Senechal, T.; Orts, W., Carbohyd. Polym. 2011, 86, 1549. 114. Kumar, R.; Choudhary, V.; Mishra, S.; Varma, I. K.; Mattiason, B.; Ind. Crop. Prod. 2002, 16, 155. 115. Wang, S.; Sue, H. J.; Jane, J.; J. Macromol. Sci. A 1996, 33, 557. 116. Wang, Y. X.; Cao, X. D.; Zhang, L. N.; Macromol. Biosci. 2006, 6, 524. 117. Bica, C. I. D.; Borsali, R.; Geissler, E.; Rochas, C.; Macromolecules 2001, 34, 5275. 118. Bica, C. I. D.; Borsali, R.; Rochas, C.; Geissler, E; Macromolecules 2006, 39, 3622. 119. Osorio-Madrao, A.; Eder, M.; Rueggeberg, M.; Pandey, J. K.; Harrington, M. J.; Nishiyama, Y.; Putaux, J. L.; Rochas, C.; Burgert, I.; Biomacromolecules 2012, 13, 850. 120. Dufresne, A.; Samain, E.; Macromolecules 1998, 31, 6426. 121. Dubief, D.; Samain, E.; Dufresne, A.; Macromolecules 1999, 32, 5765. 122. Dufresne, A.; Compos. Interfaces 2000, 7, 53. 123. Moe, S. T.; Skjakbraek, G.; Elgsaeter, A.; Smidsrod, O.; Macromolecules 1993, 26, 3589. 124. Azeredo, H. M. C.; Miranda, K. W. E.; Rosa, M. F.; Nascimento, D. M.; de Moura, M. R.; LWT-Food Sci. Technol. 2012, 46, 294. 125. Azeredo, H. M. C.; Mattoso, L. H. C.; Wood, D.; Williams, T. G.; Avena-Bustillos, R. J.; McHugh, T. H.; J. Food Sci. 2009, 74, N31. 126. Urena-Benavides, E. E.; Brown, P. J.; Kitchens, C. L.; Langmuir 2010, 26, 14263. 127. Urena-Benavides, E. E.; Kitchens, C. L.; Macromolecules 2011, 44, 3478. 128. Lin, N.; Huang, J.; Chang, P. R.; Feng, L. D.; Yu, J. H.; Colloids Surf., B 2011, 85, 270. 129. Abdollahi, M.; Alboofetileh, M.; Behrooz, R.; Rezaei, M.; Miraki, R.; Int. J. Biol. Macromol. 2013, 54, 166. 130. Oliveira Junior, C. J. F.; Braga, M. R.; Buckeridge, M. S.; Hoehnea 2006, 33, 239. 131. Jean, B.; Heux, L.; Dubreuil, F. d. r.; Chambat, G. R.; Cousin, F.; Langmuir 2008, 25, 3920. 132. Lopez, M.; Bizot, H.; Chambat, G.; Marais, M. F.; Zykwinska, A.; Ralet, M. C.; Driguez, H.; Buleon, A.; Biomacromolecules 2010, 11, 1417. 133. Hambardzumyan, A.; Molinari, M.; Dumelie, N.; Foulon, L.; Habrant, A.; Chabbert, B.; Aguie-Beghin, V.; C. R. Biol. 2011, 334, 839. 134. Ago, M.; Okajima, K.; Jakes, J. E.; Park, S.; Rojas, O. J.; Biomacromolecules 2012, 13, 918. 135. Savadekar, N. R.; Karande, V. S.; Vigneshwaran, N.; Bharimalla, A. K.; Mhaske, S. T.; Int. J. Biol. Macromol. 2012, 51, 1008. 136. Kohnke, T.; Lin, A.; Elder, T.; Theliander, H.; Ragauskas, A. J.; Green Chem. 2012, 14, 1864. 137. Altman, G. H.; Jakuba, C.; Calabro, T.; Horan, R. L.; Chen, J.; Lu, H.; Richmond, J.; Kaplan, D. L.; Biomaterials 2003, 24, 401. 138. Noishiki, Y.; Nishiyama, Y.; Wada, M.; Kuga, S.; Magoshi, J.; J. App. Polym. Sci. 2002, 86, 3425. 139. Li, R. J.; Zhang, Y. H.; Zhu, L. J.; Yao, J. M.; J. App. Polym. Sci. 2012, 124, 2080. 140. Huang, J.; Liu, L.; Yao, J.; Fiber Polym. 2011, 12, 1002. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





