Educação
|
|
| Resgatando um método eficiente para determinação do ponto de ebulição de substâncias orgânicas: percolador versus Siwoloboff Reviving an efficient method for determining the boiling point of organic substances: percolator versus Siwoloboff |
|
Flaviana Rodrigues Fintelman Dias; Wanderson Amaral da Silva; Vinícius Rangel Campos; Anna Claudia Cunha; Vitor Francisco Ferreira; Nelson Ângelo de Souza*
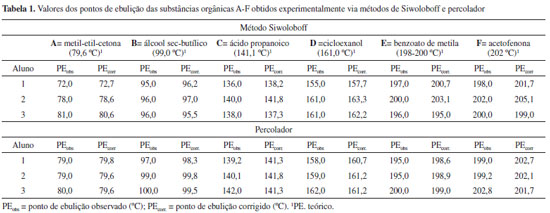
Departamento de Química Orgânica, Instituto de Química, Universidade Federal Fluminense, Outeiro de São João Batista, 24020-141 Niterói - RJ, Brasil Recebido em 05/12/2013 *e-mail: nelsonangelo@oi.com.br The aim of this paper was to revive the accurate determination of the boiling point of organic compounds using the percolator technique developed in the 1960s. Although this method is simple, fast and efficient it is omitted from current textbooks. This method has several advantages over Siwoloboff such as high reproducibility and direct measurement of the boiling point of the sample obtained by observing the temperature of the vapor-liquid equilibrium. The experiments were performed in the organic chemistry laboratory but allow interdisciplinary integration with other disciplines of several academic areas. INTRODUÇÃO Em um laboratório dentre as propriedades físicas utilizadas pelos químicos orgânicos destacam-se os pontos de fusão e ebulição como critérios básicos na determinação do grau de pureza de substâncias orgânicas. Estas constantes físicas são propriedades intrínsecas de cada substância e o intervalo de fusão ou de ebulição geralmente constitui um índice valioso da pureza da amostra.1,2 Em especial, a determinação do ponto ebulição empregando pequena quantidade de amostra é usualmente realizada pelo método de Siwoloboff (Figuras 1a-c). Este é erroneamente citado como de Thiele, sendo que, na verdade, este nome representa o tubo de vidro munido de um braço lateral (Figura 1a) no qual se realiza o aquecimento do fluido contido no mesmo, como, por exemplo, óleo mineral, óleo de silicone ou glicerina. Ao tubo de Thiele é inserido um microtubo, que se encontra ajustado ao termômetro com assistência de um anel de borracha, contendo o líquido cujo ponto de ebulição se deseja analisar e um capilar selado, de forma que a extremidade aberta fique voltada para baixo (Figura 1a).1-4
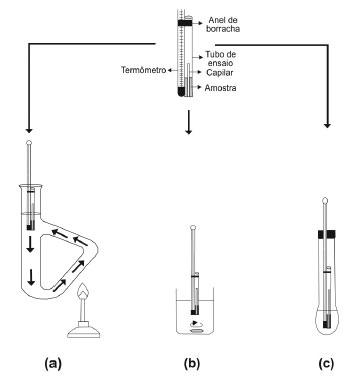 Figura 1. Método de Siwoloboff com diferentes dispositivos de aquecimento: a) tubo de Thiele; b) béquer e c) tubo de ensaio
A forma do tubo de Thiele, inventada pelo químico alemão Johannes Thiele, e o aquecimento no braço lateral permitem a formação de correntes de convecção no fluido óleo (Figura 1a). Este fato mantém uma temperatura uniforme em todo o fluido óleo. A temperatura do banho é elevada vagarosamente (cerca de 4 a 5 ºC por minuto) até que se observe um fluxo contínuo de bolhas sair do capilar. Diante da dificuldade da percepção do início do fluxo contínuo de bolhas (rosário de bolhas), que já é o ponto de ebulição da amostra, recomenda-se cessar o aquecimento e observar a temperatura registrada no termômetro no momento em que parar o borbulhamento constante e o líquido começar a subir no capilar.1-4 Neste instante é determinado o ponto de ebulição do líquido, que é a temperatura na qual a pressão de vapor do líquido se iguala a pressão atmosférica. Cabe ressaltar que esta constante física pode sofrer variação com a altitude, uma vez que a pressão atmosférica varia com a mesma. Quanto mais baixa for a pressão do sistema, menor será a temperatura de ebulição do líquido.5 Nas Figuras 1b-c, o método de Siwoloboff utiliza as aparelhagens de vidro béquer e tubo de ensaio, respectivamente, como dispositivos para o banho de aquecimento. Na Figura 1a está mostrado como proceder ao aquecimento correto do tubo Thiele. Outro método pouco conhecido no meio científico consiste na utilização de um tubo de ensaio contendo líquido para a determinação do ponto de ebulição e uma peça de vidro conhecida como percolador,6 conforme ilustrado na Figura 2. Esta se assemelha a uma "ampulheta", um material de vidro constituído de dois recipientes cônicos que se comunicam entre si por um pequeno orifício, sem as duas bases e tem dimensões de aproximadamente 2,5 cm de altura e 0,8-1,0 cm de diâmetro.
 Figura 2. Aparelhagem de determinação do ponto de ebulição pelo método percolador
Nesta técnica, o percolador (Figura 2) propicia uma medida direta de registro da temperatura de ebulição da amostra que é atingida no momento em que as pressões de vapor do líquido e atmosférica se igualam. Estranhamente, não sabemos o porquê do esquecimento de uma técnica de fácil execução, eficiente e confiável não ser mais explorada nos atuais livros didáticos de química orgânica. O método Siwoloboff amplamente usado nas Instituições de Ensino, por envolver a medida da temperatura do fluido e não da amostra, geralmente induz a erros sistemáticos que serão discutidos mais adiante no escopo deste trabalho. Ao contrário, o dispositivo do percolador confere ao aluno maior segurança na determinação desta constante física, uma vez que o termômetro está diretamente em contato com o vapor da amostra minimizando os prováveis erros sistemáticos. Diante deste contexto, com o intuito de motivar e facilitar o aprendizado do aluno com confiabilidade, este trabalho tem por objetivo resgatar o uso do dispositivo percolador como uma técnica precisa na determinação do ponto de ebulição de substâncias orgânicas.
EXPERIMENTAL Método Siwoloboff Material
Procedimento Inicia-se o experimento prendendo-se, com o auxílio do anel de borracha, o microtubo de ensaio no termômetro, de forma que o fundo do microtubo fique alinhado com o bulbo do termômetro. Em seguida adiciona-se ao microtubo de ensaio 5 gotas do líquido a ser analisado e o capilar previamente selado, conforme a Figura 1a. Introduz-se, no tubo de Thiele contendo o banho de óleo, o microtubo anexado ao termômetro. Deve-se aquecer o banho de óleo na extremidade do tubo de Thiele vagarosamente. No início, pequenas bolhas são liberadas do tubo capilar. Continua-se o aquecimento a uma velocidade constante até observar uma corrente rápida e contínua de bolhas (colar de bolhas) saindo do tubo capilar. Nesse ponto deve-se interromper o aquecimento. O banho começa a esfriar lentamente e a velocidade de borbulhamento também decresce. Registra-se a temperatura do termômetro no momento em que cessar o borbulhamento e o líquido começar a subir no capilar. Este é o ponto de ebulição da amostra. Método do percolador Material
Procedimento Inicia-se o experimento introduzindo ao tubo de ensaio o percolador, e, em seguida, adiciona-se uma quantidade suficiente do líquido a ser analisado de forma que a linha do líquido não ultrapasse a parte "estrangulada", conforme a Figura 2. O termômetro deverá ser inserido no interior do percolador de modo que o seu bulbo não obstrua seu orifício. O tubo de ensaio é colocado no béquer contendo um banho de aquecimento. A altura do banho de óleo deverá estar no mesmo nível ou um pouco acima do nível da amostra. Inicia-se o aquecimento do sistema e registra-se a temperatura do termômetro no momento em que a mesma se mantiver constante. Este é o ponto de ebulição da amostra.
RESULTADOS E DISCUSSÃO Neste trabalho foram determinados os pontos de ebulição de seis substâncias orgânicas, inicialmente codificadas como A-F, pelos métodos de Siwoloboff e percolador. As medidas de todas as amostras foram feitas por três alunos do curso de química. As substâncias tiveram as suas nomenclaturas divulgadas conforme mostrado na Tabela 1, após o término dos experimentos. Este fato tem por finalidade avaliar a eficiência dos métodos utilizando amostras preliminarmente desconhecidas pelos alunos.
Na busca pela exatidão e precisão dos valores dos pontos de ebulição das amostras supracitadas com o mínimo de erros experimentais possíveis, tornou-se imprescindível a aferição do termômetro por meio da curva de calibração. Para esta finalidade, os pontos de fusão e ebulição experimentais (abscissa) da água foram utilizados como referência.1,2 Cabe ressaltar que diante da falta de disponibilidade de substâncias padrões nos laboratórios de graduação, que permitam obter um maior número de pontos para elaboração da curva de calibração, normalmente nas instituições de ensino, recorrem-se às propriedades físicas da água destilada para à aferição do termômetro,7 conforme mostrada na Figura 3. Sendo assim, os valores dos pontos de fusão e ebulição da água são plotados contra os valores teóricos (ordenada), e traça-se a linha AB que passa pelos pontos.
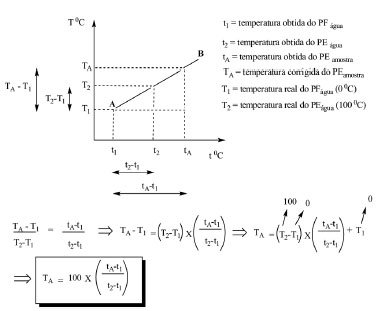 Figura 3. Equação da reta do experimento de calibração do termômetro
De uma forma articulada este experimento permitiu uma integração interdisciplinar, que foi gerada a partir do gráfico de curva de calibração, conforme mostrado na Figura 3. Esta equação foi usada para as correções dos valores dos pontos de ebulição obtidos das amostras A-F (Tabela 1). Uma vez determinada a calibração do termômetro, os pontos de ebulição das amostras A-F foram obtidos experimentalmente pelos dois métodos. Os valores das constantes físicas de A-F e as respectivas descodificações destas substâncias encontram-se discriminados na Tabela 1. Na tabela, ao compararmos as triplicatas dos valores dos pontos de ebulição obtidos experimentalmente de cada substância pelos métodos Siwoloboff e do percolador, pôde-se perceber que este último permitiu uma maior reprodutibilidade entre as medidas desta constante física, além de se aproximar dos valores encontrados na literatura.8 Durante a realização do experimento pelo método de Siwoloboff foi observado que os três alunos encontraram dificuldades na visualização do início do rosário de bolhas constantes e na observação do mesmo concomitantemente com a temperatura. Estes fatos também se refletem durante a realização deste experimento nas turmas de química orgânica experimentais das Instituições de Ensino. Os facilitadores de aprendizado do aluno muita das vezes são obrigados a divulgar o resultado do ponto ebulição de uma amostra desconhecida pelo método 1, em função da dificuldade e insegurança do discente. Portanto, este se vê obrigado a efetuar diversas vezes o experimento, com o intuito de obter a média dos valores encontrados. Estes valores nem sempre são reprodutíveis, corroborando para a sua insegurança. Outros fatores que contribuem para a falta de reprodutibilidade na determinação do ponto de ebulição das substâncias A-F pelo método de Siwoloboff são descritos a seguir:
CONCLUSÃO Este trabalho visou comparar duas técnicas de determinação de ponto de ebulição de substâncias orgânicas. A primeira consiste no método de Siwoloboff, que é um dos mais empregados nas Instituições de Ensino de Química. O outro método, pouco conhecido no meio acadêmico, utiliza um dispositivo denominado percolador que se assemelha a uma "ampulheta", um material de vidro constituído de dois recipientes cônicos que se comunicam entre si por um pequeno orifício, sem as duas bases. Exceto na quantidade de amostra utilizada, o método do percolador possui várias vantagens, tais como: maior confiabilidade, maior reprodutibilidade e didaticamente permite ao aluno visualizar, com maior exatidão, o ponto de ebulição de um líquido. Por ser uma medida direta, o termômetro mede a temperatura do vapor do líquido cujo ponto de ebulição está sendo determinado. Ao contrário, o ponto de ebulição determinado pelo método de Siwoloboff é uma medida indireta, uma vez que a temperatura observada é a do aquecimento do fluido e não do vapor da amostra. Este fato induz a erros de precisão da medida, causando a insegurança do aluno. Este trabalho teve como objetivo resgatar o método que utiliza o percolador, que apesar de antigo e não constar nos livros modernos de química orgânica experimental, se mostrou de grande valia ao aprendizado do aluno.
AGRADECIMENTOS Faperj, CNPQ, CAPES, UFF e Programa de Pós Graduação em Química-UFF.
BIBLIOGRAFIA 1. Soares, B. G.; Souza, N. A.; Pires, D. X.; Química Orgânica: Teoria e Técnicas de preparação, purificação e identificação de compostos orgânicos, Guanabara: Rio de Janeiro, 1988. 2. Vogel, A. I.; Qualitative Organic Analysis, vol. 2, 2nd ed., Longman: London, 1966. 3. Roberts, R. M.; Gilbert, J. C.; Rodewald, L. B.; Wingrove, A. S.; Modern Experimental Organic Chemistry, 4th ed., Holt-Sauders International Editions: New York, 1985. 4. Engel, R. G.; Kriz, G. S.; Lampman, G. M.; Pavia, D. L.; Quimica Orgânica Experimental: Técnicas de pequena escala, 3ª ed., Cengagel Learning: São Paulo, 2012. 5. Atkins, P. W.; Paula, J.; Atkins Físico-Química, vol. 1, 8ª ed., LTC: Rio de Janeiro, 2008. 6. Shriner, R. L; Fuson, R. C.; Curtin, D. Y.; Identificación de compuestos orgánicos, Limusa-Wiley S.A.: México, 1966. 7. Pires, D. P. L.; Afonso, J. C.; Chaves, F. A. B.; Quim. Nova 2006, 29, 1393. 8. Budavari, S.; The Merck Index an Encyclopedia of Chemicals, Drugs and Biologicals, 11th ed., Merck & Co: New Jersey, 1989. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access