Educação
|
|
| Construção de eletrodo de grafite retirado de pilha comum: aplicações didáticas Construction of a graphite electrode removed from common batteries: didactic applications |
|
José Augusto Fragale Baio; Luiz Antônio Ramos; Éder Tadeu Gomes Cavalheiro*
Instituto de Química de São Carlos, Universidade de São Paulo, Avenida Trabalhador São-carlense, 400, CP 780, 13560-970 São Carlos - SP, Brasil Recebido em 19/09/2013 *e-mail: cavalheiro@iqsc.usp.br This paper presents a proposal for using recycled graphite electrodes obtained from exhausted commercial 1.5 V batteries and its application in electroanalysis. The electrode could be prepared by the students and applied in the simple didactic experiments suggested, such as determination of active electrode area, cyclic voltammetry and useful potential range (also called "potential window"), demonstration and effect of scan rate on cyclic voltammograms. The possibility of using the graphite electrode in quantitative analysis was also demonstrated using the ferricyanide/ferrocyanide reversible redox couple ([Fe(CN)6]3-/[Fe(CN)6]4-) as an electrochemical probe by the dependence of peak current with the analyte concentration and flow injection analysis with amperometric detection. INTRODUÇÃO O carbono se apresenta em várias formas condutoras.1 As reações eletroquímicas são normalmente mais lentas em superfícies de carbono que em eletrodos metálicos, sendo a cinética de transferência de elétrons dependente da estrutura e preparação da superfície.2,3 Os derivados de carbono apresentam menor condutividade elétrica, quando comparados aos metais nobres usados na preparação de eletrodo. Assim a transferência de elétrons encontra maior dificuldade quando ocorre na sua superfície, tornando mais lentas as reações de óxido-redução sobre eletrodos de carbono nas suas diferentes formas. Esse elemento tem uma atividade superficial elevada, o que explica a sua susceptibilidade para a passivação por deposição de compostos orgânicos.3 Ligações com hidrogênio e diferentes funções oxigenadas como carboxila, hidroxila, carbonilas, quinonas, etc., podem estar presentes na superfície do carbono conforme representado na Figura 1a.
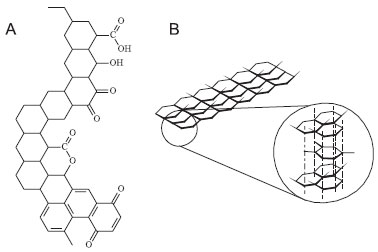 Figura 1. (A) Diferentes funções oxigenadas possivelmente encontradas na superfície periférica do carbono. (B) Estrutura do carbono grafite
Vários tipos de carbono são usados como eletrodos de trabalho em sistemas eletroquímicos, dentre eles, pode-se citar carbono vítreo,4 grafite pirolítico,5 fibras de carbono,6 espuma de carbono,7 pasta de carbono, um tipo de compósito no qual partículas de grafite são incorporadas em uma matriz inerte8 e várias outras formas, como os nanotubos e grafenos.9 Provavelmente, o mais usado é o carbono vítreo (GC do inglês glassy carbon). Entretanto, devido à sua dureza e fragilidade, a construção desse eletrodo é dificultada, além do custo elevado que limita o seu uso em aplicações didáticas.1 Segundo Kinoshita1 o grafite ocorre naturalmente na crosta terrestre e são usados na confecção de eletrodos de pilhas, mas também existem formas de grafite artificiais produzidas a partir de precursores industriais como coque de petróleo, pixe e negro de fumo. Dessas formas artificiais usadas na preparação de eletrodo destacam-se os grafites pirolíticos e os pós de grafite. O autor também apresenta uma série de propriedades e aplicações para os materiais de carbono em geral e também para os grafites. A confecção de eletrodos de baixo custo com materiais alternativos com respostas equivalentes às obtidas com os eletrodos comerciais tem sido um campo profícuo de pesquisa em eletroanalítica,10 com amplas potencialidades no ensino de análise instrumental. Uma fonte alternativa de grafite, utilizada na construção de eletrodos são os cátodo de pilhas comum de 1,5V, que são constituídos por bastões de carbono grafite natural de alta pureza, produzindo assim um material que pode ser utilizado com vantagens e a baixo custo na construção de eletrodos de trabalho para sistemas eletroquímicos.11 Considerando os preços dos materiais usados e o câmbio da época da redação deste trabalho, o custo de cada eletrodo é da ordem de US$ 1.00 (um dólar americano). O grafite natural, na maioria das vezes, necessita de purificação e classificação granulométrica para ser utilizado comercialmente. O sintético é produzido a partir de outras formas de carbono como coque e antracita.12 Esta, quando submetida à altas temperaturas, tem seus átomos de carbono organizados na forma cristalina hexagonal. As propriedades dos grafites natural e sintético diferem em vários aspectos. O grafite natural atinge estruturas cristalinas maiores, comumente conhecidas como flocos. O grafite natural apresenta três tipos comercializáveis diferentes: amorfo, flocos e veio. A denominação grafite amorfo não é essencialmente correta, pois a sua estrutura é, na verdade, microcristalina. Ocorre normalmente na natureza em altas concentrações (+ 70% carbono), não necessitando de processo de purificação para ser comercializado. Sua condutividade, resistência à oxidação e maleabilidade são inferiores às do grafite do tipo flocos. O grafite de veio é altamente cristalizado, encontrado na natureza em altas concentrações (+97%) e não pode ser purificado. Este tipo de grafite é comercializado somente no Sri Lanka, sendo recomendado para aplicações bastante específicas. O grafite tipo flocos é carbono puro. Encontra-se na natureza em estruturas laminares planas, ordenadas na forma hexagonal e romboédrica. Por apresentar uma forte ligação molecular hexagonal, o grafite do tipo flocos é extremamente resistente à oxidação e a altas temperaturas. Por outro lado, a fraca ligação entre os planos moleculares permite que estes deslizem uns sobre os outros, tornando-o um produto maleável e altamente lubrificante. A estrutura do carbono grafite esta representada na Figura 1b. O grafite do tipo flocos apresenta também outras propriedades, destacando-se a excelente condutividade elétrica e térmica e a anisotropia. Por sua versatilidade, o grafite é amplamente utilizado na indústria. A utilização deste tipo de material na confecção de eletrodos permite a preparação dos sensores com tamanhos e diâmetros diferentes uma vez que o material aceita usinagem e a possibilidade da modificação da superfície deste material com uma enorme variedade de modificadores, que podem melhorar a seletividade e a sensibilidade, em eventuais procedimentos analíticos envolvendo o dispositivo resultante.13 Tais características poderiam ser somadas ao fato de que os estudantes poderiam preparar seu eletrodo de trabalho e usá-lo em técnicas eletroanalíticas, quando usado com propósitos didáticos. O objetivo do presente trabalho é propor alguns experimentos visando proporcionar aos alunos de análise instrumental a oportunidade de confeccionar eletrodos de carbono grafite utilizando bastões de grafite natural extraídos do interior de pilhas de 1,5 V exauridas (pilhas comuns) e usá-los em técnicas voltamétrica, amperométrica e cronocoulométrica, para avaliação da sua resposta e demonstrar alguns conceitos fundamentais relacionados com estas técnicas.
PARTE EXPERIMENTAL Reagentes e soluções Todos os reagentes foram de grau analítico (P.A.) e utilizados sem purificação prévia. As soluções foram preparadas com água bidestilada em um destilador de quartzo (TE-178, Tecnal). Equipamentos Todos os experimentos descritos, inclusive as detecções amperométricas em fluxo, foram realizados em um potenciostato/galvanostato Autolab PGSTAT 30 (Eco Chemie), acoplado a um microcomputador e controlado pelo software GPES2 version 4.9. Entretanto, qualquer equipamento equivalente pode ser usado. Para obter os voltamogramas, sugere-se o uso de uma célula de vidro com capacidade para 25,0 mL, contendo um eletrodo Ag/AgCl (eletrodo de referência), fio ou placa de platina (eletrodo auxiliar) e o eletrodo de carbono grafite confeccionado(eletrodo de trabalho). Um eletrodo de carbono vítreo com diâmetro de 3,0 mm foi utilizado para comparações com os resultados do eletrodo de carbono grafite. Todas as medidas foram realizadas em temperatura ambiente e sem desaeração prévia das soluções. As microscopias eletrônicas de varredura (MEV) foram realizadas em um equipamento Zeiss DSM 940-A, operado a 5 kV em diferentes magnificações. Equipamentos equivalentes devem ser usados, caso se queira desenvolver tais estudos com os alunos. Também é proposto um experimento com um sistema de análise por injeção em fluxo que consiste de uma bomba peristáltica da ISMATEC de 12 canais e um injetor comutador manual. Na Figura 2 é apresentado um esquema do sistema de análise por injeção em linha única. A célula de fluxo para medidas eletroquímicas consistiu de três eletrodos (carbono grafite, disco de platina e Ag/AgCl). Um esquema da cela de fluxo em 3D e dos eletrodos é apresentado na Figura 3. Um eletrodo de carbono vítreo (diâmetro de 5,0 mm) foi usado nas medidas em fluxo ou hidrodinâmicas.
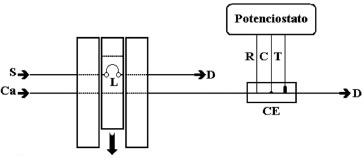 Figura 2. Diagrama do sistema de fluxo utilizado para avaliação do eletrodo de carbono grafite. Ca - solução carregadora de KCl 0,1 mol L-1, vazão de 5,4 mL min-1; S - soluções de K3[Fe(CN)6] em KCl 0,1 mol L-1 (pH 3,0); L - alça de amostragem (176 µL); CE - célula eletroquímica, R - eletrodo de referência (Ag/AgCl); C - contra eletrodo (disco de Pt); T - eletrodo de trabalho (eletrodo de carbono grafite); D - descarte
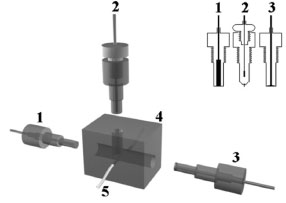 Figura 3. Esquema da cela utilizada nas medidas em sistema FIA. (1) Eletrodo de trabalho (carbono grafite), (2) Eletrodo de referência (Ag/AgCl), (3) Contra eletrodo (disco de Pt), (4) Bloco de resina poliuretana, (5) Tubo de polietileno
Construção dos eletrodos de trabalho O ideal seria que os próprios estudantes preparassem os eletrodos de carbono grafite, conforme procedimento sugerido a seguir. Entretanto, devido aos tempos de cura dos polímeros isto pode não ser possível de realizar em uma aula de graduação. Os alunos poderiam preparar os eletrodos em horários alternativos ou recebê-los prontos da equipe instrutora. Os eletrodos foram construídos com bastões de carbono grafite retirados do interior de pilhas comerciais não recarregáveis e não alcalinas de 1,5 V exauridas, nas dimensões de 4,6 cm de comprimento e 4 mm diâmetro, correspondendo aproximadamente a 0,126 cm2 de área geométrica. Em uma das extremidades dos bastões foi conectado a um fio de cobre com o auxílio de epóxido de prata (EPO-TEK 410E, Epoxy Technology), para fazer o contato elétrico com o circuito externo. Esse procedimento envolve 30 minutos para extração e limpeza dos bastões de grafite e 24 h para cura da resina tipo epóxido. O conjunto bastão-fio de cobre foi selado com resina epóxi (Silaex®) em um tubo de vidro neutro de 0,7 cm de diâmetro externo e 10 cm de comprimento de modo a ficar exposta a face do grafite. A outra extremidade foi fixada com Araldite® de cura normal, deixando exposto o fio de cobre para o contato com o circuito externo. Após 72 horas de repouso, o processo de cura da resina se completa e o eletrodo pode ser utilizado. A Figura 4a ilustra o aspecto final do eletrodo de carbono grafite utilizado nas medidas estáticas.
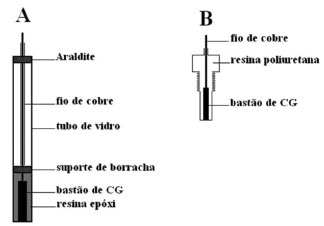 Figura 4. Esquema dos eletrodos de carbono grafite. (A) Representação do eletrodo de carbono grafite utilizado nas medidas estáticas, (B) Representação do eletrodo de carbono grafite utilizado nas medidas em sistema FIA
O eletrodo de carbono grafite utilizado como detector amperométrico no sistema de análise por injeção em fluxo foi construído de maneira semelhante. A diferença é que o conjunto foi selado com resina epóxi (Silaex®) em um tarugo de resina poliuretana (Poliquil, Araraquara, SP) de 1,5 cm com rosca de 0,9 cm para ser conectado a celinha de fluxo. A Figura 4b ilustra o aspecto final do eletrodo de carbono grafite utilizado nas medidas hidrodinâmicas. O tratamento mecânico consistiu de abrasão em lixa d'água 600, para eliminar excesso de resina epóxi da superfície e expor o grafite. Em seguida foi feito um polimento com suspensão de alumina 1,0 mm (Arotec), que foi efetuado em uma lixadeira/politriz motorizada modelo APL-02 (Arotec). Os eletrodos foram, então, imersos em água destilada e submetidos ao ultrassom em banho USC 1400 (Unique) por 5 minutos antes das medições para retirada de possíveis partículas da superfície dos eletrodos. O tratamento com ultrassom foi repetido em isopropanol. Não foi necessário submeter os eletrodos a tratamento eletroquímico para uso nos experimentos aqui propostos, nem renovar a superfície entre as medidas.
EXPERIMENTOS PROPOSTOS Os resultados descritos a seguir foram obtidos pelos autores deste trabalho, usando os eletrodos de carbono grafite como eletrodos de trabalho em várias situações. Uma aplicação didática deveria seguir os mesmos passos, para os diferentes experimentos, ou outros a serem propostos. Normalmente, os experimentos propostos podem ser realizados em um período de 4h. Experimento 1 - Determinação da área efetiva do eletrodo de carbono grafite por cronocoulometria Neste experimento propõe-se que os alunos determinem as áreas efetivas dos eletrodos carbono grafite e do carbono vítreo realizando um experimento utilizando a cronocoulometria. Este experimento pode ser realizado utilizando uma solução de K3[Fe(CN)6] 5,0 mmol L-1 em KCl 0,5 mol L-1, sendo D0 = 7.7x10-6 cm2 s-1,14 com variação de potencial de +0,5 a 0 V vs Ag/AgCl durante 1 segundo. As áreas dos eletrodos foram estimadas pela Equação de Cottrell15 (Equação 1):
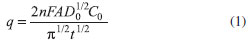
Os gráficos da carga determinada (q) em função de tempo-1/2 fornecem retas com coeficiente angular (CA), que se relaciona com a Equação 1, sendo a área do eletrodo é diretamente proporcional ao coeficiente angular da reta segundo a Equação 2:

sendo, A - área (cm2); F - Constante de Faraday (96487 C mol-1); C0 - Concentração do reagente na solução (mmol L-1); D0 - Coeficiente de difusão (7,7 x 10-6 cm2 s-1); n - número de elétrons; CA - Coeficiente angular. Na Tabela 1 são apresentados os valores da área efetiva para o eletrodo de carbono vítreo e o eletrodo de carbono grafite determinadas utilizando-se a cronocoulometria.
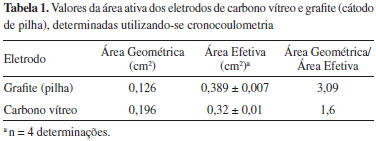
Após a determinação das áreas efetivas os alunos também poderiam obter as micrografias da superfície do carbono grafite e do carbono vítreo. Na Figura 5 são apresentadas as micrografias da superfície do carbono grafite e do carbono vítreo, após abrasão com lixa 600 seguida do polimento com suspensão de γ-alumina 1,0 mm, apresentou uma superfície muito mais porosa para o eletrodo de carbono grafite que a do carbono vítreo. Esta porosidade apresentada pelo carbono grafite esta diretamente relacionada com uma maior área efetiva determinada pela cronocoloumetria e representada pela relação área efetiva/área geométrica na Tabela 1, que é de 3,09 para o eletrodo de carbono grafite e de 1,6 para o eletrodo de carbono vítreo.
 Figura 5. Voltamograms cíclicos obtidos para o eletrodo de carbono grafite e para o carbono vítreo em solução de K3[Fe(CN)6] 5mmol L-1 em KCl 0,1 mol L-1 (pH 3,0), velocidade de varredura de 50 mV s-1. Foi registrado o 3º ciclo
Como consequência dessa maior área efetiva, as correntes de pico anódica e catódicas são maiores para o eletrodo de carbono grafite, como mostram os resultados da Tabela 1 e medidas a partir dos voltamogramas cíclicos apresentados na Figura 6, discutida no experimento seguinte.
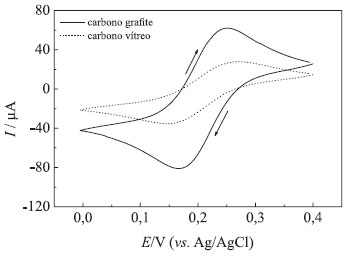 Figura 6. Micrografias eletrônicas de varredura das superfícies dos eletrodos: (A) carbono vítreo e (B) carbono grafite, após abrasão com lixa 600, polimento com α-alumina 1 mm e tratamento em ultrassom por 5 minutos em isopropanol. Magnificação 800 vezes
Experimento 2 - Voltamogramas cíclicos do eletrodo de carbono grafite e do eletrodo de carbono vítreo A resposta voltamétrica do eletrodo de carbono grafite pode ser avaliada por voltametria cíclica, utilizando uma solução de K3[Fe(CN)6] 5,0 mmol L-1 em KCl 0,5 mol L-1. A resposta voltamétrica do eletrodo de carbono grafite pode também ser comparada àquela do eletrodo de carbono vítreo, nas mesmas condições. Os voltamogramas cíclicos foram obtidos no intervalo de 0,0 e 0,4 V vs Ag/AgCl usando o eletrodo de carbono grafite e o eletrodo de carbono vítreo. Os resultados típicos esperados neste experimento estão apresentados na Figura 6. Para análise dos resultados da Figura 6, os alunos deverão medir a intensidade das correntes de pico anódica e catódica. Observa-se que o voltamograma cíclico do eletrodo de carbono grafite apresenta perfil melhor definido e maior intensidade de corrente do que a encontrada para o carbono vítreo. A explicação para esta diferença está na maior área efetiva da superfície porosa do carbono grafite, quando comparada à superfície praticamente lisa do carbono vítreo (Tabela 1 e Figura 5). Também será possível obter voltamogramas sucessivos, após polimento da superfície, para observar a repetibilidade de resposta. No presente caso, notou-se que o eletrodo de grafite apresenta maior repetibilidade (menor desvio padrão) da corrente, após renovações sucessivas da superfície. A Tabela 2 traz resultados de corrente e potencial de pico para 5 determinações consecutivas.
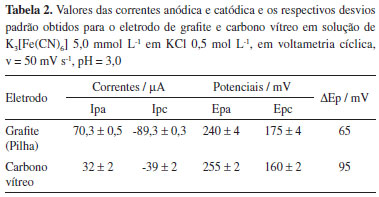
Nessa mesma tabela também se observa que o eletrodo de grafite e o carbono vítreo apresentaram valores de ΔEp (diferença entre os potenciais de pico) mais elevados, o que sugere maior dificuldade de transferência de carga e uma superfície relativamente menos ativa. Considerando-se a reversibilidade da resposta do par Fe(II)/Fe(III) no ferricianeto de potássio, espera-se que o eletrodo apresente um valor de ΔEp aproximadamente 59 mV.16 O valor relativamente mais elevado obtido pode estar relacionado com a ativação da superfície, a velocidade de transferência de carga na superfície do eletrodo de grafite carbono. De acordo com McCreery e Cline,3 a diferença nos potenciais de pico é afetada não apenas pelo tipo de material, mas também pelos eventuais tratamentos a que a superfície tenha sido submetida e explicam essa diferença com base no valor numérico da constante de velocidade de transferência heterogênea de carga, kº. O Experimento 3, a ser discutido na próxima sessão, mostra voltamogramas na ausência da espécie eletroativa. Neste caso flui uma corrente devido à carga da dupla camada elétrica, chamada de corrente capacitiva, somada à eventuais processos redox de impurezas eletroativas. Somente na presença de uma espécie eletroativa em potencial suficiente para que ocorra sua oxidação ou redução é que haverão picos de corrente nos voltamogramas cíclicos. Uma discussão detalhada desses fenômenos pode ser encontrada em bons livros didáticos, como os textos de Harris17 e Skoog & Leary.18 Experimento 3 - Estudo do intervalo útil de potenciais Neste experimento os alunos deverão estudar a janela útil de potenciais podendo ser realizado em diferentes eletrólitos de suporte: solução de H2SO4, NaOH, tampão acetato (pH 4,7), tampão fosfato (pH 7,0), tampão universal (pH 11,0) todas na concentração de 0,1 mol L-1 utilizando o eletrodo de carbono grafite e o eletrodo de carbono vítreo. A velocidade de varredura sugerida é de 50 mV s-1, a qual foi usada no presente trabalho. Na Figura 7 são apresentados resultados típicos dos estudos do intervalo útil de potenciais, para o eletrodo de carbono grafite e o eletrodo carbono vítreo. Em meio de H2SO4 0,1 mol L-1 (Figura 7a) pode-se observar que o eletrodo de carbono grafite tem o mesmo comportamento do eletrodo de carbono vítreo, com correntes residuais da mesma intensidade e limites catódicos e anódicos muito próximos.
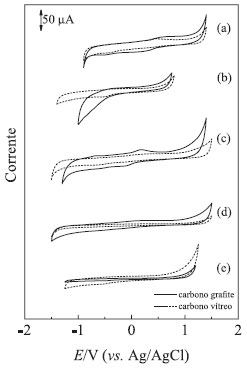 Figura 7. Voltamogramas cíclicos obtidos com os eletrodos de carbono grafite e carbono vítreo em: (a) solução de H2SO4 0,1 mol L-1, (b) solução de NaOH 0,1 mol L-1, (c) solução tampão acetato 0,1 mol L-1 (pH 4,7), (d) solução tampão fosfato 0,1 mol L-1 (pH 7,0) e (e) solução tampão universal (pH 11). A velocidade de varredura foi de 50 mV s-1 em todos os casos
Em meio de NaOH 0,1 mol L-1, (Figura 7b), pode-se observar uma limitação para o eletrodo de carbono grafite na região catódica abaixo de -1,0 V vs Ag/AgCl, onde ocorre a descarga do eletrólito de suporte. Em meio tampão acetato 0,1 mol L-1 pH 4,7 (Figura 7c) pode-se observar que o eletrodo de carbono grafite apresenta o mesmo comportamento se comparado ao eletrodo de carbono vítreo, com correntes residuais de intensidades próximas e limites catódicos e anódicos próximos. Em meio de tampão fosfato 0,1 mol L-1 pH 7,0 (Figura 7d) pode-se observar que o eletrodo de carbono grafite apresenta o mesmo comportamento que o eletrodo de carbono vítreo, com correntes residuais de intensidades muito próximas e limites catódicos e anódicos próximos. Em meio de tampão universal pH 11,0 (Figura 7e) pode-se observar que o eletrodo de carbono grafite apresenta comportamento semelhante ao eletrodo de carbono vítreo, com correntes residuais de intensidades próximas e limites catódicos e anódicos próximos. Os sinais observados, tanto em meio de ácido sulfúrico (Fig. 7.a), como em tampão acetato (Fig. 7.c), estão provavelmente relacionados com a presença de grupos funcionais na superfície do grafite, posto que o mesmo é de origem natural e não foi submetido a nenhum tratamento eletroquímico. A presença desses grupos funcionais é bem conhecida1,3 e foi citada na Introdução. Entretanto, devido à sua baixa intensidade, esses picos não devem interferir significativamente na resposta do par Fe(CN)63-/ Fe(CN)64-, cujos picos redox se apresentam fora dessa região de potenciais. Experimento 4 - Efeito da velocidade de varredura Neste experimento os alunos devem avaliar o efeito da velocidade de varredura na resposta voltamétrica do eletrodo de carbono grafite usando solução de ferricianeto de potássio 5,0 mmol L-1 em KCl 0,5 mol L-1. A velocidade de varredura foi variada de 5 a 100 mV s-1 e os resultados obtidos estão apresentados na Figura 8a. Os voltamogramas cíclicos obtidos mostram um aumento na intensidade de corrente e um ligeiro deslocamento dos picos anódico e catódico, com o aumento da velocidade de varredura.
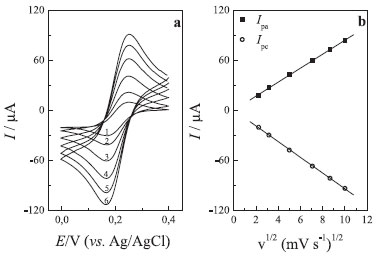 Figura 8. (a) Voltamogramas cíclicos em velocidade de varredura: (1) 5 mv s-1, (2) 10mv s-1, (3) 25mv s-1, (4) 50 mv s-1, (5) 75 mv s-1 e (6) 100 mv s-1. (b) Dependência das correntes de pico anódica e catódica com a raiz quadrada da velocidade de potenciais para o eletrodo de carbono grafite em solução de 5,0 mmol L-1 de K3[Fe(CN)6] em KCl 0,5 mol L-1
A forma do pico se relaciona com a presença da espécie eletroativa na camada de difusão, que se exaure à medida que o processo redox tem lugar. Após o pico, que representa o consumo dessas espécies o fenômeno de difusão deve abastecer a superfície do eletrodo com novas espécies a serem oxidadas ou reduzidas, ocorrendo uma diminuição da corrente, pois o sistema é mantido em repouso, sem agitação mecânica nem renovação do eletrodo, como ocorre na polarografia. Uma discussão mais aprofundada da forma da curva pode ser encontrada em livros texto.17,18 Os alunos deverão analisar a dependência das correntes de pico anódica (A) e catódica (B), encontradas nos voltamogramas da Figura 8b, em função da raiz quadrada da velocidade de varredura, indicando que a transferência de massa é controlada por difusão (Figura 8b), segundo a Equação de Randles-Sevcik15 (Equação 3):
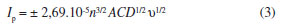
sendo, Ip - corrente de pico; n - número de elétrons envolvidos na reação redox; A - área do eletrodo (cm2); D - coeficiente difusional (cm2 s-1); C - concentração das espécies reduzidas ou oxidadas (mol cm-3); ν- velocidade de varredura (V s-1). Nesta Equação o sinal positivo (+) ou negativo (-) é usado para representar processos de oxidação e redução, respectivamente. De acordo com a Equação 3, se todas as outras condições forem mantidas constantes, a corrente de pico deverá ser proporcional à raiz quadrada da velocidade de varredura para sistemas reversíveis com controle difusional, como no presente caso. Experimento 5 - Dependência da corrente de pico com a concentração de ferricianeto em voltametria cíclica Neste experimento os alunos devem observar a dependência da corrente de pico com a concentração da espécie eletroativa. De acordo com a Equação 3, a corrente de pico deve ser diretamente proporcional à concentração, desde que mantidas as demais condições. As medidas voltamétricas deverão ser realizadas com o eletrodo de carbono grafite em um intervalo de potenciais de 0,0 a 0,4 V em solução de KCl 0,5 mol L-1 contendo diferentes concentrações de ferricianeto e velocidade de 50 mV s-1. Antes de cada medida, será feita uma adição de volume adequado de solução estoque do analito e agitação do sistema para a homogeneização do meio. Deve-se usar volumes relativamente pequenos ou corrigir para diluição. A Figura 9 apresenta a variação das correntes anódica e catódica observadas para as diferentes concentrações de [Fe(CN)6]3-, na qual se pode observar uma região linear entre 19,3 a 93,5 μmol L-1, que consiste em toda a faixa estudada. A curva resultante para a corrente catódica obedeceu à Equação 4.
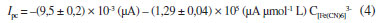
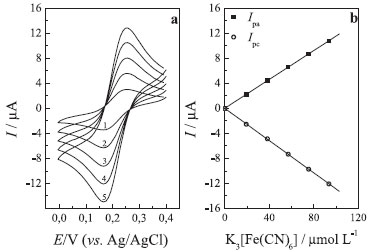 Figura 9. (a) Voltamogramas cíclicos para diferentes concentrações de K3[Fe(CN)6]: (1) 19,3 mmol L-1, (2) 38,3 mmol L-1, (3) 56,9 mmol L-1, (4) 75,3 mmol L-1 e (5) 93,5 mmol L-11. (b) Curvas analíticas obtidas para o eletrodo de carbono grafite em solução de KCl 0,5 mol L-1, v = 50 mV s-1, contendo diferentes concentrações de K3[Fe(CN)6]
com R = 0,999 (n = 6), e a curva resultante para a corrente anódica é representada pela Equação 5
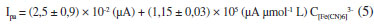
com R = 0,999 (n = 6). Os limites de detecção (LOD) obtidos no intervalo entre 19,3 e 93,5 µmol L-1 foram 0,48 (para a corrente de pico anódica) e 0,76 µmol L-1, (para a corrente de pico catódica). Segundo Long e Winefordner,19 o limite de detecção é determinado como três vezes o desvio do branco (Sd), ou do inercepto, quando concentração do analito é zero, dividido pelo coeficiente angular da reta (b), conforme Equação 6.

O desvio do branco foi determinado a partir do desvio padrão do intercepto da reta e calculado pela regressão linear da curva. Já o coeficiente angular se refere à inclinação da curva analítica. Já o limite de quantificação é definido como sendo 10 x Sd / b, de acordo com os mesmos autores.19 Experimento 6 - Avaliação do desempenho do eletrodo de carbono grafite com detector amperométrico Neste experimento os alunos deverão usar um sistema de análise por injeção em fluxo (como ilustrado na Figura 2), o eletrodo de carbono grafite foi usado como detector amperométrico em uma cela de fluxo (como ilustrado na Figura 3). Inicialmente foram otimizados alguns parâmetros como: alça de amostragem, vazão da solução transportadora, potencial de detecção. Não houve necessidade de renovação da superfície durante as medidas em um mesmo dia de trabalho. Após otimização do sistema um curva analítica foi obtida injetando 176 µL da solução de K3[Fe(CN)6] em KCl 0,1 mol L-1 em diferentes concentrações, de 20 a 80 µmol L-1. Como solução carregadora usou-se KCl 0,1 mol L-1 (pH 3,0), em uma vazão de 5,4 mL min-1. O sinal amperométrico foi monitorado em 0,0 V vs. Ag/AgCl. As injeções foram realizadas em ordem crescente seguida de repetição na ordem decrescente de concentração para avaliar possível efeito de memória. Com os resultados obtidos os alunos deverão analisar a dependência das correntes de pico anódica e catódica em função da contração de K3[Fe(CN)6]. Uma vez que o sinal é monitorado em um potencial fixo, suficiente para que ocorra o processo redox da espécie desejada, cada vez que o analito é inserido, por injeção, ao fluxo carregador, ele chega até a superfície do eletrodo, ocorre aumento de sinal até um máximo e depois há limpeza do sistema pelo fluxo carregador, que continua fluindo, mas sem injeção da espécie em análise. Na Figura 10 é apresentada uma curva analítica obtida em sistema de análise por injeção em fluxo nas condições otimizadas descritas acima. Apesar do intervalo de concentrações investigadas ser relativamente restrito, certamente a região linear é mais ampla, considerando-se as evidências experimentais.
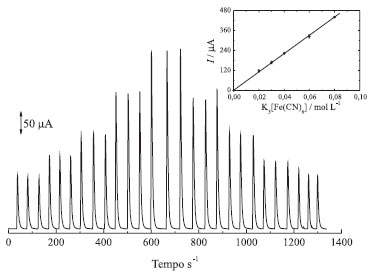 Figura 10. Curva analítica obtida para o eletrodo de carbono grafite utilizando (1) 20 mmol L-1, (2) 30 mmol L-1, (3) 40 mmol L-1, (4) 60 mmol L-1, (5) 80 mmol L-1 de K3[Fe(CN)6] e solução transportadora KCl 0,1 L-1, vazão de 5,4 mL min-1 e volume de amostragem de 176 µL
A curva resultante obtida pode ser vista em destaque na Figura 10 e obedeceu a Equação 7
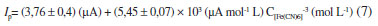
com R = 0,999 (n = 6), um limite detecção de 1,5 µmol L-1 e um limite de quantificação de 5,1 µmol L-1. A frequência analítica foi de 140 determinações por hora, sob as condições otimizadas. Tal estudo demonstra um potencial de aplicação do eletrodo de carbono grafite como detector amperométrico em condições hidrodinâmicas, como, por exemplo, os sistemas de análise por injeção em fluxo. O eletrodo se mostrou estável e não houve necessidade de renovação superficial, o que talvez ocorresse com analitos com forte caráter adsortivo. Se houvesse adsorção, haveria diminuição da intensidade da corrente de pico entre medidas sucessivas na mesma concentração. O efeito de adsorção ficaria também evidente, quando se faz as injeções em sentido crescente e decrescente na concentração do analito, pois a repetibilidade de sinais ficaria comprometida.
CONSIDERAÇÕES FINAIS Com estes experimentos é possível que os alunos tenham a oportunidade de construir um eletrodo de carbono grafite sólido, entender a definição deste tipo de material eletródico e fazer uma série de experimentos que demonstrem a sua utilidade em eletroquímica e eletroanalítica. Obviamente, além dos experimentos aqui propostos podem ser desenvolvidos outros que envolvam, também, conceitos que vão além dos demonstrados aqui. Entretanto, os objetivos destes experimentos didáticos podem ser alcançados de forma relativamente simples e sem envolver instrumentação complexa, em curto período de tempo. Os experimentos aqui propostos são factíveis dentro de um período de 4 h, ou seja, adequados a uma aula de análise instrumental. Obviamente, a confecção dos eletrodos requer um tempo relativamente longo e deve ser feita fora do horário da aula ou os eletrodos devem ser previamente confeccionados e fornecidos aos alunos.
AGRADECIMENTOS Ao programa PROCONTES/USP; FAPESP; CNPq; CAPES e ao Sr. Carlos Alberto da Silva Bento (CAQI / IQSC) pelos MEV.
REFERÊNCIAS 1. Kinoshita, K.; Carbon, Electrochemical and Physicochemical Properties, Wiley: New York, 1998. 2. McCreery, R. L. Em Electroanalytical Chemistry; Bard, A. J., ed.; Dekker: New York, Vol. 17, 1991, pp. 221-374. 3. McCreery, R. L.; K. K. Cline, Em Laboratory Techniques in Electroanalytical Chemistry; Kissinger, P. T.; Heinemann, W. R., eds.; 2nd ed., Dekker: New York, 1996, cap. 10. 4. Mirkhalaf, F.; Tammeveski, K.; Schiffrin, D. J.; Phys. Chem. Chem. Phys. 2004, 6, 1321. 5. Moore, R. R.; Banks, C. E.; Compton, R. G.; Analyst 2004, 129, 755. 6. Hamamoto, O.; Akahori, Y.; Goto, S.; Kato, Y.; Ishii, M.; Electrochemistry 2004, 72, 322. 7. Em Carbon black: science and technology; Donnet, J. B.; Bansai, R. C.; Wang, M. J. eds., Dekker: New York, 1993. 8. Adams, R. N.; Anal. Chem. 1958, 30, 1576. 9. Moore, R. R.; Banks, C. E.; Compton, R. G.; Anal. Chem. 2004, 76, 2677; Ferapontova, E. E.; Electroanalysis 2004, 16, 1101; Carregalo, S.; Merkoci, A.; Alegret, S.; Microchim. Acta 2004, 147, 245; Ly, S.Y.; Jung, Y. S.; Kim, M. H.; Han, I. K.; Jung, W. W.; Kim, H.S .; Microchim. Acta 2004, 146, 207; Calixto, C. M. F.; Cervini, P.; Cavalheiro, E. T. G.; Quim. Nova 2008, 31, 2194. 10. Carregalo, S.; Merkoçi, A.; Alegret, S.; Microchim. Acta 2004, 147, 245; Beaunier, L.; Keddam, M.; Garcia-Jareno, J. J.; Vicente, F.; Navarro-Laboulais, J.; J. Electroanal. Chem. 2004, 566, 159; Somashekarappa, M. P.; Sampath, S.; Anal. Chim. Acta 2004, 503, 195; Sebkova, S.; Navratil, T.; Kopanica, M.; Anal. Lett. 2003, 36, 2767; de Prada, A. G. V.; Pena, N.; Mena, M.L.; Reviejo, A.J.; Pingarron, J.M.; Biosens. Bioelectron. 2003, 18, 1279; Mendes, R. K; Claro-Neto, S.; Cavalheiro, E. T. G.; Talanta 2002, 57, 909. 11. http://www.grafite.com/frame.htm, acessada em Maio 2013. 12. Gonzalez, D.; Montes-Moran, M. A.; Garcia, A. B.; Energy Fuels 2003, 17, 1324. 13. Lofrano, R. C. Z.; Padovan, N. A.; Romero, J. R.; Quim. Nova 2002, 25, 1186. 14. Stackelberg, M; Pilgram, M.; Toome, V. Z.; Electrochem. 1953, 57, 342. 15. Brett, A. M. O.; Brett, C. M. A.; Electroquímica - princípios, métodos e aplicações. Oxford University: New York:, 6ª ed., 1993. 16. Heinemann, W. R.; Kissinger, P. T. Em Laboratory Techniques in Electroanalytical Chemistry, Kissinger, P. T.; Heinemann, W. R., eds.; 2nd ed., Dekker: New York, 1996, cap. 3. 17. Harris, D. C.; Quantitative Chemical Analysis, 4th ed., Freeman: New York, 1996. 18. Skoog, D. A.; Leary, J. J.; Principles of instrumental analysis, 4th ed., Saunders: Forth Worth, 1992. 19. Long, G. L.; Winefordner, J. D.; Anal. Chem. 1983, 55, 712A. |
On-line version ISSN 1678-7064 Printed version ISSN 0100-4042
Qu�mica Nova
Publica��es da Sociedade Brasileira de Qu�mica
Caixa Postal: 26037
05513-970 S�o Paulo - SP
Tel/Fax: +55.11.3032.2299/+55.11.3814.3602
Free access





